-
Medical journals
- Career
První zkušenosti s dlouhodobě působícím růstovým hormonem
Authors: Lebl Jan 1; Toni Ledjona 1; Dankovčíková Adriana 2; Košťálová Udmila 3; Magnová Olga 4; Koloušková Stanislava 1
Authors‘ workplace: Pediatrická klinika, 2. lékařská fakulta Univerzity, Karlovy a FN Motol, Praha 1; Klinika detí a dorastu, Detská fakultná nemocnica, Košice 2; Detská klinika, Lekárska fakulta Univerzity, Komenského a Národný ústav, detských chorôb, Bratislava 3; Pediatrická klinika, FN Brno 4
Published in: Čes-slov Pediat 2022; 77 (Supplementum 3): 36-40.
Category:
doi: https://doi.org/10.55095/CSPediatrie2022/057Overview
Růstový hormon se používá v léčbě již 65 let. I když se změnila výrobní technologie, molekula léku zůstala stejná. Podává se ve formě každodenních podkožních injekcí, léčba trvá obvykle řadu let a pro dítě i rodinu může představovat významnou zátěž. V současné době jsou na prahu klinického použití tři modifikované molekuly dlouhodobě působícího růstového hormonu (long-acting growth hormone, LAGH) určené k podávání jednou týdně, které mají růstový účinek srovnatelný s přirozeným růstovým hormonem. Lonapegsomatropin je pegylovaná promolekula přechodně konjugovaná s nosičem, ze které se rovnoměrně uvolňuje nativní růstový hormon. Somapacitan má v molekule růstového hormonu zaměněnou jednu aminokyselinu, na kterou se ukotví mastná kyselina s navázaným plazmatickým albuminem. Má významně prodloužený poločas, během kterého dochází k postupné konverzi na aktivní molekulu. Somatrogon má molekulu fúzovanou s přirozeným lidským peptidem (CTP technologie), což zpomaluje renální i jaterní eliminaci a sedminásobně prodlužuje poločas účinku. Zúčastnili jsme se mezinárodní multicentrické klinické studie k posouzení zátěže léčbou somatrogonem ve srovnání s každodenním růstovým hormonem. Pomocí standardizovaných dotazníků byl ve skupině 87 dětí zjištěn při léčbě somatrogonem významný pokles subjektivně vnímané zátěže pro dítě a rodinu na jednu třetinu ve srovnání s každodenní injekcí. LAGH bude brzy novou alternativou pro léčbu dětí s některými formami malého vzrůstu.
Klíčová slova:
růstový hormon – dlouhodobě působící růstový hormon – lonapegsomatropin – somapacitan – somatrogon
Růstový hormon se používá jako lék již 65 let.(1) Po celou tuto dobu se pacientům podává stejná molekula lidského růstového hormonu (hGH), i když výrobní postup se mezitím zcela proměnil. Do roku 1985 se růstový hormon získával extrakcí z kadaverózních lidských hypofýz, v roce 1985 byl registrován ke klinickému použití první přípravek vyráběný biotechnologicky – rekombinantní technologií. Touto metodou se rekombinantní lidský růstový hormon (rhGH) vyrábí dosud.(2,3)
V současné době je připraveno k použití několik přípravků růstového hormonu s modifikovanou molekulou, které není nutné podávat injekčně s.c. denně, ale které mají srovnatelný účinek při s.c. podání jednou týdně.
Fyziologie růstového hormonu
Přirozený hGH je peptidová molekula s jedním řetězcem o délce 191 aminokyselin. Její terciární strukturu dotváří jeden disulfidický můstek (obr. 1). Růstový hormon patří mezi hormony s pulzatilní sekrecí (obr. 2), která je řízena souhrou tří hypotalamických regulačních peptidů – growth hormone-releasing hormonu (GHRH), somatostatinu a ghrelinu. Po vyplavení ze somatotrofních buněk hypofýzy do krve má hGH poločas účinku 17 minut, protože se rychle vylučuje ledvinami. Jak ukazuje graf přirozené sekrece hGH na obr. 2, po naprostou většinu dne i podstatnou část noci hladina nepřesahuje 10 µg/l, což je obvyklá minimální arbitrální hodnota pro průkaz dostatečné produkce. Stanovení růstového hormonu z jednoho krevního odběru tedy zpravidla neodliší dítě s normální nebo se sníženou sekrecí – hladina bude v obou případech nízká. K diagnostice sekrece růstového hormonu používáme stimulační testy.
Image 1. Molekula lidského růstového hormonu 
Image 2. Diurnální variace sekrece růstového hormonu. Růstový hormon se vyplavuje do krve pulzatilně. V první fázi spánku sekrece vrcholí. Přes den je silným podnětem pro vyplavení růstového hormonu namáhavá fyzická zátěž. 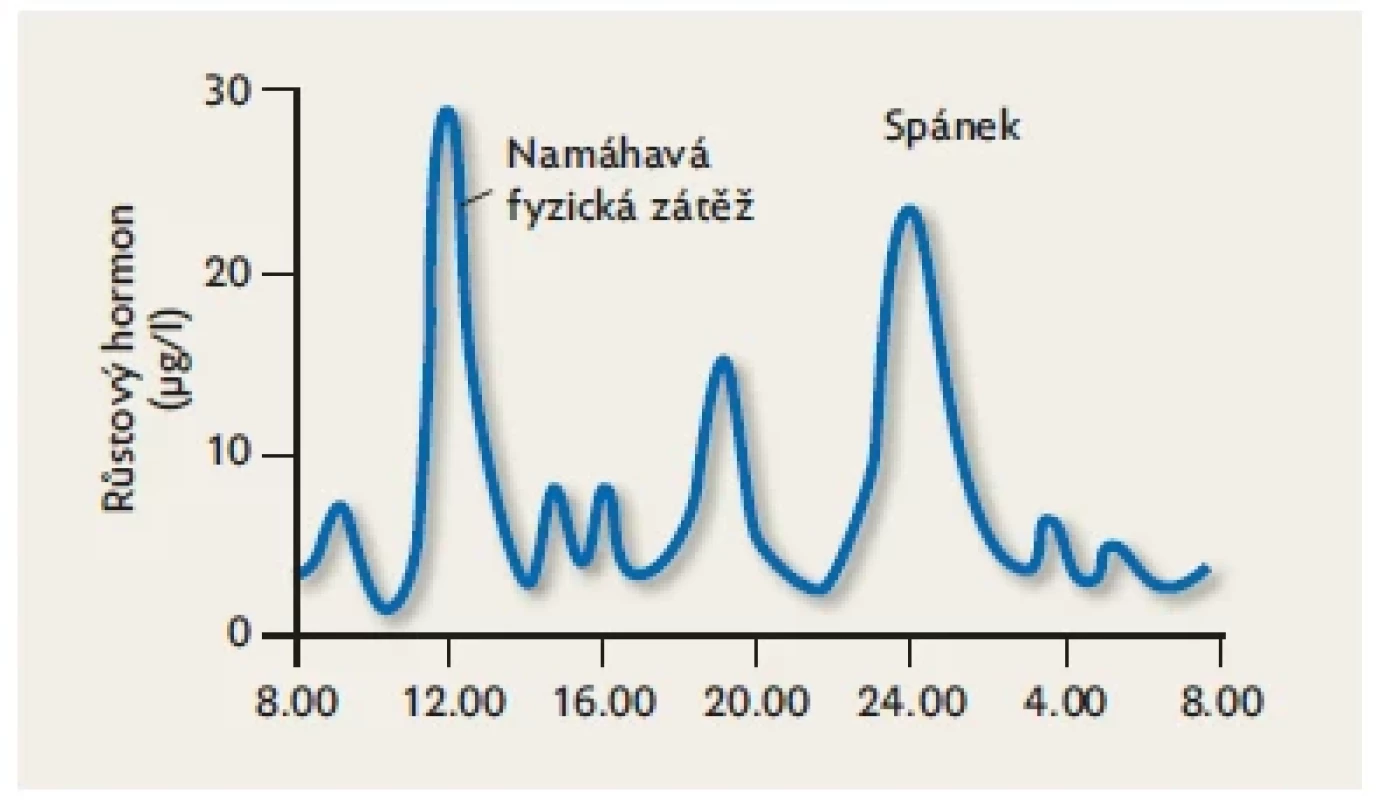
Receptor pro růstový hormon (GHR) je homodimer, složený ze dvou totožných podjednotek. Molekula hGH se váže na jeho extracelulární část (doménu). Tato vazba změní vzájemnou orientaci obou složek homodimeru – obě části navzájem rotují (obr. 3). Tím se aktivuje napojená JAK2 kináza a cestou JAK-STAT signalizační kaskády uvnitř buňky se následně změní genová transkripce v buněčném jádře. Tímto mechanismem se předává informace nesená růstovým hormonem cílovým buňkám.(4,5)
Image 3. Homodimer receptoru pro růstový hormon. Vazbou molekuly růstového hormonu (modře) se spouští JAK-STAT signalizační kaskáda, která přenese informaci do buněčného jádra, kde změní transkripční chování buňky. 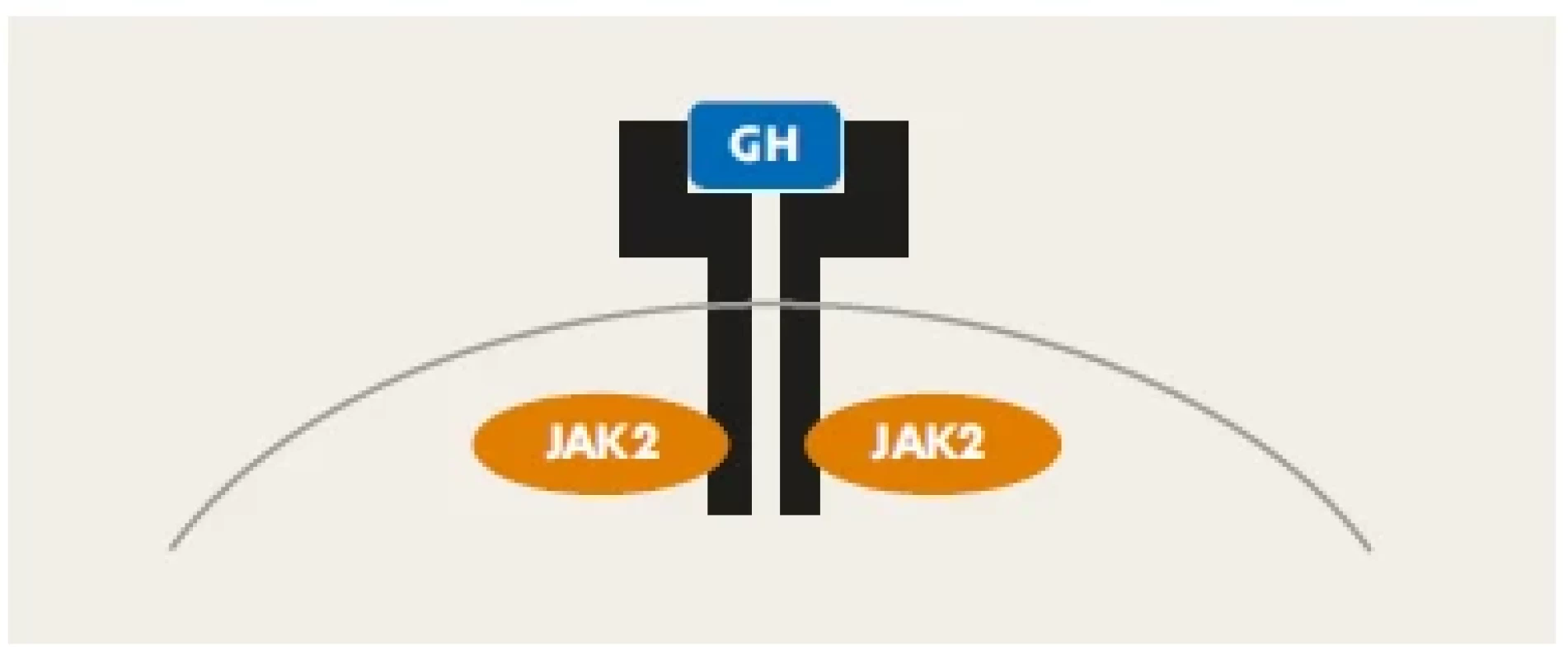
Současné léčení růstovým hormonem
Mezi roky 1957 a 1985 se k léčbě používal výhradně růstový hormon extrahovaný z kadaverózních lidských hypofýz. V té době se přípravek podával obvykle třikrát týdně i.m., děti chodily na injekce do ordinace svého dětského lékaře. Od zavedení biotechnologické výroby rhGH v roce 1985 začal být přípravek k dispozici v potenciálně neomezených množstvích a velká pozornost byla věnována optimalizaci jeho užití.(6,7) Studie ukázaly, že každodenní s.c. injekce večer před spaním jsou nejen příjemnější, ale také účinnější než dřívější podávání třikrát týdně i.m.(8) O něco lépe napodobují přirozenou pulzatilní sekreci růstového hormonu s vzestupem v prvních hodinách spánku – poločas molekuly rhGH po s.c. podání je 3,5 hodiny.
Léčba růstovým hormonem je dlouhodobá. Trvá zpravidla od stanovení diagnózy do ukončení růstu, u pacientů s těžší nedostatečností vlastní sekrece dokonce i v dospělosti. Klinická zkušenost a následně i řada studií prokázala, že při léčbě růstovým hormonem postupně klesá adherence a compliance. Je to způsobeno nejen únavou z mnohaletého léčení a nepohodlím každodenních injekcí, ale také opožděným účinkem léčby – příznivý vliv na růst je patrný až v horizontu týdnů či měsíců, což je pro dítě i adolescenta obtížné pojmout. I když se vynechání jednotlivých dávek bezprostředně neprojeví, bylo jasně dokumentováno, že nedostatečná adherence snižuje účinek léčby.
Jen 30 % pacientů je plně compliantních, tj. vynechá méně než 1 dávku za týden. Adherence klesá zvláště u adolescentů – také proto často končí růst s nižší výškou, než je jejich individuální predikce dle rodičů i populační průměr.
Pro měření adherence lze použít několik metod – pouhý zápis podaných dávek, elektronické přístroje se záznamem aplikovaných injekcí, sledování spotřeby léku či počítání vrácených použitých ampulí či per. Tyto metody ukázaly, že non-adherence kolísá mezi 21–70 %, u většiny pacientů je tedy významná a vede k poklesu růstové rychlosti.(9,10)
Koncept dlouhodobě působícího růstového hormonu (LAGH)
Vývoj dlouhodobě působícího růstového hormonu (long - -acting growth hormone, LAGH) vychází z předpokladu, že nižší četnost injekcí přinese nejen příjemnější léčení, ale zlepší adherenci.
Zájem o dlouhodobě působící růstový hormon je dokonce starší než výroba rhGH – již v éře extrakčního růstového hormonu se zkoušela gelová suspenze s obsahem extrahovaného léku (tab. 1). Nevedla ale k účinným systémovým koncentracím hGH a od dalších pokusů s LAGH bylo na řadu let upuštěno.(11)
Table 1. Metody prodloužení účinku rhGH a příklady jednotlivých molekul 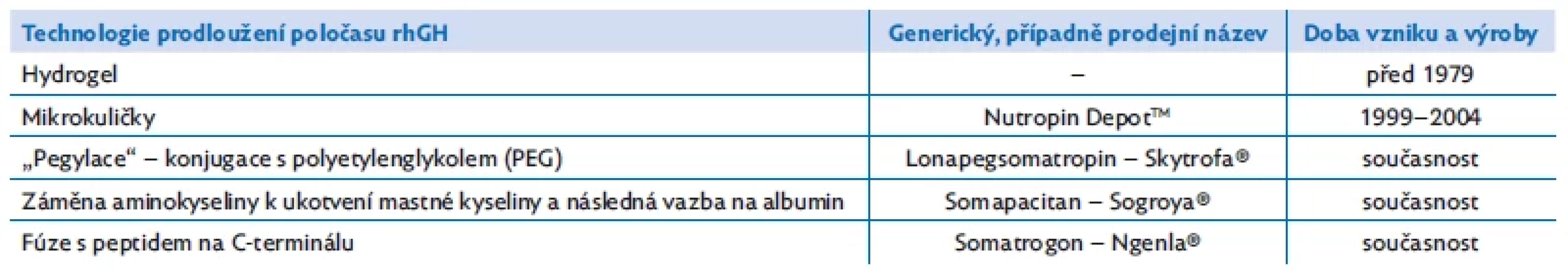
V roce 1999 schválila FDA první skutečný LAGH – Nutropin DepotTM, rhGH enkapsulovaný do mikrokuliček z biokompatibilního a biodegradabilního polyaktid-koglykolidového polymeru. Podával se jednou nebo dvakrát za měsíc.(12) Výroba byla ukončena v roce 2004 pro lokální reakce v místě vpichu a pro technologické výrobní obtíže (viz tab. 1).
V minulých 20 letech se hledaly další cesty prodloužení biologické účinnosti rhGH. Ukázalo se, že přípravky založené na principu podkožního depo rhGH mají tendenci vyvolávat lokální lipoatrofie.(13,14) Pro děti s deficitem růstového hormonu jsou registrované dva podkožní přípravky s pomalým s.c. uvolňováním, určené k aplikaci jednou týdně – jeden v Jižní Koreji a jeden v Číně.(15) V Evropě se neuplatnily.
V současné době jsou v Evropě a v USA v závěrečné fázi klinického zkoušení nebo na prahu klinického použití tři přípravky LAGH (viz tab. 1). Jednou z metod prodlouženého účinku je princip promolekuly přechodně konjugované s nosičem, ze které se předvídatelně a rovnoměrně uvolňuje nativní růstový hormon (lonapegsomatropin, Skytrofa ®).(16)
Druhou možností je záměna aminokyseliny v molekule rhGH, která ukotví mastnou kyselinu, na niž se nekovalentně, a tedy reverzibilně naváže plazmatický albumin (somapacitan, Sogroya®).(17) Tento postup významně zpomalí clearance léku z krevního oběhu a umožní postupnou konverzi na aktivní molekulu. Podobný princip byl použit u inzulinů detemir a degludec a také u liraglutidu a semaglutidu (obr. 4).
Image 4. Schematické znázornění molekuly somapacitanu. V původní molekule rhGH byla na pozici 101 zaměněna aminokyselina (označena šipkou). Na tuto aminokyselinu je ukotvena mastná kyselina, na kterou se nekovalentně reverzibilně váže plazmatický albumin. 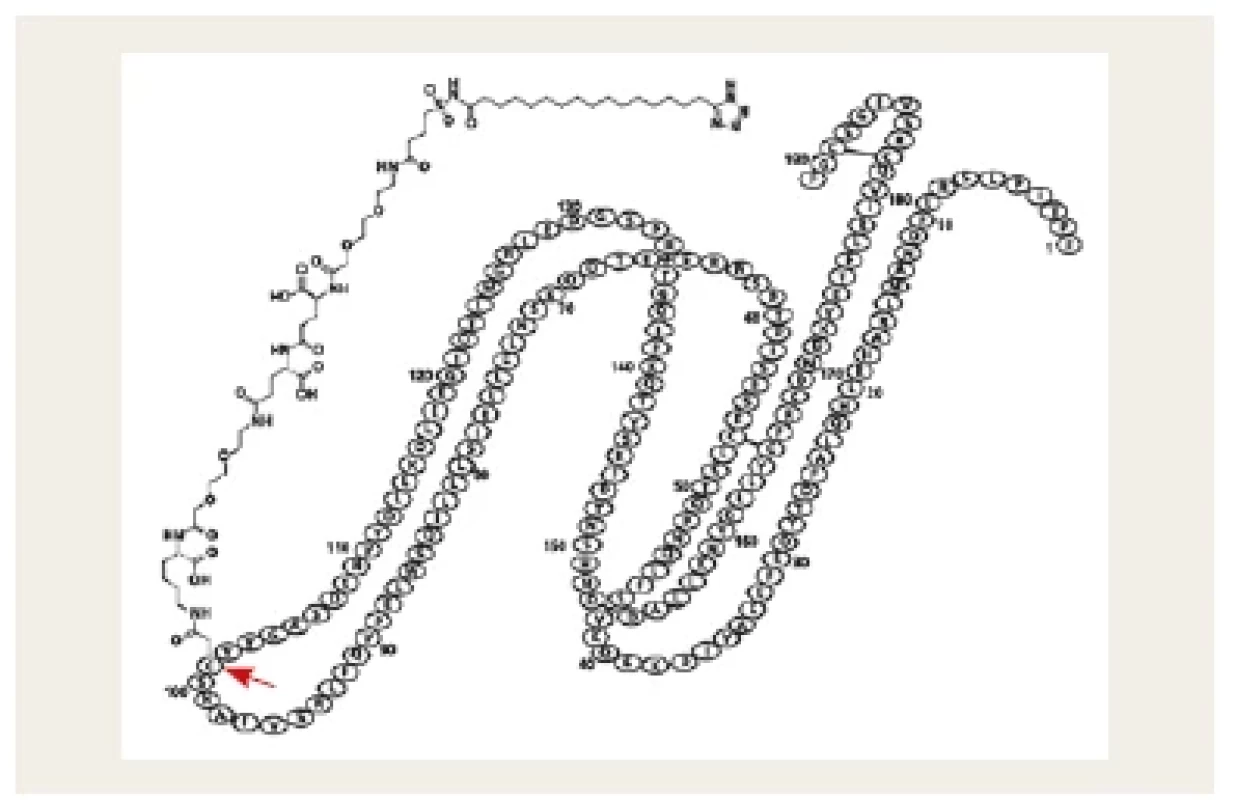
Třetí cestou je fúzní protein se sekvencí převzatou z jiných cirkulujících proteinů (somatrogon, Ngenla®). Somatrogon je rhGH fúzovaný s třemi kopiemi karboxyl-terminálního peptidu (CTP) β-podjednotky lidského choriového gonadotropinu (hCG) o velikosti 47,5 kDa. Jedná se tedy o spojení s přirozeným lidským peptidem, který pro člověka není antigenní.(18) Právě díky CTP má přirozený hCG prodloužený poločas na hodiny ve srovnání s přirozenou molekulou luteinizačního hormonu (LH) s poločasem v řádu minut.
Technologie CTP zpomaluje eliminaci – prodloužení hydrofilního terminálu snižuje renální a hepatální clearance. Somatrogon má poločas účinku 28,2 hodiny, sedmkrát delší než rhGH.
Fúzní proteiny ale mají vyšší molekulární hmotnost, což může omezit průnik do méně prokrvených tkání včetně tuku, kosti a růstové ploténky. Proto se během klinických studií nejdříve hledala bioekvivalentní dávka, která zajistí růstový účinek srovnatelný s rhGH.(19)
Všechny tyto tři molekuly byly navrženy a testovány tak, aby je bylo možné aplikovat jednou týdně a aby měly účinek srovnatelný s rhGH. Je přirozené, že po podávání injekce jednou týdně se mění profil hladin IGF-1 jinak než u každodenní injekce rhGH (obr. 5).(20) U všech tří molekul byly ve fázi 3 klinického zkoušení prokázány příznivé parametry účinnosti a bezpečnosti.(21) Somatrogon byl jako první molekula LAGH v únoru 2022 registrován v EU a v ČR pro léčbu dětí a dospívajících s deficitem růstového hormonu od 3 let věku.
Image 5. Kolísání hladin IGF-1 (SDS) v průběhu jednoho týdne po třech různých dávkách somapacitanu a po každodenní injekci rhGH. Model vytvořený podle skutečných měření u pacientů ve studiích. Upraveno dle(20) 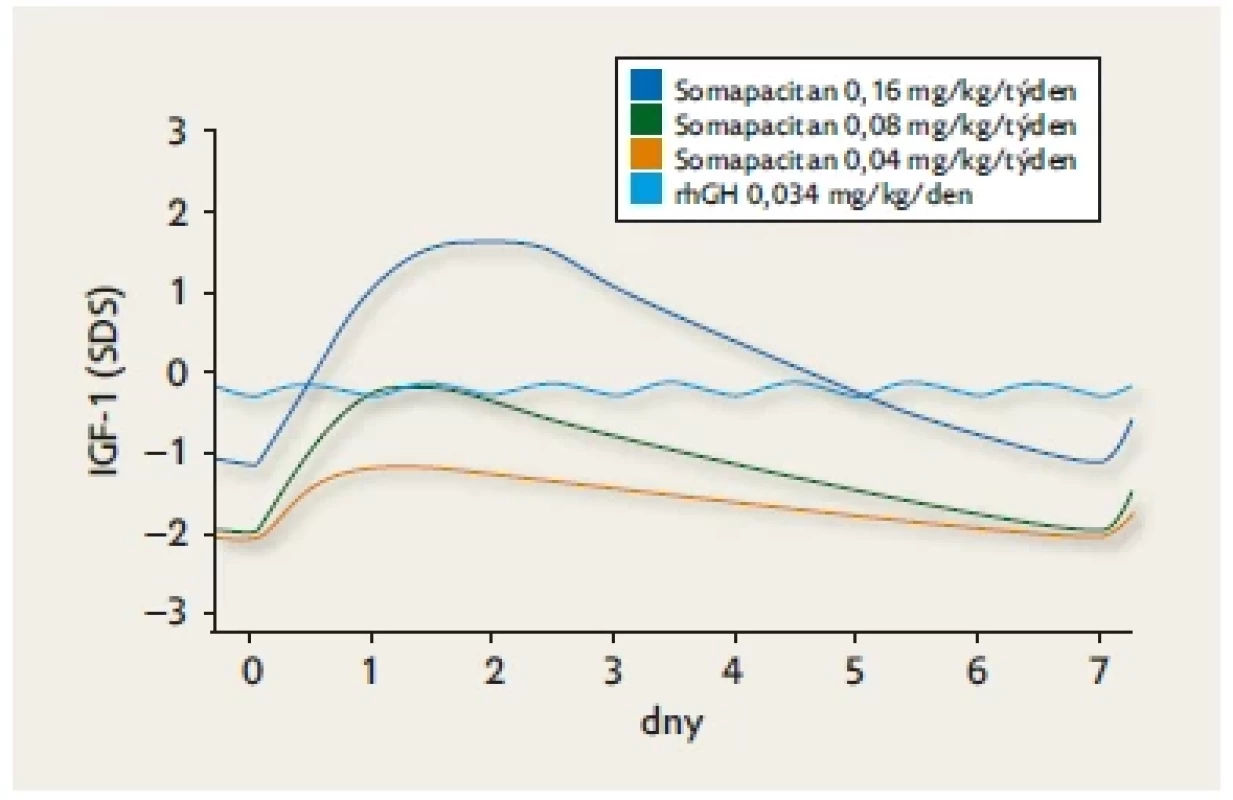
Nové výzvy při léčbě LAGH
Miller se spolupracovníky nedávno formulovali několik bodů, které označili jako nové výzvy při léčbě LAGH.(14)
Pootevřenou otázkou zůstává interpretace hladin IGF-1 při potřebě upravovat dávkování LAGH či monitorovat spolupráci při léčení. Zatímco při každodenní injekci rhGH jsou hladiny IGF-1 v průběhu dne stabilní, při injekci LAGH jednou týdně má hladina IGF-1 specifickou dynamiku – dosahuje vrcholu a poté po zbytek týdne klesá (viz obr. 5).(20) K posouzení účinku je tedy třeba znát odstup od injekce v okamžiku krevního odběru a mít k dispozici podklady pro standardní konverzi změřené hodnoty.
Jinou otázkou je skutečný vliv nižšího počtu injekcí na adherenci. I když léčba LAGH vypadá ve srovnání s každodenní injekcí atraktivně, nevíme, zda skutečně zlepší adherenci. Příčiny nízké adherence a compliance jsou komplexní – nejen každodenní aplikace. Navíc u některých dětí nemusí být LAGH přínosem – u dětí s těžkým deficitem růstového hormonu se může vrátit riziko hypoglykemie v době klesajícího účinku. A konečně – zatímco možnost recidivy či rozvoje tumoru je při každodenních injekcích rhGH a při stabilním IGF-1 nízké až zanedbatelné, zatím nejsou k dispozici údaje o účinku LAGH u dětí s anamnézou onkologického onemocnění.
Subjektivní vnímání zátěže léčbou
Naše první zkušenosti s LAGH vycházejí ze studie subjektivního vnímání zátěže léčbou u dětí, které dostávaly somatrogon jednou týdně ve srovnání s každodenní aplikací klasického rhGH. Mezinárodní multicentrické studie se zúčastnilo 87 dětí s deficitem růstového hormonu ve věku 3–17 let a dlouhodobě zavedenou léčbou, z toho 21 v našich čtyřech centrech v Česku a na Slovensku. Děti dostávaly v náhodném pořadí střídavě 12 týdnů každodenní injekci rhGH a 12 týdnů LAGH somatrogon jednou za týden. Rodiče a starší děti hodnotili standardními dotazníky zátěž, jakou léčba pro dítě a rodiče představuje. Celkové skóre zásahu léčby do života bylo během podávání somatrogonu třetinové (8,63 proti 24,13 bodu). Zlepšení bylo zřejmé ve většině parametrů, zejména v ukazatelích „spokojenost s celkovou zkušeností z léčby“ a „přání pokračovat ve stejném léčebném schématu“.(22) Subjektivně tedy vnímají možnost léčit přípravkem LAGH děti i rodiče příznivě.
Poděkování. Problematiku růstového hormonu řeší pracoviště autorů s podporou grantu AZV NV18-07-00283. Klinickou studii subjektivního vnímání zátěže léčbou somatrogonem jednou týdně ve srovnání s každodenní injekcí rhGH navrhla a podpořila společnost Pfizer.
Korespondenční adresa:
prof. MUDr. Jan Lebl, CSc.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Jan.Lebl@Lfmotol.cuni.cz
Sources
- Raben MS. Treatment of a pituitary dwarf with human growth hormone. J Clin Endocrinol Metab 1958; 18 : 901–903.
- Reh CS, Geffner ME. Somatotropin in the treatment of growth hormone deficiency and Turner syndrome in pediatric patients: a review. Clin Pharmacol 2010; 2 : 111–122.
- Ranke MB, Wit JM. Growth hormone – past, present and future. Nat Rev Endocrinol 2018; 14 : 285–300.
- Brooks AJ, Waters MJ. The growth hormone receptor: mechanism of activation and clinical implications. Nat Rev Endocrinol 2010; 6 : 515–525.
- Waters MJ. The growth hormone receptor. Growth Horm IGF Res 2016; 28 : 6–10.
- Albertsson-Wikland K, Westphal O, et al. Daily subcutaneous administration of human growth hormone in growth hormone deficient children. Acta Paediatr Scand 1986; 75 : 89–97.
- Ranke MB. Clinical experience with authentic recombinant human growth hormone. Acta Paediatr Scand Suppl 1986; 325 : 90–92.
- Kastrup KW, Christiansen JS, Andersen JK, et al. Increased growth rate following transfer to daily sc administration from three weekly im injections of hGH in growth hormone deficient children. Acta Endocrinol (Copenh) 1983; 104 : 148–152.
- Cutfield WS, Derraik JGB, Gunn AJ, et al. Non-compliance with growth hormone treatment in children is common and impairs linear growth. PloS One 2011; 6: e16223-e16223.
- Kapoor RR, Burke SA, Sparrow SE, et al. Monitoring of concordance in growth hormone therapy. Arch Dis Child 2008; 93 : 147–148.
- Lippe B, Frasier SD, Kaplan SA. Use of growth hormone-gel. Arch Dis Child 1979; 54 : 609–613.
- Johnson OL, Cleland JL, Lee HJ, et al. A month-long effect from a single injection of microencapsulated human growth hormone. Nat Med 1996; 2 : 795–799.
- Cai Y, Xu M, Yuan M, et al. Developments in human growth hormone preparations: sustained-release, prolonged half-life, novel injection devices, and alternative delivery routes. Int J Nanomedicine 2014; 9 : 3527–3538.
- Miller BS, Velazquez E, Yuen KCJ, et al. Long-acting growth hormone preparations – current status and future considerations. J Clin Endocrinol Metab 2020; 105: e2121–e2133.
- Luo X, Hou L, Liang L, et al. Long-acting PEGylated recombinant human growth hormone (Jintrolong) for children with growth hormone deficiency: phase II and phase III multicenter, randomized studies. Eur J Endocrinol 2017; 177 : 195–205.
- Thornton PS, Maniatis AK, Aghajanova E, et al. Weekly lonapegsomatropin in treatment naïve children with growth hormone deficiency: the phase 3 height trial. J Clin Endocrinol Metab 2021; 106 : 3184–3195.
- Thygesen P, Andersen HS, Behrens C, et al. Nonclinical pharmaco-kinetic and pharmacodynamic characterisation of somapacitan: A reversible non - -covalent albumin-binding growth hormone. Growth Horm IGF Res 2017; 35 : 8–16.
- Fisher DM, Rosenfeld RG, Jaron-Mendelson M, et al. Pharmacokinetic and pharmacodynamic modeling of MOD-4023, a long-acting human growth hormone, in growth hormone deficiency children. Horm Res Paediatr 2017; 87 : 324–332.
- Zelinska N, Iotova V, Skorodok J, et al. Long-acting C-terminal peptide - -modified hGH (MOD-4023): Results of a safety and dose-finding study in GHD children. J Clin Endocrinol Metab 2017; 102 : 1578–1587.
- Sävendahl L, Battelino T, Brod M, et al. Once weekly somapacitan vs daily GH in children with GH deficiency: results from a randomized phase 2 trial. J Clin Endocrinol Metab 2020; 105: e1847–e1861.
- Allen DB, Merchant N, Miller BS, et al. Evolution and future of growth plate therapeutics. Horm Res Paediatr 2021; 94 : 319–332.
- Maniatis AK, Carakushansky M, Galcheva S, et al. Treatment burden of weekly somatrogon vs daily genotropin in children with growth hormone deficiency: a randomized study. J Endocr Soc 2022; in press.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue Supplementum 3-
All articles in this issue
- Vážení kolegové, přátelé, pediatři z primární péče, z regionálních nemocnic i z klinik,
- Minipuberty – an important and still neglected period of sexual development
- Current perspectives on the aetiology of tall stature in children and adolescents (1): Syndromes associated with tall stature
- Current perspectives on the aetiology of tall stature in children and adolescents (2): Non-syndromic tall stature
- Endocrine causes of obesity in childhood and adolescence
- Children and adolescents with gender incongruence: current approaches and situation in the Czech Republic
- First experience with long-acting growth hormone
- Mystický Hagibor a jeho místo v historii české pediatrie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Minipuberty – an important and still neglected period of sexual development
- First experience with long-acting growth hormone
- Current perspectives on the aetiology of tall stature in children and adolescents (1): Syndromes associated with tall stature
- Children and adolescents with gender incongruence: current approaches and situation in the Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

