-
Medical journals
- Career
Sepse u dětí
Authors: Fremuth Jiří; Šašek Lumír; Huml Michal; Kotková Alexandra; Forejt Jan; Sýkora Josef
Authors‘ workplace: Dětská klinika, Lékařská fakulta a Fakultní nemocnice v Plzni, Univerzita Karlova v Praze
Published in: Čes-slov Pediat 2022; 77 (4): 246-254.
Category: Chapters for Specialization in Pediatrics
doi: https://doi.org/10.55095/CSPediatrie2022/041Overview
Přes pokroky v medicíně zůstává sepse i v 21. století jedním z hlavních faktorů, které se podílejí na morbiditě a mortalitě v dětském věku. Problematika sepse u dětí má svá specifika. Cílem článku je popsat přehlednou a ucelenou formou definici, etiologii, epidemiologii, patofyziologii, klinický obraz, diagnostiku a úvodní fázi terapie sepse u dětí mimo novorozenecký věk.
Klíčová slova:
deti – pediatrie – sepse – septický šok
Definice sepse
Původní a stále platná definice sepse vznikla na základě konsenzu konference v roce 2005.(1) Tato definice je shrnuta v tabulce 1.(1) Sepsi hodnotila jako postupně se zhoršující stav v důsledku prokázané či předpokládané infekce. Infekční inzult je v počátku provázen rozvojem syndromu systémové zánětlivé odpovědi (SIRS). V dalším průběhu vede k postižení (dysfunkci) jednotlivých orgánových systémů (kardiovaskulárního, dýchacího, CNS, krevního, koagulačního, jater a ledvin) a rozvoji těžké sepse a septického šoku. Tuto stále platnou definici můžeme považovat v dnešní době již za překonanou.(2)
Table 1. Původní a dosud platná definice SIRS (syndromu systémové zánětlivé odpovědi), sepse, těžké sepse a septického šoku(1) 
Cílem definice sepse by mělo být co nejvčasnější rozpoznání pacientů, kteří jsou ohroženi selháním funkce orgánových systémů, a tedy vysokou mortalitou. V roce 2016 byla vytvořena nová definice sepse pro dospělé pacienty.(3) Sepse u dospělých je definována jako život ohrožující orgánová dysfunkce v důsledku dysregulované odpovědi pacienta na infekci. Orgánová dysfunkce a její kvantifikace je charakterizována zvýšením skórovacího systému SOFA (sepsis-related organ failure assessment). Septický šok je definován jako kardiovaskulární, buněčná nebo metabolická dysfunkce vyžadující podávání vazopresorů k udržení krevního tlaku.
V současné době je vyvíjena aktivita k vypracování nové, modernizované definice sepse pro dětský věk. Aktuální pediatrická literatura již opouští původní definici a chápe sepsi shodně s aktuálně platnou definicí pro dospělé pacienty. Kvantifikace orgánového postižení se v případě nově vznikající pediatrické definice bude s nejvyšší pravděpodobností opírat o použití některého z pediatrických skórovacích systémů (např. PELOD, pSOFA).(4,5) Aktuální pediatrická literatura pracuje pouze s pojmy sepse (orgánová dysfunkce asociovaná se sepsí) a septický šok (kardiovaskulární dysfunkce s poruchou perfuze orgánů, hypotenzí a potřebou podávání vazoaktivních látek).
Etiologie a epidemiologie sepse
Nejvyšší incidence se týká pacientů v novorozeneckém věku, v dalších věkových skupinách její výskyt postupně klesá a incidence se opět zvyšuje u pacientů nad 60 let. Pokud vnímáme sepsi jako dysregulovanou reakci organismu na infekci, pak se na vzniku sepse může podílet jakékoliv infekční agens.(6,7) Nejčastěji jde o reakci na bakteriální či virovou infekci, méně často se setkáváme s reakcí na mykotické a vzácně na parazitární onemocnění. Z bakteriálních kmenů se podílejí G+ i G - bakterie. Nejčastější etiologická agens jsou uvedena v tabulce 2.
Table 2. Typická etiologická agens podílející se na vzniku sepse a septického šoku 
Dle publikovaných studií se u více než 30 % pacientů nepodaří prokázat žádné infekční agens. To může být vysvětleno například virovou etiologií onemocnění, nedostatečnou senzitivitou provedených vyšetření nebo předchozím nasazením antibiotik u bakteriálních infekcí.(6,7)
Sepsí a septickým šokem jsou častěji postiženi chronicky nemocní pacienti s komorbiditami. V tabulce 3 jsou uvedeny
Table 3. Rizikové faktory vzniku sepse a septického šoku 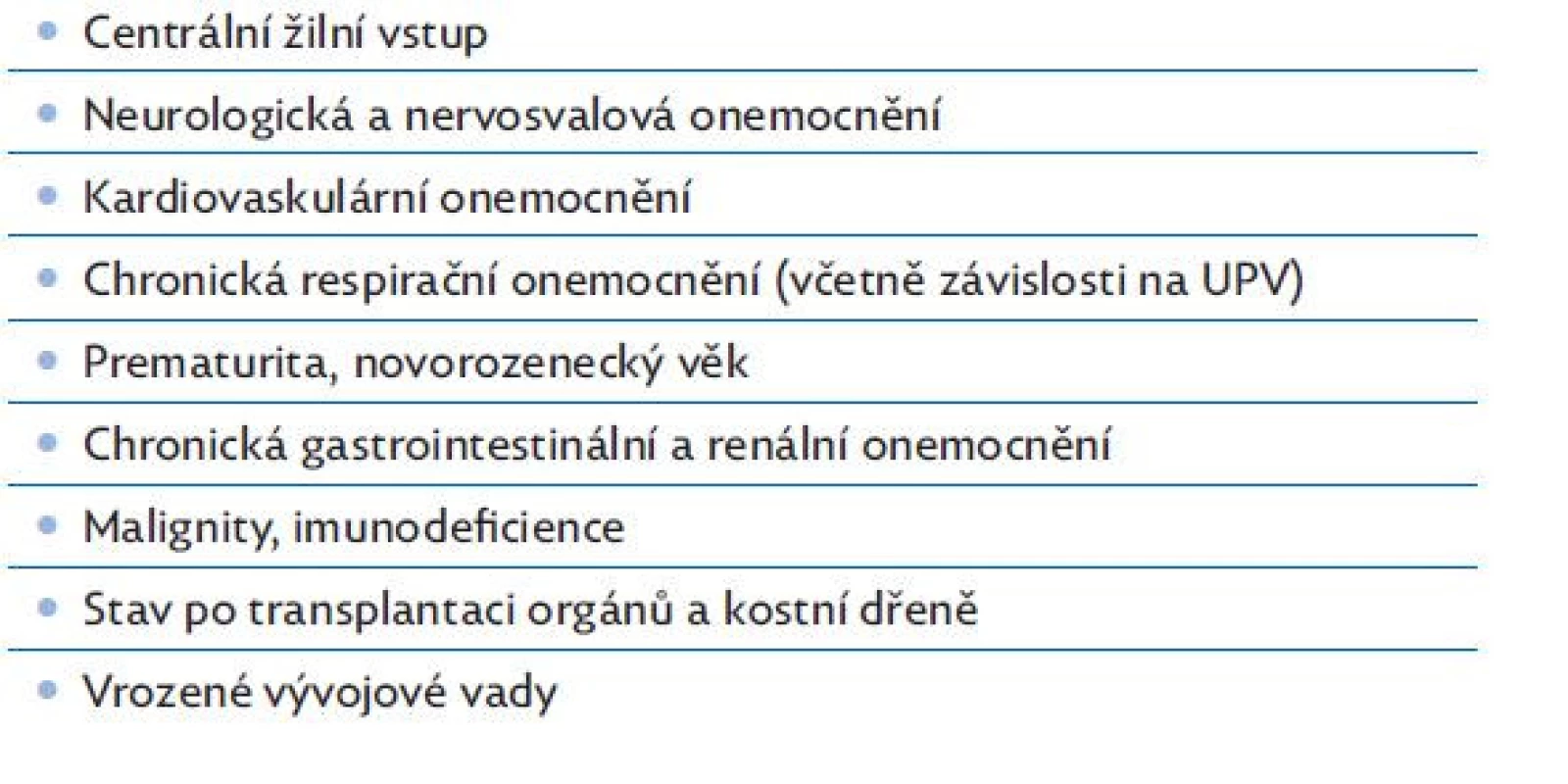
Patofyziologie sepse
Sepsi chápeme jako generalizovanou odpověď organismu na infekci, při které mohou být poškozeny i vzdálené orgány, které nesouvisejí s místem vstupu infekce.(8) Snahou organismu je infekci lokalizovat a její průběh kontrolovat. Existuje pravděpodobně více faktorů, které se podílejí na generalizaci reakce organismu na infekční podnět: druh infekčního agens, iniciální infekční nálož, vstupní místo infekce, individuální rozdíly mezi pacienty v důsledku genetických dispozic, imunosupresivní terapie a další. V rámci odpovědi organismu jsou aktivovány pro - a antiinflamatorní mechanismy, provázené produkcí řady cytokinů, mediátorů zánětu a uvolňováním částí infekčních agens, které vedou k aktivaci koagulační kaskády a komplementu. V případě expozice infekčním agens a při poškození tkání jsou rozeznávány specifické patogenní (PA MP – pathogen associated molecular pattern molecules) a tkáňové (DAMP – damage associated molecular pattern molecules) molekuly pomocí specifických receptorů (TLR – toll-like receptory) na povrchu monocytů a antigen prezentujících buněk. V další fázi dojde k produkci prozánětlivých cytokinů a mediátorů, v popředí stojí tumor necrosis factor alpha (TNF-α) a interleukin 1 (IL-1). Způsobují typické klinické příznaky, zejména horečku, tachykardii a následně změny tlaku. Je spuštěna stresová endokrinní odpověď a dále energetické metabolické změny (glukoneogeneze a lipolýza). V rámci spuštěné cytokinové kaskády dochází v další fázi k produkci např. interleukinu 6 a 8 (IL-6, IL-8). V časné fázi sepse dochází k aktivaci komplementového systému. Objevuje se leukocytóza s uvolněním mladých forem neutrofilů z marginálních poolů (adherující neutrofily a kostní dřeň). Aktivované neutrofily vytvářejí takzvané neutrofilní extracelulární pasti (NETs – neutrophil extracellular traps) s antimikrobiální funkcí. Prozánětlivé mediátory souběžně tlumí apoptotické pochody neutrofilů i makrofágů, což se negativně projevuje na omezování útlumu patologické zánětlivé odpovědi, a udržuje ji tak v začarovaném kruhu. Naopak zvýšená apoptóza lymfocytů při sepsi má nepříznivé účinky na efektivitu imunitní odpovědi vůči infekčnímu agens. Současně s aktivací prozánětlivých procesů se aktivují imunosupresivní mechanismy. Aktivace neutrofilů vede k jejich adherenci k endotelu. Na endotel adherované aktivované neutrofily produkují reaktivní kyslíkové formy, vazoaktivní látky (NO, PDGF, PA F, endotelin) a proteolytické enzymy, čímž dochází k poškození endotelu, postižení endoteliálního glykokalyxu, zvýšení endoteliální permeability a aktivaci prokoagulačních mechanismů. Spouští se koagulační kaskáda s typickými projevy ve smyslu diseminované intravaskulární koagulopatie (DIC), souběžně je aktivován i fibrinolytický systém.(8) Objevují se změny deformability erytrocytů. To vše rezultuje v postižení mikrocirkulace a v rozvoj tkáňové ischemie. Ke tkáňové ischemii přispívá i prozánětlivými cytokiny indukovaná mitochondriální dysfunkce (tkáňová dysoxie). Následkem popsaných pochodů jsou orgánově specifické patologie na úrovni krevního oběhu, ledvin (AKI – acute kidney injury), plic (ARDS – acute respiratory distress syndrome), jater, gastrointestinálního systému, mozku a vegetativního nervového systému. Dominující jsou především patologie krevního oběhu na všech jeho úrovních, tedy septická kardiomyopatie, vazoparéza a postižení mikrocirkulace.
Laboratorní průkaz sepse
Podezření na přítomnost sepse získané při důkladném klinickém vyšetření samo o sobě nepostačuje k její diagnostice. Klinický stav je ale rozhodujícím parametrem pro zahájení terapie v případě známek šokového stavu. Septický proces vede k produkci řady molekul (biomarkerů). Ideální biomarker by měl pomoci při screeningu a včasné diagnostice pacienta se sepsí, ve stratifikaci rizika (pomůže kvantifikovat závažnost stavu), v diferenciaci mezi bakteriální, virovou, mykotickou infekcí nebo neinfekčním stavem. V případě zahájení terapie by měl monitorovat odpověď na léčbu a pomoci v rozhodnutí o délce podávání antibiotické terapie. I přes intenzivní snahu a identifikaci více než stovky molekul nebyl dosud univerzální biomarker u dětí ani u dospělých objeven.(9,10) Ukazuje se, že validnější než vyšetření jednoho z laboratorních ukazatelů je kombinace vyšetření více parametrů. Vyšší vypovídací hodnotu pro sledování rozvoje patologického stavu a hodnocení odpovědi na léčbu má dynamika hladin těchto laboratorních ukazatelů (opakované vyšetření s časovým odstupem) než pouze jejich úvodní jednorázové vyšetření. Každé vyšetření laboratorních parametrů musíme hodnotit v kontextu klinického stavu pacienta.(10) Níže budu zmíněny nejčastěji dostupné a běžně používané laboratorní ukazatele spolu s jejich základní charakteristikou.
Laktát
Laktát vzniká enzymatickou reverzibilní konverzí z pyruvátu (účinkem enzymu laktátdehydrogenázy). Hladina laktátu je výsledkem dynamického procesu mezi jeho vznikem na jedné straně a jeho využitím tkáněmi na straně druhé. U řady pacientů se sepsí a septickým šokem se setkáváme se zvýšenou hladinou laktátu (normální hladina je do 1,8 mmol/l). Při nízkém srdečním výdeji dochází v důsledku nízkého zásobení tkání kyslíkem k produkci laktátu (anaerobní glykolýza). Zvýšenou hladinu laktátu při sepsi nelze zjednodušeně interpretovat pouze jako důsledek hypoxie tkání nebo jejich hypoperfuze.(11) Hyperlaktatemie může být například důsledkem zvýšené glykolýzy či důsledkem snížení aktivity pyruvátdehydrogenázy (dochází k pomalému odstraňování laktátu ze tkání). Pro praxi je nutno si pamatovat, že každý pacient se sepsí musí mít vstupně vyšetřenu hladinu laktátu. Vhodný je odběr arteriální nebo venózní krve. Arteriální hladina laktátu je považována za zlatý standard. Pokud nemá pacient hyperlaktatemii, odpovídá hladina laktátu v arteriální krvi hladině venózní. Při hladině laktátu nad 2 mmol/l se k monitoraci v intenzivní péči doporučuje jako přesnější odběr arteriální. Měření hladiny laktátu z kapilární krve se nedoporučuje pro nepřesnost měření (často je hladina ovlivněna technikou odběru). Laktát nelze dle současných poznatků použít jako jasný stratifikační parametr (hyperlaktatemie při vstupním vyšetření není u dětí jednoznačným parametrem predikujícím mortalitu pacienta), i když některé studie dokládají vyšší riziko orgánové dysfunkce a vyšší mortalitu u pacientů se vstupně zvýšenou hladinou laktátu.(11) Sledování dynamiky hladiny laktátu u septického pacienta (opakovaný odběr hladiny laktátu s odstupem 2 hodin) a jeho pomalá clearance v prvních hodinách po zahájení terapie septického šoku jsou spojeny s vyšší mortalitou (pacienti s přetrvávající hyperlaktatemií nebo pomalým poklesem zvýšené hladiny laktátu jsou zatíženi vyšší mortalitou). Vstupní normální hladina laktátu ale nevylučuje přítomnost sepse nebo septického šoku (až pětina pacientů s normální vstupní hladinou laktátu je následně postižena orgánovou dysfunkcí).(12) Při každém hodnocení laktatemie je třeba zvážit její další důvody (vrozené poruchy metabolismu, vliv léků, použití katecholaminů, poškození jater, intoxikace, maligní onemocnění, dysmikrobie střeva a další).
Prokalcitonin (PCT)
PCT je prekurzorem hormonu kalcitoninu. Za normálních podmínek je produkován prakticky pouze C buňkami štítné žlázy a konvertován na hormon kalcitonin, v séru je prokazován jen v minimálních koncentracích (hodnota u dítěte nad novorozenecký věk do 0,05 ng/ml). Pokud je jeho hodnota pod 0,5 ng/ml, je riziko systémové bakteriální infekce nízké. V případě produkce prozánětlivých cytokinů za přítomnosti bakteriální infekce je PCT produkován i dalšími tkáněmi v těle (játra, ledviny, plíce, mozek, střevo, nadledviny a pankreas) a dochází k jeho vyplavování do oběhu s prokazatelně vyššími hladinami v séru. PCT se zvyšuje časně po inzultu (4–6 h) a maximální hodnoty dosahuje mezi 24. až 36. hodinou.(13) Zvýšená produkce je prokázána i u pacientů s neutropenií. V případě virové infekce je jeho produkce tlumena produkcí interferonu-γ, a proto jeho hodnoty v séru nedosahují hodnot produkovaných při čistě bakteriální etiologii. Zvýšená hladina byla prokázána i u dalších patologických stavů mimo bakteriální infekci (mykotické infekce, chirurgický výkon, popáleniny, ischemie střeva, tumory a paraneoplastické syndromy, multiorgánové selhání, malárie).(14) Jeho klinický přínos se zvyšuje, pokud se hladina PCT kombinuje s vyšetřením CRP. Elevace hladin obou těchto biomarkerů zvyšuje pravděpodobnost bakteriální infekce. Pokud jsou oba tyto zánětlivé parametry opakovaně nezvýšené, je nízká pravděpodobnost bakteriální infekce.(10,14,15) Hodnoty PCT jsou fyziologicky vyšší v prvních několika dnech po porodu s maximem hladin kolem prvních 24 hodin a postupným poklesem v dalších 2 dnech.
C-reaktivní protein (CRP)
Je dalším široce vyšetřovaným proteinem akutní fáze. Je produkován v hepatocytech v důsledku produkce prozánětlivých cytokinů. Jeho vzestup je pozorován cca 6–12 hodin od začátku infekce a vrcholu dosahuje s delším časovým horizontem 36–50 hodin. Jeho biologický poločas je kolem 19 hodin, a proto i pokles při úspěšné léčbě bude pomalejší ve srovnání s IL-6 a PCT. Vazbou na poškozené buňky a bakteriální či nebakteriální patogeny se podílí na opsonizaci, aktivaci komplementu a fagocytóze. Zvyšuje se nespecificky u traumat, autoimunitních onemocnění, tumorózních onemocnění, nekrózy tkání, alergických reakcí a v pooperačním průběhu. Jeho izolovaný přínos k potvrzení či vyloučení bakteriální infekce je nižší ve srovnání s PCT.
Interleukin 6 (IL-6)
Je pleiotropní prozánětlivý cytokin, který je produkovaný po aktivaci nespecifické imunity makrofágy. Podílí se na produkci proteinů akutní fáze a na rozvoji imunitní odpovědi v rámci zánětu. Elevuje 2–4 hodiny od začátku infekčního inzultu s dosažením vrcholu hladin během 6–12 hodin. Vzhledem ke krátkému biologickému poločasu dochází k časnému poklesu při odpovědi na léčbu. Jeho senzitivita a specificita nejsou dle publikovaných studií vyšší ve srovnání s PCT. (9,10)
Změny v krevním obraze
V přítomnosti bakteriálních infekcí jsou typicky pozorovány leukocytóza, neutrofilie a vyplavování nezralých forem granulocytů.
Hemokultura a odběr biologického materiálu
V rámci vstupního vyšetření pacienta s podezřením na sepsi bychom měli vždy odebrat materiál k potvrzení či vyloučení bakteriálních, virových a mykotických infekcí. Typicky odebíraný biologický materiál: hemokultura, moč na kultivaci, stěry z dýchacích cest či sputum, tracheální aspirát, BAL, stolice, mozkomíšní mok, stěry z chirurgických ran či abscesů.
I když je získání biologického materiálu velice důležité, jeho odběr by neměl oddálit zahájení antibiotické terapie. Pokud by mělo dojít u pacienta s projevem orgánové dysfunkce k oddálení zahájení antibiotické léčby, má být nasazení antibiotik preferováno před odběrem biologického materiálu.
Průkaz pozitivní hemokultury je považován za zlatý standard v rámci diagnózy sepse. Dle publikovaných studií se zhruba u 50 % pacientů podaří prokázat bakteriální patogen, pozitivita hemokultury je prokázána u 30–40 % pacientů.( 17,18) Odběr hemokultury musí být proveden sterilně. Záchyt patogena se zvyšuje s vyšším odebraným objemem krve. U nízkých věkových skupin jsme ale limitováni objemem, který lze pacientovi odebrat. Výtěžnost hemokultury může být negativně ovlivněna například špatnou technikou odběru (kontaminace), malým množstvím odebrané krve, předchozím nasazením antibiotik, absencí bakteriemie nebo nebakteriální etiologií onemocnění. Pro správnou výtěžnost vyšetření je hlavní determinantou objem odebrané krve, nikoliv časování odběru (není nutné čekat na výskok teploty). V případě pozitivity se podaří prokázat záchyt nejdříve za 24–36 hodin. Z hlediska objemu odebrané krve při vyšetření hemokultury je u kojenců a batolat doporučeno odebírat 4 ml krve, u dětí nad 12,8 kg hmotnosti 10 ml krve, u dětí s hmotností nad 36 kg 20–30 ml krve. Je doporučeno provést 1–2 odběry. Při odběru pod 10 ml objemu je preferováno vyšetření na aerobní kultivaci.(18) V indikovaných případech se odebírá i anaerobní a mykologická hemokultura.
V současné době jsou k objasnění etiologie infekce (bakteriální i nebakteriální) využívány moderní postupy molekulární biologie (MALDI/TOF – matricí asistovaná laserová desorpce/ionizace, monoplexová PCR, multiplexová PCR, FISH – fluorescenční in situ hybridizace) a sérologická vyšetření. Výhodou těchto metod je rychlá identifikace infekčního agens (bakteriálního, virového či mykologického) nebo průkaz bakteriální etiologie i při neúspěšné kultivaci. Při pátrání po zdroji infekce využíváme i další dostupné vyšetřovací metody (rentgen, ultrasonografie, CT, MRI, laparoskopie).
Klinický obraz
Vzhledem k multiorgánovému charakteru postižení v rámci sepse si při klinickém vyšetření všímáme příznaků svědčících pro zatížení více orgánových systémů (CNS, dýchací systém, kardiovaskulární systém, nález na kůži, změny teploty). Klinické změny typické pro sepsi a septický šok jsou shrnuty v tabulkách 4 a 5.
Table 4. Nejčastější klinické příznaky sepse a septického šoku 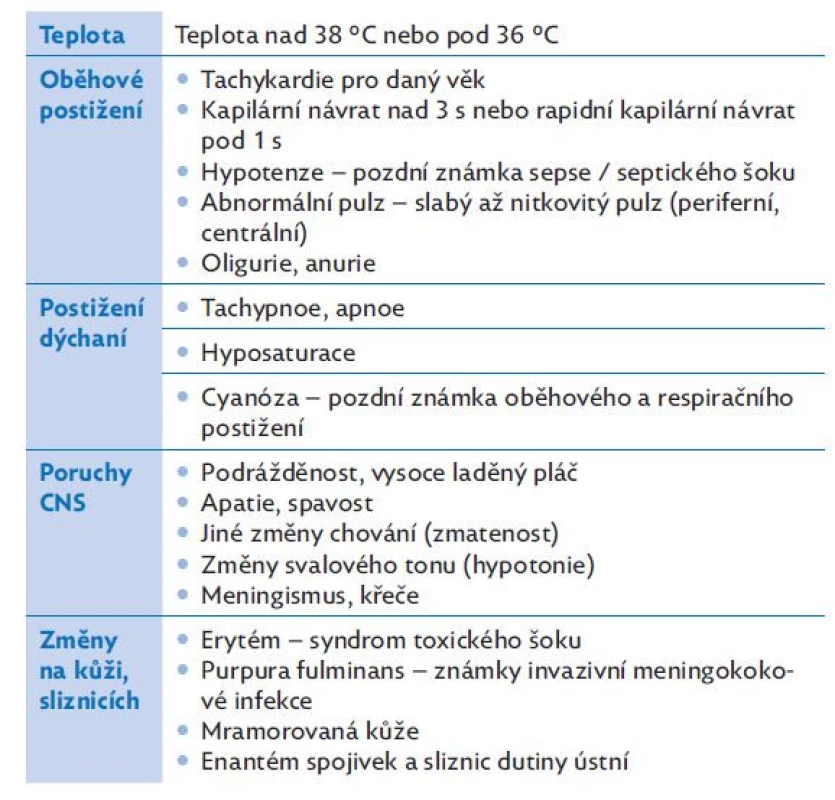
Table 5. Kritéria pro tachykardii, tachypnoi a hypotenzi dle věku. Volně podle PALS (19) 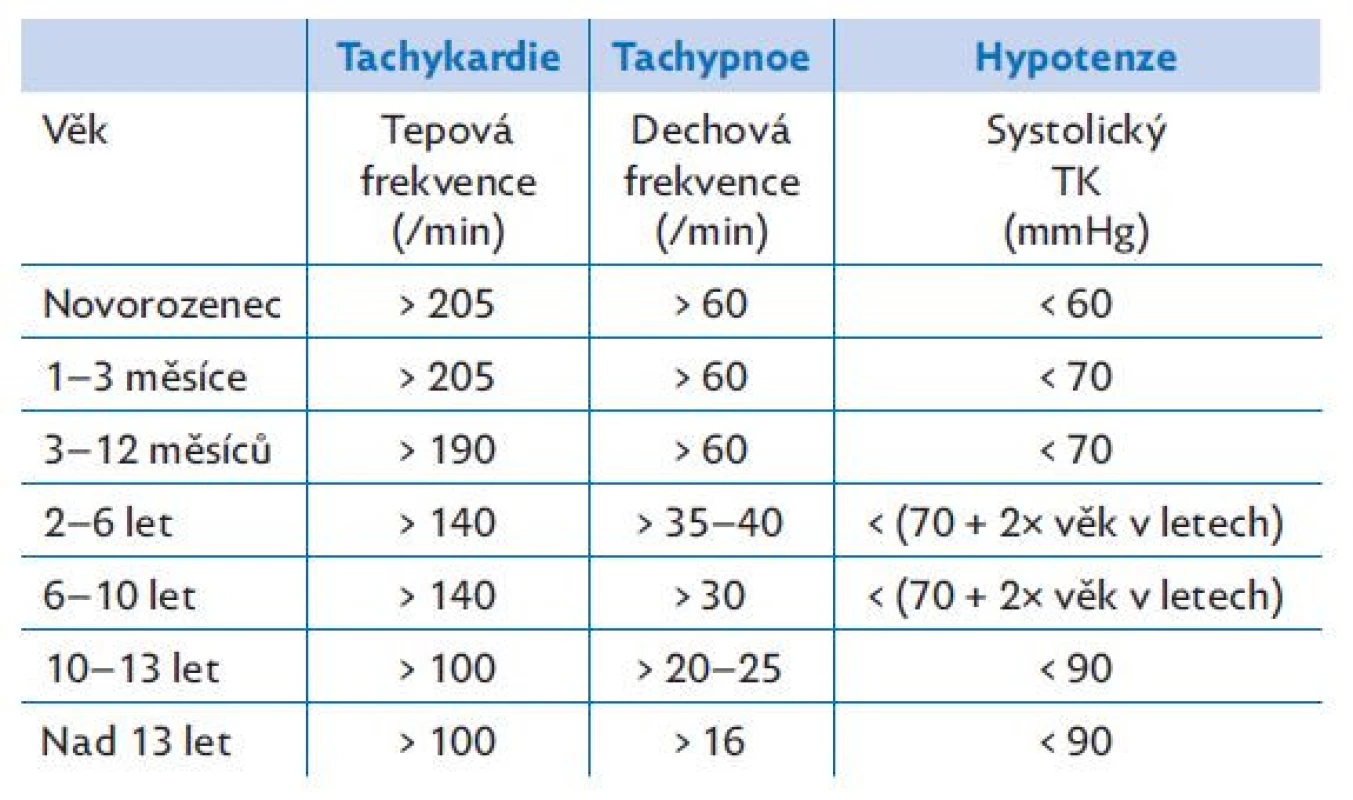
Při pátrání po etiologii onemocnění musíme zaměřit pozornost na jednotlivé orgánové systémy, které jsou infekcí primárně postižené. Nejčastější místa infekce: respirační systém (bronchopneumonie, pneumonie), primární bakteriemie, gastrointestinální trakt (gastroenteritida, kolitida, apendicitida), centrální nervový systém (meningitida, encefalitida), genitourinární systém (pyelonefritida), infekce kůže (celulitida), infekce kostí (osteomyelitida).
Diferenciální diagnostika sepse
Řada stavů může imitovat sepsi. V úvodní fázi často nelze rozhodnout o definitivní diagnóze a musíme zohlednit širokou diferenciální diagnózu. Tabulka 6 uvádí nejčastěji zvažovaná onemocnění v rámci diferenciální diagnostiky.
Table 6. Diferenciální diagnostika sepse a septického šoku 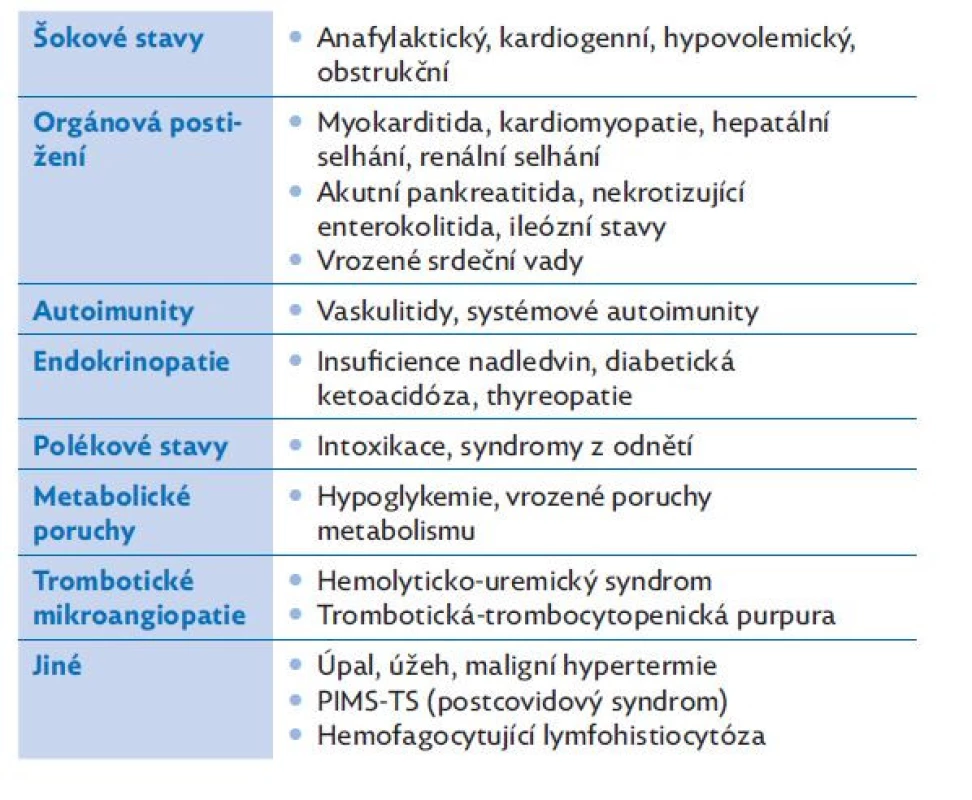
Terapie sepse
Základem úspěšné terapie sepse je časné rozpoznání pacienta, u kterého dochází k rozvoji infekčního stavu spojeného s možným rozvojem orgánové dysfunkce. Opožděné zahájení terapie septického šoku je spojeno s nárůstem morbidity a mortality. Je doporučováno, aby v rámci zdravotnických zařízení byly zavedeny vyhledávací screeningové postupy umožňující časnou identifikaci pacienta, který je v riziku rozvoje orgánové dysfunkce. Současně je doporučeno, aby každé pracoviště vytvořilo a implementovalo lokální terapeutický protokol pacientů se sepsí indukovanou orgánovou dysfunkcí. Uvedené zásady péče se opírají o aktuální platná doporučení z roku 2020.(20,21)
Antibiotická terapie
Časné podání intravenózních antibiotik je nezbytným předpokladem úspěšné terapie sepse (tabulka 7). U pacientů se septickým šokem (hypotenze se známkami tkáňové hypoperfuze) a u rizikových pacientů (neutropenický, imunosuprimovaný) se má terapie zahájit nejpozději do 1 hodiny po příchodu do nemocnice. U pacienta s podezřením na sepsí indukovanou orgánovou dysfunkci bez přítomnosti šoku (hypotenze) je doporučeno zahájit antibiotickou terapii nejpozději do 3 hodin od příchodu do nemocnice. Prodloužení této doby zvyšuje riziko mortality. Před zahájením antibiotické terapie je doporučen odběr biologického materiálu (pokud odběr neoddálí zahájení antibiotické terapie). Volba antibiotika je v úvodu širokospektrální, empirická a zohledňuje věk, zdravotní stav pacienta (chronická onemocnění a kolonizace), suspektní zdroj infekce se zvážením pravděpodobných původců, znalost lokální epidemiologické situace (nozokomiální infekce). Vždy zvažujeme imunologický profil pacienta a přítomnost zavedených invazí (centrální žilní katétr, močový katétr, intubace). Po obdržení výsledků mikrobiologických vyšetření, dle klinické a laboratorní odpovědi na léčbu, upravujeme cíleně antibiotickou terapii. Přehodnocení a úpravu antibiotické terapie (ev. ukončení v případě vyloučení sepse) děláme po 48–72 h. U imunokompromitovaného pacienta volíme častěji kombinaci antibiotik, vždy zvažujeme podání antimykotika. V indikovaných případech také zvážíme zahájení virostatické terapie. V případě přítomnosti zavedeného centrálního žilního katétru (podezření na katétrovou infekci) upřednostníme extrakci tohoto vstupu, pokud to dovoluje stav pacienta. Po základní stabilizaci se snažíme o kontrolu zdroje infekce (drenáž abscesu, chirurgické odstranění infikované tkáně). Dle možností monitorujeme hladiny antibiotik, vždy zvažujeme možnou toxicitu (především u hepatálního a renálního poškození). Není stanovena arbitrární délka podávání antibiotik. Ta je individuálně upravena podle vyvolávajícího původce, jeho citlivosti, zdroje infekce, kontroly zdroje, klinického stavu a laboratorní odezvy na léčbu. Důležitá je domluva s mikrobiologem, infektologem a klinickým farmakologem. Obecně platí, že denně přehodnocujeme indikaci každého podávaného léku (toto se netýká jen antibiotické terapie). Dlouhodobá antibiotická terapie nebo neindikované podávání antibiotik mohou vést ke vzniku multirezistentních bakteriálních kmenů, indukovat dysmikrobii, klostridiovou infekci nebo zvyšovat riziko toxicity antibiotické terapie.(22)
Table 7. Empirická antibiotická terapie. Nejčastěji užívané antibiotické kombinace. 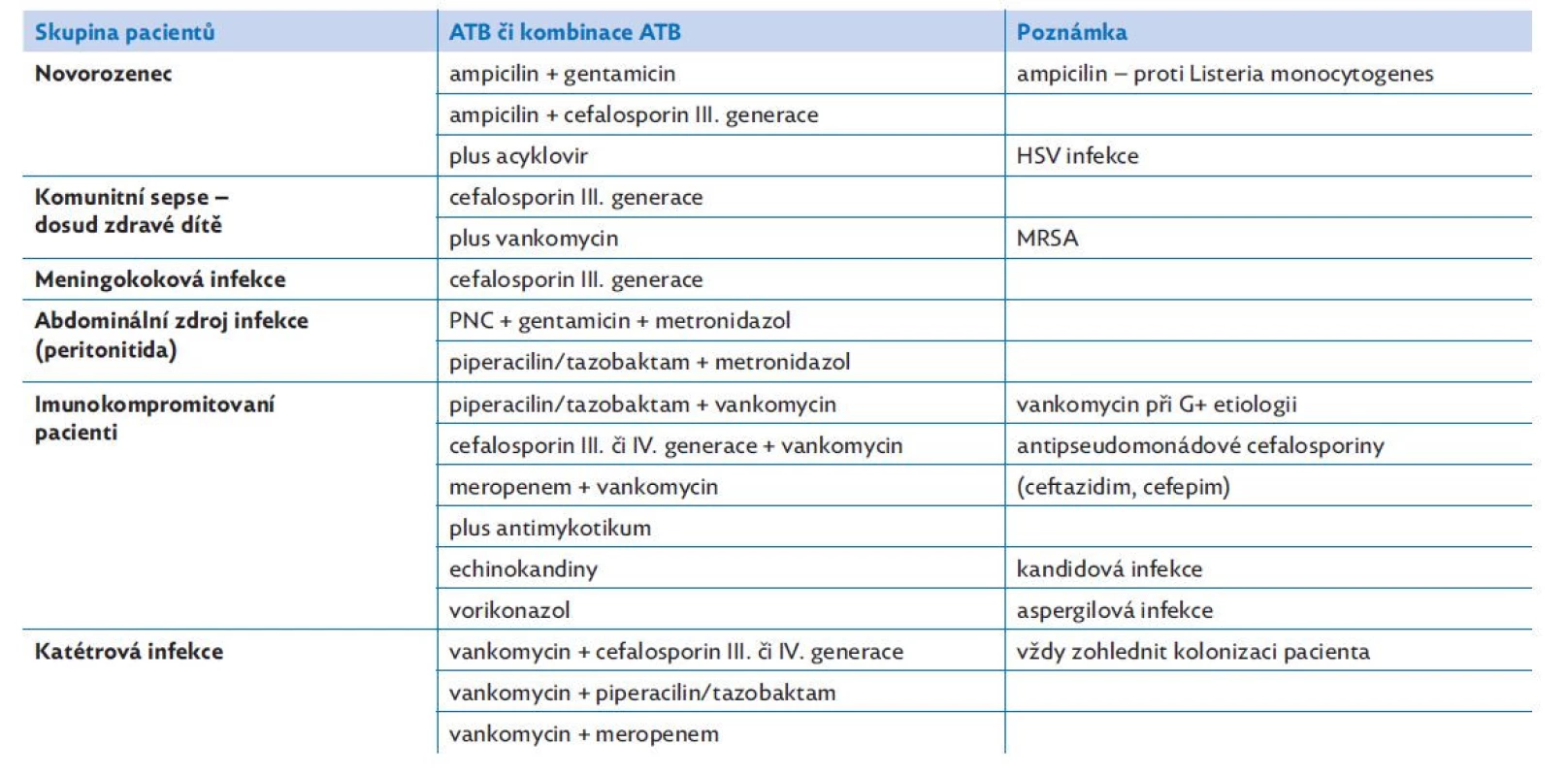
Zavedení žilního vstupu a podání tekutin
Zavedení žilního vstupu patří do úvodu managementu. U pacienta v septickém šoku je doporučeno zavedení 2 periferních žilních kanyl. Pokud se zavedení periferního žilního vstupu nedaří v úvodních 5 minutách, je doporučeno zvážit zavedení intraoseálního vstupu. Podání tekutin je u pacienta v septickém šoku spojeno se snížením mortality. Stran typu roztoku je aktuálně doporučeno preferenční podávání balancovaných krystaloidů (například Plasmalyte, Ringer laktát) před plným fyziologickým roztokem. Data u dospělých a zatím ne zcela jasná evidence u dětí vychází z předpokladu, že podání vyšších objemů plného fyziologického roztoku je spojeno s vyšším rizikem rozvoje akutního renálního poškození (AKI), s rozvojem hyperchloremické metabolické acidózy a s mírně vyšší mortalitou.(21) Objem podaných tekutin v první hodině léčby se liší dle stavu pacienta a podmínek zdravotnické péče. V našich podmínkách (dosažitelnost anesteziologa, možnosti umělé plicní ventilace a základního hemodynamického monitoringu) se můžeme setkat s následujícími scénáři.
1. Pacient v septickém šoku (hypotenzní pacient s klinickými známkami hypoperfuze = studená periferie + slabě hmatné periferní pulzace s tachykardií + prodloužení kapilárního návratu nad 3 s nebo pacient s teplou periferií a rychlým kapilárním návratem pod 1 s) – podáváme bolus 10–20 ml/kg krystaloidního roztoku až do objemu 60 ml/kg během první hodiny. Dávka tekutin je kalkulována na ideální tělesnou hmotnost nebo na 50. percentil váhy k věku. Po každém bolusu (podáván přetlakově v průběhu 10 minut) hodnotíme odpověď pacienta. Pokud je reakce pacienta příznivá (viz dále), je vhodné v podávání tekutin pokračovat. Po každém bolusu současně vylučujeme známky přetížení tekutinami (nárůst hepatomegalie, zhoršení respiračního distresu, nově zachycené chrůpky na bazích plic, sonografické či rtg známky tekutiny v plicní tkáni, sonografické hodnocení náplně dolní duté žíly). V případě známek tekutinového přetížení snížíme množství tekutin (bolusy 5–10 ml/kg během 15 minut s pečlivým monitoringem přetížení tekutin – oběhové a respirační selhání) a zvážíme podání katecholaminů při přetrvávajících známkách šoku (viz dále).
2. Pacient bez hypotenze se známkami tkáňové hypoperfuze (zvýšený či narůstající laktát, prodloužený kapilární návrat, mramorování periferie, oligurie, změna vědomí) – podávání objemů tekutin – bolusy 10–20 ml/kg, podání katecholaminů ke zvýšení srdečního výdeje (adrenalin v nízké dávce 0,03–0,05 μg/kg/min).
3. Pacient bez hypotenze a bez známek orgánové dysfunkce a tkáňové hypoperfuze – podáváme udržovací infuzi. Pokud pacient začne vykazovat známky šoku, zahájíme tekutinovou terapii dle scénáře 1.
Hodnocení reakce pacienta na bolus tekutin:
• kvalita centrálních a periferních pulzací (periferní pulzace se zlepšují, vyrovnávají se centrálním);
• perfuze kůže (teplá periferie, kapilární návrat pod 2 s);
• zlepšení stavu vědomí;
• objevuje se diuréza nad 1 ml/kg/h;
• pokles tachykardie (ovlivněna řadou dalších vlivů jako stres, bolesti, anemie, horečka a další);
• zvýšení/normalizace krevního tlaku.
Tekutiny jsou z pohledu medicíny lékem a jejich použití musí být uvážlivé. Jejich podání je základním terapeutickým opatřením zlepšujícím přežití. Přetížení pacienta tekutinami je ale spojeno s nárůstem morbidity a mortality. Při léčbě septického šoku se od prvního dne zamýšlíme nad tím, jak podávané tekutiny z pacienta následně mobilizovat. Z hlediska použitého druhu tekutin se nedoporučuje podávání koloidů (hydroxyethylškroby, želatina) – kromě albuminu v indikovaných případech (hypoalbuminemie pod 25–30 g/l).
Hemodynamická podpora pacienta se sepsí
Vysoké procento pacientů se sepsí má oběhové postižení, které je determinantou rozvoje šokového stavu. Z hlediska poruchy oběhu se setkáváme s poruchou systémové vaskulární rezistence ve smyslu vazodilatace a hyperkinetickou cirkulací s vysokým srdečním výdejem. U části pacientů se setkáváme naopak s vysokou periferní vaskulární rezistencí provázenou v některých případech selháním oběhu ve smyslu nízkého srdečního výdeje (systolická, diastolická nebo kombinovaná dysfunkce levé komory). První výše uvedený hemodynamický profil je klinicky označován jako teplý šok (pacient má dobře prokrvenou teplou periferii, rychlý kapilární návrat pod 1 s a dobře hmatné pulzace na periferii, vysoký rozdíl mezi systolickým a diastolickým tlakem). Druhý hemodynamický profil je označován jako studený šok (pacient s chladnou až mramorovanou periferií, špatně hmatnými pulzacemi, pomalým kapilárním návratem prodlouženým nad 3 s). Oba hemodynamické profily vedou k rozvoji hypotenze. Prostým klinickým vyšetřením nelze ale spolehlivě rozlišit, zda je pacient v teplém, či studeném šoku). Rozlišení je možné pouze použitím pokročilého monitoringu (echo + arteriální katétr, transpulmonální diluční metody, plicnicový katétr). Situace je navíc komplikována tím, že výše uvedená oběhová postižení se mohou v průběhu vývoje sepse kombinovat (typicky hyperdynamické oběhové postižení přechází v postižení hypodynamické, možný je ale i opačný scénář).(23)
Při hypotenzi pacienta je zahájena resuscitace oběhu podáním bolusů tekutin (viz výše). Pokud pacient nereaguje pozitivně na podání tekutin v objemu 40–60 ml/kg (viz výše) nebo vykazuje známky přetížení tekutinami, měli bychom přistoupit k podání katecholaminů. Aktuální doporučení volí jako katecholaminy první volby adrenalin nebo noradrenalin. Nepanuje konsenzus v preferenci jednoho či druhého katecholaminu. V této fázi léčby (pacient se nachází na emergency, standardním oddělení nebo je přijímán na oddělení intenzivní péče) je možno podat katecholamin do periferního či intraoseálního vstupu. Při aplikaci do periferie se doporučuje přidat katecholamin k infuzi krystaloidu. Dávka adrenalinu by měla začínat na 0,05 μg/ kg/min. Dle hemodynamické odpovědi můžeme postupně dávku upravovat/navyšovat. V dávce do 0,1–0,3 μg/ kg/min je efekt adrenalinu převážně inotropní, chronotropní a vazodilatační (může docházet ke snížení tlaku při narůstajícím srdečním výdeji při vazodilataci arteriol ve svalech). S navyšující se dávkou se akcentuje vedle inotropního a chronotropního efekt vazokonstrikční. Podání adrenalinu, jako katecholaminu první volby, by mělo být dle některých autorů zváženo v případě dokumentovaného nízkého srdečního výdeje při levostranném selhání. Úvodní dávka noradrenalinu je 0,05 μg/kg/min, dle efektu má být postupně upravována/navyšována. Další strategie hemodynamického managementu přesahuje zaměření a rozsah tohoto textu. Jakmile to stav pacienta a podmínky dovolí, je při další potřebě katecholaminů indikováno zavedení centrálního žilního katétru. Pacient je v této fázi onemocnění povinně referován na oddělení intenzivní péče do rukou anesteziologa nebo intenzivisty.
Aktuálně není dostatečná evidence stran cílových hodnot krevního tlaku při léčbě septického šoku. Autoři stávajících doporučení udávají hodnotu mezi 5. a 50. percentilem středního arteriálního tlaku (MAP) pro daný věk. Z pohledu fyziologie bychom srdeční výdej a krevní tlak měli přizpůsobit stavu pacienta a zajistit dostatečnou perfuzi orgánů a dodávku kyslíku do tkání.
5. percentil MAP pro daný věk =
(40 + 1,5x věk) mmHg
50. percentil MAP pro daný věk =
(55 + 1,5xvěk) mmHg
Kortikosteroidy
Podání kortikosteroidu je rezervováno pro případ, že má pacient dokumentovanou či předpokládanou insuficienci nadledvin a je léčen pro septický šok (panhypopituitarismus, kongenitální adrenální hyperplazie, anamnéza delší terapie systémovými steroidy). Dále dle aktuálně platných doporučení má být podání steroidu zváženo v případě „katecholamin rezistentního šoku“, tedy v případě přetrvávajícího šokového stavu i při podávání katecholaminů. Dávka hydrokortisonu je 2–4 mg/kg/den v kontinuální infuzi nebo bolusově ve 4 ekvipotentních dávkách.
Oxygenoterapie
Každý pacient s obrazem septického šoku má být léčen oxygenoterapií. V úvodu léčby podáváme kyslík nostrilami nebo polomaskou, eventuálně vysokoprůtokovou oxygenoterapií nostrilami (HFNO). V případě progrese respiračního selhání zvážíme aplikaci neinvazivní umělé plicní ventilace. Pokud dochází k progresi respiračního selhání s hypoxemií/hyperkapnií, selhává pokus o neinvazivní umělou plicní ventilaci nebo je přítomen perzistující šokový stav, pacient by měl být časně indikován k intubaci a invazivní umělé plicní ventilaci.
Korekce vnitřního prostředí
U pacientů se septickým šokem můžeme předpokládat jakýkoliv rozvrat vnitřního prostředí. Zvláštní pozornost věnujeme glykemii a kalcemii. Hypoglykemii korigujeme bolusovým a následným kontinuálním podáváním glukózy (bolus 0,2–0,4 g/kg + kontinuální podání glukózy v dávce 4–6 mg/ kg/min). Její prevenci provádíme přídavkem glukózy k infuzi balancovaného krystaloidu. U některých pacientů je šokový stav provázen hyperglykemií, pak je vhodné terapeuticky cílit hladinu glykemie na 7–10 mmol/l (snížení přívodu glukózy, aplikace inzulinu).
Často pozorovanou patologií je hypokalcemie. V případě poklesu hladiny ionizovaného kalcia (pod 1 mmol/l) či při klinických známkách hypokalcemie podáváme substituci calcium glukonátem nebo calcium chlorátem. Pravidelně provádíme kontrolu vnitřního prostředí a biochemické vyšetření orgánových funkcí.
Podpora/náhrada selhávajících orgánových funkcí
Další progrese šokového stavu může být spojena s rozvojem multiorgánového selhání a potřebou náhrady orgánových funkcí (další podávání vazoaktivních látek, umělá plicní ventilace, mimotělní očišťovací metoda – při akutním renálním postižení, přetížení tekutinami či rozvratu vnitřního prostředí, ECMO – extrakorporální membránová oxygenace). Indikace těchto metod přesahuje zaměření tohoto textu.
Shrnutí postupu terapie pacienta se sepsí / septickým šokem
1. Identifikace pacienta se suspektní sepsí / septickým šokem.
2. Aplikace kyslíku při SpO2 pod 95 % nebo při známkách šoku/hypoperfuze.
3. Zavedení žilního nebo intraoseálního (centrálního žilního) vstupu.
4. Odběr hemokultury. Odběr materiálu k bakteriologickému, virologickému a mykologickému vyšetření. Odběr materiálu k laboratornímu vyšetření včetně laktátu (tabulka 8).
5. Zahájení terapie širokospektrými antibiotiky / kombinací antibiotik.
6. Aplikace tekutiny – balancovaného krystaloidu. Bolusy tekutin u hypotenze nebo hypoperfuze tkání. Podání udržovací tekutinové infuze u absence hypotenze. a. Hodnocení odpovědi pacienta na tekutinovou terapii, ev. opakování bolusů tekutin.
7. Zahájení podávání vazoaktivních látek při nedostatečné odpovědi na podání tekutin (po podání 40–60 ml/kg tekutin).
a) A plikace adrenalinu nebo noradrenalinu.
b) Hodnocení klinické odpovědi na katecholaminovou terapii (ev. úprava dávky katecholaminu či změna farmakologické oběhové podpory).
c) Hemodynamický monitoring.
d) Zvážení podání hydrokortisonu při katecholamin rezistentním šoku.
e) Monitorace laktatemie.
8. Kontrola zdroje infekce, korekce vnitřního prostředí (pozor na hypoglykemii, hypokalcemii).
9. Podpora orgánových funkcí (umělá plicní ventilace, náhrada funkce ledvin, ECMO).
10. Nutriční podpora.
Table 8. Vstupní laboratorní vyšetření pacienta se sepsí a septickým šokem 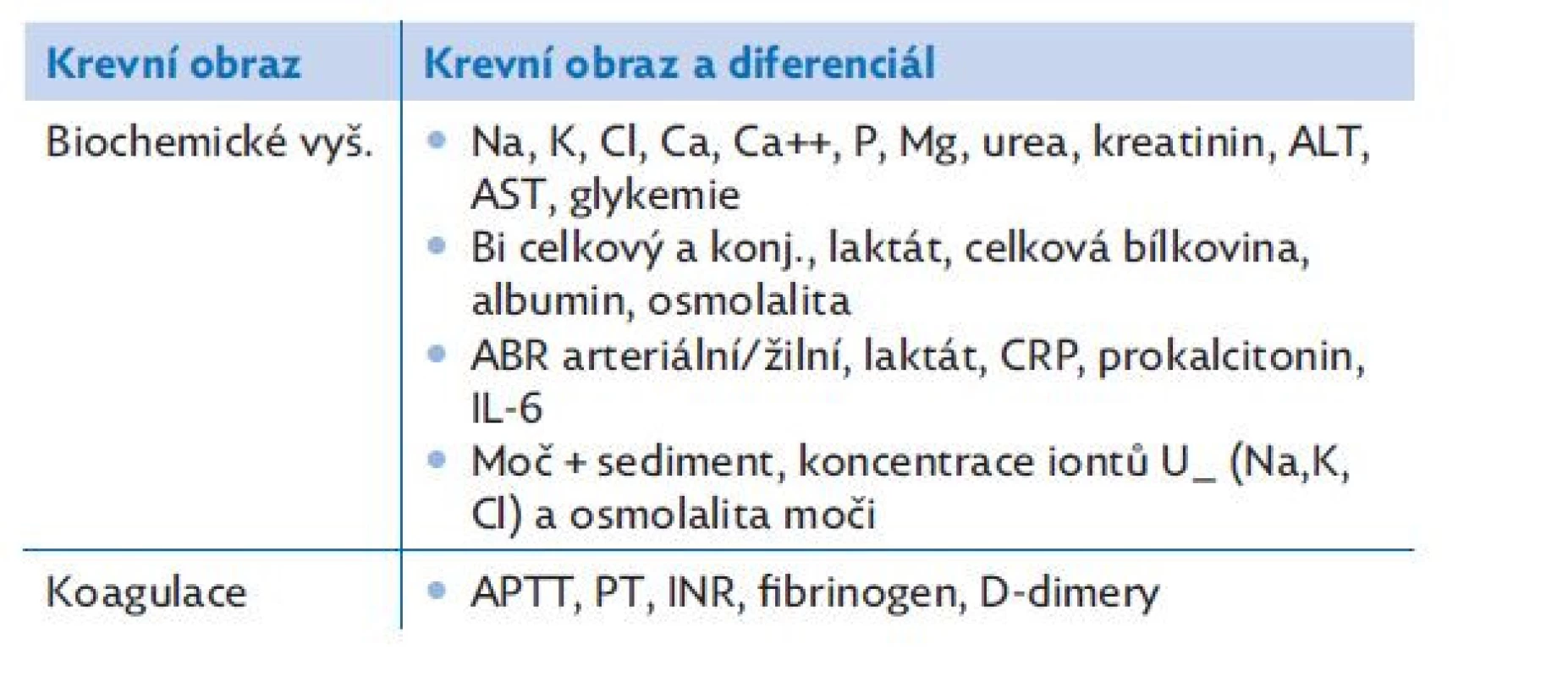
Závěr
I přes značné pokroky v medicíně jsou sepse a septický šok provázeny značnou morbiditou a mortalitou. Stran výskytu, morbidity a mortality jsou více postiženy země s nízkou socioekonomickou úrovní (Afrika a jihovýchodní Asie), tzv. nízkým socioekonomickým indexem.(24) V zemích s vysokým socioekonomickým indexem je septický šok provázen zhruba 6% mortalitou u dosud zdravých dětí. U chronicky nemocných pacientů roste mortalita na úroveň kolem 20 %.(16,17) Sepse je provázena řadou komplikací. Kromě akutních komplikací (např. DIC, multiorgánové selhání – AKI, hepatální selhání, ARDS, ischemické postižení končetin) je více než 30 % pacientů postiženo dlouhodobými následky a po přežití septického šoku se nedostávají ve fyzické, mentální nebo orgánové výkonnosti na premorbidní úroveň.(25) Musíme zdůraznit zásady prevence, mezi které patří imunizace proti některým z patogenů. Velmi důležité je dodržování správné hygieny, která má zásadní vliv na snížení výskytu katétrových infekcí u hospitalizovaných pacientů. Úspěšná terapie sepse je založena na včasném rozpoznání patologického stavu a především včasném podání tekutin a antibiotické terapie. Zavedení protokolizovaných postupů vede k časnější identifikaci těchto pacientů a snížení morbidity a mortality. Mimo aktuálně platná doporučení lze čerpat informace z přehledových článků, které byly na toto téma recentně publikovány.(7,19–21,26) Aktuálně dostupná data v rámci publikovaných doporučení jsou z velké části založena na nedostatečné úrovni důkazů a v této oblasti je potřeba rozsáhlých prospektivních studií.
Korespondenční adresa:
MUDr. Jiří Fremuth, Ph.D.
Dětská klinika LF a FN Plzeň
Alej Svobody 80
323 00 Plzeň
Sources
1. Goldstein B, Giroir B, Randolph A, et al. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005; 6(1): 2–8.
2. Schlapbach LJ, Javouhey E, Jansen NJG. Paediatric sepsis: old wine in new bottles? Intensive Care Med 2017; 43(11): 1686–1689.
3. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315(8): 801–10.
4. Menon K, Schlapbach LJ, Akech S, et al. Pediatric sepsis definition-a systematic review protocol by the Pediatric Sepsis Definition Taskforce. Crit Care Explor 2020; 2(6): e0123.
5. Schlapbach LJ, Weiss SL, Bembea MM, et al. Scoring systems for organ dysfunction and multiple organ dysfunction: The PODIUM Consensus Conference. Pediatrics 2022; 149(1 Suppl 1): S23–S31.
6. Sehgal M, Ladd HJ, Totapally B. Trends in epidemiology and microbiology of severe sepsis and septic shock in children. Hosp Pediatr 2020; 10(12): 1021 – 1030.
7. Cruz AT , Lane RD, Balamuth F, et al. Updates on pediatric sepsis. J Am Coll Emerg Physicians Open 2020; 1(5): 981–993.
8. Jarczak D, Kluge S, Nierhaus A. Sepsis-pathophysiology and therapeutic concepts. Front Med (Lausanne) 2021; 8:
9. Pierrakos C, Velissaris D, Bisdorff M, et al. Biomarkers of sepsis: time for a reappraisal. Crit Care 2020; 24(1): 287.
10. Oikonomakou M, Gkentzi D, Gogos C, et al. Biomarkers in pediatric sepsis: a review of recent literature. Biomark Med 2020; 14(10): 895–917.
11. Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med 2019; 45(1): 82–85.
12. Marikar D, Babu P, Fine-Goulden M. How to interpret lactate. Arch Dis Child Educ Pract Ed 2021; 106(3): 167–171.
13. Becker KL, Nylén ES, White JC, et al. Clinical review 167: Procalcitonin and the calcitonin gene family of peptides in inflammation, infection, and sepsis: a journey from calcitonin back to its precursors. J Clin Endocrinol Metab 2004; 89(4): 1512–25.
14. Downes KJ, Fitzgerald JC, Weiss SL. Utility of procalcitonin as a biomarker for sepsis in children. J Clin Microbiol 2020; 58(7): e01851–19.
15. Simon L, Saint-Louis P, Amre DK, et al. Procalcitonin and C-reactive protein as markers of bacterial infection in critically ill children at onset of systemic inflammatory response syndrome. Pediatr Crit Care Med 2008; 9(4): 407–13.
16. Weiss SL, Fitzgerald JC, Pappachan J, et al. Global epidemiology of pediatric severe sepsis: the sepsis prevalence, outcomes, and therapies study. Am J Respir Crit Care Med 2015; 191(10): 1147–57.
17. Boeddha NP, Schlapbach LJ, Driessen GJ, et al. Mortality and morbidity in community-acquired sepsis in European pediatric intensive care units: a prospective cohort study from the European Childhood Life-threatening Infectious Disease Study (EUCLIDS). Crit Care 2018; 22(1): 143.
18. Miller JM, Binnicker MJ, Campbell S, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2018 update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis 2018; 67(6): e1–e94.
19. Davis AL, Carcillo JA, Aneja RK, et al. American College of Critical Care Medicine clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock. Crit Care Med 2017; 45(6): 1061 – 1093.
20. Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med 2020; 46(Suppl 1): 10 – 67.
21. Weiss SL, Peters MJ, Alhazzani W, et al. Executive summary: surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med 2020; 46(Suppl 1): 1–9.
22. Bruns N, Dohna-Schwake C. Antibiotics in critically ill children-a narrative review on different aspects of a rational approach. Pediatr Res 2022; 91(2): 440–446.
23. Deep A, Goonasekera CD, Wang Y, et al. Evolution of haemodynamics and outcome of fluid-refractory septic shock in children. Intensive Care Med 2013; 39(9): 1602–9.
24. Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet 2020; 395(10219): 200–211.
25. Zimmerman JJ, Banks R, Berg RA, et al. Trajectory of mortality and health - -related quality of life morbidity following community-acquired pediatric septic shock. Crit Care Med 2020; 48(3): 329–337.
26. Peshimam N, Nadel S. Sepsis in children: state-of-the-art treatment. Ther Adv Infect Dis 2021; 8 : 20499361211055332.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 4-
All articles in this issue
- Co jsme psali
- Purkyňova cena za rok 2022 byla udělena prof. MUDr. Otto Hrodkovi, DrSc.
- Editorial
- Gregor Mendel celebrates 200 years: from the gardens of the Augustinian monastery in Brno to the causal treatment of monogenic diseases
- Dystrophinopathies
- Gregor Mendel and regulation of child’s growth: genes, molecules, and paediatric clinical routine
- DYRK1A-related intellectual disability syndrome
- Fabry disease in childhood – overview and a case report
- The clinical phenotype and genetic diagnosis of a rare cutis laxa syndrome in a newborn with multiple anomalies
- Patient with Williams-Beuren syndrome in paediatrician’s office
- Differential diagnosis of microscopic hematuria
- Hyperthermia, its causes and risks from the pathophysiologist’s perspective
- Sepsis in children
- Za MUDr. Janem Škovránkem, CSc.
- Pediatrická poezie
- Ze sbírky moderního českého a slovenského umění
- Genetic diversity of monogenic diabetes in Ukraine
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sepsis in children
- Differential diagnosis of microscopic hematuria
- Hyperthermia, its causes and risks from the pathophysiologist’s perspective
- Dystrophinopathies
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

