-
Medical journals
- Career
Resuscitace a podpora poporodní adaptace novorozence 2021
Authors: K. Liška
Authors‘ workplace: Neonatologické oddělení, Gynekologicko-porodnická klinika, 1. LF UK a Všeobecná fakultní nemocnice, Praha
Published in: Čes-slov Pediat 2021; 76 (7): 400-417.
Category: Review
Overview
V článku je podán přehled resuscitace a podpory poporodní adaptace novorozence se zaměřením na hlavní změny za poslední 10leté období. Vychází z nových doporučení Mezinárodního styčného výboru pro resuscitaci (ILCOR), Evropské rady pro resuscitaci (ERC) a Americké kardiologické asociace (AHA).
Doporučení jsou určena pro resuscitaci novorozence po porodu (přechod z intrauterinního do extrauterinního prostředí), lze je však použít i pro novorozence, kteří vyžadují resuscitaci v prvních dnech/týdnech života.
Klíčová slova:
teplota – podpora poporodní adaptace – resuscitace – ventilace – kyslík
Článek je v souladu s doporučením České neonatologické společnosti ČLS JEP.
ÚVOD – SPECIFIKA RESUSCITACE NOVOROZENCŮ [1–4]
Resuscitace novorozence po porodu se vyznačuje některými odlišnostmi starších dětí nebo dospělých, které jsou dány adaptací z nitroděložního prostředí.
Přechod z intrauterinního do extrauterinního života charakterizuje řada fyziologických, rychle na sebe navazujících událostí, které zajišťují úspěšný přechod z placentární k plicní výměně plynů. Zcela zásadní roli při přestavbě oběhu a dýchání hraje zahájení spontánní ventilace. Plíce plodu vyplněné tekutinou se s prvními dechy provzdušňují, dochází k resorbci plicní tekutiny a poklesu plicní cévní rezistence. Důležitou úlohu při vstřebávání plicní tekutiny hrají amilorid-senzitivní sodíkové kanály v epitelových buňkách alveolů (ENaC) a stresové hormony. Rozepjetí plic, ustavení funkční reziduální kapacity (FRC) a vzestup parciálního tlaku kyslíku v alveolech způsobí pokles plicní cévní rezistence s následným zvýšením průtoku plícemi. To umožňuje po podvazu pupečníku dostatečné plnění levé komory a dostatečný srdeční výdej zajišťující vitální perfuzi koronárními arteriemi a mozkem. Po odstranění nízkorezistentní placentární cirkulace stoupá periferní vaskulární rezistence a systémový krevní tlak, původně pravo-levé zkraty přes foramen ovale a otevřenou tepennou dučej se obracejí, fetální spojky se uzavírají. Tyto fyziologické změny bychom měli respektovat při podpoře poporodní adaptace a resuscitaci novorozenců. Provzdušnění tekutinou vyplněných plic vyžaduje vyšší úvodní inflační tlaky, než jaké jsou obvyklé u kojenců, důsledkem poruchy aerace plic jsou intrapulmonální pravolevé zkraty a hypoxemie. Opožděné vstřebávání plicní tekutiny může vést k tranzitorní tachypnoi donošených novorozenců. Aspirace mekoniem zkalené plodové vody může způsobit obstrukci dýchacích cest, respirační insuficienci a plicní hypertenzi.
Specifické postupy vyžaduje stabilizace a resuscitace nedonošených novorozenců, zejména novorozenců s velmi nízkou porodní hmotností pod 1500 g a extrémně nezralých rozených před 28. týdnem těhotenství (tt). Nedonošené děti mají nezralé plíce, nedostatek surfaktantu, sníženou funkci ENaC, pomalejší vstřebávání plicní tekutiny, hůře se ventilují a plíce jsou snadno zranitelné při tlakově řízené ventilaci. Nezralé mozkové cévy jsou rizikem pro krvácení, tenká kůže a velký povrch těla představují riziko rychlé ztráty tepla. Podání antenatálních steroidů matce ovlivňuje ENaC, urychluje vstřebávání plicní tekutiny, působí na zrání pneumocytů I. a II. typu, uvolnění surfaktantu, snižuje mortalitu a morbiditu nedonošených novorozenců.
Stabilizace nebo resuscitace novorozenců po porodu by měla být šetrná, měla by respektovat a podporovat fyziologické změny při přechodu z intrauterinního do extrauterinního prostředí, vyvarovat bychom se měli zbytečných intervencí.
EVIDENCE – MEDICÍNA POSTAVENÁ NA DŮKAZECH [1–4]
Nová doporučení ILCOR 2020 shrnují nové vědecké poznatky, které se týkají resuscitace novorozence. V posledním roce proběhla revize (Systematic Reviews, Scoping Reviews, Evidence Updates) následujících témat:
anticipace a příprava (predikce nutnosti ventilační podpory na porodním sále (PS), význam vyhodnocení resuscitace;
iniciální vyšetření a intervence (význam udržování normální tělesné teploty během resuscitace, intubace a odsávání u mekoniem zkalené plodové vody);
monitorace vitálních funkcí (význam EKG během neonatální resuscitace);
ventilace a oxygenace (inflační manévr, PEEP, CPAP, T spojka, kyslík u nedonošených a donošených novorozenců);
oběhová podpora (poměr kompresí hrudníku k ventilaci, technika kompresí hrudníku);
léky a tekutiny (adrenalin, volumoexpanze, bikarbonát);
prognostické faktory v průběhu resuscitace (vliv délky trvání resuscitace na outcome);
poresuscitační péče (zahřívání hypotermických novorozenců, řízená hypotermie u HIE, monirorace glykémie).
Je však třeba konstatovat, že většina současných doporučení ILCOR má slabou evidenci. Důvodem je, že chybí dostatečně velké randomizované a kontrolované humánní studie, které se týkají resuscitace novorozence. V platnosti tak zůstávají často historická doporučení z dřívější doby či doporučení na základě širšího konsensu týmu expertů.
PĚHLED HLAVNÍCH ZMĚN V RESUSCITACI NOVOROZENCE V OBDOBÍ 2010–2021 [1–5, 8–15]
Podpora poporodní adaptace
V roce 2015 se poprvé objevuje v názvu ERC doporučení Resuscitace a podpora poporodní adaptace novorozence („Resuscitation and support of transition of babies at birth“). Snaha je rozlišovat resuscitaci a podporu poporodní adaptace novorozence. Jen málo novorozenců potřebuje po porodu resuscitaci s náhradou vitálních funkcí (jen málo novorozenců se rodí primárně těžce asfyktických). Většina novorozenců vyžaduje jen určitou podporu přechodu z intrauterinního do extrauterinního prostředí, nejčastěji stimulaci a podporu dýchání.
Podvaz pupečníku
Pro donošené i nedonošené děti se doporučuje odložit podvaz pupečníku alespoň na 1 minutu po porodu, ideálně po provzdušnění plic. Toto doporučení se týká dobře se adaptujících neasfyktických novorozenců. Zatím nejsou dostatečné informace (důkazy), kdy podvázat pupečník u novorozenců, kteří vyžadují po porodu resuscitaci. Pokud nelze provést oddálený podvaz pupečníku, lze zvážit milking u dětí narozených po 28. tt.
Teplota
Velký důraz je kladen v průběhu resuscitace a celé poporodní adaptace novorozence na kontrolu tělesné teploty. U neasfyktických novorozeců udržujte po porodu teplotu v rozmezí 36,5–37,5 °C. Existuje silná asociace mezi teplotou, mortalitou a morbiditou dětí.
Udržování teploty u nedonošených novorozenců
Krytí polyetylenovou fólií po porodu se doporučuje pro všechny nedonošené děti narozené před 32. tt. V průběhu stabilizace nedonošených novorozenců slouží k udržení tělesné teploty 36,5–37,5 °C soubor opatření: zvýšená teplota na porodním sále, krytí polyetylénovou fólií/obalem, čepička, výhřevné lůžko, ohřáté a zvlhčené plyny.
Hodnocení akce srdeční
U dětí vyžadujících resuscitaci se doporučuje hodnocení akce srdeční (AS) pomocí monitoru EKG. Je rychlejší a přesnější než auskultace či měření AS pulzním oxymetrem.
Mekonium
Novorozence, kteří se rodí v přítomnosti mekoniem zkalené plodové vody, rutinně endotracheálně neodsáváme. U dětí, které se rodí apnoické, hypotonické nebo je spontánní ventilace nedostatečná, je kladen důraz na bezodkladné zahájení umělé plicní ventilace (UPV) maskou během 1. minuty života. Endotracheální odsávání je doporučováno jen při podezření na obstrukci dýchacích cest vazkou smolkou.
Vzduch/kyslík
U donošených novorozenců zahajujeme ventilační podporu vzduchem. Iniciální nastavení koncentrace kyslíku u nedonošených novorozenců: ≥ 32. tt → 21 %, 28.–31. tt→ 21–30 %, < 28. tt → 30 %. Pokud přes adekvátní ventilaci zůstává oxygenace nedostatečná (ideálně měření pulzním oxymetrem), koncentraci kyslíku postupně zvyšujme.
CPAP (kontinuální přetlak v dýchacích cestách)
U spontánně dýchajících nedonošených novorozenců s RDS se doporučuje jako úvodní ventilační podpora CPAP. Zahájit distenzní léčbu je lepší než děti primárně intubovat.
Inflační tlak (PPV)
Iniciální nastavení inflačního tlaku u nedonošených pod 32. tt je 25 cm H2O. Pokud jsou průchodné dýchací cesty a nedochází ke zlepšení oxygenace a úpravě AS, je doporučováno jeho postupné zvyšování [31].
Laryngeální maska
Pokud je ventilace maskou neúspěšná a nedaří se intubace, lze zvážit použití laryngeální masky jako alternativu zajištění dýchacích cest u dětí narozených nad 34. tt, s porodní hmotností (PH) kolem 2000 g (zkušenosti s laryngeální maskou jsou i u dětí do 1500 g) [31].
Zevní srdeční masáž
Během zevní srdeční masáže zvyšujeme kyslík na 100 %, dítě intubujeme [31].
Adrenalin
Pokud po optimalizaci ventilace a zevní srdeční masáži nestoupá AS, aplikovat adrenalin v dávce 10–30 μg/kg i.v. Pokud nedojde k reakci, lze opakovat podání adrenalinu ve stejné dávce každých 3–5 minut [31].
Glukóza
Během prolongované resuscitace aplikovat 2,5 ml/kg 10% glukózy intravenózně (i.v.) ve snaze snížit riziko hypoglykémie [31].
Přehled o hlavních změnách v resuscitaci novorozence v období let 2015 až 2021 přináší tabulka 1.
Table 1. Přehled změn v letech 2010–2021. 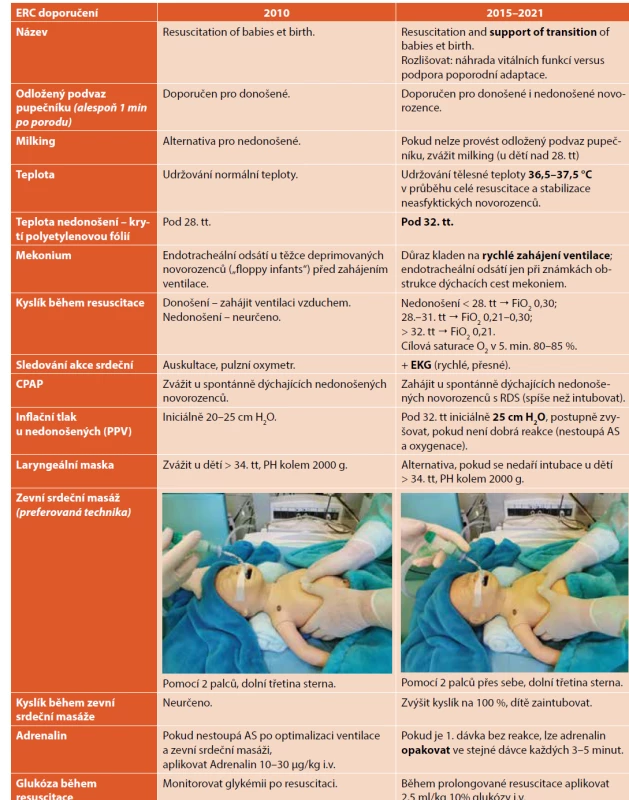
PŘÍPRAVA
Potřeba intervence po porodu [2, 3, 31]
Většina novorozenců se adaptuje na extrauterinní prostředí dobře, část dětí vyžaduje pomoc při stabilizaci nebo resuscitaci. Po porodu dýchá 85 % dětí spontánně bez intervence, 10 % reaguje na osušení, stimulaci a uvolnění dýchacích cest. Cca 5 % novorozenců vyžaduje prodechy (PPV), 0,4–2 % intubaci, méně než 0,3 % zevní srdeční masáž a jen 0,05 % podání adrenalinu.
Potřeba resuscitace donošených novorozenců s porodní hmotností nad 2500 g je relativně malá (kolem 1 %), 8 dětí z 1000 vyžaduje ventilaci maskou, 2 děti z 1000 intubaci.
Speciální přípravu (personální i přístrojovou) vyžaduje stabilizace a resuscitace nedonošených novorozenců. V České republice v posledních letech stoupl počet nezralých novorozenců a pohybuje se v současné době kolem 7–8 %.
Rizikové faktory [31]
Existuje řada antepartálních a intrapartálních rizikových faktorů, které mohou zhoršit poporodní adaptaci novorozence (viz tab. 2). Elektivní císařské řezy před 39. tt jsou asociovány se zhoršením adaptace dýchání v tranzitorní fázi. Nejčastější příčinou závažné akutní porodní hypoxie jsou pupečníkové a placentární komplikace (komprese pupečníku, uzel na pupečníku, odlučování placenty, krvácení). Ačkoliv je často možné podle rizikových faktorů predikovat poruchy poporodní adaptace novorozenců, je třeba mít na paměti, že během každého porodu se mohou vyskytnout nepředvídatelné komplikace, které vyžadující intervenci a resuscitaci novorozence (a to i v případě, že celý průběh těhotenství byl fyziologický).
Table 2. Vybrané rizikové faktory. 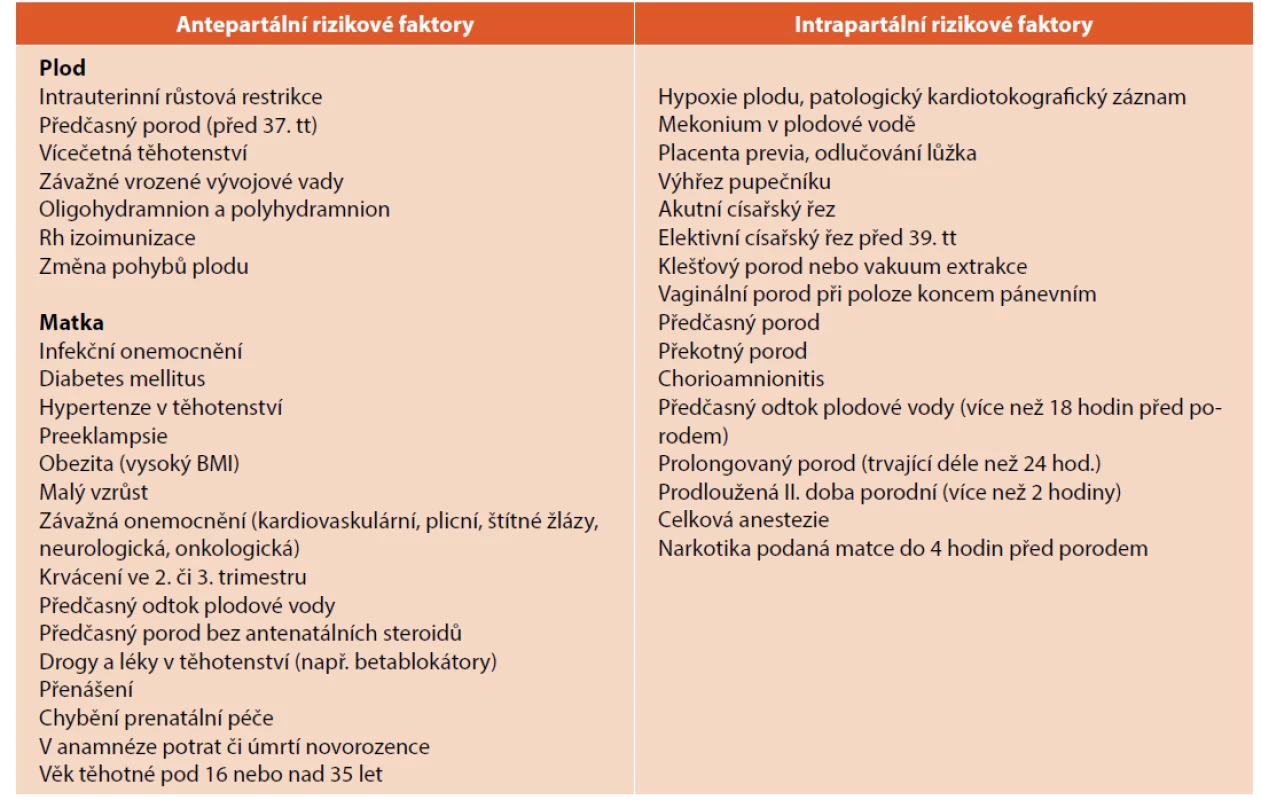
Personální obsazení [9, 10]
Každé dítě po porodu může vyžadovat intervenci.
U každého porodu má být jedna osoba, která je schopna zahájit resuscitaci (PPV maskou).
U každého porodu s vysokým rizikem je nutná přítomnost minimálně jedné osoby, která je kompletně vyškolená v resuscitaci novorozence (včetně intubace).
Po porodu těžce deprimovaného novorozence je nutná přítomnost 2–3 osob kompletně vyškolených v resuscitaci (1. osoba zajišťuje intubaci a ventilaci, 2. osoba monitoruje srdeční ozvy, eventuálně provádí zevní srdeční masáž, 3. osoba připravuje a podává léky).
U vícečetných těhotenství je nutná přítomnost oddělených týmů.
Pokud je čas, je vhodná krátká schůzka před porodem k rozdělení úloh, určení vedoucího resuscitačního týmu, kontrole pomůcek a sestavení plánu stabilizace/ resuscitace.
Přístrojové vybavení
Resuscitaci novorozence lze často předvídat, je proto možné s předstihem připravit pomůcky k resuscitaci, zkontrolovat a nastavit přístroje.
Resuscitace by měla probíhat v zahřáté místnosti, bez průvanu, dobře osvětlené, na resuscitačním lůžku s radiačním zdrojem tepla a možností ventilační podpory.
Potřebné vybavení k resuscitaci novorozence musí být pravidelně kontrolováno a testováno.
Školení/edukace [31]
Má zásadní význam.
Resuscitační tým musí mít současné („up to date“) znalosti a dovednosti týkající se resuscitace novorozence včetně technických (ovládání přístrojů).
Resuscitační tým má být průběžně školen.
Školení by mělo probíhat více jak 1x za rok.
Každé pracoviště má mít protokol resuscitace novorozence a strukturovaný výukový program.
Program má zahrnovat:
pravidelné procvičování a neustálé opakování;
týmovou přípravu/vymezit úlohu vedoucího;
multimodální přístup;
simulaci, procvičování na resuscitačních manekýnách;
zpětnou vazbu z různých zdrojů (videozáznamy z průběhu resuscitace, záznamy z přístrojů…);
objektivní vyhodnocení resuscitace celého týmu („briefing/debriefing“).
Plánované porody doma
U každého porodu doma by měli být 2 zdravotníci, 1 plně vyškolen v resuscitaci novorozence včetně ventilace maskou a zevní srdeční masáže [10, 31]. Většina odborné veřejnosti v ČR plánované porody doma nedoporučuje. I při fyziologickém průběhu těhotenství se může narodit neočekávaně dítě, které vyžaduje resuscitaci. Cca u 30 % novorozenců, kteří vyžadují resuscitaci, nenalezneme v průběhu těhotenství žádný rizikový faktor. Navíc rozsah resuscitace v domácím prostředí je vždy limitován. O všech rizicích porodu doma by měla být rodička plně informována.
ROZDĚLENÍ RESUSCITACE
Vlastní resuscitaci novorozence můžeme rozdělit do 4 částí:
1. Úvodní kroky:
rychlé zhodnocení stavu,
zabezpečení průchodnosti dýchacích cest,
teplo,
taktilní stimulace;
2. Zajištění ventilace a oxygenace:
PPV přes obličejovou masku,
CPAP, intubace;
3. Podpora oběhu:
nepřímá srdeční masáž;
4. Podání léků a tekutin:
adrenalin,
volumexpanze,
bikarbonát,
glukóza.
Prvních 60 sekund po porodu („první zlatá minuta“) je vyhrazena pro dokončení úvodních kroků, opakované hodnocení stavu, zahájení ventilační podpory (pokud je třeba) a zahájení kontinuálního monitorování EKG + pulzní oxymetrie. Iniciální kroky zahrnují udržování normální tělesné teploty, správnou polohu, zajištění průchodnosti dýchacích cest, osušení (u nedonošených pod 32. tt krytí polyetylenovou fólií) a stimulaci k dýchání. Při ventilační podpoře a oxygenoterapii průběžně vyhodnocujeme akci srdeční, dýchání a saturaci kyslíku. Vzestup akce srdeční je nejdůležitější indikátor správně prováděné resuscitace [9]. Algoritmus resuscitace novorozence podle doporučení ERC 2021 [31] je na obrázku 1.
Image 1. Algoritmus resuscitace novorozence podle ERC 2021. 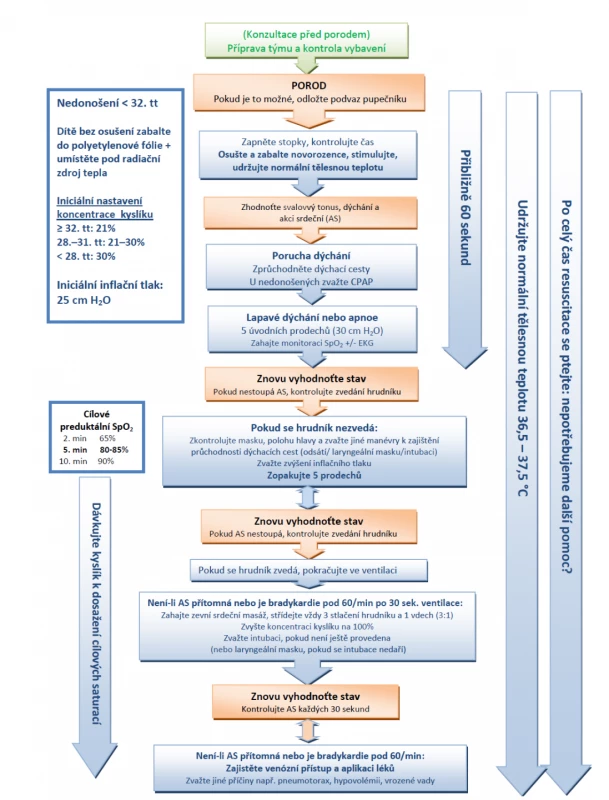
ODLOŽENÝ PODVAZ PUPEČNÍKU (PLACENTÁRNÍ TRANSFUZE)
Odložený podvaz pupečníku alespoň 1 minutu (2–3 minuty) po porodu je doporučován pro dobře se adaptující donošené i nedonošené novorozence, kteří nevyžadují bezprostředně po porodu resuscitaci. Podvaz pupečníku provádíme ideálně až po provzdušnění plic.
U donošených novorozenců může odložený podvaz pupečníku zlepšit poporodní adaptaci. Zvyšuje také zásoby železa a některé hematologické parametry ve 3 až 6 měsících věku, předchází se tak časné i pozdní anemizaci dítěte.
U nedonošených novorozenců placentární transfuze zlepšuje oběhovou a ventilační stabilitu bezprostředně po porodu (včetně vyššího krevního tlaku a hemoglobinu při přijetí). Některé studie prokázaly nižší výskyt intrakraniálního krvácení, periventrikulární leukomalacie, pozdní sepse a nekrotizující enterokolitidy a také menší potřebu transfuzí v následujících týdnech života.
Alternativou pro odložený podvaz pupečníku u nedonošených novorozenců je milking = vytlačení krve z pupečníku do dítěte. Vlastní technika milkingu pupečníku spočívá ve 3–4 expresích pupečníku do těla novorozence s přestávkami cca 2 sekundy, celý výkon trvá cca 20 sekund.
Milking zvažujeme u nedonošených novorozenců narozených nad 28. tt, kde není možný odložený podvaz pupečníku. U těžké prematurity (< 28. tt) je milking spojen se zvýšeným rizikem závažných forem krvácení do CNS 3. a 4. stupně [30].
Pokud novorozenec vyžaduje bezprostředně po porodu resuscitaci, je prioritou zahájení resuscitace po časném podvazu pupečníku. Diskutovanou alternativou je v těchto případech milking pupečníku, vzhledem k nedostatku důkazů o jeho pozitivním účinku nelze zatím tento postup doporučit pro rutinní praxi [8, 9].
Kontraindikace odloženého podvazu pupečníku i milkingu pupečníku shrnuje tabulka 3.
Table 3. Kontraindikace placentární transfuze. 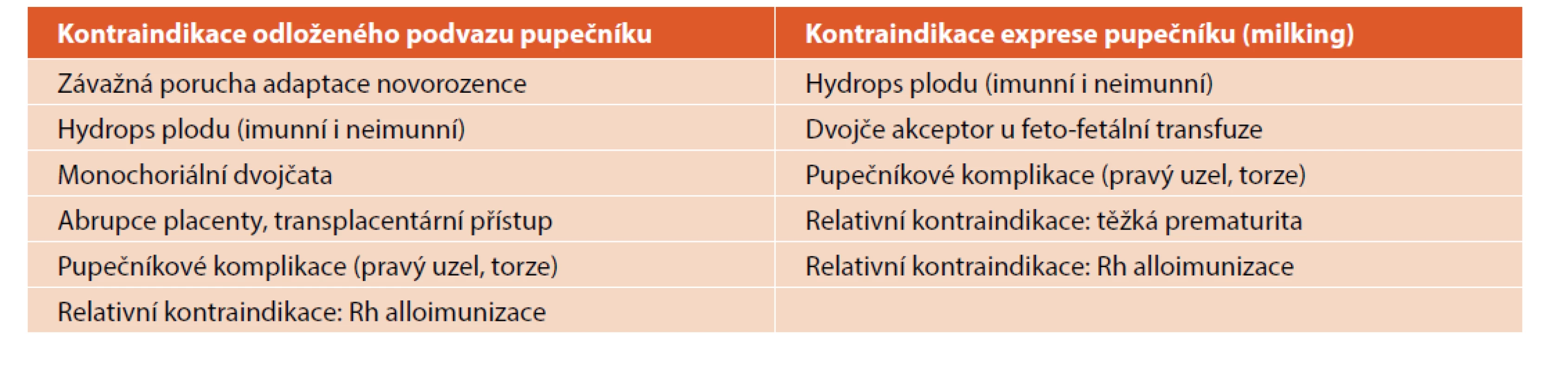
TEPLOTA
Cílem je vyvarovat se chladového stresu, který snižuje parciální tlak kyslíku a zvyšuje metabolickou acidózu. U neasfyktických novorozenců udržujte teplotu 36,5–37,5 °C. Po více než století je známa asociace mezi hypotermií a mortalitou, vstupní teplota u neasfyktických novorozenců je silný prediktor mortality ve všech gestacích. Zvláště zranitelní jsou nedonošení novorozenci. Hypotermie u nich může způsobit vážné komplikace, jako jsou intraventrikulární krvácení, potřeba ventilační podpory, hypoglykemie a pozdní sepse [8, 9].
Prevence ztráty tepla
Chraňte děti před průvanem na porodním sále (PS), okna mají být zavřená, klimatizace správně nastavená.
Teplota na PS má být 23–25 °C.
Po porodu dítě osušte, přikryjte suchým a teplým flanelem. Alternativou je přiložení „skin to skin“ matce.
Novorozence, kteří vyžadují podporu adaptace či resuscitaci, uložte do výhřevného lůžka s radiačním zdrojem tepla.
Tělesná teplota má být během celé resuscitace monitorována, vyhnout bychom se měli hypotermii (T < 36,0 °C) i hypertermii (T > 38,0 °C).
Specifika pro nedonošené
U porodu nedonošených novorozenců ≤ 28. tt má být teplota na PS alespoň 26 °C.
Všechny nedonošené děti narozené před 32. tt kryjeme polyetylenovou fólií/obalem bez předchozího osušení. Kryjeme tělo a hlavičku s výjimkou obličeje, děti umístíme na výhřevné lůžko pod radiační zdroj tepla. Pro nedonošené existují speciální polyetylenové obaly (viz obr. 2).
Image 2. Krytí nedonošených polyetylenovým obalem.
Fig. 2. Cover preterm infants with polyethylene wrap.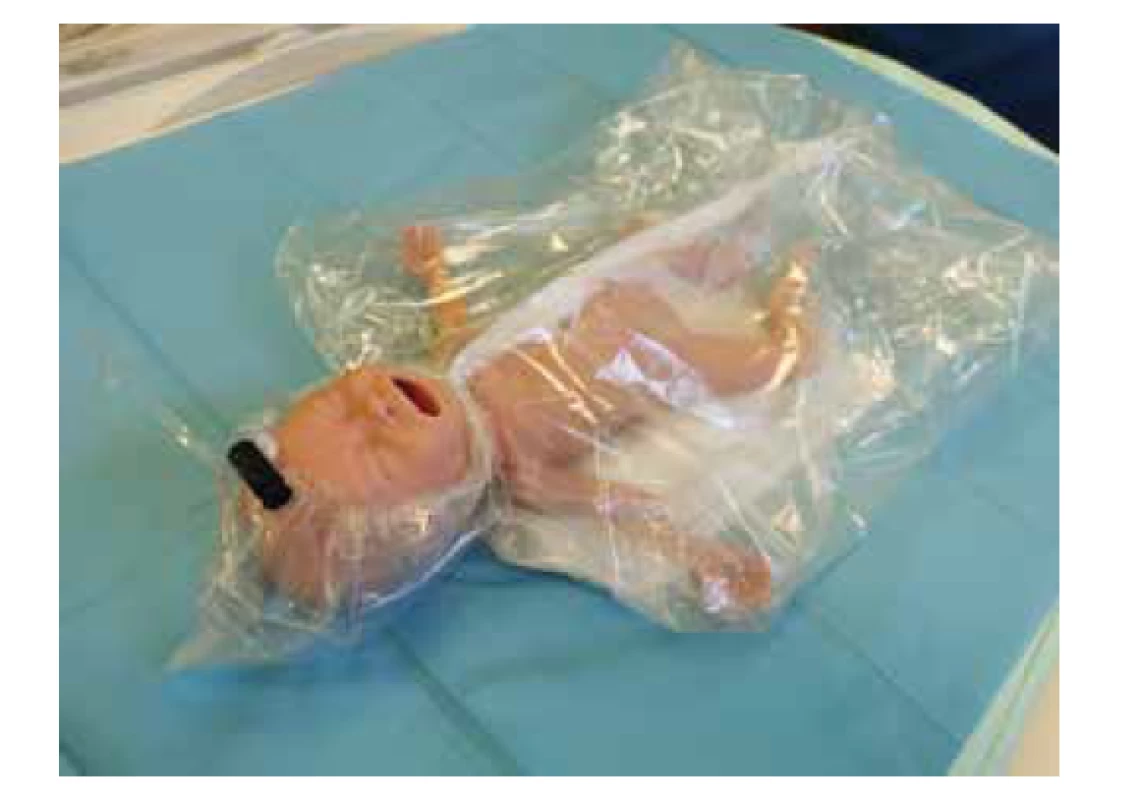
K udržení normální tělesné teploty (36,5–37,5 °C) nedonošených novorozenců narozených před 32. tt je třeba během stabilizace kombinace opatření: polyetylenová fólie, ohřáté a zvlhčené plyny při ventilační podpoře, zvýšená teplota v místnosti, čepička, výhřevná matrace a radiační zdroj tepla.
Zahřívání hypotermických novorozenců
Zahřívání podchlazených novorozenců s teplotou pod 36 °C (např. dovezené děti po extramurálním porodu) se doporučuje cca o 0,5 °C za hodinu. Nejsou známa žádná data, zda rychlejší či pomalejší zahřívání podchlazených novorozenců zlepšuje jejich mortalitu a morbiditu [2].
V průběhu resuscitace bychom se měli vyhnout přehřátí novorozence (hrozí u déletrvající resuscitace pod radiačním zdrojem tepla). Hypertermie (T > 38,0 °C) je spojena se zvýšenou morbiditou a mortalitou. Novorozenci febrilních matek mají vyšší incidenci perinatálních respiračních problémů, časné mortality, křečí a dětské mozkové obrny [2, 8].
ÚVODNÍ VYŠETŘENÍ
Skóre podle Apgarové zahrnuje vyhodnocení dýchání, akce srdeční, barvy, svalového tonu a reflexů. K potřebě zahájení resuscitace pomáhají zejména některé komponenty Apgar skóre (dýchání, barva, svalový tonus a hlavně srdeční frekvence).
Dýchání
Hodnotíme spontánní dechovou aktivitu (dýchá/nedýchá), dále pak dyspnoi, frekvenci dýchání, symetrické dýchání, gasping, grunting.
Akce srdeční
Přítomnost akce srdeční (AS) je nejdůležitější komponentou pro hodnocení stavu dítěte bezprostředně po porodu, v dalším průběhu pak vypovídá o úspěšnosti jednotlivých intervencí během resuscitace. AS hodnotíme těsně po porodu auskultací (fonendoskopem). Nově je používáno třísvodové EKG, je rychlejší a přesnější při hodnocení srdeční frekvence než pulzní oxymetrie. Nenahrazuje však pulzní oxymetr, který slouží především ke sledování oxygenace dítěte v průběhu resuscitace. Monitorovat EKG se doporučuje zejména u těžce nezralých novorozenců, těžké asfyxie a déletrvající resuscitace (viz obr. 3).
Image 3. Správné umístění EKG elektrod a senzoru pulzního oxymetru preduktálně na pravou horní končetinu.
Fig. 3. Proper ECG electrodes placement and pulse oximeter sensor preductal on the right upper limb.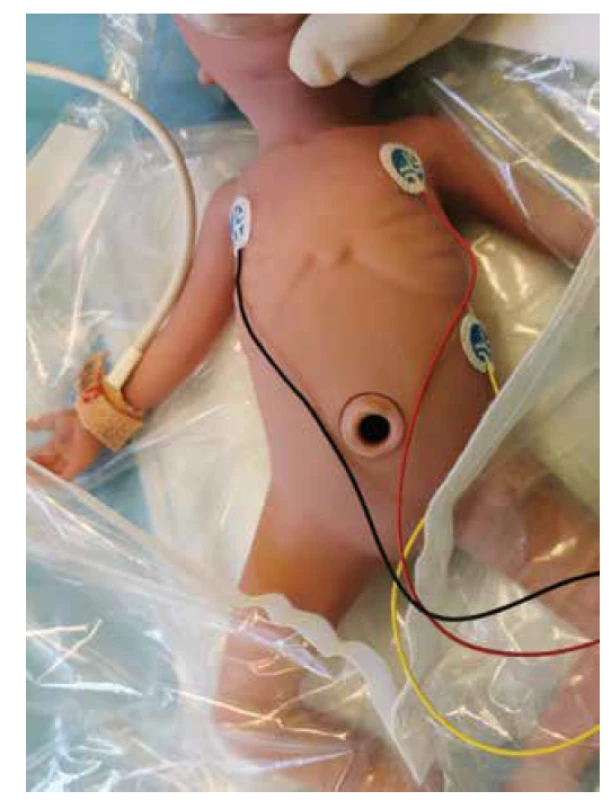
Barva
U většiny novorozenců bývá taktilní stimulace osušením většinou dostatečným stimulem pro zahájení efektivní ventilace. Podle barvy dítěte lze špatně odhadnout oxygenaci. Zdravý, fyziologický, spontánně dýchající novorozenec zpravidla zrůžoví během 30 sekund, ale lehká cyanóza může být patrná několik minut po porodu. Fyziologický donošený novorozenec má saturaci kyslíku během porodu kolem 60 %, postupně stoupá nad 90 % během 10 minut. Periferní cyanóza je častá, sama neznamená hypoxemii. Přetrvávající centrální cyanóza je indikací k zahájení měření pulzním oxymetrem (preduktálně). Přetrvávající bledost přes adekvátní ventilaci může být známkou acidózy, šoku nebo hypovolemie.
Tonus
Těžce hypotonické hadrovité děti („floppy infants“) mívají poruchu vědomí, vyžadují rychlé zahájení ventilace (PPV).
Klasifikace novorozenců podle úvodního vyšetření [10, 31]
Hodnocení svalového tonu, dýchání a akce srdeční před podvazem pupečníku může pomoci určit potřebu intervence a délku opožděného podvazu pupečníku. Na základě úvodního vyšetření můžeme novorozence rozdělit do 3 skupin a rozhodnout o prvních opatřeních.
1. skupina
vigilní dítě, křičí, dýchá;
dobrý tonus;
AS nad 100/min.
Opatření: Bez intervence, odložený podvaz pupečníku, dítě osušíme, zabalíme a přiložíme k matce („skin to skin“).
2. skupina
dýchání nedostatečné (nebo apnoe);
normální nebo snížený tonus;
AS 60–100/min.
Opatření: Osušení, stimulace, dítě zabalíme do teplé osušky, inflace plic přes masku, kontrola AS a dýchání (bradykardie je pravděpodobně v důsledku hypoxie). Odložený podvaz pupečníku pouze v případě, že jsme schopni zahájit ventilační podporu ještě na pupečníku [31].
3. skupina
dýchání nedostatečné, gasping nebo apnoe;
těžká hypotonie („hadrovité dítě“);
těžká bradykardie pod 60/min nebo AS nepřítomná;
často bledost – porucha perfuze.
Opatření: Ihned podvaz pupečníku, Dítě osušit, stimulovat, zabalit do teplé osušky, okamžitá kontrola průchodnosti dýchacích cest, inflace plic a zahájení ventilace (PPV). Kontinuální monitorování AS, dýchání a vyhodnocení efektu ventilace. Často je nutná zevní srdeční masáž, ev. aplikace léků.
Příčiny poruchy dýchání/centrální cyanózy novorozence po porodu
Nejčastější příčinou poruchy dýchání a centrální cyanózy po porodu jsou prematurita a intrapartální hypoxie. Zůstává malá skupina spontánně dýchajících dětí s normální akcí srdeční a přetrvávající centrální cyanózou. V diferenciální diagnóze se může jednat o cyanotickou vrozenou srdeční vadu, kongenitální pneumonii, pneumothorax či diafragmatickou hernii.
Diferenciální diagnostika příčin poruchy dýchání/centrální cyanózy novorozence po porodu:
prematurita,
intrapartální hypoxie,
aspirace mekonia,
farmakologický útlum,
porodní trauma (CNS),
adnátní pneumonie, sepse,
těžká anémie,
hypovolémie, hypotenze,
pneumothorax,
cyanotické vrozené srdeční vady,
vrozené vývojové vady (atrézie choan, brániční kýla, hypoplazie plicní),
primární nemoci CNS,
primární svalové onemocnění.
PODPORA ŽIVOTNÍCH FUNKCÍ
Pokud se narodí dítě s poruchou dýchání nebo bradykardií pod 100/min, je základem úspěšné resuscitace zprůchodnění dýchacích cest a provzdušnění plic. Jestliže se nepodaří zajistit tyto dva úvodní kroky, bývají další intervence neúspěšné.
Taktilní stimulace
Osušení dítěte po porodu je zpravidla dostatečnou stimulací pro zahájení efektivní spontánní ventilace. Pokud novorozenec nereaguje na krátkou periodu stimulace (jemné tření plosky nohy/zad), jsou nutné další resuscitační kroky.
Poloha, dýchací cesty
Správná poloha dítěte je na zádech v neutrálním postavení, raménka lze podložit flanelem do výšky 2 cm (viz obr. 4). Odsávání je indikováno jen při známkách obstrukce dýchacích cest (mekoniem, krví nebo hlenem). Agresivní odsávání může způsobit oddálení spontánní ventilace, laryngeální spazmus a vagovou bradykardii. Běžný odsávací podtlak je 10–15 cm H2O.
Image 4. Správná poloha, hlava v neutrálním postavení.
Fig. 4. Newborn with head in neutral position.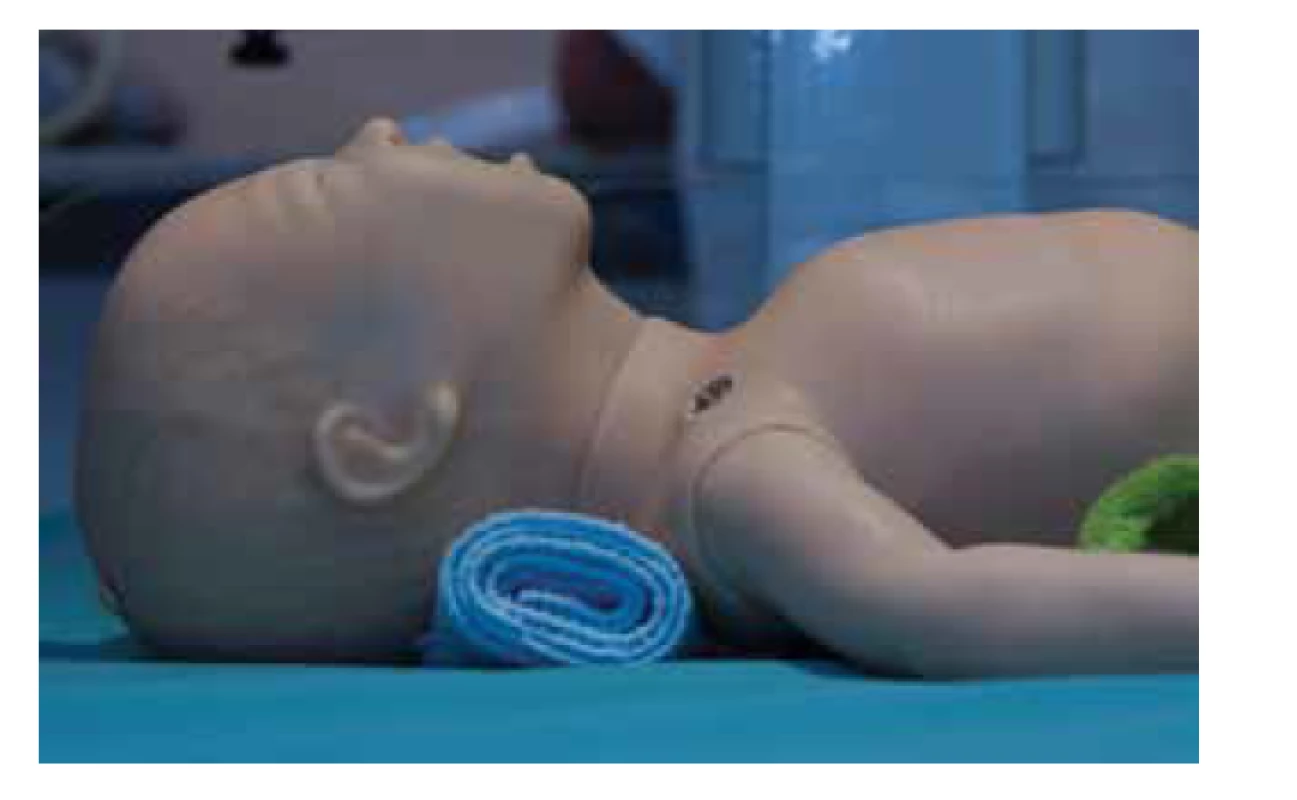
Donošené, fyziologické, dobře se adaptující novorozence rutinně neodsáváme. Lze je nechat zadaptovat v poloze na boku nebo na bříšku.
Mekonium v plodové vodě
Mekoniem zkalenou plodovou vodu nacházíme až u 12 % porodů. Mekoniem lehce zkalená plodová voda je častá a většinou nevede ke zhoršení poporodní adaptace. Plodová voda zkalená hustým mekoniem může být známkou závažné intrauterinní hypoxie s nutností resuscitace. Novorozence, kteří se rodí v přítomnosti mekoniem zkalené plodové vody, intrapartálně neodsáváme. Intrapartální odsávání (na perineu, před porodem ramének) nesnižuje incidenci aspirace mekonia, k té dochází již intrauterinně.
Po porodu s mekoniem zkalenou plodovou vodou kontrolujeme u novorozence průchodnost horních cest dýchacích, při známkách jejich obstrukce odsáváme ústa a nos.
U těžce deprimovaných novorozenců se již nedoporučuje rutinní endotracheální odsávání. U dětí, které se rodí apnoické, hypotonické s bradykardií, nebo je spontánní ventilace nedostatečná, je prioritou bezodkladné zahájení umělé plicní ventilace (UPV-PPV) maskou hned po porodu (tzn. během 1. minuty života) ve snaze co nejrychleji provzdušnit plíce. Intubace a endotracheální odsávání jsou doporučovány jen při podezření na obstrukci trachey vazkým mekoniem. Při odsávání používáme katetr 12–14 FG, odsávací podtlak 15 cm H2O. Rutinní podání surfaktantu či laváž fyziologickým roztokem nebo surfaktantem nejsou doporučovány [16, 17].
Úvodní prodechy, umělá plicní ventilace pozitivním přetlakem (PPV)
Pokud po porodu a dokončení úvodních kroků dítě nedýchá nebo je spontánní dýchání nedostatečné, je prioritou rychlé provzdušnění plic a ustanovení FRC. U donošených novorozenců zahajujeme ventilaci vzduchem přes masku (viz obr. 5), u nedonošených s FiO2 0,21–0,30. Adekvátní ventilace a inflace plic vede obvykle k rychlé úpravě akce srdeční během 30 sekund.
Image 5. Ventilace přes obličejovou masku (T spojka).
Fig. 5. Facemask ventilation (T-piece).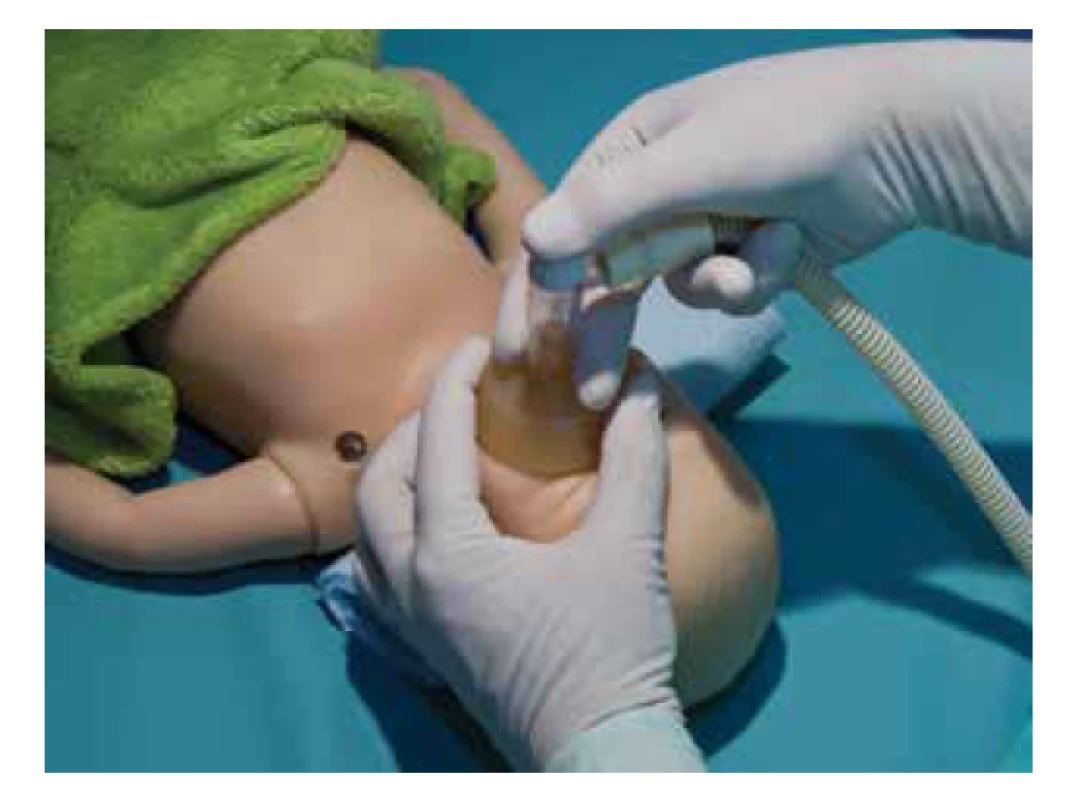
U 5 úvodních prodechů používáme delší inflační čas 2–3 vteřiny, dále frekvenci 30/minutu s inflačním časem 1 sekunda (pozn: delšího inflačního tlaku dosáhneme při použití T spojky, nikoliv při dýchání samorozpínacím vakem). Ventilujeme do nástupu dostatečné spontánní dechové aktivity dítěte (10).
U donošených novorozenců nastavujeme úvodní inflační tlak kolem 30 cm H2O, u nedonošených 25 cm H2O [31], inflační tlak zvyšujeme v průběhu resuscitace podle AS a oxygenace. Pokud nedochází ke zlepšení stavu, je možnou příčinou špatná průchodnost dýchacích cest nebo špatně prováděná ventilace. Je třeba opakovaně kontrolovat správnou polohu dítěte, průchodnost dýchacích cest, přiložení masky (pozor na „leaky“ – úniky vzduchu během ventilace) a pasivní zvedání hrudníku. U „floppy infants“ může povytažení dolní čelisti zlepšit průchodnost dýchacích cest a snížit úniky vzduchu při ventilaci maskou. Bez adekvátního provzdušnění plic je zevní srdeční masáž neefektivní.
Specifika asistované ventilace nedonošených novorozenců
Plíce nedonošených novorozenců jsou bezprostředně po porodu lehce zranitelné vysokými dechovými objemy. Hyperinflace a opakované kolapsy alveolů mohou poškodit plíci. Aplikace PEEP hned po porodu chrání plíci proti poškození, zlepšuje její provzdušnění, compliance a výměnu plynů.
CPAP se doporučuje jako úvodní ventilační podpora u všech spontánně dýchajících nedonošených novorozenců s RDS (zahájit distenzní léčbu je lepší než primárně děti intubovat). Iniciální použití CPAP snižuje potřebu endotracheální intubace, snižuje délku mechanické ventilace a výskyt bronchopulmonální dysplazie). Při použití T spojky (Neopuff nebo rPAP) nastavujeme PEEP kolem 5–6 cm H2O, úvodní FiO2 0,21 –0,30 podle stupně nezralosti.
Při nutnosti prodechů maskou (PPV) používáme co nejnižší inspirační tlak (iniciálně 25 cm H2O), který vede ke zlepšení AS a oxygenace. Správná poloha dítěte, velikost, přiložení a držení masky mohou snižovat časté úniky vzduchu a obstrukce dýchacích cest [18, 19].
U spontánně dýchajících nedonošených novorozenců s RDS pokračujeme po úvodní stabilizaci v distenční léčbě nCPAP přes nostrily nebo nosní masku (viz obr. 6).
Image 6. CPAP aplikovaný přes nosní masku.
Fig. 6. CPAP, nasal mask.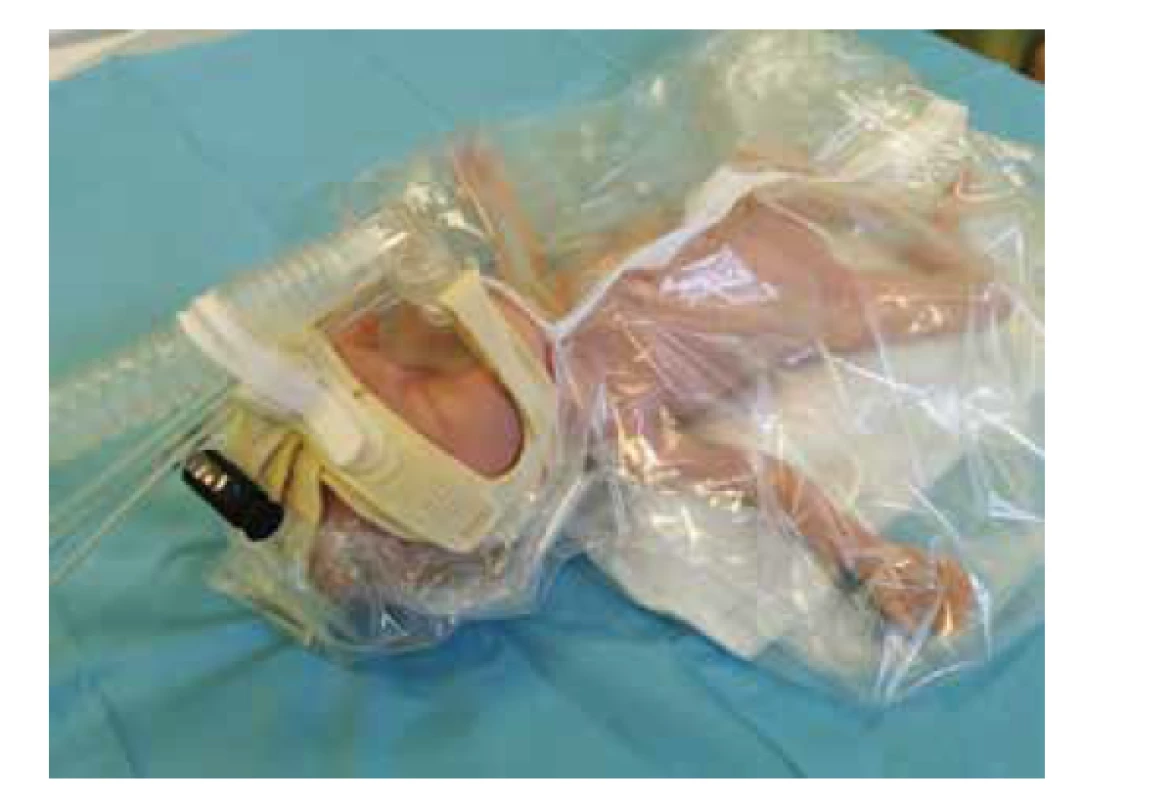
Maska versus nostrily
Obě metody jsou při ventilační podpoře možné. Úniky vzduchu při použití masky vedly na některých pracovištích k používání nostril. Dvě velké randomizované studie neprokázaly rozdíly při použití masky a nostril u nedonošených novorozenců [20, 21]. Přiložení obličejové masky i použití binazálních nostril může indukovat trigeminokardiální reflex, na který nedonošení novorozenci mohou poměrně často (až v 50 %) reagovat apnoí a bradykardií [6].
Inflační manévr > 5 sekund
Několik animálních studií prokázalo efekt inflačního manévru (SIM) pro ustanovení FRC v tranzitorním období, kdy dochází ke vstřebávání plicní tekutiny a provzdušnění plic. Randomizované klinické studie prokázaly snížení potřeby mechanické ventilace, ne však redukci mortality, „air leaks“ a BPD. Diskutovány jsou stále bezpečnost SIM, nastavení inflačního tlaku a délky trvání SIM i jeho dlouhodobý efekt. Jeho prospěšnost ve srovnání s PPV nebyla zatím v klinických studiích jednoznačně prokázána. Lze ho zvažovat v individuálních klinických situacích či výzkumu [2, 8].
CPAP u donošených novorozenců
Není dostatek dat, jak správně používat CPAP u donošených novorozenců, je třeba dalších klinických studií [10, 22, 23].
Ventilační přístroje
Efektivní ventilaci dítěte lze zajistit pomocí T spojky (Neopuff, rPAP) nebo samorozpínacího vaku (Ambuvak). Výhody T spojky spočívají v možnosti nastavení PEEP, délky inspiračního času, vrcholového tlaku a koncentrace kyslíku. Větší zkušenosti s použitím T spojky jsou u nedonošených novorozenců, lze ji však dobře používat i u donošených.
Intubace
Indikace endotracheální intubace jsou:
potřeba odsátí mekonia z trachey (a jiné obstrukce trachey vazkým hlenem, krví);
neefektivní nebo prolongovaná ventilace maskou;
nutnost nepřímé srdeční masáže;
speciální indikace (brániční kýla, podání surfaktantu).
Rozhodnutí o intubaci závisí na zkušenosti a dovednosti resuscitačního týmu. Důležitá je správná volba velikosti endotracheální kanyly (ETK), hloubka zavedení a fixace u horního rtu. U urgentní intubace na PS těsně po porodu často neznáme porodní hmotnost a ETK fixujeme podle týdne těhotenství (viz tab. 4).
Table 4. Orotracheální intubace a fixace ETK podle týdne těhotenství 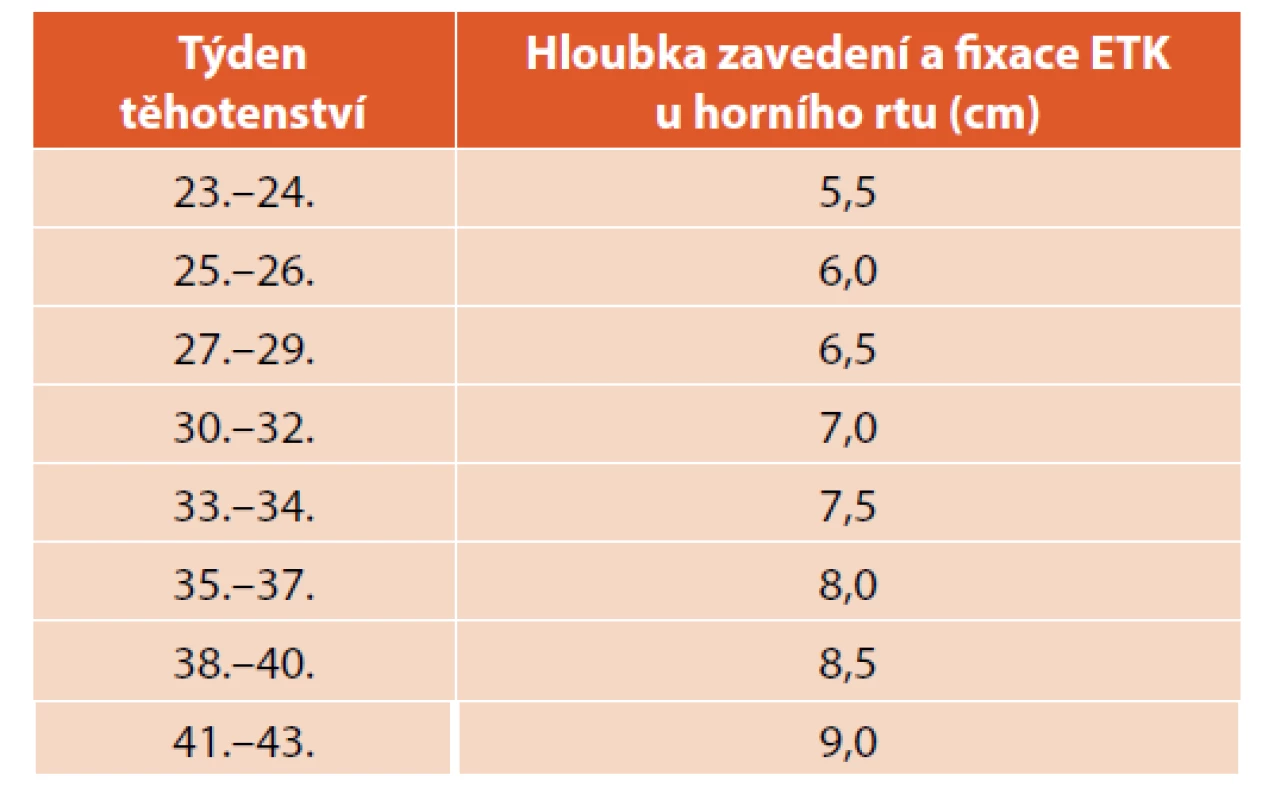
V tabulce 5 jsou uvedeny velikosti vhodného průsvitu ETK podle hmotnosti + týdne těhotenství. Doporučena je orotracheální intubace, rovná laryngeální lžíce: velikost 0 pro nedonošené (velikost 00 pro extrémně nezralé), velikost 1 pro donošené.
Table 5. Orotracheální intubace: průsvit a fixace ETK podle hmotnosti a týdne těhotenství. 
Ověření správné polohy ETK:
zlepšení AS a barvy novorozence;
symetrický poslechový nález;
registrace proudu vzduchu z endotracheální kanyly během výdechu;
pomocí vydechovaného CO2.
Pro fixaci ETK je možné použít vzorec: hmotnost dítěte v kg + 6 = hloubka zavedení ETK v cm a její fixace u horního rtu (příklad: porodní hmotnost 3 kg + 6 = fixace ETK u horního rtu ve vzdálenosti 9 cm).
Laryngeální maska (vzduchovod)
Může být zvažována jako alternativa tracheální intubace u dětí s porodní hmotností nad 2000 g nebo narozených nad 34. tt. Jedná se o situace, kdy je PPV maska neefektivní nebo se nedaří endotracheální intubace.
Kyslík, oxygenoterapie
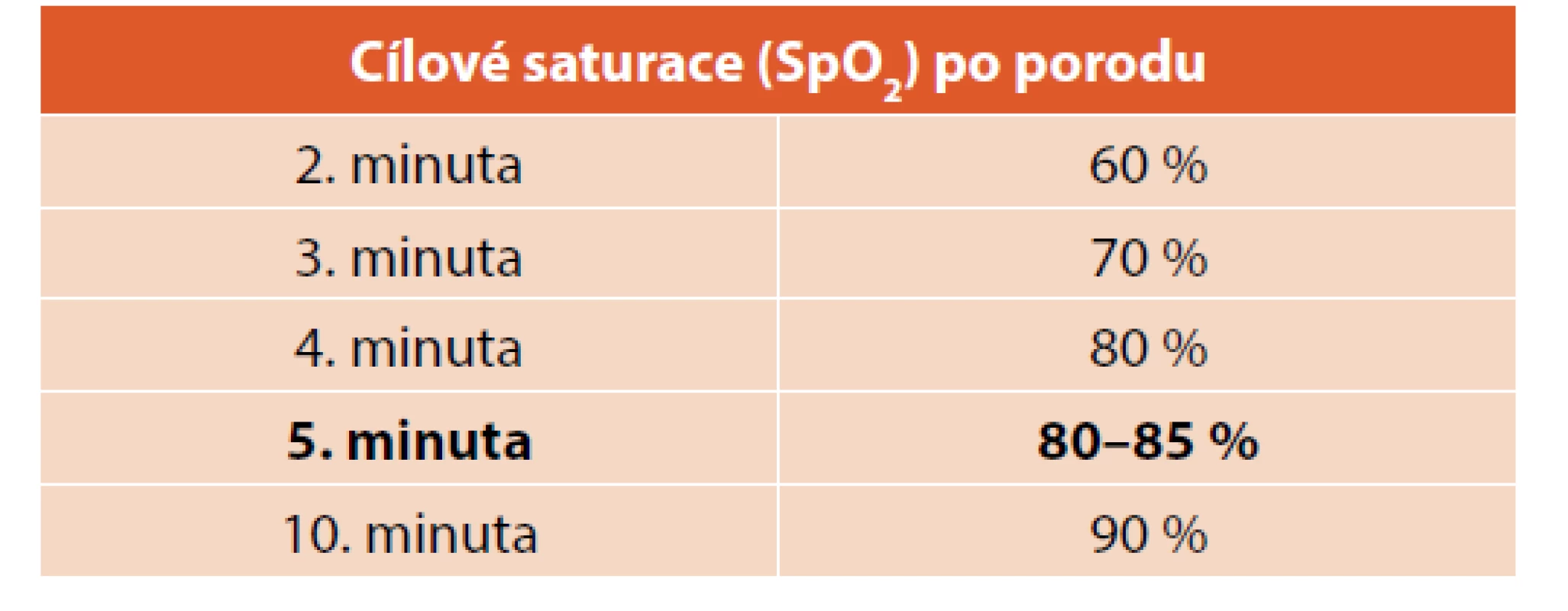
Je známo, že hypoxie a ischemie vedou k multiorgánovému poškození. V posledních 30 letech byl popsán kyslíkový paradox – zvýšené poškození buněk a tkání, pokud jsou po prodělané hypoxii vystaveny vysokým koncentracím kyslíku. Byl popsán oxidativní stres, role volných kyslíkových radikálů, antioxidans a jejich vztah k apoptóze a tkáňovému poškození v období reperfuze. I krátká expozice vysokými koncentracemi kyslíku po prodělané hypoxii může být riziková. Použití 100% kyslíku ve srovnání se vzduchem oddaluje spontánní ventilaci, prodlužuje dobu resuscitace, zvyšuje oxidativní stres, zvyšuje mortalitu a neurologickou morbiditu [24]. Ve světle současných znalostí se doporučuje u donošených novorozenců zahájit resuscitaci vzduchem (FiO2 0,21). Pokud přes adekvátní ventilaci nestoupá akce srdeční a nezlepšuje se oxygenace, lze použít vyšší koncentraci kyslíku. U nedonošených novorozenců pod 32. tt používáme vždy směšovač kyslíku a vzduchu, kyslík dávkujeme nejlépe podle saturace kyslíku měřené pulzním oxymetrem. Úvodní nastavení koncentrace kyslíku u nedonošených novorozenců doporučuje ERC v rozmezí FiO2 0,21–0,30. Kyslík dávkujeme v průběhu resuscitace tak, abychom dosáhli úpravy bradykardie a cílových saturací v prvních 10 minutách, zcela zásadní je vyhodnocení saturace kyslíkem v 5. minutě života [7]. Během resuscitace bychom se měli vyvarovat jak hypoxie, tak hyperoxie. Úvodní nastavení koncentrace kyslíku pro nedonošené novorozence a cílové saturace v 5. minutě života jsou uvedeny v tabulce 6.
Table 6. Úvodní nastavení koncentrace kyslíku pro nedonošené novorozence a cílové saturace v 5. minutě života. 
Pulzní oxymetrie
Měření saturace kyslíku pulzním oxymetrem je indikováno u déletrvající resuscitace, přetrvávání centrální cyanózy a u všech nedonošených novorozenců pod 32. týden těhotenství. Senzor pulzního oxymetru umisťuje standardně preduktálně na pravou horní končetinu. Kyslík dávkujeme tak, abychom dosáhli po porodu cílových saturací (viz tab. 7). Zcela zásadní význam má vyhodnocení saturace v 5. minutě.
Doporučení Neonatologického oddělení Gynekologicko-porodnické kliniky Všeobecné fakultní nemocnice v Praze k iniciálnímu nastavení koncentrace kyslíku u extrémně nezralých nedonošených novorozenců (ELBWI):
U spontánně dýchajících ELBWI narozených před 28. tt zahajujeme ventilační podporu CPAP s vyšší koncentrací kyslíku FiO2 v rozmezí 0,40–0,60. Po porodu dítě stimulujeme ke spontánnímu dýchání. Při přetrvávající bradykardii v prvních 3 minutách skokově zvyšujeme koncentraci kyslíku až na FiO2 1,0, zvažujeme intubaci a podání surfaktantu. Správně prováděná ventilace a oxygenace vedou zpravidla k rychlé úpravě akce srdeční. Úvodní nastavení koncentrace kyslíku u nezralých novorozenců je shrnuto v tabulce 8.
Table 8. Úvodní nastavení koncentrace kyslíku u nezralých novorozenců. 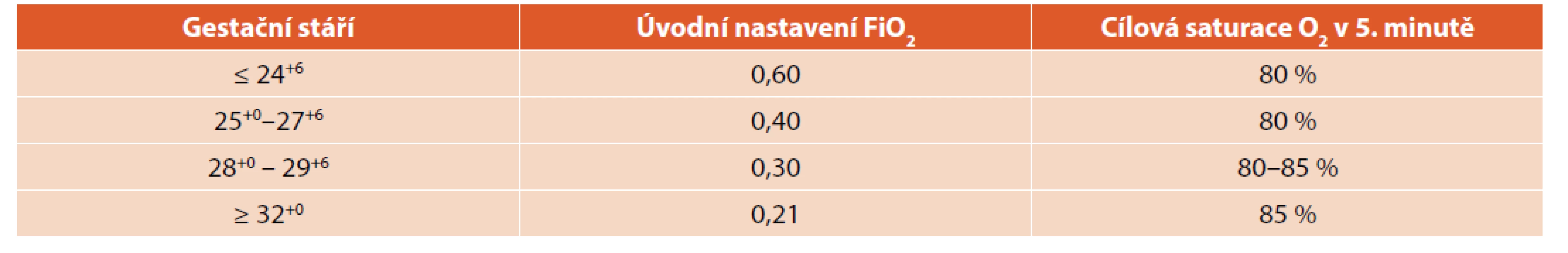
Zajištění cirkulace – nepřímá srdeční masáž [10]
Indikace: přetrvávající bradykardie pod 60/min při adekvátní ventilaci po dobu 30 sekund.
Technika: komprese hrudníku v dolní 1/3 sterna druhým a třetím prstem nebo pomocí 2 palců (preferovaná technika), hloubka kompresí je do 1/3 předozadního průměru hrudníku (obr. 7 a 8, str. 413).
Image 7. Zevní srdeční masáž (palce přes sebe).
Fig. 7. Chest compression (overlapping the thumbs).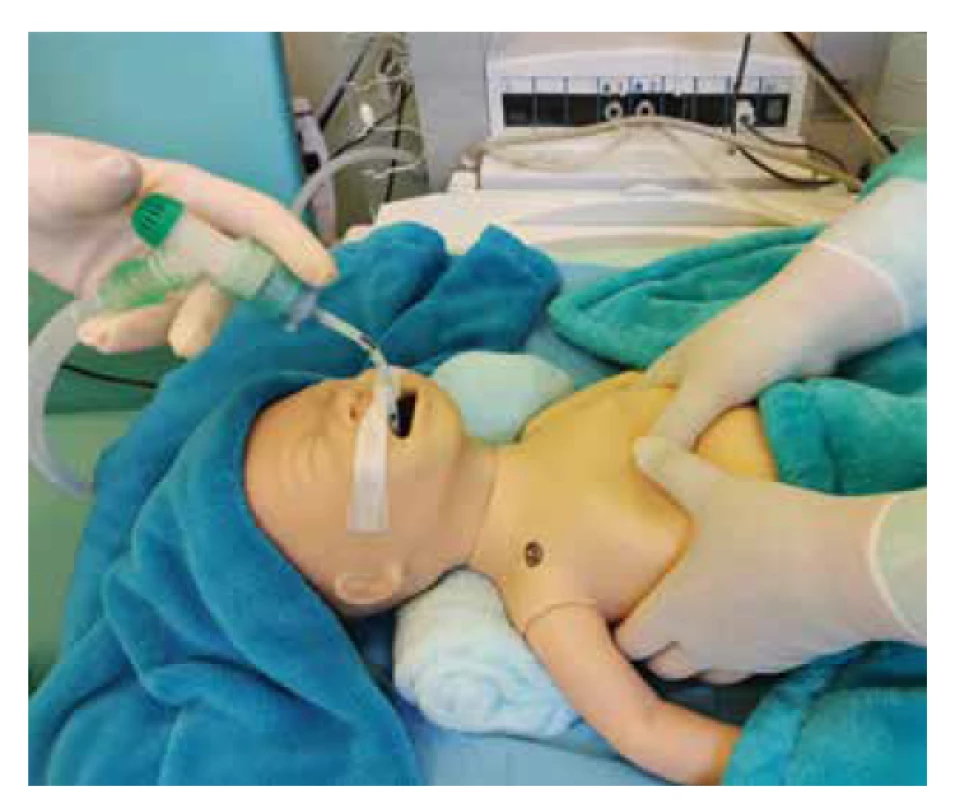
Image 8. Hloubka kompresí cca do 1/3 předozadního průměru hrudníku.
Fig. 8. Depth of the chest compression approximately one- -third of the anterior-posterior diameter.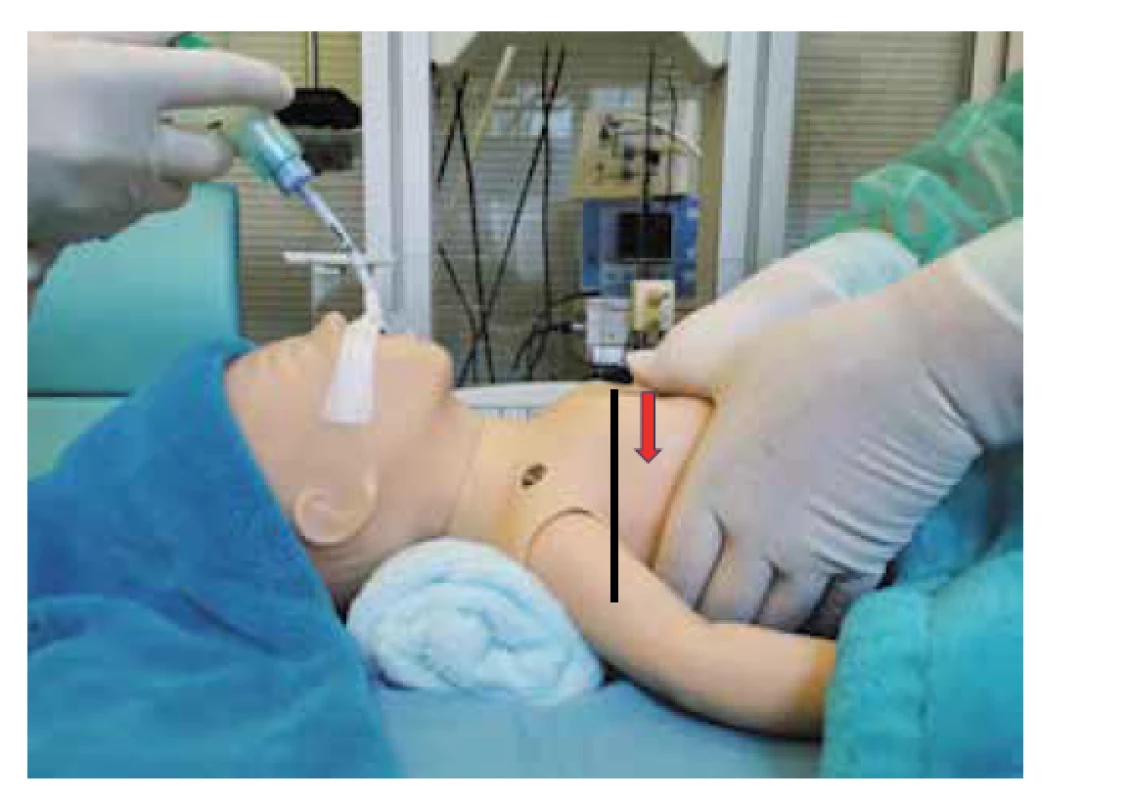
Poměr kompresí k ventilaci je 3 : 1 (tj. 90 kompresí hrudníku/ min. a 30 prodechů/min., celkový počet je 120 cyklů/ /min. = cca 1/2 sekundy na každý cyklus). Kvalita kompresí je mnohem důležitější než přesné dodržení frekvencí.
Akci srdeční kontrolujeme každých 30 sekund nebo průběžně při použití EKG či pulzního oxymetru, nepřímou srdeční masáž ukončujeme při trvalé spontánní srdeční frekvenci nad 60/min.
Prodechy a komprese hrudníku provádíme koordinovaně (ne současně stlačení hrudníku a prodech). Během zevní srdeční masáže zvyšujeme koncentraci kyslíku až na 100 %, pokud lze, dítě intubujeme [31]. Po úpravě AS se snažíme koncentraci kyslíku co nejrychleji snížit, abychom se vyhnuli hyperoxii.
V případech, kdy primární příčina kolapsu je kardiální (srdeční selhání), lze uvažovat o poměru kompresí k ventilaci 15 : 2. Jedná se však o situace spíše výjimečné. Nejčastější příčinou bradykardie novorozenců po porodu je hypoxie a zcela zásadní je zajištění ventilace a oxygenace [4].
Léky [2, 3]
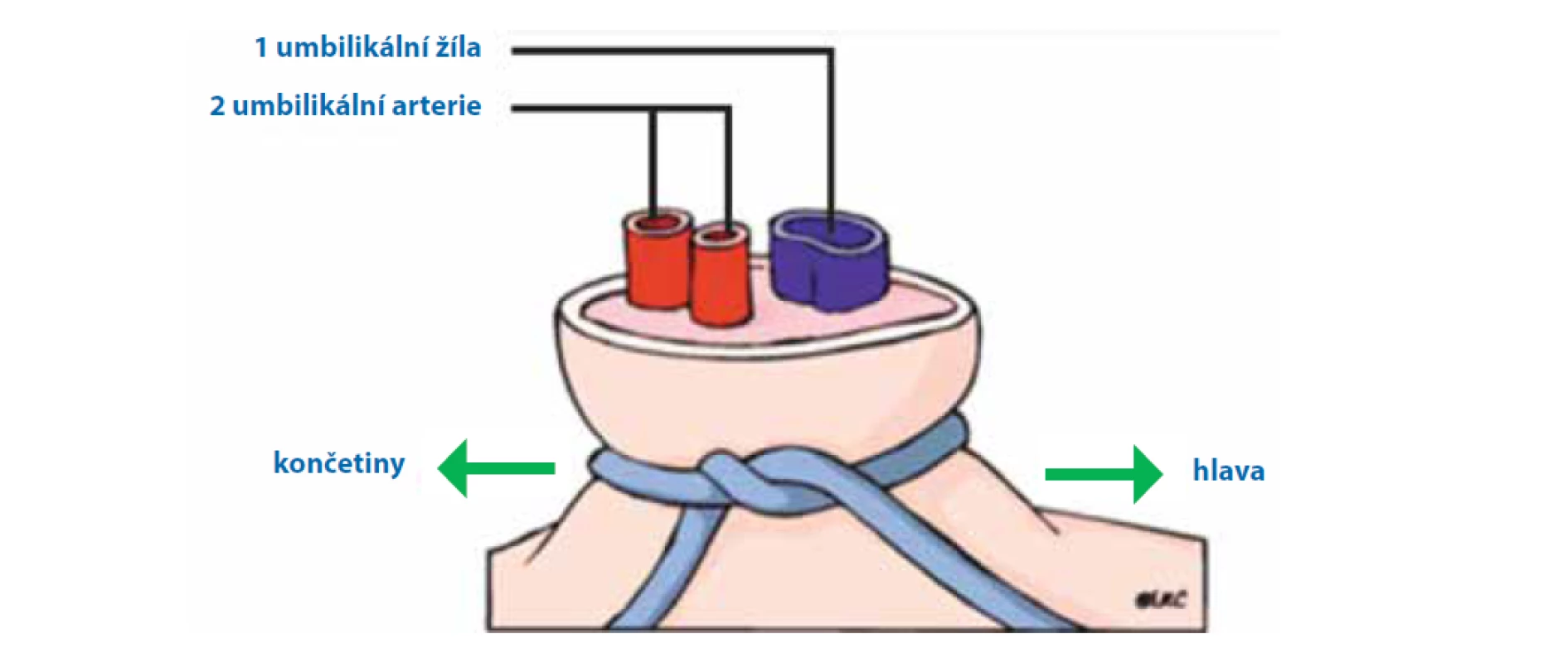
Léky jsou během resuscitace indikovány zřídka. Bradykardie je zpravidla způsobena špatnou inflací plic a hypoxií. Pro její korekci je tedy nejdůležitější adekvátní ventilace. Podání léků zvažujeme, pokud přetrvává bradykardie pod 60/min i přes adekvátní ventilaci a zevní srdeční masáž. Nejrychlejším přístupem do cévního řečiště je katetrizace umbilikální žíly (viz obr. 9).
Adrenalin
Indikace: Bradykardie < 60/min i přes adekvátní ventilaci a zevní srdeční masáž, dávka 10–30 μg/kg intravenózně, lze opakovat každých 3–5 minut při přetrvávající bradykardii < 60/min [31]. Endotracheální podání Adrenalinu není doporučováno (nelze odhadnout vstřebávání Adrenalinu z plic). Pokud nemáme cévní vstup a jsme tak nuceni podat adrenalin endotracheálně, používáme vyšší dávku 50–100 μg/kg).
Tekutiny (volumoterapie)
Indikace: Při podezření na ztrátu krve, šokový stav (bledost, špatné prokrvení), kdy dítě nereaguje na běžnou resuscitaci. Preferujeme izotonické roztoky krystaloidů (spíše než koloidní roztoky), iniciálně bolus 10 ml/ kg i. v., dle reakce na léčbu a vývoje lze volumexpanzi opakovat.
Při ztrátě krve lze podat ORh negativní krev (pokud ji máme k dispozici).
U nedonošených novorozenců bychom se měli vyvarovat rychlého intravenózního podání velkého objemu tekutin, kde je popsána souvislost s vyšším výskytem intrakraniálního krvácení [9].
Bikarbonát
Indikován jen výjimečně při špatném srdečním výdeji přes adekvátní ventilaci a zevní srdeční masáž hrudníku u déletrvající resuscitace, kdy předpokládáme intrakardiální acidózu.
Dávkování: 1–2 mmol/kg 4,2% bikarbonátu pomalu intravenózně.
Glukóza
Hypoglykémie je důležitý rizikový faktor pro perinatální poškození mozku. Během prolongované hypoxie jsou endogenní zásoby glykogenu rychle spotřebovány. U déletrvající resuscitace se proto doporučuje aplikovat bolus 2,5 ml/kg 10% glukózy intravenózně. Po ukončení resuscitace je důležité dále monitorovat glykemii, udržovat normoglykemii, vyhnout se hypoglykemii i hyperglykemii [31].
COVID-19
U suspektní či prokázané pozitivity COVID-19 u matky je riziko vertikálního přenosu na novorozence malé. S předstihem je třeba sestavit resuscitační tým a zvolit předem místo pro resuscitaci. Personál by měl použít standardní osobní ochranné pomůcky. Vlastní resuscitační postup novorozence se nemění [28, 29]. Algoritmus je znázorněn na obrázku 10.
Image 10. Algoritmus resuscitace novorozence podle ERC 2021 - upraveno pro COVID 19 pozitivní matky. 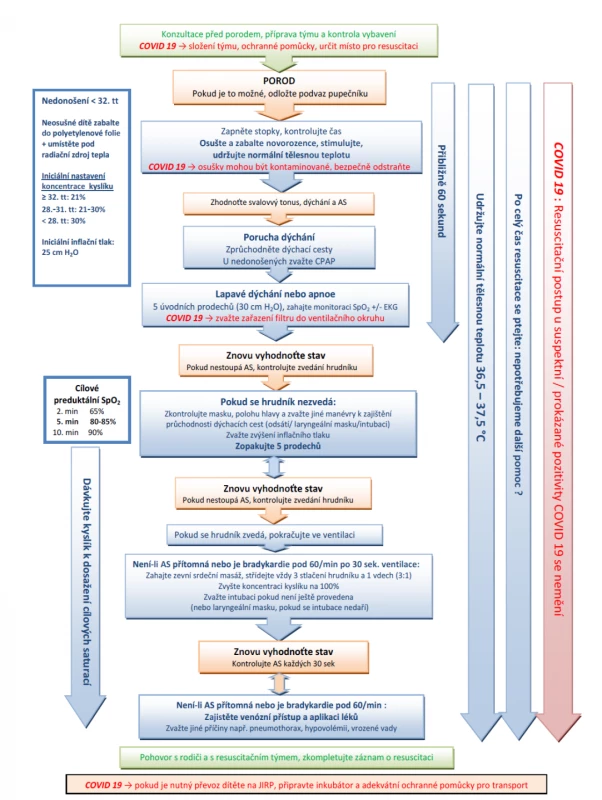
NEZAHÁJENÍ NEBO UKONČENÍ RESUSCITACE
Nezahájení a ukončení péče se považují za eticky rovnocenné. Přání rodičů by mělo hrát důležitou roli v rozhodování.
Nezahájení resuscitace [10]
Resuscitaci nezahajujeme:
u vrozených vývojových vad s nepříznivou prognózou (např. trizomie 13. nebo 18. chromozomu, anencefalus);
u extrémní nezralosti – děti narozené před 23. tt a/nebo s porodní hmotností < 400 g.
Zahajování resuscitace na hranici viability v tzv. šedé zóně (mezi 22+0–24+6 tt) záleží na lokálních doporučeních v každé zemi a výsledkách mortality a morbidity daného pracoviště. U extrémně nezralých novorozenců na hranici viability s nejistou prognózou se doporučuje individuální přístup po konzultaci s rodiči a jejich informovaném souhlasu. V klinické praxi se jedná zpravidla o rozhodování ve 23+0–24+6 tt (v ČR obligatorně zahajujeme péči od 24+0 tt, ve vybraných perinatologických centrech (PC) ve 23. tt, výjimečně ve 22. tt).
U hrozícího předčasného porodu v šedé zóně hraje zcela zásadní roli transport in utero do PC, významně zvyšuje šanci na přežití a zlepšuje krátkodobou i dlouhodobou morbiditu. Důležitý je koordinovaný a konzistentní postup mezi týmů porodníků a neonatologů po konzultaci s rodiči.
Ukončení resuscitace [2, 3]
Ukončení resuscitace zvažujeme, pokud se po 20 minutách adekvátně prováděné resuscitace nedaří obnovit spontánní AS. Rozhodnutí, zda resuscitaci ukončit či v ní pokračovat, by mělo být individuální. Mělo by zahrnovat komplexní hodnocení dané situace, předpokládanou etiologii, čas perinatálního inzultu (pokud je znám), týden těhotenství, vrozené vývojové vady, reverzibilitu stavu a přání rodičů.
Ukončování resucitace záleží též na lokálních a národních doporučeních v dané zemi (s ohledem na kulturní a náboženské rozdíly).
PORESUSCITAČNÍ PÉČE
Monitorování glykemie
Mezi základní sledování v poresuscitační péči patří monitorování glykemie. Hypoglykemie, která následuje po hypoxicko-ischemickém inzultu, může zhoršit neurologický vývoj.
Indukovaná hypotermie
Řízená hypotermie je indikována u středně těžké a těžké hypoxicko-ischemické encefalopatie (HIE) donošených novorozenců. Neuroprotektivní účinek řízené hypotermie je multifaktoriální, zahrnuje inhibiční mechanismy, které eliminují excitované buněčné procesy devastující mozkové buňky. Řízená hypotermie snižuje úmrtí a neurologická postižení v 18 měsících věku, z léčby profituje 1 z 5 až 6 léčených dětí. Řízenou hypotermii zahajujeme do 6 hodin po narození, ukončujeme po 72 hodinách chlazení.
Doporučení pro řízenou hypotermii v léčbě HIE v České republice [25]
Aktivní řízená hypotermie: Jedná se o hypotermii se servořízenou či manuálně řízenou teplotou, rektální cílová teplota je 33,5 ± 0,5 °C v trvání 72 hodin.
Pasivní hypotermie: Je soubor opatření ke snížení tělesné teploty (vypnutí výhřevného lůžka nebo inkubátoru, přikládání/odnímání přikrývky) za účelem dosažení cílové teploty a realizace bezpečného transportu novorozence do perinatologického centra (PC). Podmínkou bezpečné pasivní hypotermie je pravidelné měření teploty á 15 minut (teplota by neměla klesnout pod 33 °C).
Indikační kritéria pro řízenou hypotermii v ČR:
A. Gestační stáří a věk novorozence (obě kritéria musejí být splněna):
gestační týden ≥ 36;
věk do 6 hodin po porodu.
B. Anamnéza (alespoň 1 kritérium musí být splněno):
Apgar skóre ≤ 5 bodů v 10. minutě života;
nutnost UPV maskou nebo přes ETK v 10. minutě života;
Acidóza, pH < 7 (z pupečníkové krve nebo během 60 minut od porodu);
BE ≤ −16 (z pupečníkové krve nebo během 60 minut od porodu).
C. Známky střední nebo těžké hypoxicko-ischemické encefalopatie (HIE II.–III. stupně), která se manifestuje křečemi nebo minimálně jedním příznakem ve třech a více kategoriích (viz níže):
alterace vědomí: letargie, stupor, kóma;
abnormní svalové napětí: hypotonie, atonie;
alterace spontánní aktivity: snížená nebo žádná;
abnormní reflexy: oslabení nebo chybění sacího reflexu, snížení/absence Morova reflexu;
patologické postura: extenze, distální flexe, decerebrace;
autonomní systém: bradykardie, variabilní akce srdeční, nepravidelné dýchání, apnoe, mióza nebo mydriáza.
Pokud jsou naplněna výše popsaná kritéria (A, B, C), měla by být zahájena co nejdříve pasivní hypotermie, transport do PC + vyšetření metodou integrované amplitudy EEG (aEEG). I v nejednoznačných situacích je doporučeno kontaktovat spádové PC a konzultovat stav pacienta.
Kontraindikace řízené hypotermie:
gestační stáří < 35+0 tt;
moribundní novorozenci nebo novorozenci se závažnými vrozenými vývojovými a genetickými vadami, u kterých není plánována další aktivní léčba;
novorozenci s těžkou intrauterinní růstovou restrikcí (PH pod 3. percentil);
novorozenci se závažnou koagulopatií a/nebo krvácením;
novorozenci s těžkým poraněním hlavy nebo závažným intrakraniálním krvácením.
Komunikace s rodiči
Rodiče by měli být informováni o stavu dítěte, případné resuscitaci a jejím průběhu. Evropská doporučení podporují přítomnost rodičů během resuscitace, pokud to podmínky dovolí. Informaci rodičům o průběhu resuscitace by měl podávat starší zkušený lékař. Velice důležité je také následně zajistit časný kontakt mezi rodiči a dítětem [10].
Prognostické parametry
Skóre podle Apgarové bylo vytvořeno jako jednoduchá klasifikace novorozenců sloužící jako základ pro srovnání porodnické péče a efektu resuscitace. Přestože je Apgar skóre široce používané v klinické praxi, pro vědecké a prognostické účely je jeho využitelnost často zpochybňována pro velké rozdíly při hodnocení („inter and intra observer variation“). Není shoda v hodnocení Apgar skóre u dětí, které vyžadují léčebnou intervenci (resuscitaci), a u dětí nedonošených. Proto bylo vytvořeno kombinované Apgar skóre, které zahrnuje hodnocení stavu dětí a léčebných intervencí k dosažení tohoto stavu s přihlédnutím ke gestačnímu stáří. Kombinované Apgar skóre predikuje lépe vývoj nedonošených i donošených novorozenců [26, 27)].
Informativní schůzka před resuscitací a po resuscitaci („briefing/debriefing“)
Schůzka týmu před resuscitací je důležitá pro rozdělení úloh a odpovědnosti každého člena resuscitačního týmu. Setkání po ukončení resuscitace by měla kriticky a konstruktivně vyhodnotit celý průběh resuscitace. Tyto schůzky zlepšují provedení následných resuscitací. Prospěšné je zpětné vyhodnocení videonahrávek a záznamů z přístrojů. Ukazuje se, že strukturované zhodnocení celého perinatálního průběhu a zpětná vazba zlepšují výsledek, u nedonošených novorozenců redukují výskyt intrakraniálního krvácení [10].
ZÁVĚR
Nová doporučení resuscitace novorozence jsou vydávána ILCOR každých 5 let, v České republice jsou postupně zaváděna do praxe ve většině novorozeneckých oddělení. V následujícím období plánuje ILCOR analýzu témat, která nebyla revidována v roce 2020: oddálený podvaz pupečníku, stimulace apnoických novorozenců, monitorace plicních funkcí na PS, méně invazivní podání surfaktantu (LISA), použití laryngeální masky, CPAP versus oxygenoterapie na PS u donošených novorozenců, optimální inspirační tlak u PPV, oxygenoterapie a oxygenační pásma během resuscitace, rizikové faktory hypovolémie [2].
Velkou pozornost je třeba stále věnovat edukačním programům neonatální resuscitace pro sestry a lékaře, kteří pracují na novorozeneckých odděleních.
7 KLÍČOVÝCH SDĚLENÍ [3, 31]:
1. Resuscitace novorozence vyžaduje předvídání a přípravu. Velice důležitá je individuální a týmová příprava všech osob, které se na resuscitaci podílejí.
2. Stav novorozence může zlepšit odložený podvaz pupečníku, zejména u předčasně narozených.
3. Životně důležitá je péče o tělesnou teplotu – dítě po porodu zabalte a stimulujte.
4. Zhodnoťte dýchání a akci srdeční – rychlá srdeční frekvence znamená dostatečnou oxygenaci.
5. Většinu problémů vyřeší bazální podpora průchodnosti dýchacích cest a podpora dýchání.
6. Vzestup akce srdeční je nejdůležitější indikátor správně prováděné ventilace a oxygenace během resuscitace.
7. Komprese hrudníku jsou indikovány pouze při přetrvávající bradykardii přes správně prováděnou efektivní ventilaci, při zevní srdeční masáži preferujeme dítě zaintubovat.
Použité zkratky:
aEEG – amplitude integrated electroencephalography, integrovaná amplituda EEG
AHA – American Heart Association
AS – akce srdeční
ATP – adenosintrifosfát
BE – base excess
BMI – body mass index, index tělesné hmotnosti
CNS – centrální nervový systém
CO2 – kysličník uhličitý
CPAP – continuous positive airway pressure, kontinuální přetlak v dýchacích cestách
EEG – elektroencefalografie
EKG – elektrokardiogram
ELBWI – extrémně nezralý nedonošený novorozenec
ERC – European Resuscitation Council
ETK – endotracheální kanyla
FiO2 – fraction of inspired oxygen, inspirační koncentrace kyslíku
FRC – funkční reziduální kapacita
HIE – hypoxicko-ischemická encefalopatie
ILCOR – International Liaison Committee on Resuscitation
PEEP – positive end-expiratory pressure, pozitivní přetlak v dýchacích cestách na konci exspiria
PH – porodní hmotnost
PPV – positive pressure ventilation, ventilace pozitivním přetlakem
PS – porodní sál
RDS – respiratory distress syndrome, syndrom dechové tísně novorozence
SIM – sustained inflation manoeuvre, inflační manévr
SpO2 – peripheral capillary oxygen saturation, saturace krve kyslíkem
tt – týden těhotenství
UPV – umělá plicní ventilace
Korespondující autor:
MUDr. Karel Liška
Neonatologické oddělení Gynekologicko-porodnická klinika 1. LF UK Všeobecná fakultní nemocnice
Apolinářská 18
128 00 Praha 2
e-mail: kliska@vfn.cz
Sources
1. Nolan JP, Maconochie I, Soar J, et al. Executive summary: 2020 International consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation 2020; 156: A1–A22.
2. Wyckoff MH, Wyllie J, Aziz K, et al. Neonatal life support 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation 2020; 156: A156–A187.
3. Aziz K, Lee HC, Escobedo MB, et al. Neonatal resuscitation: 2020 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Pediatrics 2021; 147 (Suppl 1): e2020038505E.
4. Perkins GD, Olasveengen TM, Maconochie I, et al. European Resuscitation Council Guidelines for Resuscitation: 2017 update. Resuscitation 2018; 123 : 43–50.
5. Kuypers K, Lamberska T, Martherus T, et al. Comparing the effect of two different interfaces on breathing of preterm infants at birth: A matched-pairs analysis. Resuscitation 2020; 157 : 60–66.
6. Kuypers K, Lamberska T, Martherus T, et al. The effect of a face mask for respiratory support on breathing in preterm infants at birth. Resuscitation 2019; 144 : 178–184.
7. Saugstad OD, Oei JL, Lakshminrusimha S, et al. Oxygen therapy of the newborn from molecular understanding to clinical practice. Pediatr Res 2019; 85 (1): 20–29.
8. Wyllie J, Perlman JM, Kattwinkel J, et al. Part 7: Neonatal resuscitation: 2015 International consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Resuscitation 2015; 95: e171–203.
9. Perlman JM, Wyllie J, Kattwinkel J, et al. Part 7: Neonatal resuscitation: 2015 International consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation 2015; 132 : 543–560.
10. Wyllie J, Bruinenberg J, Roehr C, et al. European Resuscitation Council guidelines for resuscitation 2015. Section 7: Resuscitation and support of transition of babies at birth. Resuscitation 2015; 95 : 249–263.
11. Wyckoff MH, Aziz K, Escobedo MB, et al. Neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2015; 132: S543–S560.
12. Wyllie J. Recent changes to UK newborn resuscitation guidelines. Arch Dis Fetal Neonatal Ed 2012 Jan; 97 (1): F4–F7.
13. Richmond S, Wylie J. European Resuscitation Council guidelines for resuscitation 2010. Resuscitation of babies at birth. Resuscitation 2010; 81 : 1389–1399.
14. Kattwinkel J, Perlman J, Aziz K, et al. Special report neonatal resuscitation: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Pediatrics 2010; 126 : 1400–1413.
15. Kattwinkel J, Perlman J, Aziz K, et al. Neonatal resuscitation: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010; 122 (Suppl 3): 909–919.
16. Dargaville PA, Copnell B, Mills JF, et al. Randomized controlled trial of lung lavage with dilute surfactant for meconium aspiration syndrome. J Pediatr 2011; 158: e2383–e2389.
17. Dargaville PA, Copnell B, Mills JF, et al. Fluid recovery during lung lavage in meconium aspiration syndrome. Acta Paediatr 2013; 102: e90–e93.
18. Schilleman K, Witlox RR, Lopriore E. Leak and obstruction with mask ventilation during neonatal resuscitation. Arch Dis Child Fetal Neonatal Ed 2010; 95 : 398–402.
19. Finer N, Rich W, Wang C, et al. Airway obstruction during mask ventilation of very low birth weight infant during neonatal resuscitation. Pediatrics 2009; 123 : 865–869.
20. McCarthy LK, Twomey AR, Molloy EJ, et al. A randomized trial of nasal prong or face mask for respiratory support for preterm newborns. Pediatrics 2013; 132: e389–e395.
21. Kamlin CO, Schilleman K, Dawson JA, et al. Mask versus nasal tube for stabilization of preterm infants at birth: a randomized controlled trial. Pediatrics 2013; 132: e381–e388.
22. Hishikawa K, Goishi K, Fujiwara T, et al. Pulmonary air leak associated with CPAP at term birth resuscitation. Arch Dis Child Fetal Neonatal Ed 2015; 100: F382–F387.
23. Poets CF, Rüdiger M. Mask CPAP during neonatal transition: too much of a good thing for some term infants? Arch Dis Child Fetal Neonatal Ed 2015; 100: F378–F379.
24. Saugstad O, Ramji S, Vento M. Oxygen for newborn resuscitation: how much is enough? Pediatrics 2006; 118 : 789–792.
25. Poláčková R, Malý J, Pokorná P, et al. Řízená hypotermie v léčbě hypoxicko-ischemické encefalopatie. Neonatologické listy 2019; 25 : 39–43.
26. Rüdiger M, Braun N, Aranda J, et al. Neonatal assessment in the delivery room – trial to evaluate a specified type of Apgar (TEST-Apgar). BMC Pediatr 2015; 15 : 18.
27. Dalili H, Nili F, Sheikh M, et al. Comparison of the four proposed Apgar scoring systems in the assessment of birth asphyxia and adverse early neurologic outcomes. PloS One 2015; 10 (3): e0122116.
28. Hiu Yan Law B, Cheung P-Y, Aziz K, et al. Effect of COVID-19 precautions on neonatal resuscitation practice: a balance between healthcare provider safety, infection control, and effective neonatal care. Front Pediatr 2020; 8 : 478.
29. European Resuscitation Council (ERC). European Resuscitation Council COVID 19 guidelines [online]. ERC 2021 [cit. 8. 9. 2021]. Dostupné na: https://www.erc.edu/ sites/5714e77d5e615861f00f7d18/content_entry5ea884fa - 4c84867335e4d1ff/5ea885f34c84867335e4d20e/files/ERC_covid19_ pages.pdf?1588257310.
30. Sanchez-Ramos L, Cullough DM, Mitta M, et al. Does umbilical cord milking increase the risk of severe intraventricular hemorrhage in extreme preterm neonates? A multitreatment comparison. Am J Obstet Gynecol 2020; 223 (4): 590–592.
,31. Madar J, Roehr CC, Ainsworth S, et al. European Resuscitation Council guidelines 2021: Newborn resuscitation and support of transition of infants at birth. Resuscitation 2021; 161 : 291–326.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 7-
All articles in this issue
- A new strategy for the treatment of X-linked hypophosphatemic rickets
- Comparing creatinine-estimated and cystatin C-estimated glomerular filtration rates in children with a congenital solitary kidney
- Case study report: Don’t forget meningococcus
- Laryngomalacia – when to operate?
- The human microbiome and kidney diseases in children
- Non-surgical treatment of pectus excavatum in children
- Newborn resuscitation and support of transition of infants at birth 2021
- Stanovisko mezioborového panelu ČLS JEP ke strategii adaptace České republiky na epidemii onemocnění COVID-19
- Lekár, vedec, pedagóg – vzácne 85. životné jubileum profesora MUDr. Jána Buchanca, DrSc.
- Z histórie medicíny: Ebersov papyrus
- XXXIII. SLOVENSKO-POĽSKÉ VOJTEKOVE-RUDNIKOVE DNI DETSKEJ PNEUMOFTIZEOLÓGIE A IMUNOALERGOLÓGIE
- XXVI. Luhačovické pediatrické dny – správa z konferencie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laryngomalacia – when to operate?
- Newborn resuscitation and support of transition of infants at birth 2021
- Non-surgical treatment of pectus excavatum in children
- A new strategy for the treatment of X-linked hypophosphatemic rickets
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career