-
Medical journals
- Career
Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
Authors: J. Lebl; S. Koloušková; L. Toni; A. Kodýtková; S. A. Amaratunga; L. Plachý; Š. Průhová
Authors‘ workplace: Pediatrická klinika 2. lékařské fakulty UK a Fakultní nemocnice Motol, Praha
Published in: Čes-slov Pediat 2020; 75 (4): 219-226.
Category:
Overview
Syndrom Noonanové a podobné stavy, označované podle společné molekulární etiopatogeneze jako RASopatie, patří mezi časté vývojové syndromy s četností 1 : 1000 až 1 : 2500 živě narozených dětí. Dědí se autosomálně dominantně, ale až 60 % případů je sporadických v důsledku de novo vzniklé genové mutace. Mezi klinické projevy RASopatií patří především typický faciální fenotyp, opoždění růstu a postižení srdce, zejména pulmonální stenóza (50–60 %) a/nebo hypertrofická kardiomyopatie (20 %). Na diagnózu RASopatie můžeme pomýšlet u neprospívajících kojenců s vývojovým opožděním a makrocefalií a u růstově opožděných starších dětí s příznačnou facies a postižením srdce. V dospělosti dosahují muži se syndromem Noonanové výšky v průměru jen 162,5 cm, ženy 152,7 cm, a to v důsledku multifaktoriální růstové poruchy. Léčba růstovým hormonem, která zlepší dospělou výšku v průměru z -2,5 SD na -1,4 SD a tím významně zmírní výškový handicap, je od roku 2020 pro syndrom Noonanové schválena národními lékovými agenturami EU. O indikaci léčby u jednotlivých dětí rozhoduje dětský endokrinolog.
Klíčová slova:
syndrom Noonanové – RASopatie – pulmonální stenóza – hypertrofická kardiomyopatie – růst – růstový hormon
ÚVOD
Dětská kardioložka Dr. Jacquelina Noonanová představila v říjnu 1962 na Mid-Western Society for Pediatric Research Meeting v Cincinnati (Ohio, USA) nový syndrom. Uvedla, že postihuje ženy i muže a že mezi jeho příznaky patří vedle pulmonální stenózy také hypertelorismus, kryptorchismus a malý vzrůst. Zdůraznila, že svými příznaky připomíná Turnerův syndrom, ale nositelé mají normální karyotyp a v některých rodinách se syndrom dědí. V následujícím roce vyšlo její sdělení tiskem [1]. Pojem „syndrom Noonanové“ začal používat její žák, renomovaný genetik John Opitz [2]. Dr. Noonanová se tomuto označení dlouho vyhýbala, sama jej začala používat až od roku 1972 [3]. V roce 2001 byl identifikován první kauzální gen syndromu Noonanové – PTPN11 [4]. Postupně byly nalezeny další geny signalizační dráhy Ras/MAPK, jejichž patogenní varianty vedou ke spektru podobných fenotypů a způsobují buď syndrom Noonanové, nebo syndromy s podobnými klinickými projevy. Označují se „Noonan-like syndromy“, někdy také „onemocnění Noonanovského spektra“ nebo podle molekulární etiopatogeneze „RASopatie“. Vedle syndromu Noonanové řadíme mezi RASopatie kardio-facio-kutánní syndrom (CFC), syndrom Costellův, syndrom LEOPARD, syndrom Legius, Noonan-like syndrome with loose anagen hair a další jednotky. Vzhledem k molekulární etiopatogenezi se k RASopatiím volně přiřazuje také neurofibromatóza (Recklinghausenova nemoc), jejíž klinický obraz má významná specifika.
RASopatie jsou poměrně časté – postihují jedno z 1000 až 2500 živě narozených dětí. Při současné míře porodnosti v České republice to znamená, že se každoročně narodí cca 40–100 dětí s některou z RASopatií – ve většině případů se jedná o syndrom Noonanové. RASopatie jsou tedy častou syndromologickou příčinou růstové retardace a současně jednou z nejčastějších syndromologických příčin vrozené srdeční vady.
Všechny syndromy z okruhu RASopatií jsou monogenně podmíněné a dědí se autosomálně dominantně s kompletní penetrancí, ale variabilní expresivitou. Až 60 % případů je sporadických – jsou důsledkem de novo vzniklých patogenních genových variant. Tím začíná přenos nové varianty v rodině s rizikem pro potomky nositele varianty 50 %.
Vrozená vývojová porucha ze skupiny RASopatií se projeví zpravidla faciálním fenotypem, opožděním růstu a postižením srdce. Na diagnózu RASopatie můžeme pomýšlet u neprospívajících kojenců s vývojovým opožděním a makrocefalií a u růstově opožděných starších dětí s příznačnou facies a s postižením srdce [5].
Děti s RASopatiemi jsou typicky interdisciplinárními pacienty. Mohou primárně přijít k odborníkům několika různých pediatrických subspecializací a ti mohou být prvními, kdo na diagnózu pomyslí. Vzhledem k tomu, že jsou k dispozici kvalitní doporučení pro diagnostiku a terapii [6, 7], je včasné rozpoznání dětí s RASopatiemi výchozím předpokladem pro další optimální péči.
HLAVNÍ KLINICKÉ PŘÍZNAKY RASOPATIÍ/SYNDROMU NOONANOVÉ
Hlavní klinické příznaky RASopatií/syndromu Noonanové znázorňuje schematicky obrázek 1. Patří mezi ně zejména malý vzrůst, typický faciální fenotyp, deformita hrudníku a kardiovaskulární abnormity.
Image 1. Hlavní klinické příznaky RASopatií/syndromu Noonanové.
Fig. 1. Major clinical signs of RASopathies/Noonan syndrome.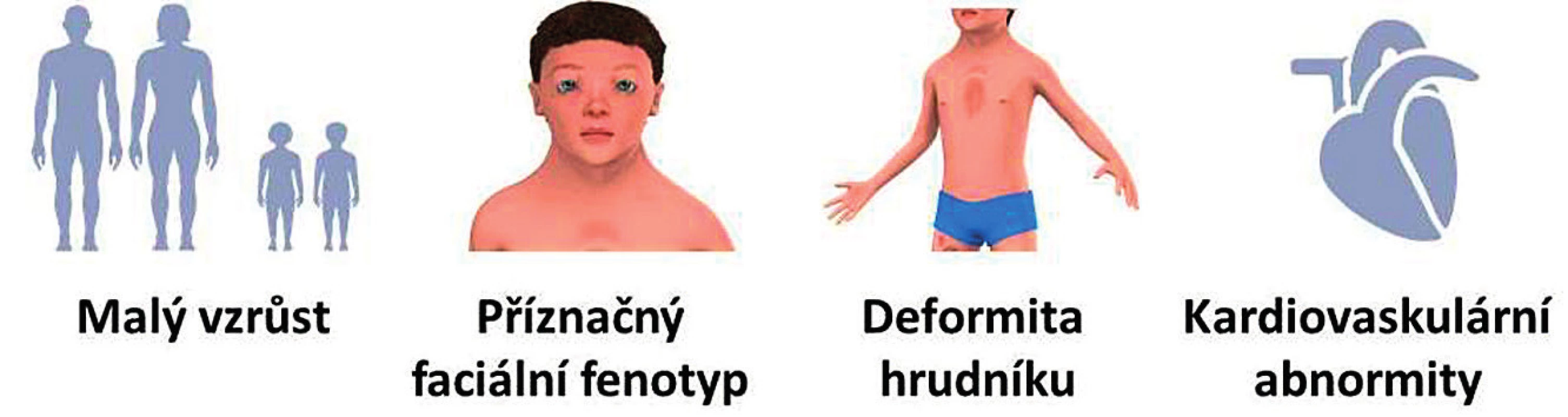
Růstový vzorec se odlišuje od růstového vzorce zdravých dětí ve všech fázích růstu a vývoje [8–11]:
- Porodní délka a hmotnost je snížena jen mírně (-1 SD), ale určitá míra intrauterinní růstové restrikce ke klinickým projevům nepochybně patří;
- Během 1. roku života ztrácejí tyto děti 1–1,5 SDS tělesné výšky. To svědčí pro nižší vydatnost postnatální fáze infantilní růstové periody;
- V průběhu dětství dochází k postupnému dalšímu poklesu tělesné výšky až do začátku puberty – i dětská fáze růstu je tedy nedostatečná;
- Puberta nastupuje u těchto dětí přibližně o 2 roky později;
- Dospělé výšky dosahují mladí lidé s RASopatiemi koncem 2. dekády života;
- Dospělí muži se syndromem Noonanové dosahují v průměru výšky 162,5 cm a ženy 152,7 cm – za předpokladu, že nebyli z hlediska růstu léčeni.
Většina dětí s RASopatiemi má nápadný faciální fenotyp.
Oči jsou často jasně modré nebo zelené – duhovka je méně pigmentovaná než odpovídá dané rodině a příslušné populaci (obr. 2). Může se vyskytnout jednostranná i oboustranná ptóza (obr. 3), mohou být přítomny epikanty.
Image 2. Nápadně modré oči u chlapce se syndromem Noonanové a patogenní variantou genu PTPN11. Oba rodiče mají oči hnědé.
Fig. 2. Strikingly bluish eyes in a boy with Noonan syndrome due to a pathogenic PTPN11 gene variant. In both parents, their eyes are brownish.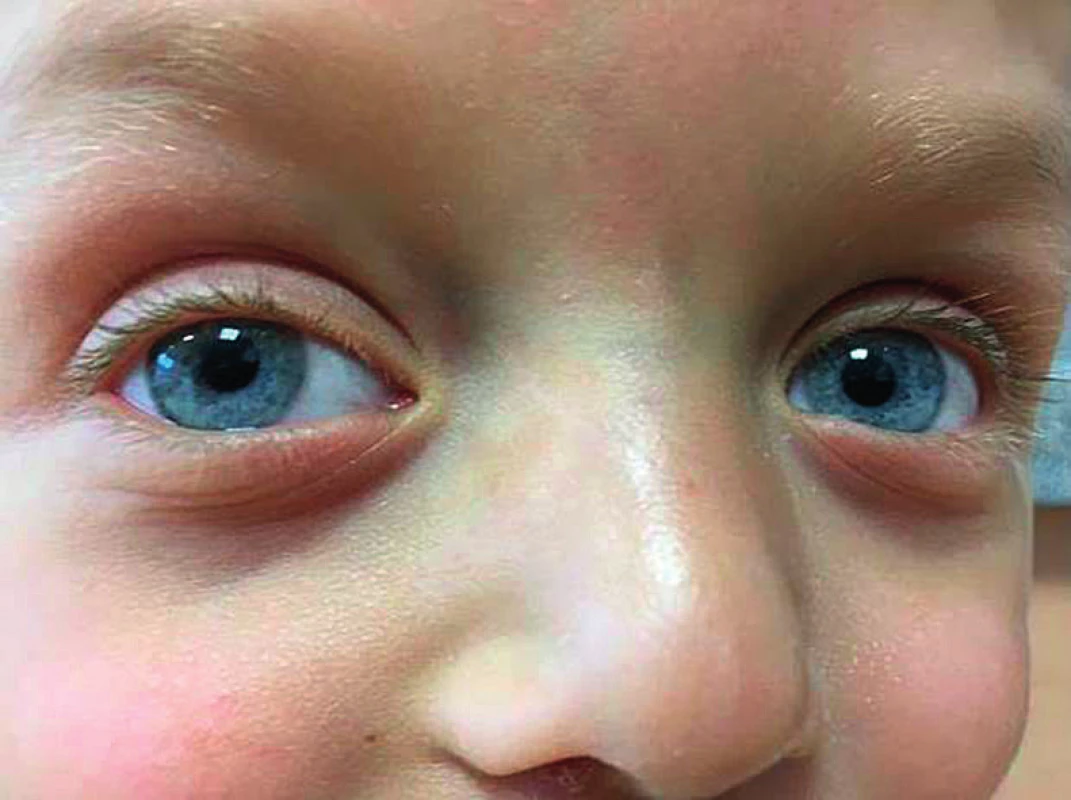
Image 3. Jednostranná ptóza u dívky s RASopatií na podkladě patogenní varianty genu SHOC2.
Fig. 3. Unilateral ptosis in a girl with RASopathy due to a pathogenic SHOC2 gene variant.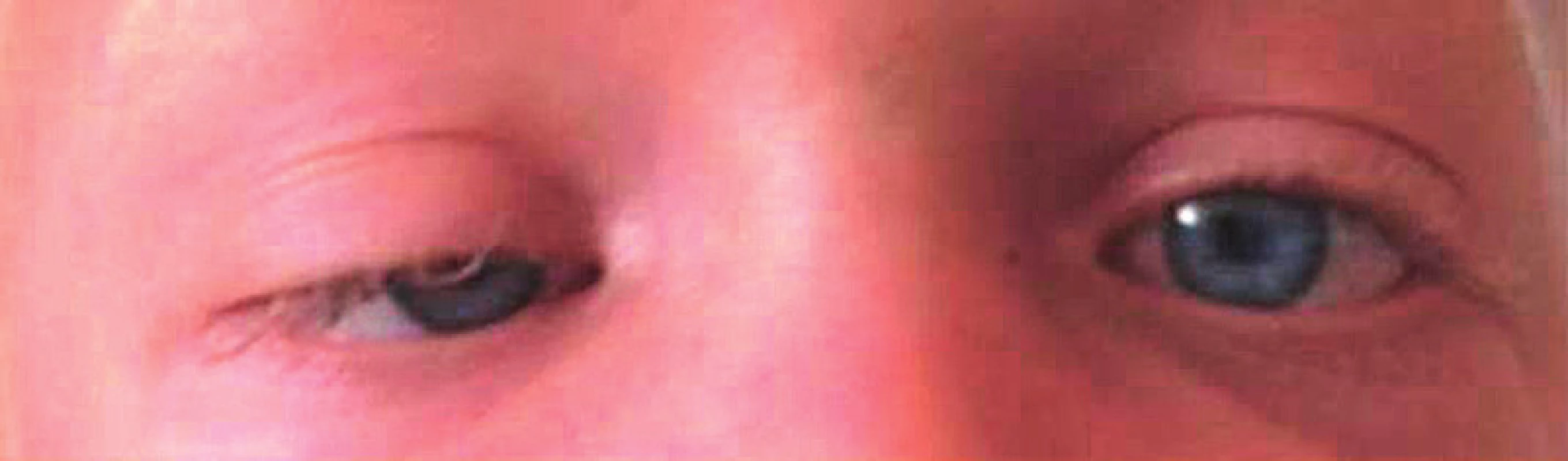
Ušní boltce bývají nízko posazené a většinou jsou rotované dozadu (obr. 4).
Image 4. Nápadně nízko posazené ušní boltce u dívky s patogenní variantou genu SHOC2.
Fig. 4. Apparently low-set ears in a girl with pathogenic SHOC2 gene variant.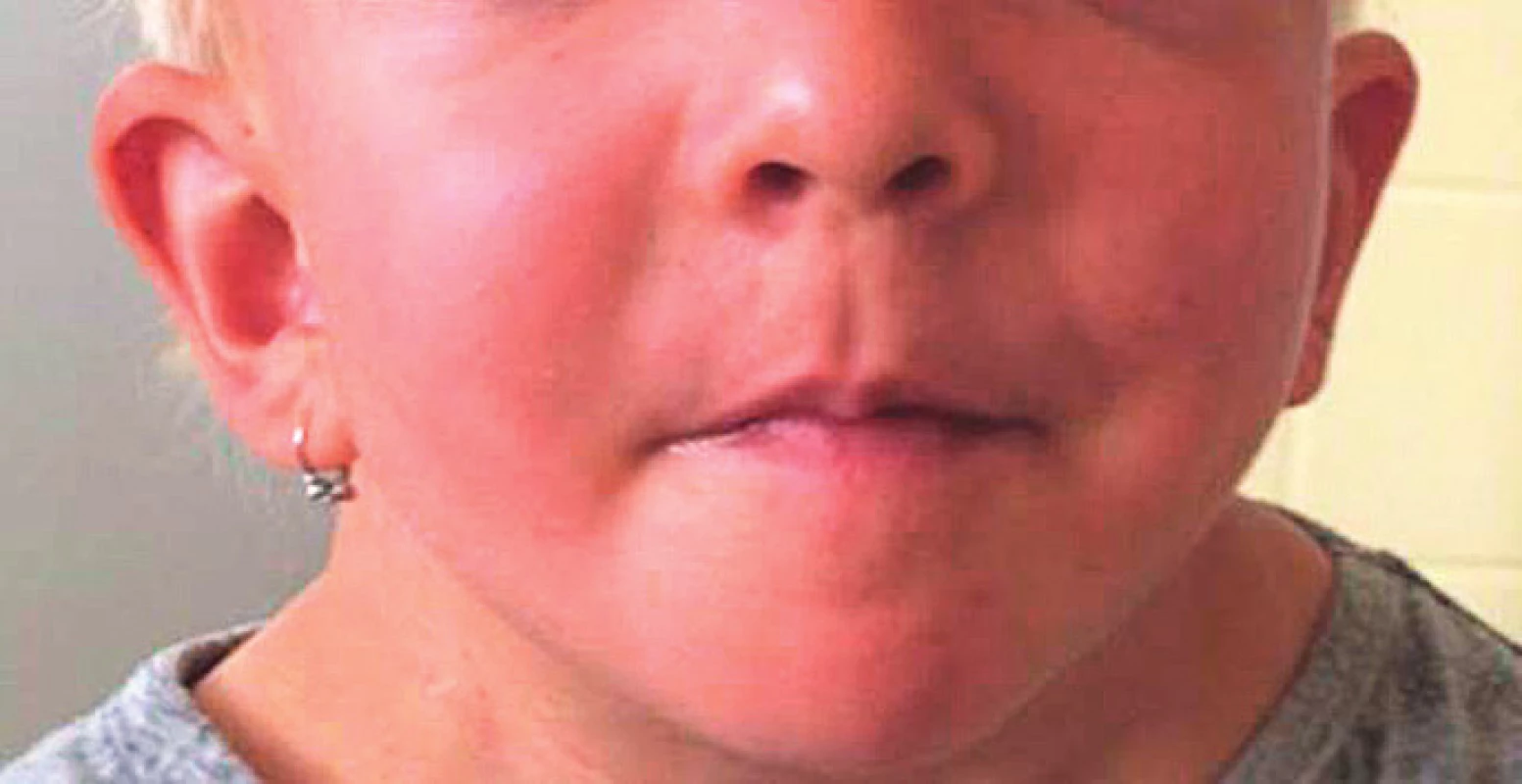
Malé děti s RASopatiemi/syndromem Noonanové mohou mít vpáčený kořen nosu a hluboce rýhované filtrum.
Kromě širokého čela je nápadná také konfigurace krku: U menších dětí je krk krátký, laterálně mohou být patrné kožní řasy. V adolescenci se krk prodlužuje, může přetrvávat pterygium coli, nebo může prominovat musculus trapezius.
Kardiální fenotyp schematicky znázorňuje obrázek 5. Více než 80 % dětí s některou z RASopatií má kardiovaskulární poruchu [6–8]. Téměř 25 % jich umírá v kojeneckém věku na selhání srdce. RASopatie jsou druhou nejčastější genetickou příčinou vrozených srdečních vad – prvenství patří trisomii 21. chromosomu a fenotypu Downova syndromu.
Image 5. Kardiální fenotyp u dětí s RASopatiemi/syndromem Noonanové. 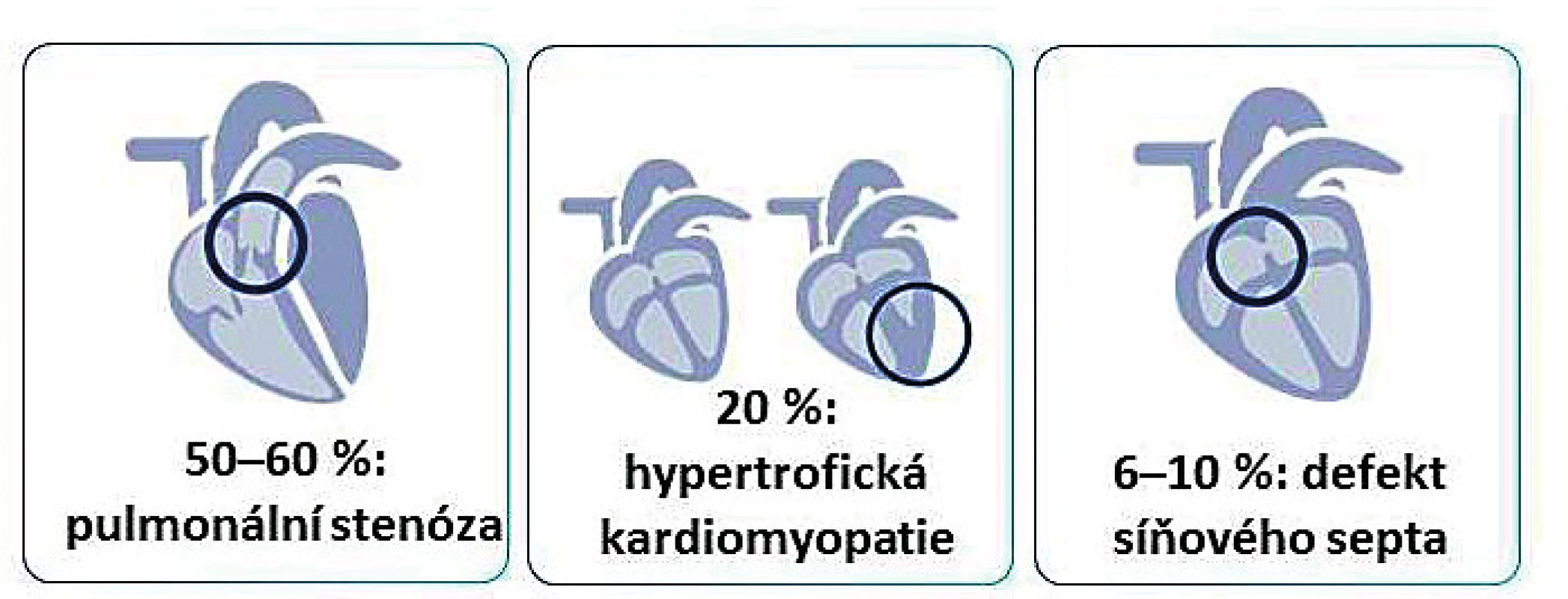
VAN DER BURGTOVA KRITÉRIA PRO KLINICKOU DIAGNOSTIKU SYNDROMU NOONANOVÉ
Van der Burgt vypracoval v roce 2007 klinická kritéria pro diagnostiku syndromu Noonanové [12]. Podle Van der Burgta hodnotíme šest parametrů – obličej, srdce, tělesnou výšku, konfiguraci hrudníku, rodinnou anamnézu a některé další klinické projevy (tab. 1).
Table 1. Van der Burgtova kritéria pro klinickou diagnostiku syndromu Noonanové [12]. Pro klinickou diagnózu syndromu Noonanové je určující jedno „hlavní“ kritérium (obvykle faciální dysmorfie) a jedno další „hlavní“ kritérium nebo dvě „vedlejší“ kritéria. ![Van der Burgtova kritéria pro klinickou diagnostiku syndromu
Noonanové [12]. Pro klinickou diagnózu syndromu Noonanové
je určující jedno „hlavní“ kritérium (obvykle faciální dysmorfie)
a jedno další „hlavní“ kritérium nebo dvě „vedlejší“ kritéria.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d72cc3057383f9584c6e980ee31888a2.png)
Ve všech položkách lze nález hodnotit jako „hlavní“ nebo jako „vedlejší“ příznak. Pro klinickou diagnózu je určující jeden „hlavní“ příznak (obvykle faciální dysmorfie) a jeden další „hlavní“ příznak nebo dva „vedlejší“ příznaky. Pozitivní rodinná anamnéza může tedy hrát v diagnostice velmi významnou úlohu.
MOLEKULÁRNÍ ETIOPATOGENEZE RASOPATIÍ
Signalizační cesta Ras/mitogen activated protein kinase (MAPK), zvaná zkráceně Ras/MAPK, je klíčovým regulátorem buněčného cyklu, diferenciace buněk, jejich růstu a zániku (obr. 6). Všechny tyto děje mají určující význam pro normální vývoj. Systém je ubikvitní – vyskytuje se v mnoha typech buněk. Úkolem Ras/MAPK signalizační kaskády je přenášet informaci mezi membránovým receptorem pro růstové faktory a buněčným jádrem. V buněčném jádře následně reguluje transkripci určitých genů – zejména genů zodpovědných za buněčnou proliferaci, migraci, diferenciaci a apoptózu [4, 6, 8, 13, 14]. Není proto nikterak překvapivé, že dysregulace tohoto systému závažně narušuje fyziologický vývoj. Z klinické zkušenosti je zřejmé, že systém se mimo jiné podílí na vývoji semilunárních srdečních chlopní a vývoji a růstu kostí.
Image 6. Schéma Ras/MAPK signalizační kaskády. Ras/MAPK signalizační kaskáda je ubikvitní komplexní nitrobuněčný systém, který přenáší informaci mezi membránovým receptorem pro růstové faktory a buněčným jádrem, kde řídí transkripci určitých genů. Schéma také znázorňuje vztah mezi geny a fenotypy – klinickými jednotkami ze skupiny RASopatií. Povšimněme si diverzity genů, které způsobují syndrom Noonanové, dvou genů zodpovědných za LEOPARD syndrom a čtyř genů spojených s CFC syndromem, zatímco neurofibromatóza 1. typu a Costellův syndrom jsou spojeny s patogenními variantami jediného genu. 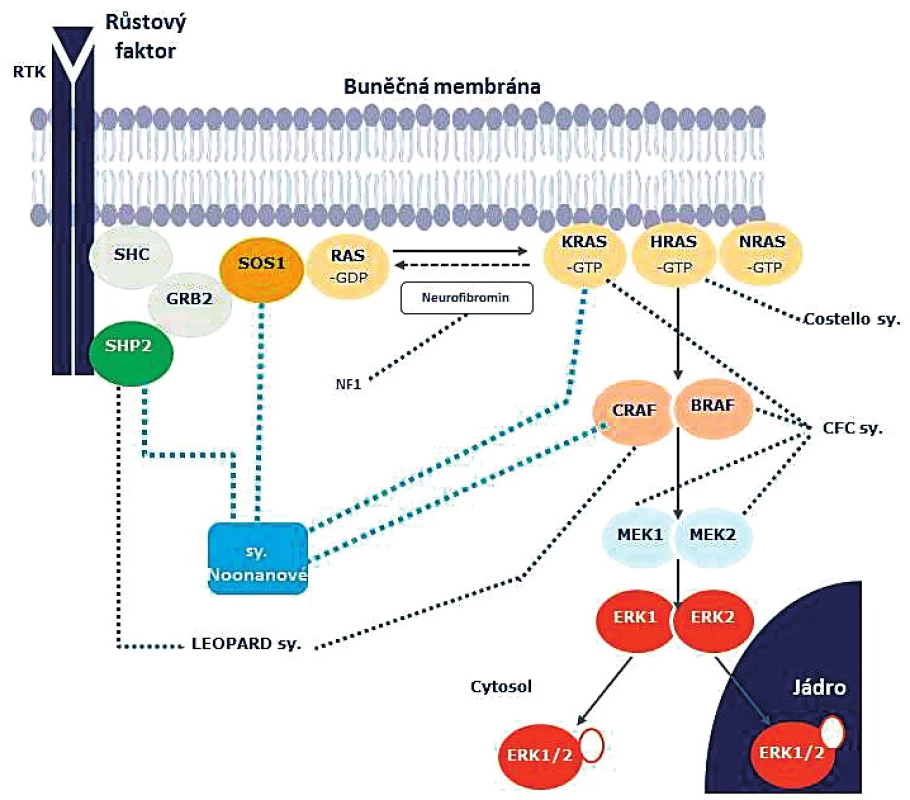
Celá skupina vývojových syndromů zvaných RASopatie je způsobena zárodečnými mutacemi genů, které kódují jednotlivé složky Ras/MAPK signalizační kaskády (obr. 6). Zpravidla se jedná o aktivační mutace, které zvyšují přenos signálu v průběhu Ras/MAPK dráhy – obvykle je ale přenos signálu akcelerován méně závažně než při somatických mutacích ve stejných genech, které vedou k onkogenezi [15].
První gen spojený se syndromem Noonanové – gen PTPN11 – byl identifikován téměř před 20 lety [4]. Následovaly objevy celé plejády dalších genů této kaskády, jejichž poruchy vedou k podobnému fenotypu, ve kterém lze klinicky ohraničit několik různých syndromů. Všechny fenotypicky spojuje faciální dysmorfie, srdeční vady, kožní příznaky, neurokognitivní opoždění a predispozice ke vzniku malignit. Přehled genů a jejich četnost v kauzalitě RASopatií a zejména syndromu Noonanové znázorňuje kruhový diagram na obrázku 7 [8, 13].
Image 7. Přehled genů Ras/MAPK signalizační kaskády, jejichž patogenní varianty vedou ke vzniku RASopatií/syndromu Noonanové. 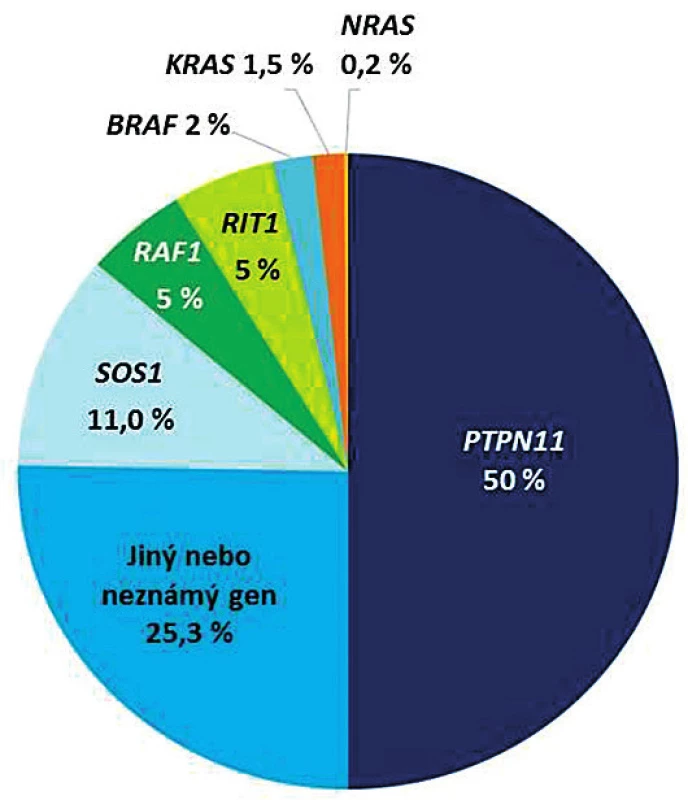
KORELACE GENOTYP-FENOTYP
I když se spektrum příznaků a celková fenotypická charakteristika u jednotlivých RASopatií do značné míry překrývá, vedou jednotlivé kauzální geny k určitým specifickým fenotypickým projevům v oblasti kardiální, růstové, neurovývojové i kožní symptomatologie. Shrnuje je tabulka 2. Některé příznačné faciální rysy spojené s jednotlivými kauzálními geny znázorňují fotografie pacientů na obrázku 8.
Image 8. Příznačný faciální fenotyp spojený s jednotlivými kauzálními geny.
Fig. 8. Typical facial phenotypes in children with individual causative genes.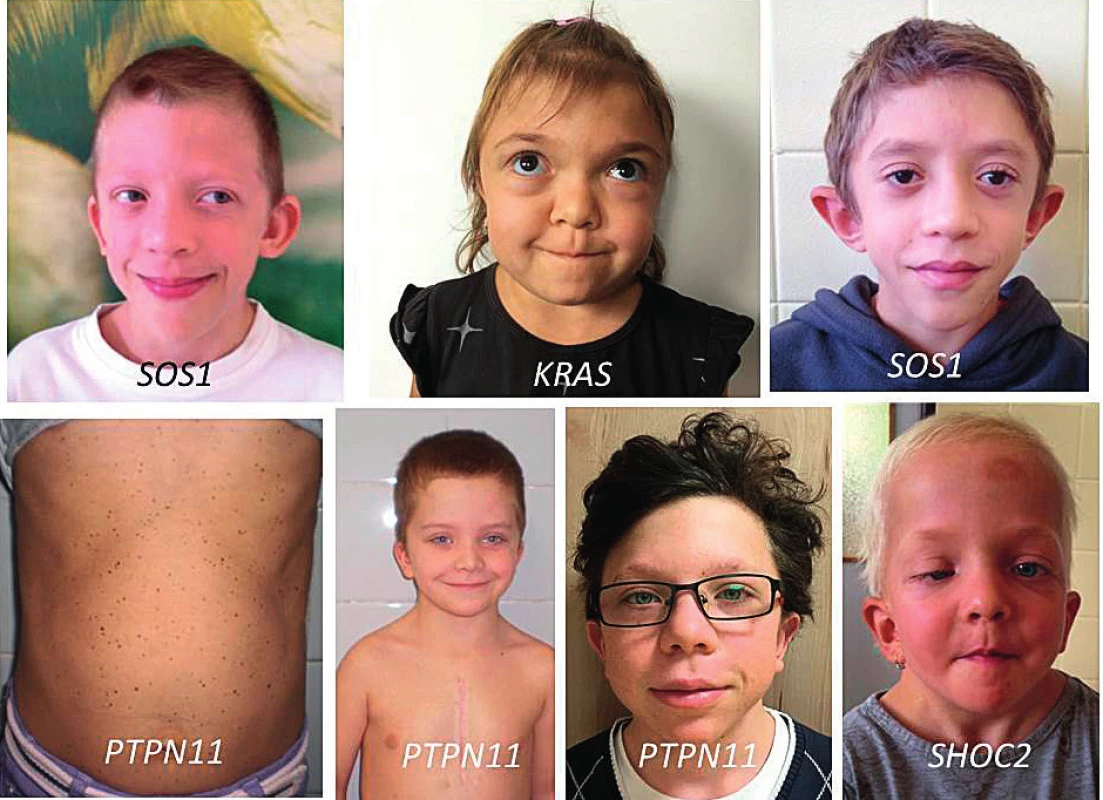
Table 2. Některé příznačné korelace mezi genotypem a fenotypem u RASopatií/syndromu Noonanové. (Upraveno dle [6, 7, 14]) ![Některé příznačné korelace mezi genotypem a fenotypem u RASopatií/syndromu Noonanové. (Upraveno dle [6, 7, 14])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1337e9c779fcfcfc1ad7d55684a45c07.png)
ASD – defekt síňového septa; CFC – kardio-facio-kutánní syndrom; GHD – deficit růstového hormonu; HCM – hypertrofická kardiomyopatie; MV – mitrální chlopeň; PS – pulmonální stenóza; VSD – defekt komorového septa RŮSTOVÁ PORUCHA U DĚTÍ S RASOPATIEMI/SYNDROMEM NOONANOVÉ
Růstová porucha je jedním z kardinálních příznaků syndromu Noonanové a ostatních RASopatií. Postihuje převážnou většinu pacientů.
Klinická zkušenost i publikované analýzy ukazují, že porucha růstu má u těchto dětí a dospívajících multifaktoriální etiologii. To souvisí s ubikvitním charakterem Ras/MAPK signalizační kaskády, která vstupuje do řady buněčných dějů a regulací. Porucha kaskády tak může nepříznivě ovlivnit několik etáží regulace růstu, které se mohou u jednotlivých pacientů s různou tíží kombinovat – od sekrece růstového hormonu, přes jeho účinek, až po úroveň nitrobuněčné regulace chondrocytu. Také proto jsou některá klinická pozorování u těchto dětí zdánlivě nekonzistentní [6, 7].
Abnormální růstový vzorec dětí s RASopatiemi je podrobně rozveden v oddílu pojednávajícím o hlavních klinických příznacích. Má svoji komponentu prenatální, infantilní, dětskou i pubertální. Sekrece růstového hormonu je u těchto dětí často abnormální, i když klasický deficit růstového hormonu nacházíme při stimulačních testech jen vzácně [16]. Děti s RASopatiemi mají často významně sníženou hladinu IGF-1, zejména pokud mají patogenní variantu PTPN11. Lze u nich tedy usuzovat na určitou rezistenci vůči růstovému hormonu [17] nebo na tzv. neurosekretorickou dysfunkci, kdy je možné ve stimulačním testu vytvořit relativně normální pík růstového hormonu, v reálném životě jsou ale píky nižší nebo málo četné.
Bylo prokázáno, že léčba růstovým hormonem zvyšuje hladinu IGF-1 a zlepšuje růstovou rychlost, a to nezávisle na tom, který gen nese patogenní variantu [18–20].
Souhrnná data z několika růstových studií ukázala, že léčba růstovým hormonem u syndromu Noonanové zlepší dospělou výšku o 9,5–13 cm u chlapců a o 9,0–9,8 cm u dívek [6, 21–24].
Růstový hormon jako lék pro léčbu malého vzrůstu u syndromu Noonanové byl poprvé zaregistrován a schválen v roce 2007 ve Spojených státech, odkud také pocházejí nejpočetnější sestavy dlouhodobě sledovaných dětí během rutinní léčby. Americká observační studie ANSWER shromažďuje data o léčbě růstovým hormonem u mnoha tisíc dětí, včetně 160 dětí se syndromem Noonanové [25]. Jedná se o „real-life“ pozorování, tedy sledování v rámci běžného léčení. Analýza změny tělesné výšky po jednom, dvou a pěti letech léčby růstovým hormonem ukázala, že tělesná výška stoupá z výchozí hodnoty v průměru -2,5 SD na hodnotu v průměru -1,4 SD – do pásma širší normy (obr. 9). Děti se syndromem Noonanové tedy reagují na dlouhodobé podávání růstového hormonu podobně jako děti narozené malé na svůj gestační věk (SGA) s přetrvávající malou postavou v dětství (SGA-SS) a jako dívky s Turnerovým syndromem – ve srovnání s Turnerovým syndromem je trend k normalizaci tělesné výšky po 5 letech léčby dokonce o něco výraznější.
Image 9. Změna tělesné výšky po léčbě růstovým hormonem u dětí v různých indikačních skupinách. Výsledky americké observační studie ANSWER. 
GHD – deficit růstového hormonu; HSDS – skóre směrodatné odchylky tělesné výšky; ISS – malá postava z neznámé příčiny (idiopathic short stature); NS – syndrom Noonanové; PWS – syndrom Pradera-Williho; SGA – děti malé na svůj gestační věk s přetrvávající malou postavou v dětství; TS – Turnerův syndrom V dalších letech byl růstový hormon registrován pro použití u syndromu Noonanové ve Švýcarsku a v Jižní Koreji (2008), v Izraeli (2011), v Brazílii (2016) a v Japonsku (2018). V Evropě byla první žádost o registraci podána k Evropské lékové agentuře (EMA) v roce 2007, ale byla odmítnuta s žádostí o doplnění dat o větším počtu pacientů ve více centrech a o doplnění echokardiografického sledování. Na počátku roku 2020 byla tato indikace schválena v Dánsku a postupem MRP (Mutual Registration Procedure) došlo v následujících dvou měsících ke schválení ve většině dalších zemí EU, včetně České republiky.
V České republice se i před schválením indikace některé děti se syndromem Noonanové růstovým hormonem léčily – ale jen díky tomu, že splnily kritéria pro léčbu z hlediska deficitu růstového hormonu nebo z hlediska intrauterinní růstové restrikce s postnatálním růstovým selháním (SGA-SS). V současné době je léčba v centrech k dispozici i pro ostatní pacienty se syndromem Noonanové, pokud léčbu malého vzrůstu potřebují. O potřebě léčby by měl rozhodnout dětský endokrinolog na základě tělesné výšky a růstové dynamiky.
Poznámka: Obrázky jsou publikovány se souhlasem zákonných zástupců dětí.
Problematiku genové podmíněnosti růstu řeší autoři s podporou grantů AZV č. 18-07-00283 a GAUK 340420 a 408120.
Prof. MUDr. Jan Lebl, CSc.
Pediatrická klinika 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: Jan.Lebl@lfmotol.cuni.cz
Sources
1. Noonan JA, Ehmke DA. Associated noncardiac malformations in children with congenital heart disease. J Pediatr 1963; 63 : 468–470.
2. Opitz JM. The Noonan syndrome. Am J Med Genet 1985; 21 : 515–518.
3. Millet BS. The history of Noonan syndrome. Pediatr Endocrinol Rev 2019; 16 (Suppl 2): 424–427.
4. Tartaglia M, Mehler EL, Goldberg R, et al. Mutations in PTPN11, encoding the protein tyrosine phosphatase SHP-2, cause Noonan syndrome. Nat Genet 2001; 29 : 465–468.
5. Breilyn MS, Mehta L. Clinical manifestations of Noonan syndrome and related disorders. Pediatr Endocrinol Rev 2019; 16 (Suppl 2): 428–434.
6. Romano AA, Allanson JE, Dahlgren J, et al. Noonan syndrome: clinical features, diagnosis, and management guidelines. Pediatrics 2010; 126 : 746–759.
7. Roberts AE, Allanson JE, Tartaglia M, et al. Noonan syndrome. Lancet 2013; 381 : 333–342.
8. Gaete X, Rodríguez F, Cassorla F. Growth hormone treatment for patients with Noonan syndrome. Pediatr Endocrinol Rev 2018; 16 (Suppl 1): 100–104.
9. Allanson JE. Noonan syndrome. J Med Genet 1987; 24 : 9–13.
10. Rogol AD, Hayden GF. Etiologies and early diagnosis of short stature and growth failure in children and adolescents. J Pediatr 2014; 164 (Suppl 5): S1–S14.
11. Ranke MB, Heidemann P, Knupfer C, et al. Noonan syndrome: growth and clinical manifestations in 144 cases. Eur J Paediatr 1988; 148 : 220–227.
12. Van der Burgt I. Noonan syndrome. Orphanet J Rare Dis 2007; 2 : 4.
13. Allen MJ, Sharma S. https://www.ncbi.nlm.nih.gov/books/NBK532269/.
14. Tidyman WE, Rauen KA. The RASopathies: developmental syndromes of Ras/MAPK pathway dysregulation. Curr Opin Genet Dev 2009; 19 : 230–236.
15. Liao J, Mehta L. Molecular genetics of Noonan syndrome and RASopathies. Ped Endocrinol Rev 2019; 16 (Suppl 2): 435–446.
16. Noordam C, van der Burgt I, Sweep CG, et al. Growth hormone (GH) secretion in children with Noonan syndrome: frequently abnormal without consequences for growth or response to GH treatment. Clin Endocrinol (Oxf) 2001; 54 : 53–59.
17. Binder G, Neuer K, Ranke MB, et al. PTPN11 mutations are associated with mild growth hormone resistance in individuals with Noonan syndrome. J Clin Endocrinol Metab 2005; 90 : 5377–5381.
18. Choi JH, Lee BH, Jung CW, et al. Response to growth hormone therapy in children with Noonan syndrome: correlation with or without PTPN11 gene mutation. Horm Res Paediatr 2012; 77 : 388–393.
19. Ferreira LV, Souza SA, Arnhold IJ, et al. PTPN11 (protein tyrosine phosphatase, nonreceptor type 11) mutations and response to growth hormone therapy in children with Noonan syndrome. J Clin Endocrinol Metab 2005; 90 : 5156–5160.
20. Binder G. Response to growth hormone in short children with Noonan syndrome: correlation to genotype. Horm Res 2009;72 (Suppl 2): 52–56.
21. Osio D, Dahlgren J, Wikland KA, et al. Improved final height with long-term growth hormone treatment in Noonan syndrome. Acta Paediatr 2005; 94 : 1232–1237.
22. Dahlgren J. GH therapy in Noonan syndrome: Review of final height data. Horm Res 2009; 72 (Suppl 2): 46–48.
23. Giacomozzi C, Deodati A, Shaikh MG, et al. The impact of growth hormone therapy on adult height in Noonan syndrome: a systematic review. Horm Res Paediatr 2015; 83 : 167–176.
24. Noonan JA, Kappelgaard AM. The efficacy and safety of growth hormone therapy in children with Noonan syndrome: a review of the evidence. Horm Res Paediatr 2015; 83 : 157–166.
25. Lee PA, Ross JL, Pedersen BT, et al. Noonan syndrome and Turner syndrome patients respond similarly to 4 years‘ growth-hormone therapy: longitudinal analysis of growth-hormone-naïve patients enrolled in the NordiNet® International Outcome Study and the ANSWER Program. Int J Pediatr Endocrinol 2015; 2015 (1): 17.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 4-
All articles in this issue
- Dětský růst v zrcadle času – a věčný třetí percentil
- Data analysis of REPAR – country-wide register of growth hormone treatment recipients
- The role of acid-labile subunit (ALS) in aetiology and diagnostic procedures of short stature
- Noonan syndrome and other RASopathies: Aetiology, diagnostic procedures and therapy
- Noonan syndrome from a paediatric cardiologistˇs perspective
- Prenatal phenotype of RASopathies
- Etiology and diagnostic approach of growth failure in children born small for gestational age (SGA) with persistent short stature in childhood (SGA-SS)
- Growth databases and registries – towards understanding physiological effects of growth hormone
- Growth disorder in 11-year-old girl with diabetes
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Noonan syndrome and other RASopathies: Aetiology, diagnostic procedures and therapy
- Etiology and diagnostic approach of growth failure in children born small for gestational age (SGA) with persistent short stature in childhood (SGA-SS)
- Noonan syndrome from a paediatric cardiologistˇs perspective
- Prenatal phenotype of RASopathies
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

