-
Medical journals
- Career
Prenatální fenotyp RASopatií
Authors: J. Pavlíček 1,2
Authors‘ workplace: Klinika dětského lékařství, Fakultní nemocnice Ostrava, Lékařská fakulta Ostravské univerzity, Ostrava 1; Centrum biomedicínského výzkumu FN Hradec Králové 2
Published in: Čes-slov Pediat 2020; 75 (4): 232-238.
Category:
Overview
RASopatie je skupina syndromů, které jsou způsobeny zárodečnými mutacemi v genech, které kódují složky signální dráhy RAS/MAPK. Tato cesta je klíčem k regulaci buněk, jejich proliferaci, diferenciaci a přežití. Pro velkou heterogenitu fenotypových projevů převládala v posledních letech klinická diagnóza RASopatií po narození, prenatální detekce těchto syndromů je ale možná. Hlavní úlohu při stanovení fetální diagnózy hraje ultrazvukové vyšetření plodu během screeningových testů. Mezi typické společné znaky a indikační kritéria pro molekulární sekvenování na RASopatie patří patologická hodnota šíjového projasnění, rozšíření lymfatických jugulárních váčků, vývoj cystického hygromu, výpotky nebo fetální hydrops, polyhydramnion, vrozené srdeční vady a patologie ledvin. Při patologickém výsledku prenatálního screeningu je, i při normálních výsledcích karyotypu, vhodné další ultrazvukové a genetické došetření plodu.
Klíčová slova:
Noonanové syndrom – prenatální screening – RASopatie – šíjové projasnění
ÚVOD
RAS je součástí malých GTPáz, které regulují buněčný růst, proliferaci, diferenciaci a přežívání buněk. RAS/ /MAPK (RAS/mitogen-activated protein kinase) signální dráha je pak klíčová cesta, která ovlivňuje výše uvedené buněčné vlastnosti. RASopatie nebo RAS/MAPK syndromy je skupina překrývajících se genetických jednotek, jejichž příčinou jsou zárodečné mutace v jednotlivých genech, které kódují tuto dráhu. Skupina onemocnění, které do RASopatií řadíme, se stále rozšiřuje, v současnosti sem patří: Noonanové syndrom (NS) (mutace v genech PTPN11, SOS1, RAF1, KRAS, BRAF, SHOC2, MEK1, NRAS), Costellův syndrom (mutace v HRAS), LEOPARD syndrom dnes nazývaný Noonanové syndrom s mnohočetnými lentigy – Noonan syndrome with multiple lentigines (mutace v PTPN11, RAF1), hereditární gingivální fibromatóza – hereditary gingival fibromatosis (mutace v SOS1), Kardio-facio-kutánní (CFC) syndrom – cardio-facio-cutaneous (CFC) syndrome (mutace v BRAF, KRAS, MAP2K1, MAP2K2), Neurofibromatóza-Noonanové syndrom –Neurofibromatosis-Noonan syndrome (mutace v NF1), Noonanové syndrom s řídkými vlasy – Noonan-like syndrome with loose anagen hair (mutace v PTPN11 a RAF1) a některé další syndromy, jako Watsonův, CBL nebo Jaffe Campanacci. Postupně se přidávají další jednotky jako: NF1 podobný syndrom vlivem haploinsuficience NF1 – NF1-like syndrome caused by haploinsufficiency, Legius syndrom (SPRED1), Noonanové podobný syndrom vlivem mutace v SHOC220 – Noonan-like syndrome caused by mutations in SHOC220, syndrom kapilárních a arterio-venózních malformací vlivem haploinsuficience genu RASA1 – capillary malformation–arteriovenous malformation caused by haploinsufficiency of RASA1 a rozšiřuje se počet nalezených mutací v genech, jako jsou RIT1, RRAS, RASA2, A2ML1, SOS2 a LZTR1 [1]. Přestože má každý syndrom unikátní fenotyp, tak se tyto jednotky překrývají řadou klinických rysů. Společným jmenovatelem je kraniofaciální dysmorfismus, kardiovaskulární patologie, muskuloskeletální postižení, opoždění psychomotorického vývoje a postižení kognitivních funkcí, kožní léze a zvýšená pravděpodobnost vzniku nádorových onemocnění. Z pohledu dětské kardiologie je podstatné, že větší část pacientů má srdeční postižení, které je po stigmatizaci nejčastějším příznakem této skupiny onemocnění. Již při prvním popisu suspektního nového syndromu americká kardioložka Jacquelin A. Noonanová popsala syndrom podobný Turnerovu, zásadně se lišily ale typy vad; zatímco u Turnerova syndromu převažují levostrané obstrukce typu vad aortální chlopně, aortálního ablouku a koarktace aorty, u RASopatií převažovaly a převažují vady plicnice a výtokového traktu pravé komory [2].
Prevalence RASopatií je odhadována na 1 : 700 až 1 : 1250 živě narozených [3]. Nejčastější RASopatií je NS s incidencí 1 : 1000 až 1 : 2500 a nejčastější mutací v genu PTPN11 s častými kardiálními patologiemi a mutacemi v SOS1 s projevy poruchy růstu, kostních a kožních změn [4]. Mutace ve výše uvedených genech se pak v různé míře podílí i na ostatních syndromech. Překrývající se klinické znaky mohou být obtížné pro finální diagnostiku, při klinickém podezření hraje klíčovou roli genetické došetření a molekulární analýza. Postnatální fenotyp jednotlivých RASopatií je v současnosti poměrně dobře znám, diagnostika se v populaci zvyšuje a rozšiřují se panely genů pro molekulární detekci.
RASopatie mohou mít již prenatální projevy a fetální fenotypy jednotlivých syndromů jsou opakovaně studovány. Prenatální diagnostika se nejčastěji opírá o ultrazvukové vyšetření plodu při jednotlivých screeningových prohlídkách těhotné ženy. Nejlépe jsou popsány možnosti fetální diagnostiky u NS, postupně se ale objevují fetální studie nebo kazuistiky i u ostatních syndromů.
PRINCIP FETÁLNÍHO SCREENINGU V ČR
V současnosti se sledování plodu během gravidity opírá o jednotlivá trimestrální vyšetření. V prvním trimestru je každé těhotné ženě nabídnuto hodnocení rizika chromosomálních aberací, které spočívá v posouzení věku matky, zhodnocení anamnézy, měření šíjového projasnění plodu, vyšetření volné β-podjednotky lidského choriogonadotropinu (hCG) a těhotenského plazmatického proteinu (PAPP-A) v séru matky. Těhotenství je přesně datováno změřením temeno-kostrční délky plodu, tento kombinační prvotrimestrální screening by měl být proveden mezi 11+0 až 13+6 týdnem gravidity. Výsledkem screeningu je stanovení rizika nejčastějších trisomií a při vysokém riziku je možné těhotné ženě nabídnout invazivní došetření a karyotypizaci plodu odběrem choriových klků nebo plodové vody, nebo neinvazivním prenatálním testováním – odběrem krve matky a vyšetřením volné fetální DNA. Rizika genetických aberací je možno upřesnit vyšetřením ultrazvukových „soft markerů“ plodu, ke kterým patří: hodnocení průtoků v ductus venosus, detekce trikuspidální regurgitace, hodnocení přítomnosti nebo absence nosní kůstky. Tento systém screeningu byl vyvinut pro odhalení nejčastějších lidských trisomií (trisomie 13, 18, 21) a není schopen detekovat vzácnější aberace. V současnosti je dokonce kladen větší důraz na podrobnější ultrazvukové vyšetření plodu a identifikaci dalších morfologických patologií, které mohou odhalit jiné typy genetického postižení plodu.
Druhotrimestrální vyšetření je ultrazvukové a proběhne většinou mezi 18.–22. týdnem. Cílem je znovu vyšetřit morfologii plodu a vyloučit orgánové patologie, z pohledu genetických vázaných abnomalit existují i v tomto trimestru patologie, které mohou podpořit jejich diagnostiku, jako jsou vady mozku, rozštěpové vady a morfologické odchylky obličeje, srdeční vady, vady gastrointestinální a urogenitální soustavy.
Ve třetím trimestru je ultrazvukově posouzena funkce fetoplacentární jednotky, sledován růst plodu, v současnosti je snahou identifikovat eventuální růstovou retardaci a stanovit management závěru gravidity i takto postiženého plodu. V této části gravidity může být rovněž sledován vývoj a stav patologií, které byly zjištěny při předchozích vyšetřeních. Těhotná žena s patologickým plodem nebo jinými riziky je zařazena do rizikové poradny a porod je veden na specializovaném pracovišti.
SPOLEČNÉ FETÁLNÍ ZNAKY RASOPATIÍ
Stanovení podezření na RASopatii v antenatálním období se opírá o některé morfologické známky, které jsme schopni identifikovat při ultrazvukovém vyšetření plodu. Společným patologickým znakem pro tato onemocnění je patologická hodnota šíjového projasnění –nuchální translucence (NT), cystický hygrom, rozšíření jugulárních lymfatických váčků, pleurální výpotky, ascites, povšechný hydrops, polyhydramnion, vrozená srdeční vada a renální abnormality. Zásadní roli hraje hodnocení NT plodu, které patří do základního schématu prvotrimestrálního screeningu a mělo by být provedeno u každého plodu. Jde o změření množství volné tekutiny (tloušťky kožní řasy) v záhlaví plodu a úspěšnost změření v tomto období je téměř 100% (obr. 1).
Image 1. Měření šíjového projasnění (NT) a jeho patologická hodnota.
Fig. 1. Measurement of nuchal translucency (NT) and its pathological value.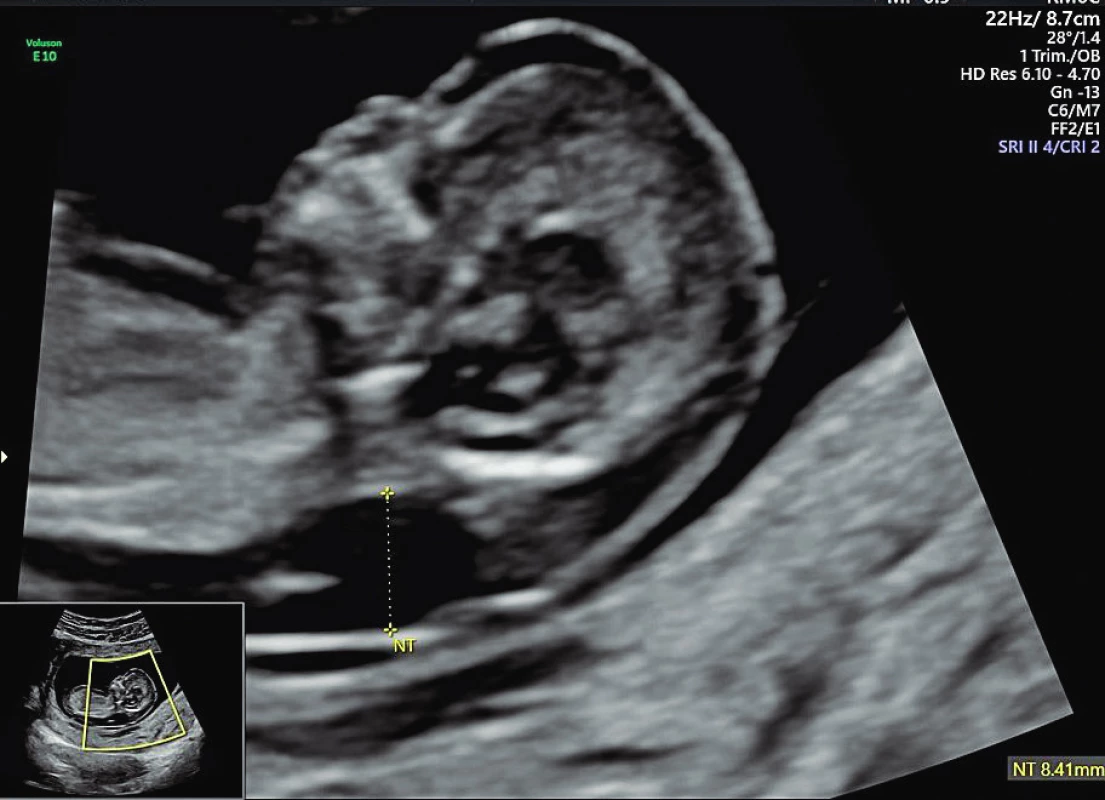
Vyšetření NT bylo původně navrženo pro screening Downova syndromu, později byla zjištěna vazba patologické hodnoty NT na další chromosomální a strukturální abnormity a význam NT rostl. Dnes spojujeme vyšší hodnotu NT se srdečními vadami, plicními abnormitami, defekty břišní stěny a brániční kýlou, patologiemi centrální nervové soustavy, skeletálními abnormalitami. Možné je spojení s metabolickými a hematologickými patologiemi plodu nebo s fetální infekcí. V prvním trimestru vždy hovoříme o šíjovém projasnění, v druhém trimestru pak popisujeme nuchální edém nebo vývoj cystického hygromu. S rostoucí hodnotou NT roste riziko genetických onemocnění včetně možné RASopatie. Hraniční hodnota NT je obecně 2,5 mm, v našich podmínkách vyjadřujeme patologii jako hodnotu nad 95. percentilem. Patologické šíjové projasnění se u RASopatií často spojuje s rozšířenými jugulárními lymfatickými váčky, jejichž dilatace je pravděpodobně způsobena hypoplastickými nebo aplastickými lymfatickými cévami s porušenou lymfatickou drenáží. Častou známkou těchto genetických onemocnění je přítomnost výpotku, ať už v lokalizované formě jako perikardiální, pleurální nebo břišní kolekce tekutiny, případně dojde k vývoji povšechného hydropsu plodu. U části plodů s RASopatiemi je identifikována srdeční patologie, nejčastěji jako vada v oblasti plicnice nebo jako hypertrofická kardiomyopatie. Z renálních abnormalit jde nejčastěji o rozšíření kalichopánvičkového systému ledvin. Nejčastějším extrakardiálním společným znakem je polydramnion, detekovatelný v kterékoliv fázi gravidity.
Podrobný fetální fenotyp RASopatií je nejlépe prostudován u syndromu Noonanové a u Kardio-facio-kutánního a Costellova syndromu.
FETÁLNÍ FENOTYP SYNDROMU NOONANOVÉ
Prenatální diagnostika NS je nejlépe propracována z celé skupiny RASopatií. Vedoucím znakem je patologie NT a dále rozlišujeme hlavní a vedlejší fetální známky NS. Mezi hlavní známky patří: rozšíření lymfatických jugulárních váčků, cystický hygrom, hydrothorax, ascites, celkový hydrops plodu, pulmonální stenóza, hypertrofická kardiomyopatie, polyhydramnion, renální abnormity (obr. 2, 3, 4). Pro podezření na fetální diagnózu postačuje patologická hodnota NT a jeden hlavní příznak. Mezi vedlejší příznaky, které podporují možnou diagnózu NS, pak patří: anomálie končetin (syndaktylie, krátké femury), faciální stigmatizace (malý nos, šikmé čelo, brachycefalie, nízké posazení uší) a některé méně typické srdeční vady (defekt komorového septa, defekt atrioventrikulárního septa nebo Fallotova tetralogie). Význam zejména extrakardiálních morfologických patologií nyní stoupá pro možnosti ultrazvukového 3D/4D zobrazení.
Image 2. Fetální hypertrofická kardiomyopatie s perikardiálním výpotkem.
Fig. 2. Fetal hypertrophic cardiomyopathy with pericardial effusion.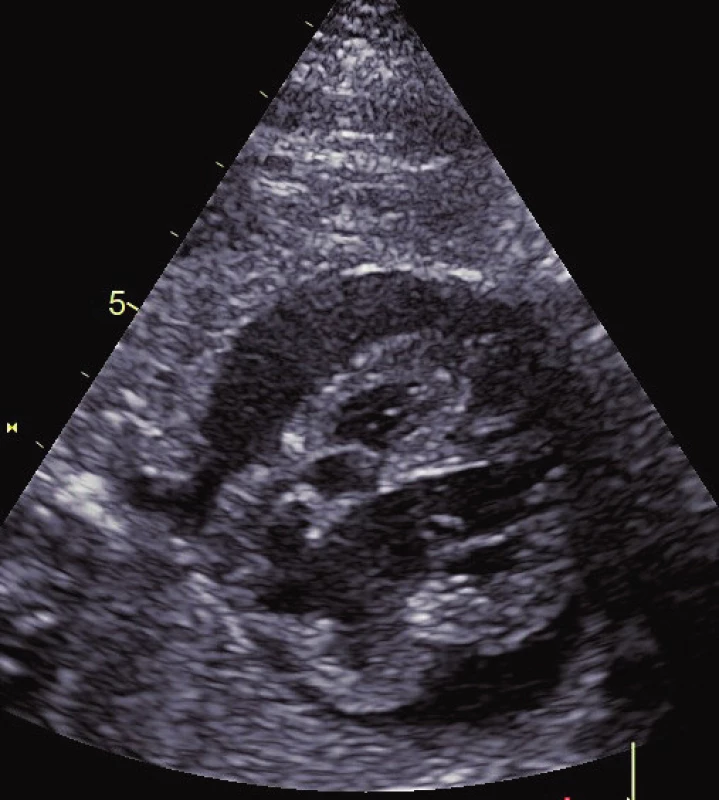
Image 3. Fetální pleurální výpotek.
Fig. 3. Fetal pleural effusion.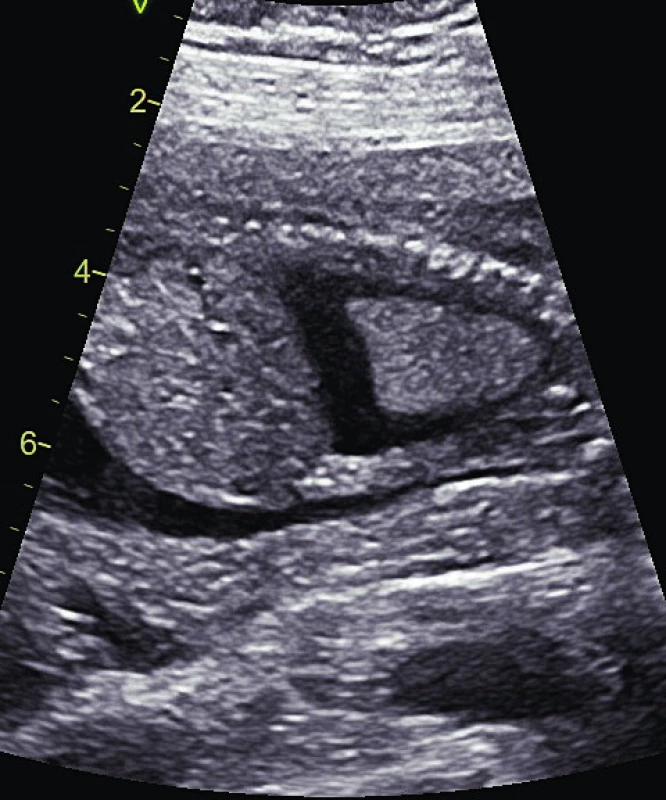
Image 4. Fetální hydronefróza.
Fig. 4. Fetal hydronephrosis.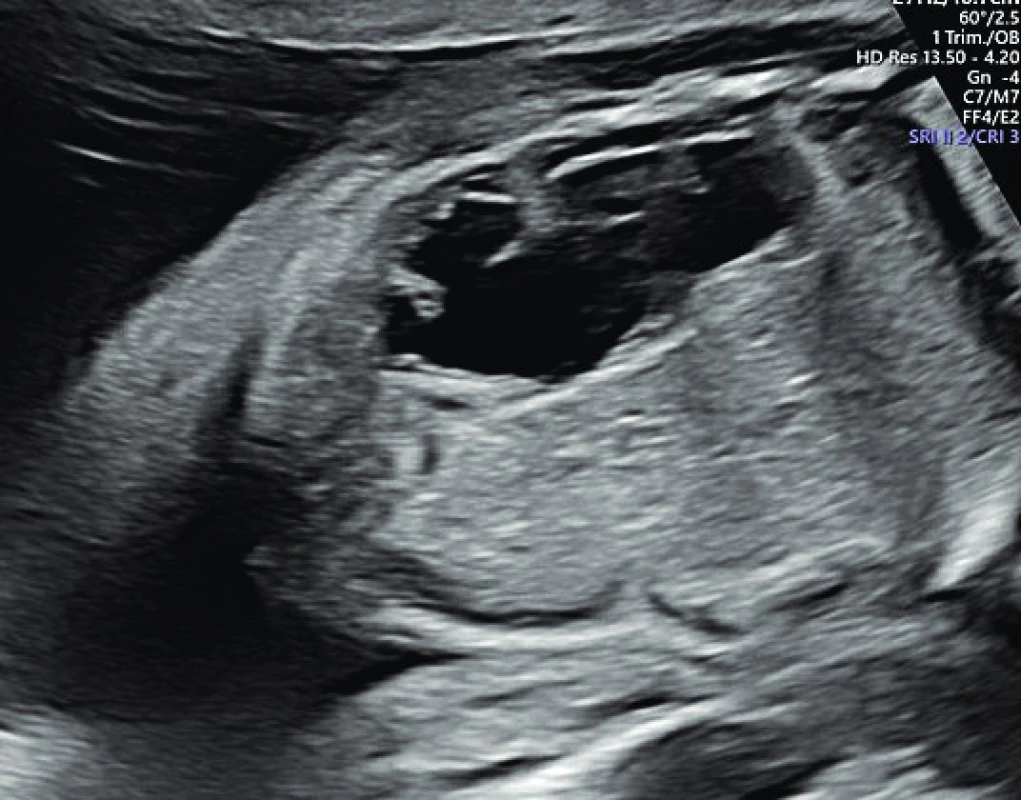
Pro dětského kardiologa je podstatné, že 60–70 % plodů a dětí s NS má vrozenou srdeční vadu a přítomnost srdečního defektu a patologické NT hodnoty nebo cystického hygromu jsou velmi silnou indikací pro prenatální testování NS [5]. Typickou srdeční vadou pro NS je stenóza plicnice nebo hypertrofická kardiomyopatie, které jsou přítomny izolovaně nebo v kombinaci. Možný je výskyt méně častých vad pro RASopatie, jako jsou defekt síňového, atrioventrikulárního a komorového septa, Fallotova tetralogie, postižení aortální chlopně nebo koarktace aorty [6]. Detekce VSV je ale v I. trimestru omezená, zobrazení celé srdeční anatomie se obvykle pro velikost, polohu a echogenní podmínky matky nepodaří a z pohledu prenatální kardiologie definitivní poradenství většinou není možné. Ve II. trimestru by již výtěžnost detekce VSV měla být při použití standardizovaného postupu vysoká [7]. Limitací je, že pulmonální stenóza se morfologicky ve 2D obraze projeví jen v těžkých formách při alteraci pravé komory, k přesné diagnostice valvárního, supravalvárního nebo subvalvárního postižení je nutno použít dopplerovské techniky. U významné pulmonální stenózy je identifikovatelná hypertrofie pravé komory, která může být normální velikosti, dilatuje nebo se naopak vyvíjí její hypoplazie.
Druhou nejčastější kardiální patologií u NS je hypertrofická kardiomyopatie, která je ale raritně diagnostikována v I. trimestru a vyvíjí se až v pozdějších fázích gravidity, přesto je možné při fetálním podezření na NS opakovaně biometrii myokardu měřit a posuzovat eventuální vývoj k patologickým hodnotám. Kompletní defekt atrioventrikulárního septa a fallotovské vady jsou jednoznačně fetálně ve II. trimestru detekovatelné. Defekt síňového a komorového septa má diagnostické limitace pro vlastnosti fetoplacentární cirkulace.
Srdeční vada je u RASopatií po stigmatizaci nejčastější orgánovou známkou a přesto, že screening VSV je v ČR velmi dobře propracován a organizován, tak včasná diagnostika VSV u RASopatií zatím selhává a obě typické vady pro NS (pulmonální stenóza a kardiomyopatie) jsou identifikovány až ve III. trimestru nebo po narození [8, 9]. Fetálně je diagnostikováno pouze okolo 10 % VSV spojených s NS [4].
FETÁLNÍ FENOTYP KARDIO-FACIO-KUTÁNNÍHO SYNDROMU
Kardio-facio-kutánní syndrom (CFCS, cardio-facio-cutaneous syndrome) je na rozdíl od NS velmi vzácný, incidence je uváděna okolo 1 : 800 000 [10]. Postnatálně se projevuje smíšenými příznaky stejně jako ostatní RASopatie, dominuje ale faciální stigmatizace, kožní příznaky, srdeční defekty a zpomalení růstu. Pro tento syndrom je typický faciální dysmorfismus s makrocefalií, širokým čelem, hrubými rysy, krátkým nosem se širokým kořenem, hypertelorismem a s nízko posazenými ušními boltci – a právě faciální stigmata v popředí s makrocefalií lze využít i v prenatální diagnostice. Vedoucí fetální příznaky jsou stejné jako u ostatních RASopatií, diagnostika se většinou odvíjí od patologické hodnoty NT nebo zjištění cystického hygromu, často ve spojení s polyhydramnionem [11]. Na CFCS můžeme upřesnit podezření při fetálním nálezu makrosomie plodu a makrocefalie s relativně krátkými femury. V současnosti je v gynekologických ordinacích dostupné 3D/4D vyšetření, které může zpřesnit faciální obraz plodu, doporučuje se zaměření na čelo, postavení očí a uší, tvar nosu a rtů, filtrum, bradu, jazyk a patro. Ve 3D/4D obraze je obraz faciální stigmatizace někdy velmi přesvědčivý, při vyšetřování zkušeným UZ specialistou je možno tuto sadu obličejových parametrů používat k další specifikaci genetické diagnózy [12]. Nicméně diagnóza faciální stigmatizace zůstane obtížná, limity bude stáří gravidity, echogenita těhotné ženy a poloha plodu, známá je také proměnlivost obličeje během vývoje těhotenství jak u fyziologických, tak i u genetických postižených plodů. I u CFCS se již fetálně vyskytují srdeční abnormality, stejně jako u NS stenóza plicnice a hypertrofická kardiomyopatie a renální abnormity, které mohou podpořit diagnózu RASopatie [13]. Dalším podpůrným příznakem je patologie mozku ve smyslu ventrikulomegalie nebo hydrocefalu. V souhrnu lze říci, že na prenatální případ CFCS myslíme při nálezu polyhydramnionu spojeného s makrosomií, makrocefalií s paradoxním zkrácením stehenních kostí a při přítomnosti srdečních, ledvinových a lymfatických abnormalit [14].
COSTELLŮV SYNDROM
Costellův syndrom s dokázanou jedinou mutací v genu HRAS a s odhadovanou incidencí 1 : 380 000 je rovněž populačně vzácný, prenatální kazustiky ale již byly opakovaně publikovány. Postnatálně je fenotypicky pacient s dysmorfními kraniofaciálními rysy, menší postavou, hypotonií, ulnární deviací zápěstí a prstů, kožními patologiemi typu papilomu, volnou kůží, jsou přítomny srdeční vady, vady centrální nervové soustavy, oftalmologické abnormity, je riziko vzniku maligních nádorů, vývoj psychomotorické retardace. Novorozenci se často rodí předčasně. Časným postnatálním rizikem jsou arytmie typu fokálních chaotických síňových dysrytmií, hypoglykémie, laryngomalacie s obstruktivním dýcháním, renální selhání, typické jsou potíže s krmením u kojenců a batolat.
Prenatálně existují tři hlavní známky: polyhydramnion, fetální nadměrný růst, relativní makrocefalie [16]. Polyhydramnion komplikuje přibližně 1 % gravidit, u CS bývá ale významný a nápadný, zdůvodňuje se hypotonií v oblasti horní trávicí soustavy a sníženým polykáním plodové vody. Při UZ vyšetření lze stanovit váhu plodu, u případů s CS se většinou pohybuje nad 90. percentil pro daný gestační věk. Makrocefalie může být relativní, nebo absolutní. Při UZ vyšetřeních plodu lze stanovit a sledovat obvod hlavy a porovnat s normami. U CS je opakovaně dokumentována prenatální porucha srdečního rytmu typu síňových tachyarytmií, Ze strukturálních kardiálních patologií je to hypertrofická kardiomyopatie a valvární stenóza plicnice, stejně jako u ostatních RASopatií, možné jsou i levostranné obstrukční vady (aortální obstrukce nebo koarktace aorty). Zesílení NT je u tohoto syndromu vedoucím příznakem méně často. Možná je fetální ventrikulomegalie, rozšíření vývodného systému ledvin, i prenatálně jsme schopni popsat ulnární deviaci zápěstí a malý nebo absentující žaludek. Hydrops nebo pleurální výpotky a ascites jsou u CS dokumentovány méně frekventně, jsou ale možné [17].
SOUHRNNÝ PRENATÁLNÍ POHLED NA RASOPATIE A INDIKACE K MOLEKULÁRNÍ ANALÝZE
V podmínkách současného prenatálního screeningu zůstává vedoucím příznakem pro detekci RASopatií patologická hodnota NT v prvním trimestru. Pokud dojde z důvodů patologické NT k běžné karyotypizaci, tak u normálního výsledku (euploidní plod) trvá 1–10% riziko výskytu NS [18]. Utrazvukové vyšetření plodu pak může vést k fetální diagnóze RASopatie. Indikační kritéria pro sekvenování na NS jsou: NT nad 95. percentil v kombinaci: s cystickým hygromem, rozšířením jugulárních lymfatických váčků, pleurálními výpotky, ascitem, povšechným hydropsem, polyhydramnionem, vrozenou srdeční vadou a renálními abnormalitami [19]. Ostatní RASopatie mají fetální známky podobné, CFCS nám pomůže specifikovat makrosomie, makrocefalie a relativně krátké kosti plodu, CS nadměrný fetální růst a fetální arytmie. U těchto syndromů se stále více uplatňuje 3D/4D ultrazvuk s možností zobrazení stigmatizace obličeje anebo jiné orgánové patologie. Všechny syndromy pak spojují srdeční a ledvinové abnormality. I fetální příznaky se mohou překrývat a podezření na jeden syndrom může vést k diagnóze jiného typu RASopatie [20]. V současnosti jsou k dispozici panely ke zjištění mutací více než 20 genů, které jsou zodpovědné za vznik RASopatií. Pokud je indikováno genetické vyšetření plodu, je doporučeno vyšetření i rodičovské DNA pro identifikaci de novo mutací. Při známé mutaci v rodině je riziko přenosu 50% a v případě gravidity je možno provést cílenou rychlou molekulární analýzu.
Během těhotenství je u RASopatií podstatná fetální echokardiografie, která sleduje vývoj srdeční vady nebo kardiomyopatie během gravidity. Srdeční patologie jsou postnatálně u RASopatií klinicky nejvíce limitující a jsou po stigmatizaci nejčastějším příznakem těchto syndromů [21]. Srdeční vady jsou po narození sledovány a podle vývoje klinické a hemodynamické významnosti jsou zařazeny k operačnímu nebo katetrizačnímu řešení. Hypertrofická kardiomyopatie ve spojení s RASopatiemi zjištěná v prvních 6 měsících života a se známkami srdečního selhávání má 30% přežívání, zatímco kardiomyopatie diagnostikovaná po 6 měsících věku bez další symptomatologie má přežití až 95%. Přestože ostatní prenatální patologie u NS nedokáží předpovědět postnatální významnost onemocnění, byl pozorován větší výskyt hemoblastóz a postižení intelektu u pacientů s fetálními výpotky, nebyla nalezena souvislost mezi prenatálními nálezy a poruchou růstu dítěte. Výpotky a celkový hydrops plodu jsou rizikovým faktorem perinatálního průběhu a mohou vést ke komplikovanému novorozeneckému průběhu a k intervenčním řešením [5].
ZÁVĚR
Prenatální diagnostika RASopatií je možná již před narozením. Nejlépe, i díky jeho četnosti, je prostudován fetální fenotyp Noonanové syndromu. Pro tuto skupinu onemocnění rizikové prenatální ultrazvukové známky existují a indikační kritéria pro molekulární analýzu je možné stanovit. Klíčové se jeví hodnocení šíjového projasnění plodu, nejčastější další známkou je polyhydramnion, výpotky a srdeční nebo ledvinové abnormality. Srdeční vady jsou po stigmatizaci nejčasnějším postnatálním příznakem u RASopatií, jejich prenatální diagnostika je ale zatím komplikovaná a méně úspěšná. Fetální echokardiografie může hrát zásadní roli jak při diagnostice, tak i při dalším sledování plodu. Fetální anamnéza může přispět k postnatální diagnostice RASopatie u stigmatizovaného nebo jinak postiženého dítěte.
MUDr. Jan Pavlíček, Ph.D.
Oddělení dětské a prenatální kardiologie
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jan.pavlicek@fno.cz
Sources
1. Aoki Y, Niihori T, Inoue S, Matsubara Y. Recent advances in RASopathies. J Hum Genet 2016; 61 : 33–39.
2. Klásková E, Tüdös Z, Sobek A, et al. Low-level 45, X/46, XX mosaicism is not associated with congenital heart disease and thoracic aorta dilatation: prospective magnetic resonance imaging and ultrasound study. Ultrasound Obstet Gynecol 2015; 45 (6): 722–727.
3. Wright EMB, Kerr B. RAS-MAPK pathway disorders: important causes of congenital heart disease, feeding difficulties, developmental delay and short stature. Arch Dis Child 2010; 95 (9): 724–730.
4. Baldassarre G, Mussa A, Dotta A, et al. Prenatal features of Noonan syndrome: prevalence and prognostic value. Prenat Diagn 2011; 31 (10): 949–954.
5. Moczulska H, Piotrowicz M, Janiak K, et al. Prenatal suspicion of Noonan syndrome on the basis of echocardiographic findings – a case report. Prenat Cardio 2013; 3 (2): 26–30.
6. Sznajer Y, Keren B, Baumann C, et al. The spectrum of cardiac anomalies in Noonan syndrome as a result of mutations in the PTPN11 gene. Pediatrics 2007; 119 : 1325–1331.
7. International Society of Ultrasound in Obstetrics & Gynecology. Cardiac screening examination of the fetus: guidelines for performing the ‚basic‘ and ‚extended basic‘ cardiac scan. Ultrasound Obstet Gynecol 2006; 27 (1):107.
8. Menashe M, Arbel R, Raveh D, et al. Poor prenatal detection rate of cardiac anomalies in Noonan syndrome. Ultrasound Obstet Gynecol 2002; 19 : 51–55.
9. Achiron R, Heggesh J, Grisaru D, et al. Noonan syndrome: a cryptic condition in early gestation. Am J Med Genet 2000; 92 (3): 159–165.
10. Abe Y, Aoki Y, Kuriyama S, et al. Prevalence and clinical features of Costello syndrome and cardio-facio-cutaneous syndrome in Japan: Findings from a nationwide epidemiological survey. Am J Med Genet A 2012; 158 (5): 1083–1094.
11. Wong Ramsey KN, Loichinger MH, Slavin TP, et al. The perinatal presentation of cardiofaciocutaneous syndrome. Am J Med Genet A 2014; 164 (8): 2036–2042.
12. Philip N, Quarello E, Gorincour G, Sigaudy S. Approche de la dysmorphologie fœtale in utero. Gynecol Obstet Fertil 2010; 38 (11): 677–685.
13. Pierpont MEM, Magoulas PL, Adi S, et al. Cardio-facio-cutaneous syndrome: clinical features, diagnosis, and management guidelines. Pediatrics 2014; 134 (4): e1149–e1162.
14. Biard JM, Steenhaut P, Bernard, P, et al. Antenatal diagnosis of cardio-facio-cutaneous syndrome: Prenatal characteristics and contribution of fetal facial dysmorphic signs in utero. About a case and review of literature. Eur J Obstet Gynecol R B 2019; 240 : 232–241.
15. Smith LP, Podraza J, Proud VK. Polyhydramnios, fetal overgrowth, and macrocephaly: prenatal ultrasound findings of Costello syndrome. Am J Med Genet A 2009; 149 (4): 779–784.
16. Kuniba H, Pooh RK, Sasaki K, et al. Prenatal diagnosis of Costello syndrome using 3D ultrasonography amniocentesis confirmation of the rare HRAS mutation G12D. Am J Med Genet A 2009; 149 (4): 785–787.
17. Hague J, Hackett G, Acerini C, Park SM. Prenatal genetic diagnosis of Costello syndrome in a male fetus with recurrent HRAS mutation p. Gly12Ser. Prenat Diagn 2017; 37 (4): 409–411.
18. Ali MM, Chasen ST, Norton ME. Testing for Noonan syndrome after increased nuchal translucency. Prenat Diagn 2017; 37 : 750–753.
19. Croonen EA, Nillesen WM, Stuurman KE, et al. Prenatal diagnostic testing of the Noonan syndrome genes in fetuses with abnormal ultrasound findings. Eur J Hum Genet 2013; 21 (9): 936–942.
20. Levaillant JM, Gérard-Blanluet M, Holder-Espinasse M, et al. Prenatal phenotypic overlap of Costello syndrome and severe Noonan syndrome by tri-dimensional ultrasonography. Prenat Diagn 2006; 26 (4): 340–344.
21. Weis D, et al. Neurofibromatóza a iné syndromy s „café au lait“ makulami. Praha: Mladá fronta, 2020.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 4-
All articles in this issue
- Dětský růst v zrcadle času – a věčný třetí percentil
- Data analysis of REPAR – country-wide register of growth hormone treatment recipients
- The role of acid-labile subunit (ALS) in aetiology and diagnostic procedures of short stature
- Noonan syndrome and other RASopathies: Aetiology, diagnostic procedures and therapy
- Noonan syndrome from a paediatric cardiologistˇs perspective
- Prenatal phenotype of RASopathies
- Etiology and diagnostic approach of growth failure in children born small for gestational age (SGA) with persistent short stature in childhood (SGA-SS)
- Growth databases and registries – towards understanding physiological effects of growth hormone
- Growth disorder in 11-year-old girl with diabetes
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Noonan syndrome and other RASopathies: Aetiology, diagnostic procedures and therapy
- Etiology and diagnostic approach of growth failure in children born small for gestational age (SGA) with persistent short stature in childhood (SGA-SS)
- Noonan syndrome from a paediatric cardiologistˇs perspective
- Prenatal phenotype of RASopathies
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

