-
Medical journals
- Career
Kostné zdravie u detí s cystickou fibrózou
Authors: M. Fajdelová; K. Kubejová; A. Feketeová; J. Ferenczová; V. Vargová
Authors‘ workplace: Klinika detí a dorastu LF UPJŠ a DFN, Košice, Slovensko
Published in: Čes-slov Pediat 2019; 74 (7): 425-429.
Category:
Overview
Nízka kostná minerálová denzita (BMD, Bone Mineral Density) u pacientov s cystickou fibrózou (CF) bola prvý krát opísaná Mischlerom v roku 1979. Zníženie pevnosti kostí u detí s CF spôsobuje najmä pankreatická insuficiencia, malnutrícia, deficit vitamínov D a K, oneskorená puberta, rekurentné infekcie sprevádzané zvýšenou prozápalovou aktivitou a vystupňovanou kostnou resorpciou a tiež systémová kortikoterapia. Najnovšie štúdie upozorňujú aj na priamy vplyv dysfunkcie CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) na úrovni kostných buniek.
Cieľ: Zistiť prevalenciu cystickou fibrózou indukovanej, kostnej choroby u pacientov jedného centra a zároveň určenie korelácií s vybranými parametrami.
Metódy: Do prierezovej štúdie sme zaradili 38 detí s cystickou fibrózou (19 chlapcov/19 dievčat, priemerný vek v čase denzitometrického vyšetrenia 12,71 ± 4,08 roka). Vplyv CF na kostné zdravie sme hodnotili pomocou: 1) antropometrických meraní, 2) vyšetrenia vybraných parametrov kostného metabolizmu a hormonálneho profilu a 3) DXA (dvojenergiová röntgenová absorbciometria), pričom hodnoty BMD v oblasti L1–L4 a TBLH (Total Body Less Head) sme korigovali k výške (height Z-score). U všetkých pacientov sme hodnotili priebeh puberty, zápalové parametre, pľúcne funkcie a liečbu ovplyvňujúcu rastúci skelet.
Výsledky: Priemerná hodnota Z-skóre telesnej výšky bola -0,25 ± 1,21 SD a pohybovala sa v rozmedzí -2,37 až 2,23 SD. Poruchu rastu charakterizovanú jej poklesom pod -2 SD malo 8 (21,05 %) detí s CF. Deficit vitamínu D definovaný poklesom sérovej koncentrácie kalcidiolu pod 20 ng/ml bol napriek suplementácii prítomný až u 1/5 pacientov. Priemerná hodnota BMD Z-skóre v oblasti L1–L4 bola -0,88 ± 0,90 SD, pričom cystickou fibrózou indukovanú nízku kostnú minerálovú denzitu sme zaznamenali u 6 detí (15,80 %). Klinicky významnú anamnézu patologických zlomenín nemal ani jeden pacient. Ako najvýznamnejší prediktor zníženia BMD sa ukázala porucha výživy (p <0,05), ktorá bola prítomná u 1/5 pacientov s CF.
Záver: Cystická fibróza je jednou z mála chronických ochorení, pre ktorú sú vypracované odporúčania (guidelines) ohľadom diagnostiky, prevencie a liečby sekundárnej osteoporózy u pediatrických pacientov. Udržanie optimálneho nutričného stavu a pľúcnych funkcií, obmedzenie perorálnej kortikoterapie, adekvátna suplementácia vitamínovými preparátmi a pravidelné denzitometrické kontroly, sú základom prevencie vzniku cystickou fibrózou indukovanej kostnej choroby.
Klíčová slova:
cystická fibróza – cystickou fibrózou indukovaná kostná choroba – CFBD – kostná minerálová denzita – BMD – DXA
ÚVOD
Cystická fibróza (CF) je najčastejším autozómovo recesívnym ochorením kaukazskej rasy, spôsobeným mutáciou CFTR génu (Cystic Fibrosis Transmembrance Conductance Regulator). Z celkového počtu, v súčasnosti známych viac ako 2000 mutácii, má najvyššiu prevalenciu delF508, a to približne 67 %. Klinický obraz ochorenia sa rozvíja už krátko po narodení. O prognóze rozhoduje v najväčšej miere postihnutie pľúc, ktoré sprevádzajú rekurentné infekcie pri rezistentnej bakteriálnej flóre. Vďaka neustálym snahám a viditeľným pokrokom v liečebnej starostlivosti sa zvyšuje kvalita života a prežívanie detí s CF. Na druhej strane však pribúdajú nove komplikácie, vrátane postihnutia kostí [1–4].
Cystickou fibrózou indukovaná kostná choroba (Cystic Fibrosis Related Bone Disease – CFBD) bola prvýkrát opísaná v roku 1979 Mischlerom [5]. Charakterizuje ju nízka hustota kostného minerálu (Bone Mineral Density – BMD), ktorá vedie k vzniku osteoporózy. Jej prevelancia stúpa s vekom, od 5 % u prepubertálnych detí, cez 20 % u adolescentov, až po 57 % u dospelých nad 45 rokov. Je spojená s vysokým rizikom kompresívnej fraktúry vertebrálnych stavcov a zlomeniny rebier, čo vedie k neprimeranej – nadmernej kyfóze a tým k zhoršeniu pľúcnych funkcií, neefektívnemu kašľu, sťaženému očisťovaniu dýchacích ciest a celkovej limitácii respiračnej fyzioterapie. Dôsledkom toho je zhoršenie kvality života a zvýšenie morbidity. Preto je veľmi dôležité pôsobiť preventívne už v detskom veku [6, 7] (tab. 1).
Table 1. Diagnostické kritéria osteoporózy u detí a adolescentov (na základe Official Pediatric Positions of the ISCD, 2013). 
Z-skóre – porovnanie so zdravými deťmi rovnakého veku a pohlavia vyjadrené v smerodajných odchýlkach SD
BMC – obsah kostného minerálu v kosti
aBMD – plošná kostná denzita pri vyšetrení DXAPatogenéza CFBD
V rámci patogenézy CFBD ide o multifaktoriálny proces, pri ktorom je jasný nepomer medzi zvýšenou kostnou resorpciou a zníženou kostnou formáciou. Etiologicky sa významne podieľajú na kostnom zdraví exokrinná insuficiencia pankresu (malabsorbcia vitamínu D a K, Ca), diabetes, poruchy výživy a rastu, oneskorená puberta, chronická infekcia, fyzická inaktivita a v neposlednom rade aj kortikoidná liečba [8].
Exokrinná pankreatická insuficiencia je prítomná u 80 až 90 % detí s CF, výsledkom čoho je malabsorbcia, znížené vstrebávanie tukov a v nich rozpustných vitamínov. Práve deficiencia vitamínu D a znížené vstrebávanie kalcia v čreve spôsobuje zvýšenie koncentrácie parathormónu (PTH), ktorý stimuluje osteoklastogenézu a následnu kostnú resorpciu, s cieľom obnoviť normálnu hladinu vápnika v sére [9–11].
CF je chronický zápalový proces, avšak najmä počas pľúcnych exacerbácii bola dokázaná zvýšená aktivita prekurzorov kostnej resorpcie. Na druhej strane je aktivita osteoblastov znížená zápalovými mediátormi [12–14].
V prípade cystickou fibrózou indukovanom diabete (CFRD – Cystic Fibrosis Related Diabetes) bol taktiež dokázaný jeho vplyv na vývoj osteoporózy. V rámci štúdie (Rana a kol.) autori porovnávali výsledky denzitometrického vyšetrenia u 81 pacientov s CF a ich glukózový status. Bola dokázana priama asociácia medzi zníženou kostnou denzitou a dysglykémiou [15].
Až takmer 90 % z celkového objemu kostnej hmoty, t. j. Peak Bone Mass (PBM), sa vytvára v prvých dvoch dekádach života, pričom kostná hmota najviac zmohutnie v adolescencii. Kostné tkanivo v období puberty pribúda až dvojnásobne rýchlejšie, v porovnaní s obdobím od narodenia po nástup dospievania, preto je puberta „kritická“ pre formovanie kostného zdravia a je hlavným určujúcim faktorom PBM a neskoršieho rizika zlomenín v dospelosti. Práve jej poruchy, ktoré sú časté u detí s CF, môžu vyústiť k zníženiu BMD [16].
Hlavným patofyziologickým podkladom kortikoidmi indukovanej osteoporózy je útlm kostnej novotvorby počas celej doby ich užívania, kým urýchlená kostná resorpcia trvá maximálne prvých 6–12 mesiacov liečby [17].
Body mass index (BMI) je jedným z dôležitých parametrov, ktorý nám hovorí o aktivite ochorenia a mnohými štúdiami bola potvrdená významná korelácia medzi zníženým BMI a znížením BMD Z-skóre [18–20].
V súčasnosti sa čoraz viac skúma aj primárna príčina – priamy vplyv dysfunkcie CFTR kanála na úrovni kostných buniek. V ľudských osteoblastoch, získaných od 25-ročného muža s CF (mutácia delF508/G542X) bola objavená defektná aktivita CFTR kanála a závažný deficit tvorby osteoprotegerínu, ktorý je dôležitým regulátorom, podieľajúcim sa na inhibícii diferenciácie osteoklastových prekurzorov na zrelé osteoklasty. Tento fakt dokazuje hypotézu, že CFTR gén hraje dôležitú úlohu pri bunkovej diferenciácii a maturácii kostnej hmoty. Pri výskumoch s myšacími modelmi (delF508), s primeranou výživou a pľúcnymi funkciami, bola zistená znížená aktivita osteoblastov a znížená kostná formácia, bez závislosti na veku a pohlaví. Zároveň pri in vivo podávaní miglustatu – CFTR korektoru, bolo u delF508 mladých myší dokázané zväčšenie kostného objemu a zlepšenie kostnej mikroarchitektúry v oblasti lumbálnej chrbtice a femuru. V prípade ľudských osteo-blastoch (mutácia delF508) liečených CFTR modulátorom C18 bola potvrdená zvýšená produkcia PGE2 a normalizácia pomeru RANKL/OPG [21–23].
Denzitometrické vyšetrenie
Zlatým štandardom v rámci diagnostiky je denzitometrické vyšetrenie – dvojenergiová röntgenová absorbciometria (DXA). V súčasnosti sa na posúdenie rizika zlomenín využíva práve hodnota BMD Z -skóre, so zameraním na lumbálnu časť chrbtice L1–L4 a celotelová denzitometria. Výhodou tohto merania je presnosť, krátky čas a veľmi nízka radiačná záťaž. Indikácie DXA u týchto pacientov sú uvedené v tabuľke 2 [24, 25].
Table 2. Indikácie DXA u cystickej fibrózy. 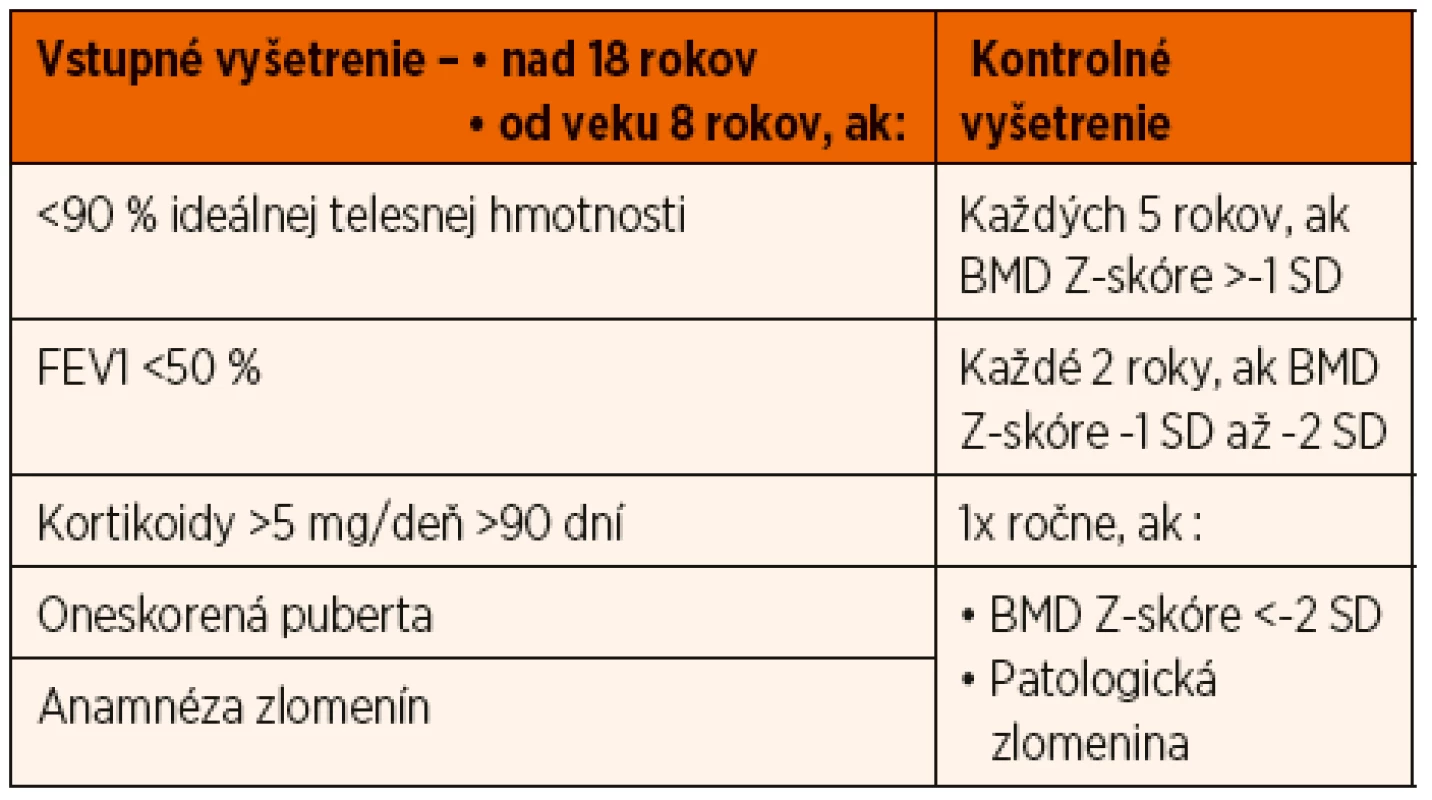
Cieľ
Zistiť prevalenciu, cystickou fibrózou indukovanej, kostnej choroby u pacientov jedného centra a zároveň určenie jej korelácií s vybranými parametrami.
METÓDY
V našej prierezovej retrospektívnej štúdii bolo zaradených 38 pacientov s CF, ktorí boli sledovaní na pracovisku so zameraním na cystickú fibrózu v Detskej fakultnej nemocnici v Košiciach. Súbor tvorilo 19 dievčat a 19 chlapcov, od 8 do 17 rokov. Priemerný vek v čase denzitometrického vyšetrenia bol 12,71 ± 4,08 roka. V rámci priebehu puberty bolo 27 % v štádiu Tanner 1, 16,2 % v štádiu Tanner 2–3 a zvyšných 58,2 % v štádiu Tanner 4–5. Desať pacientov bolo delF508 homozygotných a 19 pacientov delF508 heterozygotných. Dlhodobá kortikosteroidná liečba pre alergickú bronchopulmonálnu aspergilózu (ABPA) bola len v jednom prípade, čo následne vyústilo aj v rozvoj cystickou fibrózou indukovaný diabetes (CFRD – Cystic Fibrosis Related Diabates).
U každého pacienta sme vyhodnocovali 4 základné faktory: antropometriu, vybrané laboratórne parametre kostného metabolizmu a hormonálneho profilu, pľúcne funkcie a kostnú minerálovú denzitu (tab 3).
Table 3. Vybrané laboratórne parametre. 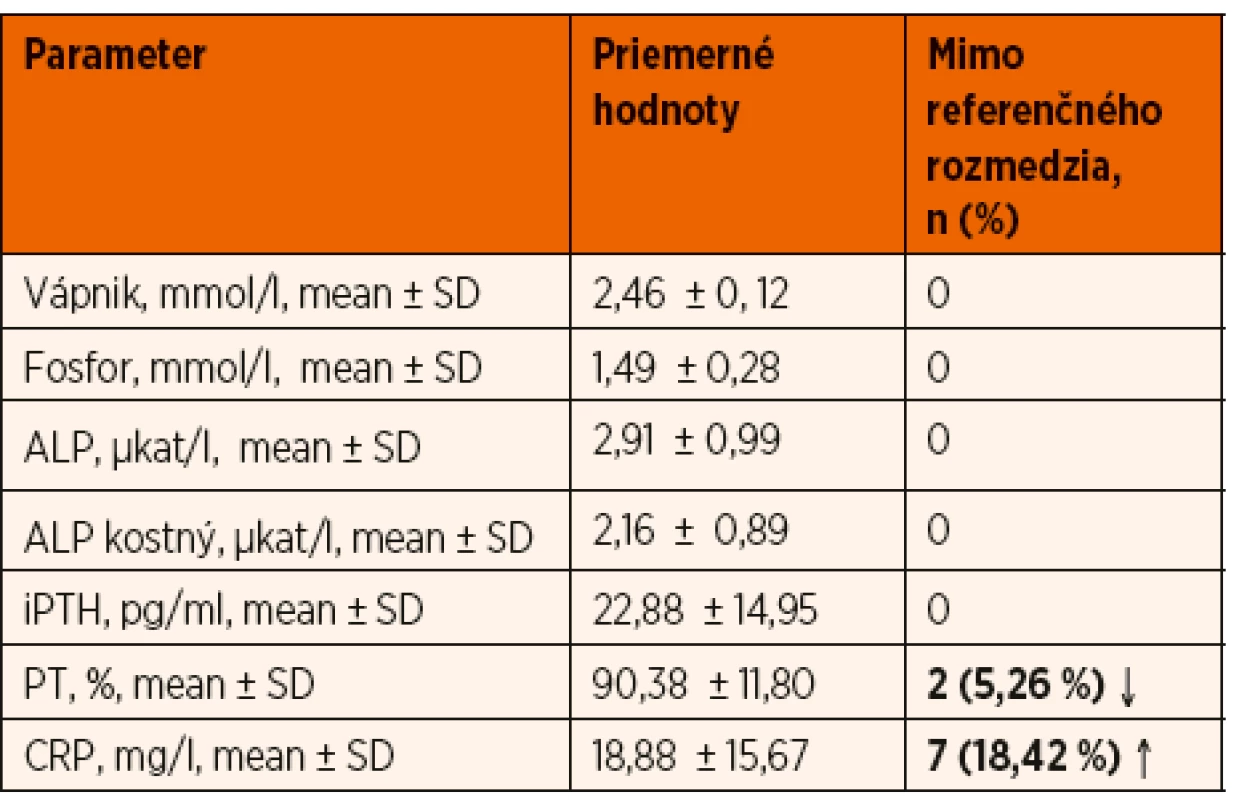
Posudzovali sme výšku, hmotnosť a BMI, ktoré boli vyjadrené v hodnotách Z-skóre. Každé dieťa malo vyšetrenú sérovú koncentráciu vápnika, fosforu, 25-hydroxycholekalciferolu, celkovej alkalickej fosfatázy (ALP) a jej kostnej frakcie, parathormón (PTH), protrombínový čas (PT) a hodnotu C - reaktívneho proteínu (CRP). V rámci pľúcnych funkcií sme hodnotili jednosekundovú vitálnu kapacitu FEV1. Kostnú minerálovú hustotu sme merali metódou DXA, a to celotelovú TBLH (Total Body Less Head) a v lumbálnej časti chrbtice L1–L4. Hodnoty BMD sme následne korigovali k výške (height Z-score).
VÝSLEDKY
Priemerná hodnota Z-skóre telesnej výšky bola -0,25 ± 1,21 SD a pohybovala sa v rozmedzí -2,37 až 2,23 SD. Poruchu rastu charakterizovanú jej poklesom pod -2 SD malo 8 (21,05 %) detí s CF. V rámci tejto skupiny bol 1 pacient s potvrdeným deficitom rastového hormónu. V prípade hodnoty BMI bol priemer v pásme -0,74 ± 1,34 SD, pričom poruchu výživy sme zaznamenali u 10 (26,31 %) detí. Z meraných laboratórnych parametrov bol najsignifikantnejší deficit vitamínu D definovaný poklesom sérovej koncentrácie kalcidiolu pod 20 ng/ml, napriek suplementácii bol prítomný až u 1/5 pacientov (tab. 3).
Priemerná hodnota BMD Z-skóre v oblasti L1–L4 bola -0,88 ± 1,66 SD a v meraní TBLH -0,51 ± 1,47 SD, pričom cystickou fibrózou indukovanú nízku kostnú minerálovú denzitu sme zaznamenali u 6 (15,80 %) detí. Klinicky významnú anamnézu patologických zlomenín nemal ani jeden náš pacient. V rámci všetkých sledovaných parametrov sa ako najvýznamnejší prediktor zníženia BMD ukázala porucha výživy (p <0,05), ktorá bola prítomná u 1/5 pacientov s CF (graf 1, tab. 4).
Graph 1. Korelácia hodnôt BMD Z-skóre v oblasti L1–L4 s hodnotou BMI Z-skóre (R = 0,786; p <0,01).
BMD – bone mineral density
BMI – body mass index
Table 4. DXA vyšetrenie u pacientov s cystickou fibrózou. 
DISKUSIA
Prevalencia osteopénie a osteoporózy v dospelom veku u pacientov s CF je pomerne vysoká a negatívne ovplyvňuje pľúcne funkcie a tým aj kvalitu života. Preto sa v súčasnosti kladie dôraz na výskum kostného zdravia v detskom veku s cieľom pochopiť presný patomecha-nizmus rozvoja CFBD a odhaliť najvýznamnejšie faktory, ktoré sa v prípade CF na nej podieľajú. Avšak závery jednotlivých štúdii nie sú úplne konzistentné. Ovplyvnené je to jednak rôznorodou charakteristikou skúmanej vzorky medzi jednotlivými štúdiami, jednak faktom, že CF je multifaktoriálna, a zároveň aj špecificitou denzitometrického vyšetrenia u pediatrických pacientov, v zmysle objemových korekcií hodnôt BMD. Napriek tomu sa však mnohé zhodujú vo viacerých menovateľoch, ktoré signifikantne ovplyvňujú kostné zdravie u detí s cystickou fibrózou a podieľajú sa na rozvoji CFBD.
V prípade našej vzorky pacientov sme dokázali úzku koreláciu medzi BMD Z-skóre v oblasti L1–L4 chrbtice a BMI Z-skóre. Tento výsledok podporuje fakt, že stav výživy je veľmi dôležitým determinantom v kostnom metabolizme. Ďalšie premenné, ktoré sme vyhodnocovali, ako oneskorená puberta, FEV1, deficit vitamínu D a kortikoidná liečba, neboli významné v korelácii s hodnotou BMD, ktoré sa však mnohými štúdiami ukázali ako faktory ovplyvňujúce BMD [26]. V rámci nášho súboru mohol byť tento opačný výsledok spôsobený jeho skladbou a počtom pacientov.
Zároveň ďalšie výskumy potvrdzujú zníženú kostnú minerálovú denzitu u detí do 6 rokov, s primeranou výživou a miernym priebehom ochorenia. Tieto závery potvrdzujú aj priamy vplyv defektného CFTR proteínu na úrovni kostných buniek [27]. Preto v rámci prevencie vzniku CFBD je do budúcna dôležité už v detskom veku ovplyvnenie signifikantných faktorov na jednej strane, a to v súčasnosti odporúčaná optimalizácia výživy a pľúcnych funkcií, cvičenie s vlastnou váhou 30 minút, 3x týždenne, a dôsledná suplementácia kalciom, vitamínom D a K. Na druhej strane je to vývoj a aplikácia medikamentov pôsobiacich priamo na CFTR kanál.
ZÁVER
Cystická fibróza je jedna z mála chronických ochorení, pre ktorú sú vypracované postupy ohľadom diagnostiky, prevencie a liečby sekundárnej osteoporózy u pediatrických pacientov. Udržanie optimálneho nutričného stavu a pľúcnych funkcií, obmedzenie perorálnej kortikoterapie, adekvátna suplementácia vitamínovými preparátmi a pravidelné denzitometrické kontroly sú základom prevencie vzniku cystickou fibrózou indukovanej kostnej choroby.
MUDr. Marianna Fajdelová
Klinika detí a dorastu LF UPJŠ
a DFN Košice
Trieda SNP č. 1
040 11 Košice
Slovenská republika
e-mail: marianna.fajdelova@upjs.sk
Sources
1. Stoltz DA, Meyerholz DK, Welsh MJ. Origins of cystic fibrosis lung disease. N Engl J Med 2015; 372 : 351–362.
2. Boyle MP, De Boeck K. A new era in the treatment of cystic fibrosis: correction of the underlying CFTR defect. Lancet Respir Med 2013; 1 : 158–163.
3. Riordan JR. CFTR function and prospects for therapy. Annu Rev Biochem 2008; 77 : 701–726.
4. Riordan JR, Rommens JM, Kerem B, et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA [published erratum appears in Science 1989 Sep 29;245(4925):1437]. Science 1989; 245 : 1066–1073.
5. Mischler EH, Chesney PJ, Chesney RW, Mazess RB. Demineralization in cystic fibrosis detected by direct photon absorptiometry. Am J Dis Child 1979 Jun; 133 (6): 632–635.
6. Aris RM, Renner JB, Winders AD, et al. Increased rate of fractures and severe kyphosis: sequelae of living into adulthood with cystic fibrosis. Ann Intern Med 1998 Feb 1; 128 (3): 186–193.
7. Rovner AJ, Zemel BS, Leonard MB, et al. Mild to moderate cystic fibrosis is not associated with increased fracture risk in children and adolescents. J Pediatr 2005 Sep; 147 (3): 327–331.
8. Aris RM, Merkel PA, Bachrach LK, et al. Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab 2005; 90 : 1888–1896.
9. Haworth CS, Webb AK, Egan JJ, et al. Bone histomorphometry in adult patients with cystic fibrosis. Chest 2000 Aug; 118 (2): 434–439.
10. Aris RM, Ontjes DA, Buell HE, et al. Abnormal bone turnover in cystic fibrosis adults. Osteoporos Int 2002; 13 (2): 151–157.
11. Aris RM, Lester GE, Dingman S, Ontjes DA. Altered calcium homeostasis in adults with cystic fibrosis. Osteoporos Int 1999; 10 (2): 102–108.
12. King SJ, Topliss DJ, Kotsimbos T, et al. Reduced bone density in cystic fibrosis: DeltaF508 mutation is an independent risk factor. Eur Respir J 2005 Jan; 25 (1): 54–61.
13. Ionescu AA, Nixon LS, Evans WD, et al. Bone density, body composition, and inflammatory status in cystic fibrosis. Am J Respir Crit Care Med 2000 Sep; 162 (3 Pt 1): 789–794.
14. Haworth CS, Selby PL, Webb AK, et al. Inflammatory related changes in bone mineral content in adults with cystic fibrosis. Thorax 2004 Jul; 59 (7): 613–617.
15. Rana M, Munns CF, Selvadurai H, et al. The impact of dysglycaemia on bone mineral accrual in young people with cystic fibrosis. Clin Endocrinol (Oxf) 2013; 78 : 36–42.
16. Kubejová K, Podracká Ľ. Kortikoidmi indukovaná osteoporóza u detí – patogenéza a diagnostika. Pediatr prax 2013; 14 (2): 57–60.
17. Klein GL. Glucocorticoid-induced bone loss in children. Clin Rev Bone Mineral Metabolism 2004; 2 (1): 37–52.
18. Stalvey MS, Clines GA. Cystic fibrosis-related bone disease: insights into a growing problem. Curr Opin Endocrinol Diabetes Obes 2013; 20 : 547–552.
19. Javier RM, Jacquot J. Bone disease in cystic fibrosis: what’s new? Joint Bone Spine 2011; 78 : 445–450.
20. Haworth CS. Impact of cystic fibrosis on bone health. Curr Opin Pulm Med 2010; 16 : 616–622.
21. Gimenez A, Le Henaff C, Norez C, et al. Deficit of osteoprotegerin release by osteoblasts from a patient with cystic fibrosis. Eur Respir J 2012; 39 : 780–781.
22. Le Henaff C, Gimenez A, Hay E, et al. The F508del mutation in cystic fibrosis transmembrane conductance regulator gene impacts bone formation. Am J Pathol 2012; 180 : 2068–2075.
23. Le Henaff C, Hay E, Velard F, et al. Enhanced F508del-CFTR channel activity ameliorates bone pathology in murine cystic fibrosis. Am J Pathol 2014; 184 : 1132–1141.
24. Aris RM, Merkel PA, Bachrach LK, et al. Guide to bone health and disease in cystic fibrosis. J Clin Endocrinol Metab 2005 Mar; 90 (3): 1888–1896.
25. Boyle MP. Update on maintaining bone health in cystic fibrosis. Curr Opin Pulm Med 2006 Nov; 12 (6): 453–458.
26. Gore AP, Kwon SH, Stenbit AE. A roadmap to the brittle bones of cystic fibrosis. J Osteoporos 2010; 2011 : 926045. doi 10.4061/2011/926045.
27. Sermet-Gaudelus I, Souberbielle JC, Ruiz JC, et al. Low bone mineral density in young children with cystic fibrosis. Am J Respir Crit Care Med 2007; 175 : 951–957.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2019 Issue 7-
All articles in this issue
- Historie cystické fibrózy u nás – editorial
- Novorozenecký screening cystické fibrózy a diagnostika CFSPID
- Desať rokov novorodeneckého skríningu cystickej fibrózy na Slovensku
- Funkce plic souboru českých kojenců a batolat s cystickou fibrózou
- Pletysmografické a biochemické metody jako nové možnosti neinvazivního hodnocení endotelové dysfunkce u dětí s cystickou fibrózou – kombinovaný diagnostický přístup
- Alergická bronchopulmonálna aspergilóza u detských pacientov s cystickou fibrózou
- Kostné zdravie u detí s cystickou fibrózou
- Vyšetrenie rotačnej tromboelastometrie (ROTEM) v manažmente krvácania a koagulopatie v pediatrii
- Recenzia knižnej publikácie: Ivan Frič, Mirko Zibolen, Viera Haľamová, František Bauer a kolektív: História neonatológie na Slovensku
-
Odešel prof. MUDr. Václav Špičák, CSc.
(14. ledna 1929–13. září 2019)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Novorozenecký screening cystické fibrózy a diagnostika CFSPID
- Vyšetrenie rotačnej tromboelastometrie (ROTEM) v manažmente krvácania a koagulopatie v pediatrii
- Historie cystické fibrózy u nás – editorial
- Alergická bronchopulmonálna aspergilóza u detských pacientov s cystickou fibrózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

