-
Medical journals
- Career
Úskalia diagnostiky a liečby feochromocytómu u detí
Authors: P. Kunovský 1; Z. Pribilincová 2; A. Kriššáková 1; R. Dinka 1; M. Kováč 1; J. Krbaťa 3; J. Malina 4; J. Babala 5
Authors‘ workplace: Národný ústav srdcových a cievnych chorôb, a. s., Detské kardiocentrum, JIS kardiologického oddelenia, Bratislava, primár MUDr. P. Kunovský, PhD., MBA 1; 2. detská klinika DFNsP a LFUK, Bratislava, prednosta prof. MUDr. L. Kovács, DrSc., MPH 2; Rádiologické oddelenie DFNsP, Bratislava, primár MUDr. D. Haviar 3; Klinika onkologickej chirurgie OUSA a LFUK, Onkologický ústav svätej Alžbety, s. r. o., Bratislava, prednosta prof. MUDr. Š. Durdík, PhD., MHA 4; Klinika detskej chirurgie DFNsP a LFUK, Bratislava, prednosta doc. MUDr. J. Trnka, CSc. 5
Published in: Čes-slov Pediat 2015; 70 (4): 249-254.
Category: Education
Overview
Feochromocytóm (FEO) a paraganglióm (PGL) sú neuroendokrinné tumory, ktoré vznikajú zo sympatických a parasympatických paraganglií. FEO sa najčastejšie prejavuje trvalou alebo záchvatovitou hypertenziou, bolesťami hlavy, potením, palpitáciami a úzkostnými stavmi. Diagnostika sa zakladá na typickom klinickom obraze a biochemickom potvrdení stanovením plazmatického normetanefrínu a metanefrínu, ktoré majú takmer 100% senzitivitu a sú vyšetrením voľby. Na lokalizáciu nádoru v bruchu a panve je metódou voľby počítačová tomografia (CT) alebo magnetická rezonancia (MRI). Definitívnou a kauzálnou liečbou je chirurgické odstránenie tumoru, a to preferenčne laparoskopicky. Hlavným cieľom predoperačnej liečby je normalizácia krvného tlaku, frekvencie srdca, obnova normovolémie a prevencia katecholamínovej „búrky“ a jej účinkov na kardiovaskulárny systém pri manipulácii s tumorom v priebehu operácie. Autori navrhujú pri hypertenznej kríze iniciálnu liečbu intravenóznym urapidilom, v prípade perzistujúcej tachykardie v kombinácii s perorálnym metoprololom podávaným s časovým posunom po dosiahnutí dostatočnej alfa blokády a/alebo s kalciovým blokátorom amlodipínom.
Cieľom práce je upozorniť na úskalia v diagnostike feochromocytómu a ukázať možnosti súčasného predoperačného manažmentu, ktorý by mal zabrániť vážnym poškodeniam detí s FEO. Ošetrujúci lekár by mal rozpoznať a aktívne pátrať po týchto tumoroch, hlavne v kontexte známej genetickej predispozície (von Hippelovom-Lindauovom syndróme, mnohopočetnej endokrinnej neoplázii typu 2, pri neurofibromatóze typu 1 a paragangliómoch). Feochromocytóm nemusí vždy prebiehať pod typickým klinickým obrazom a preto je najdôležitejšou súčasťou jeho diagnostiky myslieť na túto možnosť a pri podozrení ju potvrdiť biochemicky.Kľúčové slová:
feochromocytóm, hypertenzná kríza, von Hippelov-Lindauov syndróm, urapidilÚvod
Feochromocytóm (FEO) a paraganglióm (PGL) sú neuroendokrinné tumory, ktoré vznikajú zo sympatických a parasympatických paraganglií. Hoci sa zriedkavo diagnostikujú v detskom veku, tvoria približne 20 % celkovo diagnostikovaných feochromocytómov [1].
V oboch prípadoch sa jedná väčšinou o endokrinne aktívne tumory, ktoré sa klinicky prezentujú symptomatológiou nadprodukcie katecholamínov, adrenalínu, noradrenalínu a veľmi vzácne aj dopamínu. Produkcia a vyplavovanie katecholamínov môže prebiehať záchvatovite, čo sa typicky prejavuje epizódami bolestí hlavy, potením, palpitáciami, zblednutím a často tiež pocitom strachu, bolesťami brucha a nauzeou. Trvalá nadprodukcia katecholamínov môže spôsobovať rôzny stupeň systémovej arteriálnej hypertenzie a sekundárne orgánové poškodenia ako hypertrofiu myokardu ľavej komory, kardiomyopatiu, hypertenznú retinopatiu a iné. U detí s FEO môžu vzniknúť komplikované a potenciálne letálne kardiovaskulárne komplikácie v priebehu rutinnej diagnostiky, intervenčných zákrokov alebo pri úvode do anestézie. Pediater by mal rozpoznať a aktívne pátrať po týchto tumoroch, hlavne v kontexte známej genetickej predispozície (von Hippelov-Lindauovom syndróme, mnohopočetnej endokrinnej neoplázii typu 2, pri neurofibromatóze typu 1 a paragangliómoch). Feochromocytóm môže rovnako prebiehať pod netypickým klinickým obrazom a preto najdôležitejšou súčasťou jeho diagnostiky je myslieť na túto možnosť.
Incidencia, patofyziológia a genetika
Incidencia feochromocytómov (FEO) sa odhaduje na 0,3 prípadov na milión za rok [1], z toho približne 10–20 % prípadov sa diagnostikuje v detstve v priemernom veku 11 rokov s miernou prevahou u chlapcov. Vo veľkej väčšine syntetizujú, skladujú, ale nie vždy vylučujú katecholamíny a ich metabolity [2]. FEO na rozdiel od normálnych nadobličiek nie je inervovaný a k vyplavovaniu katecholamínov nedochádza na podklade nervových impulzov, ale je pravdepodobne spôsobené zmenami prietoku krvi, tlaku, rôznymi liekmi a angiotensínom II. Väčšina FEO u detí produkuje noradrenalín, na rozdiel od normálnych nadobličiek, ktoré obsahujú približne v 85 % adrenalín. Katecholamíny účinkujú cez alfa a beta adrenergné receptory. Alfa-1 receptory vyvolávajú arteriolárnu vazokonstrikciu. Beta-1 receptory zvyšujú frekvenciu a kontraktilitu srdca. Beta-2 receptory spôsobujú dilatáciu arteriol a vén a relaxáciu tracheobronchiálneho hladkého svalstva. Symptomatológia pozorovaná pri feochromocytómoch je dôsledkom fyziologického a farmakologického účinku veľkého množstva cirkulujúceho noradrenalínu a adrenalínu [3]. Klasické feochromocytómy nachádzame v dreni nadobličiek. V extraadrenálnej lokalizácii ich nazývame paragangliómy a môžu sa nachádzať v bruchu, v panve, hrudníku a krku. Dnes už poznáme 11 génov, ktoré sú zodpovedné za vznik feochromocytómu a paragangliómu [4]. Oba typy nádorov môžu byť súčasťou genetických syndrómov: syndrómu familiárnej paragangliomatózy (gény SDH, SDHAF2), u detí častejšie pri von Hippelovom-Lindauovom syndróme (gén VHL), syndróme mnohopočetnej endokrínnej neoplázie typu 2 (gén RET) a neurofibromatóze typu 1 (gén NF1). Práve u detí sa FEO vyskytuje častejšie v spojitosti s týmito familiárnymi ochoreniami a líši sa aj tým, že sa často nachádza obojstranne alebo multicentricky v jednej nadobličke.
Približne u 56 % zjavne sporadických FEO u pacientov pod 18 rokov sú príčinou identifikovateľné mutácie v zárodočnej DNA a u detí do 10 rokov sa zistí dedičné ochorenie až v 70 % [5].
Klinický obraz
FEO sa najčastejšie prejavuje trvalou alebo záchvatovitou hypertenziou (80–90 % prípadov), bolesťami hlavy (80 %) sprevádzaných zvýšeným potením (cca 70 %), palpitáciami (60 %), epizódami zblednutia alebo začervenania (40 %) a úzkostnými stavmi až panikou (35 %) [6]. Typicky tiež vidíme stratu na váhe. Paroxyzmy hypertenzie sa môžu objavovať niekoľko krát za deň až raz za mesiac, no u detí je viac typická trvalá hypertenzia. Paroxyzmy môžu byť vyvolané vzrušením alebo určitou fyzickou aktivitou ako napr. pri zohýbaní alebo dvíhaní ťažkých predmetov. Systolický tlak krvi môže dosahovať 180–260 mmHg a diastolický 120–210 mmHg. Pri vyšetrení sú tachykardické a pri palpácii hmatáme výrazný úder hrotu srdca. Postihnuté deti sú často emočne labilné s úzkostným výrazom v tvári. Klasická triáda: bolesti hlavy, potenie a búšenie srdca je pre diagnózu FEO patognomická [7, 8].
Na druhej strane FEO môže prebiehať úplne asymptomaticky a jeho prvou manifestáciou môžu byť život ohrozujúce stavy, ako sú hypertenzná kríza, malígna arytmia, alebo cievna mozgová príhoda. Niektoré práce udávajú, že FEO nebol diagnostikovaný až v 25 % prípadov [9].
Diagnostika
Diagnostika sa zakladá na typickom klinickom obraze, ako bolo uvedené. Vzhľadom k zriedkavému výskytu je mimoriadne dôležité myslieť na túto možnosť, hlavne u genetických syndrómov, kde je ich častou súčasťou. Pri von Hippelovom-Lindauovom syndróme špecifické mutácie určujú rozmanitú klinickú manifestáciu, kde okrem FEO vidíme aj angiómy retiny, cerebelárne hemangioblastómy, renálne, pankreatické a epididymálne tumory. Zárodočné mutácie v tumor supresorovom géne boli identifikované na chromozóme 3 [3].
Laboratórna diagnostika
Z biochemických vyšetrení je dnes vyšetrením voľby stanovenie sérového normetanefrínu a metanefrínu. FEO a PGL produkujú, ale nie vždy vylučujú katecholamíny, no ich metabolity metanefríny a normetanefríny sú vylučované prakticky vždy. V súčasnosti je jednoznačná zhoda v tom, že najlepšiu senzitivitu dosahuje stanovenie metabolitov katecholamínov – normetanefrínu ako metabolitu noradrenalínu a metanefrínu ako metabolitu adrenalínu v plazme. Ich senzitivita dosahuje až 96 %. V plazme ich stanovujeme voľné, v moči po dekonjugácii. V moči je ich senzitivita stanovenia znížená rizikom diétnych interferencií [10].
Podozrenie na FEO predstavujú dvoj - až trojnásobne zvýšenie proti referenčnej hodnote. Nie zriedka však ich hodnota dosahuje 10 až 100-násobok normy [8]. Normálne referenčné hodnoty metabolitov katecholamínov ukazuje tabuľka 1.
Table 1. Normálne hodnoty katecholamínov a onkomarkerov v sére a v moči. 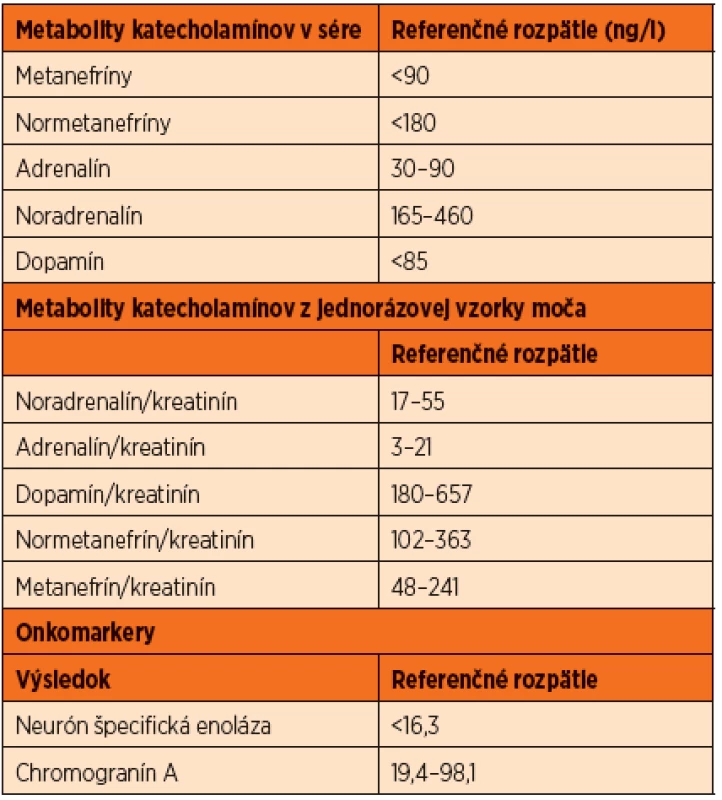
Hodnoty presahujúce 4-násobok referenčnej hodnoty takmer v 100 % znamenajú prítomnosť katecholamíny-produkujúceho tumoru [11]. Lieky, ktoré interferujú s vyšetrením (napr. acetaminophen, tricyklické antidepresíva, fenoxybenzamin a dekongestíva) by sa pred vyšetrením nemali podávať.
Image 1. CT angio brucha s kontrastom u 12-ročného pacienta s potvrdeným VHL syndrómom. V oblasti pravej nadobličky prítomný tumorózny útvar veľkosti 45 x 31 x 30 mm. Obojstranne pomerne výrazné vysycovanie po podaní kontrastnej látky, v centrálnej časti hypodenzné rozpadové dutiny. <br><b>Fig. 1.</b> Contrast CT scan of abdomen in 12 years old patient with confirmed VHL syndrome. In the place of right adrenal gland is present tumorous mass: 45 x 31 x 30 mm of size. Bilateral rather distinct enhancement after contrast is visible, with central area of low attenuation that represents necrotic cavities. 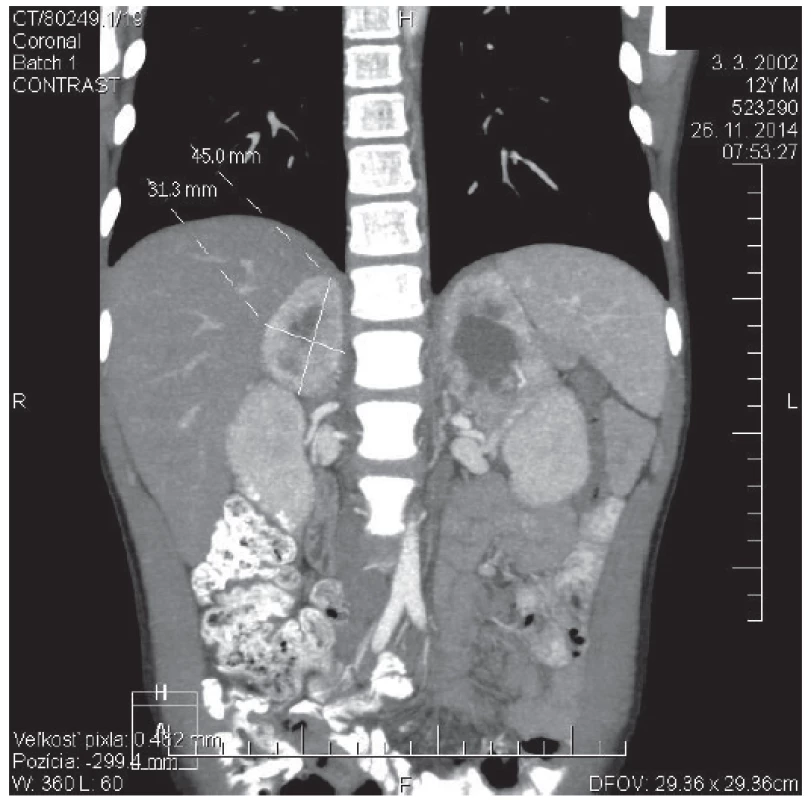
Image 2. CT angio brucha s kontrastom toho istého pacienta zobrazujúce ľavú nadobličku. V oblasti ľavej nadobličky prítomný tumorózny útvar veľkosti 72 x 35 x 37 mm. <br><b>Fig. 2.</b> Contrast CT scan of abdomen of the same patient showing left adrenal gland. In the place of left adrenal gland is present tumorous mass: 72 x 35 x 37 mm of size. 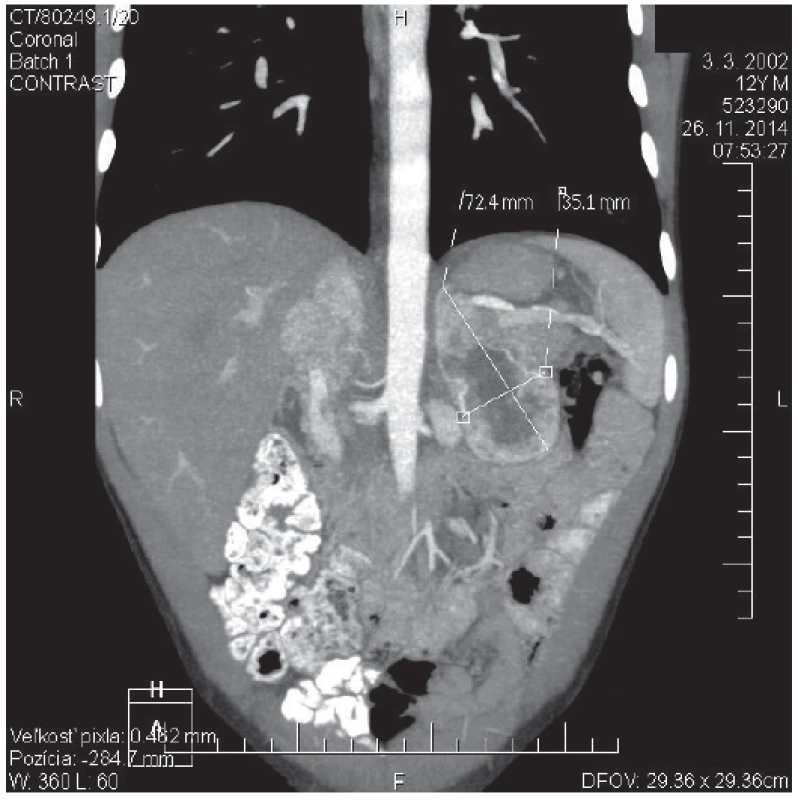
Morfologická diagnostika – lokalizácia FEO
Po biochemickom potvrdení nadprodukcie katecholamínov by sme mali prikročiť k lokalizácii tumorov zobrazovacími metodikami. Ultrasonografia brucha je najmenej invazívna, ale v porovnaní s počítačovou tomografiou (CT) a magnetickou rezonanciou (MRI) aj najmenej citlivá. CT alebo MRI brucha a panvy je vyšetrením voľby, pričom majú porovnateľnú senzitivitu. Výhodou MRI u detí je vylúčenie radiačnej záťaže. FEO a PGL sú cievne tumory, ktoré bežne obsahujú nekrotické, cystické a hemoragické okrsky [12].
Vysoko špecifickým vyšetrením, ktoré potvrdzuje katecholamíny – vylučujúce tumory, ktoré sa nemuseli zobraziť na CT alebo MRI, je scintigrafické vyšetrenie 123I-značeným metaiodo-benzylguanidinom (MIBG). Jeho využitie je rezervované skôr pre malígne prípady [12].
V súčasnosti sa zdá, že pozitrónová emisná tomografia (PET) a jej kombinácie sú rýchlejšie, senzitívnejšie a menej zaťažujúce v tejto indikácii.
Table 2. Sumarizácia návrhu predoperačnej a perioperačnej liečby. 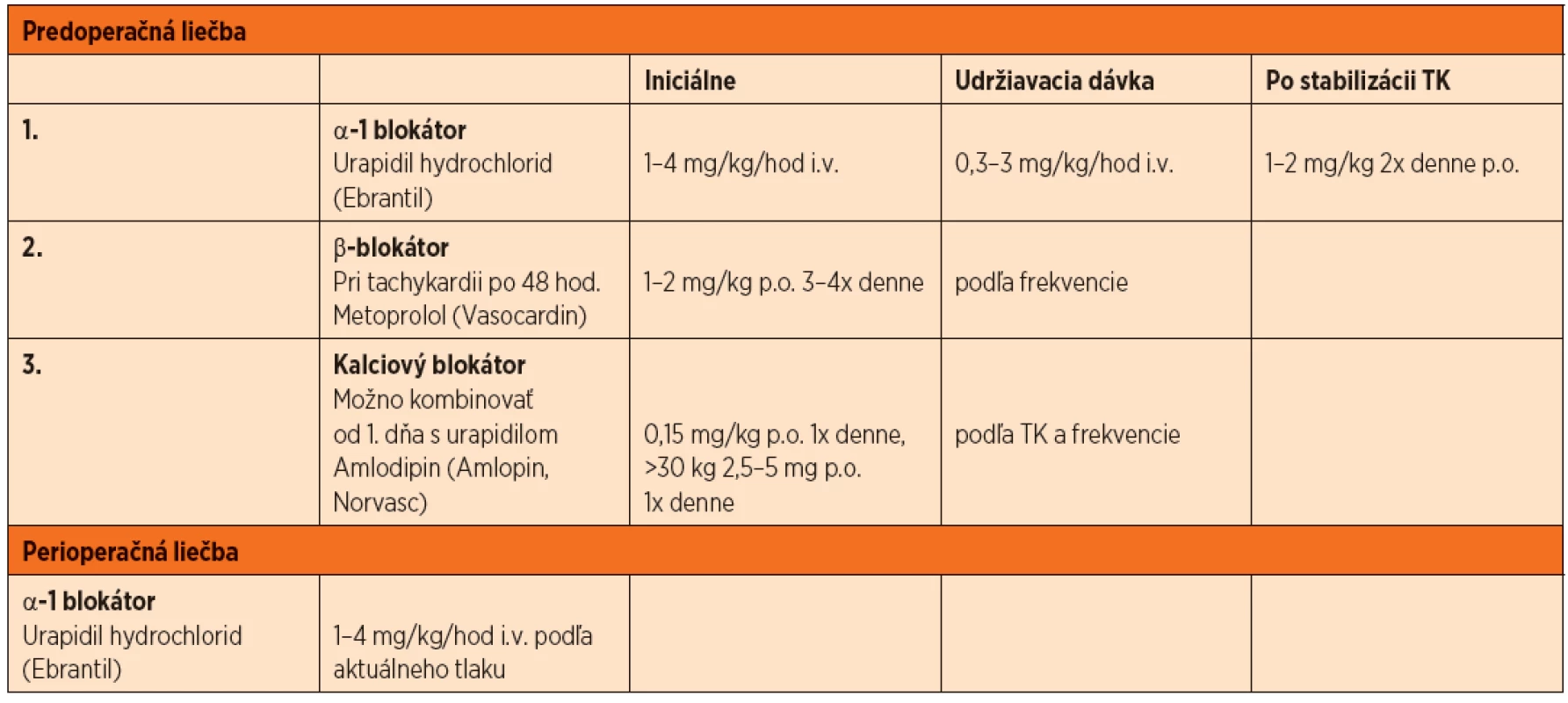
Liečba
Definitívnou a jedinou kauzálnou liečbou je chirurgické odstránenie tumoru. Predoperačná liečba je však nemenej dôležitá a prognóza pacienta vo veľkej miere závisí aj od dôslednej a kvalitnej pred-, peri - a pooperačnej liečby pacienta. Hlavným cieľom predoperačnej liečby je normalizácia TK, frekvencie srdca, funkcie ostatných orgánov, obnova normovolémie a prevencia katecholamínovej „búrky“ a jej účinkov na kardiovaskulárny systém pri manipulácii s tumorom v priebehu operácie. Neexistujú žiadne všeobecne akceptované odporučenia, o to menej pre deti, ale principiálne po laboratórnom potvrdení FEO//PGL by sa mala začať farmakologická liečba minimálne 2 týždne pred operáciou. U symptomatického pacienta je podstatné začať čo najskôr liečbu s alfa blokátormi, ktoré sú liekom voľby. V literatúre sa uvádza ako iniciálny liek voľby fenoxybenzamín, nekompetetívny alfa-1 a alfa-2 blokátor. U nás však nie je registrovaný, je drahý, má nepríjemné vedľajšie účinky (tachykardia, kongescia nosa a ortostatická hypotenzia) a jeho najväčšou nevýhodou zostáva závažná a dlhšiu dobu trvajúca hypotenzia po extrakcii tumoru. V našich podmienkach preto môžeme použiť selektívne alfa-1 blokátory ako prazosin (Minipress), terazosin (Kornam) a doxazosin (Kardura, Kamiren). Ich nevýhodou je, že u detí s touto liečbou nie sú veľké skúsenosti, dajú sa podávať len perorálne, ich nástup je pomalý a pri začiatku liečby sa musia podávať opatrne pre riziko synkopy. Nám sa zdá optimálnou iniciálnou liečbou intravenózny urapidil hydrochlorid (Ebrantil). Je to antagonista periférnych alfa-1 postsynaptických receptorov a súčasne agonista centrálnych 5-hydroxytryptamin-1A receptorov. Znižuje predovšetkým periférnu cievnu rezistenciu, čiže vedie k vazodilatácii. Na rozdiel od ostatných vazodilatátorov, napríklad neselektívneho alfa blokátoru fenoxybenzamínu, nespôsobuje významnejšiu tachykardiu. Je to pravdepodobne dôsledkom centrálnej modulácie kardiovaskulárnych centier prostredníctvom 5-hydroxytryptaminových receptorov. Zvlášť výhodný je jeho prakticky okamžitý nástup účinku. Maximálny účinok je pozorovateľný do 2–5 minút, sérový polčas je 2–3 hodiny [13]. U detí nie sú veľké skúsenosti s intravenóznym ani perorálnym podávaním. V liečbe hypertenznej krízy sa odporúča začať s dávkou 1–4 mg//kg/hodinu a po poklese tlaku krvi (TK) o 25 % prejsť na udržiavaciu dávku 0,3–3 mg/kg/hodinu. U detí do 1 roka je počiatočná dávka do 2,1 mg/kg/hodinu a udržiavacia cca 0,8 mg/kg/hodinu. V príprave na chirurgické odstránenie FEO je dôležitá aspoň 14-dňová stabilita tlaku krvi (TK) a frekvencie srdca, preto po stabilizácii stavu je možné prejsť na podávanie urapidilu p.o. v dávke 1–2 mg/kg dvakrát denne. Pri nedostatočnom poklese TK alebo pretrvávaní tachykardie je možné pridať selektívny beta blokátor (metoprolol) a/alebo kalciový blokátor (amlodipin, nifedipin alebo verapamil). Použitie beta blokátorov je možné až po dostatočne dlhej dobe liečby alfa-1 blokátormi (cca 2 dni), v opačnom prípade môžeme vyprovokovať hypertenznú krízu zablokovaním beta-2 receptormi mediovanej vazodilatácie s ponechaním alfa receptormi mediovanej periférnej vazokonstrikcie. Pred operáciou sa odporúča znovu prechod na i.v. podávanie urapidilu v uvedených dávkach, ktoré sa perioperačne upravujú podľa aktuálneho TK [14].
Perioperačne je možné použiť fentolamin, ale v SR je prístupný iba na mimoriadny dovoz rovnako ako nitroprusid sodný. Komorové arytmie sa odporúča liečiť esmololom i.v. Dôležitá je aj dostatočná objemová náhrada, ktorú je vhodné realizovať už v prípravnom období 14 dní, väčšinou infúziami fyziologického roztoku alebo liberalizáciou príjmu tekutín a večer pred operáciou znovu fyziologickým roztokom v dávke 10–20 ml/kg/12 hodín. Vyhneme sa tým závažným hypotenziám po odstránení tumoru.
Image 3. Laparoskopicky extrahovaný feochromocytóm u 12-ročného pacienta s potvrdeným VHL syndrómom. Snímka laparoskopicky extrahovaného tumoru vľavo veľkosti 70 x 40 x 30 mm. <br><b>Fig. 3.</b> Laparoscopically extracted pheochromocytoma in 12 years old patient with confirmed VHL syndrome. Photo of laparoscopically extracted left sided tumor 70 x 40 x 30 mm of size. 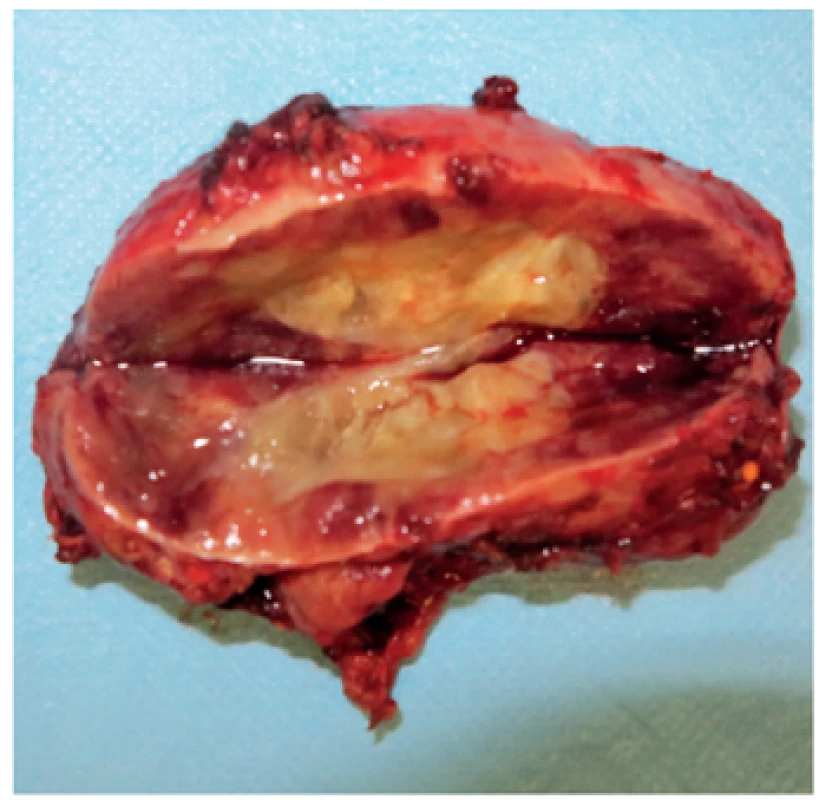
Chirurgická liečba
Väčšina pracovísk dnes uprednostňuje laparoskopické odstránenie tumorov transperitoneálnym alebo retroperitoneálnym prístupom. U bilaterálnych tumorov, hlavne u mladších detí, u ktorých je niekedy problematické zabezpečiť spoľahlivo pravidelnú medikáciu, je výhodné na strane menšieho tumoru ponechať časť kôry nadobličky in situ, čím sa môžeme vyhnúť celoživotnej potrebe substitúcie mineralokortikoidov a glukokortikoidov. Technicky býva náročné ponechať vaskularizovanú časť kôry bez toho, aby nezostala aj určitá časť drene nadobličky. To je príčinou toho, že môže dôjsť k rekurencii FEO. Niektoré štúdie uvádzajú pri tomto postupe 10–38 % rekurencií [15].
Peri - a postoperačná starostlivosť vyžaduje invazívny monitoring a anestéziológa dobre oboznámeného s problematikou FEO, hlavne rizikom prudkých vzostupov TK a arytmií pri úvode do anestézie a pri manipulácii s tumorom pred jeho odstránením. Pooperačne musíme sledovať hlavne sklon k hypotenzii a možnú hypoglykémiu.
Po bilaterálnej adrenalektómii vyžaduje pacient celoživotnú substitučnú liečbu. Pri ponechaní časti kôry nadobličky sa liečba riadi výsledkom stimulačného ACTH testu. Všetci pacienti po adrenalektómii si vyžadujú zvýšenie substitučnej liečby v záťažových situáciách.
Prognóza
Prognóza detí po adekvátnom odstránení tumorov je rôzna, od úplného uzdravenia pri dobre ohraničených nadobličkových FEO až po nepriaznivú prognózu a krátkodobé prežívanie pri metastaticky postihnutých orgánoch ako sú pečeň, pľúca a mozog pri malígnych tumoroch. U detí je menej ako 10 % FEO malígnych [16]. Z týchto prežíva 3 roky 73 % a 5 rokov iba 40–45 % po stanovení diagnózy [17]. Ani normálny histologický nález nie je absolútnou istotou, že v budúcnosti nemôže dôjsť k výskytu malígnych metastáz [18]. Tieto deti preto vyžadujú dlhodobé biochemické a klinické sledovanie, o to viac, že u mnohých je FEO súčasťou iných hereditárnych syndrómov, ktoré musia byť pravidelné sledované multidisciplinárnym tímom odborníkov.
Diskusia
Feochromocytóm je zriedkavé ochorenie v detskom veku. Je príčinou sekundárnej hypertenzie iba u 1–2 % detí po vylúčení omnoho častejších príčin arteriálnej hypertenzie (nefrogénnej, renovaskulárnej, koarktácie aorty). U pacientov s VHL syndrómom sa FEO/PGL vyskytuje až v 10–20 % a často býva bilaterálny a/alebo multifokálny a prezentuje sa už v detstve [5]. Klinické prejavy FEO/PGL môžu byť veľmi variabilné. Niektorí pacienti nemajú žiadne príznaky a sú náhodne diagnostikovaní pri CT alebo MRI pre iné obtiaže, ako sú bolesti brucha alebo chrbta, až po prípady prezentujúce sa vážnymi komplikáciami, prípadne aj úmrtím pacienta. Takto sa popisuje až 25 % prípadov FEO [19].
Aj u dieťaťa s typickými príznakmi ako bolesti hlavy, s epizódami profúzneho potenia, palpitácií a stavov úzkosti sa nemusí pri jedno rázovom meraní zachytiť zvýšený TK. Cennejšie a výpovednejšie je 24-hodinové ambulantné monitorovanie TK, ako je odporúčané v pediatrickej literatúre, ktoré potvrdí intermitentnú hypertenziu [20].
Sonografické vyšetrenie nadobličiek je síce rýchle a neinvazívne vyšetrenie, malo by však byť považované len ako skríningové vyšetrenie pre jeho nízku citlivosť [21], zobrazovacím vyšetrením voľby zostáva jednoznačne MRI alebo CT.
Vzhľadom k možnosti recidívy feochromocytómu, je nevyhnutné dlhodobé sledovanie pacientov. Kortikoidná substitúcia sa upravuje podľa nárokov rastúceho organizmu. Dlhodobo musíme tiež sledovať vývoj orgánových zmien spôsobených hypertenziou.
Záver
Napriek tomu, že FEO/PGL sa vyskytuje relatívne zriedkavo v detskom veku, je potrebné, aby pediater myslel na túto možnosť a inicioval cielené odborné vyšetrenia, hlavne v kontexte známych familiárnych ochorení. Triáda bolestí hlavy, palpitácií a profúzneho potenia u detí v kombinácii s hypertenziou by mala vzbudiť okamžité podozrenie na FEO. Z biochemických vyšetrení je dnes vyšetrením voľby stanovenie sérového normetanefrínu a metanefrínu. Z morfologických vyšetrení sa zdá, že ultrasonografia brucha je síce najmenej invazívna, ale v porovnaní s CT a MRI aj najmenej citlivá. CT alebo MRI sú vyšetrením voľby brucha a panvy a majú porovnateľnú senzitivitu. Jedinou kauzálnou liečbou je chirurgická adrenalektómia. Predoperačná stabilizácia a perioperačný manažment sú podmienkou úspešného výsledku. V našich podmienkách preferujeme kombináciu alfa blokátora urapidilu v kombinácii s beta blokátorom metoprololom pri tachykardii a/alebo s kalciovým blokátorom. Zabezpečenie predoperačnej normovolémie zníži riziko pooperačnej hypotenzie. U detí je po úspešnej chirurgickej extrakcii väčšinou priaznivá prognóza, vyžadujú však dlhodobé sledovanie multidisciplinárnym tímom odborníkov. U všetkých FEO u detí je nutné pátranie po genetickej príčine.
Poznámka:
Vážení čtenáři, do tohoto čísla našeho časopisu jsme zařadili sdělení, které má na závěr otázky. Po přečtení článku můžete ihned zjistit, zda jste vše správně pochopili a co jste si také zapamatovali. Naleznete zde i správné odpovědi.
Otázky
1. Väčšina FEO u detí produkuje:
- a) Adrenalín
- b) Dopamín
- c) Noradrenalín
- d) Metanefrín
2. Pre diagnostiku FEO je typická triáda:
- a) Bolesti hlavy
- b) Kardiomegália
- c) Potenie
- d) Búšenie srdca
3. FEO je častou súčasťou nasledujúcich genetických syndrómov:
- a) Fabryho choroba
- b) Alportov syndróm
- c) Bardetov-Biedelov syndróm
- d) von Hippelov-Lindauov syndróm
4. Liečbu pacienta s hypertenziou u FEO začíname:
- a) Beta blokátorom
- b) Alfa blokátorom v kombinácii s beta blokátorom
- c) Alfa blokátorom
- d) Alfa blokátorom a pri tachykardii v kombinácii s beta blokátorom s 48-hodinovým posunom
Správne odpovede
- c
- a, c, d
- d
- c, d
Došlo: 24. 3. 2015
Přijato: 1. 7. 2015
MUDr. Pavol Kunovský, PhD., MBA
Národný ústav srdcových a cievnych chorôb, a.s.
Detské kardiocentrum
JIS kardiologického oddelenia
Pod krásnou hôrkou 1
800 00 Bratislava
Slovenská republika
e-mail: pavol.kunovsky@gmail.com
Sources
1. Goodman MT, Gurney JG, Smith MA, et al. Sympathetic nervous system tumors. In: Ries LAG, Smith MA, Gurney JG, et al. Cancer Incidence and Survival among Children and Adolescents: United States SEER Program 1975–1995. NIH Pub. No. 99-4649. Bethesda: MD, 1999 : 65–72.
2. Waguespack SG, Rich T, Grubbs E, et al. A current review of the etiology, diagnosis, and treatment of pediatric pheochromocytoma and paraganglioma. J Clin Endocrinol Metab 95 : 2010 : 2023–2037.
3. Vuguin PM. Pediatric Pheochromocytoma:2013. http://emedicine.medscape.com/article/988683-overview.
4. Musil Z, Vícha A, Zelinka T, et al. Hereditární feochromocytóm a paraganglióm. Klin Onkol 2012; 25 : 21–26.
5. Neumann HP, Bausch B, McWhinney SR, et al. Germ-line mutations in nonsyndromic pheochromocytoma. N Engl J Med 2002; 346 : 1459–1466.
6. Widimsky J Jr, Zelinka T, Petrak O, et al. Pheochromocytoma: diagnosis and treatment. Čas Lék čes 2009; 148 (8): 365–369.
7. Widimsky J Jr, Zelinka T, Petrak O, et al. Diagnostic and therapeutic procedures in pheochromocytoma: current trends. Vnitr Lek 2007; 53 (4): 428–433.
8. Kosmálová V. Feochromcytóm. Vask med 2013; 5 (2): 70–73.
9. Yu R, Nissen NN, Chopra P, et al. Diagnosis and treatment of pheochromocytoma in an academic hospital from 1997 to 2007. Am J Med 2009; 122 (1): 85–95.
10. Lenders JW, Pacak K, Walther MM, et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002; 287 : 1427–1434.
11. Eisenhofer G, Goldstein DS, Walther MM, et al. Biochemical diagnosis of pheochromocytoma: how to distinguish true - from false-positive test results. J Clin Endocrinol Metab 2003; 88 : 2656–2666.
12. Pacak K, Eisenhofer G, Ahlman H, et al. Pheochromocytoma: recommendations for clinical practice from the First International Symposium. Nat Clin Pract Endocrinol Metab 2005; 3 : 92–102.
13. Janota T, Zelinka T. Urapidil, lék první volby pro těžké hypertenzní stavy. Interv Akut Kardiol 2013; 12 (3): 150–152.
14. Ludwig AD, Feig DI, Brandt ML, et al. Recent advances in the diagnosis and treatment of pheochromocytoma in children. Am J Surg 2007; 194 : 792–796.
15. Asari R, Scheuba C, Kaczirek K, et al. Estimated risk of pheochromocytoma recurrence after adrenal-sparing surgery in patients with multiple endocrine neoplasia type 2A. Arch Surg 2006; 141 : 1199–1205.
16. Reddy VS, O’Neill JA Jr, Holcomb GW 3rd, et al. Twenty-five-year surgical experience with pheochromocytoma in children. Am Surg 2000; 66 : 1085–1091.
17. Coutant R, Pein F, Adamsbaum C, et al. Prognosis of children with malignant pheochromocytoma. Report of 2 cases and review of the literature. Horm Res 1999; 52 : 145–149.
18. Ross JH. Pheochromocytoma. Special consideration in children. Urol Clin North Am 2000; 27 (3): 393–402.
19. Amar L, Servais A, Gimenez-Roqueplo AP, et al. Year of diagnosis, features at presentation, and risk of recurrence in patients with pheochromocytoma or secreting paraganglioma. J Clin Endocrinol Metab 2005; 90 (4): 2110–2116.
20. Kovács L. Meranie krvného tlaku a hypertenzia u detí. Pediatr prax 2007; 1 : 5–11.
21. Ilias I, Pacak K. Current approaches and recommended algorithm for the diagnostic localization of pheochromocytoma. J Clin Endocrinol Metab 2004; 89 (2): 479–491.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 4-
All articles in this issue
- Screening sluchu novorozenců ve FN Brno
- Hyperbarická oxygenoterapie u pediatrických pacientů v Centru hyperbarické medicíny Ostrava v letech 2007–2011
- Matematické modelovanie infekčných ochorení detského veku
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
- Vodní dýmka není bezpečnou alternativou klasických cigaret!
- Enzymová substituční terapie u lysosomálních onemocnění
- Možnosti zmierňovania detskej bolesti na psychosociálnej úrovni
- Specifika bolestivého chování u dětí s těžkým kombinovaným postižením
- Úskalia diagnostiky a liečby feochromocytómu u detí
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Enzymová substituční terapie u lysosomálních onemocnění
- Úskalia diagnostiky a liečby feochromocytómu u detí
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
- Možnosti zmierňovania detskej bolesti na psychosociálnej úrovni
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

