-
Medical journals
- Career
Klinická a laboratorní charakteristika 22 dětí s Kawasakiho nemocí
: H. Vyhnánková 1; R. Vyhnánek 2; V. Dvořáková 1; H. Kolářová 1; L. Vitnerová 1; M. Magner 1; H. Houšťková 2; J. Zeman 1; T. Honzík 1
: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Prahapřednosta prof. MUDr. J. Zeman, DrSc. 1; Pediatrická klinika IPVZ a UK 1. LF, Thomayerova nemocnice, Prahapřednostka doc. MUDr. H. Houšťková, CSc. 2
: Čes-slov Pediat 2014; 69 (4): 203-212.
: Original Papers
Kawasakiho nemoc (KN) patří mezi akutní vaskulitidy. Mezi diagnostická kritéria KN patří: 5 dní trvající horečka, serózní konjunktivitida, postižení sliznic dutiny ústní, krční lymfadenopatie, exantém a otok a začervenání dlaní a plosek s následným olupováním kůže. Nejzávažnější komplikací je rozvoj koronárních aneuryzmat (CA) a úmrtí. Incidence KN v mnoha zemích narůstá, ve vyspělých zemích se jedná o jednu z nejčastějších příčin získaných onemocnění srdce u dětí.
Cílem studie bylo retrospektivně analyzovat klinický průběh onemocnění a laboratorní nálezy u 22 dětí s KN a porovnat naše zkušenosti s poznatky v literatuře.
Soubor a metody:
Dvaadvacet dětí s KN ve věku od 2 měsíců do 8 let (32 ± 30 měsíců) bylo diagnostikováno v období od ledna 2001 do prosince 2013.Výsledky:
Specifické klinické projevy KN, jako je exantém, konjunktivitida a slizniční změny, byly nalezeny u 91 % dětí, naopak výrazná krční lymfadenopatie byla přítomná jen u poloviny pacientů. Nejčastějším nespecifickým projevem byl průjem (36,4 %). V kojeneckém věku onemocnělo 7 dětí (32 %), tři z nich již v prvních 6 měsících, 11 dětí (50 %) onemocnělo ve věku 1–4 roky a čtyři děti onemocněly ve věku nad 5 let. Inkompletní formu KN mělo 6 dětí (27 %), převážně se jednalo o kojence. Až na dvě děti bylo podání imunoglobulinů zahájeno včas (do 10. dne horeček). K rozvoji CA došlo u jednoho dítěte, u kterého imunoglobuliny podány nebyly.Závěr:
Prognóza včas léčených dětí s KN je příznivá. Rizikovou skupinou však zůstávají kojenci s inkompletní formou KN, u kterých může dojít k oddálení diagnostiky s pozdním zahájením léčby.Klíčová slova:
Kawasakiho nemoc, klasická a inkompletní forma, časná manifestace, koronární aneuryzmataÚvod
Kawasakiho nemoc (KN) popsal japonský pediatr Tomisaku Kawasaki v roce 1967 u 50 dě-tí s horečkou, krční lymfadenopatií, bilaterální konjunktivitidou, změnami sliznice dutiny ústní a kožním exantémem, převážně na dlaních a ploskách s olupováním v druhém týdnu nemoci [1]. Nejzávažnější komplikací u neléčených pacientů je ve 25 % případů rozvoj koronárních aneuryzmat (CA) s mortalitou až 2 % [2]. KN je akutní febrilní vaskulitidou s postižením malých a středně velkých tepen. Po Henochově-Schönleinově purpuře se jedná o druhou nejčastější vaskulitidu u dětí [3] a zároveň jednu z nejčastějších příčin získaných onemocnění srdce ve vyspělých zemích [4, 5]. V Japonsku, Číně, Koreji, Indii a Anglii incidence KN stoupá [6–8], zatímco v USA, Kanadě a severských zemích vč. Dánska došlo po původním nárůstu ke stabilizaci výskytu [9–11].
Etiologie onemocnění zůstává nejasná. Vzhledem k vyššímu výskytu KN v oblasti východní Asie (nejvyšší výskyt v Japonsku 240/100 000) [7] a častějšímu familiárnímu výskytu se předpokládá existence genetické predispozice [12–15]. Jako samotný spouštěč rozvoje vaskulitidy je vzhledem k sezonnímu výskytu (zima, jaro) zvažována probíhající virová infekce [9, 10, 16–18]. Celosvětově se většina případů KN prezentuje u dětí věkové skupiny 1–4 roky (50–75 %) [9, 11, 19, 20]. Do kojenecké skupiny spadá 4–30 % případů [7, 9–11, 19–21]. Zatímco v oblasti východní Asie nebo v Dánsku je vrchol incidence dlouhodobě dokumentován u kojenců mezi 6.–11. měsícem [7, 9, 13, 22], v Severní Americe a ostatních severských státech je to až u dětí nad rok věku [10, 11, 19].
V naší práci předkládáme výsledky retrospektivní studie u 22 dětí s KN. U téměř třetiny dětí se onemocnění manifestovalo již v kojeneckém věku. Za významné považujeme zjištění, že u více než poloviny kojenců s KN byla přítomna inkompletní forma onemocnění, u které může dojít k oddálení diagnostiky a pozdnímu zahájení léčby s následně vyšším rizikem rozvoje CA.
Soubor a metody
Do retrospektivní studie bylo zahrnuto 22 dětí hospitalizovaných od ledna 2001 do prosince 2013 na Klinice dětského a dorostového lékařství VFN v Praze (8 dětí) a Pediatrické klinice Thomayerovy nemocnice (14 dětí) ve věku od 2 měsíců do 8 let (32 ± 30 měsíců, tab. 1).
Pro diagnostiku KN byla použita klinická kritéria American Heart Association (AHA) z roku 2004, podle kterých je diagnóza klasické KN stanovena na základě horečky trvající minimálně 5 dní a alespoň 4 z dalších 5 kritérií (bilaterální serózní konjunktivitida; polymorfní kožní exantém; postižení sliznic – faryngitida/začervenání sliznice dutiny ústní/ /sytě červené nebo popraskané rty/malinový jazyk; prosáknutí, otok a začervenání dlaní a plosek nebo periunguální olupování rukou nebo nohou; uni-/bilaterální krční lymfadenopatie ≥1,5 cm) nebo <4 z 5 za přítomnosti echokardiograficky nebo angiograficky prokázaných změn na koronárních tepnách [5]. Za zmínku stojí fakt, že v iniciální akutní fázi KN jsou koronární abnormality při echokardiografickém vyšetření patrny jako zvýšená intenzita (echo)signálu stěn koronárních cév (v průměru 5,4 dnů po nástupu onemocnění) [23].
Při určování inkompletní formy KN, u které nejsou všechna specifická klinická kritéria vyjádřena, jsme se řídili základním kritériem 5 dní trvajících horeček a přítomností 2 nebo 3 z 5 specifických klinických kritérií. Dále musela být splněna podmínka přítomnosti zvýšené zánětlivé aktivity (CRP >30 mg/l a/nebo sedimentace erytrocytů >40 mm//hod) současně s více než třemi pomocnými laboratorními kritérii – anemie; trombocytóza 7. den horeček >450 000/µl; leukocytóza >15 000/µl; hypoalbuminemie (≤30 g/l); elevace jaterních testů [5].
I když trvání horeček je důležité z hlediska definice a standardizace diagnostiky KN řídících se podle AHA kritérií, v klinické praxi bychom neměli váhat, ani pokud v některých vzácnějších případech toto kritérium splněno není (například febrilie poklesnou již před 5. dnem), ale máme na KN vážné podezření z ostatních klinických projevů. Horečka se může objevit znovu a s ní již i detekovatelná CA. Podle japonských kritérií JCS (Japanese Circulation Society) je totiž horečka pou-ze jedním z 6 diagnostických kritérií a k určení klasické formy stačí splnění jakýchkoli 5 z 6 kritérií [23].
Soubor pacientů jsme rozdělili do 4 věkových skupin. Skupina I (0–6 měsíců; n = 3), II (6–12 měsíců; n = 4), III (1–4 roky; n = 11) a IV (>5 let; n = 4). V jednotlivých skupinách jsme analyzovali výskyt příznaků, laboratorní nálezy, včasnost zahájení terapie a krátkodobý i dlouhodobý průběh onemocnění. Získaná data jsme porovnali s údaji ve světové literatuře (tab. 1 a 2).
Výsledky
V našem souboru 22 dětí s KN (tab. 1, graf 1) bylo 7 dětí (32 %) v kojeneckém věku. Tři z nich (14 %) byly mladší než 6 měsíců (skupina I), nejmladší byla 2měsíční dívka a 4 děti (18 %) byly ve věku 6–12 měsíců (skupina II). Polovina dětí s KN (11 dětí) byla ve věku 1–4 roky (skupina III). Zbývající 4 děti (18 %) byly ve věku 5–9 let (skupina IV). Inkompletní forma KN se projevila u 6 dětí (27 %), u 4 z nich v kojeneckém věku (tab. 1). V celém souboru převažovali chlapci nad dívkami (14 chlapců, 8 dívek, poměr 1,75 : 1), ale v kojeneckém věku nebyly tyto rozdíly patrné (3 chlapci a 4 dívky) (tab. 1).
1. Srovnání výskytu Kawasakiho nemoci v jednotlivých věkových kategoriích u 22 českých pacientů ve srovnání se skupinou 1519 dětí (Manlhiot et al., 2009; Hao-Chuan Liu et al., 2012). 
1. Klinické projevy 22 českých pacientů s Kawasakiho nemocí ve srovnání se skupinou 1519 dětí (Manlhiot et al., 2009, Hao-Chuan Liu et al., 2012). 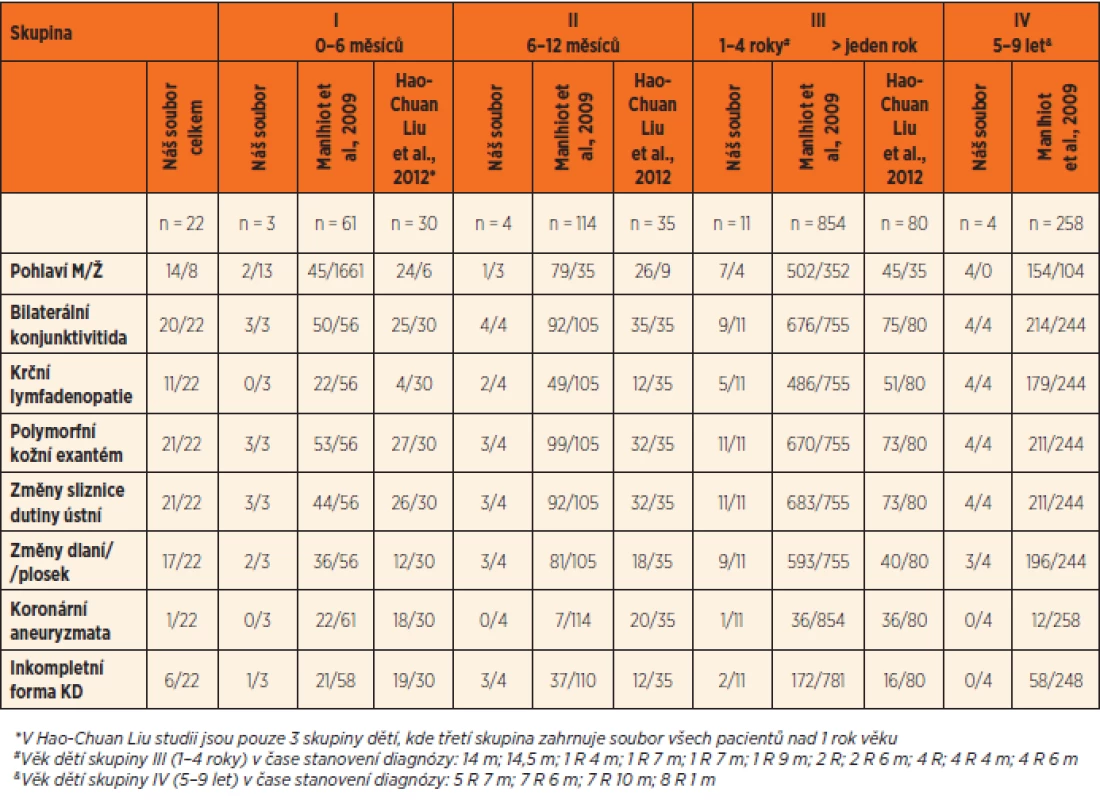
Z klinických symptomů byly v 91 % přítomné exantém, konjunktivitida a slizniční projevy. Začervenání a otoky dlaní a plosek byly v prvním týdnu onemocnění popisovány u 59 % dětí, olupování u 54,5 %, ale až ve 2.–3. týdnu od začátku horeček. Nejméně častá byla krční lymfadenopatie (50 %) (tab. 1).
Z nespecifických klinických projevů byl nejčastější průjem (36,4 %), kašel (22,7 %), zvracení (13,6 %) a bolesti břicha (13,6 %). Pro známky meningeálního dráždění byla u 4 pa-cientů (18,1 %) provedena lumbální punkce s nálezem mírně zvýšeného počtu elementů, jinak s normálními biochemickými parametry. U dvou dětí se v průběhu nemoci objevily artralgie, hydrops žlučníku diagnostikován nebyl.
V laboratorních vyšetřeních se nejčastěji vyskytovala anemie (95 %) a zvýšená zánětlivá aktivita (91 %) s hodnotami CRP 136 ± 81 mg/l. Hepatopatie byla přítomná v 73 % případů. U dětí starších 1 roku věku byly hodnoty ALT 2x a hodnoty AST 3x vyšší než norma, u kojenců pak ALT přesahovalo normu 1,6x a AST 1,2x. Hladina albuminu byla vyšetřena jen u 16 dětí, ale u 5 z nich (31 %) byla přítomná hypoalbuminemie s hodnotami <30 g/l.
Počet leukocytů byl v průměru 17 600 ± 4600//µl a počet trombocytů 637 000 ± 163 000/µl.Sedmý den horeček mělo trombocytózu >450 000/µl 82 % dětí, ale všechny děti ve věku do 6 měsíců měly počet trombocytů >700 000/ /µl, což je hodnota, která je některými autory považována za rizikový faktor rozvoje CA [23]. U starších kojenců jsme takto vysoký počet trombocytů již nepozorovali (tab. 2).
2. Laboratorní nálezy u 22 českých pacientů s Kawasakiho nemocí. 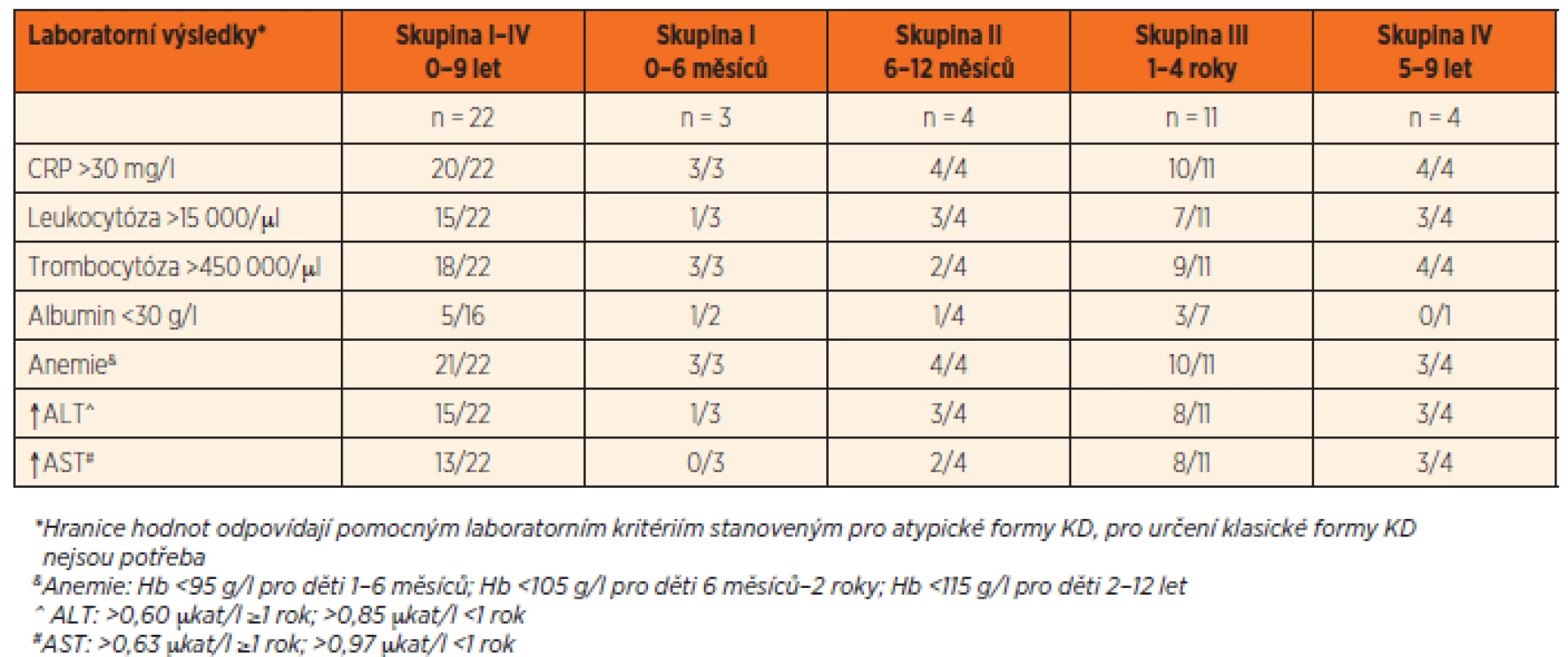
U většiny dětí byla léčba imunoglobuliny v dávce 2 g/kg zahájena do 6. a nejpozději 9. dne od vzniku horečky. U žádného z nich nedošlo k rozvoji CA. U jednoho kojence byly imunoglobuliny aplikovány až 11. den od vzniku horeček, ale ani u tohoto pacienta nedošlo k rozvoji CA. Naopak k rozvoji CA došlo u jednoho dvouletého dítěte, u kterého nebyla léčba podána a jehož diagnóza KN byla stanovena až zpětně (tab. 1).
Diskuse
Incidence KN se v jednotlivých státech výrazně liší, nejvyšší výskyt hlásí státy východní Asie: Japonsko 240 : 100 000 v roce 2010 [7] a Korea 134 : 100 000 v roce 2011 [25]. Inciden-ce severských zemí se pohybuje mezi 4,9–11,4 : 100 000 [11], v USA 19 : 100 000 (rok 2009) [8], v České republice 1,6 : 100 000 (1997–1999) [26]. Některé státy hlásí nárůst incidence KN (Japonsko, Čína, Korea, Indie, Anglie) [6–8], zatímco v jiných státech se rostoucí trend již zastavil (USA, Kanada, Norsko, Finsko, Švédsko, Dánsko) [8–11]. Zatím není jasné, zda se jedná o skutečné změny ve výskytu KN nebo jen o častější diagnostiku inkompletních forem onemocnění. Teoreticky je možné, že případná falešně pozitivní diagnostika inkompletní formy KN v některých regionech může zvyšovat celkovou incidenci KN.
Studie se shodují, že největší skupina dětí s KN je ve věku 1–4 let (cca 50–75 %) [9–11, 19]. Liší se ale v udávaném vrcholu incidence. Například z národních databází hospitalizací USA (r. 2006) je patrné maximum výskytu KN u 2letých dětí, kojenci jsou s 23,3 % na druhém místě [10]. Nejvíce případů KN v rámci USA je dokumentováno z Havaje (56 : 100 000 z roku 2001) s vrcholem incidence u kojenců (29 %) a následným postupným poklesem výskytu u ročních a dvouletých dětí až k minimu u dětí tříletých [20]. Takto vysoká celková incidence a posun výskytu onemocnění do kojeneckého věku jsou zřejmě dány skutečností, že zhruba polovinu populace tvoří imigranti//potomci obyvatel Asie a Oceánie [27], pro které je právě takováto distribuce charakteristická. Japonské národní průzkumy konané každé dva roky udávají vrchol výskytu KN (27,8 %) u kojenců (vrchol mezi 6.–11. měsícem) a plynulý pozvolný pokles výskytu do starších věkových kategorií [7]. Tento trend zůstává během posledních 10 let neměnný [7]. Obdobné údaje přináší tchajwanská národní studie [28]. Práce Hao-Chuan Lia se 145 tchajwanskými pacienty popisuje dokonce 45 % dětí s diagnózou KN v kojeneckém věku (tab. 1, graf 1) [29]. Další práce přináší, co se týče peaku incidence, obdobné výsledky i v evropském regionu. Dánská studie Fischera s 261 dětmi udává maximum výskytu KN u kojenců (26 %) s vrcholem mezi 4. a 6. měsícem věku a následuje plynulý pokles přes roční a dvouleté děti (23 % a 20 %). Do věkové skupiny 1–4 roky spadá 74 % dětí [9]. Stejně tak v Austrálii, kde je vrchol v kojeneckém věku (20 %), druhý vrchol u čtyřletých dětí a následují roční děti [21]. Naopak severské státy napodobují svojí distribucí KN spíše USA s vrcholem výskytu ve věkové kategorii 1–4 roky, kam spadá ve Finsku 51 %, ve Švédsku 60 % a v Norsku 61 % dětí vs. 18 %, 12 % a 4 % ve skupině kojenců [11]. Obdobně pak kanadská studie Manlhiota (1-4 roky 62 % vs. kojenci 12 %) (tab. 1, graf 1) [19]. V naší studii jsme zaznamenali vrchol výskytu v kojeneckém věku a u ročních dětí – shodně po 32 %, ve srovnání se zahraniční literaturou se jedná o vysoká čísla blížící se údajům z asijských zemí. Do věkové kategorie 1–4 roky spadalo celkem 50 % všech KN (tab. 1, graf 1). Z našeho souboru se tedy KN prezentovala v 64 % u dětí ≤24 měsíců.
Zajímavý je výskyt KN u 2měsíčního a 3měsíčního kojence v našem souboru. Skupina dětí pod 6 měsíců je ve většině studií malá (7,7–17 %) [30–32], v Manlhiotově studii 4 %, ve studii Hao-Chuan Lia ale až 21 %, v naší práci 14 % (tab. 1, graf 1). Výskyt KN u dětí do 3 měsíců je velmi vzácný a pohybuje se mezi 1,7–2,2 % [10, 32–34]. Zvažuje se protektivní účinek přenesených mateřských protilátek a menší riziko setkání se s patogenem [34].
Výskyt inkompletní formy udává literatura mezi 18 až 28 % [7, 19, 35–38]. Incidence inkompletních forem narůstá. Nelze však s jistotou říci, zda se nejedná spíše jen o zlepšení diagnostiky či dokonce o hyperdiagnostiku. V Japonsku vzrostl výskyt inkompletní formy KN v období let 2007/08 – 2009/10 o 7 % (z 20,2 % na 27,2 %) [7, 39]. Korejská studie z nemocnice Daejonu srovnává data z let 2004/05 a 2011/12 a popisuje 20,6% nárůst (z 45,3 % na 65,9 %)[40]. V našem souboru byla inkompletní forma přítomná u 6 dětí (27 %), z toho se 2/3 prezentovaly v kojeneckém věku, což odpovídá 57 % kojenců (tab. 1). Výsledky naší studie souhlasí s údaji většiny zahraničních prací o incidenci inkompletní formy KN a vyšším výskytu v kojeneckém věku [7, 19, 34–38, 41].
Dřívější studie dokumentují predominanci chlapců v poměru 1,5–2 : 1 [9–11, 20, 24]. Mužské pohlaví je jedním z rizikových faktorů rozvoje CA [24]. I v našem souboru celkově převažovali chlapci nad dívkami v poměru 1,75 : 1 (14 chlapců, 8 dívek) (tab. 1).
Ze specifických klinických příznaků byly nejčastěji (v 91 %) přítomny exantém, konjunktivitida a slizniční projevy. Exantém měl ve většině případů charakter makulózního nebo makulopapulózního růžovočerveného splývavého rashe, nejčastěji na trupu a končetinách. Nelze ale nezmínit i opakovaně popisované výsevy v oblasti třísel a perianálně. Výsev exantému v těchto lokalizacích by mohl být zavádějící, stejně tak jako urtikariální nebo skarlatiniformní charakter exantému některých případů. Ze slizničních projevů byla u většiny případů patrná faryngitida a popraskané nebo sytě červené rty. Při odebírání anamnézy je důležitý cílený dotaz na prosáknutí dlaní nebo plosek, protože otoky dlaní a plosek byly v prvním týdnu onemocnění popisovány u více než poloviny našich pacientů a předcházely 2–3 týdny rozvoji olupování kůže na konečcích prstů. Nejčastěji (v 50 %) byla pozorována absence krční lymfadenopatie. Z tabulky 1 je patrné, že obdobné výsledky přináší i další studie [19, 29]. Dokonce i původní Kawasakiho práce přináší srovnatelná data (konjunktivitida 98 %, exantém 86 %, změny sliznice dutiny ústní 96 %, krční lymfadenopatie 68 %) [1].
KN bývá často provázena širokou škálou nespecifických klinických příznaků (artritida, artralgie, průjem, zvracení, bolest břicha, postižení jater, hydrops žlučníku, paralytický ileus, rýma, kašel, pneumonitida, extrémní iritabilita, aseptická meningitida, obrna lícního nervu, indurace v místě BCG vakcinace, přední uveitida) [5, 23, 42]. V našem souboru byly nejčastějšími projevy postižení gastrointestinálního nebo respiračního traktu. Různý stupeň iritability je přítomen téměř vždy, často jsou děti více neklidné než při jiných horečnatých onemocněních, popisuje se až extrémní neklid. Přesný mechanismus není znám, ale může být projevem aseptické meningitidy [43]. Přítomnost nespecifických projevů může být zavádějící. Průběh KN, zvláště atypických forem, pak může imitovat jiná onemocnění.
Co se týče pomocných laboratorních parametrů (tab. 2), i v naší studii mají spíše pomocný diagnostický než prediktivní význam. Nejčastěji byla přítomná anemie (95 %), která byla výraznější u kojenců. Ti z hlediska rozvoje CA spadají do rizikové skupiny a mezi tíží anemie a rizikem CA byla popsána pozitivní korelace [24]. Jako jeden z dalších možných rizikových faktorů rozvoje CA je uváděná hypoalbuminemie [44]. V naší práci jsme tuto hypotézu nepotvrdili. Ve skupině kojenců, kde je teoreticky riziko CA nejvyšší, i když v naší studii se u žádného kojence CA nerozvinuly, byla hypoalbuminemie <30 g/l přítomná pouze u 2 z 5 vyšetřovaných kojenců. Hepatopatii jsme zachytili v 75 % případů. Tíže hepatopatie byla větší u dětí starších 12 měsíců. Rosenfeldova studie kojenců označuje trombocytózu >700 000/µl jako rizikový faktor rozvoje CA [24]. V naší práci jsme u všech dětí do věku 6 měsíců zaznamenali hladinu trombocytů vyšší než 700 000/µl.To by opět podporovalo fakt, že kojenci, obzvlášť ti nejmenší, jsou ohroženi vyšším rizikem rozvoje koronárních aneuryzmat. I ve studii Hao-Chuan Lia byla u dětí mladších 6 měsíců nejvýraznější trombocytóza, ale i anemie a nejnižší hladina albuminu [29]. Korejská studie Hya Jin Kanga, která sledovala vývoj laboratorních parametrů KN za období let 2004–2012, nezaznamenala posun ve sledovaných parametrech (hemoglobin, leukocytóza, trombocytóza, zánětlivá aktivita) během tohoto období [40].
Terapie intravenózními imunoglobuliny v jednorázové dávce 2 g/kg v kombinaci s vysokodávkovanou kyselinou acetylsalicylovou (50–100 mg/kg/den) podaných do 10. dne horeček snižuje riziko rozvoje CA [5, 45]. V našem souboru se nerozvinulo koronární postižení u žádného pacienta včas léčeného imunoglobuliny (tab. 1). Na tomto místě je nutné zmínit, že existují pacienti s KN rezistentní nebo ne zcela responzivní k terapii intravenózními imunoglobuliny. Jsou dokonce již vypracovány predikční skórovací systémy odhadující míru rizika rezistence [46]. U rezistentních pacientů je indikována terapie systémovými kortikoidy případně doplněná druhou dávkou intravenózních imunoglobulinů [47].
Počet dětí s anamnézou KN a CA, které se dožijí dospělého věku, vzrůstá. Předmětem studií zatím je, zda anamnéza KN je predisponujícím faktorem předčasného rozvoje aterosklerózy. Přesto již byla do AHA guidelines zahrnuta i prevence rozvoje aterosklerózy, která je stejná jako u metabolického syndromu (redukce nadváhy, absence kouření, antihypertenzní terapie, farmakologická terapie přítomné hyperlipidemie či hyperglykemie). Malé studie zabývající se vlivem statinů na prevenci rozvoje aterosklerózy u děti s anamnézou KN již probíhají a přináší dobré výsledky. Je ale potřeba dalších studií, abychom byli schopni jednoznačně říci, zda statiny mohou být užitečné jako adjuvantní terapie KN [23, 48–50].
Diferenciální diagnostika KN je široká. Obdobně jako KN se v dutině ústní a oblasti spojivek může prezentovat infekce způsobená adenovirem a virem spalniček. Syndrom ruka-noha-ústa vyvolaný Coxsackie virem má zase velmi podobný nález v dutině ústní, na dlaních a ploskách. Spála patří do dif. diagnostiky nejen pro nález v dutině ústní, ale i pro exantém a olupování konečků prstů. Mezi vzácnější infekce spadají do dif. diagnostiky KN rickettsiové infekce a leptospiróza. Z neinfekčních příčin zmiňme systémovou formu juvenilní idiopatické artritidy a hematologickou malignitu.
Závěr
Výsledky naší práce potvrzují trend přesunu výskytu KN do kojeneckého věku. Děti do jednoho roku věku přitom patří do nejohroženější skupiny z hlediska rozvoje CA, častěji se u nich prezentuje inkompletní forma KN. Atypický průběh onemocnění v kombinaci s nespecifickými symptomy jako průjem, zvracení, bolesti břicha, kašel, artralgie či iritabilita může ztížit a oddálit diagnostiku KN. Přitom pozdní zahájení terapie imunoglobuliny zvyšuje riziko rozvoje CA a dalších vážných komplikací včetně úmrtí. V kojeneckém věku jsou častěji přítomné i nepříznivé laboratorní parametry zvažované jako prediktivní faktory rozvoje CA (významná anemie, vysoká trombocytóza, hypoalbuminemie). Na diagnózu KN bychom měli pomýšlet vždy při protrahovaném febrilním průběhu nereagujícím na antibiotika a nejasné diagnóze.
Zkratky:
KN – Kawasakiho nemoc,
CA – koronární aneuryzma,
AHA – American Heart Association,
JCS – Japanese Circulation Society
Práce vznikla s podporou projektu RVO--VFN 64165/2012 a SVV 260022.
Došlo: 29. 4. 2014
Přijato: 29. 5. 2014
doc. MUDr. Tomáš Honzík, Ph.D.
Klinika dětského a dorostového
lékařství UK 1. LF a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: tomas.honzik@vfn.cz
Sources
1. Kawasaki T. Acute febrile mucocutaneous syndrome with lymphoid involvement with specific desquamation of the fingers and toes in children (článek v japonštině). Jpn J Allergy (Arerugi) 1967 Mar; 16 (3): 178–222.
2. Dajani AS, Taubert KA, Gerber MA, et al. Diagnosis and therapy of Kawasaki disease in children. Circulation 1993; 87 (5): 1776–1780.
3. Gardner-Medwin JM, Dolezalova P, Cummins C, et al. Incidence of Henoch-Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins. Lancet 2002 Oct; 360 (9341): 1197–1202.
4. Taubert KA, Rowley AH, Shulman ST. Nationwide survey of Kawasaki disease and acute rheumatic fever. J Pediatr 1991 Aug; 119 (2): 279–282.
5. Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the committee on rheumatic fever, endocarditis, and Kawasaki disease, council on cardiovascular disease in the young, american heart association. Pediatrics 2004 Dec; 114 (6): 1708–1733.
6. Harnden A, Alves B, Sheikh A. Rising incidence of Kawasaki disease in England: analysis of hospital admission data. BMJ 2002 Jun; 324 (7351): 1424–1425.
7. Nakamura Y, Yashiro M, Uehara R, et al. Epidemiologic features of Kawasaki disease in Japan: Results of the 2009–2010 Nationwide Survey. J Epidemiol 2012; 22 (3): 216–221.
8. Uehara R, Belay ED. Epidemiology of Kawasaki disease in Asia, Europe, and the United States. J Epidemiol 2012; 22 (2): 79–85.
9. Fischer TK, Holman RC, Yorita KL, et al. Kawasaki syndrome in Denmark. Pediatr Infect Dis J 2007 May; 26 (5): 411–415.
10. Holman RC, Belay ED, Christensen KY, et al. Hospitalizations for Kawasaki syndrome among children in the United States, 1997–2007. Pediatr Infect Dis J 2010 Jun; 29 (6): 483–488.
11. Salo E, Griffiths EP, Farstad T, et al. Incidence of Kawasaki disease in northern European countries. Pediatr Int 2012 Dec; 54 (6): 770–772.
12. Uehara R, Yashiro M, Nakamura Y, Yanagawa H. Kawasaki disease in parents and children. Acta Paediatr 2003; 92 (6): 694–697.
13. Holman RC, Christensen KY, Belay ED, et al. Racial/ /ethnic differences in the incidence of Kawasaki syndrome among children in Hawaii. Hawaii Med J 2010 Aug; 69 (8): 194–197.
14. Fujita Y, Nakamura Y, Sakata K, et al. Kawasaki disease in families. Pediatrics 1989; 84 : 666–669.
15. Onouchi Y. Genetics of Kawasaki disease. Circul J 2012; 76 : 1581.
16. Burns JC, Cayan DR, Tong G, et al. Seasonality and temporal clustering of Kawasaki syndrome. Epidemiology 2005 Mar; 16 (2): 220–225.
17. Lynch M, Holman RC, Mulligan A, et al. Kawasaki syndrome hospitalizations in Ireland, 1996 through 2000. Pediatr Infect Dis J 2003 Nov; 22 (11): 959–963.
18. Burns JC, Glode MP. Kawasaki syndrome. Lancet 2004; 364 : 533–544.
19. Manlhiot C, Yeung RSM, Chahal N, et al. Kawasaki disease at the extremes of the age spectrum. Pediatrics 2009 Sep; 124 (3): e410–415.
20. Holman RC, Curns AT, et al. Kawasaki syndrome in Hawaii. Pediatr Infect Dis J 2005 May; 24 (5): 429–433.
21. Royle J, Williams K, Elliott E. Kawasaki disease in Australia, 1993–95. Arch Dis Child 1998 Jan; 78 (1): 33–39.
22. Huang WC, Huang LM, et al. Epidemiologic features of Kawasaki disease in Taiwan, 2003–2006. Pediatrics 2009 Mar; 123 (3): e401–405.
23. JCS Joint Working Group. Guidelines for diagnosis and management of cardiovascular sequelae in Kawasaki disease (JCS 2008) – digest version. Circ J 2010 Sep; 74 (9): 1989–2020.
24. Rosenfeld EA, Corydon KE, Shulman ST. Kawasaki disease in infants less than one year of age. J Pediatr 1995 Apr; 126 (4): 524–529.
25. Kim GB, Han JW, Hong YM, et al. Epidemiologic features of Kawasaki disease in South Korea: data from nationwide survey, 2009–2011. Pediatr Infect Dis J 2014 Jan; 33 (1): 24–27.
26. Doležalová P, Telekesová P, Němcová D, Hoza J. Incidence of vasculitis in children in the Czech Republic: 2-year prospective epidemiology survey. J Rheumatol 2004 Nov; 31 (11): 2295–2299.
27. U.S. Bureau of the Census. Census 2000 summary file 2 (SF 2)100-percent data. Washington, DC: Census, 2000.
28. Huang WC, Huang LM, Chang IS, et al. Epidemiologic features of Kawasaki disease in Taiwan, 2003–2006. Pediatrics 2009 Mar; 123 (3): 2008–2187.
29. Liu HC, Lo CW, Hwang B, et al. Clinical manifestations vary with different age spectrums in infants with Kawasaki disease. Scientific World Journal 2012; 2012 : 210382.
30. Chang FY, Hwang B, Chen SJ, et al. Characteristics of Kawasaki disease in infants younger than six months of age. Pediatr Infect Dis J 2006 Mar; 25 (3): 241–244.
31. Yanagawa H, Nakamura Y, Yashiro M, et al. Results of the nationwide epidemiologic survey of Kawasaki disease in 1995 and 1996 in Japan. Pediatrics 1998 Dec; 102 (6): E65.
32. Park YW, Han JW, Park IS, et al. Epidemiologic study of Kawasaki disease in 6 months old and younger infants. Korean J Pediatr 2008; 51 : 1320–1323.
33. Lee EJ, Park YW, Hong YM, et al. Epidemiology of Kawasaki disease in infants 3 months of age and younger. Korean J Pediatr 2012 Jun; 55 (6): 202–205.
34. Burns JC, Wiggins JW Jr, et al. Clinical spectrum of Kawasaki disease in infants younger than 6 months of age. J Pediatr 1986 Nov; 109 (5): 759–763.
35. Chuang CH, Hsiao MH, Chiu CH, et al. Kawasaki disease in infants three months of age or younger. J Microbiol Immunol Infect 2006 Oct; 39 (5): 387–391.
36. Joffe A, Kabrani A, Jadavji T. Atypical and complicated Kawasaki disease in infants. Do we need criteria? West J Med 1995 Apr; 162 (4): 322–327.
37. Manlhiot C, Christie E, McCrindle BW, et al. Complete and incomplete Kawasaki disease: two sides of the same coin. Eur J Pediatr 2012 Apr; 171 (4): 657–662.
38. Tacke CE, Breunis WB, Pereira RR, et al. Five years of Kawasaki disease in the Netherlands: a national surveillance study. Pediatr Infect Dis J 2014 Jan 23.
39. Nakamura Y, Yashiro M, Uehara R, et al. Epidemiologic features of Kawasaki disease in Japan: results of the 2007–2008 nationwide survey. J Epidemiol 2010; 20 (4): 302–307.
40. Kang HJ, Kim GN, Kil HR. Changes of clinical characteristics and outcomes in patients with Kawasaki disease over the past 7 years in a single center study. Korean J Pediatr 2013 Sep; 56 (9): 389–395.
41. Gut J. Kawasakiho choroba (40. výročí první publikace). Čes-slov Pediat 2008; 63 (3): 156–163.
42. Uziel Y, Hashkes P, et al. “Unresolving pneumonia“ as the main manifestation of atypical Kawasaki disease. Arch Dis Child 2003 Oct; 88 (10): 940–942.
43. Amano S, Hazama F. Neural involvement in Kawasaki disease. Acta Pathol Jpn 1980 May; 30 (3): 365–373.
44. McCrindle BW, Li JS, Minich LL, et al. Coronary artery involvement in children with Kawasaki disease: risk factors from analysis of serial normalized measurements. Circulation 2007 Jul; 116 (2): 174–179.
45. Duronqpisitkul K, Gururaj VJ, Park JM, et al. The prevention of coronary artery aneurysm in Kawasaki disease: a meta-analysis on the efficacy of aspirin and immunoglobulin treatment. Pediatrics 1995 Dec; 96 (6): 1057–1061.
46. Sano T, Kurotobi S, Matsuzaki K, et al. Prediction of non-responsiveness to standard high-dose gamma-globulin therapy in patients with acute Kawasaki disease before starting initial treatment. Eur J Ped 2007; 166 : 131–137.
47. Eleftheriou D, Levin M, Shingadia D, et al. Management of Kawasaki disease. Arch Dis Child 2014; 99 : 74–83.
48. Newburger JW, Burns JC, et al. Altered lipid profile after Kawasaki syndrome. Circulation 1991 Aug; 84 (2): 625–631.
49. Huang SM, Weng KP, Chang JS, et al. Effects of statin therapy in children complicated with coronary arterial abnormality late after Kawasaki disease: a pilot study. Circ J 2008 Oct; 72 (10): 1583–1587.
50. Blankier S, McCrindle BW, Ito S, et al. The role of atorvastatin in regulating the immune response leading to vascular damage in a model of Kawasaki disease. Clin Exp Immunol 2011 May; 164 (2): 193–201.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2014 Issue 4-
All articles in this issue
- Clinical and biochemical characteristics of Kawasaki syndrome in 22 children
- Acute and delayed adverse effects of gentamicin in the treatment of premature neonates with sepsis during the first postnatal week – an open prospective study (part II)
- Long-term experience from iodine intake monitoring in neonatal population in the Czech Republic
- Alagille syndrome
- Children´s involuntary exposure in smoking environment is even more dangerous than it has been expected
- Drug induced aseptic meningitis and Lyell syndrome: Rare causes of headache and exanthema in adolescents
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alagille syndrome
- Clinical and biochemical characteristics of Kawasaki syndrome in 22 children
- Drug induced aseptic meningitis and Lyell syndrome: Rare causes of headache and exanthema in adolescents
- Children´s involuntary exposure in smoking environment is even more dangerous than it has been expected
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

