-
Medical journals
- Career
Akutní diseminovaná encefalomyelitida
: M. Rohanová 1; V. Smolka 1; E. Klásková 1; J. Wiedermann 1; J. Saitz 1; M. Neklanová 1; K. Michálková 2
: Dětská klinika FN, Olomouc přednosta prof. MUDr. V. Mihál, CSc. 1; Radiologická klinika FN, Olomouc přednosta prof. MUDr. M. Heřman, Ph. D. 2
: Čes-slov Pediat 2012; 67 (6): 385-389.
: Case Report
Autoři předkládají kazuistiku chlapce s akutní diseminovanou encefalomyelitidou po proběhlé infekci vyvolané Mycoplasma pneumoniae. Jedná se o demyelinizační zánětlivé onemocnění centrálního nervového systému způsobené poruchou regulace imunitní odpovědi organismu na infekci nebo vakcinaci. Onemocnění se vyskytuje poměrně vzácně a diagnóza je stanovena per exclusionem na základě anamnestických dat, klinického obrazu a nálezu při vyšetření nervového systému magnetickou rezonancí.
Klíčová slova:
akutní diseminovaná encefalomyelitida, meningoencefalitida, močová retence, demyelinizace, infekce dýchacích cestÚVOD
Akutní diseminovaná encefalomyelitida (ADEM) je autoimunní demyelinizační onemocnění centrálního nervového systému (CNS) většinou monofázicky. Projevuje se multifokálními neurologickými příznaky a encefalopatií s různorodým nálezem demyelinizačních ložisek na zobrazení CNS magnetickou rezonancí (MR). Při správně vedené léčbě jde o onemocnění s dobrou prognózou a diferenciálně diagnosticky je třeba odlišit první ataku roztroušené sklerózy, transverzální myelitidu a polyradikuloneuritidu.
KAZUISTIKA
Šestiletý chlapec byl na naše pracoviště přeložen z dětského oddělení (DO) spádové nemocnice pro retenci moči. U pacienta byla závažná riziková perinatální anamnéza. Dítě bylo z IVF programu, gemini, A. Pro abrupci placenty byl porod v 33. týdnu císařským řezem, porodní hmotnost byla 1920 g a Apgar skóre bylo 7–8–10. Pro anemizaci byla v postnatálním období podána transfuze erymasy a pro ikterus bylo dítě krátkodobě léčeno modrým světlem. Psychomotorický vývoj pacienta byl v rámci normy. Od narození byl sledován pro malrotaci a hypofunkci pravé ledviny. Byl vyšetřován pro chronický kašel a recidivující respirační infekty s potvrzenou pylovou alergií. Na doporučení alergologa trvale užívá antagonisty leukotrienových receptorů a desloratadin.
Pět dnů před přijetím na DO měl febrilie kolem 38–39 °C, které trvaly 2 dny. Současně byly denně přítomny dvě průjmové stolice a před přijetím jedenkrát zvracel. Pro bolesti břicha, hlavy a neschopnost se vymočit byl hospitalizován ve spádové nemocnici. Ve vstupním vyšetření dominoval po pupek naplněný močový měchýř a celková únavnost. Po spontánní mikci při ultrazvukovém vyšetření močového měchýře bylo přítomné významné reziduum (200 ml), a proto byl zaveden permanentní močový katétr. Vyšetření moči bylo negativní, zánětlivé parametry byly nízké. Na žádost rodičů se uskutečnil překlad na naše pracoviště.
Chlapec při přijetí byl spavý, měl teploty až 40 °C, Glasgow Coma Scale (GCS) bylo 14, měl známky infekce horních dýchacích cest a zarudlé spojivky. Udával bolesti hlavy, měl pozitivní horní i dolní meningeální příznaky a byl hraničně hydratován. Pro podezření na neuroinfekci byla provedena lumbální punkce (tab. 1).
1. Výsledky vyšetření mozkomíšního moku. 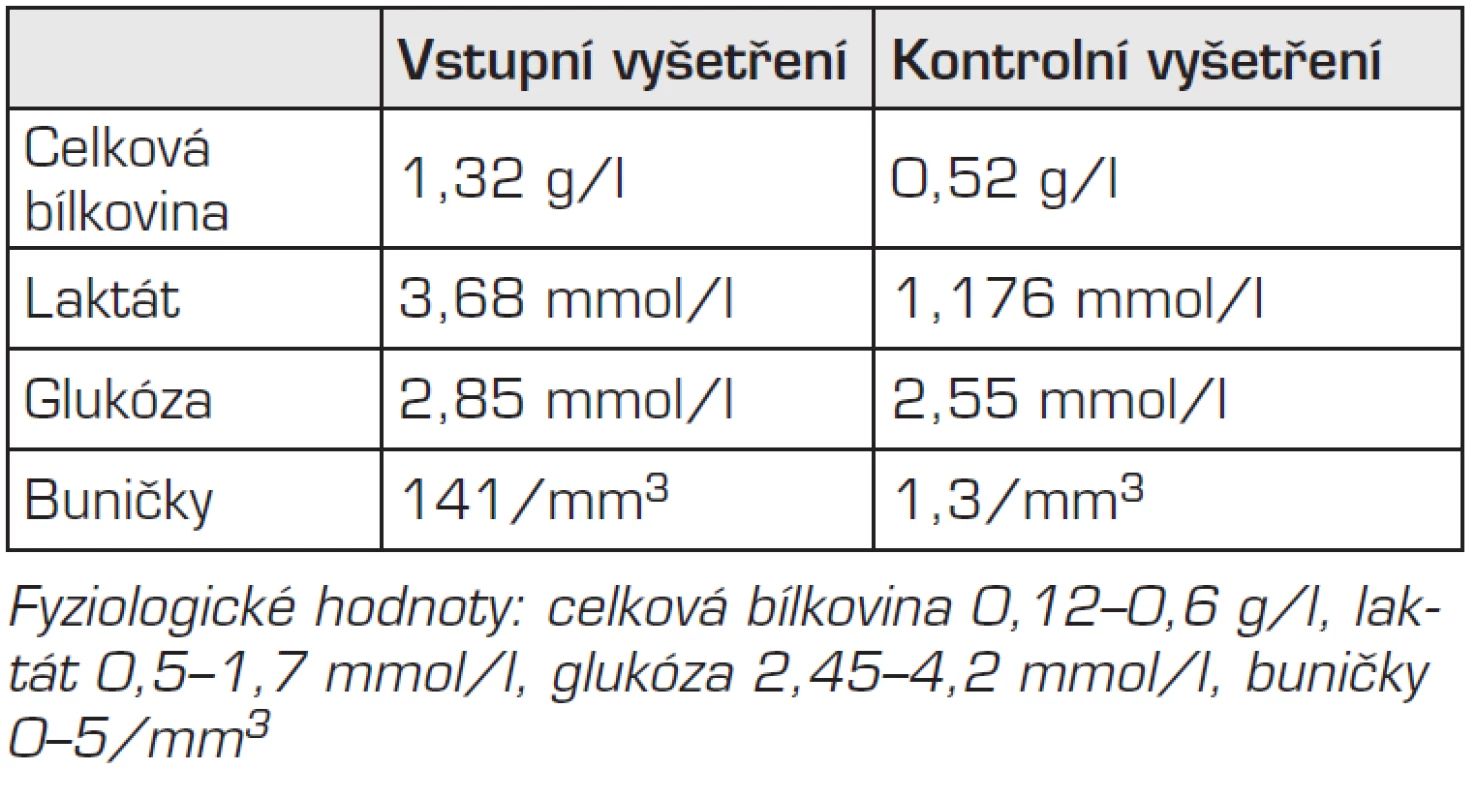
Chlapec byl pro obraz etiologicky nejasné meningoencefalitidy zajištěn acyklovirem a cefotaximem. Základní biochemická vyšetření renálních funkcí, jaterních funkcí a koagulace byla v normě. Zánětlivé parametry zůstaly nízké. V krevním obraze počty leukocytů, trombocytů i erytrocytů byly bez odchylek, v diferenciálním rozpočtu byla přítomna lymfopenie. Kultivace moči a stolice byla negativní. Aglutinačním vyšetřením stolice nebyly neprokázány rotaviry ani adenoviry.
Po dvou dnech po přijetí se objevila bradykardie (55/min) a hypotermie (34,2 °C). Prohloubila se porucha vědomí, GCS bylo 9, objevila se chabá kvadruparéza končetin, dysartrie a zhoršovala se porucha polykání. Chlapec byl živen enterální sondou a stále trvala retence moči. Na rtg snímku plic byl obraz peribronchitidy a pro zjištěnou pozitivitu IgM protilátek proti Mycoplasma pneumoniae byl přidán k současné antibiotické léčbě clarithromycin.
Bylo provedeno vyšetření NMR mozku s nálezem četných hypersignalit v bazálních gangliích, a to téměř stranově symetricky, s maximem postižení putamen a globus pallidus (obr. 1). Další hypersignální ložiska byla lokalizována v T2 a FLAIR sekvencích para - i periventrikulárně a subkortikálně s velikostí od 3 do 15 mm (obr. 2).
1. MR mozku, axiální zobrazení, FLAIR sekvence: Téměř symetrická ložiska zvýšené intenzity signálů v oblasti bazálních ganglií oboustranně (šipky). Fig. 1. MR of the brain, axial representation, FLAIR sequence: almost symmetric foci of increased signal intensity in the area of basal ganglia bilaterally (arrows). 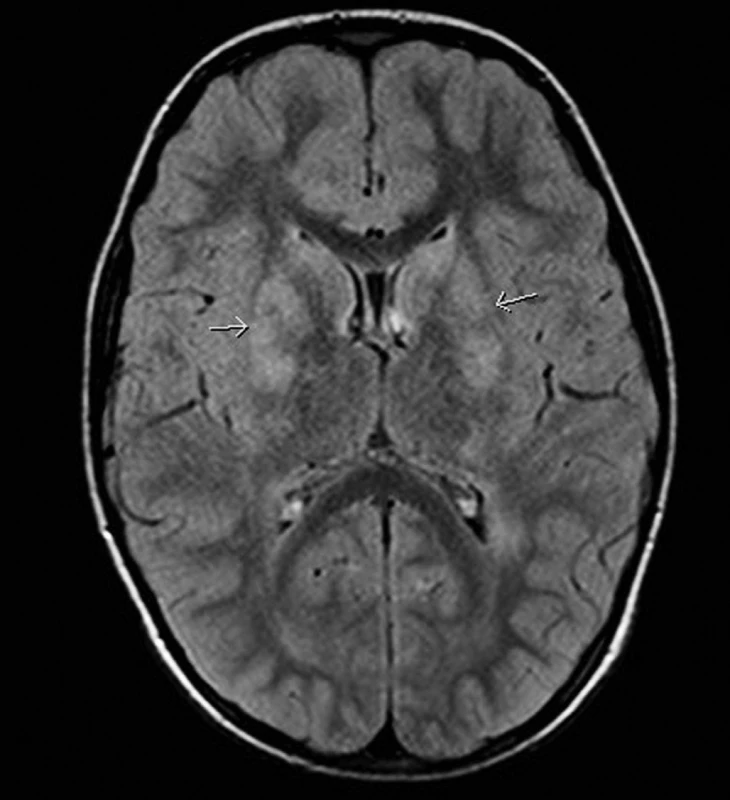
2. MR mozku, axiální zobrazení, FLAIR sekvence: Hypersignální ložiska v bílé hmotě mozku oboustranně frontoparietálně. Fig. 2. MR of the brain, axial representation, FLAIR sequence: hypersignal foci in white matter of the brain bilaterally in frontal-parietal representation. 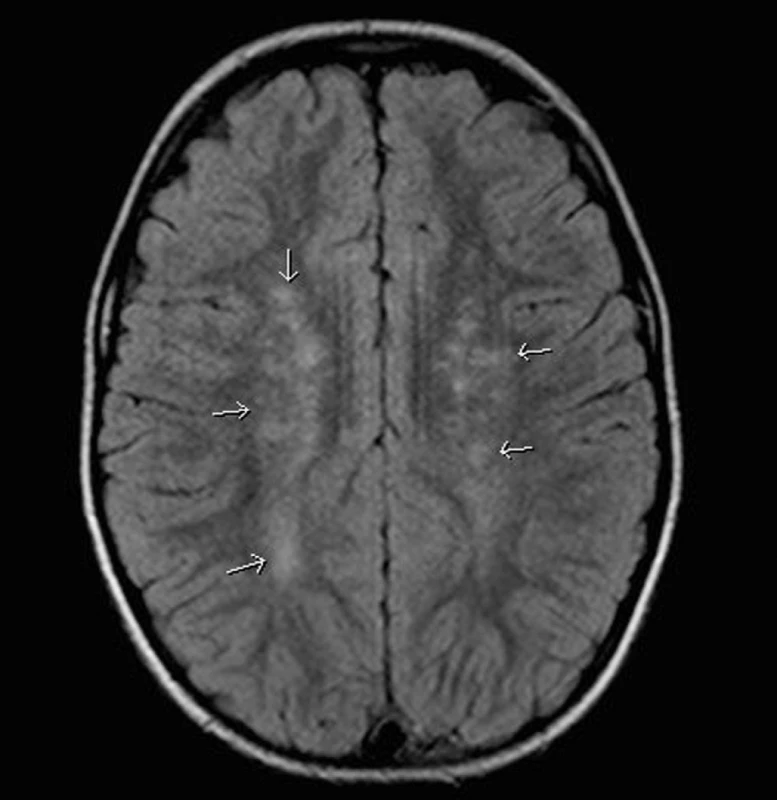
Hemoragické změny prokázány nebyly. PCR vyšetřením DNA z mozkomíšního moku nebyly potvrzeny infekce HSV 1, 2, EBV, CMV a infekce způsobené Mycoplasma pneumoniae (MP) a Chlamydia pneumoniae. Mikrobiologické vyšetření likvoru bylo negativní. Na EEG byly zaznamenány generalizované pomalé vlny. Pro zhoršení celkového stavu jsme provedli po 5 dnech kontrolní lumbální punkci s odběrem materiálu na další možné patogeny. Výsledky vyšetření kontrolního mozkomíšního moku jsou uvedeny v tabulce 1. PCR metodou byla v moku vyloučena přítomnost RNA enterovirů, viru klíšťové encefalitidy, Borrelia burgdorferi, afzelii, garinii. Byla provedena elektronová mikroskopie likvoru s negativním výsledkem. Nebyla prokázána přítomnost IgM protilátek v likvoru proti spalničkám, příušnicím, enterovirům, coxsackiím B1-B5 a Coxiella burnetii. Ze stolice jsme provedli aglutinaci na noroviry, která byla také s negativním výsledkem. Bylo doplněno oční vyšetření, které vyloučilo postižení optického nervu. NMR vyšetření míchy neprokázalo žádné míšní léze.
Na základě negativních mikrobiologických, sérologických, aglutinačních a PCR vyšetření, kterými jsme neprokázali žádnou z vyšetřovaných infekcí CNS, po zhodnocení nálezu na NMR mozku a pro výrazné zhoršení neurologického nálezu i přes zlepšující se nález v mozkomíšním moku, byla přehodnocena diagnóza pacienta na akutní diseminovanou encefalomyelitidu.
Byla zahájena léčba pulzy methylprednisolonu v dávce 30 mg/kg jednou denně po dobu pěti dnů. Již v průběhu léčby kortikoidy se stav mírně zlepšoval. Chlapec začal polykat sliny, objevovala se minimální hybnost končetin, trval sopor a mentální defekt. Léčba kortikoidy byla podáním pulzů ukončena. Postupně se v několika dnech zlepšil stav vědomí, byla zachována termoregulace, upravila se dysartrie a dysfagie, ale jen pozvolna i přes intenzivní rehabilitaci se upravovala paréza především dolních končetin. Chlapec byl propuštěn po měsíční hospitalizaci do domácí péče s plně upravenými mentálními schopnostmi, jen přetrvávala lehká paréza dolních končetin.
Po třech měsících byla provedena kontrolní NMR mozku. Došlo ke zmenšení některých ložisek, některá zcela vymizela a nová ložiska prokázána nebyla (obr. 3, 4). V neurologickém vyšetření přetrvávala lehká ataxie a chůze o širší bázi, plně byla obnovena hybnost všech končetin.
3. MR mozku, axiální zobrazení, FLAIR sekvence: Vyšetření v odstupu tří měsíců, normální intenzita signálů bazálních ganglií oboustranně, ložiska resorbována. Fig. 3. MR of the brain, axial representation, FLAIR sequence: examination after three months, a normal intensity of basal ganglia signals bilaterally, the foci were resorbed. 
4. MR mozku, axiální zobrazení, FLAIR sekvence: Vyšetření v odstupu tří měsíců, v bílé hmotě mozku oboustranně frontoparietálně jsou stále přítomná hypersignální ložiska, ale jejich počet je redukován. Fig. 4. MR of the brain, axial representation, FLAIR sequence: examination after three months, hypersignal foci are still present in the brain white matter bilaterally in the frontal parietal representation, but their number is reduced. 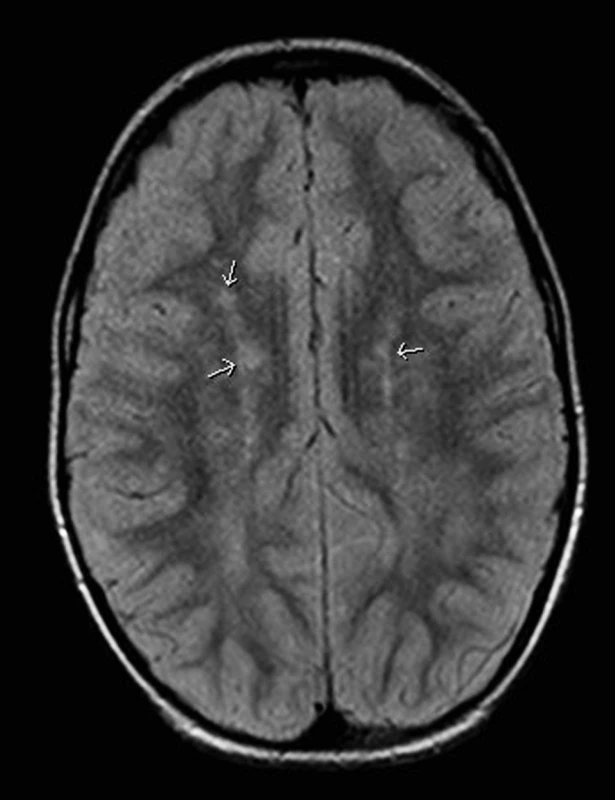
DISKUSE
Akutní diseminovaná encefalomyelitida je akutně probíhající demyelinizace mozku a míchy. Incidence je 0,2–0,4/100 000 v proočkované dětské populaci. Častěji postihuje chlapce s predominancí v zimě a na jaře, což pravděpodobně souvisí s vyšším výskytem respiračních infekcí v těchto obdobích. Rozvoji ADEM ve více jak 70 % předchází virová nebo bakteriální infekce, která se projevuje jako katar dýchacích cest nebo infekce zažívacího traktu, a to 2 dny až 4 týdny před propuknutím klinických známek ADEM. Infekce mohou být způsobeny coronaviry, coxsackiemi, CMV, EBV, HSV 1,2, virem hepatitidy A, HIV, chřipkovými viry, viry zarděnek, spalniček, příušnic, West Nile virem, RSV, boreliemi, chlamydiemi, mykoplasmaty, leptospirami, rickettsiemi, beta hemolytickým streptokokem [1]. Ve většině případů se ale původce nezjistí. Proto se předpokládá, že spouštěčem je patogen, který má schopnost indukovat demyelinizaci v CNS a běžně se v laboratořích netestuje, jako např. coronavirus. U našeho pacienta předpokládáme, že spouštěčem patologické imunitní reakce vedoucí k demyelinizaci byla infekce MP, protože při opakovaném vyšetření protilátek došlo k sérokonverzi po léčbě clarithromycinem. V méně jak 5 % je spojován rozvoj ADEM s očkováním v odstupu do 3 měsíců od vakcinace např. proti vzteklině, neštovicím, pneumokokům, žloutence B, zarděnkám, spalničkám, příušnicím, chřipce aj.
Patogeneze onemocnění není zcela známa. Jde o autoimunitní postižení centrálního nervového systému u geneticky predisponovaného jedince, které je spuštěno infekcí nebo vakcinací. K autoimunitní odpovědi dochází na podkladě antigenní podobnosti vyvolávajícího viru nebo bakterie a myelinového bazického proteinu, proteolipidového proteinu, myelinového oligodendrocytárního proteinu, z nichž jsou složena nervová vlákna. Po aktivaci a pomnožení T buněk v lymfatických uzlinách dochází k jejich migraci do CNS cestou postkapilárních venul do perivaskulárního prostoru [2]. Po reaktivaci vazbou na HLA antigeny II. třídy exprimované na dendritických buňkách aktivované T buňky migrují do mozkového parenchymu, kde dochází k produkci cytokinů a chemokinů podporující migraci lymfocytů, monocytů a neutrofilů do CNS. Uvolnění proteáz vede k porušení hematoencefalické bariéry, migraci dalších efektorových buněk imunitního systému a produkci kyslíkových radikálů, které způsobují endoteliální dysfunkci. Důsledkem je zánětlivá reakce s demyelinizací a axonálním poškozením, které je způsobeno kyslíkovými a dusnými radikály, TNF alfa, CD8+ cytotoxickými T lymfocyty, fagocytózou myelinu a oligodendrocytární apoptózou. Zánětlivý proces trvá několik dnů až 2 týdny. Po něm následuje reparační fáze s aktivací a proliferací astrocytů, oligodendrocytárních prekurzorů a dochází k remyelinizaci [3].
V klinickém obraze úvodně dominují příznaky respirační infekce nebo zánětlivého onemocnění zažívacího traktu. Tyto známky měl i sledovaný pacient. Neurologická symptomatologie vychází z mnohaložiskové demyelinizace, jsou časté motorické deficity s parézami končetin, retence moči především při postižení míchy. U našeho pacienta jsme však demyelinizační změny míchy neprokázali, i přesto, že retence moči trvala téměř dva týdny. Dalšími projevy jsou parézy hlavových nervů s projevy dysartrie, afázie, oftalmoplegie, dysfagie. Jsou popisovány poruchy vizu při oboustranné neuritidě, nystagmus, senzorické poruchy, extrapyramidové příznaky, poruchy vědomí a vzácně i křeče. Porucha vědomí může vyústit v komatózní stav s nutností UPV.
V laboratoři je nespecifický nález zvýšené sedimentace, může být leukocytóza, lymfopenie, která byla přítomna i u našeho pacienta. V mozkomíšním moku je smíšený proteino-cytologický nález. Počet buněk v 1 mm3 moku se pohybuje podle různých autorů od 0 do 290 a celkové bílkoviny od 0,2 do 1,5 g/l [2]. Identický nález v mozkomíšním moku byl prokázán i u našeho pacienta. Hlavním odlišením od roztroušené sklerózy (RS), jejíž první ataka může mít stejné projevy, je průkaz oligoklonálních pásů, které vzácně byly přítomny i u ADEM, ale po odeznění akutní fáze vymizely a tito pacienti neměli další ataku demyelinizace. U popsaného pacienta oligoklonální protilátky prokázány nebyly. Na EEG je popisován nespecifický nález generalizovaného zpomalení mozkové aktivity. Na CT mozku může být zcela normální nález. V retrospektivní studii amerických autorů z 18 případů ADEM nález na CT byl identifikován pouze u 2 pacientů [4].
Pro stanovení diagnózy je významný nález na magnetické rezonanci mozku a míchy, kde v T2 vážených a FLAIR sekvencích jsou přítomna mnohočetná hypersignální ložiska demyelinizace s velikostí od několika milimetrů do 5 cm, uložená v bílé hmotě kortikálně i subkortikálně s predominancí ve frontálním laloku, periventrikulárně, hluboko v bazálních gangliích, thalamu a prodloužené míše. Postižení je obvykle asymetrické kromě postižení bazálních ganglií, které bývá symetrické [5]. Výjimečně jsou postiženy capsula interna, corpus callosum a mozeček. Typický je jednodobý vznik ložisek. Ve studiích různých autorů při kontrolním MR vyšetření CNS došlo vždy ke zmenšení nebo vymizení ložisek či byl nález stacionární. Progrese, tedy vznik nových ložisek, je typická pro RS, které se ADEM především u dospělých pacientů a adolescentů může podobat, ale u našeho pacienta nebyla naplněna diferenciálně diagnostická kritéria pro RS při vyšetření MR [6].
Diagnóza je tedy stanovena na základě anamnestických údajů předcházejícího inzultu – infekce, vakcinace, dále klinického neurologického nálezu a změn na MR CNS. Diferenciálně diagnosticky je třeba kromě RS odlišit serózní meningoencefalitidy, což je zpočátku obtížné, proto i většina pacientů je vstupně léčena antibiotiky a antivirotiky, a Guillainův-Barréův syndrom, především pokud jsou přítomny parézy dolních končetin [7].
Léčba při správném a včasném stanovení diagnózy je velmi efektní. Všechny práce doporučují kortikoidy v imunosupresivních dávkách nebo imunoglobuliny. Není-li dostatečná klinická odezva na tuto léčbu, je indikována plasmaferéza. Při srovnání methylprednisolonu v dávce 10–30 mg//kg podávaného 3–5 dnů s maximální dávkou 1 g a dexamethazonu v dávce 1 mg/kg byl hodnocen lépe methylprednisolon pro lepší výstupní neurostatus, ale práce byla limitována malým počtem pacientů. Následné podávání prednisonu s jeho postupným vysazováním během 6 týdnů nemělo jednoznačný benefit [8]. U našeho pacienta došlo ke zlepšení již po pulzech methylprednisolonu, proto nebyla podána další imunosupresivní léčba. Není-li dosaženo po kortikoidech klinického zlepšení, jsou doporučeny imunoglobuliny 1–2 g/kg v jedné dávce nebo rozděleně do 3–5 dnů. Pokud ani tato léčba nevede ke zlepšení stavu, je doporučena plasmaferéza [9]. Svůj význam má podpůrná léčba – umělá plicní ventilace při těžkém kómatu (GCS <8) nebo hypoventilaci, enterální výživa nazogastrickou sondou při dysfagii, rehabilitační léčba paréz končetin, antibiotická léčba komplikujících infekcí, derivace moči při retenci atp.
Prognóza typického ADEM je dobrá, v publikovaných studiích všichni pacienti přežili a u 60–90 % došlo k úplné úpravě neurologických deficitů. Na kontrolních MR CNS u pacientů s ADEM i přes klinickou odezvu mohou ložiska přetrvávat, avšak ve většině případů dochází ke zmenšení počtu i velikosti lézí. Vzhledem k podobnosti první ataky RS a ADEM je doporučeno některými autory provést MR kontrolu CNS ještě dvakrát během pěti let po normalizaci úvodního nálezu.
Došlo: 27. 11. 2011
Přijato: 26. 7. 2012
MUDr. Marie Rohanová
Dětská klinika FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: mar.rohan@seznam.cz
Sources
1. Dostálová V, Dostál P, Černý V. Akutní diseminovaná encefalomyelitida. Anest Intensiv Med 2008; 19 : 203–209.
2. Garg RK. Acute disseminated encephalomyelitis. Postgrad Med 2003; 79 : 11–17.
3. Lotze TE, Chadwick D. Acute disseminated encephalomyelitis in children: Pathogenesis, clinical features, and diagnosis. UpToDate 2011; http://www.uptodate.com/contents/acute-disseminated-encephalomyelitis-in-children-pathogenese.
4. Murthy SNK, Faden HS, Michael E, Cohen ME, Bakshi R. Acute disseminated encephalomyelitis in children. Pediatrics 2002; 110: e21.
5. Dale RC, de Sousa C, Chiny WK, et al. Acute disseminated encephalomyelitis, multiphasic disseminated encephalomyelitis and multiple sclerosis in children Brain 2000; 123 : 2407–2422.
6. Callen DJ, Stroff MM, Branson HM, Li DK, Lotze TE, et al. Role of MRI in the differentiation of ADEM from MA in children. Neurology 2009; 72 (11): 968–963.
7. Kopal A, Mrklovský M, Ehler E. Akutní diseminovaná encefalomyelitida a její možná záměna s AIDP. Neurologie pro praxi 2007; 8 : 364–366.
8. Lotze TE, Chadwick D. Acute disseminated encephalomyelitis in children: Prognosis and treatment. UpToDate, 2011; http://www.uptodate.com/contents/acute-disseminated-encephalomyelitis-in-children-prognosis,treatm.
9. Alexander M, Murthy JMK. Acute disseminated encephalomyelitis disseminated encephalomyelitis: Treatment guidelines. Ann Indian Acad Neurol 2011; 14 : 60–64.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2012 Issue 6-
All articles in this issue
- A higher risk of terminal renal failure in Roma children – data from Slovak Pediatric Registry
- Quality of life and morbidity in children after repair of congenital diaphragmatic hernia
- Quality of life of persons taking care of children with inherited metabolic disease
- Acute disseminated encephalomyelitis – case report
- Difficulties in prenatal diagnostics trisomy 20 and its mosaic
- Diagnostics and therapy of neurogenic bladder in children
- The development of enteric nervous system and pathogenesis of Hirschsprung disease
- The so-called problem patient
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Quality of life and morbidity in children after repair of congenital diaphragmatic hernia
- Difficulties in prenatal diagnostics trisomy 20 and its mosaic
- Acute disseminated encephalomyelitis – case report
- Diagnostics and therapy of neurogenic bladder in children
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

