-
Medical journals
- Career
Henochova-Schönleinova purpura – diagnostika a léčba z pohledu současných poznatků
: S. Skálová 1; J. Zieg 2; L. Minxová 1
: Dětská klinika LF UK a FN, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Pediatrická klinika UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Lebl, CSc. 2
: Čes-slov Pediat 2010; 65 (11): 660-666.
: Postgraduate Education
Henochova-Schönleinova purpura (HSP) patří k nejčastějším vaskulitidám dětského věku. Její diagnostika vychází především z klinické symptomatologie, která zahrnuje typicky palpovatelnou kožní purpuru, postižení kloubů, renální a gastrointestinální příznaky, vzácněji i postižení jiných orgánů. Z hlediska léčby je dnes prokázáno, že kortikoidy zkracují dobu trvání a závažnost gastrointestinálních a kloubních příznaků, ale nejsou dostatečně účinné v prevenci a léčbě nefritidy.
Jednotné terapeutické postupy pro léčbu HSP a HSP nefritidy dosud neexistují. V léčbě HSP nefritidy se používají na základě dosavadních zkušeností inhibitory renin-angiotenzinového systému, rybí tuk, imunosupresiva, plazmaferéza a tonzilektomie.Klíčová slova:
Henochova-Schönleinova purpura, vaskulitida, nefritida, kortikoidy, imunosupresivaÚvod
Henochova-Schönleinova purpura (HSP) je leukocytoklastická vaskulitida postihující malé cévy. Vyskytuje se převážně v dětském věku, i když postiženi mohou být i dospělí. Jedná se o celosvětově nejčastější systémovou vaskulitidu u dětí [1].
HSP byla poprvé popsána v roce 1801 Heberdenem u 5letého chlapce s kožní purpurou, bolestí břicha, enteroragií a hematurií. O 36 let později Schönlein zaznamenal výskyt kožní purpury s artritidou a jeho žák Henoch popsal asociaci gastrointestinálních a renálních příznaků [2].
Epidemiologie
Incidence HSP se udává v rozmezí 10–20 případů/100 000 dětí/rok. Nejvyšší incidence je popisována ve věkové skupině 4–6 let, kde dosahuje až 70,3/100 000 dětí/rok. Více než 90 % dětí s HSP je mladších 10 let. Chlapci bývají postiženi častěji než dívky v poměru 1,2–1,7 : 1.
Výskyt onemocnění vykazuje geografickou distribuci, je časté v Evropě a Japonsku, méně se vyskytuje v USA a nejnižší výskyt je v Africe, což souvisí s nízkou incidencí onemocnění u černošské populace[1].
Etiopatogeneze
Patogeneze onemocnění není zatím zcela objasněná. Předpokládá se, že se jedná o imunokomplexy zprostředkovanou chorobu. Manifestaci nemoci předchází asi v 50 % případů respirační infekt vyvolaný zejména β-hemolytickým streptokokem skupiny A, uplatňovat se však mohou i jiné mikroorganismy jako mykoplazmata, adenoviry, parvovirus B19, varicela a herpes simplex virus [3].
Dalšími spouštěcími faktory mohou být očkování, léky, malignity a gravidita. Hlavní roli v patogenezi HSP hraje abnormální glykosylace molekuly IgA1, která obsahuje snížené množství galaktosylových zbytků v oligosacharidech tvořících tzv. „hinge region“. Přestože úloha aberantně glykosylovaného IgA1 (Gal-d IgA1) byla u pacientů s HSP opakovaně prokázána, není jasné, zda defekt glykosylace je pouze dočasný či trvalý [4, 5]. K rozvoji nemoci vede ukládání Gal-d IgA1 ve formě nerozpustných imunokomplexů do cévní stěny s následnou aktivací alternativní cesty komplementu. Tkáň je poté infiltrována polymorfonukleárními leukocyty, dochází k vyplavení prozánětlivých cytokinů a k nekróze cévní stěny s následným vznikem trombózy a extravazací erytrocytů. Histologickým vyšetřením prokazujeme leukocytoklastickou vaskulitidu [6].
V etiopatogenezi HSP se předpokládá určitá genetická predispozice. Turečtí nefrologové popsali asociaci HSP s určitými HLA genotypy. Podle jejich závěrů je přítomnost HLA-DRB1 spojena s vyšší náchylnosti ke vzniku HSP, avšak nikoliv se závažností průběhu onemocnění [7]. Recentní španělská studie prokázala, že genotyp HLA-B35 byl spojen s vyšším rizikem postižení ledvin u HSP [8]. Zajímavé je, že HSP se vyskytuje u 7 % pacientů s familiární středomořskou horečkou (FSH) [9]. Studie z Izraele a Turecka popsaly u pacientů s HSP vyšší výskyt mutací genu MEFV podmiňujících FSH. To by mohlo vysvětlit úspěšné případy léčby jednotlivých případů dětí s protrahovaným průběhem HSP kolchicinem, který je lékem první volby u FSH [10].
Klinická symptomatologie a diagnostika
HSP je charakterizována kožními (obr. 1), kloubními, abdominálními, renálními a dalšími vzácnějšími příznaky, které jsou shrnuty v tabulce 1. Diagnóza tohoto onemocnění je založena převážně na klinické symptomatologii.
1. Kožní purpura. Různá vývojová stadia lézí a podkožní prosáknutí v oblasti nártu. Fig. 1. Cutaneous purpura. Various developmental stages of the lesions and subcutaneous edema of the instep of the foot. 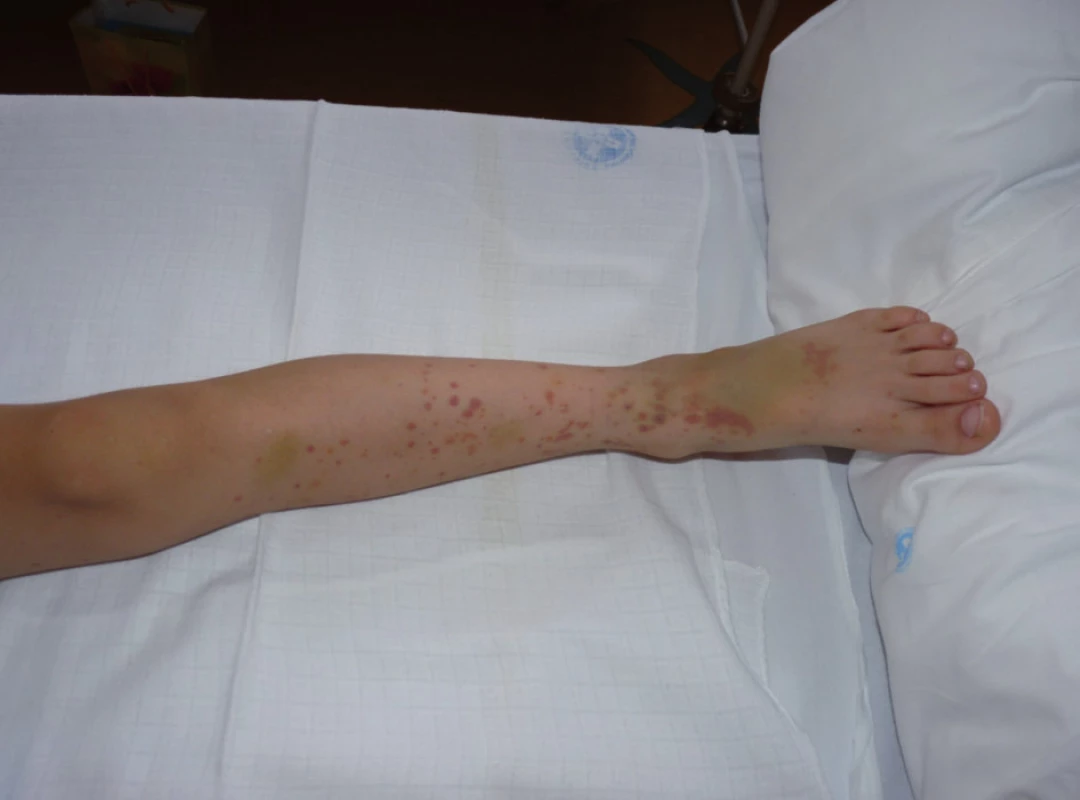
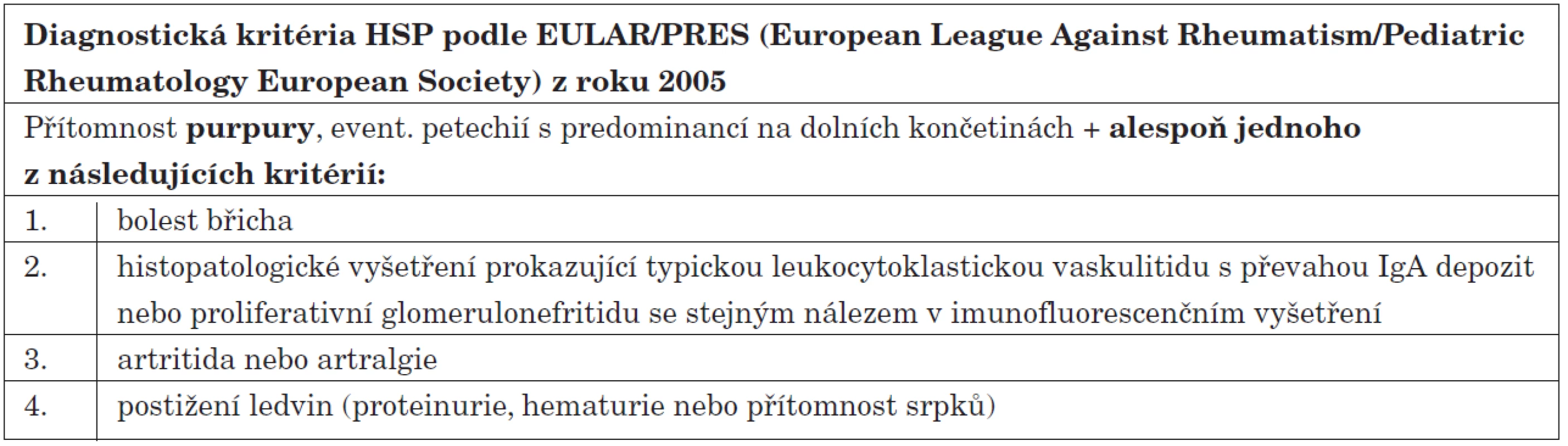
Diagnostická kritéria HSP v současné době vycházejí ze společného konsensu EULAR/PRES (European League against Rheumatism/Pediatric Rheumatology European Society) z roku 2005 [11]. K diagnóze HSP je nutná přítomnost hmatné purpury a minimálně jednoho z dalších příznaků: bolest břicha, nález IgA depozit v biopsii kůže či ledvin, artralgie či artritida a postižení ledvin (tab. 2).
U dětí do 2 let může HSP probíhat pod specifickým obrazem s purpurou a podkožním edémem končetin a obličeje. Jednotka je někdy označována jako infantilní akutní hemoragický edém (AHEI – acute hemorrhagic edema of infancy). Další orgánové postižení bývá u této formy nemoci v kojeneckém a batolecím věku vzácné [12]. Diagnostika HSP může být někdy zpočátku složitá, zejména pokud kožní purpura není prvním příznakem onemocnění, což bývá popisováno v 10 až 25 % případů. Laboratorní obraz choroby je variabilní, avšak nespecifický, diagnostický test pro HSP neexistuje. U více než 50 % pacientů bývá zvýšená hladina IgA v séru. V případě postižení ledvin nacházíme při chemickém vyšetření moči hematurii a případně i proteinurii. Doporučená laboratorní vyšetření při diagnostice nekomplikované HSP uvádí tabulka 3.
3. Doporučená laboratorní vyšetření u nekomplikované HSP. 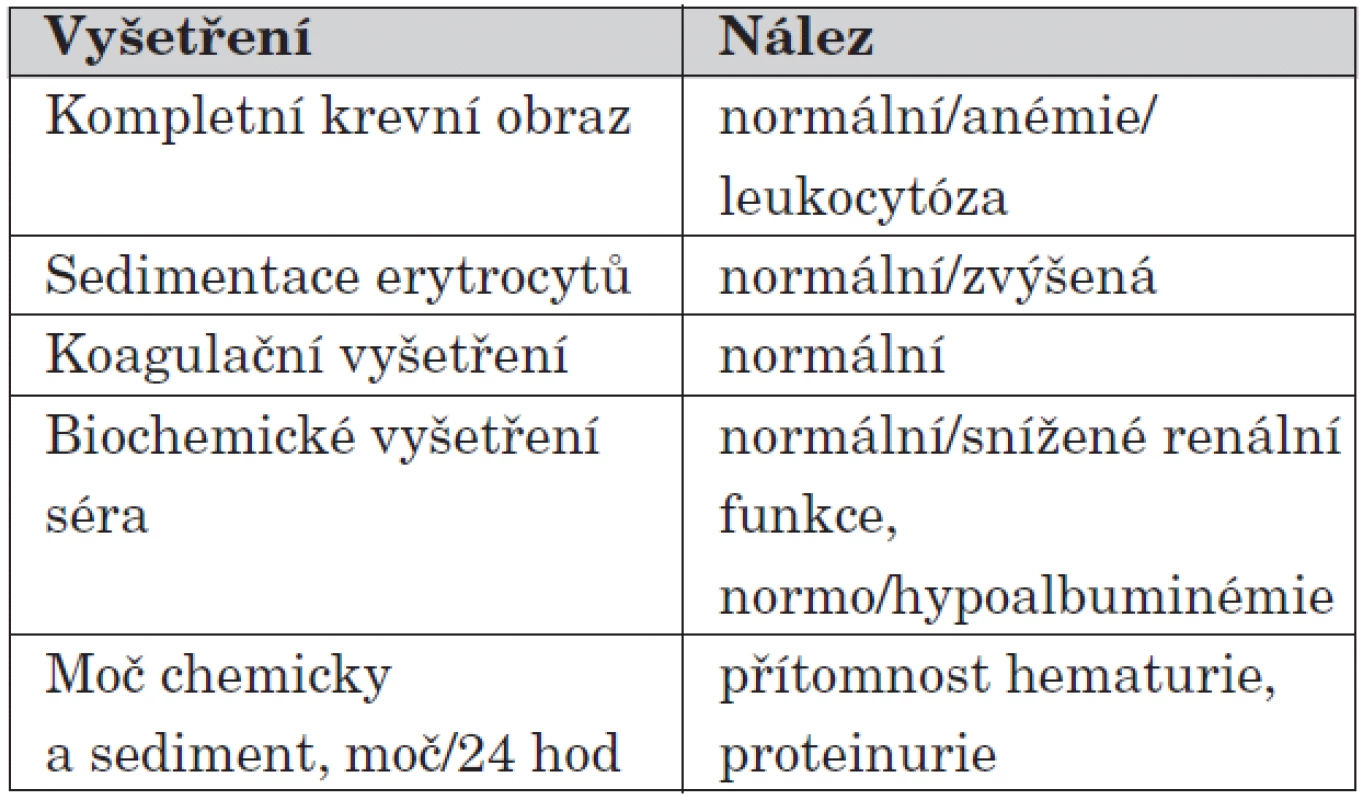
V případě diagnostických nejasností je vhodné doplnit hemokulturu k vyloučení infekční příčiny a dále vyšetření protilátek ANA, anti-ds DNA a ANCA, C3 a C4 složky komplementu a kvantitativních imunoglobulinů k vyloučení systémového lupus erythematosus či ANCA pozitivních vaskulitid. Vyšetřením ASLO lze prokázat předcházející streptokokovou infekci. Ze zobrazovacích vyšetření hraje důležitou roli ultrazvuk břicha, který může v případě gastrointestinálního postižení prokázat ztluštění střevní stěny a je nezbytný při podezření na případné gastrointestinální komplikace [13]. Kožní biopsie je indikována v dětství vzácně při diagnostických rozpacích a je charakterizována nálezem leukocytoklastické vaskulitidy postihující kapiláry a venuly v dermis s perivaskulární depozicí IgA, C3 a fibrinogenu.
Postižení ledvin u HSP
Renální postižení u HSP je hlavním faktorem určujícím prognózu tohoto onemocnění. Nejčastěji se vyvíjí do 4 týdnů od manifestace HSP, v naprosté většině případů se manifestuje do 6 měsíců od začátku trvání nemoci [14]. Symptomatologie je variabilní, nejčastějším nálezem je izolovaná mikroskopická či makroskopická hematurie, dále hematurie s proteinurií různého stupně. Onemocnění může probíhat pod obrazem nefrotického nebo smíšeného nefriticko-nefrotického syndromu a vzácně i jako rychle progredující glomerulonefritida (RPGN).
Mezi hlavní rizikové faktory rozvoje HSP nefritidy (HSPN) patří rekurentní výsev purpury trvající déle než jeden měsíc, závažná abdominální symptomatologie a věk nad 7 let [15]. Studie japonských nefrologů ukázala, že věk nad 7 let, přetrvávající kožní purpura a snížená aktivita koagulačního faktoru XIII vedly ke zvýšenému riziku renálního postižení [16]. U části pacientů s HSP nefritidou dochází postupně ke zhoršování funkce ledvin a někteří dospějí do konečného stadia renálního selhání (ESRD – end stage renal disease). Děti s mikroskopickou hematurií a lehkou proteinurií mají dobrou prognózu. Vyšší pravděpodobnost přechodu do ESRD mají pacienti s renální insuficiencí v úvodu onemocnění, RPGN, nálezem nefritického či nefrotického syndromu a s perzistující proteinurií [17]. Histologickou klasifikaci HSP nefritidy shrnuje tabulka 4.
4. Histologická klasifikace HSP nefritidy. 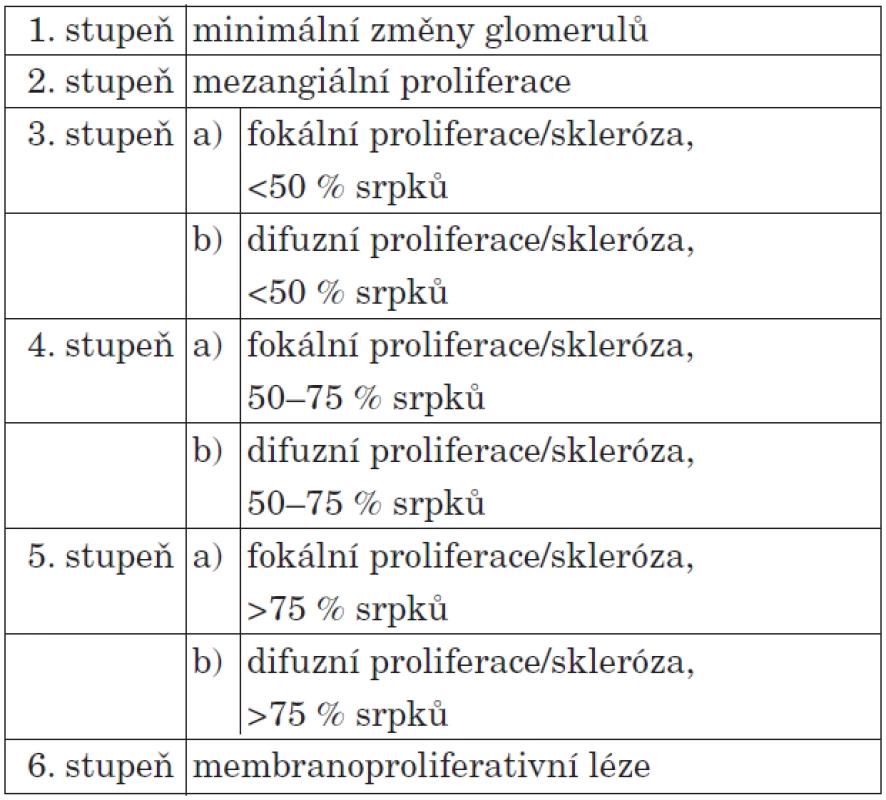
Mezi histologické léze spojené s progresivním postižením ledvin patří přítomnost více než 50 % srpků (obr. 2), intersticiální fibróza a přítomnost subepiteliálních depozit v bioptickém nálezu [18, 19]. Provedení renální biopsie je indikováno při těchto nálezech: akutní nefritický syndrom, smíšený nefriticko-nefrotický syndrom, nefrotický syndrom, opakovaný nález proteinurie >1 g/m2/den, recidivy makroskopické hematurie, pokles renálních funkcí. Někteří autoři doporučují provádět renální biopsii i u lehčích forem HSPN s non-nefrotickou proteinurií, protože klinický obraz HSPN často nekoreluje s histologickým nálezem [20].
2. HSP nefritida. Přítomnost nekrózy a celulárního srpku v glomerulu u těžce probíhající formy HSPN. Fig. 2. HSP nephritis. Glomerular necrosis and cellular crescent in severe HSP nephritis. 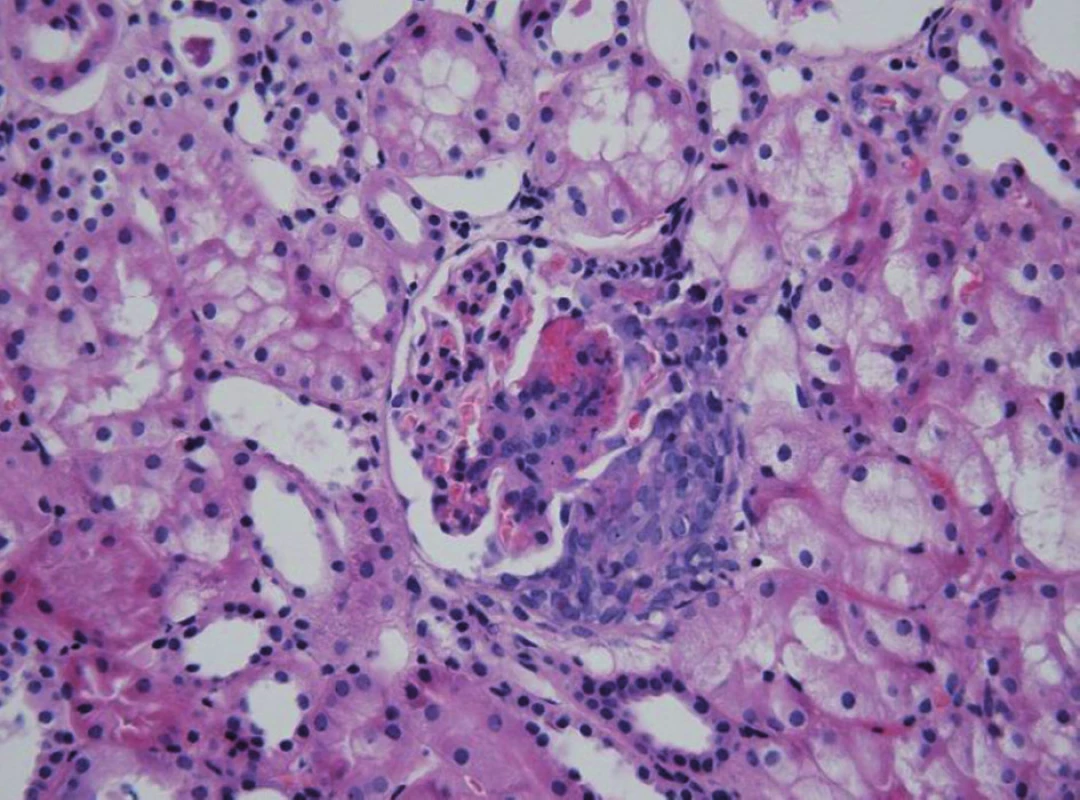
Léčba HSP bez postižení ledvin
Léčba HSP bez postižení ledvin je symptomatická. Onemocnění obvykle ustoupí do 1–3 týdnů, u jedné třetiny dětí však dochází k rekurenci příznaků. Lehčí případy s izolovanými kožními a kloubními příznaky lze léčit ambulantně s pečlivým sledováním vývoje onemocnění a rozvoje případných známek orgánového postižení, těžší případy vyžadují hospitalizaci. Klid na lůžku je důležitý při artralgiích a bolestech břicha, nicméně nemá vliv na průběh či progresi onemocnění [13]. V případě artralgií podáváme analgetika, použití nesteroidních antirevmatik (NSAIDs) je diskutabilní, a to zejména při současném postižení gastrointestinálního traktu či ledvin. Artritida u HSP je přechodná a nevede k trvalému poškození kloubu. Ke zmírnění a zkrácení doby trvání intenzivních kloubních příznaků lze použít kortikoidy s velmi dobrým efektem [13, 21].
V léčbě gastrointestinálních příznaků byl prokázán v řadě retrospektivních studií příznivý efekt kortikoidů. V randomizované, placebem kontrolované studii z roku 2006 prokázal Ronkainen signifikantní zkrácení doby trvání a závažnosti abdominálních příznaků u pacientů léčených kortikoidy [22]. V literatuře existuje několik schémat léčby kortikoidy, která se liší dávkou i délkou podávání. Obvykle se podává prednison nebo methylprednisolon v dávce 1–2 mg/kg/den první týden, poté se dávka postupně snižuje během dalších 2–3 týdnů. K většímu efektu léčby a při intoleranci perorální léčby je vhodné zpočátku podat kortikoidy parenterálně. U těžkých gastrointestinálních forem vaskulitidy byl popsán dobrý efekt intravenózních imunoglobulinů [23]. Součástí léčby je v případě zvracení či výrazných bolestí břicha zastavení perorálního příjmu a parenterální výživa. Samozřejmostí je pečlivé monitorování klinického stavu pacienta z hlediska možných komplikací. Vzácně se vyskytují protrahované formy HSP s opakovanými výsevy purpury, které jsou spojeny s vyšším rizikem vzniku HSP nefritidy. Někteří autoři poukazují v těchto případech na příznivý efekt kolchicinu [10].
Na neexistující konsensus v léčbě pacientů s HSP poukázala v roce 2009 retrospektivní studie zahrnující téměř 2000 pacientů z 36 nemocnic v USA. Nejčastěji používanými léky u hospitalizovaných dětí byly kortikoidy (56 %), dále opioidy (36 %), NSAIDs (35 %) a antihypertenziva (11 %), jednotlivá pracoviště se však významně lišila v indikacích a léčebných postupech [24].
Léčba lehké a středně závažné HSP nefritidy
Děti s minimálními močovými nálezy nevyžadují žádnou léčbu, symptomy většinou ustoupí spontánně. U pacientů s lehkou proteinurií, nefritickým či nefrotickým syndromem bez renální insuficience, u nichž biopticky nenacházíme závažný aktivní histologický nález (<50 % srpků), byla zkoušena řada léčebných postupů. Většina studií zabývajících se léčbou této formy HSP nefritidy se týkala malého počtu pacientů s různě závažnou formou nemoci. V terapii byla dětem podávána různá imunosupresiva samostatně či v kombinaci: kortikosteroidy, cyklofosfamid, cyklosporin A a mykofenolát mofetil.
Jedna z recentních studií neprokázala lepší výsledky léčby ve skupině 43 dětí s HSP a IgA nefropatií léčených kombinací kortikoidů s cyklofosfamidem proti skupině dětí léčených kortikoidy samotnými [25]. Současné podávání ACE inhibitorů a rybího tuku vedlo k poklesu krevního tlaku, proteinurie a ke stabilizaci renální funkce u několika pacientů [26]. Japonská studie, do které bylo zařazeno 16 dětí, prokázala příznivý vliv časné tonzilektomie (TE) v kombinaci s imunosupresivní léčbou. Do 6 měsíců od TE došlo k vymizení patologické proteinurie, navíc v průběhu sledování několika let nebyla zjištěna rekurence základního onemocnění [27]. Ke sjednocení léčebných doporučení a optimalizaci léčby této formy HSP nefritidy jsou nezbytné multicentrické randomizované studie (RCT).
Léčba těžkých forem HSP nefritidy a RPGN
Do této kategorie řadíme pacienty se smíšeným nefroticko-nefritickým syndromem s normální nebo sníženou glomerulární filtrací a děti s progresivní formou HSP nefritidy s postižením více než 50 % glomerulů srpky v bioptickém nálezu. Niaudet prokázal efekt pulzů methylprednisolonu s následným pokračováním perorálními kortikoidy po 3,5 měsíce a s přidáním cyklofosfamidu u pacientů se srpky ≥50 %. Kromě klinického zlepšení byl u těchto dětí pozorován i ústup aktivity nemoci v kontrolní biopsii ledvin [28]. V práci Fostera měla kombinace azathioprinu s kortikoidy lepší efekt než kortikoidy samotné či pouze podpůrná léčba [29]. V některých studiích vedlo podávání cyklofosfamidu ke snížení indexu aktivity onemocnění, index chronicity ovšem zůstal nezměněn [30]. RCT z roku 2004 neprokázala v souboru 56 dětí efekt léčby cyklofosfamidem ve srovnání pouze s podpůrnou léčbou na další průběh onemocnění [31]. Několik menších nerandomizovaných studií potvrdilo dobrý efekt cyklosporinu A u těžké HSP nefritidy. Někteří pacienti se však stávají cyklosporin-dependentními [32]. Zatím zcela ojedinělé jsou zkušenosti s léčbou mykofenolát mofetilem a rituximabem.
Studie z poslední doby prokazují velmi dobrý efekt plazmaferéz (PF) jako samostatné léčby či kombinace PF s imunosupresivní léčbou [33]. Bylo prokázáno, že pacienti, u nichž byla zahájena léčba PF do 1 měsíce od manifestace onemocnění, měli lepší prognózu. Výhodou léčby PF bez další imunosuprese je eliminace závažných nežádoucích účinků medikace. I v léčbě těžkých forem HSP nefritidy se očekávají výsledky rozsáhlejších RCT.
Prevence HSP nefritidy
Možnost předejít vzniku nefritidy v době diagnózy HSP je opakovaně diskutovanou otázkou a tématem řady publikovaných prací [34]. Účinností kortikoidů v prevenci HSPN se dosud zabývalo 7 retrospektivních a 5 randomizovaných prospektivních studií s podáním prednisonu v dávce 1–2,5 mg/kg/den po dobu 1–3 týdnů.
V necelé polovině těchto studií byl prokázán efekt časného podání kortikoidů, většina studií však účinnost kortikoidů na rozvoj renálního postižení neprokázala. Jednotlivé studie se však lišily v dávce, době nasazení a délce podávání kortikoidů [35]. Recentní metaanalýzy 4 randomizovaných kontrolovaných studií rovněž účinnost kortikoidů v prevenci rozvoje HSP nefritidy nepotvrdily [36, 37].
Sledování pacientů po prodělané HSP
HSP ve většině případů kompletně odezní do 8 týdnů, avšak během prvního roku u 30–40 % pacientů může docházet k rekurenci choroby, i když s mírnější symptomatologií. Sledování pacientů s HSP bez nefritidy v úvodu onemocnění je doporučováno 2 roky, po této době je vývoj ledvinného postižení nepravděpodobný.
Pacienti s prodělanou HSP nefritidou by měli být dlouhodobě sledováni nefrologem pro riziko progrese onemocnění a rozvoj chronického selhání ledvin.
Závěr
Přestože je HSP onemocnění známé přes 200 let a řada recentních poznatků přispěla k objasnění patogeneze, neexistují zatím jednoznačná doporučení pro optimální léčbu a prevenci nefritidy. Závažnost renálního postižení je nejdůležitějším ukazatelem prognózy HSP a dnes již známe některé rizikové faktory pro jeho vznik i progresi do ESRD. Kortikoidy, které se původně v prevenci vzniku nefritidy zdály slibné, v randomizovaných studiích bohužel nepotvrdily dostatečný efekt.
V léčbě HSP nefritidy využíváme na základě dosavadních zkušeností inhibitory renin-angiotenzinového systému, rybí tuk, imunosupresiva, plazmaferézu a tonzilektomii.
Došlo: 25. 8. 2010
Přijato: 14. 10. 2010
MUDr. Sylva Skálová, PhD.
Dětská klinika LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: skalova.s@seznam.cz
Sources
1. Gardner-Medwin JM, Dolezalova P, Cummins C, et al. Incidence of Henoch-Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins. Lancet 2002 Oct 19; 360 : 1197–202.
2. Henoch EH. Uber ein eigenthe Form von Purpura. Berl. Klin. Wochenschr. 1974; 11 : 641–643.
3. Brogan PA. What’s new in the aetiopathogenesis of vasculitis? Pediatr. Nephrol. 2007; 22 : 1083–1094.
4. Lau KK, Suzuki H, Novak J, et al. Pathogenesis of Henoch-Schönlein purpura nephritis. Pediatr. Nephrol. 2010; 25 : 19–26.
5. Matoušovic K, Mestecký J, Tomana M, et al. Imunoglobulin A a choroby ledvin. Vnitř. Lék. 2006; 52 : 256–262.
6. Saulsbury FT. Henoch-Schönlein purpura. Curr. Opin. Rheumatol. 2001; 13 : 35–40.
7. Soylemezoglu O, Peru H, Gonen S, et al. HLA-DRB1 alleles and Henoch-Schönlein purpura: susceptibility and severity of disease. J. Rheumatol. 2008; 35 : 1165–1168.
8. Amoli MM, Thomson W, Hajeer AH, et al. HLA-B35 association with nephritis in Henoch-Schönlein purpura. J. Rheumatol. 2002; 29 : 948–949.
9. Ozdogan H, Arisoy N, Kasapçapur O, et al. Vasculitis in familial Mediterranean fever. J. Rheumatol. 1997; 24 : 323–327.
10. Saulsbury FT. Successful treatment of prolonged Henoch-Schönlein purpura with kolchicine. Clin. Pediatr. 2009; 48 : 866–868.
11. Ozen S, Pistorio A, Iusan SM, et al. EULAR/PRINTO/PRES criteria for Henoch-Schönlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arthritis: Ankara 2008. Part II: Final classification criteria. Ann. Rheum. Dis. 2010; 69 : 798–806.
12. Al-Sheyab M, El-Shanti H, Ajlouni S, et al. The clinical spectrum of Henoch-Schönlein purpura in infants and young children. Eur. J. Pediatr. 1995; 154 : 969–972.
13. McCarthy HJ, Tizard EJ. Clinical practice: Diagnosis and management of Henoch-Schönlein purpura. Eur. J. Pediatr. 2009; 169 : 643–650.
14. Narchi H. Risk of long-term renal impairment and duration of follow up recommended for Henoch - -Schönlein purpura with normal or minimal urinary findings: a systematic review. Arch. Dis. Child. 2005; 90 : 921–924.
15. Bogdanović R. Henoch-Schönlein purpura nephritis in children: risk factors, prevention and treatment. Acta Pediatr. 2009; 98 : 1882–1889.
16. Kaku Y, Yonekawa Y, Taub E. Renal involvement in Henoch-Schönlein purpura: a multivariate analysis of prognostic factors. Kidney Int. 1998; 53 : 1755–1759.
17. Halling SE, Söderberg MP, Berg UB. Predictors of outcome in Henoch-Schönlein nephritis. Pediatr. Nephrol. 2010; 25 : 1101–1108.
18. Rieu P, Noël LH. Henoch-Schönlein nephritis in children and adults. Morphological features and clinicopathological correlations. Ann. Med. Interne (Paris) 1999; 150 : 151–159.
19. Zieg J, Skálová S. Postižení ledvin při Henoch - -Schönleinově purpuře. Pediatrie pro Praxi 2010; 11 : 169–171.
20. Butani L, Morgenstern BZ. Long-term outcome in children after Henoch-Schönlein purpura nephritis. Clin. Pediatr. 2007; 46 : 505–511.
21. Ronkainen J, Koskimies O, Ala-Houhala M, et al. Early prednisone therapy in Henoch-Schönlein purpura: a randomized, double-blind, placebo-controlled trial. J. Pediatr. 2006 Aug; 149 : 241–247.
22. Sohagia AB, Gunturu SG, Tong TR, et al. Henoch-Schoenlein purpura – A case report and review of the literature. Gastroenterol. Res. Pract. 2010; 2010 : 597648. Epub 2010 May 23.
23. Buchanec J, Galanda V, Belakova S, et al. Incidence of renal complications in Schoenlein-Henoch purpura syndrome in dependence of an early administration of steroids. Int. Urol. Nephrol. 1998; 20 : 409–412.
24. Weis PF, Klink AJ, Hexem K, et al. Variation in inpatient therapy and diagnostic evaluation of children with Henoch-Schönlein purpura. J. Pediatr. 2009; 155 : 801–806.
25. Edström Halling S, Söderberg MP, Berg UB. Treatment of severe Henoch-Schönlein and immunoglobulin A nephritis. A single center experience. Pediatr. Nephrol. 2009; 24 : 91–97.
26. Dixit MP, Dixit NM, Scott K. Managing Henoch--Schönlein purpura in children with fish oil and ACE inhibitor therapy. Nephrology 2004; 9 : 381–386.
27. Inoue CN, Chiba Y, Morimoto T, et al. Tonsillectomy in the treatment of pediatric Henoch-Schönlein nephritis. Clin. Nephrol. 2007; 67 : 298–305.
28. Niaudet P, Habib R. Methylprednisolone pulse therapy in the treatment of severe forms of Schönlein-Henoch purpura nephritis. Pediatr. Nephrol. 1998; 12 : 238–243.
29. Foster BJ, Bernard C, Drummond KN, et al. Effective therapy for severe Henoch-Schönlein purpura nephritis with prednisone and azathioprine: a clinical and histopathologic study. J. Pediatr. 2000; 136 : 370–375.
30. Tanaka H, Suzuki K, Nakahata T, et al. Early treatment with oral immunosuppressants in severe proteinuric purpura nephritis. Pediatr. Nephrol. 2003; 18 : 347–350.
31. Tarshish P, Bernstein J, Edelmann CM. Henoch-Schönlein purpura nephritis: course of disease and efficacy of cyclophosphamide. Pediatr. Nephrol. 2004; 19 : 51–56.
32. Shin JI, Park JM, Lee JS, et al. Successful use of cyclosporin A in severe Schönlein-Henoch nephritis resistant to both methylprednisolone pulse and azathioprine. Clin. Rheumatol. 2006; 25 : 759–760.
33. Shenoy M, Ognjanovic MV, Coulthard MG. Treating severe Henoch-Schönlein and IgA nephritis with plasmapheresis alone. Pediatr. Nephrol. 2007; 22 : 1167–1171.
34. Buchanec J, Zibolen M, Hyrdelová E, et al. Možná prevencia vzniku nefropatie pri Schoenlein-Henochovej purpure včasným podaním prednisonu – dôvody pre a proti. Čes.-slov. Pediat. 1998; 53 : 256–259.
35. Jeseňák M, Antonová M, Brndiarová M, et al. Henochova-Schönleinova purpura z pohľadu preventivného podávania kortikoidov. Čes.-slov. Pediat. 2008; 63 : 557–564.
36. Zaffanello M, Fanos V. Treatment-based literature of Henoch-Schönlein purpura nephritis in childhood. Pediatr. Nephrol. 2009; 24 : 1901–1911.
37. Chartapisak W, Opastriakul S, Willis NS, et al. Prevention and treatment of renal diseases in Henoch-Schönlein purpura: a systematic review. Arch. Dis. Child. 2009; 94 : 132–137.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2010 Issue 11-
All articles in this issue
- Prenatal Cardiology in the Czech Republic
- Inborn Heart Defects and Their Risk Factors
- Current Trends in the Treatment of Invagination in Childhood
- Imunoglukan P4H® in the Prevention of Recurrent Respiratory Infections in Childhood
-
Hemolytic Uremic Syndrome (HUS) – One of the Most Common Causes of Acute Renal Failure in Childhood.
Complexity of the Pathophysiology and Novel Diagnostic and Therapeutic Options for Atypical Forms - The Screening and Brief Intervention Project in Primary Care Pediatric Surgeries with the Aim of Reducing Substance Abuse by Teenagers
- Henoch-Schönlein purpura – State-of-the-Art Diagnosis and Treatment
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Henoch-Schönlein purpura – State-of-the-Art Diagnosis and Treatment
-
Hemolytic Uremic Syndrome (HUS) – One of the Most Common Causes of Acute Renal Failure in Childhood.
Complexity of the Pathophysiology and Novel Diagnostic and Therapeutic Options for Atypical Forms - Current Trends in the Treatment of Invagination in Childhood
- Imunoglukan P4H® in the Prevention of Recurrent Respiratory Infections in Childhood
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career