-
Medical journals
- Career
Kožní T buněčné lymfomy: mycosis fungoides a Sézaryho syndrom. Diagnostika a terapie
Authors: P. Fialová 1
Authors‘ workplace: I. dermatovenerologická klinika FN u sv. Anny v Brně a LF MU, přednosta prof. MUDr. Hana Jedličková, Ph. D. 1
Published in: Čes-slov Derm, 97, 2022, No. 2, p. 45-59
Category: Reviews (Continuing Medical Education)
Overview
Primární kožní lymfomy (PCL – Primary Cutaneous Lymphomas) tvoří samostatnou heterogenní skupinu extranodálních nehodgkinských lymfomů, pro které je typická přítomnost maligních T nebo B lymfocytů v kůži. PCL z definice v době diagnózy postihují pouze kůži, v této době není prokazatelné mimokožní postižení. Podle konsenzuální klasifikace WHO-EORTC (Světová zdravotnická organizace/Evropská organizace pro výzkum a léčbu rakoviny) se PCL dělí na kožní lymfomy z T lymfocytů (Cutaneous T-cell Lymphoma – CTCL), které představují 75 % případů, a kožní lymfomy z B lymfocytů (Cutaneous B-cell Lymphoma – CBCL). Mycosis fungoides (MF) a Sézaryho syndrom (SS) společně představují nejčastější podtyp CTCL, tvoří dvě třetiny všech CTCL. Mycosis fungoides je indolentní nádorové onemocnění, s mnohaletým vývojem, nejčastěji probíhající ve třech stadiích – stadium makulózní (dříve také označováno jako premykotické), kožních infiltrátů (plaků), tumorů (tumours). Sézaryho syndrom je vzácné onemocnění s agresivním průběhem, charakterizované erytrodermií, generalizovanou lymfadenopatií a přítomností nádorových T lymfocytů v krvi. Zásadní pro stanovení diagnózy MF/SS je klinický obraz a zejména histologické, imunohistochemické a genetické vyšetření. CTCL jsou v současnosti nevyléčitelné. Cílem léčby je prodloužení přežití při dobré kvalitě života. Léčebné možnosti dělíme na terapii cílenou na kůži a systémovou léčbu. Pacienti s CTCL vyžadují multidisciplinární péči ve specializovaných centrech pro léčbu kožních lymfomů.
Klíčová slova:
diagnostika – prognóza – staging – mycosis fungoides – systémová léčba – Sézaryho syndrom – kožní lymfomy z T buněk – terapie cílená na kůži
ÚVOD
PCL patří do skupiny nehodginských lymfomů, které jsou charakterizované přítomností klonálních T nebo B lymfocytů v kůži. PCL z definice v době diagnózy postihují pouze kůži, v této době není prokazatelné mimokožní postižení [28]. Představují heterogenní skupinu kožních T buněčných (CTCL – Cutaneous T-cell Lymphomas) a kožních B buněčných lymfomů (CBCL – Cutaneous B-cell Lymphomas). V západním světě tvoří CTCL přibližně 75–80 % všech PCL a CBCL 20–25 % [23, 35, 41]. Jednotlivé typy CTCL a CBCL mají charakteristické klinické projevy a histopatologický obraz. PCL jsou klasifikovány podle WHO-EORTC (WHO – World Health Organization, EORTC – European Organisation for Research and Treatment of Cancer) konsenzuální klasifikace, která byla vytvořena v roce 2005. V současné době je platná její revidovaná verze z roku 2018 (tab. 1) [41]. Primární kožní lymfomy (PCL – Primary Cutaneous Lymphomas) tvoří 2 % všech lymfomů [28]. Postihují častěji muže než ženy (1,5–2 : 1), nejčastěji po 60. roce věku. Odhadovaná roční incidence je 7,2 případy na 1 milion obyvatel. V roce 2017 žilo v České republice (ČR) asi 800 nemocných s PCL [1]. Nejčastějším typem CTCL je mycosis fungoides (MF), představuje asi 60 % z CTCL a 50 % ze všech PCL. Druhou nejčastější skupinou z CTCL jsou primární kožní CD30+ lymfoproliferativní onemocnění (představují asi 25 % CTCL) zastoupeny lymfomatoidní papulózou a primárním kožním anaplastickým velkobuněčným lymfomem [4, 16]. Leukemickou variantou CTCL je Sézaryho syndrom (SS), vzácné onemocnění s agresivním průběhem a špatnou prognózou [41].
Table 1. Klasifikace primárních kožních lymfomů dle WHO-EORTC, upravená verze z roku 2018, relativní výskyt a 5leté přežití jednotlivých diagnostických jednotek [40] ![Klasifikace primárních kožních lymfomů dle WHO-EORTC, upravená verze z roku 2018, relativní výskyt a 5leté přežití
jednotlivých diagnostických jednotek [40]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d5a041dc55c0e6b12d7055a0d92fe7b2.jpg)
ETIOLOGIE A PATOGENEZE
V současné době není etiologie CTCL známá. Jako příčiny klonální proliferace T lymfocytů u CTCL byly zkoumány toxické látky z vnějšího prostředí, chronická antigenní stimulace bakteriálními superantigeny či virové infekce (HTLV-1). Podle proběhlých studií nebyla ale prokázána žádná příčinná souvislost [18, 19]. Výzkum se zaměřil i na genetické pozadí. V buňkách CTCL bylo identifikováno heterogenní spektrum genetických abnormalit, většinou delecí a translokací, vedoucí k selhání procesu apoptózy či nadměrné expresi onkogenů. Zjištěna byla chyba v přepisu protoonkogenu MYC, ztráta tumor supresorového genu TP53, porušená regulace genu pro tumor suprimující protein p16, což vede k narušení kontroly buněčného cyklu a k selhání procesu apoptózy [13, 14]. Neoplastické buňky MF/SS pocházejí z paměťových CD4+ T lymfocytů [17]. Podle výsledků studií molekulárních profilů T lymfocytů se ukázalo, že T lymfocyty u SS vychází z centrálních paměťových T lymfocytů (TCM), zatímco u MF z efektorových paměťových T lymfocytů (TEM). Maligní T lymfocyty MF z kůže exprimují CCR4+/CLA+/CCR7-/L - -selektin – imunofenotyp kožních rezidentních paměťových T lymfocytů (TRM). Oproti tomu maligní T lymfocyty z krve pacientů se SS exprimují fenotyp CCR4+/ CCR7+/L-selektin+. Exprese povrchového ligandu CCR4 určuje schopnost kožního navádění T lymfocytů, zatímco CCR7+/L-selektin+ určuje schopnost T lymfocytů recirkulovat mezí krví a lymfatickými uzlinami. Mikroprostředí nádoru hraje roli v patogenezi a progresi MF a SS. V časném stadiu MF se infiltrát T lymfocytů skládá jak z maligních CD4+, tak z reaktivních CD8+ T lymfocytů s dominantním Th1 cytokinovým vzorem. U pokročilých stadií MF a u SS dochází k postupnému zvyšování CD4+ T lymfocytů a přechodu na mikroprostředí s dominancí Th2. To vede ke zvýšené produkci cytokinů Th2 (zejména IL-10 a TGF-beta), což se odráží v charakteristických imunitních abnormalitách u pacientů s pokročilou MF a SS: snížená odpověď T lymfocytů na antigeny a mitogeny, porucha cytotoxicity zprostředkované buňkami, včetně aktivity NK buněk (natural killer – přirození zabíječi), zvýšené hladiny IgE v séru, periferní eozinofilie, porucha funkce dendritických buněk. Toto má za následek endogenní imunosupresi a oslabenou protinádorovou imunitu [3, 12, 18, 32].
MYCOSIS FUNGOIDES
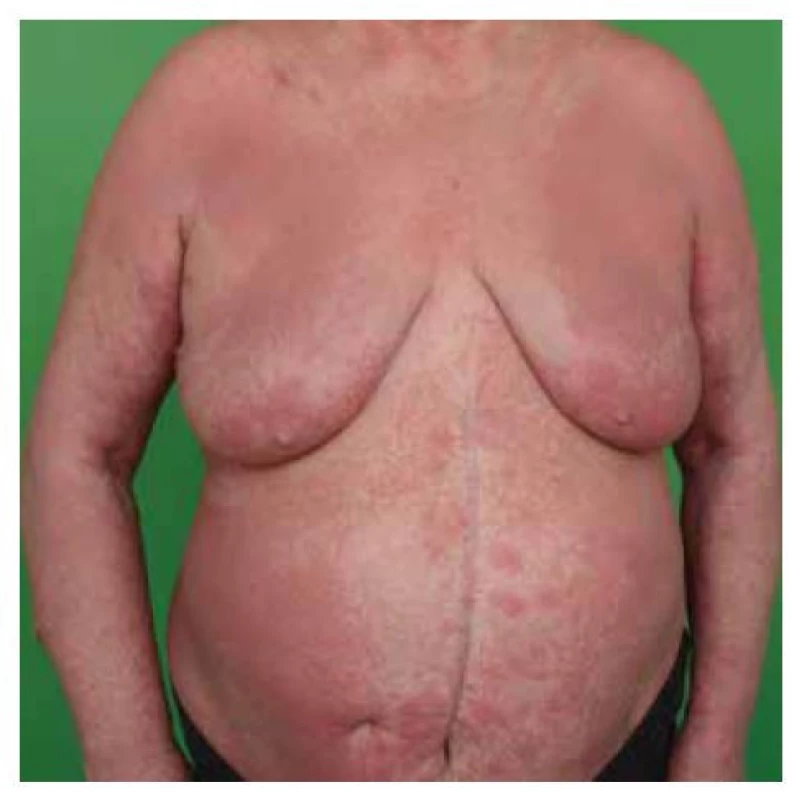
Mycosis fungoides je kožní T buněčný lymfom, charakterizovaný epidermotropní proliferací CD4+ malých nebo středně velkých T lymfocytů s cerebriformním anebo pleomorfním jádrem. MF byla poprvé popsána v roce 1806 francouzským dermatologem Alibertem jako onemocnění s kožními projevy vzhledu klobouků hub. V roce 1870 Bazin poprvé definoval tři stadia choroby. Darier v roce 1890 popsal u pacientů s MF intraepidermální shluky leukocytů a tento nález byl popularizován Pautrierem, po němž byly následně mikroabscesy pojmenovány. MF je relativně vzácné onemocnění, výskyt v Evropě i ve Spojených státech je přibližně šest případů na jeden milion obyvatel ročně. Postihuje častěji muže, poměr mezi muži a ženami je přibližně 2 : 1. MF se manifestuje nejčastěji v 5.–7. dekádě života, ale výskyt je možný v kterémkoliv věku (20 % případů se manifestuje mezi 25.–49. rokem) [14, 15]. Podle údajů Národního onkologického registru bylo v letech 2005–2015 v ČR ročně hlášeno 0,232 případů MF na 100 000 obyvatel. Častěji byli postiženi muži (poměr muži : ženy je 1,5 : 1), průměrný věk při stanovení diagnózy je 67 let [7]. Definitivní diagnóze MF často předchází „premykotické období“ v rozmezí měsíců až desetiletí, během kterého může mít pacient nespecifické kožní léze, klinicky nejčastěji popisovány jako ekzémové. Ty se objevují a zase mizí, mohou se zvětšovat i zmenšovat. Histologický nález odpovídá nespecifické dermatitidě. Průměrná doba od počátku projevů ke stanovení diagnózy trvá 4–6 let, ale může trvat i desetiletí [38]. Kožní projevy MF jsou různorodé a v průběhu onemocnění se mění. Lze je popsat jako barevné změny bez infiltrace (makuly/skvrny), infiltrované plaky, tumory a erytrodermii. U jednoho pacienta se může vyskytovat více těchto projevů současně. MF je onemocnění typicky s mnohaletým vývojem, během kterého rozlišujeme tři na sebe navazující stadia. Iniciální, stadium makul/skvrn (patch) je charakterizováno výskytem červenohnědých ostře ohraničených plošných ložisek různé velikosti s atrofickým (mírně zřaseným), jemně se olupujícím povrchem. Typicky se vyskytují na kůži v lokalizacích chráněných před sluncem – vnitřní strana paží a předloktí, po stranách trupu a na bocích, hýždě, vnitřní strana stehen (obr. 1). Subjektivně projevy často svědí. Makuly mohou spontánně vymizet a znovu se objevovat. Stadium makul/skvrn, pokud není léčeno, progreduje po několika letech do stadia infiltrativního. V infiltrativním stadiu (stadium plaků – plaque) se plaky vytváří v místě jak původních projevů, tak i na dříve nepostižených partiích. Makroskopicky jde o ostře ohraničená infiltrovaná růžová až lividní ložiska různé velikosti, často anulárního či polycyklického („podkovovitého“) tvaru.
Image 1. MF – stadium makul (skvrn) 
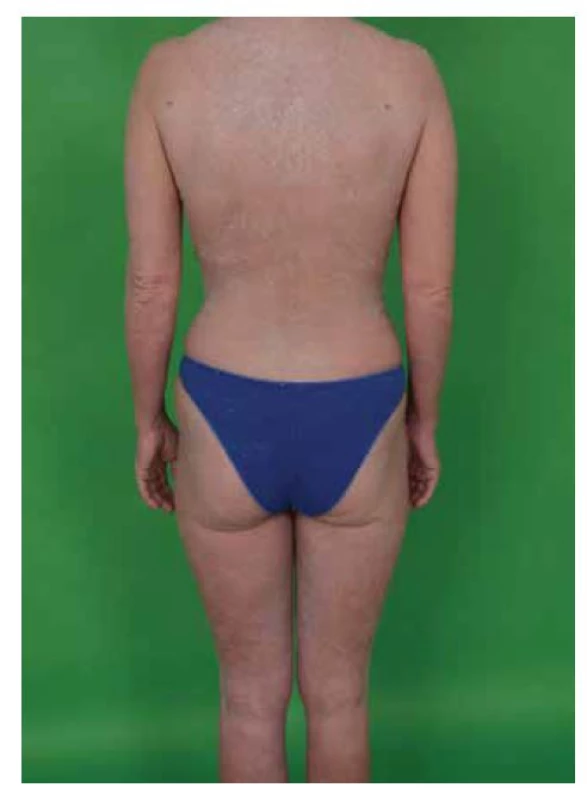
Povrch plaků může být krytý šupinami, vzácněji může být erodován (obr. 2). Tumorózní stadium je charakterizované přítomností tumorů, což jsou tuhé vertikálně rostoucí uzly (minimálně 5 mm nad niveau či se zřetelnou infiltrací do hloubky dermis), větší než 1 cm v průměru. Jsou červenohnědé až lividní barvy, s hladkým povrchem, který se často ulcerózně rozpadá a sekundárně infikuje. Tumory mohou vznikat kdekoliv na kožním povrchu s častější predilekcí v obličeji a v kožních záhybech (podpaží, třísla, kubitální jamky, u žen pod prsy). Některé nádory mají vklesklý povrch a podobají se klobouku hub (obr. 3). Mohou vyrůstat z plaků či skvrn nebo mohou vzniknout de novo. U některých pacientů s MF může onemocnění progredovat až do obrazu generalizovaného kožního postižení – erytrodermická mycosis fungoides. Generalizovaná erytrodermie je charakterizovaná výskytem skvrn a/nebo plaků na 80 % a více kožního povrchu. Kůže je difuzně jasně červená, s jemnými snadno se odlučujícími bílými šupinami. Často intenzivně svědí. Klinicky je tato forma špatně rozlišitelná od Sézaryho syndromu. Ve dlaních a na ploskách nacházíme hyperkeratózy s tvorbou ragád, bývá přítomna dystrofie nehtových plotének, různý stupeň alopecie. Může být hmatná periferní lymfadenopatie, která je v časných stadiích reaktivního (dermopatického) charakteru, v pozdních stadiích může být odrazem uzlinové infiltrace lymfomovými buňkami (obr. 4). Extrakutánní projevy se rozvinou u přibližně 5–7 % pacientů s MF a zahrnují kromě postižení lymfatických uzlin šíření nádorových buněk do plic, sleziny, jater a gastrointestinálního traktu [2]. V průběhu onemocnění MF dále může dojít k velkobuněčné transformaci, většinou doprovázené expresí CD30, která se klinicky projeví jako náhle vzniklé noduly a tumory obvykle významně zhoršující prognózu [8].
Image 2. MF – infiltrativní stadium (plaky) 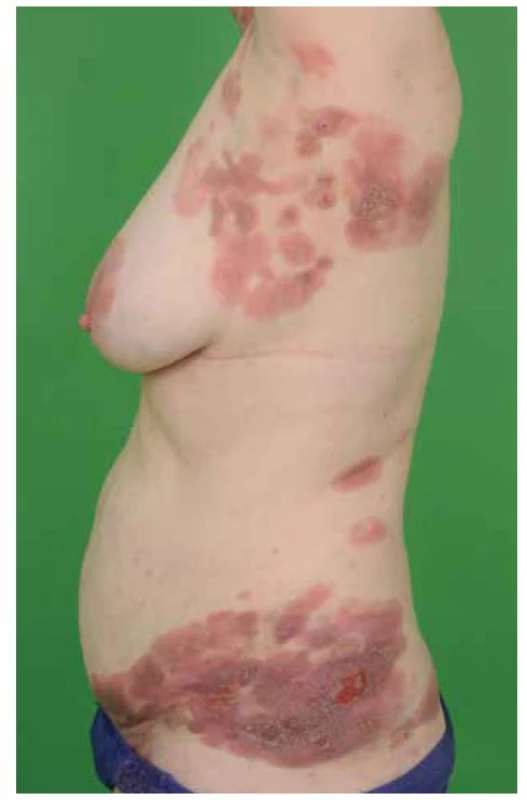
Image 3. MF – tumorózní stadium 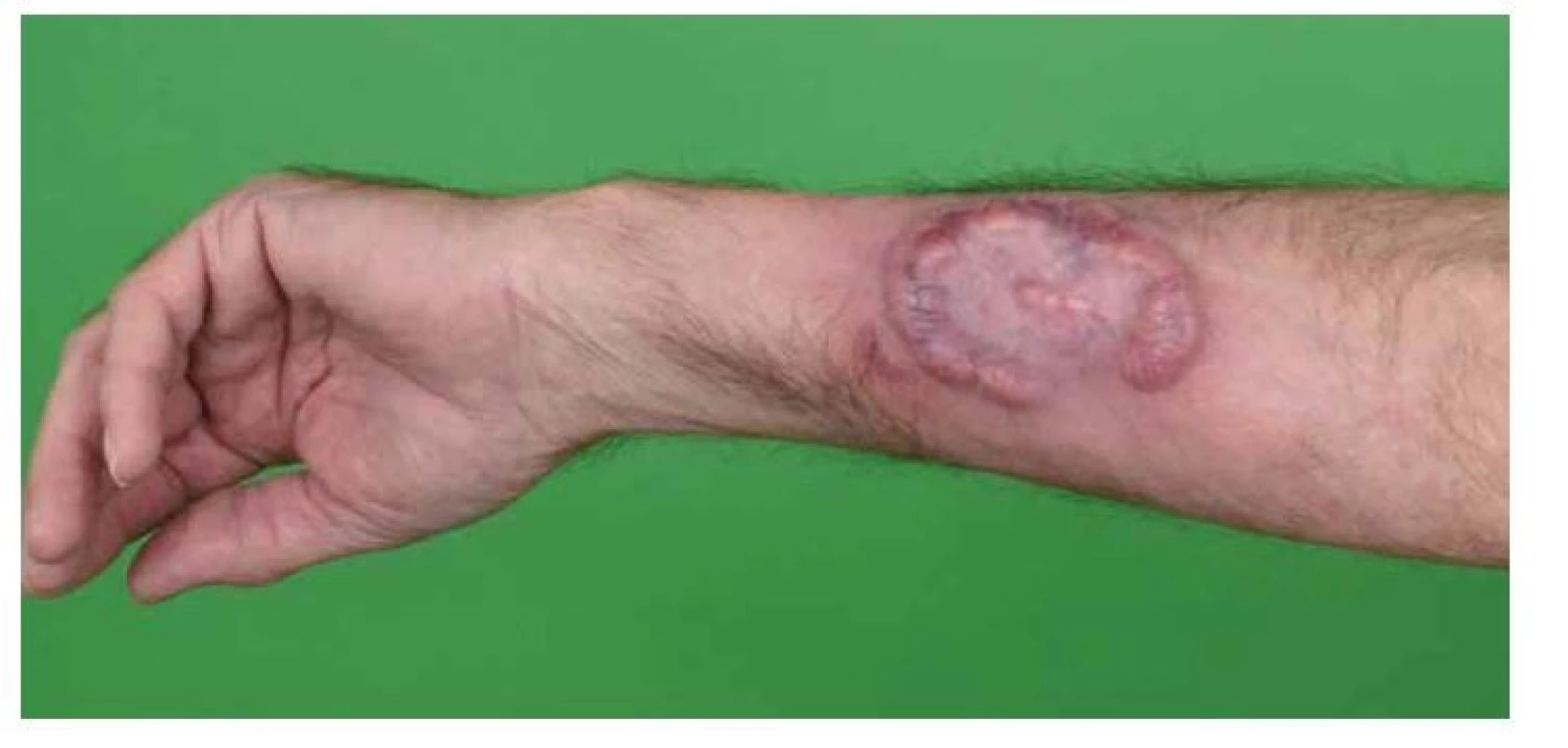
Mycosis fungoides se kromě klasické formy může projevovat vzácnějšími variantami. Folikulotropní mycosis fungoides (FMF, folikulární mucinóza) představuje asi 10 % všech MF. Postihuje převážně dospělé jedince, spíše muže. Predilekční lokalizace je oblast hlavy a krku, ale vyskytuje se i na ostatních částech těla. Projevuje se erytematozními folikulárně vázanými papulami, akneiformními lézemi, indurovanými plaky a někdy i tumory (obr. 5). V oblasti kapilicia a očních řas vede k alopecii. Folikulotropní MF se histologicky vyznačuje charakteristickými infiltráty z neoplastických T lymfocytů vázaných na vlasové folikuly. Typickým znakem je akumulace mucinu ve vlasových folikulech, která však nemusí být patognomonická pro toto onemocnění. Prognóza je horší než u klasické MF, 5 let přežívá 70–80 % pacientů [8]. Léčebně je nutné volit razantnější metody než u konvenční MF, protože infiltrát je lokalizován hlouběji. Pagetoidní retikulóza (Woringerova-Koloppova) je lokalizovaná forma CTCL. Klinicky se manifestuje jako psoriaziformní nebo hyperkeratotické ložisko s typickou lokalizací na končetinách a pomalou progresí choroby. Na rozdíl od klasické MF nedochází u této varianty k mimokožnímu šíření onemocnění. Granulomatózní syndrom ochablé kůže (granulomatous slack skin – GSS) je vzácný podtyp MF charakterizovaný rozsáhlými ložisky, se ztenčelou ochablou kůží vytvářející převislé řasy s predilekcí v axilách a tříslech. U pacientů s GSS se může souběžně manifestovat Hodgkinova choroba [13]. Mezi méně časté klinické obrazy MF řadíme hypopigmentovaná či hyperpigmentovaná ložiska anebo ložiska poikilodermická – poikiloderma atrophicans vasculare (skvrnitá pigmentace, epidermální atrofie a teleangiektazie). Hypopigmentovaná ložiska jsou častější u dětí a u pacientů s tmavší kůží. Vzácně se také můžeme setkat s bulózními/vezikulózními lézemi (plihé nebo napjaté puchýře), purpurovými lézemi, ichtyosiformními projevy, facies leontina (obr. 6).
Image 5. MF – folikulotropní varianta 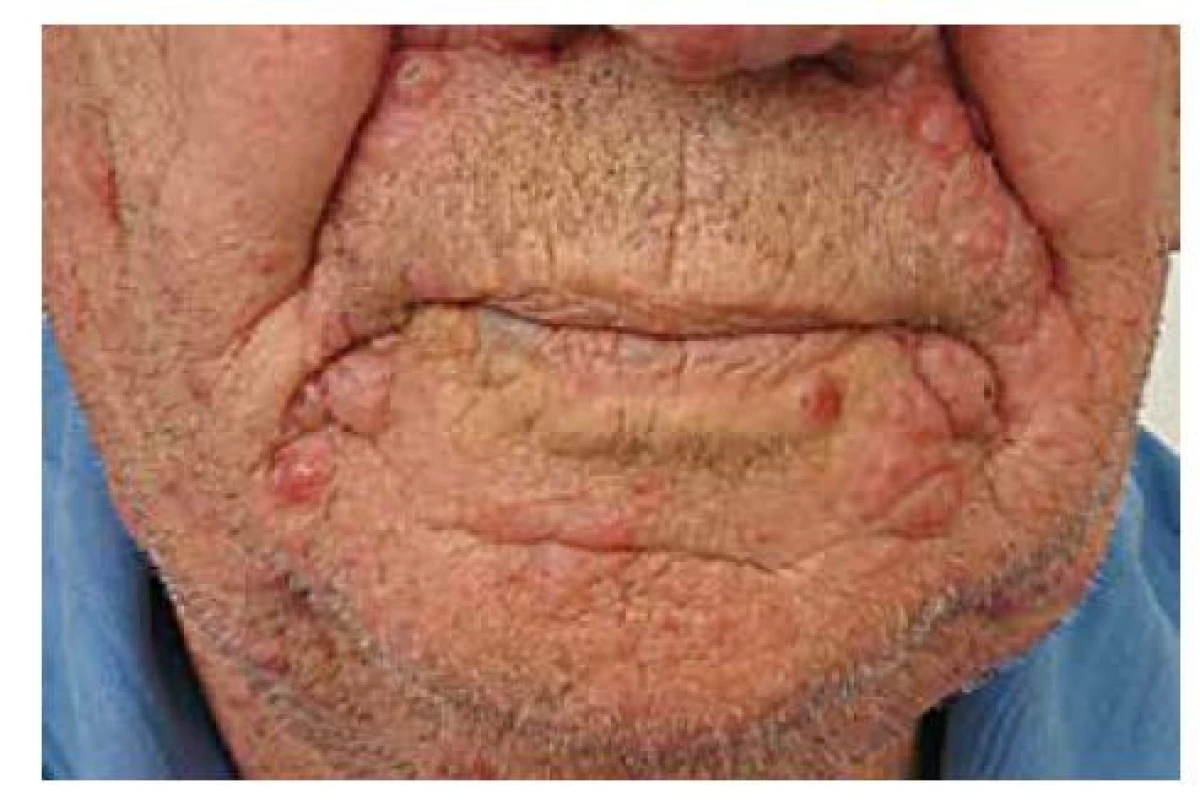
Image 6. MF – tumorózní stadium, facies leontina 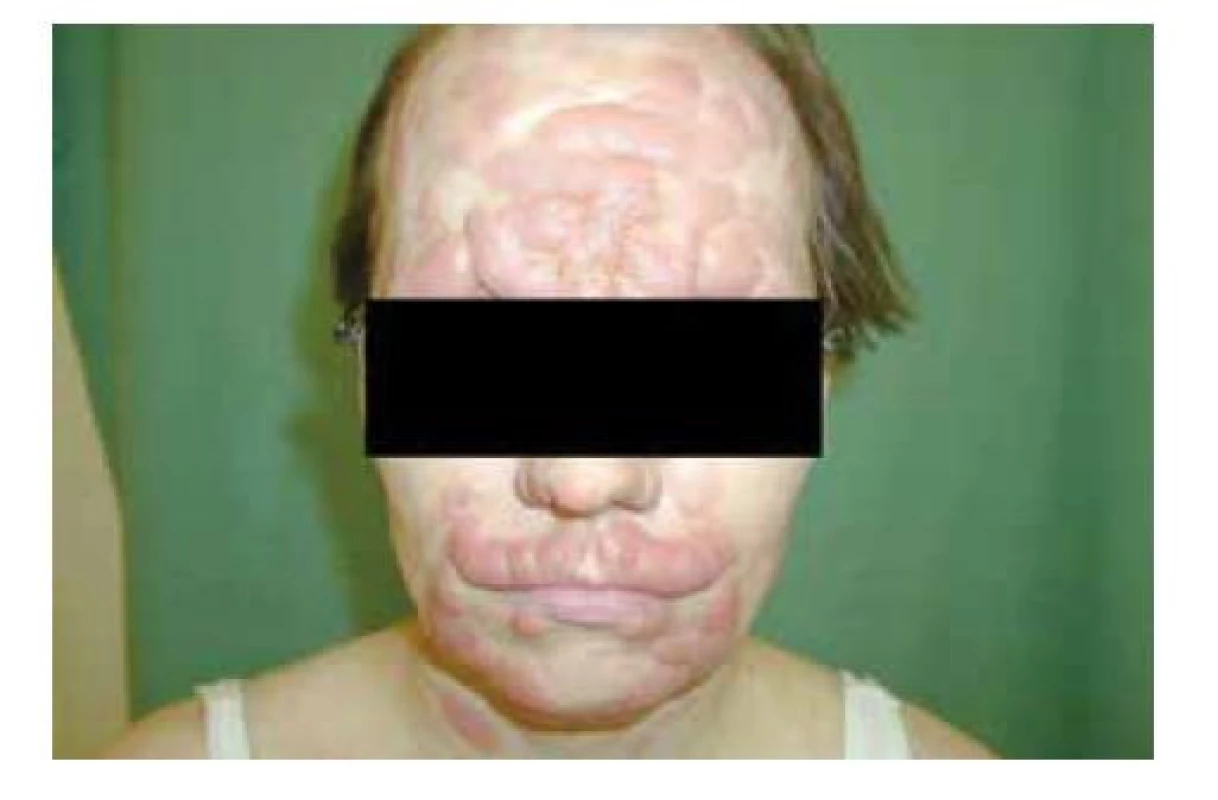
SÉZARYHO SYNDROM
Sézaryho syndrom (SS) je definován triádou erytrodermie, generalizovaná lymfadenopatie a přítomnost cirkulujících maligních T lymfocytů s cerebriformními jádry, nazývané „Sézaryho buňky“ v periferní krvi, v lymfatických uzlinách a v kůži. Sézaryho syndrom je považován za leukemickou variantu CTCL s agresivním průběhem, vyvíjí se rychle, v průběhu týdnů až měsíců. SS byl poprvé popsán v roce 1938 Albertem Sézarym u pacienta s erytrodermií, leukocytózou a lymfadenopatií, který měl v periferní krvi atypické lymfocyty s cerebriformními jádry. Ultrastrukturu Sézaryho buněk v roce 1968 popsali pomocí elektronové mikroskopie Lutzner a Jordan. Sézaryho buňky, nacházející se v periferní krvi, se podle velikosti rozdělují na velké, střední a malé (nazývané též podle svého objevitele – Lutznerovy buňky). SS představuje asi 3 % ze všech primárních kožních lymfomů, roční incidence je udávaná 0,2–0,4 případů na 1 milion obyvatel ČR [1]. Postihuje stejně jako MF starší dospělé jedince, častěji muže. Příčina většiny případů SS zůstává nejasná. Malé procento případů SS je však spojeno s lidskými T lymfotropními viry typu 1 a 2 (HTLV-I/II), které jsou endemické v jižním Japonsku, karibských ostrovech a části Středního východu [24]. V klinickém obrazu dominuje erytrodermie, postihující více než 80 % tělesného povrchu, která bývá v počátku onemocnění přechodného rázu s relaps-remitentním průběhem. Kůže je červená/erytematózní, prosáklá, lichenifikovaná, výrazně se olupuje a intenzivně svědí (obr. 7). Přítomná bývá alopecie, ektropion, onychodystrofie, hyperkeratózy dlaní a plosek s tvorbou ragád. V pokročilém stadiu mohou být postiženy vnitřní orgány, nejčastěji játra a slezina, nádorové buňky se však mohou šířit do jakéhokoliv orgánu, včetně kostní dřeně.
Doprovázející příznaky MF/SS. Pacienti s MF/SS mohou mít různý stupeň alopecie, od difuzního prořídnutí kštice, přes projevy klinicky nerozlišitelné od alopetia areata, po totální ztrátu vlasů, vyskytující se často v pokročilých stadiích onemocnění. Mezi symptomy, které provází pacienty s MF/SS a významně snižují kvalitu jejich života, patří pruritus. Jeho tíže vzrůstá s rostoucím stadiem onemocnění. Bývá provázen poruchami spánku, úzkostí a depresí. V důsledku intenzivního pruritu a škrábání jsou na kožním povrchu exkoriace, často sekundárně infikované zlatým stafylokokem. Je běžné, že kůže pacientů s MF/SS je tímto mikrobem kolonizována [19] Vzhledem k tomu, že pacienti s MF/SS vykazují poruchu buněčné i humorální imunity, mohou mít těžší průběh virových (např. herpetických) i bakteriálních infekcí [36, 37]. Pokročilá stadia choroby může dále provázet zvýšená tělesná teplota, zimnice, úbytek hmotnosti, narušená termoregulace. Podle studií vycházejících z údajů z onkologických registrů – SEER (Surveillance, Epidemiology, and End Results data by Amber et al., 2016), Finnish Cancer Registry by Väkeväa et al. (2000), Danish Nationwide Population-Based Registries by Lindahl et al. (2014), California Cancer Registry by Ai et al. (2014) je u pacientů s MF/SS prokázán zvýšený výskyt duplicitních tumorů, nejčastěji jiných typů lymfomů [12].
DIAGNOSTIKA
Určení diagnózy a klasifikace CTCL se opírá o kombinaci klinického, histologického, imunohistochemického (imunofenotypizace) a genetického vyšetření, s průkazem klonální přestavby genů pro T buněčný receptor (T-cell receptor – TCR) v lézi nebo periferní krvi (metody Soouthern blot či PCR) [23]. Základem pro potvrzení diagnózy je histologické vyšetření kožní biopsie, kterou je často nutné provádět opakovaně. Vzorek kůže by měl být odebrán z nejvíce infiltrované léze, přínosné je provádět více odběrů z různých míst [26]. Histologický obraz se mění podle stadia a klinické varianty onemocnění. V časném stadiu (stadium skvrn): nález lymfocytů podél dermoepidermální junkce (tzv. lining up), pronikání atypických T lymfocytů do epidermis (tvz. epidermotropismus), kde mohou tvořit shluky lymfocytů (tzv. Pautrierovy mikroabscesy (obr. 8).
Image 8. Pautrierovy mikroabscesy HE 200x 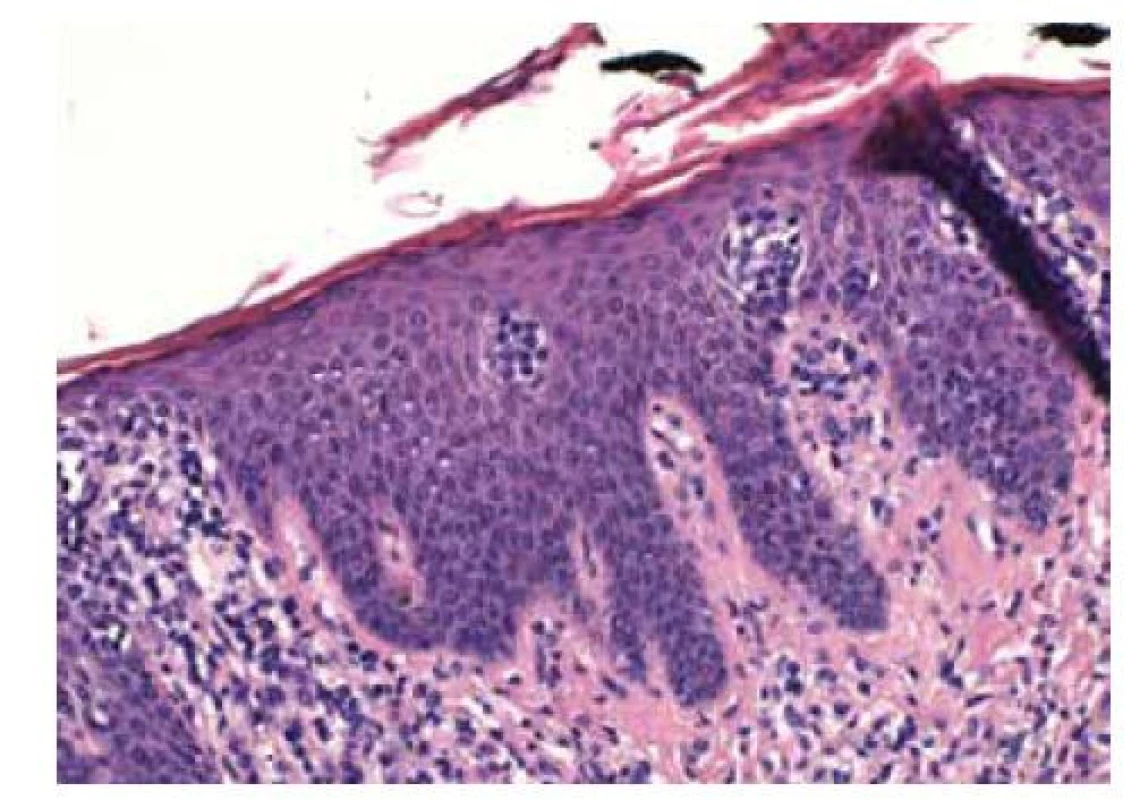
(Foto MUDr. Lukáš Velecký PAÚ FNUSA) Intraepidermální lymfocyty jsou obvykle větší než lymfocyty v dermis a mají cerebriformní jádro. V superficiální dermis je lehká fibróza a zhrubělá kolagenová vlákna, pruhovitý nebo ložiskový lymfoidní infiltrát. Infiltrativní stadium (stadium plaků): denzní pruhovitý lymfoidní infiltrát v superficiální dermis, intraepidermální kolekce lymfocytů (tzv. Pautrierovy mikroabscesy). V tumorózním stadiu je lymfoidní infiltrát denzní, nodulární či difuzní postihující celou dermis, často zasahuje až do subcutis. Epidermotropismus může vymizet. Je možná velkobuněčná transformace (velké buňky jsou minimálně čtyřikrát větší než malý lymfocyt) do high-grade lymfomu, který je spojen s horší prognózou. Histologický obraz SS je v některých případech málo vyjádřený a obtížně interpretovatelný. Často je přítomen psoriaziformní a spongiotický vzhled s variabilně denzním lymfoidním infiltrátem v superficiální dermis. Epidermotropismus je obvykle méně vyjádřen než u MF, Pautrierovy mikroabscesy mohou chybět.
Imunofenotyp neoplastických buněk je nejčastěji CD2+, CD3+, CD4+, CD5+, CD7-, CD8-, vzácně se zjistí CD4-, CD8+. Exprese CD30 je přítomna ve zvýšené míře u pacientů s histologickou transformací velkých buněk. U většiny případů se silným podezřením na MF se najde klonální přestavba genů pro T buněčný receptor (TCR), negativní výsledek však nevylučuje diagnózu lymfomu [13]. Klinické vyšetření pacienta zahrnuje zhodnocení celkového stavu, podrobný popis kožních lézí s určením jejich rozsahu (výpočet procentuálního postižení tělesného povrchu, BSA – Body Surface Area), vyšetření regionálních lymfatických uzlin a palpaci břišních orgánů. Pro přesnější určení kožního postižení a zejména pro hodnocení léčebné odpovědi je vhodná metoda mSWAT (modified Severity Weighted Assessment Tool), která ve výpočtu zohledňuje i tloušťku nádorové infiltrace. mSWAT počítáme jako násobek procentuálního postižení tělesného povrchu a faktoru tloušťky/infiltrace jednotlivých kožních lézí (neinfiltrované makuly = 1, infiltrovaná ložiska = 2, tumory = 4) [23]. V rámci stagingu se ptáme na možnou přítomnost systémových příznaků, B symptomů, které mohou signalizovat mimokožní šíření onemocnění. Patří sem jinak nevysvětlitelný vzestup tělesné teploty nad 38 °C, pokles tělesné hmotnosti o více než 10 % v průběhu 6 měsíců a zvýšené noční pocení. Dále sledujeme subjektivní potíže, z nichž nejčastější je pruritus, objevuje se ale i bolest, nechutenství, únava, ztráta výkonnosti. Laboratorní vyšetření zahrnují krevní obraz s diferenciálním rozpočtem leukocytů, morfologické vyšetření krve, tj. vyšetření „krevního nátěru“ (k detekci atypických lymfocytů, velkých Sézaryho buněk), základní biochemické parametry – jaterní a ledvinné funkce včetně laktátdehydrogenázy (LDH), elektroforetické vyšetření plazmatických bílkovin (ELFO), beta 2-mikroglobulin a vyšetření TCR. Do kompletního laboratorního vyšetření patří průtoková cytometrie (FACS periferní krve) – stanovení povrchových antigenních markerů T lymfocytů a procentuálního zastoupení jednotlivých typů lymfocytů včetně stanovení imunoregulačního indexu (IRI). U pacientů v časném stadiu MF nejsou zobrazovací vyšetření vyžadována. V jednotlivých indikovaných případech v rámci stagingu doplňujeme CT hrudníku, břicha a pánve. U všech ostatních pacientů (s pokročilým stadiem MF a SS) je indikováno celotělové CT vyšetření. Role PET/CT ve stagingu MF/SS není v současné době jednoznačná, doporučuje se provádět u pacientů v pokročilém stadiu MF a SS, zejména při indikaci biopsie, tzv. navigované FDG aviditou biologického materiálu (lymfatická uzlina, kůže, viscerální postižení). Exstirpace či biopsie lymfatických uzlin je indikována u pacientů s lymfatickou uzlinou větší než 1,5 cm v průměru. Vyšetření kostní dřeně (cytomorfologické, imunohistochemické) je doporučováno u MF a SS pouze v případě, že jsou v krevním obraze přítomny jinak nevysvětlitelné změny [1, 11, 15, 16, 28, 29, 39]. Pro stanovení diagnózy SS je nutná kromě klinického obrazu erytrodermie přítomnost jednoho nebo více následujících kritérií: absolutní počet velkých Sézaryho buněk v periferní krvi alespoň 1000/mm3, nález imunofenotypových abnormalit (zvýšení poměru CD4/CD8 více než 10krát a/nebo zvýšení CD4+ T lymfocytů s abnormálním fenotypem CD4+CD7 - nad 40 % nebo CD4+CD26 - nad 30 %, zvýšené relativní či absolutní množství lymfocytů v periferní krvi, přítomnost identického T buněčného klonu v periferní krvi). Nález klonálních T-buněk v periferní krvi je důležité pro odlišení SS od erytrodermické varianty MF a od benigních typů erytrodermií [30]. Zatímco přítomnost velkých Sézaryho buněk v periferní krvi je typická pro SS, malé a střední Sézaryho buňky se mohou v periferní krvi vyskytovat i u benigních dermatóz viz diferenciální diagnóza. Výše uvedená vyšetření se v pravidelných intervalech provádí opakovaně v rámci sledování vývoje onemocnění, odpovědi na léčbu nebo při relapsu či progresi choroby (tab. 2).
Table 2. Specifická stagingová vyšetření u MF/SS 
DIFERENCIÁLNÍ DIAGNÓZA
MF ve stadiu skvrn a plaků je nutné odlišit od chronicky probíhajících dermatitid (atopický ekzém, alergická kontaktní dermatitida, seborhoická dermatitida, psoriáza), od povrchových mykotických infekcí, lékových exantémů, pityriasis rosea Gibert, roseola syphilitica, maloložiskové parapsoriázy (případy velkoložiskové parapsoriázy jsou spíše považovány za možný předstupeň primárního kožního lymfomu, musí být důsledně sledovány, neboť u více než 1/3 nemocných dochází k progresi do mycosis fungoides), PLEVA, fotodermatóz (např. aktinický retikuloid), pityriasis rubra pilaris, erythema annulare, erythema multiforme, lichen planus, lichenoidní dermatózy. Tumorózní stadia MF je nutné odlišit od jiných typů PCL než MF, tj. zejména primárních B buněčných kožních lymfomů, karcinomů kůže, pseudolymfomů, kožních typů sarkoidózy, hlubokých mykotických infekcí, atypických mykobakteriálních infekcí, leishmaniázy. Diferenciální diagnóza SS zahrnuje těžké polékové reakce, erytrodermickou formu mycosis fungoides, kožní choroby provázené erytrodermií, jako je psoriáza, atopická dermatitida, pityriasis rubra pilaris, seborhoická dermatitida [2, 13]. Nález malých a středních Sézaryho buněk v periferní krvi je typický pro benigní dermatózy typu – kontaktní dermatitida, atopická dermatitida, erytrodermická forma psoriázy, aktinický retikuloid, pseudolymfomatózní poléková reakce. Tento typ buněk se může nacházet i v krvi zdravých starých lidí.
STAGING A PROGNÓZA
Stanovení klinického stadia onemocnění spolu se zhodnocením prognostických faktorů je nezbytné k vytvoření adekvátního léčebného plánu. Pro MF/SS je v současnosti platný stážovací TNMB systém ISCL/ EORTC (International Society for Cutaneous Lymphoma, Cutaneous Task Force of European Organization for Research and Treatment of Cancer), který umožňuje celkové zhodnocení postižení, tj. kožní změny (T), postižení lymfatických uzlin (N), diseminaci do vnitřních orgánů (M) a přítomnost nádorových buněk v periferní krvi (B) (tab. 3, 4) [23, 24, 41]. Stážovací systém rozděluje MF/SS do devíti stadií s prognostickou váhou. Stadia IA–IIA jsou označovaná jako časná stadia. Ty tvoří téměř 70 % všech MF, mají indolentní průběh. Pacienti s MF ve stadiu skvrn a plaků (T1) mají prognózu shodnou s věkem odpovídající populaci. Téměř 25 % pacientů s časným stadiem MF progreduje do pokročilého stadia – IIB–IVB, která mají obecně agresivní průběh s mediánem přežití mezi 1 rokem až 5 lety od stanovení diagnózy. Medián přežití u SS se pohybuje podle prognostických faktorů od 1,5 do 4 let, pětileté přežití 18 % (tab. 5) [23, 24, 29, 40].
Table 3. TNMB klasifikace ISCL/EORTC (2007) pro MF/SS [22] ![TNMB klasifikace ISCL/EORTC (2007) pro MF/SS [22]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b3f4d4b37c47f4e0b7ebf4f1ec42c1d2.jpg)
Table 4. Definice postižení u MF/SS v TNMB klasifikaci ISL/EORTC (2007) pro MF/SS [22] ![Definice postižení u MF/SS v TNMB klasifikaci ISL/EORTC (2007) pro MF/SS [22]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/29245326ec69d146ac4cc3d97e5782ea.jpg)
Table 5. Stážovací systém ISL/EORTC (2007) pro MF/SS 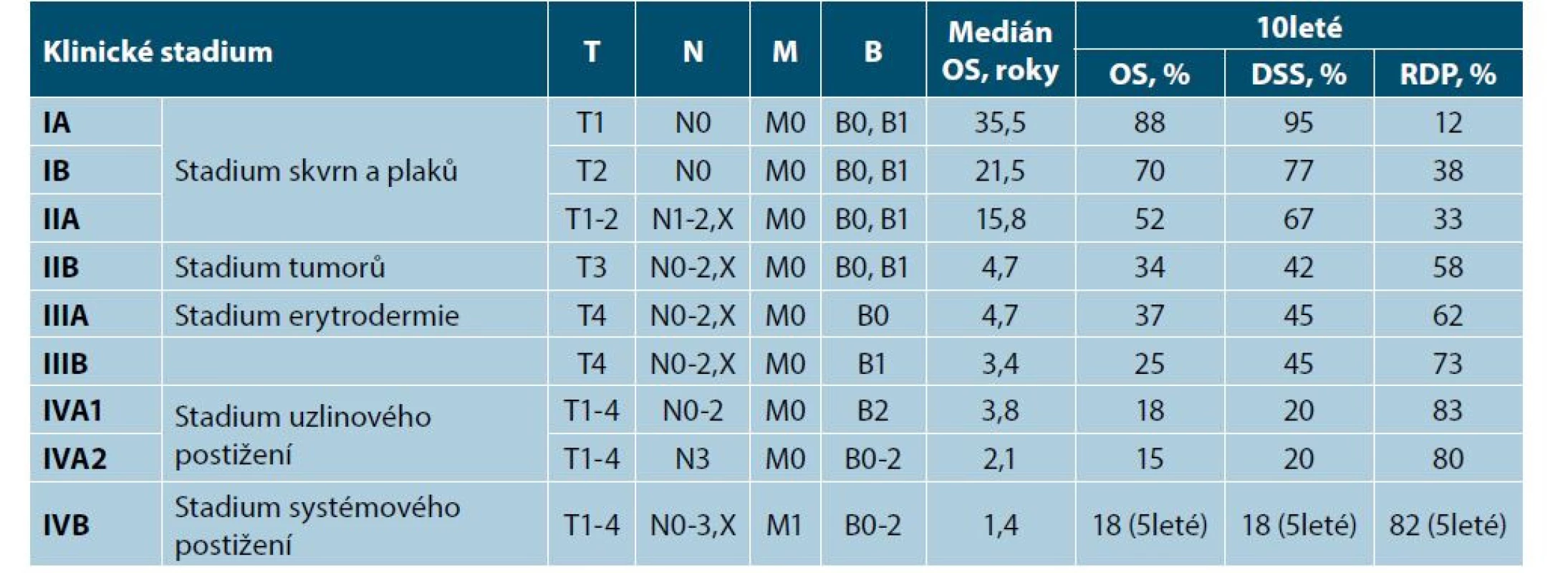
(Medián celkového přežití, 10leté přežití, 10leté přežití specifické k nemoci a 10leté riziko progrese onemocnění (OS – celkové přežití; DSS – přežití specifické k nemoci; RDP – riziko progrese onemocnění)
[upraveno dle 14,22,23]TERAPIE
V současné době jsou kožní T lymfomy nevyléčitelné. Strategie léčby vychází z přesně stanovené diagnózy podtypu CTCL a řídí se zejména stadiem onemocnění. V terapii CTCL se zaměřujeme na úlevu od příznaků, na zlepšení kvality života, na dosažení a udržení remise, na zmenšení nádorového objemu, oddálení progrese onemocnění a tím prodloužení délky života [28, 29]. Péče o pacienty s primárními kožními lymfomy vyžaduje multidisciplinární přístup a spolupráci mezi dermatology, patology, radioonkology a hematoonkology. Role zúčastněných specialistů se doplňuje a často i překrývá. Dermatolog se podílí zejména na primární diagnostice, určuje léčbu cílenou na kůži, indikuje a podává systémovou léčbu první volby. Vzhledem k vzácnosti výskytu a nutnosti specifického terapeuticko-diagnostického přístupu by měla být péče o pacienty s kožními lymfomy centralizovaná [2, 8]. Léčba kožních T lymfomů se řídí několika principy. Nejlepší výsledky jsou dosaženy při léčbě lokalizovaných ložisek, kdy lze využít cílenou terapii. Při rozsáhlejším kožním i mimokožním postižení musíme přistoupit k možnostem plošného ošetření kůže či k systémové léčbě. Po dosažení remise onemocnění musíme pokračovat v udržovací terapii, abychom zabránili relapsu. Vzhledem k tomu, že většina pacientů s CTCL podstupuje léčbu dlouhodobě, trvající i několik desetiletí, je důležité brát zřetel na nežádoucí účinky různých léčebných metod a snažit se je minimalizovat. Průběh terapie lze rozdělit na fázi indukční (intenzivní, k dosažení remise) a fázi udržovací (k oddálení relapsu onemocnění). Léčebné modality, které se využívají u pacientů s CTCL lze rozdělit na: léčbu cílenou na kůži (SDT – Skin Directed Therapy), systémovou léčbu (BRMs – Biologic Response Modifiers), cytotoxickou terapii a kombinované léčebné postupy [13].
V časných stadiích CTCL (jednoložiskové/lokalizované postižení) je metodou volby léčba cílená na kůži (SDT). Zahrnuje především místně aplikované silné až velmi silné kortikosteroidy, karmustin (BCNU), lokální mechlorethamin (HN2), lokální bexaroten, fototerapii UVB a fotochemoterapii PUVA, celotělové ozáření elektronovým svazkem (TSEI – Total Skin Electron beam Irradiation) a cílenou radioterapii. Místně aplikované kortikoidy typu silných až velmi silných jsou v klinické praxi nejčastějším lékem první volby u postižení menších ploch. V rámci předcházení nežádoucím účinkům kortikoidů místním i systémovým je vhodná intermitentní aplikace. Léčebná odpověď ve stadiu skvrn je u 90 % pacientů [44]. Karmustin (bis-chlorethylnitrosourea – BCNU, BiCNU) je alkylující cytostatikum dostupné v ČR jako magistraliter, používané v místní terapii ve formě 0,2% roztoku nebo 0,01% masti. Je možné ho použít k léčbě nerozsáhlých ložisek při důsledném poučení pacienta o léčebném režimu. Aplikuje se jedenkrát denně večer, ráno se očistí. Mezi nežádoucí účinky patří systémová toxicita (útlum krvetvorby) po absorpci při ošetřování větších ploch a lokální iritace ve formě ztenčení kůže, teleangiektazie, hyperpigmentace. Délka aplikace BCNU je 8–20 týdnů. Během léčby jsou nutné pravidelné kontroly krevního obrazu každé dva týdny k vyloučení útlumu krvetvorby. Léčebná odpověď je 84–98% [43]. Lokální mechlorethamin (HN2, dusíkatý yperit) je v ČR registrován k léčbě časných stadií MF (IA a IIA), dostupný je ve formě 0,02% gelu. Je hrazen z prostředků veřejného zdravotního pojištění po schválení revizním lékařem podle paragrafu 16 zákona č. 48/1997 Sb. Z důvodu nežádoucích účinků ve formě iritace kůže se aplikace zahajuje v režimu jedenkrát denně třikrát týdně s postupným zkracováním intervalu až na jedenkrát denně každý den. Délka léčby je možná až po dobu 1 roku. Kompletní léčebná odpověď je mezi 30–60 %. Mechlorethamin je karcinogen, proto jsou po ukončení léčby nutné pravidelné kontroly kožního povrchu k vyloučení tvorby kožních karcinomů [38]. Lokální bexaroten je rexinoid, který se selektivně váže a aktivuje retinoidové X-receptory. K lokální aplikaci se používá ve formě 1% gelu (není v ČR registrován). Je určen k léčbě kožních lézí u pacientů ve stadiu IA až IIA, kteří mají refrakterní nebo na předchozí léčbu nereagující onemocnění nebo netolerují jiné léčebné možnosti. Aplikován by měl být na méně než 15 % tělesného povrchu. Kompletní léčebná odpověď je udávána v intervalu 44–63 %. Mezi nežádoucí účinky patří lokální iritace a teratogenita [37]. Cílená radioterapie je nejspolehlivější a nejrychlejší metoda navození remise u solitárních a lokalizovaných ložisek. Tato léčebná metoda je široce využívaná bez ohledu na lokalizaci lézí a lze s ní při minimálních vedlejších účincích dosáhnout dlouhodobé remise. Lze využít k léčbě samostatně nebo v kombinaci se systémovou či jinou na kůži cílenou terapií. Standardním režimem u časných stadií je aplikace 8–12 Gy v 1 až 6 frakcích [5, 38]. V léčbě solitárních či vícečetných lokalizovaných projevů I. až III. stadia je možné v off-label režimu použít i fotodynamickou terapii s methylaminolevulovou kyselinou (PDT, photodynamic therapy) nebo imiquimod [38].
U diseminovaného kožního postižení jsou úspěšnější na kůži cílené léčebné metody, které postihují celý kožní povrch – fototerapie a celotělové ozáření elektronovým svazkem (TSEI). Fototerapie je účinnou metodou léčby, přičemž současným trendem je preference NB-UBV 311 nm (úzkospektré ultrafialové záření B) před PUVA fotochemoterapií (psoralen a ultrafialové záření A). Důvodem je zejména vyšší dlouhodobé riziko kancerogeneze, kožní a okulární fotosenzitivita (vznik katarakty) a nesnášenlivost oxsoralenu u PUVA terapie při srovnatelném účinku s UVB na neinfiltrované projevy. PUVA fotochemoterapie by měla být rezervována k léčbě plaků, kde lze díky hlubšímu průniku UVA do kůže očekávat lepší efekt ve srovnání s UVB. PUVA umožňuje navodit kompletní klinickou odpověď a dlouhotrvající remisi u pacientů s CTCL ve stadiu IA-IIA. PUVA vyžaduje pravidelný léčebný režim. Záření probíhá zpočátku 4krát týdně, intervaly se postupně prodlužují za zvyšování dávky. Po dosažení remise se pokračuje v udržovací terapii v intervalu jedenkrát týdně každé 2–4 týdny. Ke snížení celkové dávky záření a prodloužení remise lze využít kombinace PUVA s retinoidy nebo interferonem alfa. NB-UVB 311nm se zahajuje v režimu 3–5 záření týdně v délce trvání 2–3 měsíce. Po dosažení remise pokračujeme v udržovací terapii jedenkrát týdně. Dosažení kompletní remise po fototerapii (UVB a PUVA) se pohybuje v rozmezí 54–91 % [22, 25]. Celotělové ozáření elektronovým svazkem (TSEI) je k léčbě MF často využíváno, protože MF je silně radiosenzitivní. Elektrony penetrují pouze do horních vrstev dermis, nedochází tedy k nežádoucímu postižení sliznic, kostní dřeně, gastrointestinálního traktu ani jiných vnitřních orgánů. TSEI působí pouze na místa, kam dopadají elektrony, proto dlaně, plosky, kštice, podpaží a perineum musí být dozářeny zvlášť tak, aby byla zajištěna celotělová léčba. TSEI v dávce 30–36 Gy za 8–10 týdnů je efektivní léčba u refrakterní nebo relabující MF (plaky nebo tumory), ale je spojena s kožní toxicitou ve formě akutní radiační dermatitidy – alopecie, anhidróza, erytém, puchýře až ulcerace, xeróza kůže s deskvamací. Srovnatelné léčebné výsledky s minimálními vedlejšími účinky má nízkodávková TSEI v režimu 10–12 Gy. Účinnost léčby je vyšší při zahájení terapie v nižším stadiu postižení. Pacienti s limitovaným postižením ve stadiu plaků dosahují průměrnou dobu remise delší než 3 roky, zatímco pacienti v tumorózním stadiu mají interval do relapsu kratší než 6 měsíců. TSEI lze využít i k paliativní terapii (např. léčba maligních kožních ulcerací, bolestivých lézí, snížení intenzity pruritu), jednorázově nebo ve dvou frakcích lze podat 7–8 Gy. TSEI může probíhat samostatně, ale častěji je kombinována s adjuvantní lokální či systémovou léčbou [5, 20, 21].
U pacientů v počátečních stadiích MF se symptomatickými refrakterními ložisky, které nereagují na výše uvedené metody zevní léčby, a u pacientů s pokročilými stadii MF a SS je indikovaná systémová léčba. Léky první volby jsou protinádorové léky s imunomodulačním efektem – BRMs (interferon alfa, retinoidy, extrakorporální fotoferéza, nízkodávkovaný metotrexát), a to buď samostatně, nebo v kombinaci s SDT (fototerapie, lokální kortikosteroidy či radioterapie), nebo jako kombinovaná systémová léčba. U velmi pokročilých a agresivně progredujících lymfomů jsou indikovány i léky cytotoxické (chemoterapie). Retinoidy jsou deriváty vitaminu A, které modifikují proliferaci a diferenciaci buněk, navozují apoptózu a fragmentaci DNA. U MF/SS se užívá v off-label podání acitretin (agonista receptoru pro kyselinu retinovou – RAR), úvodní dávka se pohybuje mezi 25–50 mg/den (0,5–1 mg/kg/den). Retinoidy jsou vysoce teratogenní. Mezi další vedlejší účinky patří suchost kůže a sliznic, elevace hladiny triglyceridů. Retinoidy vedou k léčebné odpovědi u přibližně 50 % pacientů v časných fázích onemocnění a u 20 % navozují plnou remisi. Léčebná odpověď po vysazení netrvá déle než 1 rok [38]. Rexinoid (retinoid 3. generace) – bexaroten je syntetický specifický retinoid s vysokou afinitou k jadernému receptoru typu X a velmi nízké afinitě k receptorům typu RAR (jako předcházející retinoidy). Byl speciálně vyvinut pro léčbu CTCL, proto je jeho užití v ČR schváleno pouze pro léčbu CTCL a je podle SPC indikován jako systémová léčba 2. volby u pokročilých stadií CTCL u pacientů, u nichž selhala alespoň jedna předchozí systémová terapie. Podává se perorálně formou tablet, optimální dávka u CTCL je 300 mg/m2/den s možnou úpravou podle tolerance. K léčebné odpovědi vede u všech stadií kožních T lymfomů včetně SS. Léčebné odpovědi je dosaženo přibližně u poloviny pacientů. Mezi vedlejší účinky kromě teratogenity patří neutropenie, hypertriglyceridemie/ hypercholesterolemie, centrální hypothyreóza, které u většiny pacientů vyžadují konkomitatní suplementaci hormony štítné žlázy a podávání hypolipidemik. Lze jej kombinovat kromě místní léčby i s PUVA terapií, interferonem alfa [10, 31]. Interferon alfa (IFN α) má protivirové, prozánětlivé a antitumorózní účinky. Při léčbě CTCL se zahajuje dávkou 3 miliony jednotek (MU) třikrát týdně ve formě subkutánně aplikovaných injekcí a navyšuje se do maximální tolerované dávky (což může být až 9 milionů jednotek/den). Nejvyšší léčebná odpověď je patrna za 3–6 měsíců. Po jejím dosažení je možno dávku snižovat na udržovací množství, odpovídající 1 MU denně. Kompletní léčebná odpověď je patrna asi u 20 % pacientů. Nežádoucí účinky léčby jsou závislé na dávce a patří mezi ně zejména chřipkové příznaky (teplota, bolest hlavy, svalů, únava), zvýšení jaterních transamináz, leukopenie, trombocytopenie, deprese, neuropatie, demence, thyroidální dysfunkce. Léčbu INF α lze kombinovat s podáváním retinoidů, PUVA terapií, s nízkodávkovaným metotrexátem [11, 38]. V současné době není interferon alfa dostupný z důvodu ukončení výroby. Extrakorporální fotochemoterapie (ECP, fotoferéza) je léčebná metoda, která byla vyvinuta k léčbě onemocnění, na jejichž patogenezi se podílejí T lymfocyty, tedy zejména k léčbě pacientů s CTCL. Je to jediná (kromě alogenní transplantace kostní dřeně) léčebná metoda, která specificky aktivuje imunitní reakci namířenou proti maligním T lymfocytům. Indikována je zejména v terapii erytrodermické formy MF a Sézaryho syndromu. Cílem ECP je snížení počtu atypických (maligních) lymfocytů. Kromě přímého cytotoxického účinku metody se předpokládá indukovaný mechanismus imunizace in vivo s mobilizací cytotoxických CD8+ lymfocytů zajišťujících další protinádorový efekt. ECP se prakticky provádí na separátoru krevních buněk, kde se pacientovi z periferní krve odeberou leukocyty (lymfocyty a monocyty). K leukocytům se přidá fotosenzibilující látka 8-metoxypsoralen (8-MOP) ve formě roztoku a následně se buňky ozáří ultrafialovým zářením – UVA (2 J/cm2). Upravené buňky se vracejí jako autotransfuze zpět do krevního oběhu nemocného. Celá ECP, zahrnující separaci mononukleárních buněk, ozáření a zpětnou transfuzi koncentrátu, trvá přibližně 4–5 hodin. Výkon se opakuje po dva následující dny jedenkrát měsíčně. Léčebná odpověď u pacientů s erytrodermickou MF a SS je uváděna asi 60%. ECP lze kombinovat s INF alfa, bexarotenem nebo TSEI [17]. Metotrexát (antimetabolit kyseliny listové) je cytostatikum, které může indikovat a podávat i dermatolog. Lze ho podávat jak v monoterapii, tak v kombinaci s interferonem alfa nebo bexarotenem v dávce 5–25 mg jednou týdně. V monoterapii vykazuje efekt u 33–58 % pacientů. Mezi nejčastější nežádoucí účinky patří útlum krvetvorby, dyspepsie, hepatotoxicita, intersticiální pneumonitida [38].
Další léčebné látky spadají do skupiny cílené imunoterapie (mogamulizumab, alemtuzumab, brentuximab vedotin). Mogamulizumab je humanizovaná defucosylovaná monoklonální protilátka IgG1 kappa, která je namířena proti C-C chemokinovému receptoru typu 4 (CCR4). CCR4 je receptor spřažený s G proteinem pro C-C chemokiny, který je důležitý pro migraci T lymfocytů do kůže a míst kožního zánětu. CCR4 je nadměrně exprimován na maligních T buňkách u většiny CTCL včetně mycosis fungoides a Sézaryho syndromu. Selektivní vazba mogamulizumabu na buňky exprimující CCR4 indukuje buněčnou cytotoxicitu závislou na protilátkách a vede k depleci cílových buněk. Mogamulizumab byl Evropskou agenturou pro léčivé přípravky (EMA) schválen v roce 2018 pro léčbu pacientů s relapsem nebo refrekterní MF a SS, kteří byli dříve léčeni alespoň jednou systémovou léčbou. Podkladem pro toto schválení byly výsledky klinické studie MAVORIC (mezinárodní multicentrická otevřená randomizovaná klinická studie fáze III s aktivní kontrolou, do které byly zařazeni dospělí s relabující nebo refrakterní MF nebo SS ve stadiu IB–IVB po alespoň jedné předchozí systémové léčbě). Podává se jako nitrožilní infuzní roztok v dávce 1,0 mg/kg týdně po dobu 4 týdnů, následně každé 2 týdny až do progrese. Nejčastější nežádoucí účinky jsou reakce na infuzi, kožní erupce, průjem, únava, muskuloskeletální bolesti a infekce horních cest dýchacích. V ČR prozatím nemá tento preparát schválenou úhradu z prostředků zdravotního pojištění [27]. Brentuximab vedotin (BV) je konjugát monoklonální protilátky anti CD 30 a neurotoxinu – monomethylauristatinu E. Po vazbě na CD30+ lymfocyty se neurotoxin dostává do buněk a zastavuje jejich buněčný cyklus. Nejčastějším nežádoucím účinkem je periferní neuropatie, která je reverzibilní. Brentuximab vedotin je v ČR schválen k léčbě nemocných s relabujícími CD30+ kožními lymfomy po minimálně jedné předchozí systémové léčbě. Podkladem ke schválení BV k léčbě těchto lymfomů byla data, která vzešla ze studie ALCANZA (multicentrická, randomizovaná, otevřená klinická studie fáze III, která sledovala účinnost BV oproti volbě lékaře, což byly metotrexát nebo bexaroten). Ve studii bylo dosaženo objektivní léčebné odpovědi trvající alespoň 4 měsíce u 60 % pacientů. Pro úhradu BV hrazenou z prostředků zdravotního pojištění je nutné schválení revizním lékařem podle paragrafu 16 zákona č. 48/1997 Sb. [27, 34]. Alemtuzumab je humanizovaná anti-CD 52 monoklonální protilátka s dobrou účinností u MF i SS s celkovou četností odpovědí 51–85 %. Při obvyklém dávkovacím schématu je však zatížen nepřijatelnou vysokou toxicitou v důsledku deplece T a B buněk. Alemtuzumab je pro vybrané pacienty s MF a SS, s především krevním postižením, podávaný v nízkém dávkování v zajištění specifickou podpůrnou péčí. V současné době je v České republice dostupný v „named patient program“ [27, 33]. Pro úplnost u pacientů v pokročilých stadiích MF/SS je indikován, ale v Evropě dosud neregistrován, přípravek vorinostat. Vorinostat je inhibitor histondeacetylázy, který způsobuje zvýšení acytylace histonů, což vede ke zvýšené transkripci genů, které příznivě ovlivňují diferenciaci buněk, buněčný cyklus a navození apoptózy. Podáván je v kapslích, jedenkrát denně [13].
Cytotoxická chemoterapie je indikovaná v pokročilých stadiích CTCL a je podávána hematoonkology. Výhodou chemoterapie je rychlá remise onemocnění, která má ale krátké trvání. Chemoterapie má řadu vedlejších účinků. Měla by zůstat vyhrazena jako paliativní léčba u pokročilých stadií onemocnění. Je podávána obvykle v monoterapii (např. chlorambucil, gemcitabin, etoposid) nebo v polychemoterapii (např. ICE – ifosfamid, karboplatina, etoposid, CMED – cyklofosfamid, metotrexát, etoposid, dexametazon) [1, 27, 29]. U mladších nemocných s pokročilým stadiem MF a SS je nutné uvažovat v individuálním léčebném schématu o alogenní transplantaci kostní dřeně, která může u vybraných nemocných vést k navození kompletní remise a prodloužení života. Tabulky 5 a 6 shrnují léčebná doporučení pro mycosis fungoides časných a pokročilých stadií a pro Sézaryho syndrom [1].
Table 6. Léčebná doporučení pro mycosis fungoides 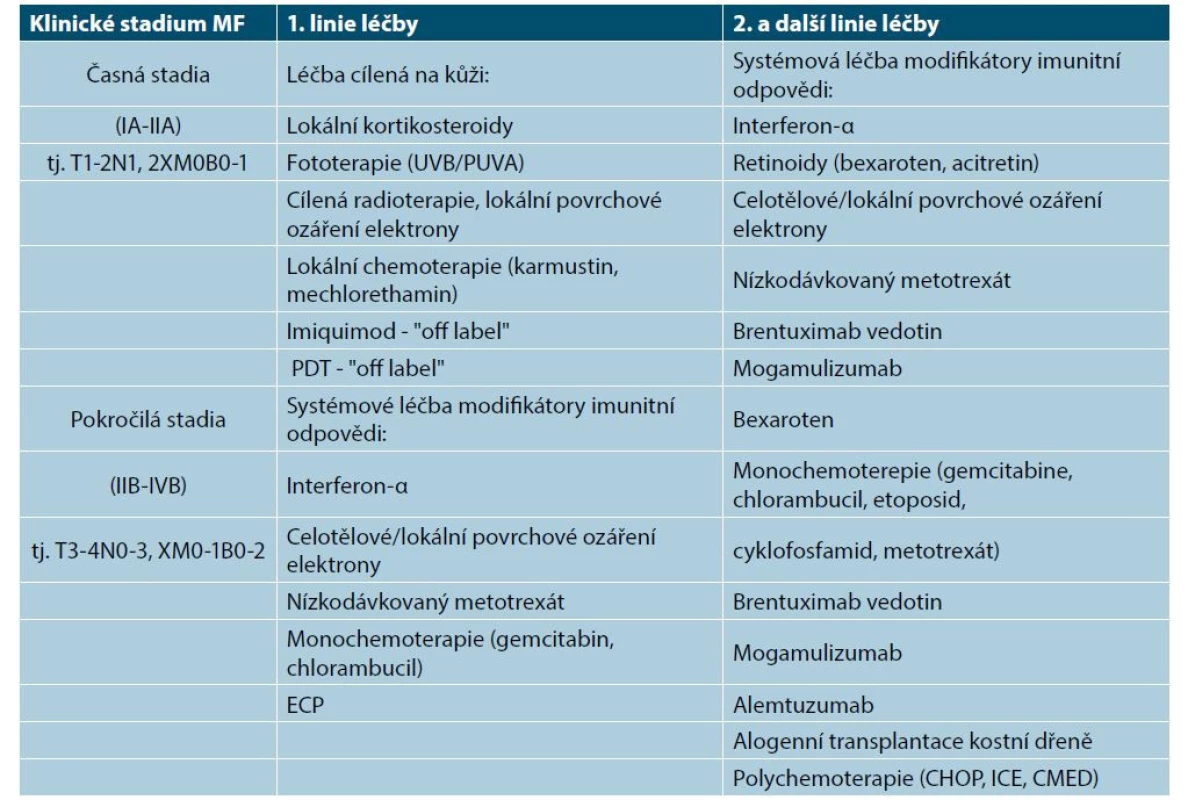
UVB – fototerapie UVB o vlnové délce 311 nm; PUVA – fototerapie UVA s psoralenem; ECP – extrakorporální fotoferéza; CHOP – cyklofosfamid, vinkristin, doxorubicin, prednison; ICE - ifosfamid – karboplatina, etoposid; CMED – cyklofosfamid, methotrexát, etoposid, dexametazon)
[upraveno dle 1]Table 7. Léčebná doporučení pro Sézaryho syndrom 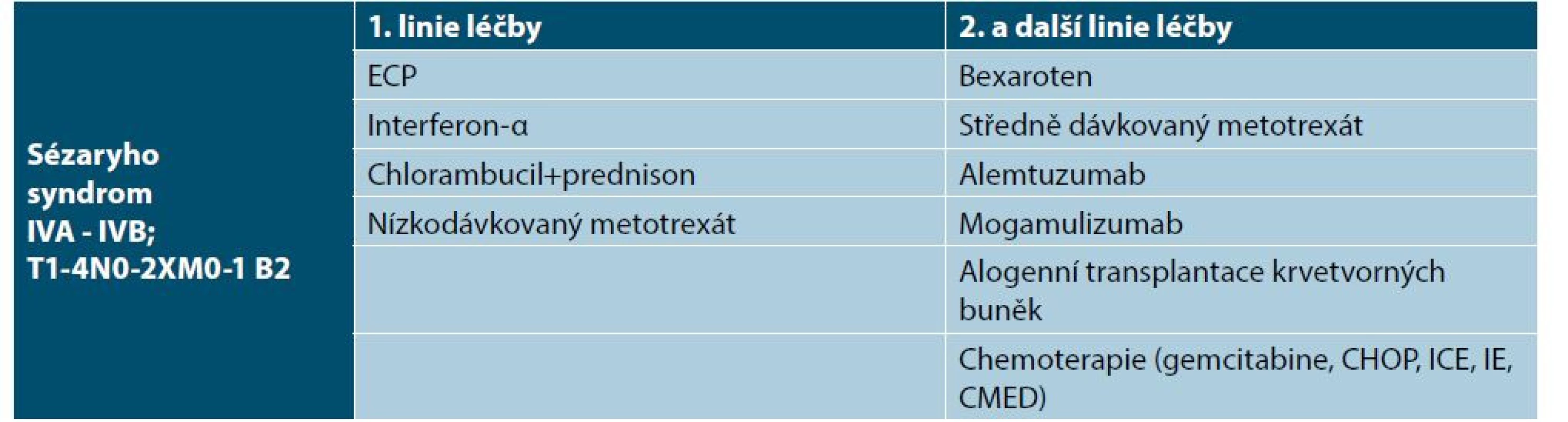
(ECP – extrakorporální fotoferéza; CHOP – cyklofosfamid, vinkristin, doxorubicin, prednison; ICE – ifosfamid, karboplatina, etoposid; IE – ifosfamid, etoposid; CMED – cyklofosfamid, metotrexát, etoposid, dexametazon)
[upraveno dle 1]V celém průběhu MF od časných do pokročilých stadií a zejména u erytrodermických forem MF a SS je onemocnění provázeno výraznou symptomatologií zejména svěděním, suchostí kůže s deskvamací, vznikají eroze a ragády s rizikem infekce. Podpůrná léčba spočívá v důsledné aplikaci emoliencií ideálně s antiseptiky (chlorhexidin, hexamidin) či zevními antibiotiky (kyselina fucidová, mupirocin, klindamycin) [6]. V případě záchytu kolonizace kůže zlatým stafylokokem se doporučuje celkově nasadit antibiotika podle citlivosti. Eradikace stafylokoka má příznivý efekt i na hojení kožních projevů MF [36]. Pruritus můžeme tlumit celkově podávanými H1-antihistaminiky. Při refrakterním intenzivním pruritu může mít efekt gabapentin, některá antidepresiva, případně na přechodnou dobu i prednison. U výrazně imunokompromitovaných pacientů s vysokým rizikem infekčních komplikací je vhodné indikovat antimikrobiální profylaxi antistafylokokovými antibiotiky, případně antivirotiky a antimykotiky [38, 39]. Pacientům by měla být během života s chronickým onemocněním dostupná také psychologická podpora či intervence.
ZÁVĚR
Primární kožní T buněčné lymfomy jsou vzácná onemocnění, ale i přesto na ně nesmí dermatolog ve své praxi zapomínat. Zejména v případě recidivujících ekzémových změn u starších pacientů. Nesmí být opomenuty ani v rámci diferenciální diagnostiky erytrodermií. Vzhledem k tomu, že se typický, a to jak klinický, tak histologický obraz CTCL, může vyvíjet několik let až desetiletí, je nutné takové pacienty pravidelně sledovat a provádět opakovaně probatorní kožní excize. Léčba pacientů s CTCL vyžaduje multidisciplinární přístup a měla by probíhat v centrech pro léčbu kožních lymfomů. Zde je pacientům poskytnuta komplexní péče, založená na spolupráci mezi dermatology, patology, hematoonkology a radioonkology. U pacientů s pokročilým onemocněním nesmíme podcenit podpůrnou terapii včetně odborné psychologické podpory.
Poděkování
Děkuji za odborné vedení a předávání zkušeností s péčí o pacienty s kožními lymfomy panu profesorovi MUDr. Vladimírovi Vašků, CSc., který na I. dermatovenerologické klinice FN u sv. Anny v Brně a LF MU založil Centrum pro léčbu kožních lymfomů a i nadále se podílí na jeho činnosti.
Prohlášení o střetu zájmů
Autor v souvislosti s tématem práce v posledních 12 měsících nespolupracoval s žádnou farmaceutickou firmou.
Do redakce došlo dne 7. 3. 2022.
Adresa pro korespondenci:
MUDr. Petra Fialová
I. dermatovenerologická klinika
FN u sv. Anny v Brně a LF MU
Pekařská 664/53
656 91 Brno
e-mail: petra.fialova@fnusa.cz
Sources
1. BELADA, D., TRNĚNÝ, M. et al. Diagnostické a léčebné postupy u nemocných s maligními lymfomy – XI.vydání, KAP CZ, s.r.o., září 2020. 131 s. ISBN 978 - 80-86780-61-0.
2. BEYER, M., STERRY, W. Cutaneous Lymphoma. In Goldsmith, L. A., Katz, S. I., Gilchrest, B. A., et al. (Eds.) Fitzpatrick‘s Dermatology in General Medicine, 8th Ed., New York: McGraw-Hill Companies Inc., 2012, p. 1745–1766, ISBN: 978-0-07-171755-7.
3. CAMBELL, J. J., CLARK, R. A., WATANABE, R., KUPPER, T. S. Sézary syndrome and mycosis fungoides arise from distinct T-cell subsets: a biologic rationale for their distinct clinical behaviours. Blood, 2010, 116(5), p. 767–771.
4. CETKOVSKÁ, P. Nová WHO-EORTC klasifikace kožních lymfomů. Čes-slov Derm., 2006, 81(2), s. 69–76.
5. DOLEČKOVÁ, M., CHOUROVÁ, A., KRÁLOVÁ, D., BERKOVSKÝ, P. TSEI u pacientů s mycosis fungoides – klinické výsledky. Klin Onkol., 2020, 33(Suppl 1), s. S65–S79.
6. ETTLER, J., ARENBERGER, P., POLÍVKA, J. Aktuální trendy v léčbě primárních kožních T-buněčných lymfomů. Dermatol. praxi, 2018, 12(1), s. 31–35.
7. ETTLER, J., MUŽÍK, J., POLÍVKA, J. Epidemiologie primárních kožních lymfomů v České republice podle dat Národního onkologického registru z let 2005–2015. Onkologie, 2018, 12(3), p. 100 – 104.
8. ETTLER, J., POLÍVKA, J., ARENBERGER, P. Primární kožní lymfomy v dermatologické praxi. Dermatol. praxi, 2018, 12(3), s. 128–132.
9. FEIT, J., JEDLIČKOVÁ, H., BURG, G. et al. Atlas dermatopatologie. Dostupné na www: https://atlases. muni.cz/.
10. FIALOVÁ, P., VAŠKU, V., ADAM, Z. Naše zkušenosti s léčbou bexarotenem u kožním T-lymfomů. Dermatol praxi, 2011, 5(4), s. 187–191.
11. GILSON, D., WHITTAKER, S. J., CHILD F. J. et al. British Association of Dermatologists and U.K. Cutaneous Lymphoma Group guidelines for the management of primary cutaneous lymphomas 2018. Br J Dermatol., 2019, 180(3), p. 496–526.
12. GOYAL, A., O’LEARY, D., GOYAL, K. et al. Screening for second malignancies in mycosis fungoides: non-Hodgkin lymphoma, Hodgkin lymphoma, lung cancer, bladder cancer and melanoma. J Eur Acad Dermatol Venereol., 2021, 35(9), p. 1821–1829.
13. HERCOGOVÁ, J. a kol. Klinická Dermatovenerologie 2. díl, Praha: Mladá fronta a.s., 2019, 857 s. ISBN 978 - 80-204-5549-9.
14. HODAK, E., KLEIN, T., GABAY, B. et al. Familial mycosis fungoides: report of 6 kindreds and a study of the HLA system. J Am Acad Dermatol., 2005, 52(3 Pt 1), p. 393 – 402.
15. HRISTOV, A. C., TEJASVI, T., WILCOX, R. A. Mycosis Fungoides and Sézary syndrome: 2019 update on diagnosis, risk-stratification, and management. Am. J Hematol, 2019, 94(9), p. 1027–1041.
16. KEMPF, W., ZIMMERMANN, A. K., MITTELDORF, CH. Cutaneous lymphomas – An update 2019. Hematological Oncology, 2019, 37(S1), p. 43–47.
17. KNOBLER, R., BERLIN, G., CALZAVARA-PINTON, P. et al. Guidelines on the use of extracorporeal photopheresis. J Eur Acad Dermatol Venereol., 2014, 28(Suppl 1), p. 1–37.
18. LAROCCA, C., KUPPER, T. Mycosis Fungoides and Sézary syndrome: An Update. Hematol Oncol Clin North Am., 2019, 33(1), p. 103–120.
19. MIRVISH, E. D., POMERANTZ, R. G., GESKIN, L. J. Infectious agents in cutaneous T-cell lymphoma. J Am Acad Dermatol., 2011, 64(2), p. 423–431.
20. MORRIS, S., SCARISBRICK, J. J., FREW, J. et al. The results of low-dose total skin electron beam radiation therapy (TSEB) in patients with mycosis fungoides from the UK cutaneous lymphoma group. Int J Radiat Oncol Biol Phys., 2017, 99(3), p. 627–633.
21. NAVI, D., RIAZ, N., LEVIN, Y. S. et al. The Stanford University experience with conventional-dose, total skin electron-beam therapy in treatment of generalized patch or plaque (T2) and tumor (T3) mycosis fungoides. Arch Dermatol, 2011, 147(5), p. 561–567. doi: 10.1001/archdermatol.2011.98.
22. OLSEN, E. A., HODAK, E., ANDERSON, T. et al. Guidelines for phototherapy of mycosis Fungoides and Sézary syndrome: A consensus statement of the United States Cutaneous Lymphoma Consortium. J Am Acad Dermatol., 2016, 74(1), p. 27–58.
23. OLSEN, E. A., VONDERHEID, E., PIMPINELLI, N. et al. Revisions of the staging and classification of mycosis Fungoides and Sézary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous Lymphoma Task Force of the European Organisation of Research and Treatment of Cancer (EORTC). Blood, 2007, 110(6), p. 1713–1722.
24. OLSEN, E. A., WHITTAKER, S. J., KIM, Y. H. et al. Clinical endpoints and response criteria in mycosis fungoides and Sézary syndrome: a consensus statement of the International Society for Cutaneous Lymphomas (ISCL), the United States Cutaneous Lymphoma Consortium (USCLC), and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). J Clin Oncol., 2011, 29(18), p. 2598–2607.
25. PHAN, K., RAMACHANDRAN, V., FASSIHI, H., SEBARATNAM, D. F. Comparison of narrowband UV-B with psoralen-UV-A phototherapy for patients with early - stage mycosis fungoides: A systematic review and meta-analysis. JAMA Dermatol., 2019, 155(3), p. 335–341.
26. PIMPINELLI, N., OLSEN, E. A., SANTUCCI, M. et al. Definning early mycosis fungoides. J Am Acad Dermatol., 2005, 53(6), p. 1053–1063.
27. POLÍVKA, J. Mogamulizumab: nová léčba pokročilých stadií kožních T buněčných lymfomů – mycosis fungoides a Sézaryho syndromu. Onkologie, 2021, 15(4), s. 187–193.
28. POLÍVKA, J. Primární kožní lymfomy: současný pohled na vzácná hemato-onkologická onemocnění. Onkologie, 2016, 10(2), s. 66–71.
29. POLÍVKA, J., ETTLER, J. Role hematologa v multidisciplinární péči o nemocné s kožním lymfomem. Onkologie, 2018, 12(3), s. 117–122.
30. SCARISBRICK, J., HODAK, E., BAGOT, M. et al. Blood classification and blood response criteria in mycosis Fungoides and Sézary syndrome using flow cytometry: recommendations from the EORTC cutaneous lymphoma task force. Eur J Cancer, 2018, 93, p. 47–56.
31. SCARISBRICK, J. J., MORRIS, S., AZURDIA, R. et al. U. K. consensus statement on safe clinical prescribing of bexarotene for patients with cutaneous T-cell lymphoma. Br J Dermatol., 2013, 168(1), p. 192–200.
32. SOKOLOVSKA-WOJDYLO, M., WENZEL, J., GAFFAL, E. et al. Circulating clonal CLA (+) and CD4(+) T cells in Sézary syndrome express the skin-homing chemokine receptors CCR4 and CCR10 as well as the lymph node-homing chemokine receptor CCR7. Br J Dermatol., 2005, 152(2), p. 258–264.
33. STEWART, J. R., DESAI, N., RIZVI, S. et al. Alemtuzumab is an effective thirdline treatment versus single-agent gemcitabine or pralatrexate for refraktory Sézary syndrome: a systematic review. Eur J Dermatol, 2018, 28(6), p. 764–774.
34. STRANZENBACH, R., DIPPEL, E., SCHLAAK, M., STADLER, R. Brentuximab vedotin in CD30+ cutaneous lymphoma: how do we treat – how shall we treat? A review of the literature. Br J Dermatol., 2017, 177(6), p. 1503–1509.
35. SWERDLOW, S. H., CAMPO, E., PIRELI, S. A. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood, 2016, 127(20), p. 2375–2390.
36. TALPUR, R., BASSET, R., DUVIC, M. Prevalence nad treatment of Staphylococcus aureus colonization in patients with mycosis Fungoides and Sézary syndrome. Br J Dermatol., 2008, 159(1), p. 105–112.
37. TALPUR, R., SINGH, L., DAULAT, S. et al. Long-term outcomes od 1263 patients with mycosis fungoides and Sézary syndrome from 1982 to 2009. Clin Cancer Res., 2012, 18(18), p. 5051–5060.
38. TRAUTINGER, F., EDER, J., ASSAF, Ch. et al. European Organisation for Research and Treatment of Cancer consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome – Update 2017. Eur J Cancer, 2017, 77, p. 57–74.
39. VANTUCHOVÁ, Y. Kožní lymfomy. In Benáková, N. a kol. Moderní farmakoterapie v dermatologii. Praha: Maxdorf, 2020, s. 441–451.
40. WILCOX, R. A. Cutaneous T-cell lymphoma: 2016 update on diagnosis, risk-stratification, and management. Am J Hematol., 2016, 91(1), p. 151–165.
41. WILLEMZE, R., CERRONI, L., KEMPF, W. et al. The 2018 update of the WHO – EORTC classification for primary cutaneous lymphomas. Blood, 2019,133(16), p. 1703–1714.
42. WU, X. S., LONSDORF, A. S., HWANG, S. T. Cutaneous T-cell lymphoma: roles for chemokines and chemokine receptors. J Invest Dermatol., 2009, 129 (5), p. 1115–1119.
43. ZACKHEIM, H. S. Topical carmustine (BCNU) in the treatment of mycosis fungoides. Dermatol Ther., 2003, 16(4), p. 299–302.
44. ZACKHEIM, H. S. Treatment of patch - stage mycosis fungoides with topical corticosteroids. Dermatol Ther., 2003, 16(4), p. 283–287.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2022 Issue 2-
All articles in this issue
- Dostupnost epikutánních testů: příběh se světlem na konci
- Kožní T buněčné lymfomy: mycosis fungoides a Sézaryho syndrom. Diagnostika a terapie
- KONTROLNÍ TEST
- Využití 3D CT a 3D modelu k rekonstrukci skalpu tkáňovým expandérem
- Žlutavé papuly flekčních palmárních rýh. Stručný přehled
- Jasné bílé struktury („shiny white structures“) v dermatoskopii. Stručný přehled
- Zápis ze schůze výboru ČDS konané dne 3. 2. 2022
- Odborné akce 2022
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožní T buněčné lymfomy: mycosis fungoides a Sézaryho syndrom. Diagnostika a terapie
- Dostupnost epikutánních testů: příběh se světlem na konci
- Využití 3D CT a 3D modelu k rekonstrukci skalpu tkáňovým expandérem
- Jasné bílé struktury („shiny white structures“) v dermatoskopii. Stručný přehled
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career