-
Medical journals
- Career
Infantilní hemangiomy z pohledu dermatologa
: R. Faberová 1; P. Arenberger 2; Š. Čapková 3; Simona Polášková 4; J. Štěrba 5; J. Vokurková 6; D. Prusíková 2; H. Bučková 1
: Dětské kožní oddělení Pediatrické kliniky FN Brno a LF MU, Brno přednosta prof. MUDr. Zdeněk Doležel, CSc. 1; Dermatovenerologická klinika 3. LF UK a FN Královské Vinohrady, Praha přednosta prof. MUDr. Petr Arenberger, Dr. Sc., MBA 2; Dermatologické oddělení pro děti, FN Motol Praha primářka MUDr. Štěpánka Čapková 3; Poliklinika VFN Karlovo náměstí, Dětská kožní ambulance Dermatovenerologické kliniky 1. LF UK a VFN, Praha přednosta prof. MUDr. Jiří Štork, CSc. 4; Klinika dětské onkologie FN Brno a LF MU, Brno přednosta prof. MUDr. Jaroslav Štěrba, Ph. D. 5; Oddělení plastické chirurgie KDCHOT FN Brno a LF MU, Brno přednosta prof. MUDr. Ladislav Plánka, Ph. D. 6
: Čes-slov Derm, 92, 2017, No. 5, p. 206-218
: Reviews (Continuing Medical Education)
Infantilní hemangiomy (IH) patří mezi cévní anomálie. Jsou nejčastějšími benigními nádory, postihují 10–12% kojenců. Vyšší výskyt IH je u nedonošených a nezralých dětí ženského pohlaví. Rozlišují se tři základní typy: superficiální, hluboký a smíšený IH. Infantilní hemangiomy jsou výsledkem dysregulace vaskulogeneze a angiogeneze. IH se liší počtem, velikostí, tvarem i hloubkou průniku kůží a podkožím. Vývoj IH je charakterizován fází růstu, která trvá v průměru 5–6 měsíců a postupně přechází v involuci trvající několik let. Uvádí se, že 90% IH spontánně involuje. Rozsáhlé segmentální a hluboké hemangiomy vykazují růstovou aktivitu i ve 2.–3. roce života. Asi 10% IH způsobují závažné komplikace. Volba léčebného postupu u IH vyžaduje komplexní přístup a je individuální. Lékem první volby je v současné době neselektivní betablokátor propranolol podávaný v dávce 2–3 mg/kg/den v průměru po dobu 6–7 měsíců. Propranolol působí vazokonstrikci kapilár IH, blokuje produkci angiogenních faktorů (VEGF – vaskuloendothelial growth factor), které podporují novotvorbu cév a způsobuje apoptózu (přirozenou smrt cévních buněk). Léčbu a sledování pacientů s IH je nutné provádět v centrech se zkušenými specialisty: dětským dermatologem, pediatrem, kardiologem, onkologem, radiologem a plastickým chirurgem. Léčba propranololem je hrazena v České republice ve 4 centrech (FN Motol, FN Královské Vinohrady, FN Brno a FN Ostrava).
Klíčová slova:
infantilní hemangiomy – epidemiologie – patogeneze – diferenciální diagnostika – terapie – propranololÚVOD
Infantilní hemangiomy (IH) jsou nejčastější benigní nádory dětského věku, postihují 10–12% kojenců [15, 18, 34, 35, 36, 45]. IH patří do široké skupiny cévních anomálií, vznikají proliferací endoteliálních buněk kapilár. Většina IH nevyžaduje žádnou léčbu, v průběhu měsíců až let spontánně involují. Asi v 10–15% případů mohou působit komplikace. Včasná diagnostika a volba optimálního léčebného postupu u IH jsou nezbytné.
Epidemiologie
Prevalence IH u zralých novorozenců a kojenců se pohybuje v Evropě mezi 4–5%. Častější výskyt je pozorován u předčasně narozených dětí ženského pohlaví s hmotností menší než 1 500 g, a to v poměru 2 : 1 až 5 : 1. Jen 2% IH se vyskytuje při narození, jde o světle růžové makuly nebo drobné růžové papulky. Je-li hemangiom zcela vyvinut při porodu, jedná se o kongenitální hemangiom. Deset procent IH se objeví v průběhu prvních týdnů života dítěte [11, 12, 15, 34, 35, 36, 44, 45, 48, 55].
K rizikovým faktorům, které se podílí na vzniku IH, patří opakované gravidity, vyšší věk matky, in vitro fertilizace, preeklampsie. Ke vzniku IH mohou přispět placentární anomálie (např. zdvojená placenta) a další perinatální komplikace (např. lokální nebo systémová hypoxie) [11, 25, 27, 31].
Většina hemangiomů vzniká sporadicky, ale jsou popisovány rodiny s autozomálně dominantní dědičností [11, 15, 25, 27, 31, 54, 55]
Patogeneze
IH jsou výsledkem dysregulace vaskulogeneze a angiogeneze. I přes nové genetické, patofyziologické a histologické poznatky není jednoznačně objasněn spouštěcí mechanismus, který vede ke zvýšené expresi angiogenních faktorů, jako jsou VEGF-A (vascular endothelial growth factor), bFGF (fibroblast growth factor), angiopoetin a k aktivaci VEGFR-1 a VEGFR-2 receptorů u IH. Proliferační fáze IH je ovlivňována angiogenním účinkem MMP (matrix metalloproteases), IL-6, IL-8 (interleukiny) a PD-ECGF (platelet-derived cell growth factor) a angiopoetinem 1 [15, 18, 19, 23, 24, 31].
V současné době jsou předkládány tři teorie vzniku IH:
- Somatická mutace kmenových buněk genu lokalizováného v oblasti 5q31-33, která u IH zvyšuje signalizaci dráhy/expresi/VEGFR [31, 62, 64]. Endoteliální progenitorové buňky u IH jsou odvozené od buněk CD 34+/CD133+ označované jako hemangiomatózní kmenové buňky HemSC. Tyto buňky u somatické mutace mají schopnost se diferencovat na endoteliální buňky, které mají pozitivní imunohistochemický marker GLUT 1+ a během regrese z nich vznikají adipocyty. Imunohistochemický marker GLUT 1+ je specifický jen pro IH, není však přítomný u jiných cévních nádorů nebo vaskulárních malformací.
- Placentární teorie je založena na výskytu stejných imunohistochemických markerů (GLUT1, Lewis Y, FcRIII, merosin) u IH a v placentě. Vzhledem k tomu, že placenta i IH jsou charakterizovány rychlým růstem s následnou involucí, tato teorie odvozuje vznik IH z angioblastů embolizovaných placentárních buněk.
- Hypoxie plodu během těhotenství a protrahovaného porodu může být impulsem k vaskulární proliferaci a vzniku IH. Příkladem jsou předčasný porod a placentární anomálie. Na hypoxii se podílí nízká porodní hmotnost novorozence a vyšší věk matky.
Klasifikace a klinické projevy IH
IH jsou charakterizovány značnou variabilitou ve velikosti, počtu, tvaru a hloubce uložení v kůži a podkoží.
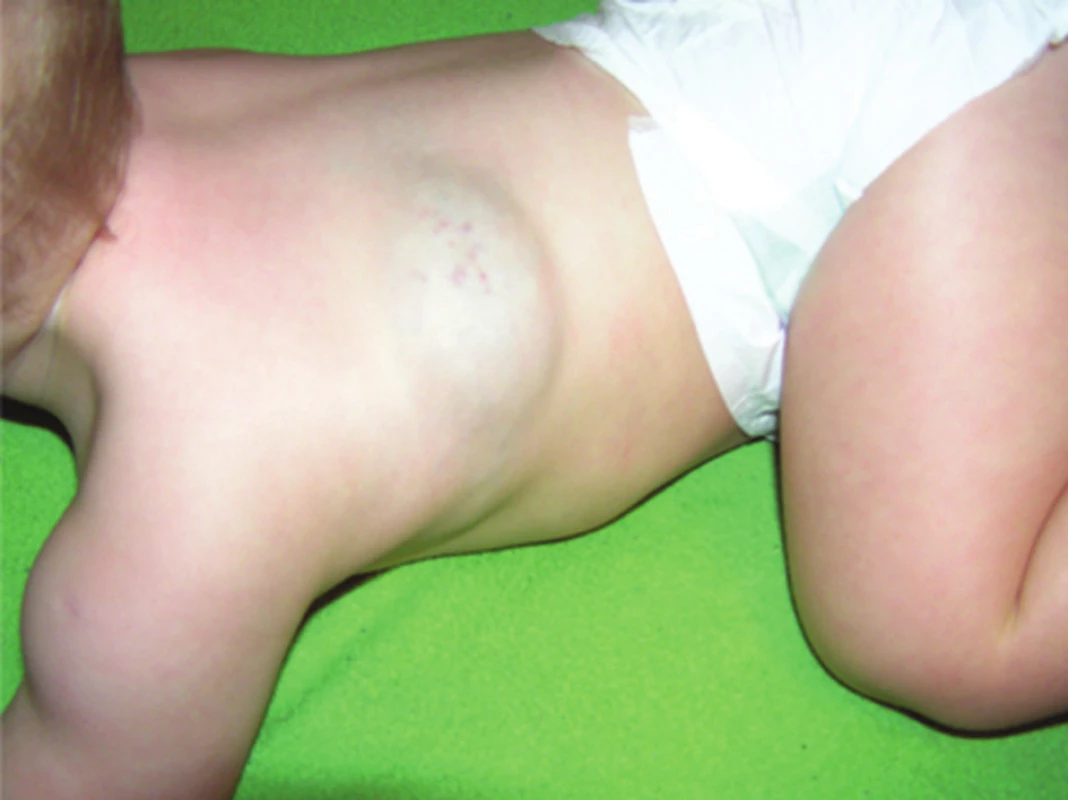
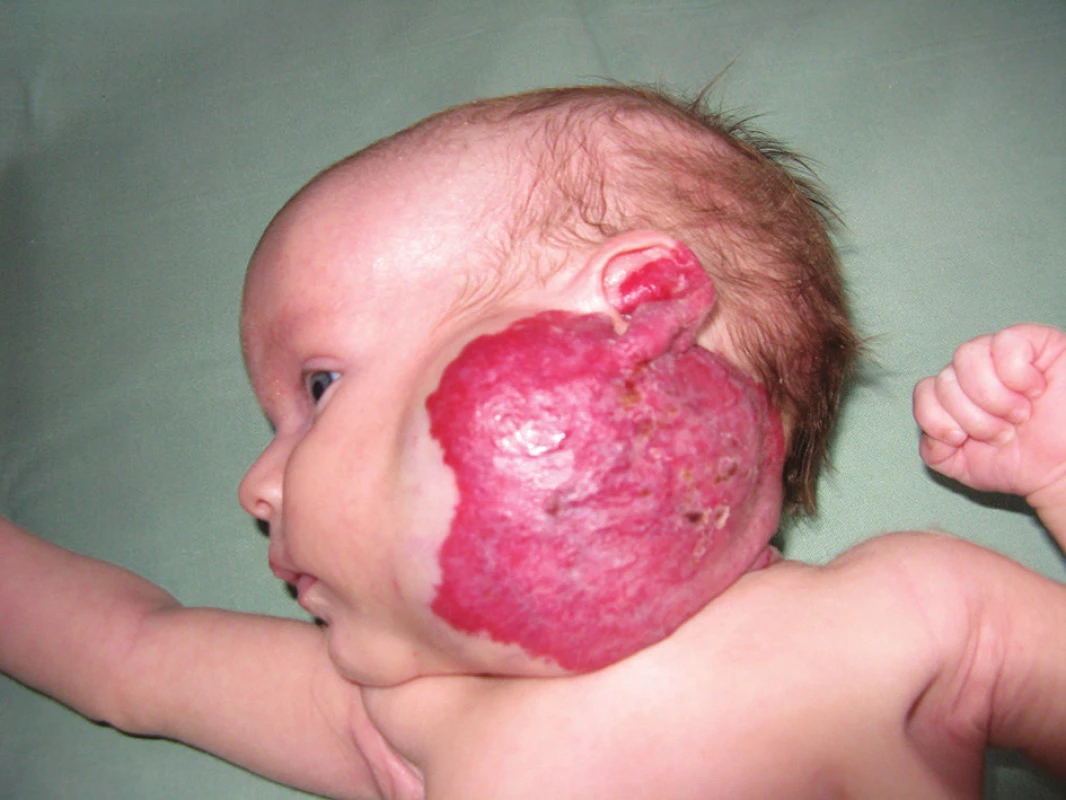
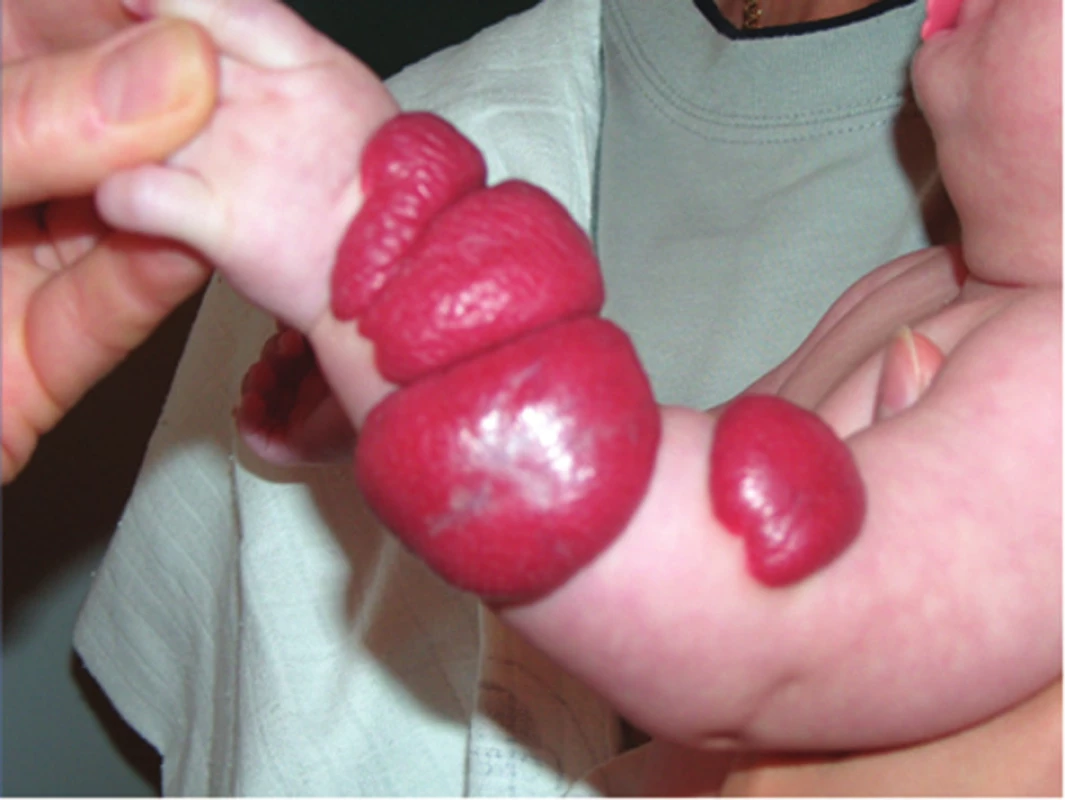
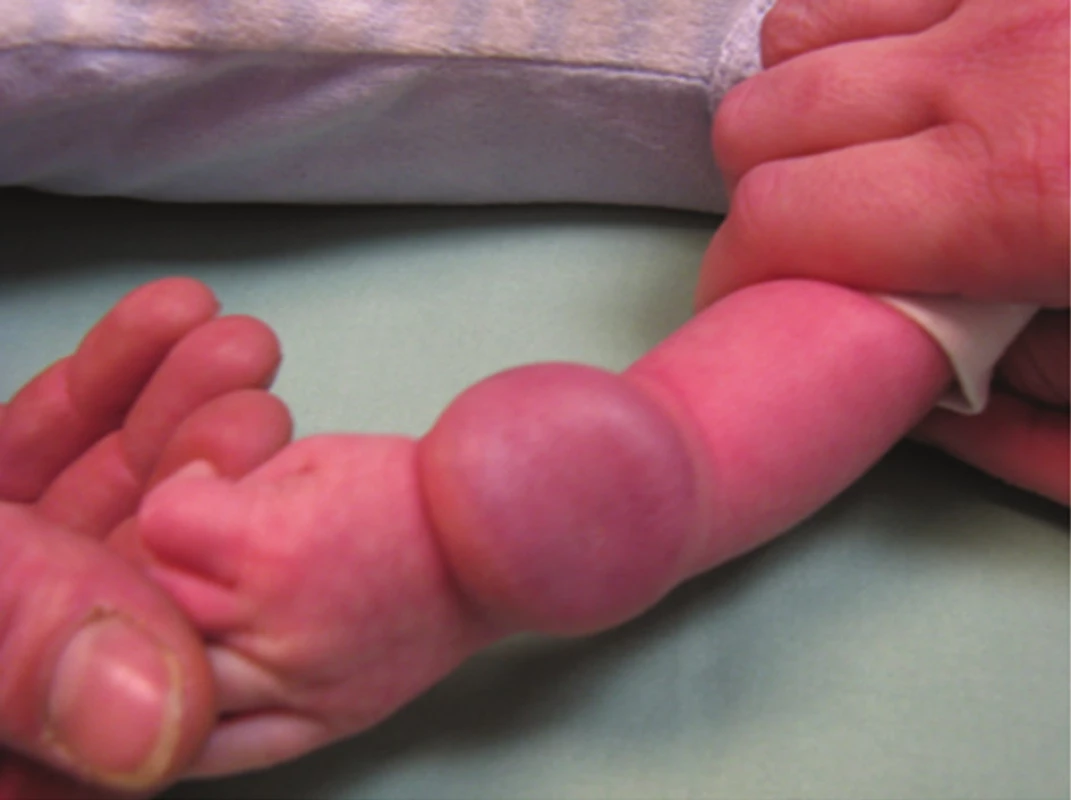
Podle hloubky postižení jednotlivých vrstev kůže (epidermis, corium, tela subcutanea) rozlišujeme IH: superficiální (povrchový, obr. 1), hluboký (v podkoží, zcela překryt kůží, obr. 2) a smíšený (obr. 3), kdy je na povrchu viditelná pouze část hemangiomu a v podkoží je skrytá hluboká složka.
1. Superficiální (povrchový) infantilní hemangiom 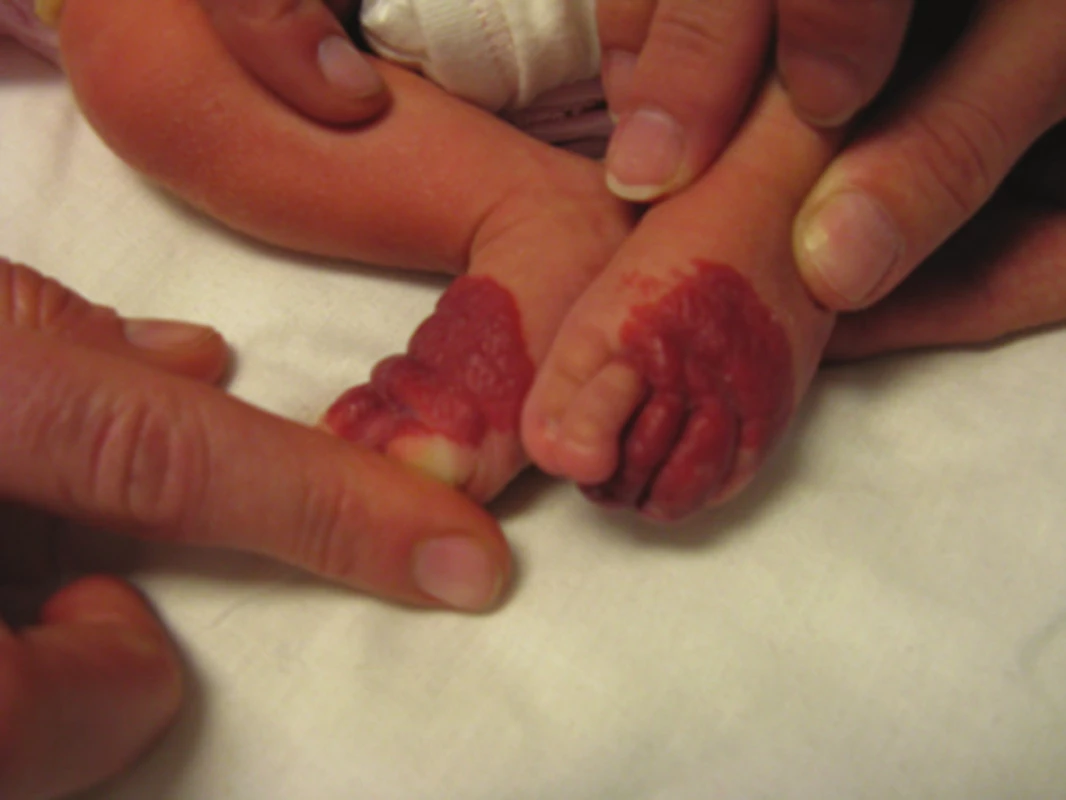
Podle distribuce rozlišujeme IH na lokalizovaný, segmentální a multifokální.
Největší skupinu tvoří lokalizované IH 67%, segmentálních je 13%, zbývající jsou multifokální IH.
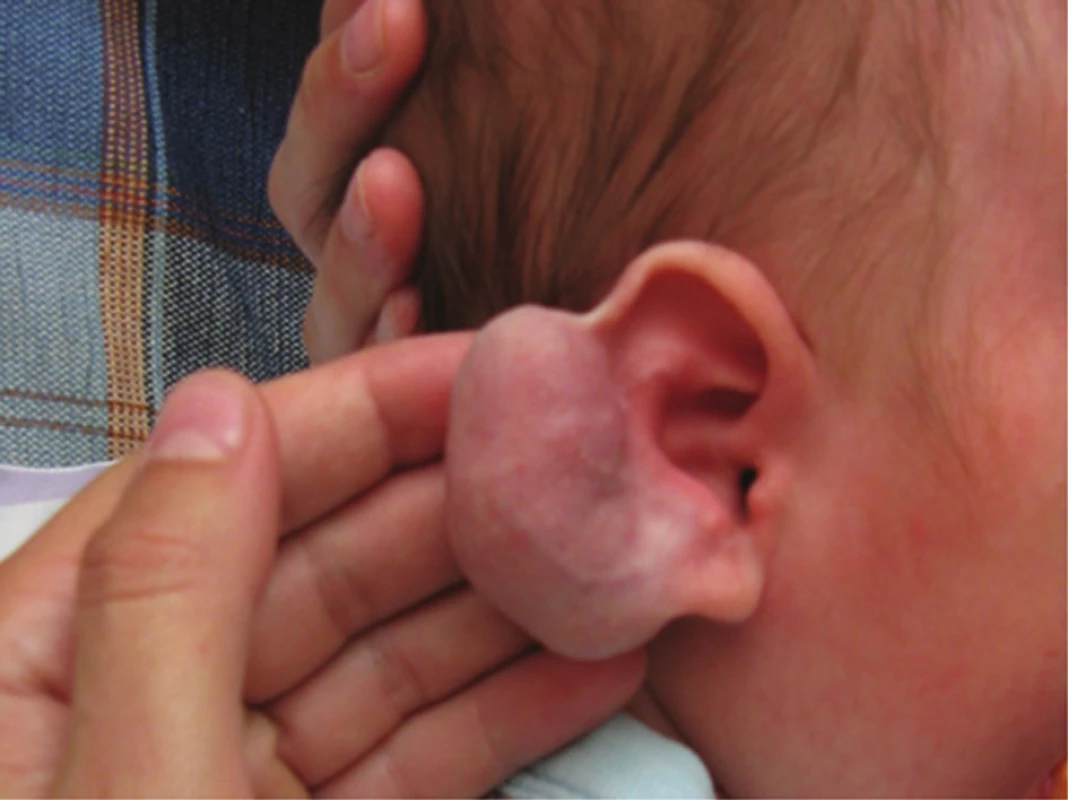
Nejvíce IH se vyskytuje na hlavě a krku (cca 60%) – obrázek 4. IH mohou postihovat sliznice dutiny ústní, gastrointestinálního traktu, horních a dolních cest dýchacích. Vyskytují se v genitoanální oblasti, oku, plicích a centrálním nervovém systému.
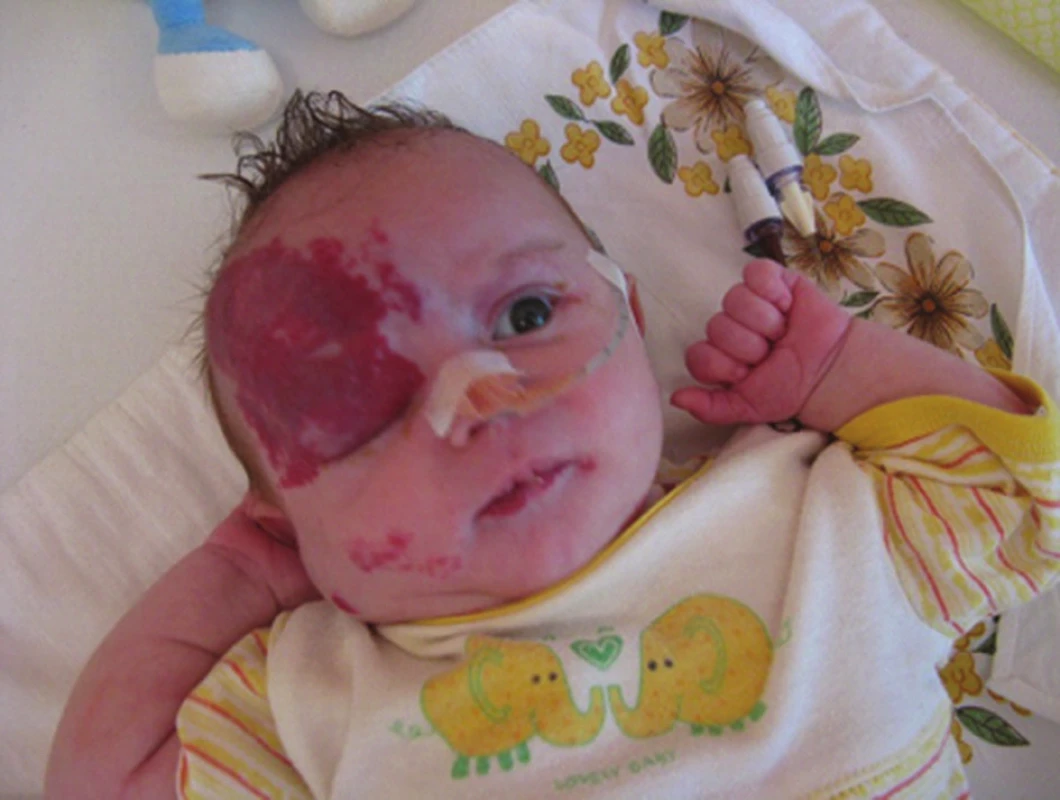
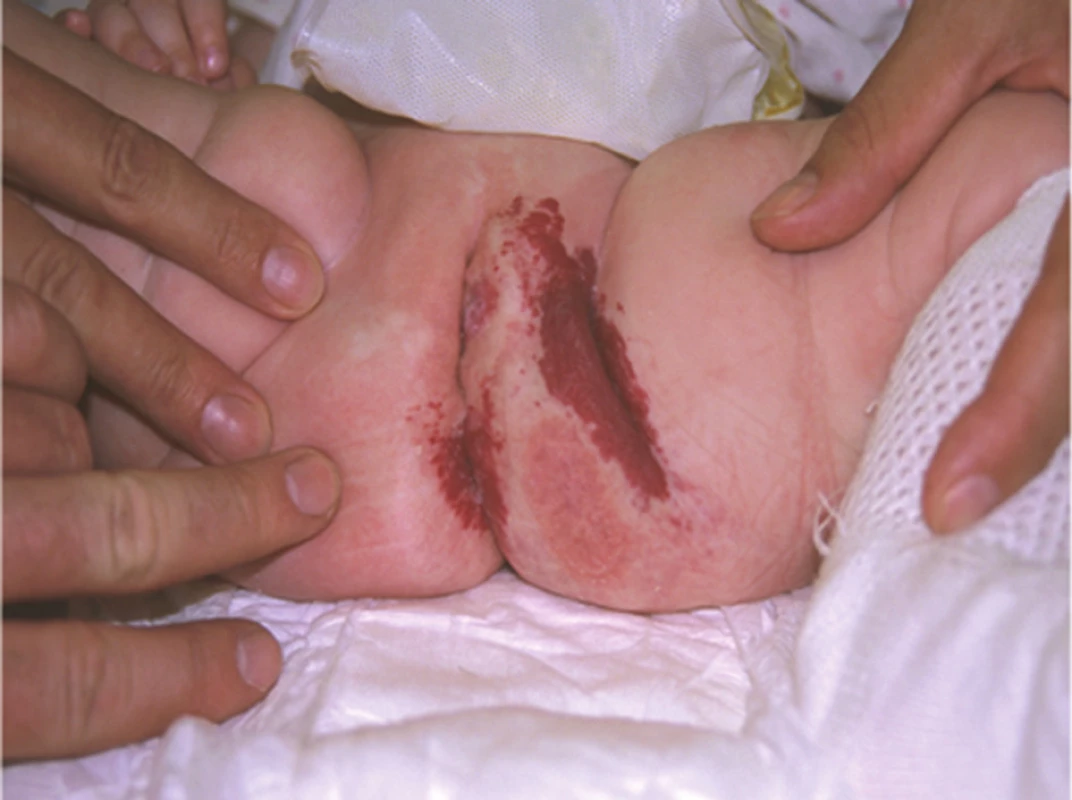
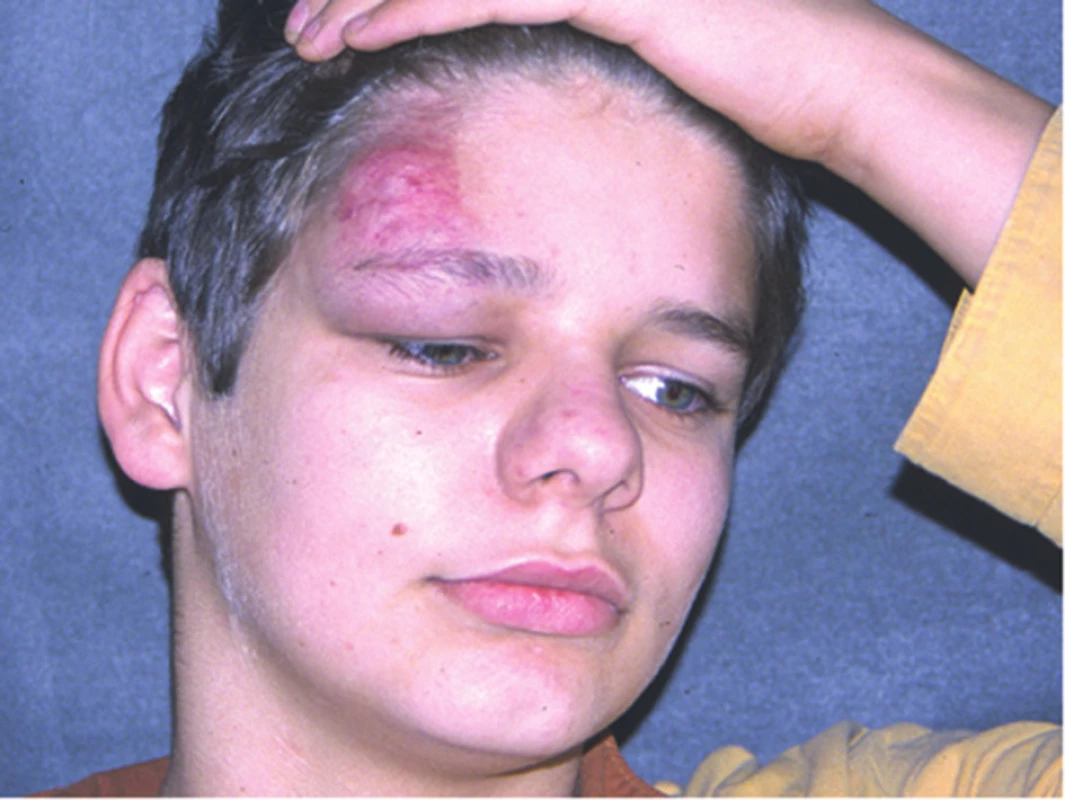
Segmentální IH, např. na obličeji, se rozdělují podle postižené oblasti na frontotemporální, maxilární, mandibulární a frontonazální. Segmentální IH mohou být spojeny se strukturálními malformacemi (anomáliemi skeletu, genitouretrálními, gastrointestinálními a neurologickými malformacemi) jako součást syndromů: PHACE syndromu (obr. 5), LUMBAR syndromu a PELVIS syndromu – obrázek 6, tabulky 1, 2, 3, 4 [15, 18, 19, 23, 24, 31].
2. Diagnostická kritéria PHACE syndromu 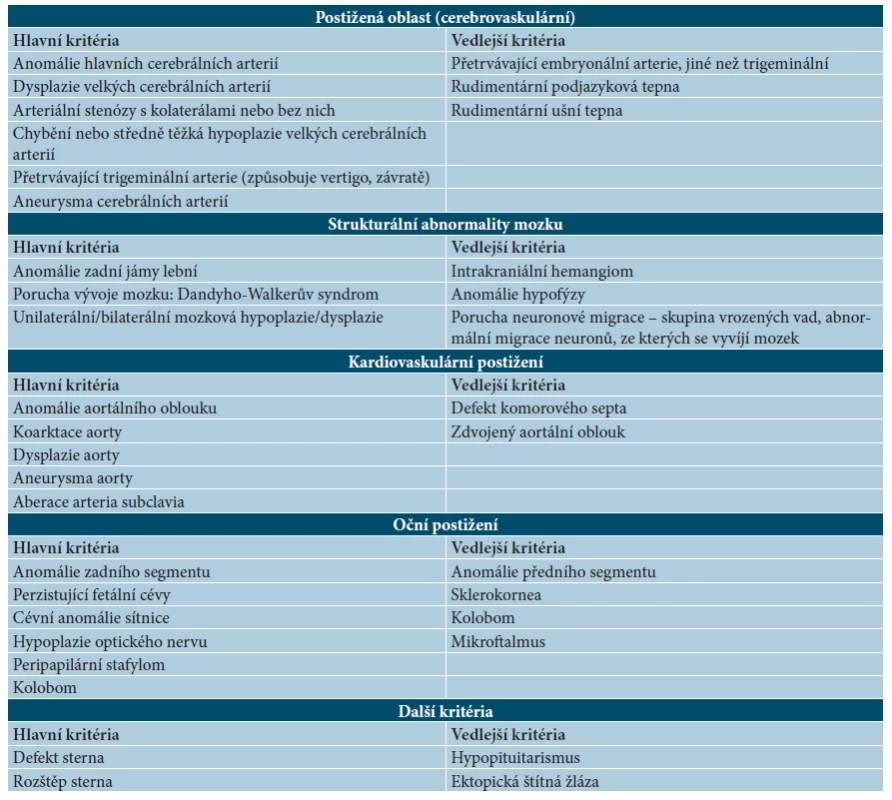
Studie na molekulární úrovni, týkající se mutace genů u těchto syndromů, probíhají. U PHACE syndomu byla zjištěna kompletní delece genu SLC35B4 na 7q33, delece genu AKR1B1 na 7q33. Diagnostická kritéria PHACE syndromu se zakládají na hlavních a vedlejších kritériích postižené oblasti (viz tab. 1, 2) [34, 35, 36, 39, 45, 51, 59].
Podle počtu IH rozlišujeme jednotlivé a vícečetné hemangiomy (obr. 7), kdy se jedná o výskyt více než 5, ale méně než 10 IH. Hemangiomatóza je charakteristická přítomností více než 10 hemangiomů. V diferenciální diagnostice hemangiomatózy odlišujeme difuzní neonatální hemangiomatózu, u které jsou IH na kůži a ve viscerálních orgánech, nejčastěji v játrech (obr. 8).
8. Difuzní neonatální hemangiomatóza, IH se vyskytují i v játrech 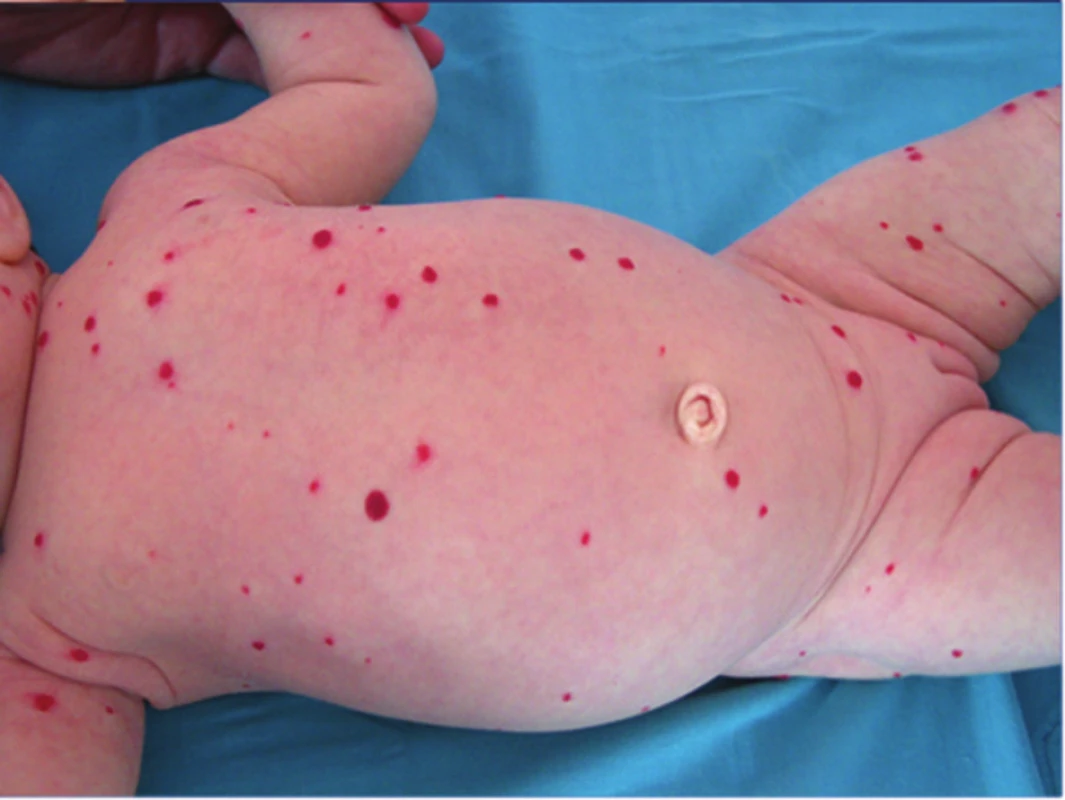
U povrchových IH jsou počáteční projevy patrné v prvních dnech života jako erytematózní, teleangiektatické makuly, drobné papulky obklopené vyblednutím nebo lividní makuly podobné hematomům. Postupně se vyvíjí v ostře ohraničené červenofialové lobulární tumory o průměru i více než 20 cm. Histologický obraz povrchového hemangiomu odpovídá shluku kapilárních lumin v různých stadiích vývoje.
Hluboké IH vytváří tumorózní hmoty v subcutis. Kůže nad hlubokými IH je normální barvy nebo mírně namodralá. V některých případech jsou na povrchu patrny teleangiektázie nebo dilatované cévy. Histologický obraz u hlubokého IH je tvořen zralými dobře diferencovanými dilatovanými cévami a sinusoidními krevními prostory ve fibrózním stromatu.
Smíšené IH jsou kombinací povrchových a hlubokých hemangiomů [15, 34, 35, 36, 48]
Vývoj infantilních hemangiomů
Vývoj IH je charakterizován fází růstu trvající v průměru 5–6 měsíců, která postupně přechází v involuci. Rozsáhlé segmentální a hluboké hemangiomy vykazují růstovou aktivitu ještě ve 2.–3. roce života. Až 90% IH spontánně involuje mezi 2.–7. rokem věku dítěte [4, 7, 12, 31, 34, 35, 36, 45, 48, 63, 64].
V involuční fázi dochází k postupnému vyblednutí IH od červené k růžovošedé barvě s bělavými ložisky v centru. Infantilní hemangiomy měknou, oplošťují se až do úrovně kůže s naznačenou atrofií, hypopigmentací, ojediněle s teleangiektaziemi. Po regresi IH se v původním ložisku nachází fibrózně tuková tkáň. Regrese hlubokých IH často nebývá kompletní. Ulcerovaný IH se hojí atrofickou nebo hypertrofickou jizvou.
DIFERENCIÁLNÍ DIAGNOSTIKA
Většina IH je diagnostikována klinicky na základě anamnézy, klinického obrazu a vývoje. Důležité jsou informace o průběhu gravidity, perinatálního období i vývoje IH. Je nutné odlišit IH od jiných typů hemangiomů, lymfangiomů a jiných cévních nádorů a vaskulárních malformací na kůži a v podkoží.
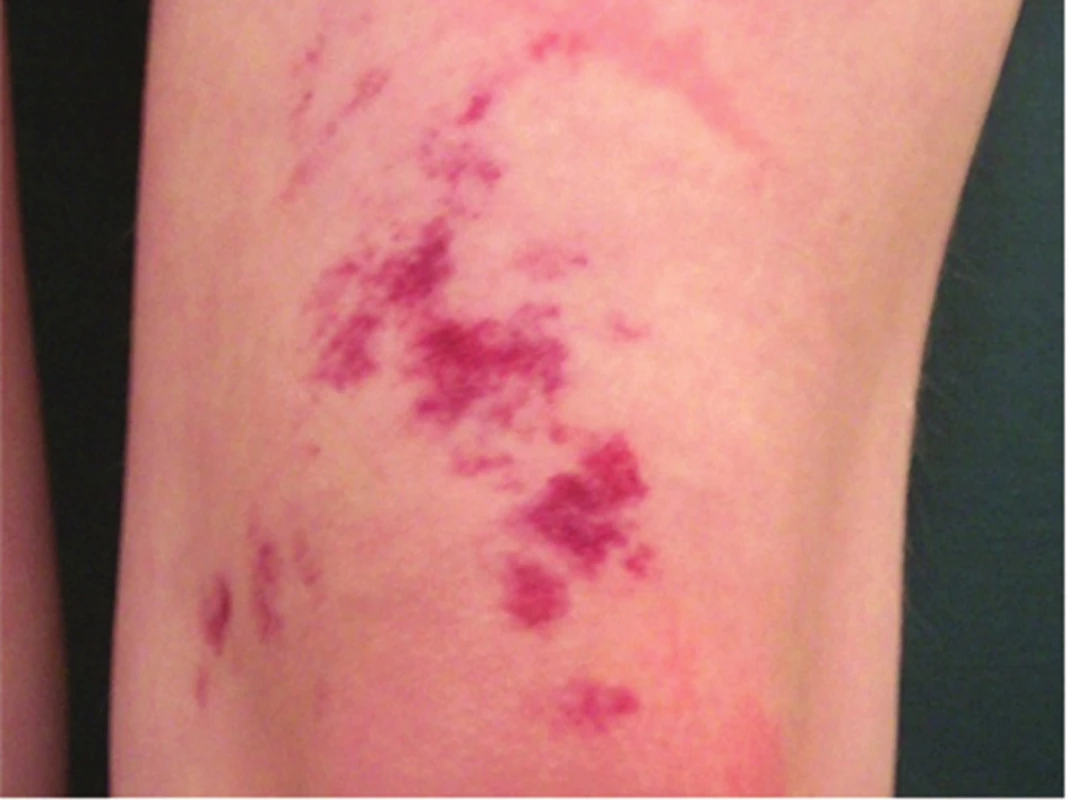
Kongenitální hemangiom (KHM) (obr. 9, 10) vzniká intrauterinně. KHM se dělí na regredující (RICH) a neregredující (NICH). Regredující KHM lze imunohistochemicky potvrdit pozitivním markerem GLUT1. KHM může být zaměněn za kaposiformní hemangioendoteliom.
Kongenitální tufted hemangiom (povrchový, smíšený, hluboký) se liší od IH pestrým klinickým obrazem (obr. 11, 12) a v histologickém obraze typickým uspořádáním kapilár do okrouhlých ložisek (obr. 13). Kongenitální tufted hemangiom má u kojenců tendenci k regresi.
11. Kongenitální hluboký tufted hemangiom 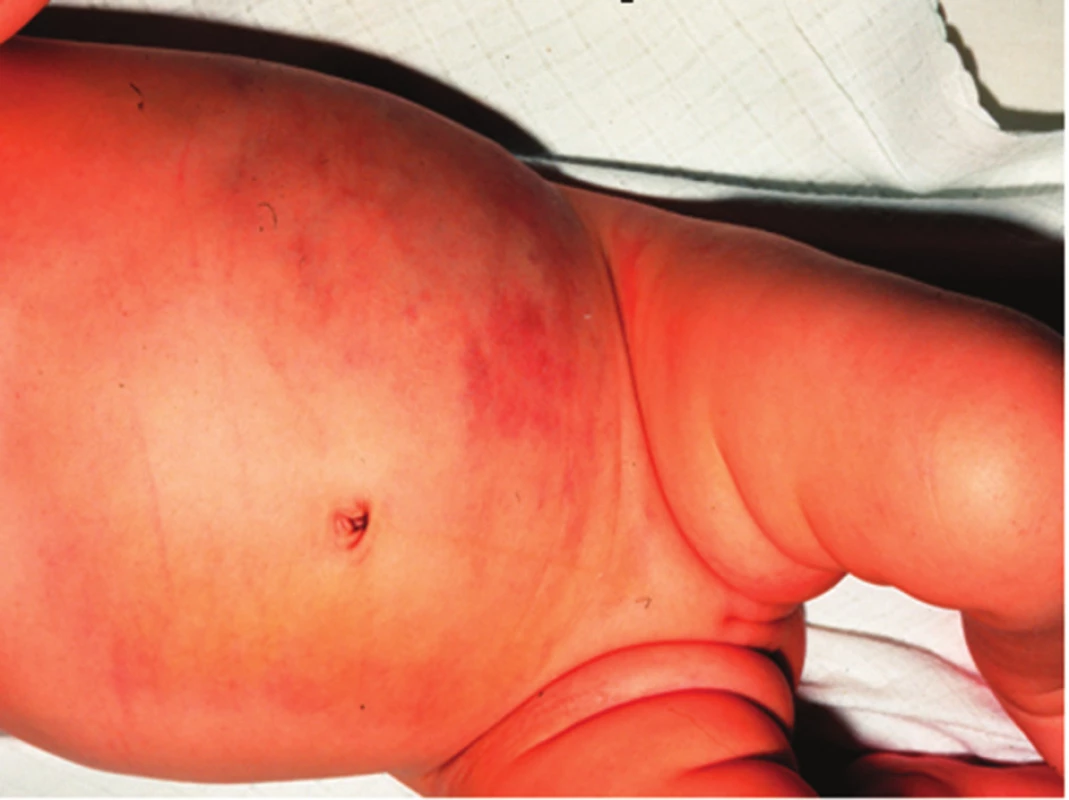
12. Kongenitální povrchový tufted hemangiom 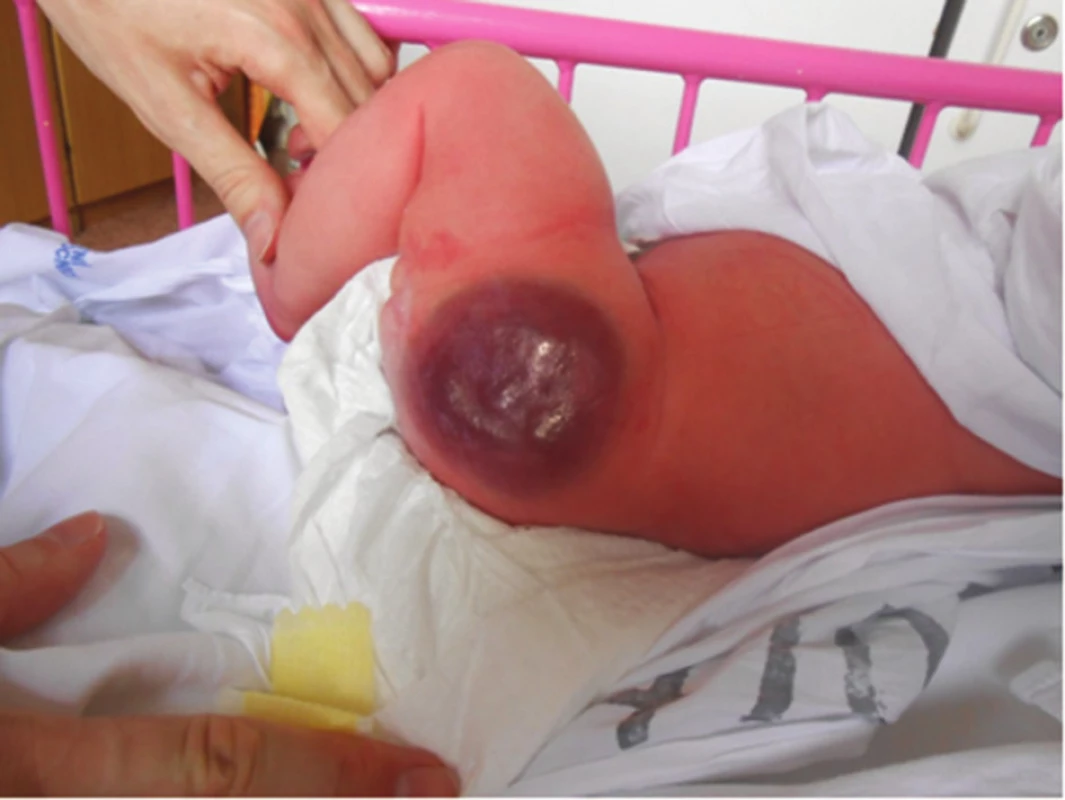
13. Histologický obraz tufted hemangiomu: typické uspořádání kapilár do okrouhlých ložisek 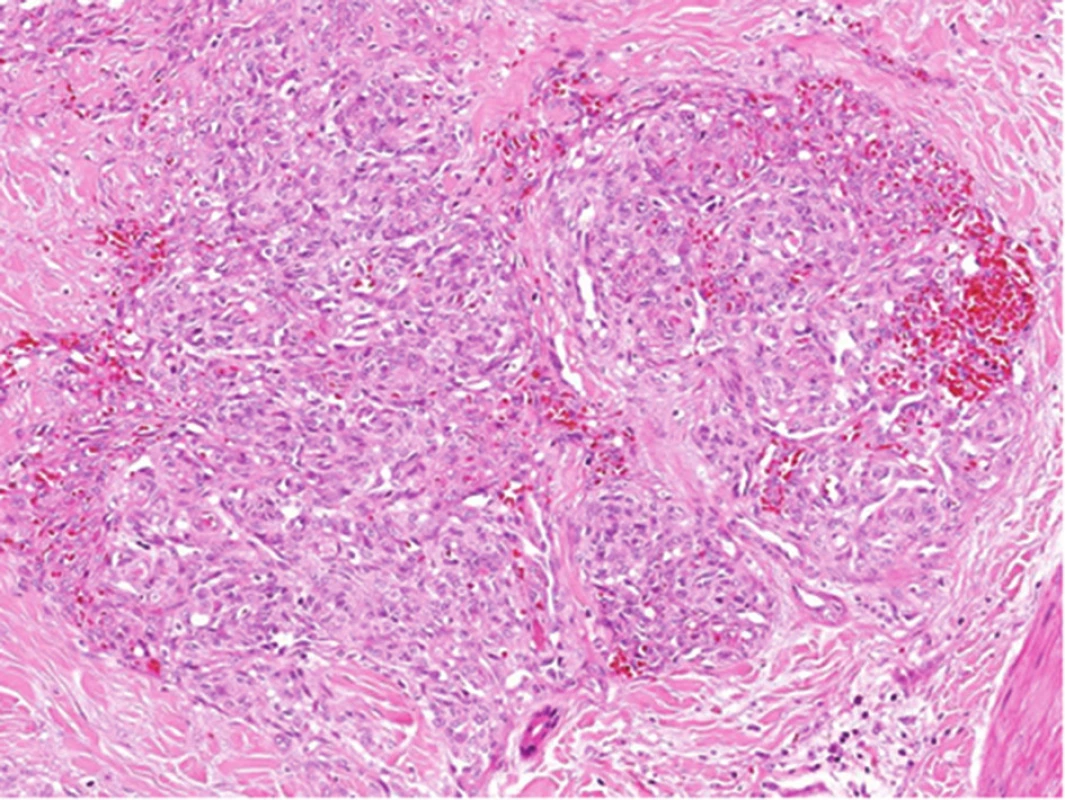
Vřetenobuněčný hemangiom (obr. 14) tvoří polokulovitá ložiska lividní barvy. Vytváří se kolem cévních anomálií, např. u syndromu Klippela-Trenaunayho, Maffucciho syndromu a venózních malformací. V histologickém obrazu vřetenobuněčného hemangiomu jsou typické vřetenité buňky, které rostou kolem kapilár (obr. 15).
14. Vřetenobuněčný hemangiom u venózní malformace 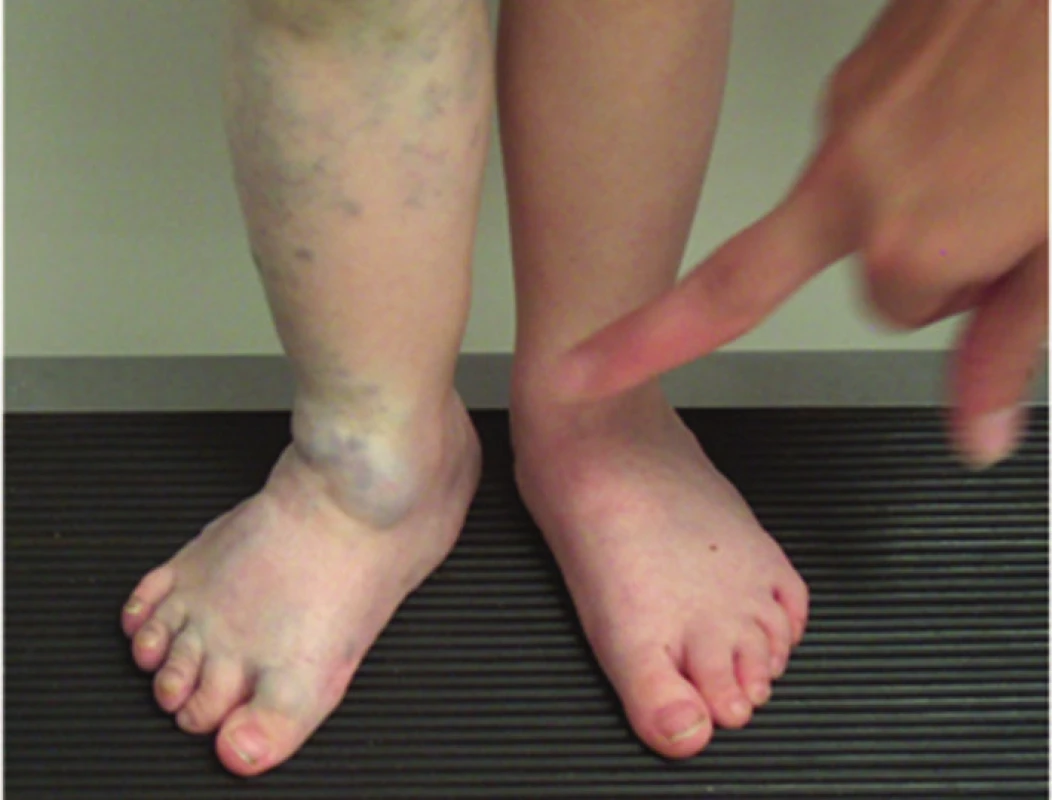
15. Histologický obraz vřetenobuněčného hemangiomu: typické vřetenité buňky kolem kapilár 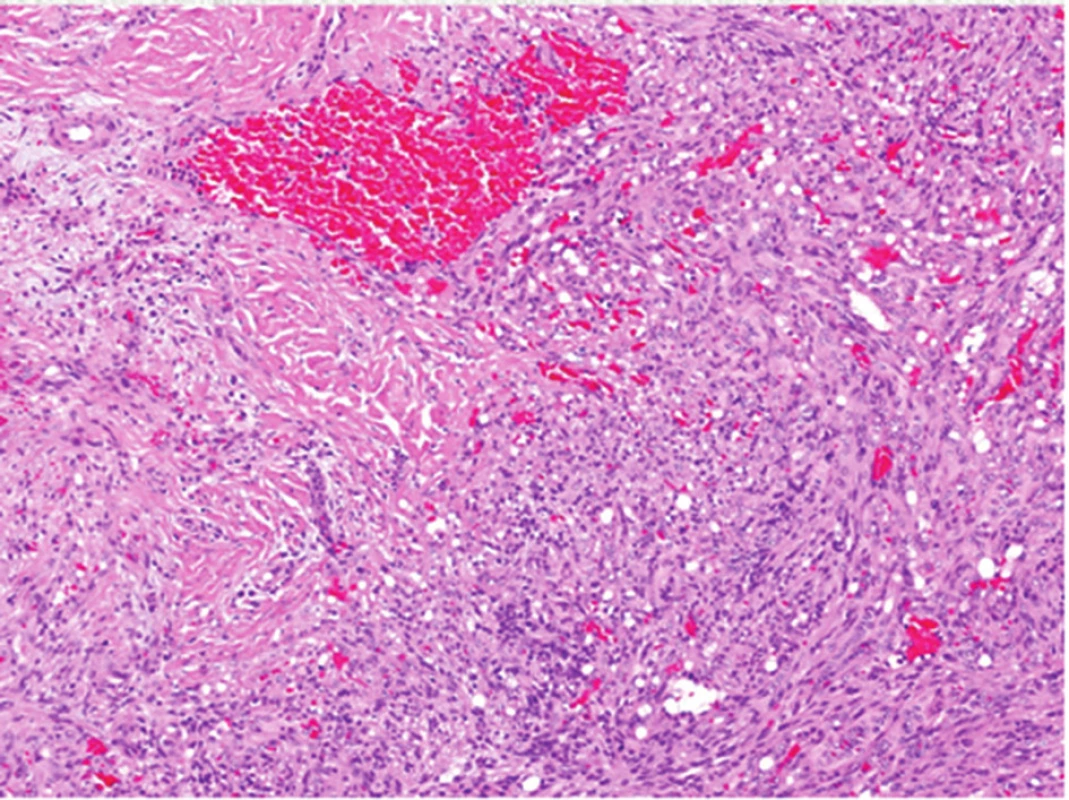
Verukózní hemangiom (obr. 16) je bradavičnatý tumor složený ze světle až tmavě červených splývajících papul. Zpravidla se u dětí vyskytuje na dolních končetinách. Histologický obraz (obr. 17): patrná hyperkeratóza, dilatované tenkostěnné cévy i hlouběji uložené v koriu. Verukózní hemangiom neregreduje. V diferenciální diagnostice je nutno odlišit angiokeratom, který nemá hlubokou složku.
17. Histologický obraz verukózního hemangiomu: dilatované tenkostěnné cévy, na povrchu hyperkeratóza 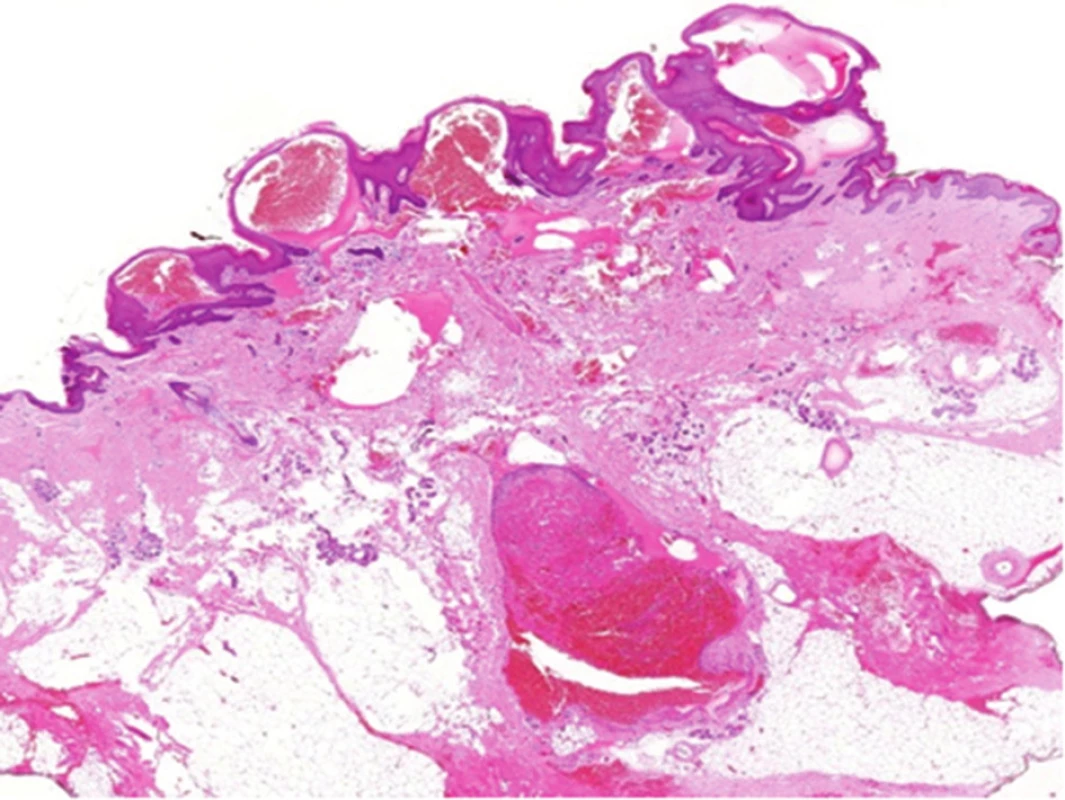
Pyogenní granulom je sytě červený, polokulovitý nádorek velikosti 5 mm. Jde o získaný kapilární hemangiom. Vzniká po drobném úrazu jako reaktivní hyperplazie granulační tkáně.
Solitární angiokeratom je červenočerný hyperkeratotický plochý hrbol velikosti 1cm. Histologický obraz je podobný verukóznímu hemangiomu, dilatované tenkostěnné cévy jsou jen v epidermis.
Difuzní angiokeratomy jsou projevem Fabryho nemoci (defekt alfa-galaktosidázy).
Kapilární malformace, dříve označovaná jako n. flammeus („oheň, teleangiektatický névus, skvrna portského vína“) je často mylně diagnostikována jako rozsáhlý superficiální hemangiom. Jde o mapovitá, světle růžová až sytě červená nebo modrofialová ložiska v niveau kůže, obvykle patrná již při narození. V histologickém obraze jsou přítomny četné dilatované kapiláry bez endoteliální proliferace. Kapilární malformace může být součástí různých syndromů, např. Klippelova-Trenaunayova (obr. 18) a Sturgeova-Weberova syndromu (obr. 19).
18. Kapilární malformace u syndromu Klippela-Trenaunayho 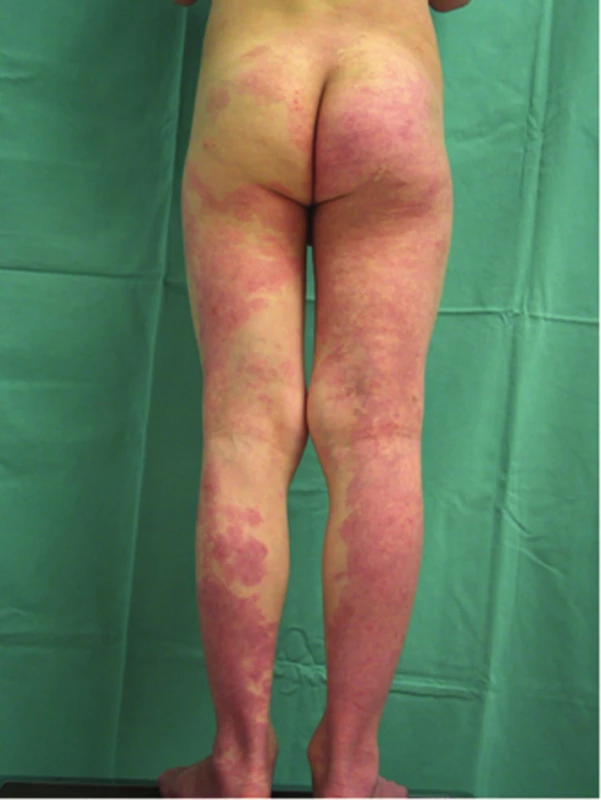
19. Kapilární malformace u syndromu Sturgeho-Webera (případ s bilaterálním postižením) 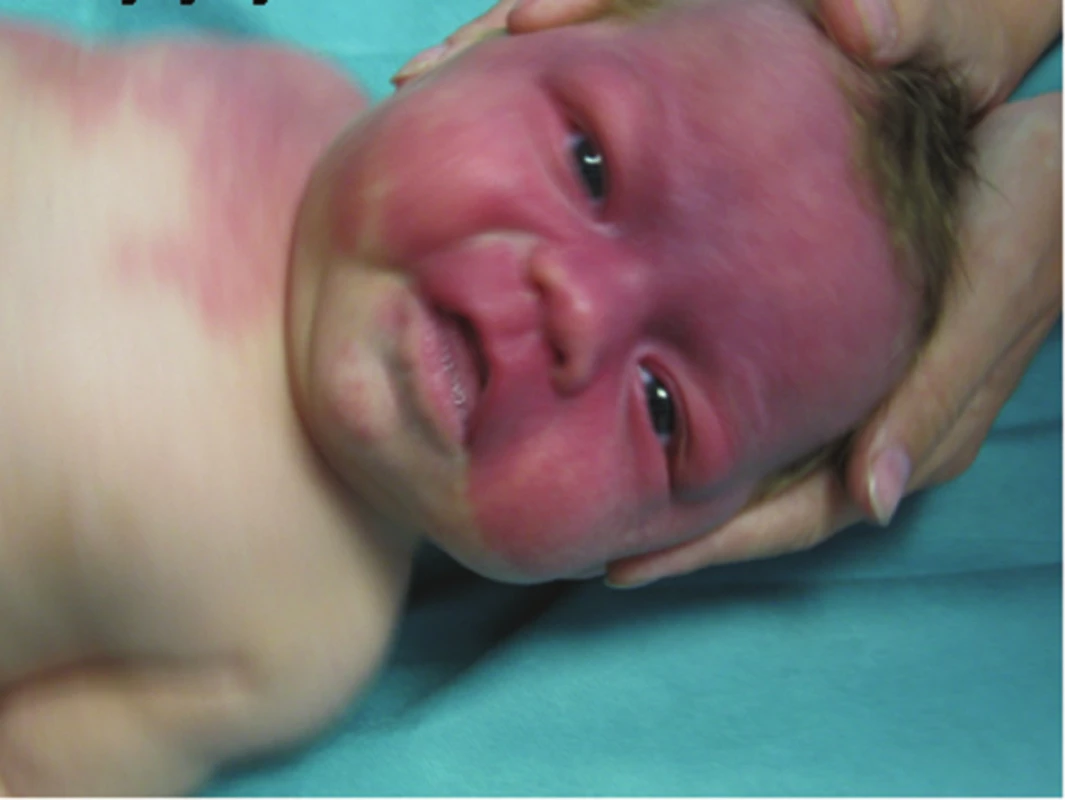
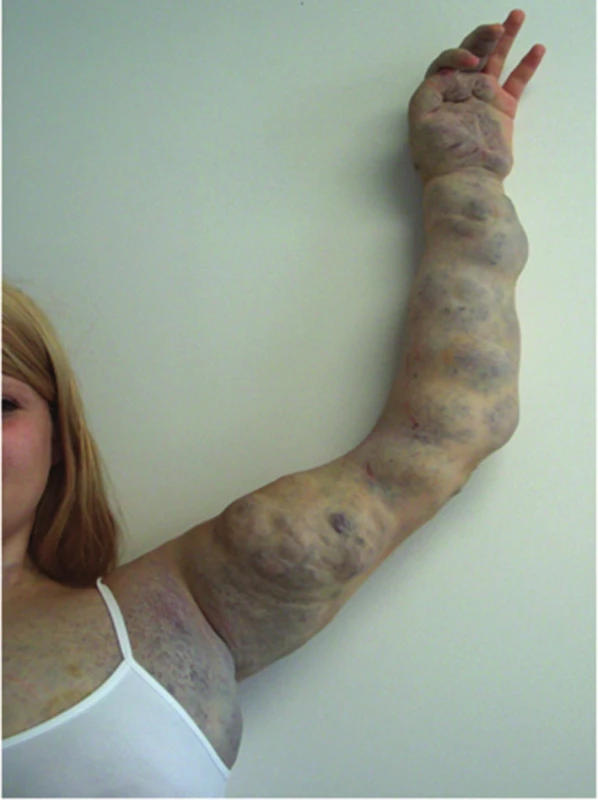
Venózní malformace (VM) se skládá z venózních lakun a kanálů, které mají nepravidelně ztenčené stěny (obr. 20). VM mohou být při narození nenápadné, modravého zbarvení, kompresibilní, velmi připomínající subkutánní IH. Někdy se již během intrauterinního života vyvíjejí objemné venózní masy. Venózní malformace se často vyskytují s kapilárními malformacemi jako tzv. kapilarovenózní malformace s převažující venózní nebo kapilární složkou. Prorůstají i do svalů a kostí. V průběhu života dochází k progresi VM. U rozsáhlých VM se vyvíjí chronická disseminovaná intravaskulární koagulopatie.
Arteriovenózní malformace (obr. 21) je vysokoprůtoková cévní anomálie s velkým arteriálním průtokem. Lze je zaměnit za vaskularizovaný hluboký IH.
Infantilní myofibromatóza nebo infantilní fibrosarkom mohou připomínat hluboký IH.
Rabdomyosarkom je nejběžnějším sarkomem v raném dětství, nejčastěji postihuje oblast hlavy a krku. Lze zaměnit za superficiální IH.
Nazální gliom je kongenitální, červenošedý uzel v glabelární oblasti, který se skládá z extrakraniální tkáně mozku a mozkových plen.
Dermoidní cysty mohou napodobovat subkutánní IH.
Kavernózní lymfangiom je uložen hluboko v dermis, podobá se subkutánnímu IH. Kavernózní lymfangiom se často vyskytuje s hlubokým IH [2, 6, 16, 17, 19, 21, 26, 34, 35, 36, 37, 47, 62].
VYŠETŘOVACÍ METODY
Vyšetřovací metody se odvíjí od typu a lokalizace IH.
Ultrazvukové vyšetření (UZV) a dopplerovské zobrazení je indikováno k potvrzení a posouzení rozsahu subkutánního a smíšeného IH.
Magnetická rezonance (MRI) s kontrastem se doporučuje u nejasných výsledků UZV a dopplerovského zobrazení. Doporučuje se vždy u IH v oblasti oka, při postižení dýchacích cest IH je indikovaná laryngoskopie s následnou MRI s kontrastem.
Počítačová tomografie (CT) k odlišení jiné vaskulární malformace od IH v játrech.
RTG vyšetření plic a UZV břicha jsou indikovány u mnohočetných IH, při podezření na difuzní neonatální hemangiomatózu.
Echokardiografické vyšetření vyloučí kardiální insuficienci u mnohočetných IH, hemangiomatózy a u difuzní neonatální hemangiomatózy [18, 31, 34, 35, 36].
Chirurgická excize (biopsie) k histologickému vyšetření u sporných případů.
LÉČBA HEMANGIOMŮ
Volba léčebného postupu IH je vždy individuální a vyžaduje komplexní přístup k pacientovi [1, 3, 5, 9, 10, 13, 29, 30]. Léčebný postup je závislý na velikosti, lokalizaci, rychlosti růstu IH, věku pacienta, na sociálním zázemí jeho rodiny. Většina hemangiomů involuje spontánně. Terapie IH je lokální i celková.
Přehled léčebných postupů užívaných u IH je uveden v tabulce 5.
5. Přehled užívaných léčebných postupů u IH 
Lokální terapie IH
Zvolení vhodného léčebného postupu u IH je dáno zkušenostmi lékaře. Z lokální terapie se nejvíce používá 0,1–0,5% timolol v roztoku nebo gelu, 1% propranolol v gelu nebo krému, v režimu 2krát denně. Používají se z psychologického a léčebného hlediska u superficiálních, lehce nad niveau kůže drobných IH, které mají sklon k ulceraci. Pacienty sledujeme až v tříměsíčních intervalech. Smíšené a subkutánní IH v oblasti očního víčka se korigují intralezionální aplikací Depo Medrolu zkušeným oftalmologem. V tabulce 6 jsou uvedeny i méně užívané lokální léčebné prostředky.
6. Přehled lokální terapie IH 
* po > 3měsíční lokální terapii jsou vhodná vyšetření: EKG, MP, MD, TK, laboratorní screening Systémová terapie IH
Ze všech IH vyžaduje 10–12% systémovou terapii. Indikace k celkové léčbě IH jsou uvedeny v tabulce 7. Na obrázku 22 je rozsáhlý ulcerující IH určený k systémové terapii. Používalo se mnoho léčebných prostředků. V minulosti se používaly kortikoidy v různých dávkách po dobu několika týdnů až měsíců. Vysoké dávky kortikoidů byly často komplikovány nežádoucími vedlejšími účinky. V léčbě se používal interferon alfa, cytostatika (vinkristin), později sirolimus. V roce 2008 publikovala Christine Labreze účinnou terapii hemangiomů propranololem, po dalším klinickém zkoušení se propranolol stal lékem první volby v systémové léčbě IH. Propranolol v klinické praxi není novým lékem. Jako betablokátor se používá při léčbě srdeční arytmie, kardiomyopatie, hypertyroidismu nebo migréně. Retrospektivní komparativní studie prokázaly, že propranolol je v porovnání s kortikoidy efektivnější a je lépe tolerován. V současnosti je propranolol ve formě sirupu jediným originálním lékem schváleným pro léčbu IH. V některých případech se propranolol kombinuje s kortikosteroidy, např. u rozsáhlých segmentálních hemangiomů a IH v subglotické oblasti [1, 5, 8, 12, 13, 14, 15, 16, 17, 18, 20, 22, 28, 32, 33, 41, 46, 52, 51].
7. IH doporučené k celkové terapii 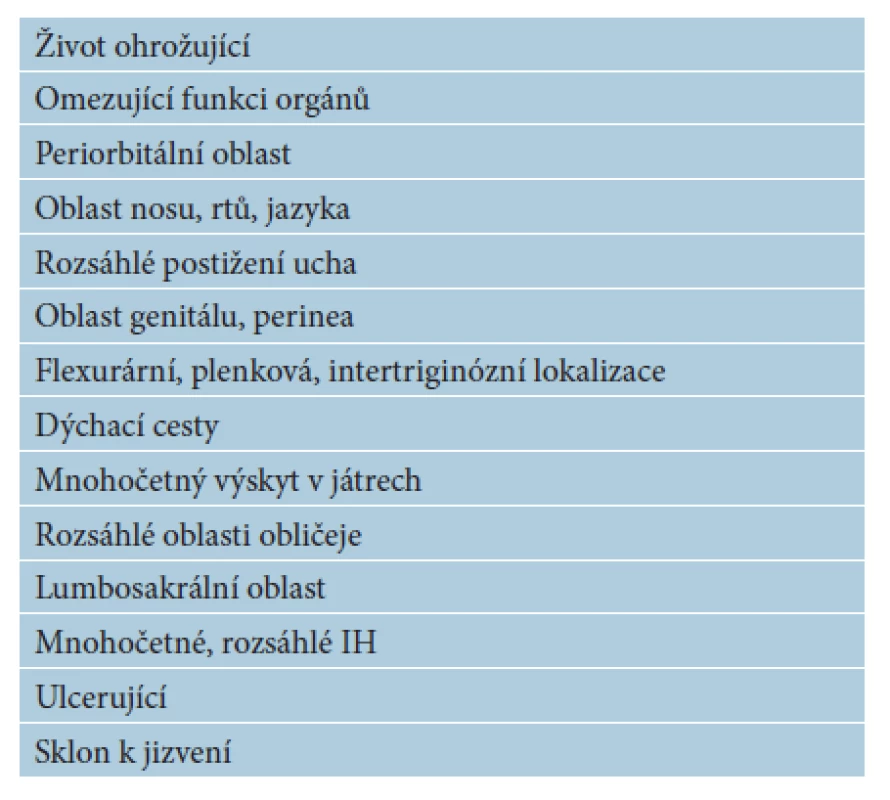
22. Ulcerovaný IH k systémové terapii 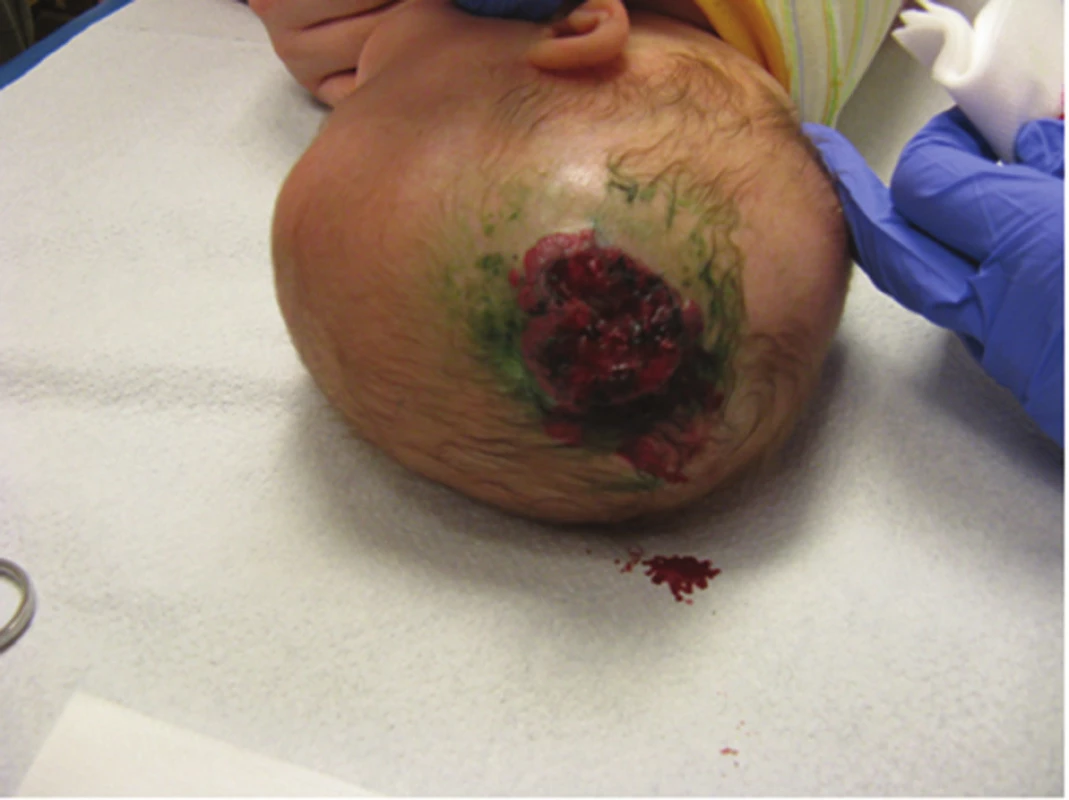
Mechanismus účinku propranololu
Jsou známy tři podstatné patofyziologické kroky, které vysvětlují příznivý účinek propranololu na IH:
- a) vazokonstrikce navodí vyblednutí hemangiomu;
- b) zablokování receptorů pro angiogenní faktory, zejména VEGF;
- c) navození apoptózy.
Kontraindikace léčby IH propranololem jsou uvedeny v tabulce 8.
8. Kontraindikace léčby IH propranololem 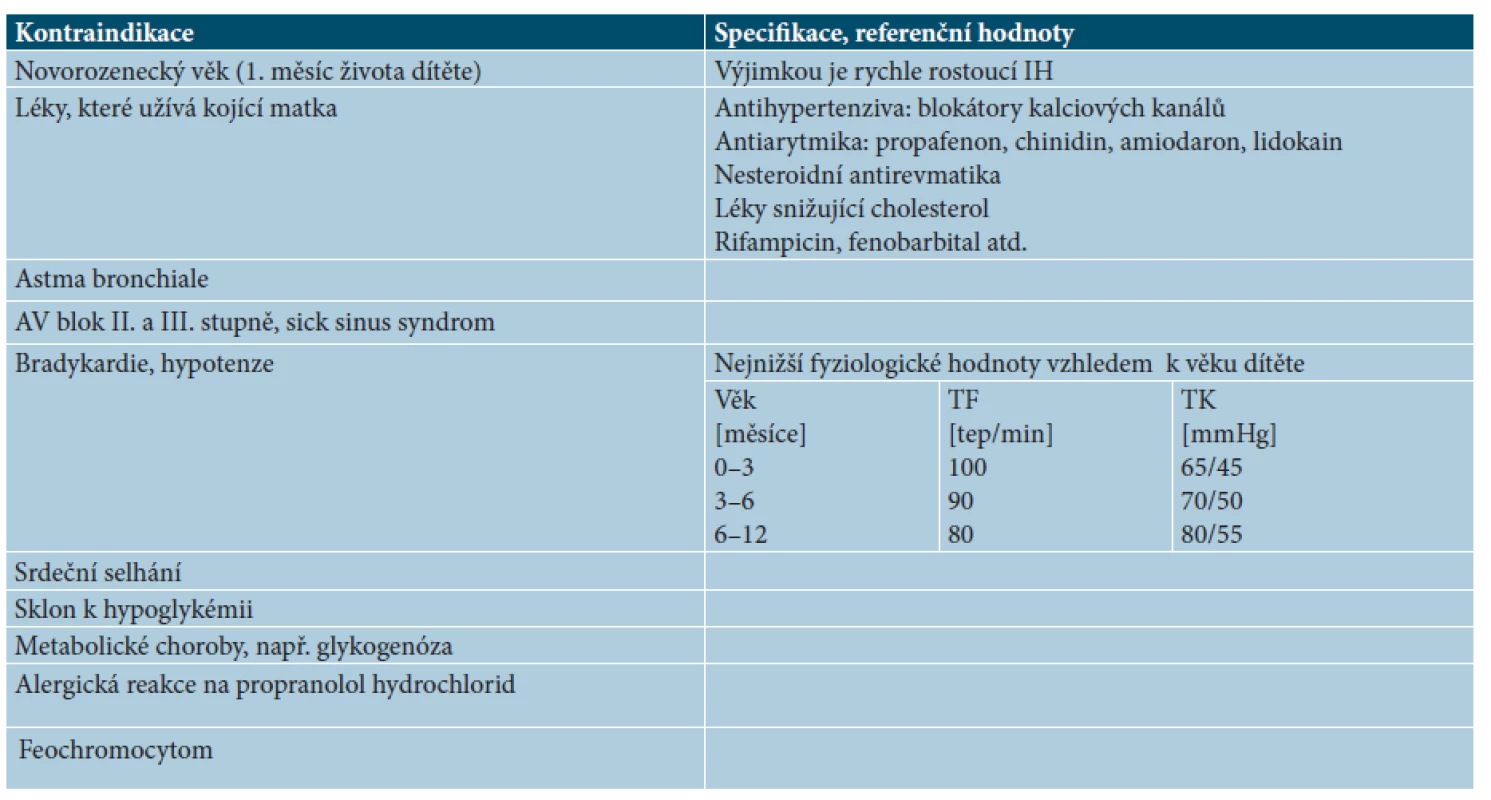
TF – tepová frekvence TK – krevní tlak Komplikace a nežádoucí účinky léčby propranololem
U 15–25% dětí léčených propranololem jsou pozorovány poruchy spánku, somnolence, podrážděnost, přechodné zvýšení jaterních enzymů, hypotenze, bradykardie. Mezi vzácnější nežádoucí účinky patří deprese, bronchospasmus, průjmy nebo zácpa, hypoglykémie, vazoneuróza, snížená chuť k jídlu vedoucí k neprospívání, poruchy metabolismu lipidů a hyperkalémie. Závažné vedlejší účinky u dětí s IH léčených propranololem nebyly dosud publikovany, a to vzhledem k nízkým terapeutickým dávkám propranololu. Další nežádoucí účinky jako bradykardie, hypotenze, bronchokonstrikce. Hypoglykémie u diabetiků jsou výjimečné, pokud jsou respektovány kontraindikace k nasazení propranololu (viz tab. 8).
Věk vhodný pro zahájení léčby propranololem
Optimální věk dítěte pro zahájení léčby propranololem vychází z fáze růstové aktivity IH, která trvá obvykle do 5.–12. měsíce věku dítěte, výjimečně až do 3. roku věku (u segmentálních a hlubokých hemangiomů).
Vstupní vyšetření před léčbou propranololem
- Anamnéza a klinické vyšetření
- Vstupní kardiologické vyšetření, EKG, ECHO
- Tepová a dechová frekvence
- Krevní tlak
- Laboratorní screening: krevní obraz s rozpočtem bílých krvinek, jaterní testy, urea, kreatinin, glykémie moč + sediment, eventuálně hemokoagulační vyšetření
- Zobrazovací metody (UZV, MRI, CT vyšetření, MRI a CT s kontrastem, RTG plic)
- Fotodokumentace, ultrazvukové vyšetření a dopplerovská analýza u hlubokých smíšených IH
Nasazení propranololu, dávkování
Randomizované studie prokázaly, že optimální denní dávka propranololu je 2–3 mg/kg, rozdělená do dvou až tří dávek. Propranolol se v průměru podává po dobu 6–7 měsíců. Při těchto dávkách jsou nežádoucí účinky terapie minimální.
Cílové dávky lze dosáhnout dvěma režimy:
- a) za hospitalizace, s postupným vytitrováním cílové dávky propranololu v průběhu 3 dnů. Při iniciační dávce propranololu 1 mg/kg/den se monitoruje tepová a dechová frekvence, krevní tlak 3krát po sobě v intervalu 1 hodiny. Po dalším navýšení dávky se uvedené parametry hodnotí 3krát denně.
- b) ambulantně, dávka propranololu se zvyšuje vždy o 1 mg/kg/den v týdenních intervalech. Po zahájení podávání propranololu se může objevit mírné asymptomatické snížení krevního tlaku a tepové frekvence, které jsou přechodné. Monitorování tepové frekvence a krevního tlaku je nutné za 1 a 2 hodiny po podání propranololu a při každém dalším navýšení dávky.
V případě bradykardie nebo hypotenze je vhodné dávku nenavyšovat, případně ji naopak snížit a potřebné navýšení dávky odložit až do úpravy sledovaných parametrů. Lék se podává s jídlem, aby se předešlo hypoglykémii. Pokud dítě opakovaně zvrací, má průjem nebo má sníženou chuť k jídlu, doporučuje se terapii propranololem přerušit [26].
Nasazení propranololu za hospitalizace je nutná v těchto případech:
- u nedonošených novorozenců a kojenců mladších 3 měsíců;
- u kojenců s IH v subglotické oblasti, v dýchacích cestách;
- u kojenců s přidruženými závažnými chorobami kardiovaskulárního systému a poruchami glukózového metabolismu;
- u dětí ze špatných sociálních poměrů.
Délka terapie propranololem
Standardní délka terapie je 6–7 měsíců, ale u pozvolné involuci IH léčba trvá 12 měsíců (viz obr. 14, 15, 16, 17). Léčbu je vhodné přerušit při obstrukční bronchitidě, bronchopenumonii, gastroinstestinálních obtížích (zvracení, průjem). Při ukončení léčby postupně snižujeme denní dávku propranololu v průběhu dvou týdnů. K monitorování efektu léčby je vhodné dítě vyšetřit v odstupu 3 a 6 měsíců od vysazení propranololu [22, 42, 43, 49, 50, 56, 57, 58]
- c) ostatní terapeutické možnosti
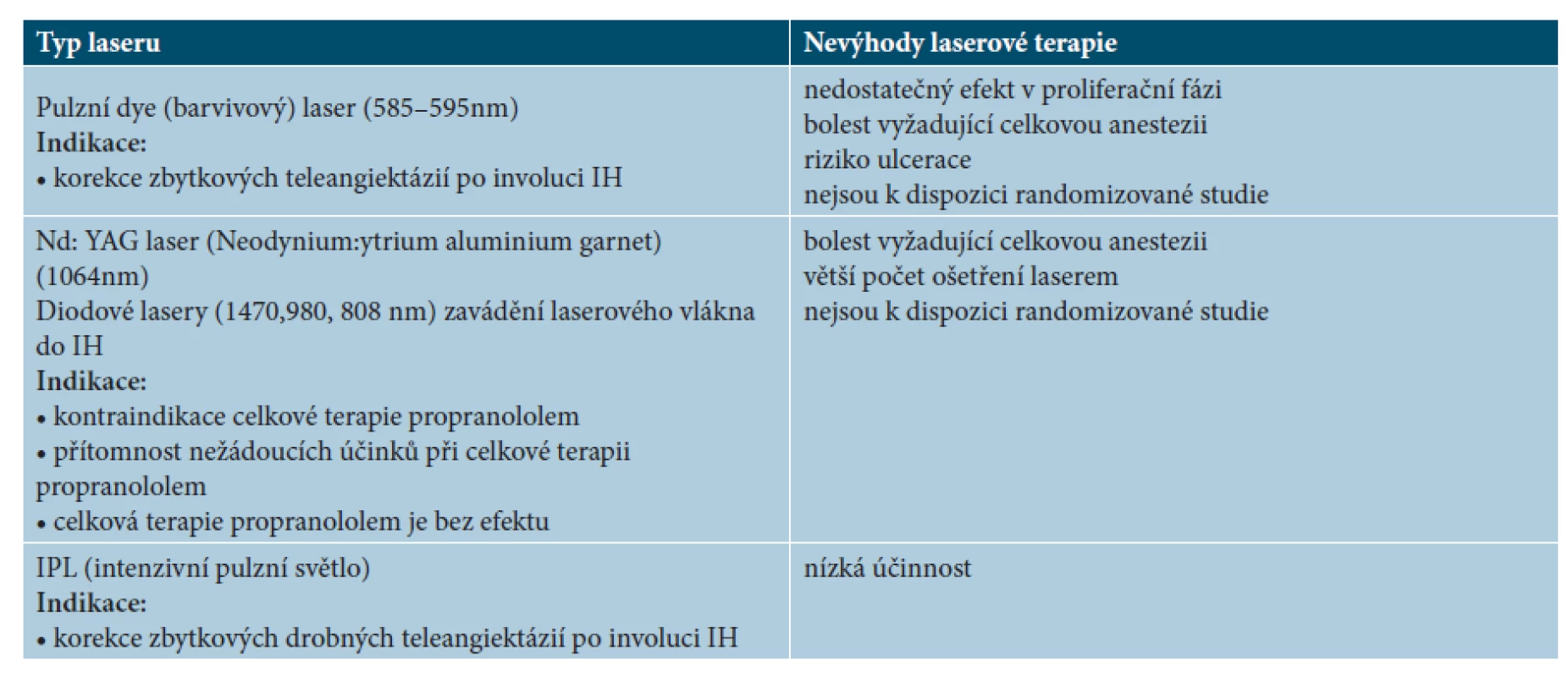
Laserová terapie
Fotoselektivní lasery jsou efektivní jen u drobných IH, většinou stačí k odstranění léze pouze jedno ošetření. Větší IH vyžadují opakovanou léčbu laserem, tato terapie je bolestivá a často vyžaduje výkon v celkové anestezii. U větších IH se fotoselektivní lasery doporučují k doléčení zbytkových lézí a teleangiektazií po skončení systémové terapie. Doporučuje se dostatečný časový odstup od vysazení propranololu pro očekávanou pokračující spontánní involuci IH, trvající většinou až do předškolního věku dítěte [31, 34, 35, 36, 38, 40, 60].
Využití fotoselektivních laserů v léčbě IH uvádí tabulka 9.
Chirurgická léčba
Odstranění IH plastických chirurgem je indikováno v místech, kde IH omezuje funkci orgánů: např. na obličeji v oblasti očních víček, nosního vchodu, zevního zvukovodu apod. Chirurgické odstranění je indikováno u kojenců, kde léčba nebyla účinná, IH ohrožuje správný vývoj postižené oblasti. V batolecím věku se chirurgicky řeší stopkaté a pendulující IH menšího rozsahu [18, 31, 34, 35, 36, 48].
Neurochirurg řeší IH v oblasti spina bifida, pokud způsobují útlak míchy a periferní neuropatii.
Výkony se provádějí v celkové anestezii na specializovaných pracovištích vybavených dětskou anesteziologií a intenzivní pooperační péčí pro děti.
Radioterapie a kryodestrukce jsou méně užívanými terapeutickými postupy.
Péče o pacienty s IH
Většina IH nevyžaduje žádnou léčbu, protože v průběhu měsíců až let spontánně involuje. Tyto IH by měly být diagnostikovány dermatologem a následně by pacienti měli být sledováni u praktického lékaře pro děti a dorost (PLDD). Nejasné a komplikované případy IH vyžadují péči na pracovišti s mezioborovým týmem specialistů, kteří mají zkušenost s diagnostikou a terapií cévních anomálií u dětí.
ZÁVĚR
IH patří mezi cévní anomálie. Klinické obrazy IH jsou velmi pestré a v průběhu věku dítěte se vyvíjí. Většina IH spontánně involuje. K urychlení involuce lze užít lokální terapii. Pouze 10–12% IH vyžaduje systémovou léčbu propranololem. Komplikované případy cévních anomálií u dětí by měly být sledovány v centru s multioborovým týmem specialistů se zkušenostmi s jejich diagnostikou a léčbou.
Do redakce došlo dne 20. 9. 2017.
Adresa pro korespondenci:
MUDr. Renata Faberová, Ph.D.
Dětské kožní oddělení PeK FN a LF MU
Černopolní 9
662 63 Brno
e-mail: faberova.renata@fnbrno.cz
Sources
1. ÁBARZÚA-ARAYA, A., NAVARRETE-DECHENT, C. P., HEUSSER, F. et al. Atenolol versus propranolol for the treatment of infantile hemangiomas: a randomized controlled study. J. Am. Acad. Dermatol., 2014, 70, p. 1045–1049.
2. ADAMS, M. T., SALTZMAN, B., PERKINS, J. A. Head and neck lymphatic malformation treatment a systematic review. Otolaryngol. Head Neck Surg., 2010, 147, p. 627–639.
3. AHOGO, C., EZZEDINE, K., PREY, S. et al. Factors associated with the relapse of infantile haemangiomas in chidren treated with propranolol. Brit. J. Dermatol., 2013, 169, p. 1252–1256.
4. BAULAND, C. G., LUNING, T. H., SMIT et al. Untreated hemangiomas:growth pattern and residual lesions. Plastic. Reconstr. Surg., 2011, 127, p. 1643–1648.
5. BAUMAN, N. M., SHIN, J. J., OH, A. K. et al. Propranolol vs prednisonole for symptomatic proliferating infantile hemangiomas a randomized clinical trial. JAMA Otolaryngol. Head and Neck Surg., 2014,140, p. 323–330.
6. BLEI, F. Congenital lymphatic malformation. Ann. N. Y. Acad. Sci., 2008, 1131, p. 185–194.
7. BLEI, F., MCELHINELLY, D. B., GUARINI, A. et al. Infantile heamangiomas with unsually prolonged growth phase:a case series. Arch. Dermatol., 2014, 144, p. 1632–1637.
8. BREUER, J. M., DE GRAAF, M., BREUGEM, C. C. et al. Hypoglycemia as a result of propranolol during treatment of infantile hemangioma:a case report. Pediatr. Dermatol., 2011, 28, p. 169–171.
9. CHAMLIN, S. L., HAGGSTROM, A. N., DROLET, B. A. et al. Multicenter prospective study of ulcerated hemangiomas. J. Pediatr., 2007, 151, p. 684–689.
10. CHAN, H., MCKAY, C., ADAMS, S. et al. RCT of timolol maleate gel for superficial infantile hemangiomas in 5-24 week-olds. Pediatrics, 2013, 131, p. 1739–1747.
11. CHEN, T. S., EICHENFIELD, L. F., FRIEDLANDER, S. F. Infantile Hemangiomas:an Update on pathogenesis and therapy. Pediatrics, 2013, 131, p. 99–108.
12. DEL FRARI, L., DELARUE, A. Data on File (Pierre Fabre). Presented at World Congress od Pediatric Dermatology, Madrid 2013.
13. DROLET, B. A., FROMMELT, P. C., CHAMLIN, S. I. et al. Initiation and use propranolol for infantile hemangioma: report of a consensus konference. Pediatr., 2013, 131, p. 128–140.
14. DROLET, B. A., POPE, E., JUERN, A. M. et al. Gastrointestinal bleeding in infatile hemangioma: a complication of segmental, rather than multifocal infantile hemangiomas. J. Pediatr., 2012, 160, p. 1012–1016.
15. Faberová, R.: Hemangiomy u dětí. Referátový výběr z dermatovenerologie, 2015, s. 11 - 29.
16. Faberová, R., Bučková, H., Feit, J.: Hemangiomy u dětí. Čes-slov. Derm., 2002, 77, č. 4, s. 178-182, ISSN 0009-0514.
17. FABEROVÁ, R., PROCHÁZKA, J., CHARVÁTOVÁ, M. Nové poznatky léčby hemangiomů u dětí, jejich diferenciální diagnostika. Dermatol. pro praxi, 2009, 3, p. 75–77.
18. FABEROVÁ, R. Diagnostické přístupy a terapeutické možnosti periferních cévních anomálií u dětí. Disertační práce, 2003.
19. FEIT, J. Atlas dermatopatologie. Dostupné na www.atlases.muni.cz, 2003.
20. FIILLIPI, L., CAVALLARO, G., BAGNOLI, P. et al. Oral propranolol for retinopathy of prematurity: risks, safety concens, and perspectivex. J. Pediatr., 2013, 163, p. 1570–1577.
21. FLETCHER, D. CH. M., UNNI, K., MERTENS, F. Pathology and Genetics of Tumours of Soft Tissue and Bone. IARCPress: Lyon 2002. ISBN 92 832 2413 2.
22. GIACHETTI, A., CARCIA-MONACO, R., SOJO, M. et al. Long-ter, tratment with oral propranolol reduces relapses of infantile hemangiomas. Pediatr. Dermatol., 2014, 31, p. 14–20.
23. GIRARD, C., BIGORRE, M., GUILLOT, B. et al. Pelvis syndrome. Arch. Dermatol., 2006, 142, p. 884–888.
24. GNARRA, M., SOLMAN, L., HARPER, J. I. et al. Propranolol and prednisolone combination for the tratment of segmental hemangioma in PHACES syndrome. Br. J. Dermatol., 2015, Doi:10.111/bjd.13588. Epub a head of print.
25. GREENBERGER, S., BISCHOFF, J. Pathogenesis of infantile hemangioma. Brit. J. Dermatol., 2013, 136, p. 12–19.
26. HACHISUGA, M., TSUKIMORI, K., HOJO, S. et al. Prenatal diagnosis of a retroperitoneal lymphangioma: a case and review. Fetal Diagnosis and Therapy, 2008, 24, p. 177–181.
27. HARPER, J. I. Neonatal haemangiomatosis associated with placental chorangiomas: report of three cases and review of the literature. Clin. Exp. Dermatol., 2009, 34:e78–80.
28. HENGST, M., OELERT, M., HOEGER, P. H. Blood pressure monitoring during the induction and maintenance period of propranolol therapy for complicated infantile hemangiomas. A prospective study of 109 infants. Pediatr. Dermatol., 2015.
29. HERMANS, D. J., BOEZEMAN, J. B., VAN DE KERKHOF, P. C. et al. Differences between ulcerated and non-ulcerated hemangioma:indications safety and future directions. Brit. J. Dermatol., 2009, 168, p. 152–156.
30. HERMANS, D. J., BAULAND, C. G., ZWEGGERS, J. et al. Propranolol in a case series of 174 patients with complicated infantile hemangioma: indications, safety and future directions. Brit. J. Dermatol., 2013, 168, p. 837–843.
31. HOEGER, PETER. H., HARPER, JOHN. I., BASELGA et al. Treatment of infantile haemangiomas: recommendations of a European expert group. Eur. J. Pediatr., May, 2015.
32. HOGELING, M., ADAS, S.,WARGON, O. A randomized controlled trial of propranolol for infantile hemangiomas. Pediatrics, 2011, 128, p. 259–266.
33. HOLLAND, K. E., FRIEDEN, I. J., FROMMELT, P. C. et al. Hypoglycemia in children taking propranolol for the treatment of infantile hemangioma. Arch. Dermatol., 2010, 146, p. 775–777.
34. HURWITZ, S., PALLER, AMY. S., MANCINI et al. Clinical Pediatric Dermatology, A Textbook of Skin Disorders of Childhood and Adolescence. Third edition, 2006, p. 307–344. ISBN0323026117.
35. HURWITZ, S., PALLER, AMY. S. et al. Clinical Pediatric Dermatology. A Textbook of Skin Disorders of Childhood and Adolescence. 4th edition 2011, p. 268–299, ISBN9781437704129.
36. HURWITZ, S., PALLER, AMY. S. et al. Clinical Pediatric Dermatology. A Textbook of Skin Disorders of Childhood and Adolescence.
5th edition 2015, p. 279–304, ISBN 9780323244756.
37. International Society for the Study of Vascular Anomalies. ISSVA classification of vascular anomalies. 2014.issva.org/classification.
38. KAGAMI, S., KUWANO, Y., SHIBATA, S. et al. Propranolol Propranolol is more effective than pulsed dye laser and cryosungery for infantile hemangiomas. Eur. J. Pediatr., 2013,172, p. 1521–1526.
39. KAYLANI, S., THEOS, A. J., PRESSEY, J. G. Treatment of infantile hemangiomas with sirolimus in patient with PHACE syndrome. Pediatr. Dermatol., 2013, 30, p. 194–197.
40. KLAUZOVÁ, K. Přehled laserů používaných v estetické dermatologii. Referátový výběr z dermatovenerologie, 2014, 6, p. 24–29.
41. LANGLEY, A., POPE, B. Propranolol and central nervous system function: potential implication for pediatric patients with infantile hemangiomas. Br. J. Dermatol., 2015, 172, p. 12–23.
42. LÉAUTÉ-LABRÈZE, C. Propranolol for severe hemangiomas of infancy. N. Engl. J. Med., 2008, 358, 24, p. 2649–265.
44. LÉAUTÉ-LABRÈZE, C., BOCCARA, O. Safety of Oral Propranolol for the Treatment of Infantile Hemangioma. A Systematic Review. Pediatrics, 2016, 2016 Oct., 138(4).
45. LÉAUTÉ-LABRÈZE, C., HARPER, J. I., HOGER, P. H. Infantile haemangioma. Published:12, January 2017. DOI:http://dx.doi.org/10.1016/S0140-6736(16)00645-0.
46. LÉAUTÉ-LABREZE, C., PREY, S., EZZEDINE, K. Infantile hemangioma: part I. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities. J. Eur. Acad. Dermatol. Venereol., 2011, 25, p. 1245–1253.
47. LÉAUTÉ-LABREZE, C., PREY, S., EZZEDINE, K. Infantile hemangioma: part II. Risks, complications and treatment. J. Eur. Acad. Dermatol. Venereol., 2011, 25, p. 1254–1260.
48. LEBOIT, E. P., BURG, G., WEEDON, D. et al. Pathology and Genetics of Skin Tumours. IARCPress: Lyon 2006. ISBN 92 832 2414 0.
49. MALIŠ, J. Hemangiomy kojenců. Česká dermatovener., 2014, 4, 1, p. 7–13.
50. MALIŠ, J., STARÁ, V. et al. Betablokátory v léčbě hemangiomů dětského věku. Čes.-Slov. Ped., 2014, 69, 5, p. 274–282.
50. MARQUELING, A. L., OZA, V., FRIEDEN, I. J. et al. Propranolol and infantile hemangiomas four years later: a systematic review. Pediatr. Dermatol., 2013, 30, p. 182–191.
51. MARUANI, A., PIRAM, M., SIRINELLI, D. et al. Visceral and mucosal involvement in neonatal haemangiomatosis. J. Eur. Acad. Dermatol. Venereol., 2012, 26, p. 1285–1290.
52. MENAPACE, D., MITKOV, M.,TOWBIN, R. et al. The changing face of complicated infantile hemangioma treatment. Pediatr. Radiol., 2016, Oct., 46, 11, p. 1494–506.
53. METRY, D., FRIEDEN, I. J., HESS, C. et al. Propranolol use in PHACE syndrome with cervical and intracranial arterial anomalies: collective experience in 32 infants. Pediatr. Dermatol., 2013, 30, p. 71–89.
54. MUNDEN, A., BUTSCHEK, R., TOM, W. L. et al. Prospective study of infantile haemangiomas: incidence clinical characteristics and associacion with placental anomalie. Brit. J. Dermatol., 2014, 170, p. 907–913.
55. PARIKH, S., DARROW, D. H., GRIMMER, J. F. et al. Propranolol use for infantile hemangiomas. American Society of Pediatric Otolaryngology Vascular Anomalies Task Force Practice Patterns. JAMA Otol. Rhinol. Head Neck Surg., 2013, 139, p. 153–156.
56. RUTTGEN, K. B., SUMMERER, B., SCHNEIDER, J. et al. Cardiovascular and blood Glucose parameters in infants during propranolol intitiation for tratment of symplomatic infantile hemangiomas. Am. Otol. Rhinol. Laryngol., 2013, 122, p. 550–554.
57. SOLMAN, L., MURABIT, A., GNARRA, M. et al. Propranolol for infantile haemangiomas; single centre experience of 250 cases and proposed therapeutic protocol. Arch. Dis. Child., 2014, 99, p. 1132–1136.
58. SCHUPP, C. J., KLEBER, J. B., GUNTHER, P. et al. Propranolol therapy in 55 infants with infantile hemangioma: dosage, duration, adverse effects, and outcome. Pediatr. Dermatol., 2011, 28, p. 640–644.
59. STOCKMAN, A., BORALEVI, F., TAIEB, A. et al. Sacral syndrome spinal dysraphism, anogenital, cutaneous, renal and urologic anomalies, associeted with an angioma of lumbosacral localization. Dermatol., 2007, 214, p. 40–45.
60. ŠMUCLER, R. Vysoce efektivní léčba hlubokých hemangiomů a arteriovenózních malformací intralezionálním laserem. Referátový výběr z dermatovenerologie, 2015, 3, s. 29–35.
61. VERGINE, G., MARSCIANI, A., PEDINI, A. et al. Efficacy of propranolol tratment in thyroid dysfunction associated with severe infantile hepatic hemangioma. Horm. Res. Pediatr., 2012, 78, p. 256–260.
62. UEBELHOER, M., BOON, M. L., VIKKULA, M. Vascular Anomalies From Genetics toward Models for Therapeutic Trials. Cold Spring Harb. Perspect. Med., 2012, 2:a009688.
63. VREDENBORG, A. D., JANMOHAMED, S. R., DE LAAT, P. C. J. et al. Multiple cutaneous infantile haemangiomas and the risk of haemangioma. Brit. Dermatol., 2013, 169, p. 188–191.
64. ZHENG, WEI. J., ZHANG, L., ZHOU, Q. et al. A practical quide treatment of infantile hemangiomas of the head and neck. Int. J. Clin. Exp. Med., 2013, 6, p. 851–860.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2017 Issue 5
Most read in this issue
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career