-
Medical journals
- Career
Psychofarmaka v dermatologii
Authors: R. Pánková
Authors‘ workplace: Dermatovenerologická klinika 1. LF UK a VFN přednosta prof. MUDr. Jiří Štork, CSc.
Published in: Čes-slov Derm, 89, 2014, No. 3, p. 95-106
Category: Reviews (Continuing Medical Education)
Overview
Význam psychofarmakologie a psychoterapie v dermatologické praxi stále narůstá. Autorka pojednává základní klasifikaci psychických poruch v klinické dermatovenerologii, význam psychosomatického přístupu, který zahrnuje celostní přístup k člověku ve zdraví a nemoci a biopsychosociální jednotu člověka. Uvádí zásady racionálního předepisování psychotropních léků, poskytuje přehled hlavních skupin klasických i moderních psychofarmak (anxiolytika, antidepresiva, thymoprofylaktika, hypnotika, antipsychotika a nootropní látky) včetně jejich indikací, vedlejších účinků a významu v dermatovenerologii. Vznik stále nových psychotropních látek a složitost dermatovenerologických nemocných s psychickými poruchami vyžaduje mezioborovou spolupráci dermatovenerologů, klinických psychologů a psychiatrů konzultantů, a umožňuje tak uplatnění vědeckých poznatků psychoneuro-endokrino-imunologických.
Klíčová slova:
psychodermatologie – psychofarmaka – psychofarmaka v dermatovenerologiiMotto:
„Rozpaky z nedostatku psychofarmak se během 40 let změnily v rozpaky z nadbytku psychofarmak.“
(Prof. MUDr. Vladimír Vondráček, DrSc.)
ÚVOD
Vývoj nových psychotropních látek průběžně pokračuje a narůstá i jejich preskripce. Základní poznatky o psychofarmakách se proto dotýkají i současné dermatovenerologie [13, 34, 45]. Klinické studie potvrzují, že s psychickými poruchami se dermatologové setkávají přibližně u jedné třetiny ambulantních pacientů [1]. Z porovnání zásadní podmíněnosti některých dermatóz činiteli psychosociální povahy a naopak zpětného účinku kožního onemocnění na psychosociální postoje a chování kožních pacientů, vyplývají snahy diagnosticky postihnout a léčebně ovlivnit oba tyto póly současně [40]. Přesné vymezení indikace jednotlivých skupin psychotropních látek je obtížné, protože psychogeneze kožních projevů může být rozdílná. Pozorovali jsme například obdobný, klinicky neodlišitelný, sekundární kožní nález u pacientů s neurotickou, ale i psychotickou symptomatologií, u anxiózně - depresivní poruchy, schizofrenie, depresivní poruchy bipolární i reaktivní, ale i bludné parazitózy [41].
Ke stanovení správné psychodermatologické diagnózy přispívá i psychodynamická interpretace somatických obtíží pacienta včetně porozumění somatizaci, rozpoznání úzkosti a deprese, případně sebevražedného chování nemocného. Jedna pětina ambulantních kožních pacientů psychotropní léky již užívá [47]. Výskytu nežádoucích účinků psychofarmak a lékových interakcí s dermatologickými systémovými léky se snažíme zabránit podrobnou farmakologickou anamnézou a informacemi získanými např. na: www.medigrid.cz/interakce [4].
Dermatolog se také setkává se skutečností, že celková kožní léčba může být příčinou rozvoje psychických poruch; kortikosteroidy mohou být příčinou deprese nebo hypománie u 5 % pacientů, méně známé jsou psychózy vyvolané antimalariky a sulfony. U pacientů s narušenými renálními funkcemi mohou antivirotika vyvolat psychózu [53].
Klasifikace psychických poruch v klinické dermatologii
- Psychofyziologické poruchy se vyskytují u dermatóz závislých na vrozených faktorech nebo na vlivu prostředí, jejichž klinický průběh je citlivý na psychosociální stres – atopický ekzém, psoriáza, dyshidrotický ekzém, acne vulgaris, seborroická dermatitida, rosacea, periorální dermatitida, herpes simplex recidivans, pemphigus vulgaris, alopecia areátní i difuzní, lichen planus, urticaria chronica [9, 36, 37, 43, 51].
- Primárně psychiatrické poruchy jsou čistě psychického charakteru bez kožních příčin, všechny klinické projevy na kůži jsou sekundární, způsobené samotným pacientem, např. blud parazitů v kůži (delusions of parasitosis – DP) – monosymptomatická psychóza, často v rámci involuční deprese, naléhavost bludu bývá značná, indukované formy jsou časté.
Dále sem patří také:- arteficiální dermatitida – psychogeneze různá;
- neurotické exkoriace (skin picking) – návykové chování;
- dysmorfofobie – porucha vnímání vzhledu vlastního těla;
- obsedantně kompulzivní porucha (obsessive-compulsive disorder – OCD);
- bromidrosis – solitární blud zápachu vlastního těla,
- trichotillománie, onychofagie – poruchy kontroly impulsů [2, 5, 7, 14, 19, 24, 35, 39, 46, 52, 58, 67].
- Sekundárně psychiatrické poruchy se objevují u klinicky závažných dermatóz, acne cystica, vitiligo, alopecia areata, maligní melanom, dále u dermatóz, které silně svědí a vyvolávají neklid, úzkost, depresi a nespavost – psychické poruchy reaktivní [22, 23, 26, 50].
- Narušené pocity vnímané kůží jako jsou pálení, bodání, nepříjemné pocity na kůži, a to bez primárního kožního onemocnění. Psychiatrická porucha může a nemusí být doprovodným příznakem [66].
- Nepsychiatrické kožní poruchy, u kterých byla obvyklá dermatologická léčba neúčinná a empiricky se osvědčila psychofarmaka, např. u lokalizovaného pruritu, chronické urtikarie a postherpetických neuralgií [44, 62].
Léčebné postupy, které spojují psychosomatický přístup k pacientovi, kožní odbornou léčbu, psychoterapii a cílenou farmakoterapii, bývají v psychodermatologii účinnější. Spolupráce dermatologa s klinickým psychologem a psychiatrem konzultantem je u některých kožních pacientů nezbytná [5, 10, 11, 30, 38].
PSYCHOFARMAKA
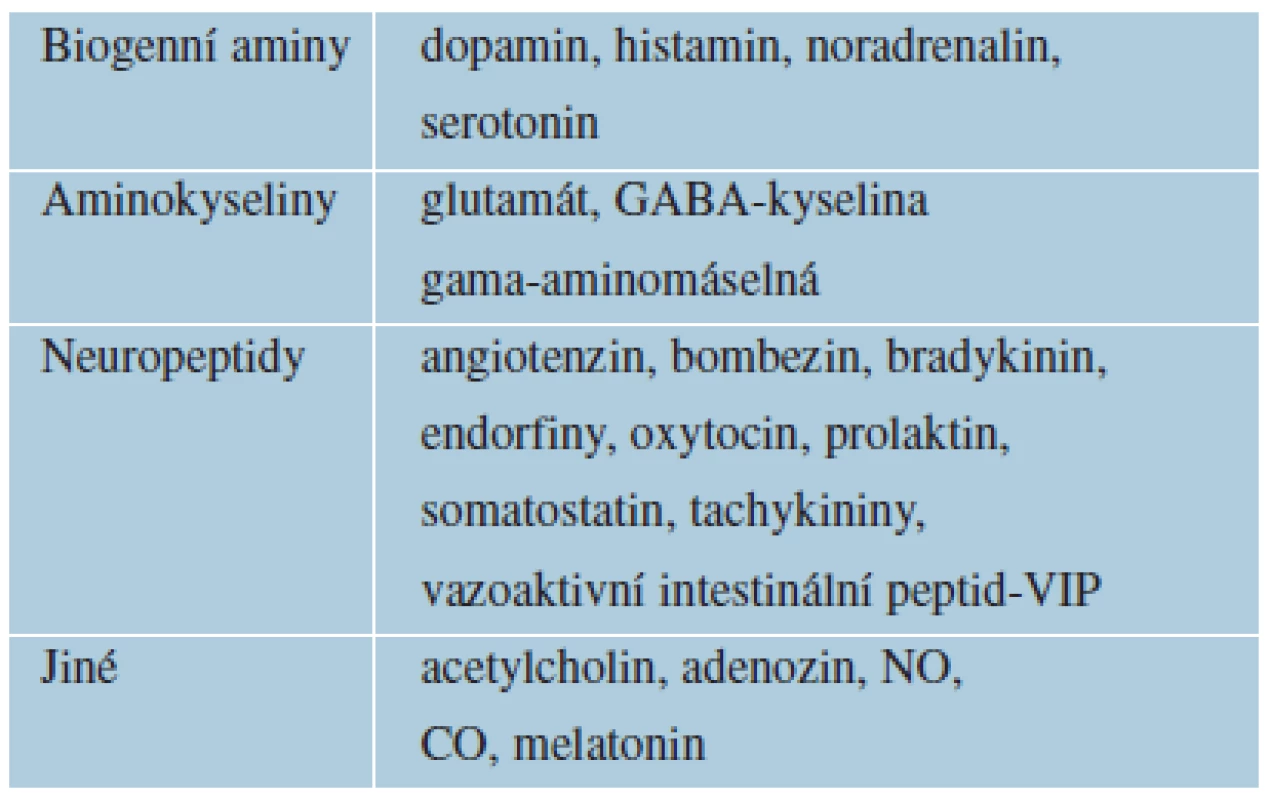
Psychofarmaka jsou definována jako léky s primárním účinkem na centrální nervový systém (CNS). Ovlivňují chemickou neurotransmisi v CNS. Přenos signálu mezi neurony a uvnitř neuronů lze ovlivnit změnou koncentrace neurotransmiterů či změnou funkce příslušných receptorů, umístěných pre - a postsynapticky. Obecná psychofarmakologie se zabývá farmakodynamikou a farmakokinetikou psychotropních látek [61]. Neurotransmitery jsou označovány za první posly (first messengers) činné v synaptické štěrbině. Přehled hlavních neurotransmiterů uvádí tabulka 1. Vazbou neurotransmiterů na receptory nebo iontové kanály se spustí kaskáda dalších intracelulárních změn zprostředkovaných sekundárními posly (cyklický adenosinmonofosfát – cAMP, inositoltrifosfát, kyselina arachidonová aj.). Terciárními posly jsou fosforylované proteiny, které aktivují transkripční faktory v jádru neuronů a poté expresi časných a pozdních genů [25]. Psychotropní látky působí současně na více funkcí v CNS a intenzita účinku je rozdílná. Přesné rozdělení je proto obtížné. Hlavní skupiny psychofarmak představují anxiolytika, antidepresiva, thymoprofylaktika, hypnotika, antipsychotika a nootropní látky.
Léčba psychofarmaky vyžaduje individuální léčebný postup a psychoedukaci pacienta.
Zásady racionálního předepisování psychotropních léků:
- Primárně získat psychiatrickou anamnézu.
- Znát farmakologii a interakce předepisovaných léků (viz www.medigrid.cz/interakce).
- Rozlišovat individuální snášenlivost léků, začít s nízkou dávkou a pomalu ji zvyšovat.
- Vysvětlit pacientovi případné vedlejší účinky léku, které se v průběhu léčby většinou zmírňují, a podpořit tak spolupráci a vytrvání pacienta v léčbě – compliance a adherence.
- Pozor na riziko návyku a vzniku lékové závislosti – benzodiazepinová anxiolytika, hypnotika.
- Zohlednit vliv farmakoterapie na pozornost pacienta – řízení motorových vozidel, obsluha strojů.
- Zajistit pacientovi psychoterapii.
- U pacientů vyššího věku a somaticky nemocných pacientů jsou nutné nižší dávky psychofarmak, pouze 20 až 50 % obvyklých dávek ve středním věku, s ohledem na celkový stav nemocného.
- Ve stáří je vyšší senzitivita k neurotransmiterům a výskyt vedlejších účinků je daleko častější.
- Anxiolytický účinek benzodiazepinových preparátů ve stáří klesá a stoupá účinek tlumivý, prodlužuje se poločas rozpadu a riziko intoxikace se zvyšuje, ve stáří snáze dochází k amentnímu syndromu, proto platí zásada „co nejméně lékových kombinací“, dlouhodobé podávání benzodiazepinů silně omezuje aktivitu seniorů.
- U starších pacientů hrozí nebezpečí rozvoje extrapyramidového syndromu (ES), hypotenze, závrati, obstipace, poruchy převodového systému srdečního, stavy zmatenosti, dysurické obtíže, retence moči, hypertrofie prostaty.
- Kombinace psychofarmak s diuretiky a kardiotoniky může potencovat toxicitu zvláště thymoleptik.
- Pozor na lékové interakce některých psychofarmak a kožních léků s metabolismem přes cytochrom P450. Důsledkem může být zpomalení nebo zrychlení metabolismu a nežádoucí hladiny léku v krvi. Cytochrom P450 (zkratka CYP) označuje rozsáhlou skupinu hemoproteinových enzymů. Tyto enzymy se podílejí na metabolismu více než 50 % prodávaných léčiv. Mezi metabolicky nejvýznamnější lidské CYP patří forma 3A4 (metabolizuje amiodaron, diazepam, třezalku, cyklosporin), 2C9 (metabolizuje ibuprofen) a 2D6 (tricyklická antidepresiva, kodein) [48].
PŘEHLED A CHARAKTERISTIKA JEDNOTLIVÝCH SKUPIN PSYCHOFARMAK
Úzkostně-depresivní poruchy bývají u kožních nemocných časté. Úzkost má do určité míry funkci adaptivní a může dokonce zvyšovat výkon jedince. Objevuje-li se příliš často, dlouho trvá, v nadměrné intenzitě a neadekvátně situaci, stává se nepříjemným emočním stavem. Na rozdíl od fobie nemá konkrétní obsah a projevuje se tělesně – palpitacemi, pocením, třesem, zrychlenou střevní peristaltikou; psychicky – zvýšenou psychickou tenzí, strachem, trémou a chováním – blokem, útěkem. K rozvoji úzkostných poruch vedou maladaptivní způsoby zvládání stresu nebo výrazné stresové, traumatické události. Patická úzkost je komplexní psychická porucha, v jejíž patogenezi se uplatňuje více neurotransmiterových systémů. Úzkostné poruchy rozlišujeme podle klinického průběhu na akutní, chronické nebo panické poruchy a fobie. Léčba úzkostných poruch zahrnuje psychoterapii a psychotropní léky snižující úzkost – anxiolytika [18].
A. Anxiolytika mají účinky anxiolytické, hypnosedativní, antikonvulzivní a myorelaxační. Rozdělení anxiolytik uvádí tabulka 2. Úzkost odstraňují i jiné psychotropní léky – antidepresiva, antipsychotika a betablokátory. Léčba anxiolytiky, propandioly a benzodiazepiny by měla trvat krátce, nejdéle 6 týdnů. Riziku rozvoje lékové závislosti lze předejít zahájením léčby současným podáním anxiolytika s antidepresivem. Anxiolytický účinek antidepresiva se sice uplatní později, ale na rozdíl od anxiolytika nevyvolává návyk.
Nebenzodiazepinová anxiolytika zahrnují propandioly – deriváty myorelaxancií typu tolperisonu (Mydocalm®), hydroxyzin (Atarax®) a buspiron hydrochlorid (Buspiron®, Anxiron®).
Hydroxyzin (Atarax®) je nebenzodiazepinové piperazinové anxiolytikum uvedené na trh již v roce 1955. Působí mírně anxiolyticky, silněji sedativně/hypnoticky, myorelaxačně, anti-H1-histaminově, slabě anticholinergně, antiemeticky, bronchodilatačně a potencuje účinek analgetik. Tlumivý účinek se projevuje subkortikálně, zvláště v oblasti retikulární formace a limbického systému. Nevyvolává závislost ani abstinenční syndrom. Hlavním aktivním metabolitem hydroxyzinu je antihistaminikum cetirizin (Zyrtec®). Kontraindikace Ataraxu jsou porfyrie, respirační insuficience, kongestivní glaukom, hypertrofie prostaty a stavy zmatenosti. Opatrnosti je třeba u i pacientů s kontaktními čočkami (suchost sliznic), bronchiálním astmatem a epilepsií. Nežádoucí účinky Ataraxu jsou nejčastěji ospalost a únava, závratě, suchost sliznic, hypotenze, méně často fotosenzitivita, nauzea, vomitus a při vyšších dávkách riziko vzniku epilepsie. Interakce Ataraxu zesiluje účinky všech tlumivě působících psychofarmak na CNS. Denní dávkování je 30–100 mg, individuální snášenlivost je rozdílná.
Buspiron (Buspiron®, Anxiron®) je zástupcem skupiny nebenzodiazepinových anxyolitik. Působí proti úzkosti a chorobnému strachu. Během užívání se neobjevuje ospalost, svalová slabost ani poruchy kognitivních funkcí, nezvyšuje se tlumivý účinek alkoholu. Anxiolytický účinek se rozvíjí v 7–10 dnech, maximální účinnost léku se plně uplatní až za 4 týdny. Nežádoucí účinky se projevuií zvracením, zažívacími potížemi, bolestí hlavy, závratí, nervozitou, podrážděností a nespavostí. Interakce s inhibitory cytochromu P450-3A4 zvyšují sérové hladiny buspironu, např. systémová antimykotika, cyklosporin. Počáteční dávka je 3krát 5 mg denně, obvyklá denní dávka je 5–30 mg rozdělená do dvou až tří dávek.
Benzodiazepinová anxiolytika se rozdělují podle vylučovacího poločasu (tab. 3). Nejčastější nežádoucí účinky benzodiazepinových anxiolytik jsou únava a denní ospalost, ataxie (porucha koordinace pohybů), někdy zmatenost a hypotenze, zejména u starších osob, paradoxní uvolnění vzteku a agrese, anterográdní amnézie (tj. neschopnost zapamatovat si podněty aplikované několik hodin po rušivém zásahu), amotivační syndrom, riziko vzniku závislosti, útlum dýchacího centra (zvláště v kombinaci s jinými látkami působícími tlumivě na CNS), možnost vzniku kongenitálních malformací. Kontraindikace představují myasthenia gravis, intoxikace tlumivými látkami a alkoholem, drogová závislost, glaukom s uzavřeným úhlem, těžší poruchy jater a ledvin a první trimestr gravidity a kojení.
Table 3. Rozdělení benzodiazepinových anxiolytik 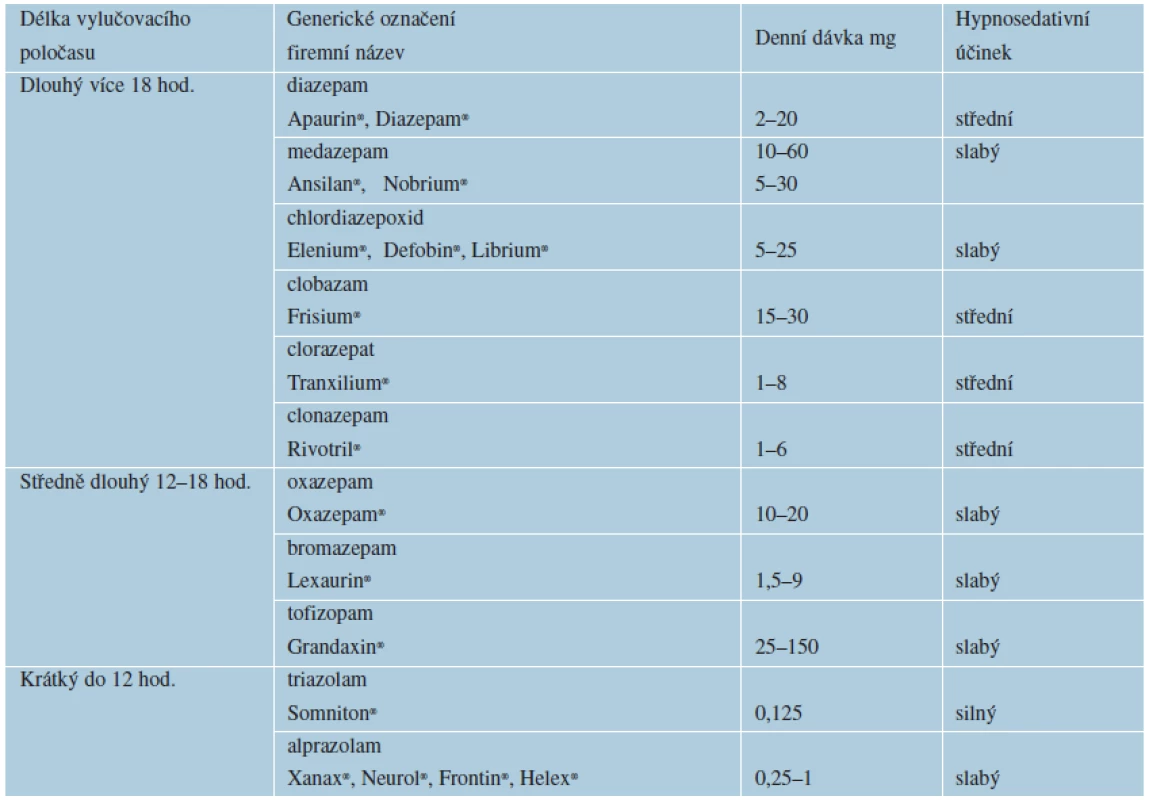
Nižší dávkování pro dermatologické účely Indikace anxiolytik v dermatovenerologii: svědící dermatózy vyvolávající neklid, úzkost, nespavost. Psychoterapie zvyšuje účinnost farmakoterapie [31, 33].
Depresivní poruchy – afektivní poruchy – poruchy nálady
Deprese je provázena funkčními a strukturálními odchylkami mediální prefrontální kůry, zadní a zevní orbitofrontální kůry, amygdaly, hipokampu a ventromediálních částí bazálních ganglií, endokrinními a imunitními poruchami. Představuje duševní poruchu, která se vůlí nedá zvládnout [8, 27, 28].
Klinické příznaky se projevují smutnou náladou po většinu dne, zřetelně sníženým zájmem o sebe i okolí, anhedonií, která znamená neschopnost radovat se (hedónia je vědomý pocit něčeho příjemného, představuje afektivní složku štěstí – obr. 1, eudamónia znamená správně a vyrovnaně žitý život), apatií, významnou ztrátou hmotnosti a sníženou chutí k jídlu (90 %) nebo příbýváním na hmotnosti a zvýšenou chutí k jídlu (10 %) u atypické deprese, insomnií nebo hypersomnií, psychomotorickou agitovaností nebo retardovaností, úzkostí, únavností nebo ztrátou energie, pocity méněcennosti nebo nadměrné viny, které se někdy stupňují až k autoakuzacím. Pacienti si stěžují na sníženou schopnost soustředění, rozhodování, na opakované suicidální myšlenky. Nápadné bývají změny v chování nemocného. Podle závažnosti rozlišujeme depresivní poruchy lehké, středně těžké, těžké s psychotickými symptomy (Hamiltonova stupnice pro deprese, Hamilton psychiatric Rating Scale, HMRD). Pokud se u jednoho pacienta střídají jak epizody depresivní, tak manické, trpí bipolární afektivní (maniodepresivní) poruchou – BAP (F31) [1].
Image 1. Hédonický mozek Vyznačené oblasti jsou uzly oboustranné neuronální sítě velkého rozsahu („konektomu“) Zdroj: Koukolík, F.: Základy kognitivní, afektivní a sociální neurovědy XXV. O štěstí – hédonický mozek. Prakt. Lék., 2013, 1, s. 10–15. 
Symptomatická deprese je druhotná při některých tělesných onemocněních – po infarktu myokardu, po chřipce, po silném krvácení, anémii [3]. Deprese se vyskytuje i při organickém postižení mozku – nádorem, zánětem, atrofií. V průběhu tzv. maskované deprese jsou tělesné symptomy zcela v popředí. Depresivní porucha je rovněž součástí klinického obrazu jiných psychických nemocí, např. alkoholismu, mentální anorexie a toxikománie. Riziko rozvoje chronicity deprese a sebevražedného jednání je vysoké. Stále asi 10 % nemocných s afektivní poruchou končí život dokonanou sebevraždou [56].
Přibližně 25 % pacientů s kožním onemocněním trpí poruchou nálady, 13 % z nich se setkalo s příznaky těžké deprese. Sekundární depresí obvykle trpí pacienti s areátní alopecií, atopickým ekzémem, chronickou kopřivkou, psoriázou, sklerodermií, maligním melanomem, vitiligem [1, 23, 33].
V průběhu somatoformní poruchy si pacient stěžuje na netypické zdravotní obtíže bez závažného somatického nálezu – nespecifické srdeční a oběhové nebo gastrointestinální potíže, změnu chuti k jídlu, psychickou podrážděnost, únavu a pocity úbytku sil, svědění kůže [6].
Dysmorfofobie (obsessive-compulsive disorder – OCD) je hypochondrická tělesná stížnost (domnělý vzhledový deficit) bez organického nálezu, která se u kožních pacientů vyskytuje až v 10 % případů, zatímco v běžné populaci u 1–2 %. Bývá spojena s depresivně-úzkostnou poruchou nebo poruchou příjmu potravy. Klinicky se projevuje neurotickými exkoriacemi (skin picking), trichotillománií. Trýznivé prožívání dysmorfofobie může vést k sebepoškozujícímu jednání a sebevražednému chování. Pacient zpočátku hledá čistě medicínské vysvětlení i řešení a žádá nová vyšetření laboratorní, přístrojová a opakované korektivní dermatologické výkony. Výskyt dysmorfofobie se bude pravděpodobně zvyšovat u disponovaných jedinců spolu se současným upřednostňováním vzhledu před jinými vlastnostmi. Na vytváření nerealistických vzorů fyzického zevnějšku se podílejí i média [7].
Fyziologický proces stárnutí kůže je mylně považován v současnosti za nemoc. Kožní rejuvenaci vyhledávají i jedinci mladší 30 let, s nereálnými představami a očekáváními. Léčba dysmorfofobie spočívá v indikaci antidepresiv [17].
B. Antidepresiva představují rozsáhlou skupinu léků, které odstraňují biochemickou příčinu depresivní poruchy, deficit monoaminů – serotoninu, noradrenalinu, dopaminu a potlačují i patickou hypersenzitivitu noradrenergních receptorů. Všechna antidepresiva, nezávisle na jejich zařazení do jednotlivých skupin, jsou účinná v 60–80 % případů.
Rozdělení antidepresiv podle mechanismu účinku není jednoznačné [3, 53] – tabulka 4.
Table 4. Antidepresiva 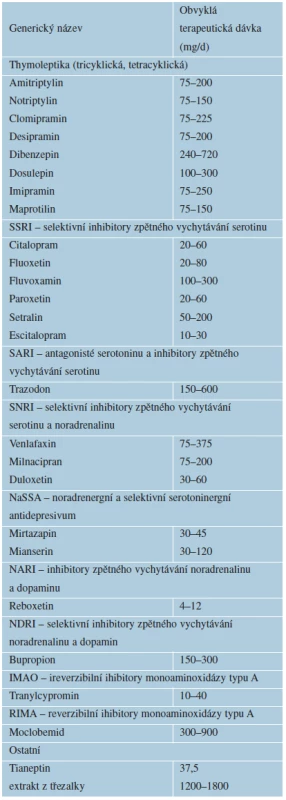
Anders,M.,Mohr, P.: Léčba psychických poruch u somaticky nemocných [3] (Upraveno podle Höschl, 2002 – Bareš a Praško, 2004) 1. generace: tricyklická a tetracyklická antidepresiva (TCAs, TeCAs)
Tato antidepresiva zvyšují koncentraci monoaminů (noradrenalinu, serotoninu a dopaminu) v limbické oblasti centrální nervové soustavy a současně ovlivňují řadu receptorových systémů včetně muskarinových, histaminergních a alfa1-adrenergních, čímž mohou vyvolat nežádoucí účinky: sucho v ústech, únavu, tachykardie, poruchy akomodace zraku, ortostatickou hypotenzi, zvýšené pocení, poruchy mikce, zácpu, deliriózní stav u starších nemocných. Do této skupiny se řadí amitriptylin (Amitriptylin®), dosulepin (Prothiaden®), imipramin (Tofranil®, Melipramin®), clomipramin (Anafranil®), maprotilin (Ludiomil®), nortriptylin (Notrilen®). Náhlé ukončení léčby TCA, TeCA může vést k syndromu z vysazení, proto je nutné pozvolné snižování dávky o 25 % týdně.
2. generace: heterocyklická antidepresiva
Viloxazin (Vivalan®) představuje lék, který zvyšuje koncentraci dvou ze tří monoaminů a na rozdíl od první generace nepůsobí anticholinergně, i když účinkuje ještě adrenolyticky a antihistaminově. Bupropion SR (Wellbutin®) se nově řadí do 4. generace antidepresiv.
Indikace TCA, TeCA a heterocyklických antidepresiv v dermatovenerologii: chronická urtikarie, generalizovaný pruritus, noční pruritus u atopického ekzému, postherpetické neuralgie, neurotické exkoriace. Antipruriginózní - -antihistaminový H1, H2 a sedativní účinek se plně uplatní do dvou týdnů po zahájení léčby [15].
3. generace: inhibitory reuptake jen jediného monoaminu:
a) SSRI (Selective Serotonin Reuptake Inhibitor) – selektivní inhibitory zpětného vychytávání serotoninu zahrnují – citalopram (Seropram®, Citalec®, Sepram®, Cerotor®), escitalopram (Cipralex®), fluoxetin (Prozac®, Deprex®, Portal®, Deprenon®), fluvoxamin (Fevarin®), paroxetin (Seroxat®, Remood®), sertralin (Zoloft®, Asentra®) – tabulka 5. Prvním SSRI uvedeným na trh byl fluoxetin v roce 1974. Léky této skupiny se vzájemně liší chemickou strukturou. Mechanismus antidepresivního účinku mají společný. Inhibitory reuptake – zpětného vychytávání monoaminů zvyšují koncentraci těchto látek v synaptických štěrbinách neuronů CNS. Antidepresiva SSRI představují léky první volby v ambulantní praxi. Oproti předchozím generacím antidepresiv jsou prokazatelně bezpečnější při předávkování pacientem za účelem suicidia, nepůsobí většinou sedativně, nepotencují účinek alkoholu a mají pro svůj dostatečně dlouhý, vylučovací poločas jednoduché schéma dávkování. Podle individuálního vlivu na útlum pacienta je možné zvolit ranní nebo večerní denní dávku léku. Léčebný účinek se plně projeví za 4–6 týdnů. U většiny nemocných postačuje tzv. minimální účinná denní dávka, u somaticky nemocných i nižší. K nevýhodám patří serotoninové nežádoucí účinky včetně tenze, anxiety, insomnie, cefalgie, tremoru, gastrointestinálních a sexuálních dysfunkcí, dočasné snížení tělesné hmotnosti, zvýšení hmotnosti při dlouhodobém užívání, snížení serotoninu v trombocytech. Kožní nežádoucí účinky jsou uvedeny v tabulce 6. Farmakokinetické lékové interakce jsou vyvolány inhibicí CYP450. U pacientů se somatickými chorobami a doprovodnými symptomy úzkosti se doporučuje dodržovat zásadu „start slow, go slow“, neboť rychlé obsazení serotoninových receptorů často vyprovokuje nebo násobí úzkost pacienta. K rozvoji serotoninového syndromu může dojít po všech inhibitorech selektivního vychytávání serotoninu (SSRI), nejrizikovější kombinací zůstává interakce mezi SSRI a inhibitory mono-aminooxidázy (IMAO) typu A i B, ireverzibilními i reverzibilními. Potenciálně nebezpečné jsou i kombinace s thymoprofylaktiky, tricyklickými antidepresivy a některými novějšími antidepresivy (venlafaxin, nefazodon, mirtazapin aj.), ale i třezalkou (f. o. Jarsin), některými antibiotiky (erytromycin, linezolid) a antimykotiky (ketokonazol). Serotoninový syndrom byl popsán i po současném podávání antidepresiv s antipsychotiky druhé generace, risperidonu a olanzepinu. Klinický průběh serotoninového syndromu je variabilní – od mírných příznaků až po mnohočetná orgánová selhání a letální zakončení [57]. Syndrom z vysazení SSRI je nejčastější po paroxetinu, prevencí je postupné vysazování léku a snižování o 20–30 % dávky každých 6–8 týdnů. Nežádoucí účinky léčby SSRI se vyskytují častěji v souvislosti s vysokým nárůstem spotřeby těchto léků. Antidepresiva SSRI představují celosvětově nejčastěji předepisované léky [29].
Indikace SSRI v dermatovenerologii: dysmorfofobie, neurotické exkoriace, parazitofobie, úzkostně depresivní poruchy, sociální fobie, skin picking a trichotillománie [33].
b) SARI (serotonin antagonits/reuptake inhibitor) antidepresiva se zdvojeným serotoninovým působením – blokádou serotoninových receptorů S2A/S2C a slabší inhibicí zpětného vychytávání serotoninu.
Trazadon (Trittico®) vykazuje i antihistaminové a alfa1--adrenolytické účinky. Působí nejen antidepresivně, ale i anxiolyticky a hypnoticky. Nežádoucí účinky – ospalost, závratě, nervozita, únava, nauzea, zácpa, xerostomie, porucha akomodace, ortostatická hypotenze.
Nefazodon (Sermone®, Dutonin®) má méně nežádoucích účinků než trazadon. Nefazodon je silným inhibitorem CYP4503A4 a zpomaluje metabolismus jeho substrátů. Pozor na současné podávání s terfenadinem, astemizolem, cyklosporinem – prodlužuje QT interval a vyvolává komorovou tachykardii [57].
c) NARI – inhibitory reuptake noradrenalinu zastupuje reboxitin (Edronax®, Vestra®). Inhibitory CYP4503A4 zvyšují sérové koncentrace reboxitinu.
4. generace
a) SNRI (Serotonin-Norepinephrine Reuptake Inhibitor) – inhibitory zpětného vychytávání serotoninu a noradrenalinu zvyšují synaptickou koncentraci serotoninu a noradrenalinu, aniž ovlivňují jiné neurotransmiterové systémy. Označují se také jako dualistická antidepresiva. Patří sem: duloxetin, milnacipran, venlafaxin.
Ovlivnění obou neurotransmiterových systému jednak potlačuje depresivní náladu, ale také příznivě ovlivňuje utlumenou psychomotoriku. Duální účinek příznivě ovlivňuje i bolestivé symptomy. Tato antidepresiva nepůsobí antihistaminově a jejich předností je slabá inhibice cytochromu P450 a jeho isoenzymů. Výrobci těchto léků zvolili heslo: „účinnější než SSRI a stejně účinná jako TCA, stejně dobře snášená jako SSRI a lépe než TCA“.
Venlafaxin (Effectin®, Effexor®, Olwexya®, Velaxin®) je antidepresivum, které inhibuje zpětné vychytávání především serotoninu a v menší míře též noradrenalinu, vliv na zpětné vychytávání dopaminu je pouze zanedbatelný. Pro tyto vlastnosti bývá označován jako duální antidepresivum. V řadě metodicky dobře provedených randomizovaných a kontrolovaných studií byla prokázána jeho účinnost v léčbě různých druhů depresivní poruchy včetně její farmakorezistentní formy. Je minimálně stejně účinný jako tricyklická antidepresiva, ve srovnání s nimi však představuje bezpečnější způsob terapie. Antidepresivní účinek venlafaxinu je možná dokonce vyšší než u léčiv ze skupiny SSRI při téměř shodné toleranci. Mechanismus antidepresivního působení venlafaxinu spočívá v zesílení neurotransmiterové aktivity v centrálním nervovém systému. Venlafaxin i jeho účinný metabolit O-demethylvenlafaxin jsou silnými inhibitory zpětného vychytávání serotoninu (5-hydroxytryptaminu, 5-HT) ze synaptické štěrbiny, poněkud méně inhibují zpětné vychytávání noradrenalinu a jen slabě, a to až po podání vyšších dávek, též dopaminu (obr. 2).
Image 2. Molekula venlafaxinu (antidepresiva ze skupiny SNRI) s částmi odpovědnými za inhibici zpětného vychytávání serotoninu (SRI), noradrenalinu (NRI) a dopaminu (DRI) 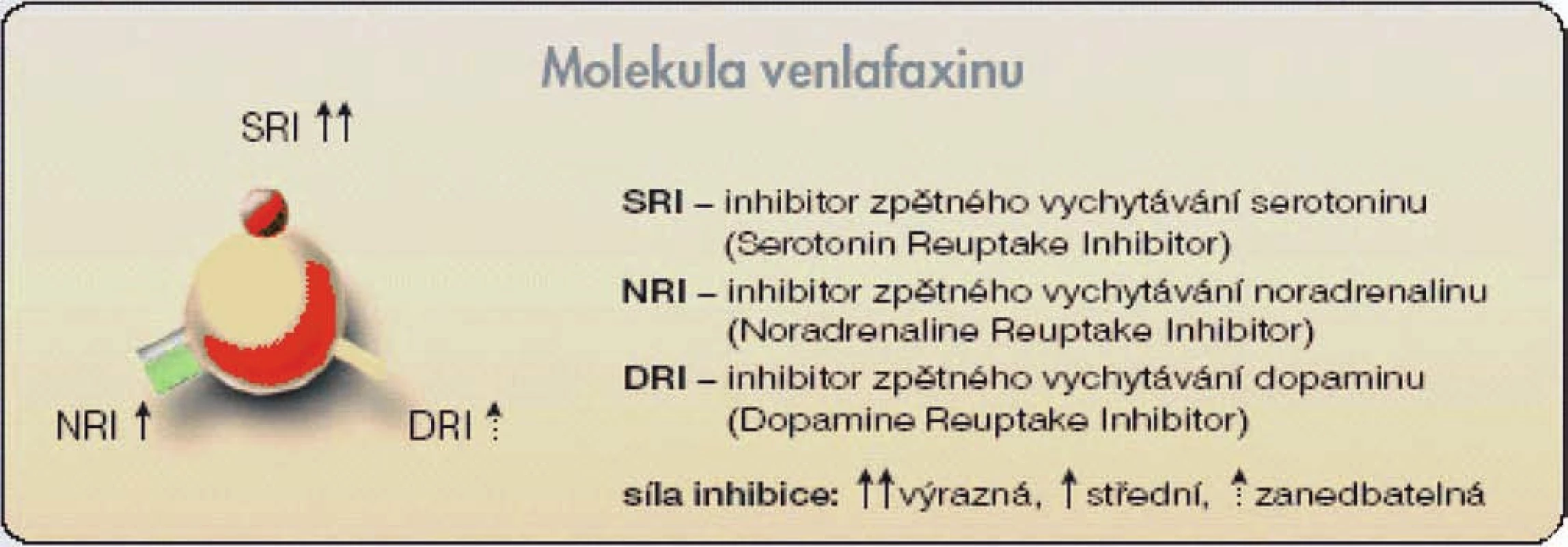
Venlafaxin má nízký potenciál rizika vzniku lékových interakcí způsobených ovlivněním cytochromového systému P-450. Prokázána byla též jeho krátkodobá i dlouhodobá účinnost u generalizované úzkostné poruchy a sociální fobie. Další práce naznačují, že by venlafaxin mohl mít ještě širší terapeutický potenciál. Nadějná jsou zjištění o jeho možném využití při terapii panické úzkostné poruchy, posttraumatické stresové poruchy nebo u algického syndromu. Bolesti u diabetické neuropatie jsou lépe ovlivnitelné tricyklickými antidepresivy (TCA) než opioidy nebo nesteroidními antiflogistiky. SSRI byla v této indikaci shledána jako méně účinná než TCA. Venlafaxin zvyšuje v experimentálních pracích práh pro vnímání bolesti, což by mohlo svědčit pro jeho analgetické účinky.
Nežádoucí účinky venlafaxinu jsou mírné, pacienty je dobře snášen. Mnohé z jeho nežádoucích účinků se jeví jako závislé na dávce (nechutenství, nauzea, zvracení, snižování tělesné hmotnosti, závratě, ospalost, zvýšené pocení, hypertenze, třes a poruchy sexuálních funkcí). Některé z nich odeznívají v průběhu terapie. V průběhu terapie venlafaxinem se doporučuje pravidelně sledovat hodnoty TK. Předávkování venlafaxinem vyvolává kardiovaskulární nežádoucí účinky (prodloužení intervalu QT, sinusovou tachykardii), jejichž závažnost je však výrazně nižší než u TCA. Venlafaxin neovlivňuje významně pozornost ani schopnost řídit motorová vozidla.
Lékové interakce vyvolávají kombinace s inhibitory monoaminooxidázy, venlafaxin se biotransformuje v játrech na cytochromu P-450, na izoenzymu CYP2D6 na účinný metabolit O-demethylvenlafaxin. Venlafaxin je velmi slabým inhibitorem CYP2D6, což potvrdilo jeho srovnání s fluoxetinem, který je naopak velmi silným inhibitorem CYP2D6 [11].
b) DNRI – inhibitory zpětného vychytávání dopaminu a noradrenalinu – bupropion SR (Wellbutin®) zvyšuje koncentraci dopaminu a noradrenalinu v centrálních synapsích mozku, bez ovlivnění jiných neurotransmiterů. Nepříznivé je, že má určitý epileptogenní potenciál. Kromě léčby depresí je jeho indikací odvykání kouření. Původně byl řazen do 2. generace antidepresiv.
5. generace: SNDRI – inhibitory reuptake serotoninu, noradrenalinu a dopaminu nemají působit anticholinergně, adrenolyticky ani antihistaminově. Léky jsou ve vývoji [20].
Jiné inhibitory zpětného vychytávání monoaminů
Fytofarmakum třezalka tečkovaná (Hypericum perforatum) (Jarsin®) je slabým inhibitorem zpětného vychytávání monoaminů a je volně prodejné. Extrakt je indikován k léčbě mírných a podprahových depresí. Lékař by se měl zeptat pacienta, neužívá-li, některé formy extraktu třezalky. Kromě rizika metabolických interakcí hrozí potenciální riziko následků receptorové interakce, které vznikají v důsledku prudce zvýšené nabídky monoaminů (hypertermie, hypertenzní krize, myoklonus, rigidita, kolísání vitálních funkcí, změny duševního stavu).
Látky zvyšující zpětné vychytávání serotoninu
Tianeptin (Stablon®, Coaxil®) bývá řazen do skupiny tzv. stimulantů zpětného vychytávání serotoninu. Podání léku vyvolává zvýšení zpětného vychytávání serotoninu a mechanismem účinku se liší od ostatních antidepresiv. Je bezpečný při léčbě kardiovaskulárně nemocných, nezvyšuje tělesnou hmotnost.
Mirtazapin, mianserin jsou noradrenergní a selektivní serotoninergní antidepresiva (NaSSA).
Histaminová H1 aktivita NaSSA způsobuje sedativní vlastnosti a zvýšení chuti k jídlu.
Mirtazepin byl účinný při léčbě pruritu, cholestázy, renálních selhání, neurotických exkoriací, v onkologii. Léčebný účinek se dostavil za 2–4 týdny léčby.
Moclobemid je reverzibilní inhibitor monoaminoxidázy A (RIMA).
Mechanismus účinku spočívá v inhibici enzymu monoaminooxidázy MAO, který odbourává noradrenalin, dopamin, serotonin, tyramin. Mají časté nežádoucí interakce. Výhodou je nízký potenciál indukce sexuálních dysfunkcí [20].
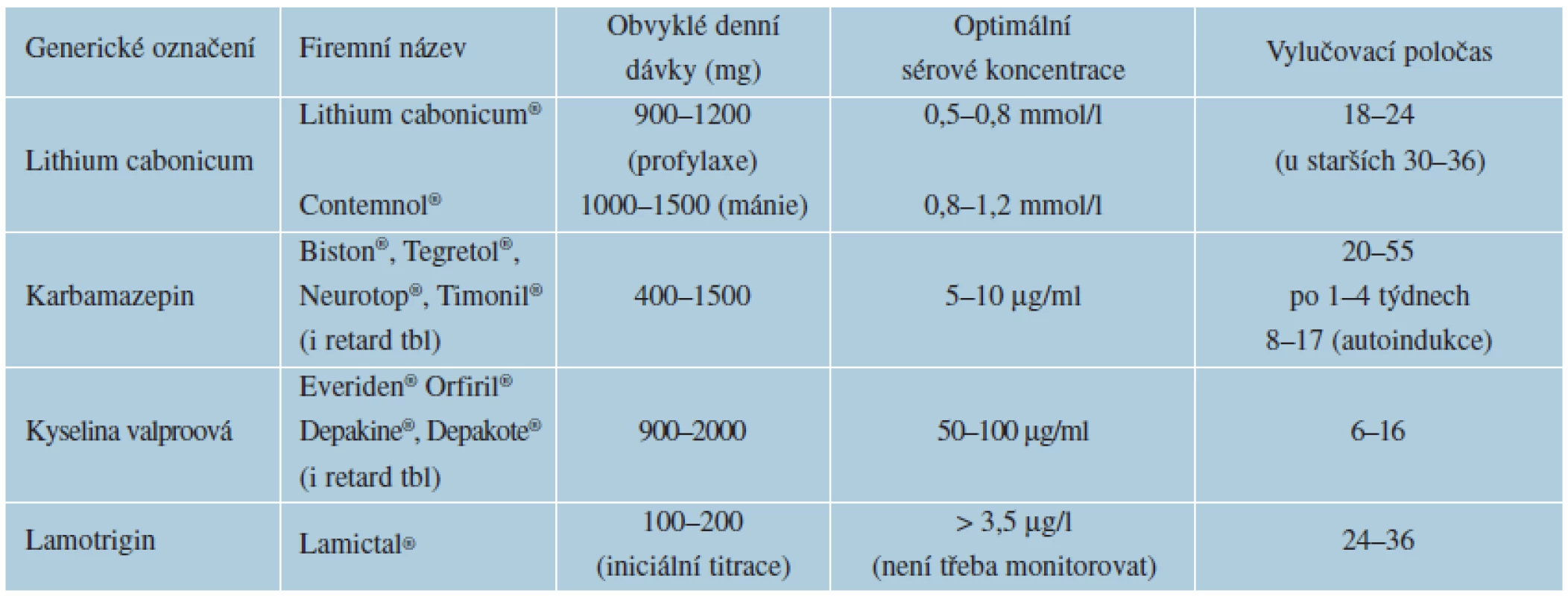
C. Thymoprofylaktika (synonymum stabilizátory nálady) jsou psychofarmaka, která při dlouhodobém profylaktickém podávání snižují frekvenci a intenzitu manických, depresivních a smíšených epizod afektivních i schizoafektivních poruch (viz tab. 6). Současně účinkují antimanicky a antidepresivně při léčbě akutních epizod, aniž vyvolávají přesmyk do opačné polarity [20]. Patří sem lithium, karbamazepin, kyselina valproová a částečně lamotrigin, který nepůsobí antimanicky.
Table 6. Kožní nežádoucí účinky vyvolané antidepresivy SSRI 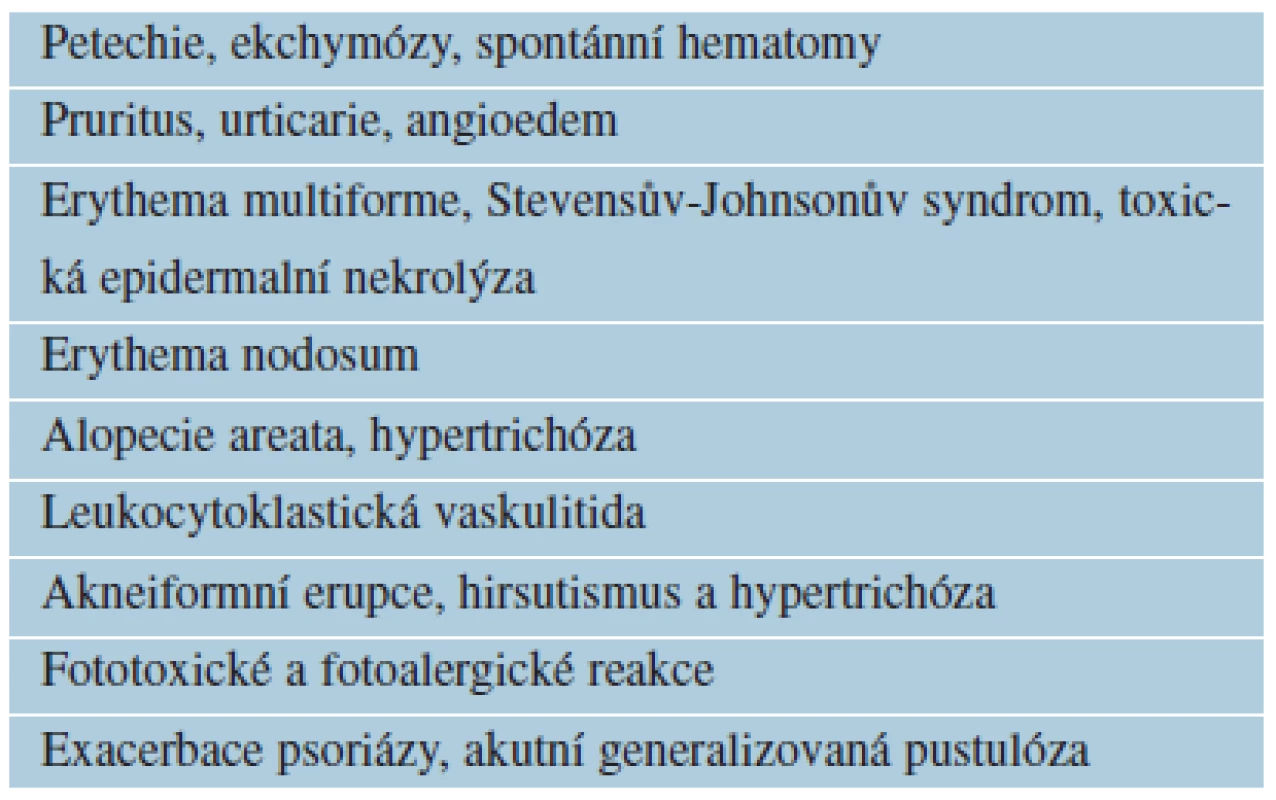
Závažné nežádoucí kožní účinky může způsobovat lamotrigin (Lamictal®, Lamitrigin®). Exantém (až u 10 % pacientů), většinou makulopapulózní, obvykle se objevuje do 8 týdnů od zahájení léčby, riziko výskytu souvisí s vysokými úvodními dávkami lamotriginu, vzácnější Stevensův--Johnsonův syndrom a toxická epidermální nekrolýza. U dětí je riziko závažných kožních reakcí vyšší [16, 65].
Lithium (Lithium cabonicum®, Contemnol®) může způsobit alopecii, psoriázu, acne vulgaris, lichen planus, lupus erythematosus [21].
D. Hypnotika jsou léčiva, která vyvolávají spánek či usnadňují usínání, obvykle prostřednictvím receptoru pro kyselinu gama-aminomáselnou v mozku (tab. 7). Kyselina gama-aminomáselná (GABA) je hlavní inhibiční neurotransmiter v CNS a je přímo odpovědná za regulaci svalového tonu. Látky, které působí jako agonisté GABA receptoru (známé jako analogy GABA nebo GABAergní látky) nebo zvyšují množství GABA, mají účinky sedativní, hypnotické, anxiolytické, myorelaxační, antikonvulzivní a vyvolávají změny paměti (agonistické působení na podtypy receptorů A, B). Nespavost jako primární onemocnění nebo jako doprovodný příznak tělesných či duševních poruch je častá. Zvládání nespavosti zahrnuje farmakologické i nefarmakologické postupy, dodržování zásad spánkové hygieny a komplexní léčbu.
Table 7. Hypnotika 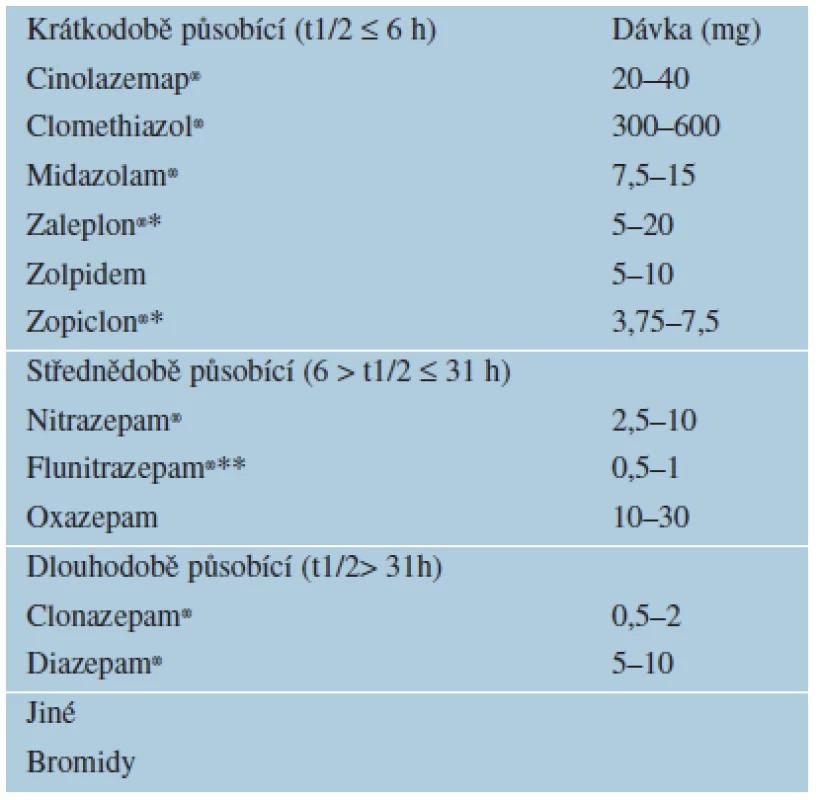
*Látka registrovaná, ale není v distribuci. **Přípravek podléhá zvláštnímu režimu preskripce. Hypnotika III. generace jsou doporučováná ke krátkodobé léčbě nespavosti.
Jedním z nich je zolpidem – krátkodobě působící imidazopyridinové hypnotikum, které zlepšuje kvalitu spánku, nepůsobí následnou denní sedaci, nevede po vysazení k abstinenčním příznakům ani k „rebound“ fenoménu.
Pro všechna hypnotika platí následující pravidla léčby [13]:
- Omezit aplikaci pouze na čtyři týdny.
- Co nejnižší účinné večerní dávky.
- Podávat podle potřeby, ne kontinuálně.
- Lékem volby jsou hypnotika III. generace – zolpidem (Hypnogen®, Stilnox®, Zolpidem®), zopiclon (Imovane®, Zopiclon®), zaleplon (Sonata®).
- Benzodiazepinová hypnotika mohou vést ke vzniku psychické i fyzické závislosti, po vysazení se objevují abstinenční příznaky a „rebound“ insomnie, např. po náhlém odejmutí krátkodobě působících bezodiazepinů.
- Lékař by měl jasně informovat pacienta o riziku a přínosu hypnotika.
E. Antipsychotika jsou psychofarmaka s příznivým účinkem na psychické integrace – myšlení. Antipsychotika nejsou léky kauzální, ale po dobu jejich podávání jsou psychotické příznaky dostatečně potlačeny u většiny nemocných. Nutná je dlouhodobá medikace. Antipsychotika jsou léky volby pro potlačení neklidu, agitovanosti a agresivity, nejen u schizofrenních, schizoafektivních a afektivních psychóz, ale i u organických psychických poruch včetně demencí, mentální retardace, poruch osobnosti, akutních reakcí na stres psychotické úrovně, somatoformních poruch s bludnými domněnkami až bludy, autismu či poruch motorických, jako jsou tiky a jiné [20]. Dělí se na:
- klasická: sedativní a incizivní antipsychotika (tab. 8),
- atypická (tab. 9).
Table 8. Typická antipsychotika registrovaná v ČR 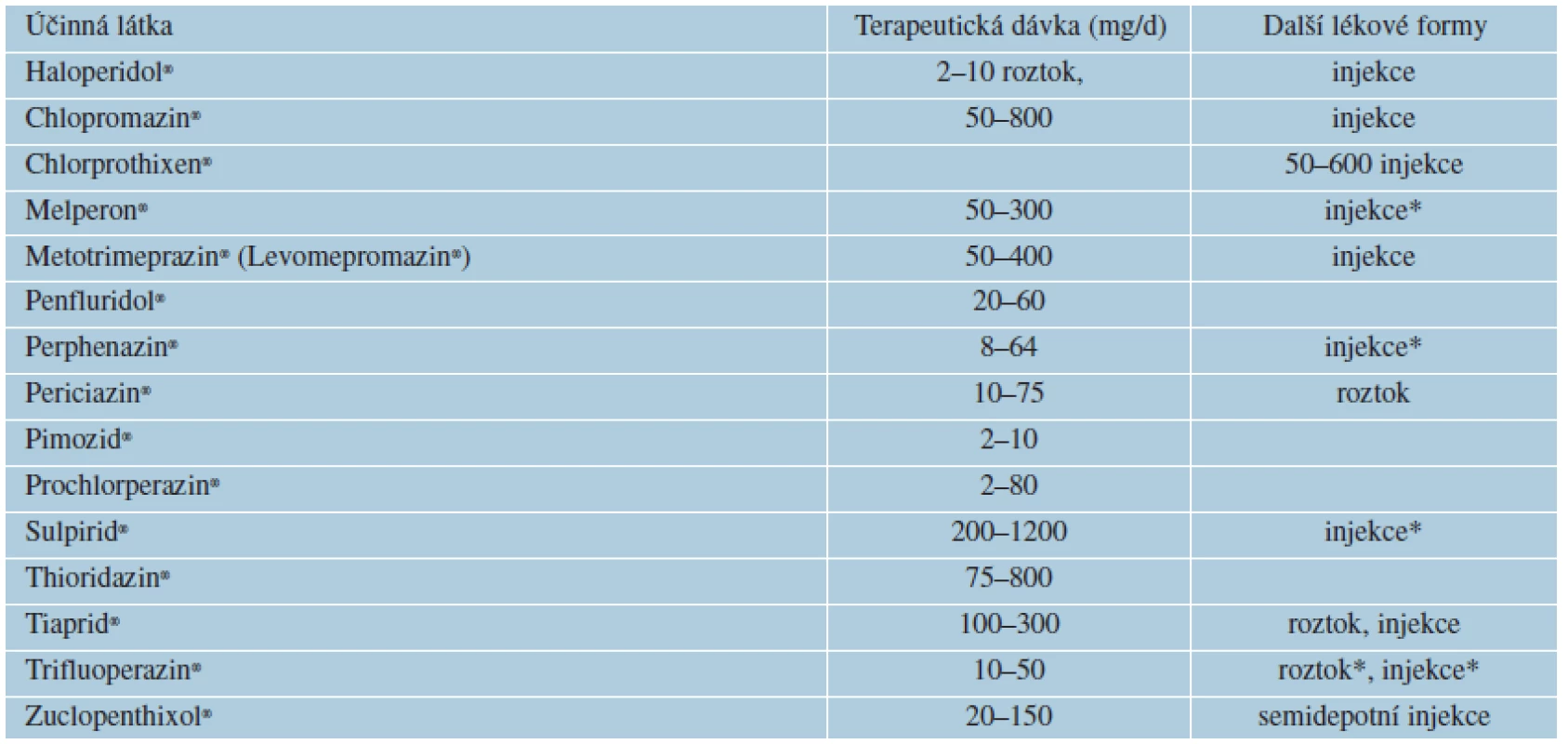
*V ČR není dostupný. Table 9. Atypická antipsychotika 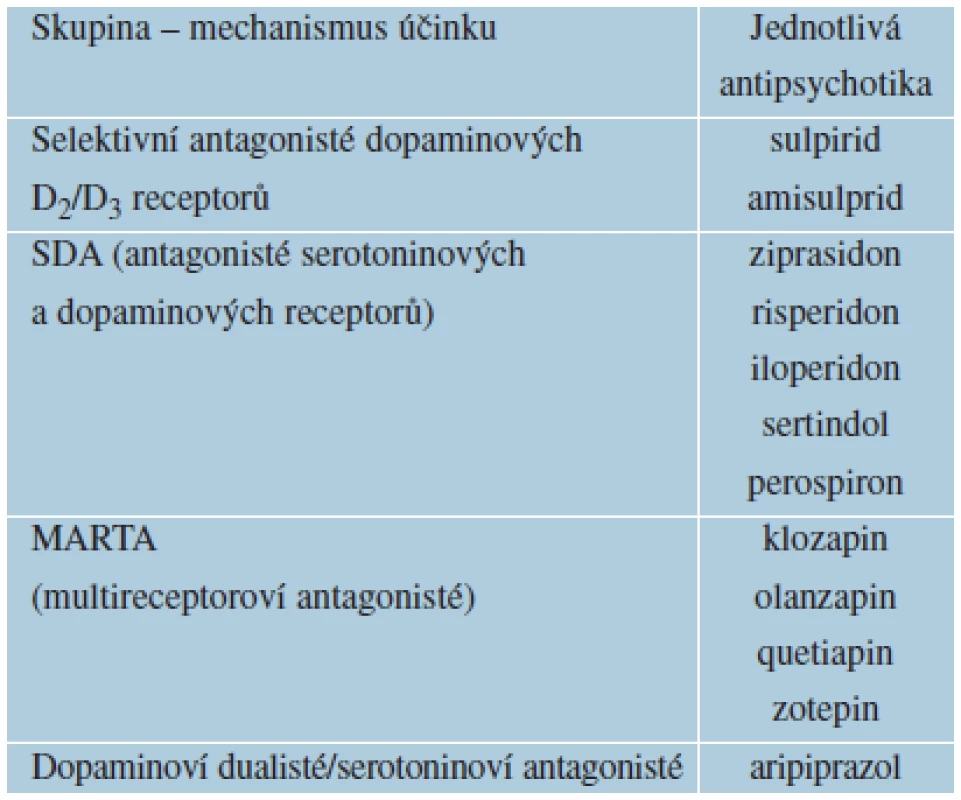
1. Klasická antipsychotika způsobují centrální antagonismus dopaminových D2/D3-receptorů, současně silně inhibují nervová zakončení histaminová H1, muskarinová a alfa1-adrenergní, což je příčinou jejich nežádoucích příznaků. Vyznačují se mohutným účinkem na neklid a agresivitu, protože mají vysokou afinitu k D2-receptorům, což vede k extrapyramidovým nežádoucím účinkům a hyperprolaktinémii. Nejstaršími antipsychotiky jsou sedativní chlorpromazin (Plegomazin®, Largactil®, 1951) a incizivní klasické antipsychotikum haloperidol (Haloperidol®). Klasická antipsychotika vyvolávají extrapyramidový syndrom (EPS), neuroleptický maligní syndrom, hyperprolaktinémii, anticholinergní nežádoucí účinky (blokádou centrálních a periferních muskarinových receptorů), antihistaminové účinky zahrnují sedaci, hypotenzi, zvýšení tělesné hmotnosti, kardiovaskulární nežádoucí účinky – ortostatickou hypotenzi, tachykardii, trombembolizaci, změny EKG ve smyslu prodloužení QT intervalu, případně komorovou tachykardii či fibrilaci, krevní dyskrazii (nejvíce leukopenii až agranulocytózu), ale i jaterní poškození – cholestatický ikterus.
Kožní nežádoucí účinky klasických antipsychotik nastávají nejčastěji při aplikaci fenothiazinových léků: fotosenzitivita u 3–10 %, pruritus u 5 %, exantémy, Lyellův syndrom, kontaktní dermatitida či angioneurotický edém. Mezi všemi fenothiazinovými preparáty se vyskytuje zkřížená senzitivita [12]. K dalším patří okulokutánní syndrom (melanosis) – ukládání komplexu melaninu s fenothiaziny do kůže v solární lokalizaci, současně i rohovky a čočky. Pigmentace vedou k břidlicově šedému nebo namodralému zbarvení kůže.
Z hlediska lékových interakcí potencují antipsychotika účinek všech látek působících tlumivě na CNS, antihypertenziv včetně ACE inhibitorů, dále anticholinergik a hypoglykemik. Všechna klasická antipsychotika jsou středně silnými inhibitory a zároveň substráty cytochromu P4502D6. Haloperidol a pimozid jsou substráty izoenzymu CYP4503A4.
2. Atypická antipsychotika – druhá generace antipsychotických látek. Tyto léky jsou významně lépe snášeny nemocnými. Sociální funkce a kvalita života pacientů jsou na vyšší úrovni. Pro svůj příznivý léčebný profil, lepší snášenlivost a bezpečnost se atypická antipsychotika stala léky první volby. Atypická antipsychotika se dělí do čtyř skupin, podle mechanismu účinku (viz tab. 9).
F. Neuroprotektiva
Jedná se o psychotropní látky, které chrání neurony CNS před poškozením, zvyšují metabolismus a průtok krve mozkem. Neuroprotektiva zlepšují kognitivní funkce, včetně paměti a učení, dělí se do několika skupin:
- nootropika,
- antioxidanty,
- antagonisté NMDA receptorů (N-metyl-D-asparát),
- centrální vazodilatancia,
- inhibitory cholinesteráz.
Nootropika jsou zastoupena léky jako piracetam, pyritinol, klomethiazol, meklofenoxát, nicergolin, které zlepšují činnost mozku a jeho metabolismus. Příznivě působí na využití kyslíku, mnohdy mají účinky antiagregační či vazodilatační. Podobně působí i vazodilatancia např. cinnarizin.
Indikací nootropik jsou některé formy demence, akutní poruchy vědomí, úrazy hlavy.
K nežádoucím účinkům nootropik patří nespavost či agitovanost [20].
ZÁVĚR
Psychotropní léky jsou nápomocné u četných psychických i somatických nemocí.
Účinnost kombinace farmakoterapie a psychoterapie je potvrzena v recentních studiích.
V souvislosti s vysokým nárůstem spotřeby psychofarmak se, ale také častěji setkáváme i s nežádoucími kožními účinky a lékovými interakcemi. Příkladem jsou antidepresiva SSRI (specifické inhibitory zpětného vychytávání serotoninu), která představují léky první volby v léčbě deprese a stala se celosvětově nejčastěji předepisovanými léky.
Mezioborová spolupráce s klinickými psychology a psychiatry konzultanty rozšiřuje hranice oboru dermatovenerologie. Vítané jsou postgraduální psychodermatologické a psychoterapeutické kurzy připravované EADV (European Academy of Dermatology and Venerology) spolu s ESDaP (European Society for Dermatology and Psychiatry) a IPVZ (Institut postgraduálního vzdělávání ve zdravotnictví), které se zabývají psychosomatickým přístupem k pacientům, psychodermatologií a léčebnými postupy psychoterapie [54, 55].
Psychodermatologická sekce České dermatologické společnosti ČLS JEP ustavená v září 2004 v Novém Jičíně si zvolila za jeden ze svých cílů změnit současné nevhodné ambulantní podmínky pro psychosomaticky orientované dermatovenerology.
Slavnostní setkání se bude konat na Zámku Kunín dne 12. září 2014.
Do redakce došlo dne 23. 5. 2014.
Adresa pro korespondenci:
Doc. MUDr. Růžena Pánková, CSc.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 00 Praha 2
e-mail: ruzena.pankova@lf1.cuni.cz
Sources
1. AKTAN, S., OZMEN, E., SANLI, B. Psychiatric disorders in patients attending a dermatology outpatient clinic. Dermatology, 1998, 197, p. 230–234.
2. ALTUNAY, I. K., ATES, B., MERCAN, S., DEMIRCI, G. T., KAYAOGLU, S. Variable clinical presentations of secondary delusional infestation: an experience of six cases from a psychodermatology clinic. Int. J. Psychiatry Med., 2012, 44, 4, p. 335–350.
3. ANDERS, M., MOHR, P. Léčba psychických poruch u somaticky nemocných. Farmakoterapie. In Herman, E., Praško, J., Seifertová, D. a kol. Konziliární psychiatrie. 1. vydání. Medical Tribune, 2007, s. 236–243. ISBN 978-80-903708-9-0, Galén SBN 978-80-7262-498-0.
4. BLISS, S. A., WARNOCK, J. K. Psychiatric medications: Adverse cutaneous drug reactions. Clinics in Dermatology, 2013, 31, p. 101–109.
5. BOYD, A. S., RITCHIE, C., LIHARI, S. Munchhausen syndrome and Munchhausen syndrome by proxy in dermatology. J. Am. Acad. Dermatol., 2014. Dostupné na www: http://dx.doi.org/10.1016/j.jaad.2013.12.028.
6. CHROMÝ, K., HONZÁK, R. et al. Somatizace a funkční poruchy. Grada Publishing, Praha, 2005, s. 216.
7. CHROMÝ, K. Dysmorfofobie. In Chromý, K., Honzák, R. et al. Somatizace a funkční poruchy. Grada Publishing, 2005, s. 69–75.
8. DREVETS, W. C., PRICE, J. L., FUREY, M. L. Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry model sof depression. Brain Struct. Funct., 2008, 213, p. 93–118.
9. FIRDAUS, S., DHABHAR, P. Psychological stress and immunoprotection versus immunopathology in the skin. Clinics in Dermatology, 2013, 31, p.18–30.
10. FRIED, R. G. Nonpharmacologic treatments in psychodermatology. Dermatol. Clin., 2002, 20, 1, p. 177–185.
11. GIELER, U., HARTH, W. Psychodermatologie. Hautarzt, 2008, 59, p. 287–288.
12. GORDON-ELLIOTT, J. S., MUSKIN, P. R. Managing the patient with psychiatric issues in dermatologic practice. Clinics in Dermatology, 2013, 31, p. 3–10.
13. GUPTA, M. A., GUPTA, A. K. Sleep-wake disorders and dermatology. Clinics in Dermatology, 2013, 31, p. 118–126.
14. GUPTA, M. A., GUPTA, A. K. Evaluation of cutaneous body image dissatisfaction in the dermatology patient. Clinics in Dermatology, 2013, 31, p. 72–79.
15. GUPTA, M. A., GUPTA, A. K. The use of antidepressant drugs in dermatology. JEADV, 2001, 15, p. 512–518.
16. GUPTA, M. A. Emotional regulation, dissociation, and the self-induced dermatoses: Clinical features and implications for treatment with mood stabilizers. Clinics in Dermatology, 2013, 31, p. 110–117.
17. HARTH, W., Gieler, U., Kunir, D., TAUSK, F. A. Clinical Management in Psychodermatology. Springer Verlag Berlin Germany, 2009, p. 195–208.
18. HAUTMANN, G., LOTTI, T. Psychoactive drugs and skin. European Academy of Dermatology and Venereology. JEADV, 2003, 17, p. 383–393.
19. HELLER, M. M., KOO, J. Y. Neurotic excoriations acne excoriee and factitial dermatitis (2011) Contemporary Diagnosis and Management in Psychodermatology. In Heller, M. M., Koo, J. Y. 1st ed. Newton: Handbooks in Health Care C.o. p. 37–44.
20. HONZÁK, R. Behaviorální medicína. In HOESCHL et al. Psychiatrie, 2. vyd. TIGIS, 2004, s. 606–608.
21. JAFFARANY, M. Lithium and skin: Dermatologic manifestations of lithium therapy. International Journal of Dermatology, 2008, 47, 11, p. 1101–1111.
22. JAFFARANY, M. Psychodermatology: A guide to understanding common psychocutaneeous disorders. Prim. Care Companion J. Clin. Psychiatry, 2007, 9, p. 201–213.
23. KASPARIAN, N. A. Psychological stress and melanoma: Are we meeting our patients’ psychological needs? Clinics in Dermatology, 2013, 31, p. 41–46.
24. KOBLENZER, C. S. Dermatitis artefacta: Clinical features and approaches to treatment. American Journal of Clinical Dermatology, 2000, 1, p. 47–55.
25. KOO, J., LEE, C. S. General Approach to Evaluating in Psychodermatological Medicine. In Koo, J., Lee, C. S. (Eds.) Psychocutaneous Medicine. New York, Marcel Deker, 2003, p. 1–12.
26. KOO, J. Psychodermatology: A practical manual for clinicians. Curr. Probl. Dermatol., 1995, 7, 6, p. 204–232.
27. KOO, J., LEE, C. S. Comprehensive dermatologic drug therapy: psychotropic agents. Philadelphia: WB Saunders Co, 2001, p. 402–425.
28. KOUKOLÍK, F. Základy kognitivní, afektivní a sociální neurovědy XXV. O štěstí – hédonický mozek. Prakt. Lék, 2013, 93, 1, s. 10–15.
29. KRASOWSKA, D., SZYMANEK, M., SCHWARTZ, R. A., MYSLINSKI, W. Cutaneous effects of the most commonly used antidepressant medication, the selective serotonin reuptake inhibitors. J. Am. Acad. Dermatol., 2007, 56, p. 848–853.
30. KRECHLEROVÁ, M., PÁNKOVÁ, R. Psychofarmaka v dermatologii. Část I. Čes.-slov. Derm., 1989, 64, s. 339–349.
31. KUKLOVÁ, I., PÁNKOVÁ, R. Psychoterapie v dermatovenerologii. Čes.-slov. Derm., 1994, 69, s. 214–215.
32. LEE, C. S., KOO, J. The use of psychotropic medications in dermatology. In Koo, J. Y. M., Lee, C. S. Psychocutaneous Medicine. Marcel Dekker, NY, USA, 2003, p. 427–451.
33. LEE, E., MURASE, J., KOO, J., LEE, C. S. Psychofarmacology in Dermatological Practice: A Review and Update. Dermatol. Psychosom., 2003, 4, p. 131–140.
34. LOWRY, C. L., BEWLEY, A., TAYLOR, R. Facial ulcer treated with olanzapine. Clinical and Experimental Dermatology, 2013, 38, 5, p. 504–506.
35. MOHANDAS, P., BEWLEY, A., TAYLOR, R. Dermatitis artefacta and artefactual skin disease: The need for a psychodermatology multidisciplinary team to treat a difficult condition. British Journal of Dermatology, 2013, 169, 3, p. 600–606.
36. NAKANO, Y. Stress-induced modulation of skin immune function: two-types of antigene-pressenting cells in the epidermis are differentially regulated by chronic stress. Br. J. Dermatol., 2004, 151, p. 50–64.
37. ORRINGER, J. S, HELFRICH, Y. R., HAMILTON, T. et al. Prevalence of psychotropic medication use among cosmetic and medical dermatology patients: a comparative study. J. Am. Acad. Dermatol., 2006, 54, p. 416-419.
38. PANCONESI, E. Dermatologically expressed psychiatric syndromes. Clin. Dermatol., 1984, 2, p. 205–206.
39. PANCONESI, E. Psychosomatics factors in dermatology: Special perspectives for application in clinical practice. Dermatol. Clin., 2006, p. 639–633.
40. PÁNKOVÁ, R., BALCAR, K. Psychosomatika v dermatologii. In Novotný, F. et al. Obecná dermatologie. Praha, Avicenum, 1989, s. 266–270.
41. PÁNKOVÁ, R., MALÁ, H. K problematice tzv. neurotických exkoriací. Čes.-slov. Derm., 1979, 54, s. 271–273.
42. PÁNKOVÁ, R. Psychosomatické přístupy v dermatovenerologii. Čas. lék. čes., 2006, 145, s. 112–115.
43. PÁNKOVÁ, R., TARABA, P. Psychodermatologie a psychosomatický přístup: psycho - neuro-endokrino-imuno-dermatologie. Čes.-slov. Derm., 2007, 82, 1, s. 5–11.
44. PÁNKOVÁ, R. Diferenciální diagnostika pruritu. Čes.-slov. Derm., 2012, 87, 4, s. 127–133.
45. PÁNKOVÁ, R. Psychické poruchy u venerických pacientů. Česká derm., 2011, 1, 1, s. 45–48.
46. PAPEŽOVÁ, H. Úzkostné a somatoformní poruchy. Psychiatrie pro všeobecné praktické lékaře. RAABE, 2011, s. 34–47.
47. PARK, K. K., KOO, J. Use of psychotropic drugs in dermatology: Unique perspectives of a dermatologist and a psychiatrist. Clinics in Dermatology, 2013, 31, p. 92–100.
48. PHILIP, D., SHENEFELT, P. D. Update on psychodermatological disorders. Expert Rev. Dermatol., 2010, 5, 1, p. 95–107.
49. PICARDI, A., MELEHI, A. D. et al. Psychiatric morbidity in dermatological outpatients: an issue to be recognized. Br. J. Dermatos., 2000, 143, p. 983–991.
50. PICARDI, A., PASQUINI, P., ABENI, D., FASSONE, G., MAZZOTI, E., FAVA, G. A. Psychosomatic assessment of skin diseases in clinical practice. Psychother. Psychosom., 2005, 74, p. 315–322.
51. PICARDI, A., LEGA, I., TAROLLA, E. Suicide risk in skin disorders. Clinics in Dermatology, 2013, 31, p. 47–56.
52. PRAŠKO, J., PÁNKOVÁ, R. Diagnostika a léčba psychických poruch v dermatologii. In Herman, E., Praško, J., Seifertová, D. a kol. Konziliární psychiatrie, 1. vydání. Medical Tribune, 2007. CZ - ISBN 978-80-903708-9-0, Galén ISBN978-80-7262-498-0.
53. POOT, F., SAMPOGNA, F., ONNIS, L. Basic knowledge in psychodermatology. JEADV, 2007, 21, p. 227–234.
54. POOT, F. What a dermatologist needs to know to transfer dermatological patients to the psychiatrist or psychologist. Dermatol. Psychosom., 2002, 3, p. 34–37.
55. POOT, F. How to be a happy dermatologist. Dermatol. Psychosom., 2004, 5, p. 112–113.
56. RABOCH, J. Afektivní poruchy. In Raboch, J., Herle, P. et al. Psychiatrie pro všeobecné praktické lékaře. RAABE, 2011, s. 67–79.
57. RAUDENSKÁ, J., JAVŮRKOVÁ, A. Psychosociální aspekty smíšených dermatóz. Dermatol. pro praxi, 2011, 5, s. 201–215.
58. SEIFERTOVÁ, D., MIKLÓŠ, T., KOTRLÍKOVÁ, E. Diagnostika a léčba psychických poruch v somatické intenzivní péči. In Herman, E., Praško, J., Seifertová, D. a kol. Konziliární psychiatri. 1. vydání, 2007, Medical Tribune. CZ - ISBN 978-80-903708-9-0, Galén SBN978-80-7262-498-0.
59. SHENEFELT, P. D. Therapeutic management of psychodermatological disorders. Expert Opin. Pharmacother., 2008, 9, 6, p. 6–10.
60. SHENEFELT, P. D. Update on psychodermatological disorders. Expert Rev. Dermatol., 2010, 5, 1, p. 95–107.
64. ŠVESTKA, J. Obecná psychofarmakologie. In Hoeschl, C., Libiger, J., Švestka, J. Psychiatrie. 2. doplněné a opravené vydání. TIGIS, spol. s r.o., 2004, s. 102–124.
62. TEY, H. L., WALLENGREN, J., YOSIPOVITCH, G. Psychosomatics factors in Pruritus. Clinics in Dermatology, 2013, 31, p. 31–40.
63. VEČEŘOVÁ-PROCHÁZKOVÁ, A. Stres, deprese a somatická onemocnění z pohledu psychoneuro-imuno-endokrinologie. Psych@Som IV, 2006, 6, s. 142–144.
64. VONDRÁČEK, V. Duše a chemie. In Úvahy psychologicko-psychiatrické. Avicenum Praha, 1975, s. 246.
65. WANG, E. H., YANG, A. C. Reversible skin rash in a bipolar disorder patient on first use of lithium. Psychiatry and Clinical Neurosciences, 2013, 67, 5, p. 365.
66. WESSELY, S. C., LEWIS, G. H. The classification of psychiatric morbidity in attenders at a dermatology clinic. Br. J. Psychiatry, 1989, 155, p. 686–691.
67. WONG, J. W., NGUYEN, T. V., KOO, J. Y. M. Primary psychiatric conditions: Dermatitis artefacta, trichotillomania and neurotic excoriations. British Journal of Dermatology, 2013, 58, 1, p. 44–48.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2014 Issue 3
Most read in this issue- Psychofarmaka v dermatologii
- Vývoj kontaktní přecitlivělosti na alergeny Evropské standardní sady v České republice v průběhu let
- Folikulotropní T lymfom – klinický případ
- Analýza biologické léčby psoriázy ve FN Hradec Králové v letech 2006–2011
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career