-
Medical journals
- Career
Polyarteritis nodosa s disekcí iliackých tepen
Authors: M. Janebová 1; A. Krajina 2; M. Vajda 2; T. Soukup 1
Authors‘ workplace: Subkatedra revmatologie, II. interní gastroenterologická klinika LF UK a FN, Hradec Králové 1; Radiologická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Hradec Králové 2
Published in: Čes. Revmatol., 28, 2020, No. 2, p. 102-109.
Category: Case Report
Overview
Polyarteritis nodosa (PAN) je vaskulitida arterií středního kalibru s pestrým klinickým obrazem. Mezi projevy PAN patří příznaky, jako je únava, horečka, hubnutí, kožní projevy, nespecifické artritidy, artralgie, postižení gastrointestinálního traktu či ledvin. PAN postihuje cévy středního kalibru, nezpůsobuje glomerulonefritídu a nepostihuje malé arterioly, kapiláry a venuly. Postižení velkých cév je vzácné.
Popisujeme případ doposud zdravého 44letého muže, u kterého se choroba manifestovala kromě přetrvávajících febrilií i bolestmi břicha a hlavy, vysokým krevním tlakem. Při vyšetření počítačovou tomografií (CT) byl zjištěn nález infarktů obou ledvin, vpravo postihujících až 50 % parenchymu a dále byla zjištěna i disekce a. iliaca communis vlevo. Doplněné angiografické vyšetření viscerálních tepen prokázalo tři aneurysmata jaterních tepen, dále byly popsány v povodí arteria mesenterica superior a na jejunálních větvích segmentální ektázie. Diagnóza PAN byla stanovena na základě angiografického nálezu. Diagnózu podporoval klinický obraz s elevací dusíkatých katabolitů, myalgiemi, a vysokým krevním tlakem. Angiograficky byla také zjištěna disekce levostranné arteria iliaca communis a externa, která byla po vyloučení aterosklerotického či infekčního postižení hodnocena jako projev PAN.
Postižení iliackých arterií je raritní manifestací PAN, v literatuře popisované jen kazuisticky. Přesto je třeba na ni pomýšlet. Je třeba věnovat pozornost tomuto možnému projevu a provádět zobrazovací vyšetření minimálně před angiografií, aby místo invaze do cévy nebylo zasažené.
Klíčová slova:
nekrotizující vaskulitida – polyarteritis nodosa – disekce arteria iliaca communis – aneurysma viscerálních tepen
ÚVOD
PAN je nekrotizující vaskulitida převážně arterií středního kalibru postihující všechny tři vrstvy stěny cévy a vede ke vzniku mnohočetných aneurysmat, trombů, stenóz a infarktů (1). PAN není charakterizována žádnými specifickými klinickými příznaky, není spojena s žádnou ze specifických autoprotilátek, může být klinicky dlouho němá. Z těchto důvodů můžeme nalézat orgánové změny pozdního charakteru.
Ze systémových příznaků jsou typické: horečka, úbytek hmotnosti (> 90 % pacientů), slabost a myalgie (28–84 %). Ke klinickým projevům se řadí polymorfní exantémy a livedo reticularis (44–50 %), artritidy a artralgie (24–80 %), postižení periferních nervů (55–79 %), ledvin (11–66 %), gastrointestinálního traktu (33–36 %) (2). Pro PAN je typická jednostranná orchitida. Teoreticky může PAN postihnout jakýkoliv orgán, ale překvapivě nebývá přítomno postižení plic (3). PAN může být asociována s revmatoidní artritidou, Sjögrenovým syndromem i dalšími difuzními nemocemi pojiva.
Nejčastěji se objevuje mezi 40. až 60. rokem života bez rozdílu pohlaví či etnika. Etiologie je neznámá, etiopatogeneticky se mohou uplatnit viry hepatitidy B a C, human imunodeficiency virus (HIV), cytomegalovirus (CMV) (4). Incidence a prevalence PAN, které nejsou spojené s virovou infekcí, je jeden případ na milion obyvatel za rok (2).
Diagnózu PAN stanovíme na základě klinických projevů onemocnění, abnormálního angiografického zobrazení a histologického nálezu typického pro PAN. Lze použít klasifikační kritéria American College of Rheumatology (ACR) z roku 1990 (tab. 1) (5).
Table 1. Klasifikační kritéria PAN ACR 1990 (upraveno dle Lightfoot et al. (5)) 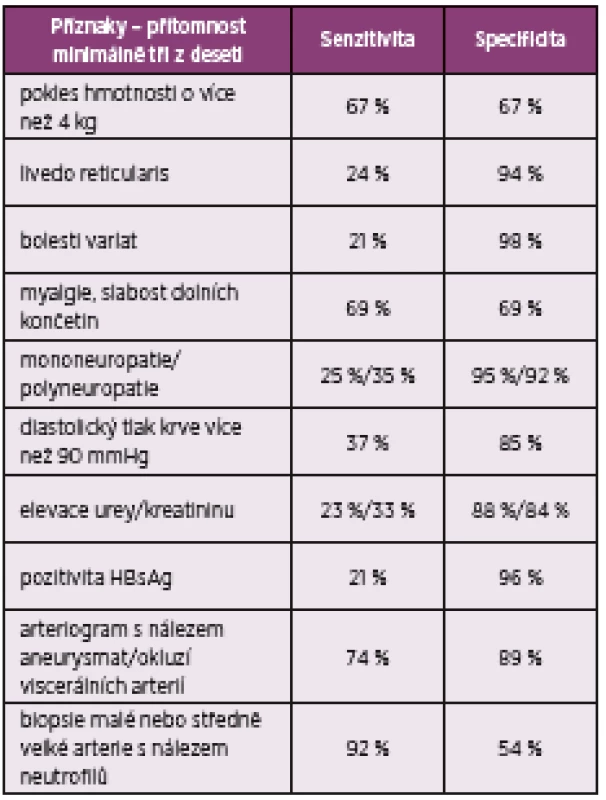
V terapii PAN dle European Vasculitis Study Group (EUVAS) je doporučována kombinace cykofosfamidu (intravenózně či orálně) a glukokortikoidů k indukci remise. Jako udržovací terapie je doporučována kombinace nízké dávky glukokortikoidů s azathioprinem nebo leflunomidem či methotrexátem. U pacientů, kteří nedosáhli remise nebo došlo k relapsu onemocnění při maximálních dávkách standardní terapie, je doporučena terapie intravenózními imunoglobuliny nebo terapie mykofenolát mofetilem, 15-deoxysperqualinem či biologickou terapií infliximabem, antithymocytárními protilátkami či rituximabem. Terapie je modifikovaná při přítomné virové hepatitidě B; doplněna o antivirotickou terapii (4, 6, 7).
POPIS PŘÍPADU
Popisujeme případ 44letého, dosud zdravého, muže, kuřáka, zaměstnaného jako správce sítě výpočetní techniky. Rodinná anamnéza nemocného je zatížena výskytem maligního melanomu u otce. V květnu 2016 si začal stěžovat na únavu, bolesti obou kyčlí, lumbální páteře a kolenních kloubů. Potíže následovaly proběhlou infekci horních cest dýchacích. Bolesti byly trvalého celodenního charakteru, nereagující na nesteroidní antirevmatika. Po měsíci trvání příznaků byl vyšetřen v revmatologické ambulanci včetně základních laboratorních vyšetření a rentgenových snímků hrudníku a bolestivých tělesných partií. Nebyla shledána příčina zánětlivého stavu a potíží ve smyslu infekce, nádorového onemocnění ani autoimunitního onemocnění, včetně systémového onemocnění pojiva či systémové vaskulitidy. Po 4 týdnech trvání příznaků se podrobil lázeňským procedurám v termálních lázních v zahraničí, při kterých se poprvé objevila intenzivní bolest v pravém podbřišku s propagací do zad, horečka 38,5 °C. Pacient byl vyšetřen za krátkodobé hospitalizace na zahraničním chirurgickém oddělení, zde byla po vyloučení infekční příčiny a náhlé příhody břišní podána symptomatická analgetická infuzní terapie a k dalšímu vyšetření pacient odcestoval zpět do České republiky. Po návratu byl nemocný praktickým lékařem opět vyšetřován na možné infekční příčiny, včetně kultivačního vyšetření moči a laryngu, sérologií na hepatitidy A, B, C, E. Následovala necílená léčby antibiotiky (klaritromycin) s iluzí přechodného efektu, ale po ukončení antibiotické terapie se opět objevily febrilie až 39 °C. Pro výrazné bolesti břicha, trvající výraznou únavu, bolesti hlavy a přetrvávající horečky byl pacient vyšetřován spádovou chirurgickou a interní ambulancí. Lékař provádějící ultrasonografické vyšetření břicha konstatoval nález cysty v oblasti ledviny a hemangiomy jater, ty ale nevysvětlovaly příčinu obtíží. Přetrvávající febrilní stav bez zjištění příčiny byl indikací k provedení CT břicha, při kterém byl zjištěn překvapivý nález infarktů obou ledvin, vpravo postihujících až 50 % parenchymu. Vzhledem k těmto nálezům a klinickému stavu byl k dalšímu vyšetřování přeložen na revmatologické lůžkové oddělení. Při přijetí vyplynulo z epidemiologické anamnézy, že často cestoval do zahraničí (Taiwan, Dominikánská republika), poslední cestu uskutečnil v lednu 2016 do Thajska. Nepopíral opakovaný nahodilý nechráněný pohlavní styk při provozování sexuální turistiky. Užívání jakýchkoliv drog negoval.
Při příjmu na naše oddělení dominovala zejména únava a subfebrilie, nekorigovaná arteriální hypertenze, bolesti v průběhu levého ureteru a bolesti zad, pozitivní tapottement vlevo, mírná bolestivost levého varlete. Při vstupním laboratorním vyšetření byla zjištěna středně zvýšená sedimentace erytrocytů 42 mm/h, lehká normocytární normochromní anemie 125 g/l hemoglobinu. Krevní obraz byl bez leukocytózy, biochemické výsledky se známkami mírné renální insuficience (urea 3 mmol/l, kreatinin 126 µmol/l), CRP 26 mg/l, prokalcitonin nízký 0,03 µg/l, elektroforéza bílkovin při normální hladině albuminu s elevací frakce alfa1 a alfa2 globulinů. Močový sediment i chemické vyšetření byly bez zjevné patologie, včetně proteinurie 0,26 g/den. Imunologické vyšetření neprokázalo žádnou z relevantních autoprotilátek: antifosfolipidové protilátky, revmatoidní faktory, protilátky proti cyklickému citrulinovanému peptidu, C3 a C4 složky komplementu v séru v normě, kryoglobuliny negativní, cirkulující imunokomplexy, antinukleární protilátky, protilátky proti cytoplazmě neutrofilů (ANCA) vyšetřené imunofluorescenčním i Enzyme-Linked Immuno Sorbent Assay (ELISA), testy na ANCA reagující s myeloperoxidázou a proteinázou 3.
V rámci diagnostiky byla zvažována široká škála onemocnění i s ohledem na možnost vzácnějších infekčních onemocnění. Nativní CT mozku neprokázalo patologické změny, lumbální punkce byla také s normálním nálezem. Transezofageální ultrazvuk srdce vyloučil infekční endokarditidu, vedlejším nálezem bylo perzistentní foramen ovale s pravolevým i levopravým zkratem. Ultrazvukové vyšetření skrota vyloučilo tumor i torzi varlete, nález pouze malé hydrokély bilaterálně.
Pro opakované výrazné bolesti břicha nereagující na analgoterapii bylo provedeno akutně vícefázové CT břicha s intravenózním podáním kontrastní látky. Při sledování průběhu renálních tepen byla popsána v segmentální úrovni četná drobná aneurysmata a směrem do periferie drobné uzávěry (obr. 1, 2). Nález infarktů ledvin byl stacionární. K diagnostice dalších aneurysmat bylo indikováno angiografické vyšetření viscerálních tepen, kde byla popsána známá aneurysmata ledvin (obr. 3), nejméně tři další aneurysmata jaterních tepen (obr. 4), dále na a. mesenterica superior a na jejunálních větvích byly popsány segmentální ektázie. Nově byla také zjištěna disekce levostranné arteria iliaca communis a arteria iliaca externa bez významných stenóz (obr. 5, 6). K vyloučení možné aterosklerotické embolizace či vyloučení jiné disekce byla provedena další ultrazvuková vyšetření tepen: karotidy, břišní tepny, tepny dolních končetin bez nálezu významných aterosklerotických plátů či jiné patologie.
Image 1. CT angiografie, arteriální fáze, koronární rovina. V obou renálních tepnách na segmentární úrovni jsou patrná aneurysmata (šipky). Je průkazný i asymetrický výpadek perfuze parenchymu pravé ledviny. 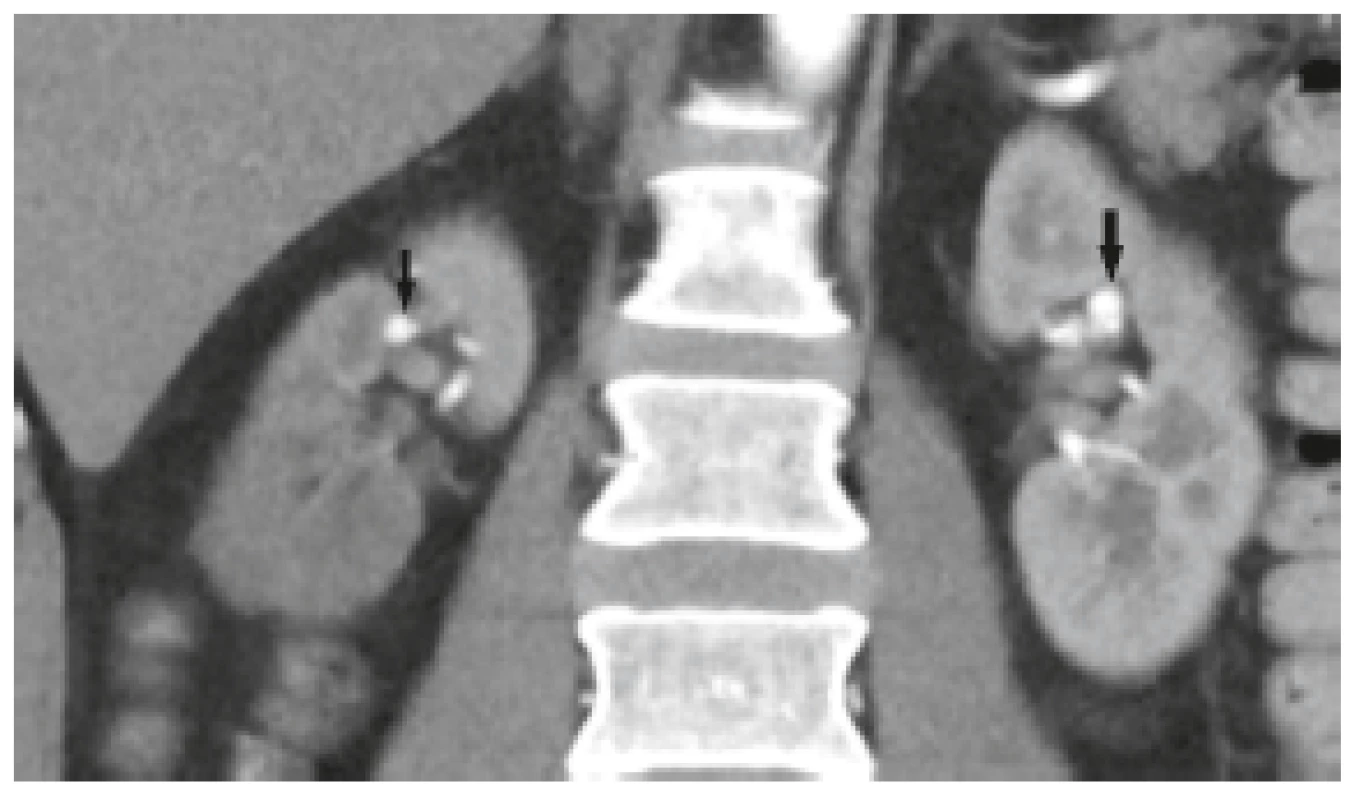
Image 2. 3D rekonstrukce levé renální tepny zobrazuje prostorový model aneurysmat 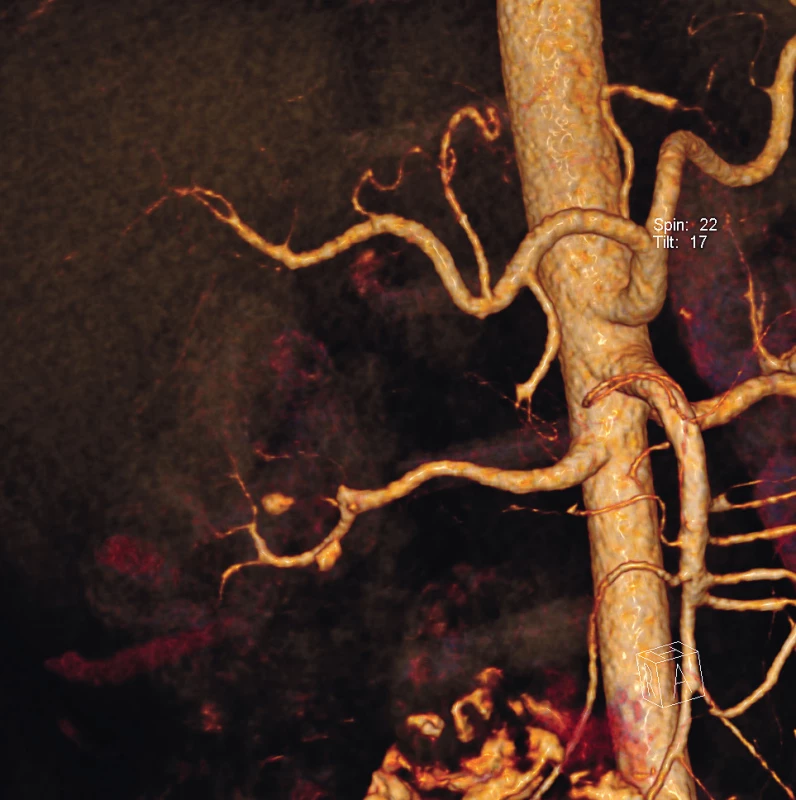
Image 3. Selektivní angiografie pravé renální tepny potvrzuje přítomnost několika aneurysmat (šipky). Rovněž je patrný kompletní výpadek perfuze kaudální třetiny ledviny. 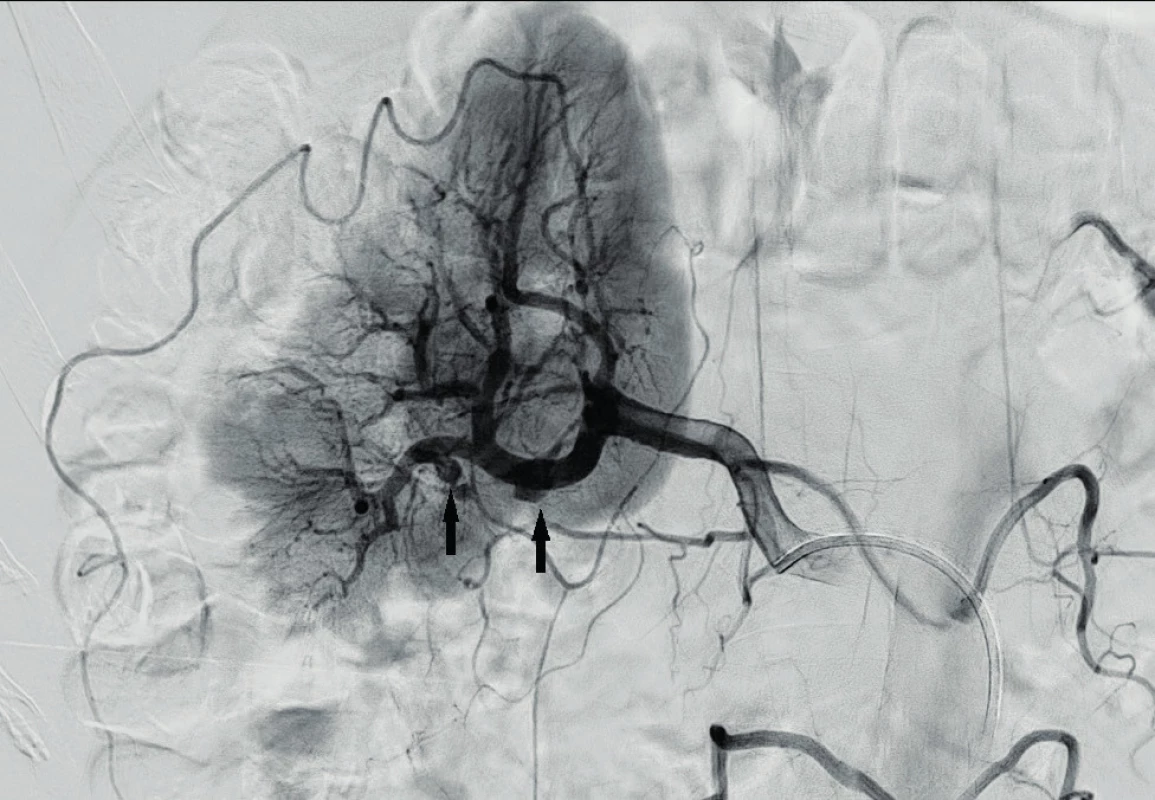
Image 4. Selektivní angiografie arteria hepatica propria odhaluje několik drobných promývaných aneurysmat (šipky) 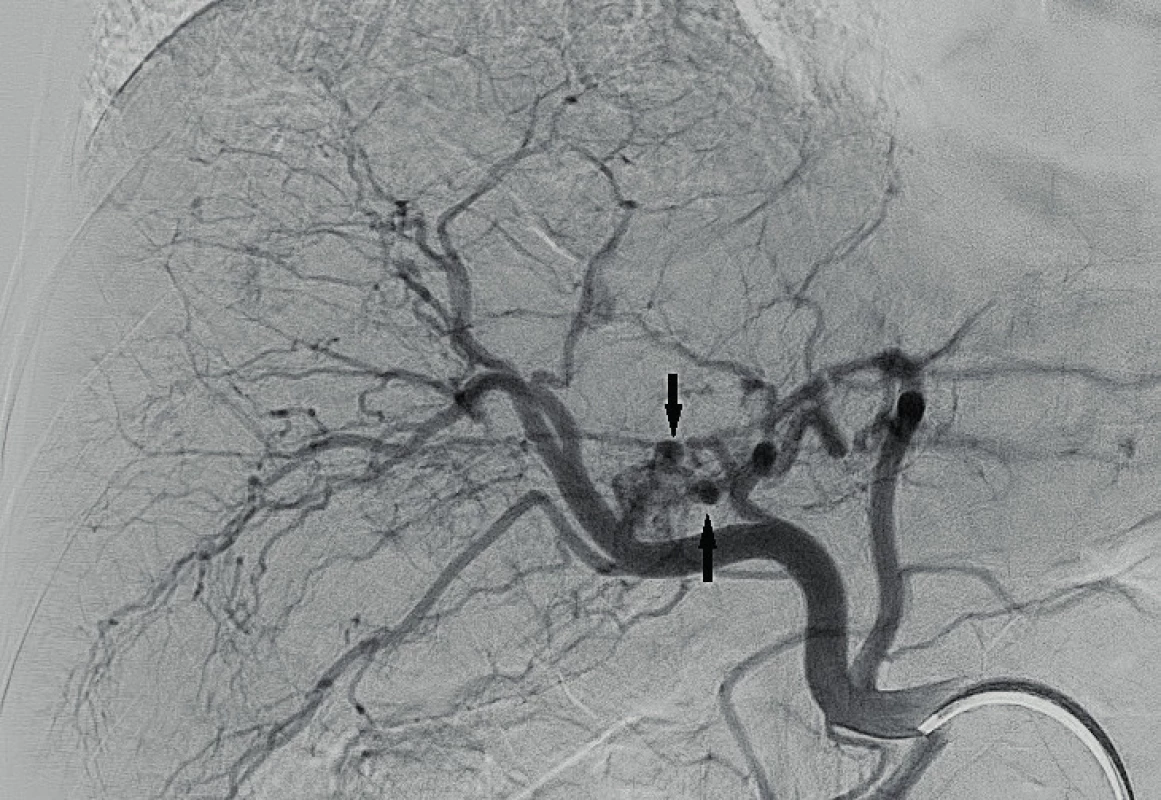
Image 5. CT angiografie, koronární rekonstrukce disekované společné až vnější ilické tepny vlevo 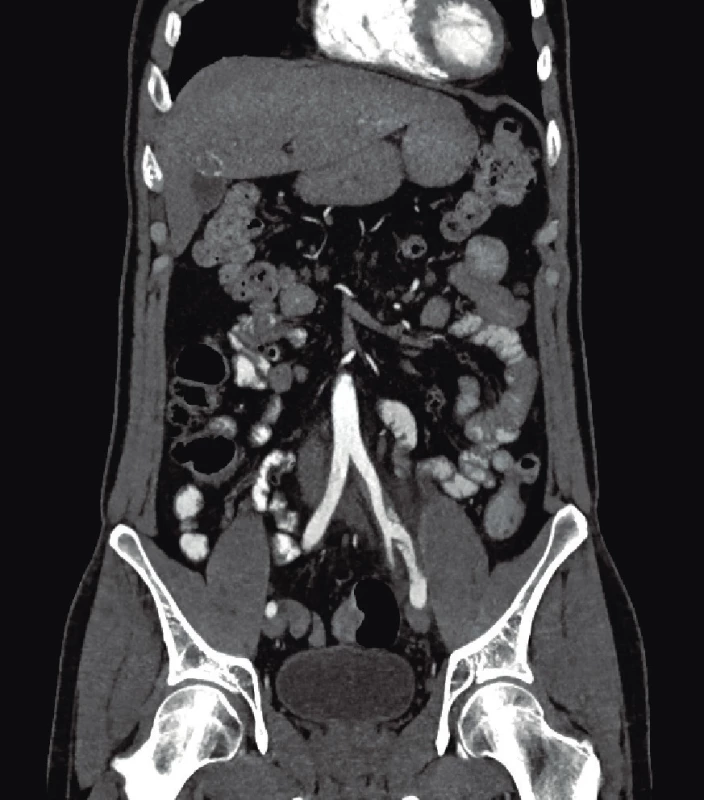
Image 6. CT angiografie, transverzální zobrazení disekce a. iliaca vlevo 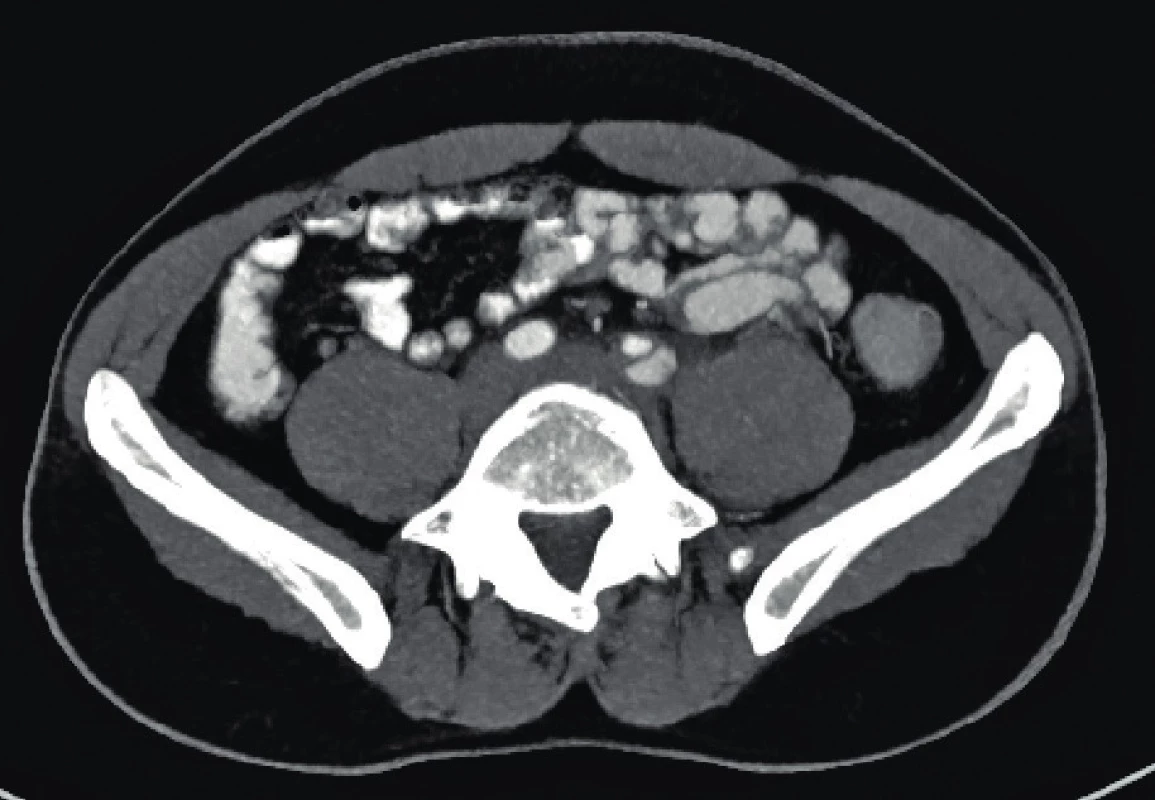
Arteriální hypertenze, která pacienta provázela po většinu času hospitalizace, byla hodnocena jako sekundární při postižení ledvinného parenchymu, byla nasazena kombinace antihypertenziv (ACE inhibitory, blokátory kalciových kanálů, centrálně působící antihypertenziva) s dostatečným efektem.
Během vyšetřování se zvažovalo především infekční onemocnění, a to i s přihlédnutím k epidemiologické anamnéze a nálezu cévních aneurysmat, kdy bylo nutné vyloučit jejich infekční etiologii. V úvaze byla i možnost septických embolizací. Provedli jsme panel mikrobiologických a imunologických vyšetření včetně cestovatelských nákaz a sexuálně přenosných chorob (opakované hemokultury, sérologická vyšetření, antistreptolyzin O, párové sérum k vyšetření HIV1 a 2, syfilis, chlamydií, borrelií, cestovatelských střevních nákaz, Ebsteina-Barrové viru, CMV, brucelózy, yersinií, vyšetření aspergilového a kandidového galaktomananu, tuberkulózy včetně vyšetření quantiferonu, parazitologické vyšetření stolice. Kandidový galaktomanan vyšel vysoce pozitivní, ale nebyly přítomné žádné příznaky recentního mykotického infektu. Byla zahájena terapie flukonazolem a pátrání po možné mykotické infekci. Bylo provedeno vyšetření plic: prostý snímek hrudníku, vysoce rozlišovací CT plic, bronchoskopie včetně bronchoalveolární laváže. Dále bylo provedeno vyšetření stěru z rekta a moči na PCR (polymerázová řetězová reakce) kandidy bez průkazu mykotické infekce. Proto byla mykotická infekce hodnocena jako málo pravděpodobná. Výsledky souborně přinášejí tabulky 2, 3, 4 a 5.
Table 2. Nálezy zobrazovacích vyšetření 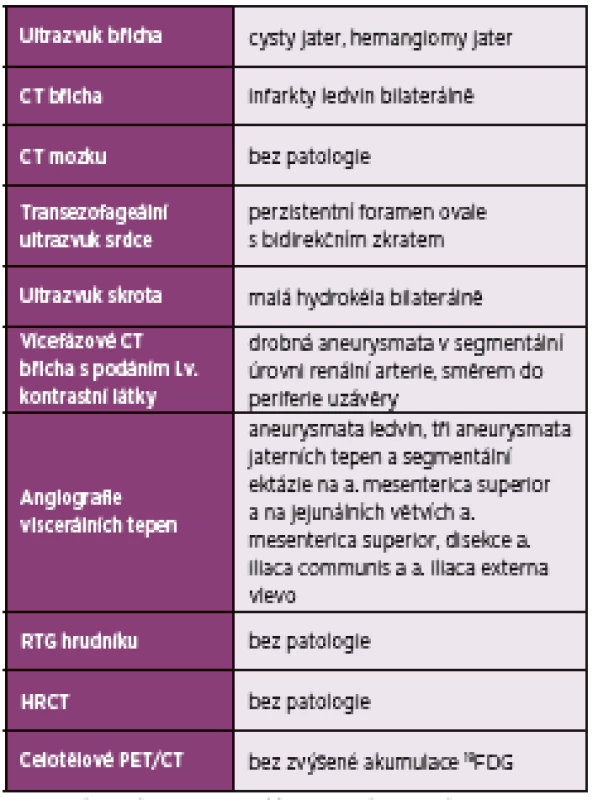
HRCT – výpočetní tomografie s vysokým prostorovým rozlišením, PET/CT – pozitronová emisní tomografie/počítačová tomografie, 18FDG – fludeoxyglukóza-(18F) Table 3. Biochemická, hematologická a imunologická vyšetření 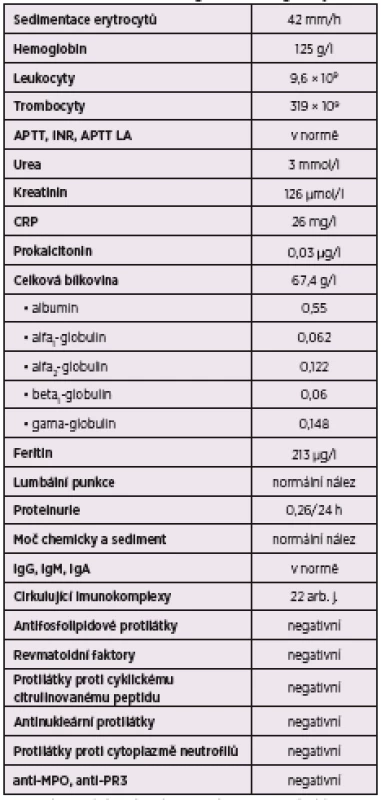
APTT – aktivovaný částečný tromboplastinový čas, INR – mezinárodní normalizovaný poměr, APTT LA – aktivovaný parciální tromboplastinový čas – s reagencií necitlivou na LA, CRP – C-reaktivní protein, Ig – imunoglobulin, anti-MPO – protilátky proti myeloperoxidáze, anti-PR3 – protilátky proti proteináze 3, arb. j. – arbitrální jednotka Table 4. Výsledky mikrobiologických vyšetření 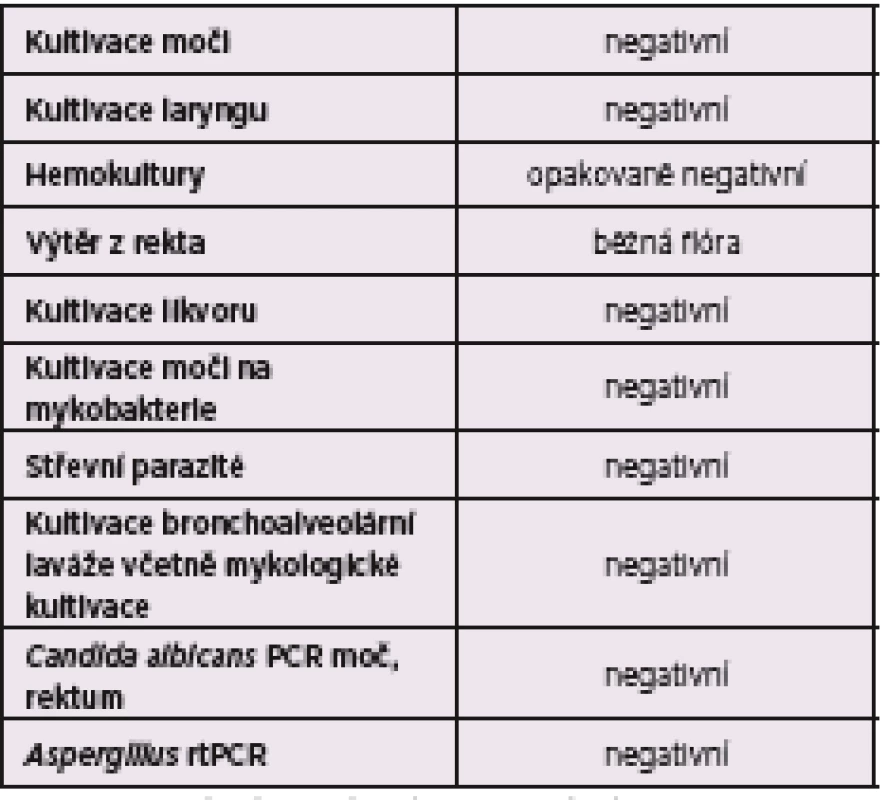
rtPCR – polymerázová reverzní transkripce řetězové reakce Table 5. Výsledky sérologických vyšetření 
HIV – virus získané lidské imunitní nedostatečnosti, OCH test – Ericsonův test,
CMV – cytomegalovirus, Ig – imunoglobulin, Ag – antigenVzhledem k malé pravděpodobnosti infekčního onemocnění a vysoké pravděpodobnosti vaskulitidy na imunopatologickém podkladě byla zahájena pulzní intravenózní terapie glukokortikoidy v dávce 1000 mg methylprednisolonu obden, celkem 5krát. Po ukončení pulzní terapie glukokortikoidy byl podáván methylprednisolon 48 mg/den s postupnou detrakcí a byla zahájena pulzní terapie cyklofosfamidem 1000 mg (15 mg/kg) podle protokolu EUVAS (7). Po této terapii došlo ke zlepšení zdravotního stavu pacienta. Ustoupily horečky i výrazná slabost, přetrvávala pouze zmírněná bolest v pravém třísle. Po léčbě došlo k normalizaci hodnot urey i kreatininu.
Následovaly čtyři podání pulzní terapie cyklofosfamidem (celkově podáno 6krát 1000 mg cyklofosfamidu), který pacient dobře toleroval. Postupně jsme snižovali dávku glukokortikoidů až na 12 mg/den methylprednisolonu. Po přehodnocení stavu, kdy ve spolupráci s angiology provedeno i hybridní vyšetření celotělovou pozitronovou emisní tomografií a RTG počítačovou tomografií (PET/CT), nebyl v cévách ani jinde shledán zvýšený metabolismus 18 fluorodeoxyglukózy, který by svědčil pro aktivní zánět. Následně byla nasazena terapie azathioprinem v konečné dávce 2 mg/kg. Při postupném navyšování dávky však došlo ke gastrointestinální nesnášenlivosti. Proto byla změněna terapie na methotrexát 10 mg týdně s kyselinou listovou 10 mg týdně, a to s dobrým efektem a tolerancí. Třicet šest měsíců od stanovení diagnózy je pacient stabilizován, bez progrese onemocnění, v terapii methotrexátem 10 mg týdně + kyselina listová 10 mg týdně a methylprednisolonem 12 mg/den.
Pro postižení levostranné arteria iliaca communis a arteria iliaca externa disekcí byl stav konzultován s angiologickým pracovištěm, kam pacient dochází na pravidelné kontroly, a nález je pravidelně sledován ultrasonografickým vyšetřením. Nález se nemění, obě lumen disekce jsou nadále průchodná, končetina je dobře prokrvená až do periferie. Terapeuticky je indikována pouze kyselina acetylsalicylová, zatím bez indikace endovaskulárního výkonu.
DISKUZE
Diferenciální diagnostika PAN je složitá vzhledem k nespecifickým symptomům vycházejících z široké škály příznaků horeček nejasné etiologie, kdy jejich vyšetřování vede často k vyšetření pomocí PET/CT. V našem případě to byly subfebrilie až febrilie, hubnutí, bolesti svalů a kloubů. Diagnostika PAN je složitá i pro absenci specifického laboratorního testu. Proto byla navržena klasifikační kritéria PAN ACR 1990 (5), kde k diagnóze je nutná pozitivita tří z deseti znaků. V našem případě pacient splnil kritérium ztráty hmotnosti, myalgie a slabosti dolních končetin, elevace kreatininu, bolesti varlat a arteriografický nález aneurysmat a okluzí viscerálních tepen. Biopticky se nález neověřoval. Naopak zavádějící v rámci diagnostiky byla pozitivita sérologie na mykózy, ale po podrobném vyšetření byla mykotická infekce shledána jako velmi nepravděpodobná. Dalším komplikujícím momentem vyšetřování byla pozitivní epidemiologická anamnéze, která nás v tomto případě nutila pátrat důkladněji i mezi sexuálně přenosnými a exotickými chorobami.
PAN na rozdíl od ANCA vaskulitid nezpůsobuje glomerulonefritidu (4, 8). Rozdílnost oproti ANCA vaskulitidám je dána kalibrem postižených cév, což lze dobře prezentovat na postižení ledvin a přítomnosti či absenci postižení glomerulů. PAN je obvykle příčinou klínovitých infarktů s bází k povrchu ledviny, naproti tomu mikroskopická polyangiitida postihuje drobné cévy glomerulů.
Příčinou viscerálních aneurysmat jsou i mykotická aneurysmata, což jsou infekční aneurysmata především bakteriální etiologie. Jsou komplikací hematogenního rozsevu bakteriální infekce, nejčastěji při endokarditidě, následkem iatrogenního postižení či intravenózního užívání drog.
V rámci prezentace tohoto případu klasické PAN s méně obvyklým postižením iliackých arterií je vhodné komentovat diferenciální diagnostiku onemocnění, která mohou způsobovat aneurysmata viscerálních arterií. Krom zde diskutované PAN je nejčastější příčinou ateroskleróza (32 %), cystická medionekróza (24 %), břišní trauma (22 %). Dále se na vzniku aneurysmat mohou podílet onemocnění pojiva (Marfanův syndrom, Ehlersův-Danlosův syndrom, fibromuskulární dysplazie) či další vaskulitidy (Takayasu arteritida, Kawasakiho choroba, vaskulitidy při jiných systémových onemocněních pojiva) (12 %) (9).
Podle dostupné literatury není disekce stěny tepen u PAN ojedinělá. Nejčastěji jsou popisovány případy disekce truncus coeliacus a koronárních tepen (10, 11).
Kazuisticky je popsán případ katastrofické mnohočetné disekce (bilaterální disekce karotid, bilaterální disekce renálních arterií, arteria mesenterica superior a ektázie iliackých tepen) při konkomitantní PAN a Elhersově-Danlosově syndromu. PAN je jen výjimečně spojena s arteriální disekcí, zatímco u Elhersova-Danlosova syndromu je výskyt disekcí v 5–10 % (12). V našem případě bylo disekující aneurysma asymptomatické, protože po celou dobu nepůsobilo a ani doposud nepůsobí, významnou stenózu.
Z prostudované literatury nejsou popisovány případy disekce iliackých tepen při samotné PAN. Jako nejčastější příčina spontánní disekce iliackých tepen jsou udávány Marfanův syndrom, Elhersův--Danlosův syndrom, fibromuskulární dysplazie, těhotenství, deficit alfa1 - antitrypsinu, trauma, fyzický trénink a ateroskleróza (13). Lze si zpětně uvědomit, že pacient neměl typické příznaky ani Marfanova syndromu ani Ehlersova-Danlosova syndromu, nicméně neproběhlo podrobnější vyšetření. Vzhledem k raritnímu výskytu spontánní disekce iliackých tepen není jasně určen terapeutický postup. Při ruptuře je indikována operační revize, při symptomatické disekci bez známek ruptury může být indikována endovaskulární terapie. Při konzervativním postupu je z literatury nejčastěji indikovaná kombinovaná antiagregační a antikoagulační terapie (14). Trauma, aterosklerózu, mediokalcinózu ani jiné příčiny jsme nezjistili.
ZÁVĚR
Diagnostika polyarteritis nodosa je poměrně složitá, jak dokazuje i předložená kazuistika. V diferenciální diagnostice je nutné vyloučit celou řadu onemocnění, a to jak infekční nemoci, jiné autoimunitní onemocnění či malignity. Vždy je důležité odebrat podrobně i epidemiologickou anamnézu.
Angiografický nález aneurysmat je jedno z deseti diagnostických kritérií PAN dle ACR z roku 1990, je však nutné nález korelovat s ostatními příznaky. V dnešní době může být použita jako základ diagnostiky i metoda PET/CT (15).
Po zkušenosti z případu naší kazuistiky doporučujeme myslet i na vzácnější projevy PAN a možné disekce středně velkých cév, zvážit provedení UZ daných tepen minimálně před plánovanými angiografickými vyšetřeními, aby nedošlo k poranění již postižené cévy a následným komplikacím.
Při včasné diagnóze a adekvátní terapii PAN je prognóza onemocnění dobrá, u značné části nemocných je možné dosáhnout úplné remise onemocnění.
Práce vznikla za podpory projektu PROGRES Q40-15 (Karlovy Univerzity).
Poděkování
Děkuji zejména sestrám a lékařskému kolektivu, který se podílel na péči o pacienta, a také kolegům jiných odborností účastnících se na tomto případu.
Konflikt zájmů: žádný.
adresa pro korespondenci:
doc. MUDr. Tomáš Soukup, Ph.D.
II. interní gastroenterologická klinika Fakultní nemocnice Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: tomas.soukup@fnhk.cz
Sources
1. Pavelka K, Bečvář R. Vaskulitidy. In: Pavelka K, Vencovský J, Horák P, Šenolt L, Mann H, Štěpán J, et al. Revmatologie, 2. aktualizované a rozšířené vydání. Praha: Maxdorf 2018.
2. Luqmani R. Polyarteritis nodosa and related disorders. In: Firestein GS, Budd RC, Gabriel SE, Mcinnes IB, O’Dell JR. (eds.) Kelly’s Textbook of Rheumatology. Philadelphia: Elsevier Saunders 2013; 1498–1507.
3. Merkel PA. Clinical manifestation and diagnosis of polyarteritis nodosa in adult In: uptodate.com (online). Curtis MR (ed.), Waltham MA. UpToDate Inc. https://www.uptodate.com (cit. 15. 1. 2019). Dostupné z: https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-polyarteritis-nodosa-in-adults?search=Clinical%20manifestation%20and%20diagnosis%20of%20polyarteritis%20nodosa%20in%20adult&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
4. Němec P. Revmatologie pro praxi. Praha: Mladá fronta 2016; 310–316.
5. Lightfoot RW, Michel BA, Bloch DA, Hunder GG, Zvaifler NJ, McShane DJ, et al. The American College of Rheumatology 1990 criteria for the classification of polyarteritis nodosa. Arthritis Rheum 1990; 33 : 1088–1093.
6. Merkel PA. Treatment and prognosis of polyarteritis nodosa In: uptodate.com (online). Curtis MR (ed.), Waltham MA. UpToDate Inc. (cit. 15. 1. 2019). Dostupné z: https://www.uptodate.com/contents/treatment-and-prognosis-of-polyarteritis-nodosa?search=treatment%20and%20prognosis%20of%20polyarteritis%20nodosa&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
7. Mukhtyar C, Guillevin L, Cid MC, et al. EULAR recommendations for the management of primary small and medium vessel vasculitis. Ann Rheum Dis 2009; 68(3): 310–317.
doi: 10.1136/ard.2008.088096 [Epub 2008 Apr 15].
8. Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65 : 1–11. doi:10.1002/art.37715
9. van Rijn MJ, Ten Raa S, Hendriks JM, Verhagen HJ. Visceral aneurysms: old paradigms, new insights? Best Pract Res Clin Gastroenterol 2017; 31 : 97–104. doi:10.1016/j.bpg.2016.10.017
10. Munguti CM, Ndunda PM, Muutu TM. Sudden death from spontaneous coronary artery dissection due to polyarteritis nodosa cureus. Cureus 2017; 9(10): e1737. doi:10.7759/cureus.1737
11. Galastri FL, Cavalcante RN, Motta-Leal-Filho JM, de Fina B, Affonso BB, de Amorim JE, et al. Evaluation and management of symptomatic isolated spontaneous celiac trunk dissection Vascular Medicine 2015; 20(4): 358–363. doi:10.1177/1358863X15581447
12. Caudrelier L, Pugnet G, Astudillo L, Delbrel X, Bura Riviere A, Sailler L Catastrophic multiple arterial dissections revealing concomitant polyarteritis nodosa and vascular Elhers-Danlos syndrome 2018,36,2, Clinical and Experimental Rheumatology 2018; Suppl1 : 0174–0175. PMID: 29745881 [PubMed]. https://www.clinexprheumatol.org/article.asp?a=12432
13. Spinella G, Pane B, Perfumo MC, Palombo D. Spontaneous iliac artery dissection treated with a combination of covered and self-expandable stents to preserve hypogastric patency. J Vasc Surg Cases 2016; 2 : 14–17.
14. Stanson AW, Friese JL, Johnson CM, McKusick MA, Breen, JF, Sabater EA, et al. Polyarteritis nodosa: Spectrum of angiographic findings. RadioGraphics 2001; 21 : 151–159.
15. Bleeker-Rovers CP, Bredie SJ, van der Meer JW, Corstens FH, Oyen WJ. F-18-fluorodeoxyglucose positron emission tomography in diagnosis and follow-up of patients with different types of vasculitis. The Netherlands Journal of Medicine 2003; 61(10): 323–329.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 2
Most read in this issue- Drug induced lupus
- Cutaneou vasculitis in SLE – to treat or not to treat?
- Polyarteritis nodosa with dissection of the iliac arteries
- Symptoms of depression and anxiety in patients with axial spondyloarthritis: a pilot study in patients with an active approach to physical activity treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

