-
Medical journals
- Career
Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
Authors: K. Bouchalova 1,2; J. Fráňová 2; M. Schüller 2; J. Skotáková 3; M. Macků 2
Authors‘ workplace: Dětská klinika, Ústav molekulární a translační medicíny LF UP a FN, Olomouc 1; Pediatrická klinika LF MU a FN, Brno 2; Klinika dětské radiologie LF MU a FN, Brno 3
Published in: Čes. Revmatol., 27, 2019, No. 3, p. 116-124.
Category:
Overview
Cílem práce byla jak detailní rešerše problematiky chronické rekurentní multifokální osteomyelitidy (CRMO), zpracovaná v první části, tak retrospektivní analýza péče o vlastní pediatrické pacienty se zaměřením na diagnostické parametry, léčbu a její výsledky. Specifickým cílem bylo zhodnotit léčbu pamidronátem.
Pacienti a metodika. Byla analyzována data 20 pacientů s CRMO (15 dívek a pět chlapců, poměr 3 : 1), kteří byli léčeni na Pediatrické klinice LF MU a FN Brno v období leden 2011 až květen 2016. Byla zhodnocena epidemiologická, klinická, laboratorní a radiologická data v čase diagnózy a v průběhu sledování.
Výsledky. Symptomatická místa byla především na dolních končetinách (u všech nemocných), dále na klavikule (u 35 % pacientů), páteři (35 %), horních končetinách (35 %) a sternu (10 %). Celotělové MR a biopsie byly provedeny u 7/20 (35 %) a 14/20 (70 %) pacientů. Alespoň jeden laboratorní znak zánětu byl zvýšen u 15 nemocných, avšak elevace CRP nad 30 mg/l byla pouze u čtyř dětí. Medián sledování od diagnózy byl 3,6 roku (rozmezí 0,2–8,8 let). Prednison (u šesti dětí) a metho - trexát (MTX u čtyř dětí) neměly dlouhodobý účinek. Naopak intravenózní pamidronát a etanercept vykazovaly dobrý efekt. Pamidronát byl použit u 14/20 (70 %) dětí. U 13/14 (93 %) těchto nemocných bylo pozorováno inaktivní onemocnění nebo zlepšení stavu. U 9/14 (64 %) nemocných byl pamidronát ukončen pro setrvalou inaktivitu onemocnění (absence bolesti, místních a systémových známek zánětu, včetně laboratorních zánětlivých znaků). Etanerceptem byli úspěšně léčeni dva nemocní.
Závěr. V případě selhání léčby pomocí nesteroidních antirevmatik jsme dosáhli výborných výsledků použitím pamidronátu, a to bez závažných nežádoucích účinků. Naopak kortikoidy a MTX měly pouze krátkodobý efekt. Další výzkum je vhodné zacílit na markery remise a optimalizaci léčebného režimu s pamidronátem.
Klíčová slova:
chronická rekurentní multifokální osteomyelitida – celotělová magnetická rezonance – pamidronát
Úvod
Chronická rekurentní multifokální osteomyelitida (CRMO) byla poprvé popsána v roce 1972 Giedionem na souboru čtyř dětí (1). Termín CRMO vyjadřující tendenci onemocnění k rekurenci byl publikován o 5 let později Probstem, Bjorkstenem a Gustavsonem (2). Od té doby je název používán pro tuto klinickou jednotku, třebaže se nejedná vždy o onemocnění multifokální ani rekurentní (1–3). Onemocnění lze v literatuře nalézt i pod dalšími názvy, jako jsou např. chronická nebakteriální osteomyelitida (CNO), nebakteriální osteomyelitida (NBO), chronická sklerozující osteitida (3). Od popisu onemocnění zaznamenáváme evoluci jak diagnostických metod a diagnostických kritérií, tak léčby. Dále jsou zpracovány možnosti léčby, zahrnující v případě farmakoterapie především nesteroidní antirevmatika, non steroidal antiinflammatory drugs (NSAIDs) a léky modifikující chorobu, disease modifying drugs (DMARDs), klasické i biologické. Větší prostor je věnován roli bisfosfonátů v léčbě této vzácné autoinflamatorní nemoci.
ETIOLOGIE
CRMO patří mezi kostní autoinflamatorní nemoci. Přesná etiologie zatím zůstává neznámá. Nicméně recentní data ukazují na roli FBLIM1, kdy byla nalezena homozygotní mutace filamin-binding domain tohoto genu v případě dítěte s CRMO příbuzných rodičů (4). Je studován genetický podklad a existují data ukazující na roli lokusu 18q21.3-22 v rozvoji této nemoci (5). Ke studiu nemoci byly vyvinuty dva zvířecí/myší modely CRMO s mutací genu PSTPIP2 pro prolinovou-serinovou-treoninovou fosfatázu. Je potvrzeno, že k rozvoji nemoci u myšího modelu není potřebná adaptivní imunita (3). Intenzivní studium mikrobiomu přineslo zajímavé informace o roli patogenů, jako je Kingella Kingae nebo Prevotella (6).
EPIDEMIOLOGICKÁ DATA
CRMO představuje vzácné onemocnění, vyskytující se především v dětském věku. Začátek onemocnění bývá nejčastěji mezi 7 a 12 lety. Začátek před 2. rokem věku je neobvyklý, v těchto případech je potřeba vyloučit syndromologickou formu CRMO, jako je deficit antagonisty IL-1 receptoru (DIRA) a Majeed syndrom. Bývají častěji postiženy dívky v poměru 2 : 1 ke chlapcům. V současné době je v literatuře popsáno několik stovek případů, avšak incidence je stále neznámá (3). Data publikovaná Girschickem et al. ukazují 486 pacientů (z toho 455 dětí) s CRMO evidovaných v registru Eurofever (7). Recentní publikace ukazuje, že se pravděpodobně jedná o onemocnění alespoň stejně časté jako infekční osteomyelitidy (8). Naše data z jednoho dětského revmatologického centra (Pediatrická klinika Brno, ČR) popisují 20 nemocných, léčených v období leden 2011 až květen 2016 (9).
KLINICKÝ PRŮBĚH A DIAGNOSTICKÁ KRITÉRIA
Jedná se o onemocnění s chronickým nebo častěji undulujícím průběhem, kdy aktivita je střídána s remisemi. Mezi hlavní klinické projevy patří lokalizovaná bolest kostí, otok a zduření okolních tkání, mohou být přítomny celkové příznaky, jako je horečka. Onemocnění může postihnout kteroukoliv kost v těle, nejčastěji jsou to metafýzy dlouhých kostí, klíční kost, těla obratlů a pánev (3). Počet osteomyelitických lézí kostí bývá od jedné do 18 (3), s dostupností celotělové magnetické rezonance (WB MR) vzrostl i počet detekovatelných lézí, mnohdy klinicky asymptomatických, např. Roderick et al. popisují dívku s celkem 23 lézemi nalezenými na WB MR (10). Symetrické postižení kostí bývá u 25–45 % nemocných (3). Rovněž mohou být přítomny extraoseální projevy, z nichž nejčastější jsou kožní projevy (3). Prognóza onemocnění je různá, zastoupení nemocných s trvající aktivitou nemoci je ve studiích s délkou sledování nad 5 let uváděno v rozmezí 0–100 % (3). V diferenciální diagnostice vylučujeme infekční osteomyelitidu, maligní kostní tumory (jako jsou primární intraoseální lymfom, osteosarkom, Ewingův sarkom, leukemie, neuroblastom), benigní kostní léze (osteoidní osteom a osteoblastom), histiocytózu z Langerhansových buněk, Rosai-Dorfmanovo onemocnění, psoriatickou artritidu, spondyloartropatie, hypofosfatázii a imunodeficity (3).
V současnosti je pro diagnostiku CRMO používáno více kritérií. Diagnostika se postupně vyvíjela především v návaznosti na rozrůstající se možnosti zobrazovacích metod (tab. 1). Zatímco Kingova kritéria z roku 1987 (11–12) vyžadovala pro diagnózu CRMO pozitivní histopatologický nález, lze nyní za určitých podmínek stanovit dg CRMO i bez provedení biopsie. Tak je tomu v případě kritérií Janssonové z roku 2007 (kombinace hlavních kritérií s vedlejšími kritérii) (13) nebo Bristolských kritérií (14). V případě druhých jmenovaných se lze bez biopsie obejít v případě mnohočetného postižení kostí nebo izolovaného postižení klavikuly a zároveň CRP pod 30 g/l (tab. 1). Diagnostická kritéria nebyla dosud validována.
Table 1. Přehled diagnostických kritérií CRMO 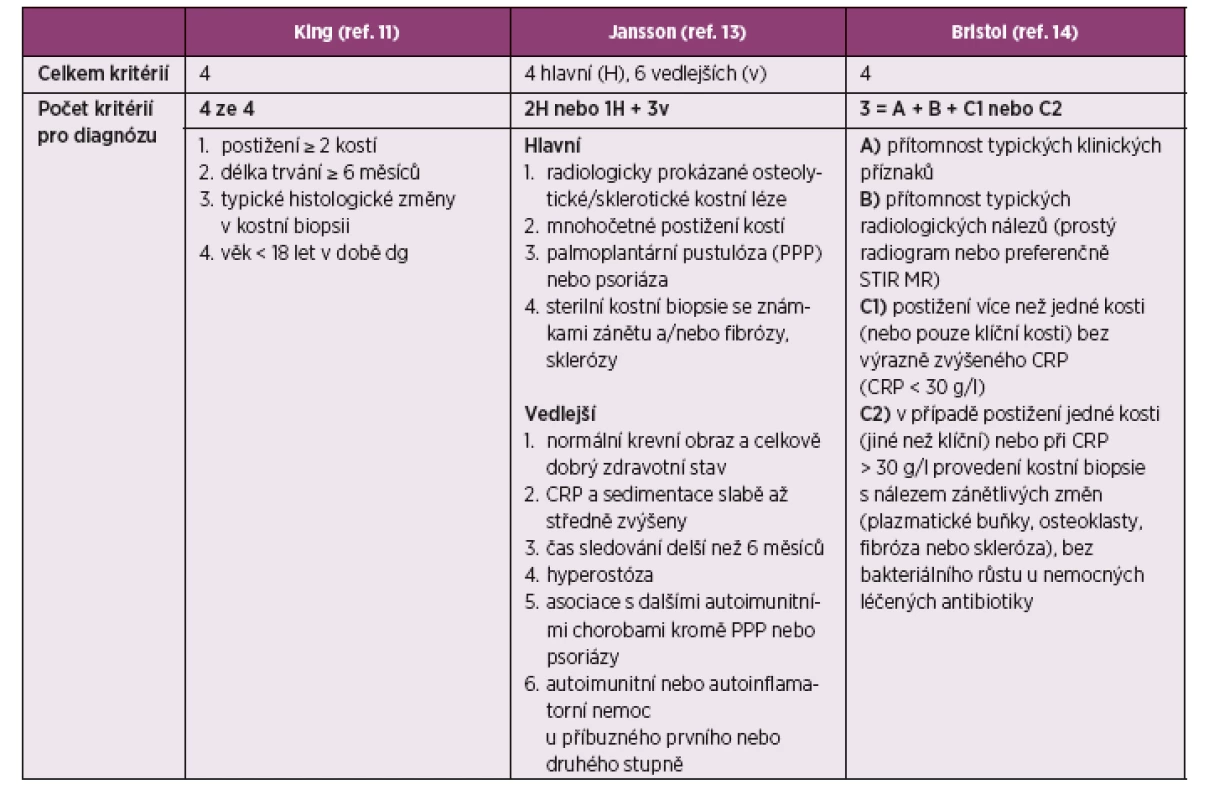
DIAGNOSTICKÉ METODY
Radiologická diagnostika CRMO je zahajována prostým radiogramem oblastí s klinickým postižením. Poté se za nejvhodnější považuje provedení celotělového MR (WB MR) se STIR zobrazeními k odhalení asymptomatických lézí. Následně jsou provedeny RTG snímky asymptomatických lézí, zjištěných na WB MR a eventuálně je posouzen rozsah postižení pomocí lokalizovaného MR (3).
Významnou výhodou WB MR je, že deteguje klinicky okultní/němé léze (3, 15, 16), což je významné především v případě asymptomatického postižení páteře. Navíc je WB MR senzitivnější v porovnání s kostními skeny v odhalování klinicky a radiograficky okultních lézí (3, 16). Další výhodou WB MR je, že zobrazuje i mimokostní postižení, jako je myositida a synoviitida (3, 16). Výhodou WB MR je rovněž eliminace radiace, proto v mnoha institucích toto vyšetření nahradilo kostní skeny (scintigrafii) (3, 16). CT v diagnostice CRMO ustoupilo rovněž do pozadí s ohledem na radiační zátěž. WB MR je prováděna obvykle s použitím přístroje 1,5 T (10). Využití přístrojů 3 T bylo publikováno, jejich limitací zůstává omezené potlačení tuku a rostoucí sklon k artefaktům oproti 1,5 T (17).
Prostý radiogram je v časné fázi normální nebo ukazuje osteopenii (3). Nejčastější radiologické nálezy jsou smíšené osteolytické a sklerotické léze s predilekčním postižením metafýz dlouhých kostí. Mohou být přítomny periostální reakce. Postižení malých tubulárních kostí je častěji spojeno se signifikantní periostální reakcí, než bývá typicky nalézáno u dlouhých kostí.
Ztluštění kortikalis a progresivní skleróza představují léze, které se objevují později v průběhu nemoci a jsou následovány postupnou normalizací radiologických nálezů v průběhu let. Postižení epifýz je neobvyklé, avšak může se vyskytnout a vede k předčasné epifyzeální fúzi. Stejně tak je neobvyklé postižení diafýz, v tom případě se nalézá blízko postižených oblastí metafýz. Léze klavikuly bývají typicky uloženy v její mediální části a mohou mít lytický destruktivní vzhled s periostální novou kostní formací v případě aktivního onemocnění. V průběhu hojení dochází k nárůstu sklerotizace. Opakované periody remisí a aktivity onemocnění často vedou k progresivní skleróze a hyperostóze (3). Léze páteře typicky vykazují eroze vertebrálních ploch někdy společně s redukcí meziobratlových prostorů, které mohou napodobovat infekční spondylodiscitidu. Mohou se vyskytnout destruktivní lytické léze zahrnující těla obratlů, které mohou předcházet jejich kolapsu. Také mohou být nalézána vertebra plana. Postižení zahrnující pánevní kosti může být objeveno v těsném okolí kloubů a synchondróz a často má sklerotický vzhled. Součástí kostních lézí pánve může být také sakroiliitida (3).
Aktivní léze na WB MR mají typicky vysokou intenzitu signálu na T2-vážených (T2-weighted) a short tau inversion recovery (STIR) zobrazeních v kombinaci se sníženou intenzitou signálu na T1-vážených (T1-weighted) snímcích (3). Podle vývoje kostní léze v čase je v principu možné na MR popisovat časné nálezy, kterými jsou edém kostní dřeně a perioseální edém (3). V průběhu nemoci je přítomné ztluštění kortikalis a progresivní skleróza, ve fáze hojení narůstající skleróza a hyperostóza (3). CRMO je možné hodnotit pomocí aktuálně publikovaného radiologického indexu pro nebakteriální osteomyelitidu, NBO (RINBO indexu) (18). Tento index hodnotí parametry kvantitativně na základě WB MRI (tab. 2). Maximální možná hodnota indexu je 10.
Histopatologické nálezy závisí na trvání léze. V časné fázi je převaha neutrofilů, zatímco pro pozdní léze jsou typické smíšené zánětlivé infiltráty s převahou lymfocytů a plazmocytů s různým zastoupením sklerózy a fibrózy. V časné fázi také bývají abscesy a zvýšená aktivita osteoklastů se známkami zvýšené kostní resorpce. V pozdní fázi mohou být i mnohojaderné obrovské buňky, nekrotická kost, oblasti kostní novotvorby a již zmíněná fibróza. Histopatologický obraz může být v rámci jedné léze heterogenní, a proto je potřeba posoudit více řezů z každého bioptického vzorku (3, 19).
Zánětlivé markery sedimentace erytrocytů (FW), C-reaktivní protein (CRP), krevní obraz s diferenciálním rozpočtem mohou a nemusejí být abnormální. Většina nemocných má lehce zvýšenou FW a CRP. Počet bílých krvinek bývá typicky normální nebo pouze lehce zvýšený. Nebývají přítomné vysoké titry autoprotilátek a není silná asociace s HLA B27. V séru nemocných byly nalezeny zvýšené sérové hladiny tumor nekrotizujícího faktoru alfa (TNF-α) a interleukinu 6 (IL-6), což ukazuje na jejich roli v patogenezi onemocnění (3).
Recentně Hofmann et al. popsali devět sérových markerů zánětu, které umožňují odlišení pacientů s CRMO od nemocných s Crohnovou nemocí a zdravých kontrol (Eotaxin, IL-12, IL-1RA, sIL-2R, IL-6, MCP-1, MIG, MIP-1b a RANTES). Tyto proteiny mohou být užitečné pro diagnostiku v budoucnosti, nicméně je potřeba je otestovat na větší multietnické kohortě nemocných a u pacientů s přídatnými zánětlivými onemocněními (20).
ASOCIACE S DALŠÍMI ONEMOCNĚNÍMI
Společně s CRMO je možné nalézt u pacientů další autoinflamatorní nemoci, jako jsou psoriáza (P), palmoplantární pustulóza (PPP), generalizovaná pustulózní psoriáza (GP), nespecifické střevní záněty (IBD): Crohnova nemoc (CD), ankylozující spondylitida, těžká akné (3). Ve třech publikovaných souborech byla zmíněna vysoká incidence výskytu CD v příbuzenstvu pacientů s CRMO, kdy 13 % nemocných mělo příbuzné prvního či druhého stupně trpící CD, což podporuje souvislost IBD a autoinflamatorních kostních nemocí (přehledně v 3, 13, 21, 22). Zda jsou CRMO a syndrom zahrnující synovitis, acne, pustulosis, hyperostosis a osteitis (SAPHO) stejná onemocnění v různých věkových kategoriích (SAPHO se vyskytuje především u dospělých), zůstává předmětem odborné diskuze (3, 6).
LÉČBA
Léčbou první volby jsou NSAIDs, jejichž účinnost je popisována asi u 1/3 nemocných. Efekt těchto léků se jeví lepší u dětí s limitovanou nemocí (6, 7). Při jejich selhání ve druhé linii připadá v úvahu více druhů léků. Byly používány glukokortikoidy, sulfasalazin, methotrexát (MTX), azitromycin, kolchicin, hyperbarický kyslík, interferon α, interferon γ, kalcitonin, bisfosfonáty nebo biologická DMARDs (anti-TNF) léčba (3, 6, 7). Nyní se v klinické praxi v této linii uplatňují především bisfosfonáty a biologická DMARDs (viz níže).
V poslední době se jako efektivní ukazují bisfosfonáty, především u nemocných s postižením páteře v podobě fraktur obratlů (6, 23, 24). Bylo používáno mnoho různých léků této skupiny: pamidronát, neridronát, alendronát, risedronát. Největší klinické zkušenosti jsou s pamidronátem, v literatuře je popsáno cca 120 takto léčených dětí s CRMO, z toho v našem centru 14 (3, 6, 8, 10, 12, 14, 20, 23–47). Jiné dvě práce uvádějí dalších 17 pacientů léčených bisfosfonáty, není však zřejmé, kolik jich užívalo pamidronát (25, 26). Ten se jeví jako vysoce efektivní i u případů rezistentních k jiným lékům (6). Nicméně výsledky randomizovaných klinických studií scházejí vzhledem k velmi nízké incidenci onemocnění. V současnosti probíhá klinická studie porovnávající pamidronát s placebem (48). Aktuálně není k dispozici prediktor odpovědi na léčbu pamidronátem. Při podávání pamidronátu je nutný monitoring (elektrolyty, vápník, fosfor, hořčík, kreatinin) a doporučena suplementace vápníku a vitaminu D (49). V souvislosti s podáváním je popisován flu-like syndrom (10), jemuž lze předejít podáním antipyretik-antiflogistik.
Efekt pamidronátu ve smyslu zlepšení klinických projevů bývá zaznamenáván již po prvním podání, efekt na radiologické projevy si vyžaduje prospektivní klinickou studii. Obvykle je podávána dávka 1 mg/kg/den po dobu 3 po sobě jdoucích dnů. Obvykle je doporučována maximální jednotlivá dávka 60 mg. První dávka první série bývá poloviční, tj. 0,5 mg/kg, s maximem 30 mg. Nejčastěji doporučované schéma je podávání každé 3 měsíce, lze však v literatuře najít i jiné intervaly podání léku (6, 48).
Biologická anti-TNF léčba zasahuje do narušené regulace cytokinů a obnovuje rovnováhu mezi vysoce prozánětlivými cytokiny a imunomodulačními cytokiny IL-10 a IL-19 (6). V literatuře je popsáno z biologických DMARDs mimo anti-TNF i použití anti-IL-1 (3, 50). Nicméně jednoznačná doporučení pro indikaci těchto léků schází.
PACIENTI A METODIKA
Byla retrospektivně analyzována data u pacientů s CRMO, kteří byli léčeni na dětské revmatologii Pediatrické kliniky FN Brno v období leden 2011 až květen 2016 (tab. 3). Kritéria pro zařazení byla přítomnost alespoň jedné léze odpovídající chronické osteomyelitidě potvrzená zobrazovacími metodami, nepřítomnost detekovatelné infekce a začátek onemocnění před 18. rokem života, podobně jako použili Wipff et al. (26). Klinicky inaktivní onemocnění bylo definováno jako absence bolesti, místních a systémových známek zánětu, včetně laboratorních zánětlivých znaků. Snímky WB MR byly provedeny přístrojem 1,5 Tesla na Klinice dětské radiologie LF MU a FN Brno v podobě řezů á 5 mm doplněné řezy páteří á 3,2 mm. Byla zhodnocena epidemiologická, klinická, laboratorní a radiologická data v čase diagnózy a v průběhu sledování. Efekt terapie byl hodnocen jako dosažení inaktivity onemocnění nebo zlepšení stavu. Odpověď na terapii byla hodnocena ke dni poslední kontroly.
Table 3. Klinická charakteristika pacientů 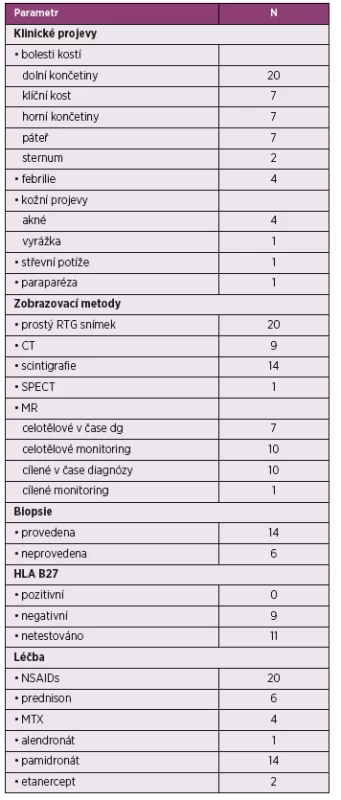
VÝSLEDKY
Celkem bylo léčeno 20 pacientů (15 dívek a pět chlapců, poměr 3 : 1) s CRMO. Medián věku na počátku symptomů byl 8,9 let (rozmezí od 2,8 do 14,7 let), medián věku při diagnóze 10,4 let (rozmezí 4,5–17,6 let). Medián času od začátku symptomů do času diagnózy byl 0,4 roku (rozmezí 0,1–8,0 let). Medián sledování od diagnózy byl 3,6 roku (rozmezí 0,2–8,8 let).
V předchorobí mělo šest dětí (30 %) imunopatologická onemocnění (atopickou dermatitidu n = 3, přičemž jeden z nich s anamnézou suspektní psoriatické artritidy léčené methotrexátem; psoriázu n = 1; chladovou alergii n = 1; potravinovou alergii n = 1). V dalším průběhu byla u jednoho chlapce (5 %) se střevní symptomatologií (viz výše) diagnostikována Crohnova nemoc. U dalšího dítěte (5 %) byla po stanovení diagnózy CRMO zjištěna psoriáza. U jiného nemocného byla po stanovení diagnózy CRMO potvrzena celiakie. V rodinné anamnéze byla zjištěna imunopatologická onemocnění u tří (15 %) pacientů (tyreopatie, alergie na bílkovinu kravského mléka a asthma bronchiale), nebyly přítomny autoinflamatorní nemoci.
Symptomatická ložiska osteomyelitidy byla především na dolních končetinách (u všech nemocných), dále na klavikule (u 35 % pacientů), páteři (35 %), horních končetinách (35 %) a sternu (10 %). Monofokální onemocnění bylo zjištěno u sedmi (35 %) dětí, v těchto případech se jednalo o postižení dolních končetin. Febrilie byly přítomné v čase diagnózy u 20 % dětí. Z mimokostních postižení byly nejčastější kožní projevy (25 %), akné mělo 20 % dětí a vyrážku charakteru keratotických ložisek lokte 5 %. Z dalších klinických projevů děti trpěly střevními potížemi (5 %) a paraparézou (5 %) (tab. 3). Relapsy byly zaznamenány u 8 (40 %) dětí, jejich počet byl 1 až 4.
Celotělové MR a biopsie byly provedeny u 7/20 (35 %) a 14/20 (70 %) pacientů. V případě bioptovaných pacientů se jednalo o monofokální postižení u čtyř (20 %) dětí. Prostý radiogram byl proveden u všech nemocných (obr. 1). Známky zánětu byly zvýšeny pouze u části nemocných: CRP u 13 nemocných (z toho byla hodnota nad 30 mg/l pouze u čtyř nemocných), FW u šesti dětí, leukocyty a trombocyty pouze u dvou dětí. Alespoň jedna z laboratorních známek zánětu byla přítomna u 15 dětí. Zvýšený feritin nebyl v našem souboru detegován (tab. 3). V našem souboru 19/20 pacientů vyhovělo kritériím podle Janssonové, u jednoho nemocného nebylo možné tato kritéria zhodnotit s ohledem na krátkou dobu sledování.
Image 1. Předozadní radiogram levého distálního bérce 11,5leté dívky s CRMO před (levý snímek) a rok od začátku léčby pamidronátem (pravý snímek). Periostální reakce a nehomogenní kostní struktura s mnohočetnými malými oblastmi projasnění a sklerózou v oblasti distální části levé tibie, významné zlepšení při léčbě pamidronátem. © doc. MUDr. Jarmila Skotáková CSc. – Klinika dětské radiologie, LF MU a FN Brno 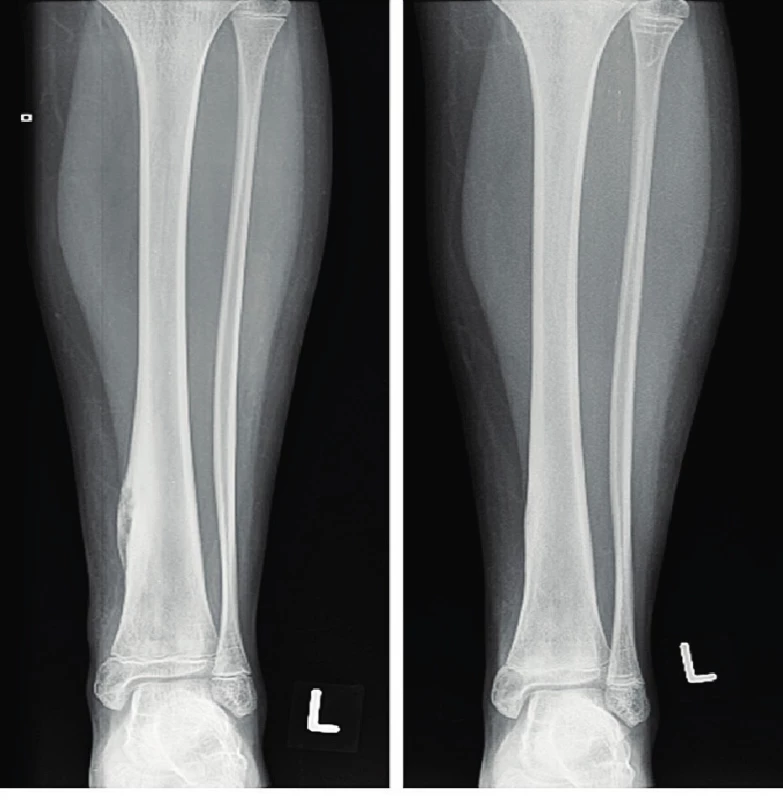
Léčba monoterapií NSAIDs byla úspěšná u 5/20 (25 %) nemocných. Prednison (u šesti dětí) a MTX (u čtyř dětí) neměly dlouhodobý účinek. Prednison byl použit v dávce 1 mg/kg/den po dobu 1 týdne s rychlým vysazením, u jednoho nemocného byl podáván dlouhodobě s ukončením po zahájení biologické léčby. Naopak intravenózní pamidronát a etanercept vykazovaly dobrý efekt. Pamidronát byl použit u 14/20 (70 %) dětí. U 13/14 (93 %) těchto nemocných bylo pozorováno inaktivní onemocnění nebo zlepšení stavu. U 9/14 (64 %) nemocných byl pamidronát ukončen pro setrvalou inaktivitu onemocnění. Obvykle bylo použito schéma podávání 3 dny po sobě každé 3 měsíce. Jednotlivá dávka pamidronátu byla 1 mg/kg/den, s maximem 60 mg, první dávky každé série byly poloviční. Etanerceptem byli úspěšně léčeni dva nemocní (jeden chlapec s nedostatečným efektem pamidronátu a jedna dívka s předchozí léčbou jiným bisfosfonátem alendronátem).
DISKUZE
Věk dětí na počátku symptomů CRMO ve studovaném souboru (8,9 let) odpovídá literárním údajům (3). V souboru převažovaly dívky v poměru 3 : 1, což rovněž odpovídá publikovaným datům (3). Byla publikována i práce, kde byly pouze dívky (10).
Všichni nemocní měli bolesti kostí dolních končetin, které jsou popisovány jako nejčastější místo osteomyelitidy (3). Taktéž zastoupení dětí s febriliemi je srovnatelné s publikovanými daty (3).
Bývá popisován souběh s dalšími autoimunitními a autoinflamatorními nemocemi. Z nemocných dětí s CRMO byla u jednoho hocha (5 %) diagnostikována Crohnova choroba. Jedná se o vzácný souběh nemocí, v literatuře je popsán pouze u minority pacientů s CRMO: 18 dětí a devět dospělých (29, 30).
U většiny nemocných byla v diagnostice použita celotělová MRI. Tato metoda je nyní používána v diagnostice CRMO v Dětské nemocnici FN Brno rutinně. U mladších dětí je vyšetření prováděno v celkové anestezii, u starších bez anestezie. Problémem může být výrazný hluk generovaný přístrojem, jeho vliv je možné omezit použitím sluchátek s reprodukovanou hudbou nebo pohádkami.
Léčba pamidronátem ze skupiny bisfosfonátů je dokumentována v literatuře u cca 120 pacientů s CRMO, kdy byla použita různá schémata, přičemž převažovaly tři denní cykly s dávkou 1 mg/kg/den každé 3 měsíce. Ve studovaném souboru jsme použili obdobné dávkování, první dávka každého cyklu byla poloviční. Pacienti v našem souboru léčbu dobře tolerovali. Flu-like syndromu bylo předcházeno podáváním antipyretik. U dvou nemocných (10 %) se vyskytla tromboflebitida v místě vstupu kanyly. Jako sekundární prevence se osvědčilo velmi pomalé podávání léku, u jednoho z nich doplněné každodenním použitím nové kanyly.
Zaznamenali jsme výborný efekt léčby. Obdobné výsledky prezentovali například Roderick et al. s efektem u 9/11 pacientů (10) a Kostik et al. s efektem u 88,8 % nemocných léčeným pamidronátem (31). Výborný klinický efekt pamidronátu popisují někteří pacienti již po první dávce (12, 24). Taková je i naše klinická zkušenost. Byli popsáni i nemocní, kteří měli výborný efekt po první a jediné dávce.
ZÁVĚR
V případě selhání léčby pomocí nesteroidních antirevmatik jsme dosáhli výborných výsledků použitím pamidronátu, a to bez závažných nežádoucích účinků. Naopak kortikoidy a MTX měly pouze krátkodobý účinek. Efekt terapie pamidronátem je potřeba studovat v prospektivní studii. Další výzkum je vhodné zacílit na markery remise a optimalizaci léčebného režimu s pamidronátem.
Podpořeno grantem MZ ČR – RVO (FNOl, 00098892) a MŠMT ČR NPU I LO1304 .
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Kateřina Bouchalová, Ph.D.
Dětská klinika LF UP a FN
Puškinova 6, 775 15 Olomouc
e-mail: katerina.bouchalova@upol.cz
Sources
1. Giedion A, Holthusen W, Masel LF, Vischer D. Subacute and chronic ‘symmetrical’ osteomyelitis. Ann Radiol (Paris) 1972; 15 : 329–342.
2. Probst FP, Bjorksten B, Gustavson KH. Radiological aspect of chronic recurrent multifocal osteomyelitis. Ann Radiol (Paris) 1978; 21 : 115–125.
3. Ferguson PJ, Laxer RM. Autoinflammatory bone disorders. In Petty RE, Laxer RM, Lindsley CB, Wedderburn LR. Textbook of Pediatric Rheumatology 7th ed. Elsevier 2016; 627–641.
4. Cox AJ, Darbro BW, Laxer RM, Velez G, Bing X, Finer AL, et al. Recessive coding and regulatory mutations in FBLIM1 underlie the pathogenesis of chronic recurrent multifocal osteomyelitis (CRMO). PLoS One 2017; 12: e0169687.
5. Golla A, Jansson A, Ramser J, Hellebrand H, Zahn R, Meitinger T, et al. Chronic recurrent multifocal osteomyelitis (CRMO): evidence for a susceptibility gene located on chromosome 18q21.3–18q22. Eur J Hum Genet 2002; 10 : 217–221.
6. Hofmann SR, Schnabel A, Rosen-Wolff A, Morbach H, Girschick HJ, Hedrich CM. Chronic Nonbacterial Osteomyelitis: Pathophysiological Concepts and Current Treatment Strategies. J Rheumatol 2016a; 43 : 1956–1964.
7. Girschick H, Finetti M, Orlando F, Schalm S, Insalaco A, Ganser G, et al. for the PRINTO and Eurofever registry. The multifaceted presentation of chronic recurrent multifocal osteomyelitis: a series of 486 cases from the Eurofever international registry. Rheumatology (Oxford) 2018 Mar 27. doi:10.1093/rheumatology/key058
8. Schnabel A, Range U, Hahn G, Berner R, Hedrich CM. Treatment response and longterm outcomes in children with chronic nonbacterial osteomyelitis. J Rheumatol 2017; 44 : 1058–1065.
9. Bouchalova K, Franova J, Schuller M, Macku M. Chronic recurrent multifocal osteomyelitis (CRMO): a single centre experience. Poster 29 : 23rd PReS congress 2016, Genoa, published in Pediatric Rheumatology 2017; 15(Suppl 1): P29.
10. Roderick M, Shah R, Finn A, Ramanan AV. Efficacy of pamidronate therapy in children with chronic non-bacterial osteitis: disease activity assessment by whole body magnetic resonance imaging. Rheumatology (Oxford) 2014; 53 : 1973–1976.
11. King SM, Laxer RM, Manson D, Gold R. Chronic recurrent multifocal osteomyelitis: a noninfectious inflammatory process. Pediatr Infect Dis J 1987; 6 : 907–911.
12. Miettunen PM, Wei X, Kaura D, Reslan WA, Aguirre AN, Kellner JD. Dramatic pain relief and resolution of bone inflammation following pamidronate in 9 pediatric patients with persistent chronic recurrent multifocal osteomyelitis (CRMO). Pediatr Rheumatol Online J 2009; 7 : 2.
13. Jansson A, Renner ED, Ramser J, Mayer A, Haban M, Meindl A, et al. Classification of non-bacterial osteitis: retrospective study of clinical, immunological and genetic aspects in 89 patients. Rheumatology (Oxford) 2007; 46 : 154–160.
14. Roderick MR, Shah R, Rogers V, Finn A, Ramanan AV. Chronic recurrent multifocal osteomyelitis (CRMO) - advancing the diagnosis. Pediatr Rheumatol Online J 2016; 14 : 47.
15. Voit AM, Arnoldi AP, Douis H, Bleisteiner F, Jansson MK, Reiser MF, et al. Whole-body Magnetic Resonance Imaging in Chronic Recurrent Multifocal Osteomyelitis: Clinical Longterm Assessment May Underestimate Activity. J Rheumatol 2015; 42 : 1455–1462.
16. Eutsler EP, Khanna G. Whole-body magnetic resonance imaging in children: technique and clinical applications. Pediatr Radiol 2016; 46 : 858–872.
17. Leclair N, Thormer G, Sorge I, Ritter L, Schuster V, Hirsch FW. Whole-body diffusion-weighted imaging in chronic recurrent multifocal osteomyelitis in children. PLoS One 2016; 11: e0147523.
18. Arnoldi AP, Schlett CL, Douis H, Geyer LL, Voit AM, Bleisteiner F, et al. Whole-body MRI in patients with non-bacterial osteitis: Radiological findings and correlation with clinical data. Eur Radiol 2017; 27 : 2391–2399.
19. Girschick HJ, Huppertz HI, Harmsen D, Krauspe R, Müller-Hermelink HK, Papadopoulos T. Chronic recurrent multifocal osteomyelitis in children: diagnostic value of histopathology and microbial testing. Hum Pathol 1999; 30 : 59–65.
20. Hofmann SR, Kubasch AS, Range U, Laass MW, Morbach H, Girschick HJ, et al. Serum biomarkers for the diagnosis and monitoring of chronic recurrent multifocal osteomyelitis (CRMO). Rheumatol Int 2016b; 36 : 769–779.
21. Huber AM, Lam PY, Duffy CM, Yeung RS, Ditchfield M, Laxer D, Cole WG, Kerr Graham H, Allen RC, Laxer RM. Chronic recurrent multifocal osteomyelitis: clinical outcomes after more than five years of follow-up. J Pediatr 2002; 141 : 198–203.
22. Ferguson PJ, El-Shanti HI. Autoinflammatory bone disorders. Curr Opin Rheumatol 2007; 19 : 492–498.
23. Gleeson H, Wiltshire E, Briody J, Hall J, Chaitow J, Sillence D, et al. Childhood chronic recurrent multifocal osteomyelitis: pamidronate therapy decreases pain and improves vertebral shape. J Rheumatol 2008; 35 : 707–712.
24. Hospach T, Langendoerfer M, von Kalle T, Maier J, Dannecker GE. Spinal involvement in chronic recurrent multifocal osteomyelitis (CRMO) in childhood and effect of pamidronate. Eur J Pediatr 2010; 169 : 1105–1111.
25. Kaiser D, Bolt I, Hofer M, Relly C, Berthet G, Bolz D, et al. Chronic nonbacterial osteomyelitis in children: a retrospective multicenter study. Pediatr Rheumatol Online J 2015; 13 : 25.
26. Wipff J, Costantino F, Lemelle I, Pajot C, Duquesne A, Lorrot M, et al. A large national cohort of French patients with chronic recurrent multifocal osteitis. Arthritis Rheumatol 2015; 67 : 1128–1137.
27. Al Hajry M, Al Jumaah S, Almayouf SM. Chronic recurrent multifocal osteomyelitis: a first report from Saudi Arabia. Ann Saudi Med 2012; 32 : 611–614.
28. Bouchalova K, Schüller M, Franova J, Skotakova J, Macku M. A patient with three diagnoses? juvenile idiopathic arthritis, chronic recurrent multifocal osteomyelitis and atypical subacute Moraxella osloensis infection. Abstract B3 : 24th PReS congress 2017, Athena, published in Pediatric Rheumatology 2017; 15(Suppl 2): B3.
29. Morbach H, Dick A, Beck C, Stenzel M, Muller-Hermelink HK, Raab P, et al. Association of chronic non-bacterial osteomyelitis with Crohn’s disease but not with CARD15 gene variants. Rheumatol Int 2010; 30 : 617–621.
30. Audu GK, Nikaki K, Crespi D, Spray C, Epstein J. Chronic recurrent multifocal osteomyelitis and inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2015; 60 : 586–591.
31. Kostik MM, Kopchak OL, Chikova IA, Masalova VV, Dubko MF, Snegireva LS, et al. Different treatment strategies for chronic non-bacterial osteomyelitis: the experience of 52 patients. Poster EULAR congress 2016 London, published in Ann Rheum Dis 2016; 75(Suppl 2): 763.
32. Catalano-Pons C, Comte A, Wipff J, Quartier P, Faye A, Gendrel D, et al. Clinical outcome in children with chronic recurrent multifocal osteomyelitis. Rheumatology (Oxford) 2008; 47 : 1397–1399.
33. Chapurlat RD, Hugueny P, Delmas PD, Meunier PJ. Treatment of fibrous dysplasia of bone with intravenous pamidronate: long-term effectiveness and evaluation of predictors of response to treatment. Bone 2004; 35 : 235–242.
34. Compeyrot-Lacassagne S, Rosenberg AM, Babyn P, Laxer RM. Pamidronate treatment of chronic noninfectious inflammatory lesions of the mandible in children. J Rheumatol 2007; 34 : 1585–1589.
35. Ferguson PJ, Sandu M. Current understanding of the pathogenesis and management of chronic recurrent multifocal osteomyelitis. Curr Rheumatol Rep 2012; 14 : 130–141.
36. Ferraria N, Marques JG, Ramos F, Lopes G, Fonseca JE, Neves MC. Chronic recurrent multifocal osteomyelitis: case series of four patients treated with biphosphonates. Acta Reumatol Port 2014; 39 : 38–45.
37. Hedrich CM, Hahn G, Girschick HJ, Morbach H. A clinical and pathomechanistic profile of chronic nonbacterial osteomyelitis/chronic recurrent multifocal osteomyelitis and challenges facing the field. Expert Rev Clin Immunol 2013a; 9 : 845–854.
38. Hedrich CM, Hofmann SR, Pablik J, Morbach H, Girschick HJ. Autoinflammatory bone disorders with special focus on chronic recurrent multifocal osteomyelitis (CRMO). Pediatr Rheumatol Online J 2013b; 11 : 47.
39. Kerrison C, Davidson JE, Cleary AG, Beresford MW. Pamidronate in the treatment of childhood SAPHO syndrome. Rheumatology (Oxford) 2004; 43 : 1246–1251.
40. Kuijpers SC, de Jong E, Hamdy NA, van Merkelsteijn JP. Initial results of the treatment of diffuse sclerosing osteomyelitis of the mandible with bisphosphonates. J Craniomaxillofac Surg 2011; 39 : 65–68.
41. Pastore S, Ferrara G, Monasta L, Meini A, Cattalini M, Martino S, et al. Chronic nonbacterial osteomyelitis may be associated with renal disease and bisphosphonates are a good option for the majority of patients. Acta Paediatr 2016; 105: e328–333.
42. Schuller M, Franova J, Macku M. Pamidronate in CRMO – a small case series. Poster 20th PReS congress 2013, Ljubljana, abstract number 2229. Published in Pediatric Rheumatology 2013; 11(Suppl 2): P219.
43. Simm PJ, Allen RC, Zacharin MR. Bisphosphonate treatment in chronic recurrent multifocal osteomyelitis. J Pediatr 2008; 152 : 571–575.
44. Sulko J. Diagnostic difficulties: chronic recurrent multifocal osteomyelitis and lymphoma. One or two diseases? J Pediatr Orthop B 2013; 22 : 170–174.
45. Teruzzi B, Salmaso A, Gerloni V, Gattinara M, Pontikaki I, Fantini F. Chronic Recurrent Multifocal Osteomyelitis (CRMO): four cases treated with aminobisphosphonate (pamidronate). Pediatr Rheumatol 2008, 6(Suppl 1): P189.
46. Yamazaki Y, Satoh C, Ishikawa M, Notani K, Nomura K, Kitagawa Y. Remarkable response of juvenile diffuse sclerosing osteomyelitis of mandible to pamidronate. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 104 : 67–71.
47. Ziobrowska-Bech A, Fiirgaard B, Heuck C, Ramsgaard Hansen O, Herlin T. Ten-year review of Danish children with chronic non-bacterial osteitis. Clin Exp Rheumatol 2013; 31 : 974–979.
48. ClinicalTrials, dostupné z www.clinicaltrials.gov
49. Zhao Y, Wu EY, Oliver MS, Cooper AM, Basiaga ML, Vora SS, et al. Consensus Treatment Plans for Chronic Nonbacterial Osteomyelitis Refractory to Nonsteroidal Antiinflammatory Drugs and/or With Active Spinal Lesions. Arthritis Care Res 2018; 70 : 1228–1237.
50. Twilt M, Laxer RM. Clinical care of children with sterile bone inflammation. Curr Opin Rheumatol 2011; 23 : 424–431.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2019 Issue 3-
All articles in this issue
- Vnímanie bolesti u mužov a žien s reumatoidnou artritídou
- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
- Steroidní myopatie
- Odborné události
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Steroidní myopatie
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career