-
Medical journals
- Career
Inhibitory Janusových kináz v terapii revmatoidní artritidy
: M. Filková
: Revmatologický ústav, Praha
: Čes. Revmatol., 26, 2018, No. 3, p. 132-140.
: Review Article
Inhibitory Janusových kináz (JAK) jsou synteticky vyrobené malé molekuly s perorálním podáváním, které inhibují nitrobuněčnou signalizaci řady mediátorů s významnou úlohou v patogenezi revmatoidní artritidy (RA). Tofacitinib inhibuje JAK3, JAK1 a v menší míře JAK2, baricitinib preferenčně inhibuje JAK1 a JAK2. Jejich klinická účinnost byla podpořena v klinických hodnoceních fáze III u pacientů s RA doposud neléčených, s nedostatečnou odpovědí na konvenční či biologické chorobu modifikující léky, kde došlo k rychlému nástupu účinku, s poklesem a dlouhodobým udržením nízké klinické aktivity a zpomalení rentgenové progrese. Některé výsledky dokonce podporují jejich nadřazenost vůči methotrexátu a adalimumabu, příp. stejnou klinickou účinnost. Spolu s ohledem na příznivý bezpečnostní profil jsou v současnosti tofacitinib a baricitinib schválené k léčbě dospělých pacientů se středně až vysoce aktivní RA a nedostatečnou odpovědí na methotrexát, tofacitinib i pro pacienty s psoriatickou artritidou a ulcerózní kolitidou. Klinická hodnocení současných i nových JAK inhibitorů ukážou účinnost a bezpečnost u pacientů s RA a jinými zánětlivými chorobami.
Klíčová slova:
JAK, tofacitinib, baricitinib, revmatoidní artritida, účinnost, bezpečnost
Úvod
Lepší porozumění patogeneze celé řady onemocnění přineslo objev četných cytokinů a jejich receptorů, které se staly léčebným cílem monoklonálních protilátek a rekombinantních proteinů. Jejich zavedení do běžné klinické praxe tak v novém miléniu přineslo revoluci v léčbě, včetně zánětlivých revmatických onemocnění, jejichž prototypem se stala revmatoidní artritida (RA). I přes veškeré úsilí v časné diagnostice a léčbě RA s uplatněním principu léčby k cíli, existuje část pacientů, která buď primárně neodpovídá adekvátně na stávající léčbu, s odstupem dojde ke ztrátě účinku terapie, nebo k jejímu přerušení v důsledku nežádoucích účinků a tím k potřebě léčbu změnit [1]. Proto nadále přetrvává nejenom potřeba individuálního léčebného přístupu ke každému pacientovi, ale i hledání nových léčebných modalit. Pokud ovlivnění extracelulárních cytokinů nevede k dostatečnému účinku, jako další možnost se jeví ovlivnění molekul uvnitř buňky. Použití tzv. cílených chorobu modifikujících léků (targeted synthetic disease modifying antirheumatic drugs, tsDMARDs), které představují inhibitory Janusových kináz (JAK), podporuje i Evropská liga proti revmatismu (EULAR) ve svých doporučeních z roku 2016 [2].
Inhibice Janusových kináz – nový přístup v terapii
Skupina Janusových kináz je malou skupinou tyrozinkináz, které jsou asociovány s receptory, a zprostředkují signální kaskádu četných cytokinů např. IL-2, IL-6, IL-12 a IL-23 [3]. Není pochyb o důležitosti těchto cytokinů v patogenezi zánětlivých revmatických onemocnění, jelikož některé se již staly terapeutickým cílem. Signální transdukce cytokinů přes dráhu JAK vede k selektivní kombinaci dvou ze čtyř enzymů skupiny JAK (JAK1, JAK2, JAK3 a TYK2). Po navázání cytokinů na buněčné receptory dochází k fosforylaci JAK a intracelulárních částí receptorů. To umožní navázání a fosforylaci proteinů skupiny STAT (signal transducer and activator of transcription), které poté v aktivované fosforylované formě dimerizují a translokují se do buněčného jádra. Tam se váží na specifické sekvence v promotorech příslušných genů a modulují jejich expresi [4]. Specifické párování JAK a následná aktivace STAT po navázání těchto cytokinů vede ke specifickým biologickým funkcím (obr. 1) [5].
1. Použití různých Janusových kináz (JAK) v signální transdukci cytokinů, chemokinů a růstových faktorů. Upraveno podle O´Shea et al. [5] ![Použití různých Janusových kináz (JAK) v signální transdukci cytokinů, chemokinů a růstových faktorů. Upraveno podle
O´Shea et al. [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2f6885dbcf44d7d329bf3aa613ac3e95.png)
JAK inhibitory jsou syntetické malé molekuly s perorálním podáváním, které interferují s nitrobuněčnou signalizací skrze inhibici JAK enzymů a zařazují se do relativně nové skupiny léků z názvem tsDMARDs [6].
JAK inhibitory v léčbě revmatoidníartritidy
Tofacitinib
Tofacitinib je první schválený JAK inhibitor, který inhibuje signalizaci heterodimerními cytokinovými receptory, které se asociují s JAK3 a/nebo JAK1 s funkční selektivitou nad cytokinovými receptory, které signalizují prostřednictvím párů JAK2.
Účinnost a bezpečnost tofacitinibu byla stanovena v 7 randomizovaných, dvojitě zaslepených, kontrolovaných multicentrických klinických hodnoceních fáze III u pacientů s aktivní RA: 2 hodnocení s užitím v monoterapii (ORAL Start, ORAL Solo) [7, 8], z nichž ORAL Start [7] byla u doposud neléčených pacientů; a 5 hodnocení v kombinované terapii se současným podáním konvenčních syntetických DMARD (conventional synthetic DMARD, csDMARD) u RA pacientů s nedostatečnou odpovědí na methotrexát (MTX) (ORAL Standard) [9], csDMARD nebo biologických DMARD (bDMARD) (ORAL Sync, ORAL Scan) [10, 11], s nedostatečnou odpovědí na TNF inhibitory (ORAL Step) [12], a 1 přímé porovnání s adalimumabem (ORAL Strategy) [13] (tabulka 1).
1. Přehled klinických hodnocení fáze III pro vývoj tofacitinibu. 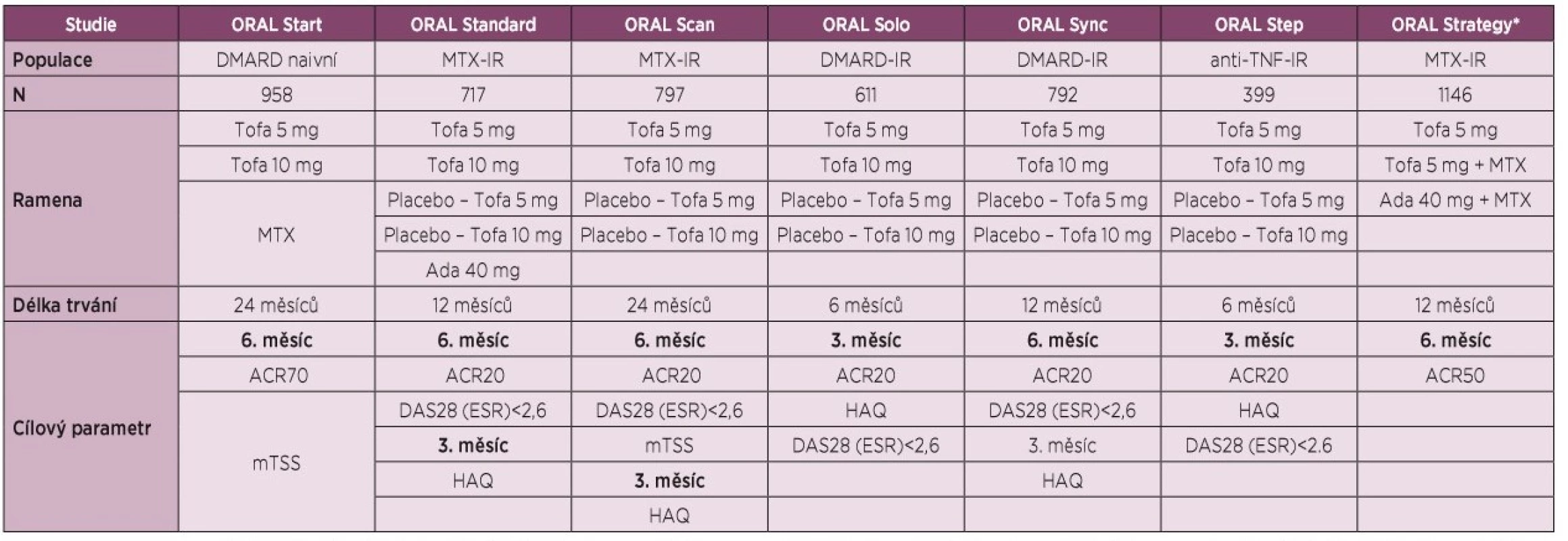
Legenda: ADA – adalimumab; ACR20/50/70 – skóre klinické odpovědi o 20/50/70 % podle Americké koleje revmatologů; DAS28 – Disease Activity Score, skóre klinické aktivity na základě vyšetření 28 kloubů; DMARD – Disease Modifying Antirheumatic Drug, chorobu modifikující léky; HAQ – Health Assessment Questionnaire, dotazník funkčních schopností; IR – inadequate response, nedostatečná klinická odpověď; mTSS, modifikované celkové Sharpovo skóre; MTX – methotrexát; TNF – tumor nekrotizující faktor; Tofa – tofacitinib; * test non-inferiority. V textu budou zmíněny klinické odpovědi ACR20 s možnost porovnání stejného parametru, kompletní přehled účinnosti tofacitinibu v klinických hodnoceních fáze III s důrazem na primární cíle studie je uveden v tabulce 2.
2. Přehled klinické účinnosti dle ACR kritérií a primárního cíle v hodnoceních fáze III pro vývoj tofacitinibu. 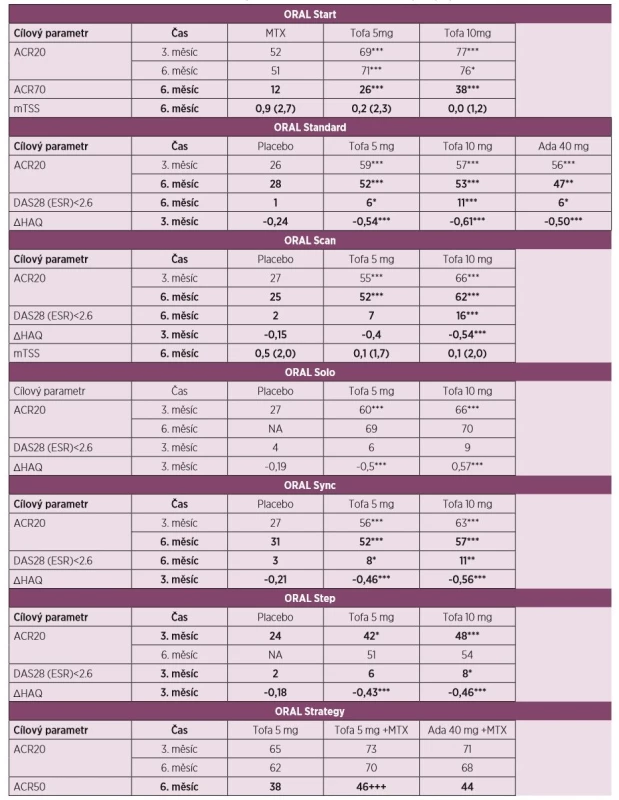
Legenda: Ada – adalimumab; ACR20/50/70 – skóre klinické odpovědi o 20/50/70 % podle Americké koleje revmatologů; DAS28 – Disease Activity Score, skóre klinické aktivity na základě vyšetření 28 kloubů; HAQ – Health Assessment Questionnaire, dotazník funkčních schopností; mTSS – modifikované celkové Sharpovo skóre; MTX - methotrexát; Tofa – tofacitinib; * p < 0,05; ** p < 0,01, *** p < 0,001. +++ Studie byla navržena tak, aby ukazovala non-inferioritu. Dolní hranice rozdílu intervalu spolehlivosti větší než -13 % prokázala non-inferioritu mezi Tofa+MTX a Ada+MTX s p < 0,001. Primární cíle hodnocení. V hodnocení ORAL Start [7] u doposud neléčených pacientů s RA dosáhlo klinického zlepšení o 20 % podle American College of Rheumatology (ACR20) v 6. měsíci 51 % pacientů léčených MTX a 71 % a 76 % pacientů léčených tofacitinibem 5 mg a 10 mg dvakrát denně. Odpovědi ACR70 v 6. měsíci dosáhlo 12 % pacientů léčených MTX a 26 % a 38 % léčených tofacitinibem v dávce 5 a 10 mg. Po 24 měsících zůstal rozdíl v ACR20 rovněž významný (42 % vs. 64 %vs. 64 % v tomto pořadí). Terapie tofacitinibem vedla k významnějšímu zpomalení rentgenové progrese v 6., 12. a 24. měsíci dle modifikovaného Sharpova skóre.
U pacientů s RA s nedostatečnou odpovědí na MTX v hodnocení ORAL Standard [9] bylo současně s pokračující terapií MTX podáváno placebo, tofacitinib 5 mg nebo 10 mg dvakrát denně nebo adalimumab ve standardním dávkování. Klinické odpovědi ACR20 v 6. měsíci dosáhlo 52 % a 53 % pacientů léčených tofacitinibem, 47 % léčených adalimumabem a 28 % ve větvi s placebem. Signifikantně víc pacientů léčeno tofacitinibem dosáhlo v tomto časovém intervalu i odpověď ACR70 a dosáhlo i remise dle DAS28. Signifikantní zlepšení nejenom symptomů RA, ale i fyzických funkcí bylo na terapii tofacitinibem dosaženo již po 2 týdnech a přetrvalo i po 12 měsících léčby.
V klinickém hodnocení ORAL Solo [8] u pacientů s RA s nedostatečnou odpovědí na víc než 1 csDMARDs nebo bDMARDs byla účinnost tofacitinibu pozorována již ve 2. týdnu a v měsíci 3 byla klinická odpověď ACR20 ve srovnání s placebem větší při monoterapii tofacitinibem v dávce 5 mg a 10 mg (27 % vs. 60 % vs. 66 % v tomto pořadí). Statistické významnosti rozdílu v procentuálním zastoupení pacientů, kteří dosáhli remise dle skóre DAS28, nebylo dosaženo.
Další hodnocení u pacientů s RA s nedostatečnou odpovědí na MTX, případně další csDMARD nebo bDMARD bylo provedeno ve studii ORAL Scan [11], kde pacienti nadále pokračovali v terapii MTX, nebo v hodnocení ORAL Sync [10], kde pokračovali jiným csDMARD. Ve studii ORAL Scan dosáhlo v 6. měsíci ve srovnání se skupinou s placebem odpověď ACR20 signifikantně víc pacientů v obou skupinách s tofacitinibem 5 mg a 10 mg (25 % vs. 52 %vs. 62 %), podobně tomu bylo i u pacientů s jinou konkomitantní medikací csDMARD ve studii ORAL Sync (31 % vs. 52 % vs. 57 %). Nástup účinku byl rovněž významný již ve 2. týdnu hodnocení a přetrvával po celou dobu studie. V klinickém hodnocení ORAL Scan bylo ve skupině s 10 mg tofacitinibu dosaženo zpomalení rentgenové progrese ve srovnání s placebem (p ≤ 0,05), u pacientů léčených 5 mg tofacitinibu nebylo dosaženo statistického významu (p = 0,07).
U pacientů s nedostatečnou odpovědí na inhibitory TNF v hodnocení ORAL Step [12] s pokračující terapií MTX bylo podáváno placebo s následným přechodem na aktivní látku anebo léčba tofacitinibem 5 mg nebo 10 mg dvakrát denně. Výsledky nejenom prokázaly klinickou odpověď ACR20, ale tato terapie byla nadřazena vůči placebu v měsíci 3 (24 % vs. 42 %, vs. 48 %). Klinické hodnocení ORAL Strategy [13] u pacientů s neadekvátní odpovědí na MTX mělo za cíl přímé porovnání účinnosti a bezpečnosti monoterapie tofacitinibem 5 mg dvakrát denně, jeho kombinaci s MTX a kombinaci adalimumabu s MTX. Primární cíl, kterým bylo dosažení klinické odpovědi ACR50 v 6. měsíci, byl splněn (38 % vs. 46 % vs. 44 %). Tato studie svým designem (non-inferiority) s nastavením dolní hranice rozdílu intervalu spolehlivosti -13 % prokázala, že účinnost kombinace tofacitinib+MTX splnila kritéria non-inferiority (nenadřazenosti) vůči kombinaci adalimumab+MTX. Tato hranice nebyla splněna při porovnání ostatních skupin. Účinek tofacitinibu ve všech studiích se projevil již do několika týdnů od zahájení terapie.
Tofacitinib je v doporučené dávce 5 mg dvakrát denně p. o. schválen k použití v kombinaci s MTX k léčbě středně těžké až těžké aktivní RA u dospělých pacientů, kteří dostatečně neodpovídali na jedno případně více DMARD, nebo je netolerovali. Lze jej podávat v monoterapii v případě intolerance MTX, nebo pokud léčba MTX není vhodná. Snížení dávky na 5 mg jednou denně se doporučuje u pacientůs těžkou poruchou funkce ledvin (clearance kreatininu <30 ml/min) a u pacientů se středně těžkou poruchou funkce jater (Child Pugh B). U pacientů starších 65 let není potřeba žádná úprava dávky, u pacientů starších 75 let jsou k dispozici jen omezené údaje. Tofacitinib byl schválen i pro léčbu aktivní psoriatické artritidy u pacientů s nedostatečným efektem nebo intolerancí předchozí léčby jinými DMARD.
Tofacitinib je kontraindikován v těhotenství a laktaci, u pacientů s aktivní tuberkulózou, se závažnou nebo oportunní infekcí a u těžké poruchy jaterních funkcí.
Baricitinib
Baricitinib je selektivní a reverzibilní inhibitor JAK1 a JAK2. Jeho účinnost a bezpečnost byla prokázána ve 4 klinických hodnoceních fáze III u pacientů se střední až vysokou aktivitou RA (tabulka 3). Přehled účinnosti baricitinibu v klinických hodnoceních fáze III s důrazem na primární cíle studie je uveden v tabulce 4.
3. Přehled klinických hodnocení fáze III pro vývoj baricitinibu. 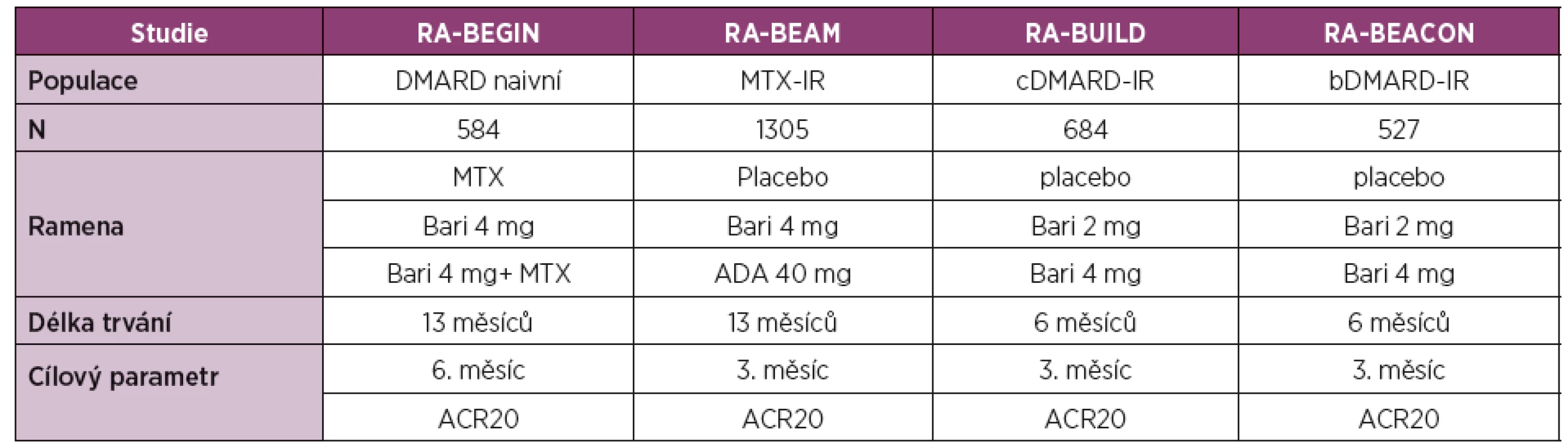
Legenda: ADA – adalimumab; ACR20 – skóre klinické odpovědi o 20 % podle Americké koleje revmatologů; Bari – baricitinib; DAS28 – Disease Activity Score – skóre klinické aktivity na základě vyšetření 28 kloubů; DMARD – Disease Modifying Antirheumatic Drug, chorobu modifikující léky; cDMARD – konvenční DMARD; bDMARD – biologické DMARD; IR – inadequate response, nedostatečná klinická odpověď; MTX – methotrexát 4. Přehled klinické účinnosti dle ACR kritérií a primárního cíle v hodnoceních fáze III pro vývoj baricitinibu. 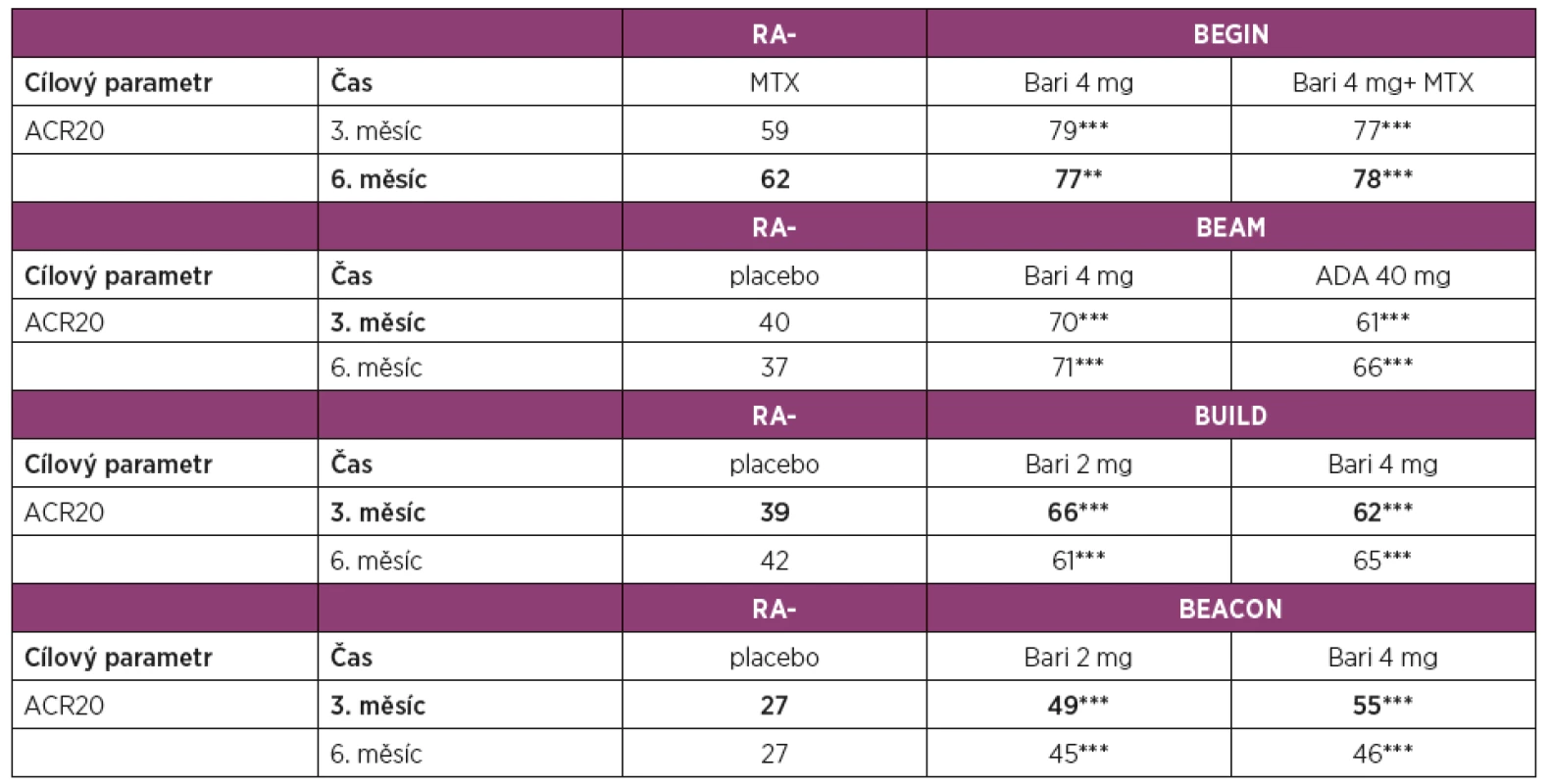
Legenda: ADA – adalimumab; ACR20 – skóre klinické odpovědi o 20 % podle Americké koleje revmatologů; Bari – baricitinib; MTX – methotrexát; Tofa – tofacitinib. * p < 0,05; ** p < 0,01, *** p < 0,001. Primární cíle hodnocení. Baricitinib v monoterapii nebo v kombinaci s MTX byl hodnocen u pacientů s RA doposud neléčených (RA-BEGIN) [14], v kombinaci s MTX nebo jiným csDMARD u pacientů s nedostatečnou odpovědí na MTX (RA-BEAM) [15] nebo jiná na csDMARD (RA BUILD) [16] a u pacientů s nedostatečnou odpovědí na bDMARD (RA-BEACON) [17].
Klinické hodnocení RA-BEGIN u pacientů s časnou RA doposud neléčených nebo po minimální expozici csDMARD (maximálně 3 dávky MTX) [14] prokázalo v 6. měsíci v porovnání s MTX lepší klinickou odpověď dle ACR20 u pacientů léčených 4 mg baricitinibu jedenkrát denně (62 % vs. 77 %) a dosáhlo zároveň statistickou významnost nenadřazenosti (non-inferiority) těchto 2 léčebných modalit.
Klinické hodnocení u pacientů s nedostatečnou odpovědí na MTX (RA-BEAM) [15] porovnávalo účinnost a bezpečnost baricitinibu 4 mg ve srovnání s adalimumabem ve standardním dávkování a s placebem při trvající léčbě MTX. Studie umožnila i hodnocení non-inferiority a superiority. Ve 3. měsíci dosáhlo v porovnání s placebem klinické odpovědi ACR20 signifikantně víc pacientů léčených baricitinibem (40 % vs. 70 %). Ve srovnání s adalimumabem byla ve skupině s baricitinibem v 3. měsíci pozorována vyšší klinická účinnost dle ACR20 (61 % vs. 70 %). Podle ACR20 byla dosažena hranice non-inferiority baricitinibu vůči adalimumabu, podle DAS28 byla dosažena hranice superiority v prospěch baricitinibu. V této studii byla vyhodnocena i rentgenová progrese, která byla v 6. měsíci ve skupině léčené baricitinibem výrazně pomalejší než ve skupině s placebem.
Klinické hodnocení RA-BUILD [16] u pacientů s RA s nedostatečnou odpovědí na víc než 1 csDMARD porovnávalo procentuální zastoupení pacientů dosahujících léčebné odpovědi ACR20 na terapii baricitinibem ve srovnání s placebem, u obou skupin s dále pokračující terapií s csDMARD [16]. V porovnání s placebem dosáhlo v 3. měsíci víc pacientů léčených baricitinibem nejenom odpovědi ACR20 (39 % vs. 62 %), ale i zpomalení rentgenové progrese (77 % vs. 89 %).
V hodnocení RA-BEACON [17] u pacientů se středně až vysoce aktivní RA s nedostatečnou odpovědí na předchozí léčbu bDMARD (včetně selhání ≥1 TNF inhibitoru) byl v 3. měsíci v porovnání s placebem prokázán signifikantní efekt dle ACR20 u pacientů léčených baricitinibem (27 % vs. 55 %). Počet předchozích bDMARD měl zanedbatelný efekt na účinnost baricitinibu. Podobně jako v předchozích hodnoceních byl nástup účinku v 1. týdnu rychlejší u pacientů s léčených baricitinibem v porovnání s placebem.
Baricitinib je v doporučené dávce 4 mg jednou denně p.o. indikován k léčbě středně až vysoce aktivní RA u dospělých pacientů, kteří neodpověděli dostatečně na jedno nebo více DMARD, nebo je netolerovali. Baricitinib může být použit v monoterapii nebo v kombinaci s MTX. Snížení dávky na 2 mg jednou denně se doporučuje u pacientů s poruchou funkce ledvin (clearance kreatininu 30–60 ml/min). Podání baricitinibu se nedoporučuje u pacientů s clearance kreatininu <30 ml/min a u pacientů se závažnou poruchou funkce jater. Redukovaná dávka 2 mg jednou denně je vhodná i pro pacienty ve věku ≥75 let, pro pacienty s chronickými nebo recidivujícími infekcemi v anamnéze, resp. pro pacienty, u kterých bylo dosaženo trvalé kontroly aktivity onemocnění při dávce 4 mg jednou denně a u kterých přichází v úvahu snižování dávky.
Baricitinib je kontraindikován v těhotenství. Léčba nesmí být zahájena u pacientů s absolutním počtem lymfocytů <0,5x109/l, s absolutním počtem neutrofilů <1x109/l a u pacientů s hodnotou hemoglobinu <8 g/dl.
Nové JAK inhibitory v probíhajícím klinickém hodnocení u pacientů s RA
Ve fázi II klinického hodnocení s pan-JAK inhibitorem peficitinibem je klinická odpověď je obdobná jako ve studiích s jinými neselektivními JAK inhibitory [18–20].
Filgotinib je JAK1 selektivní inhibitor se sníženou aktivitou vůči JAK2. Dle výsledků klinického hodnocení fáze II u pacientů bez a s konkomitantní terapií MTX byla jeho klinická účinnost obdobná jako ve studiích s tofacitinibem [21, 22].
Upadacitinib je selektivní JAK1 inhibitor, který u pacientů s RA s nedostatečnou odpovědí na MTX nebo inhibitory TNF ve fázi II klinického zkoušení rovněž dosáhl slibných výsledků [23, 24].
Bezpečnostní profil JAK inhibitorů
Nežádoucí příhody spojené s užíváním JAK inhibitorů jsou z velké části předpovídatelé na základě jejich biologické funkce jako mediátorů signální transdukce cytokinů I. a II. typu [25]. Protože nejvíc klinických zkušeností se týká tofacitinibu, je jeho bezpečnostní profil nejlépe charakterizovaný.
Výskyt infekcí, tak jako u jiných preparátů, je i v případě JAK inhibitorů nejvíc diskutovaný. Riziko infekcí je srovnatelné s bDMARD, ve studiích s tofacitinibem, baricitinibem a peficitinibem se ale ukazuje vyšší riziko infekce herpes zoster. V hodnoceních s tofacitinibem byl vyšší výskyt herpes zoster zejména v oblastech východní Asie, u žen a u pacientů vyššího věku a při souběžné terapii glukokortikoidy. I přes všeobecně vyšší riziko výskytu této infekce u RA, je toto riziko asi 1,5–2x vyšší u pacientů léčených tofacitinibem [26], což může být důsledkem inhibice signální transdukce IFN a deplece NK buněk, které jsou důležité pro boj proti virovým infekcím a jejichž diferenciace a činnost závisí od JAK3 signální dráhy. V klinických hodnoceních se ojediněle vyskytly případy tuberkulózy, nicméně toto riziko se nezdá být zvýšené. Byly hlášeny ojedinělé případy infekce oportunními patogeny, riziko oportunních infekcí bylo vyšší v asijských zeměpisných oblastech. U pacientů s aktivními, chronickými nebo recidivujícími infekcemi je nutno před zahájením léčby JAK inhibitory pečlivě zvážit její rizika a přínosy a musí být provedeno screeningové vyšetření na tuberkulózu a hepatitidu B a C. Použití živých a atenuovaných vakcín se během léčby či bezprostředně před ní nedoporučuje.
Interference JAK inhibitorů s T buňkami a NK buňkami může rovněž být potenciálním prokancerogenním mechanismem. Nicméně dostupná data neprokazují zvýšený výskyt hematologických malignit či solidních tumorů [27].
Cytopenie se vyskytují často u pacientů léčených prvními JAK inhibitory, protože hematopoetické růstové faktory včetně erytropoetinu jsou ovlivňovány JAK2. U tofacitinibu byl hlášený zvýšený výskyt lymfopenie, neutropenie a anémie oproti placebu. U baricitinibu byl hlášený zvýšený výskyt neutropenie a trombocytózy.
Přímá souvislost s výskytem tromboembolických příhod nebyla popsána, i když raritní případy byly zaznamenány. Krevní obraz je třeba zkontrolovat na začátku léčby a následně každé 3 měsíce. Baricitinib v souladu s platným SPC má být používán s opatrností u pacientů, kteří mají rizikové faktory pro tromboembolické onemocnění.
V klinických hodnoceních byla léčba s JAK inhibitory spojena s častějším výskytem zvýšených hodnot jaterních enzymů. V průběhu léčby je proto třeba dbát opatrnosti, zejména pokud je léčba zahájena v kombinaci s potenciálně hepatotoxickými léčivými přípravky,
Terapie JAK inhibitory zvyšuje hodnoty LDL a HDL cholesterolu, ale nemění jejich poměr nebo počet kardiovaskulárních komplikací [28]. Vysvětlením může být blokáda JAK dependentních cytokinů, např. IL-6, které se jinak podílejí na vzniku kardiovaskulárních onemocnění, ovlivňují metabolismus lipidů a inzulinovou rezistenci [28, 29]. Bezpečnostní profil inhibitorů JAK týkající se rizika perforací dolních částí gastrointestinálního traktu je příznivý, byl prokázán buď nižší nebo stejný výskyt u pacientů léčených JAK inhibitory nebo jinými DMARD.
JAK inhibitory a lékové interakce
Tofacitinib je metabolizován CYP3A4, je proto pravděpodobná interakce s léčivými přípravky inhibujícími nebo indukujícími CYP3A4. Expozice tofacitinibu je zvýšená, pokud je podáván současně s potentními inhibitory CYP3A4 (např. ketokonazolem), středně silnými inhibitory CYP3A4 a silnými inhibitory CYP2C19 (např. flukonazolem), kdy je třeba dávku třeba snížit na 5 mg jednou denně. Expozice je snížena, pokud je podáván současně s potentními induktory CYP3A4 (např. rifampicinem).
Baricitinib substrátem pro OAT3, P-glykoprotein (Pgp), BCRP a MATE2-K a CYP3A4. V klinických hodnoceních současné podávání baricitinibu s ketokonazolem, flukonazolem nebo rifampicinem nevedlo k žádným klinicky významným změnám expozice baricitinibu. Dávka baricitinibu 2 mg je doporučena u pacientů léčených inhibitory OAT3 se silným inhibičním potenciálem (např. probenecid) a u slabých inhibitorů OAT3 (např. leflunomid jako prekurzor) je třeba opatrnosti. Současné podávání baricitinibu s cyklosporinem (inhibitor Pgp/BCRP) nebo s MTX (substrát pro několik transportérů) nevedlo ke klinicky významným účinkům na expozici baricitinibu.
JAK inhibitory v graviditě a laktaci
Tofacitinib je v těhotenství a laktaci kontraindikován a ženy ve fertilním věku by měly během léčby a nejméně 4 týdny po poslední dávce používat účinnou antikoncepci. Vliv na fertilitu u lidí není znám. Baricitinib je kontraindikován v těhotenství, ženy ve fertilním věku musí během léčby a alespoň 1 týden po skončení léčby používat spolehlivou antikoncepci. Baricitinib by se neměl užívat během kojení. Léčba baricitinibem může v průběhu léčby snížit fertilitu žen, neměla však žádný účinek na mužskou spermatogenezi.
Závěr
Cílené inhibitory intracelulární signalizační kaskády jsou malé molekuly, které inhibují intracelulární proteiny zodpovědné za přenos signálu do jádra po navázání ligandu na buněčné receptory imunitních buněk. V současné době jsou v Evropě schválené 2 inhibitory JAK: tofacitinib a baricitinib.
Jejich klinická účinnost byla podpořena v klinických hodnoceních fáze III u pacientů s RA doposud neléčených, s nedostatečnou odpovědí na konvenční či biologické, chorobu modifikující léky, kde došlo k rychlému nástupu účinku s poklesem a dlouhodobým udržením nízké klinické aktivity a zpomalení rentgenové progrese. Některé výsledky dokonce podporují jejich nadřazenost vůči methotrexátu a adalimumabu. Oba přípravky mají v léčbě RA podobnou účinnost a bezpečnost jako biologické léky. Nyní jsou tofacitinib a baricitinib schválené k léčbě dospělých pacientů se středně až vysoce aktivní RA a nedostatečnou odpovědí na MTX, tofacitinib i pro pacienty s psoriatickou artritidou a ulcerózní kolitidou. S jejich zařazením do léčebného algoritmu pacientů s RA, od října 2018 s dostupností v České republice, počítá ve svých doporučeních i Česká revmatologická společnost [30].
Poděkování: Tato práce vznikla za podpory projektu Ministerstva zdravotnictví České republiky: koncepční rozvoj výzkumné organizace 023728.
adresa pro korespondenci:
MUDr. Mária Filková, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
E-mail: filkova@revma.cz
Sources
1. Smolen JS, Aletaha D, Barton A, Burmester GR, Emery P, Firestein GS, et al. Rheumatoid arthritis. Nat Rev Dis Primers 2018; 4 : 18001.
2. Smolen JS, Landewe R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017; 76(6): 960–77.
3. Schwartz DM, Bonelli M, Gadina M, O’Shea JJ. Type I/II cytokines, JAKs, and new strategies for treating autoimmune diseases. Nat Rev Rheumatol 2016; 12(1): 25–36.
4. Schwartz DM, Kanno Y, Villarino A, Ward M, Gadina M, O’Shea JJ. JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nat Reviews Drug Disc 2017; 16(12) :843–62.
5. O’Shea JJ, Kontzias A, Yamaoka K, Tanaka Y, Laurence A. Janus kinase inhibitors in autoimmune diseases. Ann Rheum Dis 2013; 72 (Suppl 2): ii111–5.
6. Smolen JS, van der Heijde D, Machold KP, Aletaha D, Landewe R. Proposal for a new nomenclature of disease-modifying antirheumatic drugs. Ann Rheum Dis 2014; 73(1): 3–5.
7. Lee EB, Fleischmann R, Hall S, Wilkinson B, Bradley JD, Gruben D, et al. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med 201; 370(25): 2377–86.
8. Fleischmann R, Kremer J, Cush J, Schulze-Koops H, Connell CA, Bradley JD, et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med 2012 ; 367(6): 495–507.
9. van Vollenhoven RF, Fleischmann R, Cohen S, Lee EB, Garcia Meijide JA, Wagner S, et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 367(6): 508–19.
10. Kremer J, Li ZG, Hall S, Fleischmann R, Genovese M, Martin-Mola E, et al. Tofacitinib in combination with nonbiologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis: a randomized trial. Ann Intern Med 2010; 159(4): 253–61.
11. van der Heijde D, Tanaka Y, Fleischmann R, Keystone E, Kremer J, Zerbini C, et al. Tofacitinib (CP-690,550) in patients with rheumatoid arthritis receiving methotrexate: twelve-month data from a twenty-four-month phase III randomized radiographic study. Arthritis Rheum 2013; 65(3): 559–70.
12. Burmester GR, Blanco R, Charles-Schoeman C, Wollenhaupt J, Zerbini C, Benda B, et al. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet 2013; 381(9865): 451–60.
13. Fleischmann R, Mysler E, Hall S, Kivitz AJ, Moots RJ, Luo Z, et al. Efficacy and safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimumab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): a phase 3b/4, double-blind, head-to-head, randomised controlled trial. Lancet 2017; 390(10093): 457–68.
14. Fleischmann R, Schiff M, van der Heijde D, Ramos-Remus C, Spindler A, Stanislav M, et al. Baricitinib, methotrexate, or combination in patients with rheumatoid arthritis and no or limited prior disease-modifying antirheumatic drug treatment. Arthritis Rheumatology 2017; 69(3): 506–17.
15. Taylor PC, Keystone EC, van der Heijde D, Weinblatt ME, Del Carmen Morales L, Reyes Gonzaga J, et al. Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017; 376(7): 652–62.
16. Dougados M, van der Heijde D, Chen YC, Greenwald M, Drescher E, Liu J, et al. Baricitinib in patients with inadequate response or intolerance to conventional synthetic DMARDs: results from the RA-BUILD study. Ann Rheum Dis 2017; 76(1): 88–95.
17. Genovese MC, Kremer J, Zamani O, Ludivico C, Krogulec M, Xie L, et al. Baricitinib in Patients with Refractory Rheumatoid Arthritis. N Engl J Med 2016; 374(13): 1243–52.
18. Takeuchi T, Tanaka Y, Iwasaki M, Ishikura H, Saeki S, Kaneko Y. Efficacy and safety of the oral Janus kinase inhibitor peficitinib (ASP015K) monotherapy in patients with moderate to severe rheumatoid arthritis in Japan: a 12-week, randomised, double-blind, placebo-controlled phase IIb study. Ann Rheum Dis. 2016; 75(6): 1057-64.
19. Kivitz AJ, Gutierrez-Urena SR, Poiley J, Genovese MC, Kristy R, Shay K, et al. Peficitinib, a JAK inhibitor, in the treatment of moderate-to-severe rheumatoid arthritis in patients with an inadequate response to methotrexate. Arthritis Rheumatology 2017; 69(4): 709–19.
20. Genovese MC, Greenwald M, Codding C, Zubrzycka-Sienkiewicz A, Kivitz AJ, Wang A, et al. Peficitinib, a JAK inhibitor, in combination with limited conventional synthetic disease-modifying antirheumatic drugs in the treatment of moderate-to-severe rheumatoid arthritis. Arthritis Rheumatology 2017; 69(5): 932–42.
21. Kavanaugh A, Kremer J, Ponce L, Cseuz R, Reshetko OV, Stanislavchuk M, et al. Filgotinib (GLPG0634/GS-6034), an oral selective JAK1 inhibitor, is effective as monotherapy in patients with active rheumatoid arthritis: results from a randomised, dose-finding study (DARWIN 2). Ann Rheum Dis 2017; 76(6): 100 9–19.
22. Westhovens R, Taylor PC, Alten R, Pavlova D, Enriquez-Sosa F, Mazur M, et al. Filgotinib (GLPG0634/GS-6034), an oral JAK1 selective inhibitor, is effective in combination with methotrexate (MTX) in patients with active rheumatoid arthritis and insufficient response to MTX: results from a randomised, dose-finding study (DARWIN 1). Ann Rheum Dis 2017; 76(6): 998–1008.
23. Kremer JM, Emery P, Camp HS, Friedman A, Wang L, Othman AA, et al. A Phase IIb study of ABT-494, a Selective JAK-1 inhibitor, in patients with rheumatoid arthritis and an inadequate response to anti-tumor necrosis factor therapy. Arthritis Rheumatology 2016; 68(12): 2867–77.
24. Genovese MC, Smolen JS, Weinblatt ME, Burmester GR, Meerwein S, Camp HS, et al. Efficacy and Safety of ABT-494, a selective JAK-1 inhibitor, in a phase IIb study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Arthritis Rheumatology 2016; 68(12): 2857–66.
25. Winthrop KL. The emerging safety profile of JAK inhibitors in rheumatic disease. Nat Rev Rheumatol 2017; 13(5): 320.
26. Winthrop KL, Yamanaka H, Valdez H, Mortensen E, Chew R, Krishnaswami S, et al. Herpes zoster and tofacitinib therapy in patients with rheumatoid arthritis. Arthritis Rheumatology 2014; 66(10): 2675–84.
27. Maneiro JR, Souto A, Gomez-Reino JJ. Risks of malignancies related to tofacitinib and biological drugs in rheumatoid arthritis: Systematic review, meta-analysis, and network meta-analysis. Semin Arthritis Rheum 2017; 47(2) : 149–56.
28. Charles-Schoeman C, Wicker P, Gonzalez-Gay MA, Boy M, Zuckerman A, Soma K, et al. Cardiovascular safety findings in patients with rheumatoid arthritis treated with tofacitinib, an oral Janus kinase inhibitor. Semin Arthritis Rheum 201; 46(3): 261–71.
29. Charles-Schoeman C, Fleischmann R, Davignon J, Schwartz H, Turner SM, Beysen C, et al. Potential mechanisms leading to the abnormal lipid profile in patients with rheumatoid arthritis versus healthy volunteers and reversal by tofacitinib. Arthritis Rheumatology 2015; 67(3): 616–25.
30. Šenolt L, Mann H, Závada J, Pavelka K, Vencovský J. Doporučení Českér evmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017. Čes Revmatol 2017; 25(1): 8–24.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 3-
All articles in this issue
- Diagnosis of polymyalgia rheumatica and giant cell arteritis using FDG PET and PET / CT imaging – Twelve-year experience of one diagnostic center
- Inhibitors of Janus kinases in the treatment of rheumatoid arthritis.
- Attenuation of chronic inflammation by exercise or by modifying the intestinal mikrobiome as causal measures on osteoporosis
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inhibitors of Janus kinases in the treatment of rheumatoid arthritis.
- Diagnosis of polymyalgia rheumatica and giant cell arteritis using FDG PET and PET / CT imaging – Twelve-year experience of one diagnostic center
- Attenuation of chronic inflammation by exercise or by modifying the intestinal mikrobiome as causal measures on osteoporosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

