-
Medical journals
- Career
Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
Authors: Hrnčíř Zb 1; L. Sobotka 2; M. Pospíšil 2; P. Prášil 3; J. Brtková 4; J. Laco 5
Authors‘ workplace: II. interní gastroenterologická klinika, 2III. interní gerontometabolická klinika, 3Klinika infekčních nemocí, 4Radiologická klinika, 5Fingerlandův ústav patologie, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice, Hradec Králové 1
Published in: Čes. Revmatol., 26, 2018, No. 2, p. 59-63.
Overview
Pyoderma gangrenosum (PG) je vzácné onemocnění ze skupiny neutrofilních dermatóz, které může být prognosticky závažnou komorbiditou revmatoidní artritidy. Dominantní klinickou manifestací jsou primárně abakteriální kožní ulcerace s nepravidelným, indurovaným a fialově zabarveným okrajem (zvl. trup/DK). Předmětem případové studie je závažná forma PG u 73letého muže, která kompletně splňuje poslední verzi (2017) diagnostických kritérií PG a navíc má tyto zvláštnosti: (a) paralelní klinická manifestace PG a pozdně začínající (ACPA a RFs izotypy séropozitivní) revmatoidní artritidy, (b) ulcerace PG byla fenoménem maskujícím fibrinoidně-nekrotickou (revmatoidní) arteritidu a (c) odpověď na terapii kombinací glukokortikoidy-cyklosporin byla sice pomalá, ale doposud dlouhodobě setrvalá. Analýza triády „pyoderma gangrenosum – revmatoidní artritida – nekrotizující arteritida“ je inspirativní v kontextu komplikované patogenní dráhy i jako klinický problém.
Klíčová slova:
Pyoderma gangrenosum, pozdně začínající revmatoidní artritida, patergní reakce, nekrotická arteritida, glukokortikoidy, cyklosporin
Úvod
Pyoderma gangrenosum (PG) je méně častý, ale prognosticky závažný syndrom ze skupiny neu-trofilních dermatóz. Dominantní klinickou manifestaci PG představují abakteriální bolestivé kožní ulcerace s indurovanými okraji fialového zabarvení, které ohraničují nekrotickou bázi vředu (-ů), zpravidla na trupu a/nebo na (dolních) končetinách, s tendencí k chronicitě a rekurencím. První popis L. Brocqa (1908) pod názvem „geometrický phagedenismus“ byl následně (1930) nahrazen termínem PG (1, 2): východiskem pro toto, z dnešního hlediska rozporuplné pojmenování byla skutečnost, že materiál z vředových lézí pacientů vyvolával podobné změny také po injektování experimentálním zvířatům. Teprve později se zjistilo, že léze u PG jsou abakteriální a nereagují na antibiotika; druhá část termínu PG celkem výstižně reflektuje destruktivní histopatologii (3). Méně častou vstupní manifestací PG jsou pustuly a buly nebo vegetativní léze. Charakteristickým, nikoliv však specifickým znakem PG je pozitivní patergní reakce na mechanický kožní podnět: standardním testem je intradermální vpich do kůže na volární ploše předloktí s tvorbou papulózní/pustulózní morfy během následných 24–48 h. Při podezření na PG pátráme po patergní reakci v anamnéze a během léčebných zákroků (injekce, débridement) vč. operačního traumatu.
Epidemiologická data o PG jsou k dispozici z databáze britských praktických lékařů (4): v kohortě 318 PG bylo 59 % žen, věkový medián 59 roků a incidence adjustovaná ke standardu evropské populace 0,63 (95% CI 0,57–0,71) na 100 000 pacientských roků. U 119 (35,9 %) PG z těchto nemocných byla zjištěna asociace k jinému onemocnění; v podskupině 39 PG (11,9 %) šlo o revmatoidní artritidu (RA). V téže databázi byla hodnocena i životní prognóza nemocných s PG: po adjustaci k celkové mortalitě evropské populace bylo zjištěno signifikantní riziko pro celou sestavu 318 PG, HR 3,02 (95% CI:1,84–4,73), p < 0,001 i pro podskupinu PG u RA, HR 1,55 (95% CI:1,01–2,27), p < 0,045 (4). Vedle RA jsou nejčastější komorbiditou PG idiopatické střevní záněty; významná část z nich má zánětlivé změny i na osovém skeletu nebo na periferních kloubech, ale jejich specifikace ve vztahu k PG není zatím k dispozici. V observační studii o PG u systémového lupus erythematodes byla zaznamenána korelace s aktivitou (5). Pohotovost k patergní reakci souvisí i s rizikem PG po operačním traumatu (post-OP). V systematickém přehledovém článku (1946–2013) byla provedena analýza post-OP PG u 220 nemocných: u 16,8 % bylo PG už v anamnéze, z komorbidit šlo o RA u 3,6 %, o idiopatický střevní zánět u 5,9 % a hematoonkologickou malignitu u 8,6 %. Ve vztahu k operačnímu zákroku bylo zjištěno post-OP riziko v tomto sestupném pořadí: oboustranná redukční mamoplastika (45,0 %), rekonstrukce prsů (25,0 %), kardiochirurgické operace (14,0 %), břišní chirurgie (14,0 %) a gynekologické operace (13,0 %); v preventivních opatřeních je kladen důraz na minimalizaci, débridement, a zmiňována je také pozitivní zkušenost s preventivním podáváním prednisonu (6).
Image 1. Pyoderma gangrenosum v konceptu chorob s autoinflamatorní komponentou. 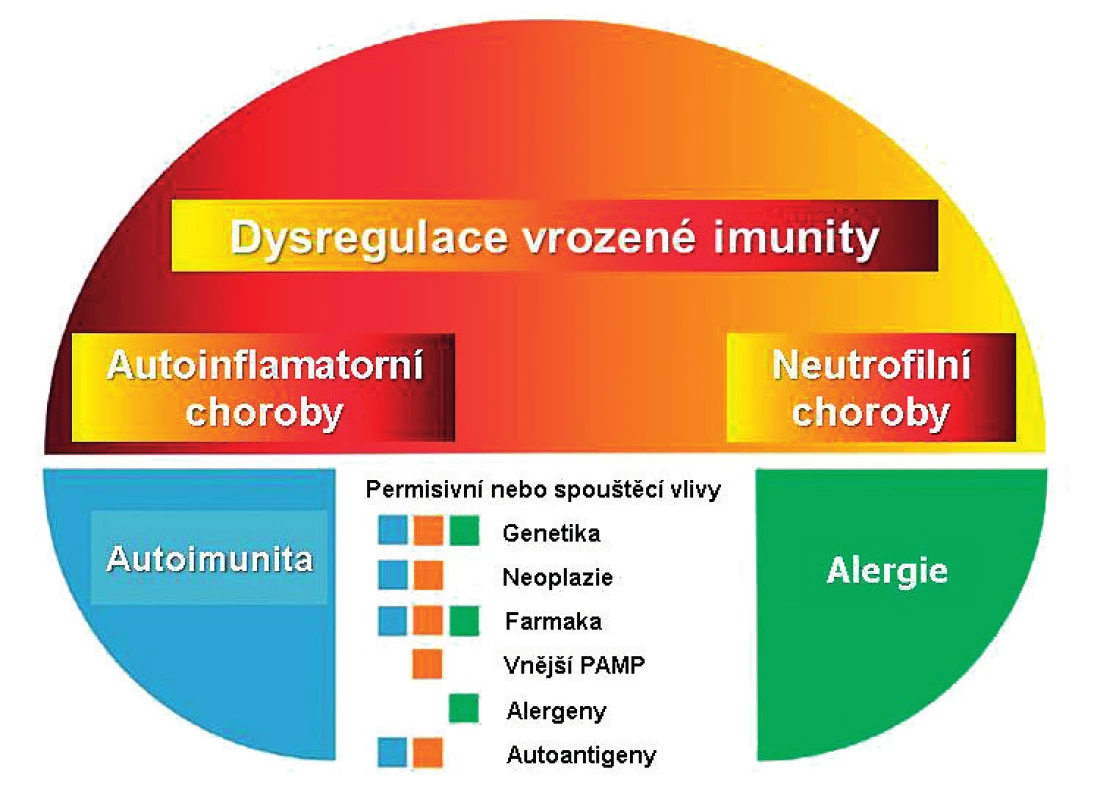
PAMP: Pathogene Associated Molecular Pattern. Upraveno podle Navarini AA et al. (8). Vzácně je PG součástí autoinflamatorního syndromu PAPA (Pyogenně sterilní Artritida-Pyoderma gangrenosum-Akne): jde o důsledek monogenní mutace genu CD2GP1 s patogenní dráhou podobnou jako u familiární mediteránní horečky (7). PG mimo PAPA syndrom má multifaktoriální provenienci v širším kontextu neutrofilních dermatóz. Společným znakem těchto onemocnění je dysregulace vrozené imunity s nekontrolovanou nadprodukcí proinflamatorních molekul; z hlediska patofyziologie se tak PG řadí do skupiny chorob s autoinflamatorní komponentou (obr. 1). (3, 8, 9).
PG nemá autorizovaná a všeobecně akceptovaná klasifikační nebo diagnostická kritéria. Syntézou dosavadních schémat je návrh na diagnostická kritéria PG z roku 2017 (tab. 1) (9). Těžištěm tohoto systému je triáda klinického, histologického a mikrobiologického vyhodnocení; v běžné praxi ale histologické posouzení mnohdy chybí, protože je důvodná obava ze zhoršení klinického nálezu patergní reakcí na biopsii. Tak např. archivní záznam 14 neutrofilních dermatóz u PG za 8 let (2008–2016) z Fingerlandova ústavu patologie (LF UK a FN Hradec Králové) zřejmě představuje blíže nespecifikované podhodnocení reálné incidence PG. Patergní reakce je sice inspirujícím, ale ne specifickým ukazatelem PG, a nelze ji proto zahrnovat do standardu diagnostických/klasifikačních požadavků. Nutno dodat, že PG může mít i extradermální projevy: nejčastěji jde o variabilní formy postižení plic (10, 11). S jednoznačnou výhradou o neúčinnosti antibiotik nejsou k dispozici ani autorizovaná doporučení pro terapii. Všeobecně se má za to, že prvním krokem jsou glukokortikoidy p. o., výběrově po vstupní sérii IV infuzí methylprednisolonu na úrovni tzv. minipulzů (tj. 125 mg pro jednu dávku), popř. v kombinaci s imunosupresivními cytostatiky nebo s cyklosporinem. Z biologik byl doložen příznivý efekt TNFi (infliximab) (12), opětovně však byl zaznamenán i opačný fenomén, tj. manifestace PG u RA během biologické léčby (13, 14); sporadicky byla zjištěna příznivá odpověď PG i na biologika mimo TNFi, např. na rituximab.
Table 1. Diagnostická kritéria pyoderma gangrenosum (PG) 2017. 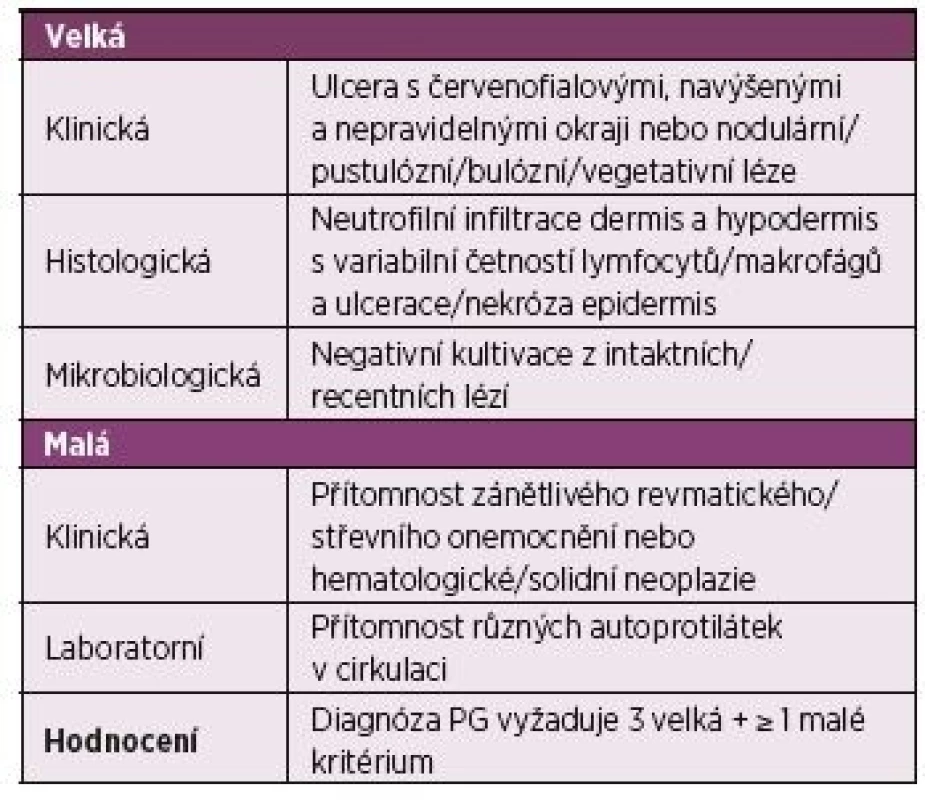
Upraveno podle Marzano et al. (9) Popis případu
Tč. 73letý muž se v sedmi letech léčil pro revmatickou horečku a v 41 letech byl vyšetřován pro lymfoproliferativní syndrom. Během 6. decennia se manifestovala cukrovka typu 2 (dieta a PAD), hemodynamicky významná aortální vada a chronická fibrilace síní, pro kterou warfarinizován. V 62 letech byla provedena náhrada aortální chlopně s implantací protézy: v dokumentaci z této doby není záznam o PG nebo o patergní reakci. Na cílený dotaz udává, že v posledních letech ho občas oboustranně bolely drobné ruční klouby, snad i s epizodickým otokem; u lékaře z tohoto důvodu nebyl.
Nynější onemocnění začalo náhle v 04/2016 jako rychle se rozpadající bulózní exantém v křížové krajině a nekrotizující vřed na pravém bérci. Pro podezření na erysipel byl přijat na Kliniku infekčních nemocí FN, kde však nebyla prokázána infekční příčina kultivačně ani při vyšetření PCR (Staphylococcus aureus, Streptococcus pyogenes i panbakteriální DNA negativní); sérový prokalcitonin byl v normě, ale CRP 182 mg/l. Pro otok kolen byla provedena (ortopedem) aspirační punkce se ziskem kultivačně negativní nitrokloubní tekutiny. Z podnětu revmatologického konzilia byly zhotoveny RTG snímky skeletu rukou a nohou (obr. 2), zjištěny abnormální hodnoty autoprotilátek (aCCP2 82,27 U/ml, RF-IgM 43 IU/ml a RF-IgG 36 IU/ml) a stanovena dg. pozdně začínající RA (EORA). K dořešení klinicky dominujících kožních ulcerací byl pacient předán na geriatrické oddělení. Přes intenzivní ATB a další komplexní celkovou i lokální péči se však stav nemocného nelepšil; na břišní stěně se rozšiřoval plošný nekrotický vřed (obr. 3A) a v místě injekčních vpichů docházelo k zánětlivé reakci a rozpadu. Při kontrolním revmatologickém konziliu bylo vysloveno podezření na PG u EORA, vzápětí doložené bioptickým průkazem neutrofilní dermatózy (obr. 4A, 4B) a navíc arteritidy s fibrinoidní nekrózou (obr. 4C, 4D); klinicky zřejmé projevy vaskulitidy nebyly zjištěny. Následně bylo rozhodnuto o terapii glukokortikoidy, vstupně formou série pěti „minipulzů“ IV infuzemi se 125 mg methylprednisolonu, pak Medrol (vstupně 32 mg) s postupnou redukcí na udržovací dávku 4 mg denně dlouhodobě. Při tomto postupu se zhojilo ložisko na pravém bérci a v křížové krajině, ale přetrvával rozsáhlý plošný vřed na břišní stěně (obr. 2B): terapie byla proto rozšířena o cyklosporin A (dlouhodobě nastaven na dávku 2 mg/kg); postupně se zhojil i tento plošný vřed (obr. 3C, 3D, 3E). Aktuálně je pacient 20 měsíců v setrvalé remisi a bez subj. obtíží; po 12měsíčním odstupu zhotovené RTG snímky drobných ručních a nožních kloubů jsou bez významné změny a protilátky aCCP2 jsou setrvale vysoce pozitivní (nejvyšší zaznamenaná hodnota 118 U/ml); kardiologický nález je antikoagulačně zajištěn apixabanem.
Diskuse
Pozorování splňuje diagnostická kritéria PG 2017 (9) a navíc má některé zvláštnosti. Z revmatologického hlediska je to především rozsah kožních ulcerací u doposud nerozpoznané RA s malými strukturními změnami na drobných ručních a nožních kloubech, ale současně a setrvale vysokou séropozitivitou protilátek proti citrulinovaným peptidům (ACPA). Nejde o překvapení, protože některá pozorování nasvědčují tomu, že ACPA séropozitivní RA má určitý sklon k PG (15): ACPA séropozitivita byla dokonce zaznamenána u PG bez klinicky vyjádřené RA (16).
Retrospektivně je evidentní, že klinické podezření na PG gradovalo s tím, jak chyběla odpověď na ATB terapii, která sice blokovala sekundární infekci a s tím související riziko sepse, ale podstatu problému nevyřešila. Inspirativním klinickým pozorováním byl opakovaný záznam abnormální reakce na injekční vpichy rázu patergní reakce. V této souvislosti je třeba zdůraznit, že v době kardiochirurgického zákroku a s tím souvisejícími venepunkcemi nebyla patergie zaznamenána: časový odstup 10 let je nepochybně dostatečný interval k tomu, aby se změnila tato forma kožní reaktivity s dovětkem, že bližší údaje o dynamice patergní reakce u PG nejsou k dispozici. Některé starší návrhy diagnostických kritérií PG zařazují anamnestický údaj o patergní reakci jako „malé kritérium“ (17). Hluboká kožní biopsie nejenže umožnila histopatologickou konfirmaci klinického obrazu PG, ale prokázala současně skrytou,maskovanou arteritidu s fibrinoidní nekrózou (obr. 4C, 4D), kterou lze v kontextu s EORA označit za – nejspíše limitovanou – revmatoidní vaskulitidu (RV). Ze systémových vaskulitid bylo PG popsáno u Takayausovy arteritidy (18) a opakovaně u granulomatózy s polyangiitidou (GPA): pro konkomitanci PG a GPA byl navržen termín „maligní pyoderma“ (19); jeho alternativou je fenomén mimikry, kdy kožní ulcerace má vzhled PG, ale histopatologickým nálezem je např. nekrotizující vaskulitida s obrovskobuněčnými granulomy (20). Obdobně lze komponenty zde popisovaného pozorování PG a RV u EORA hodnotit časově jako souběh a topograficky jako mimikry. Nutno dodat, že vaskulitida se občas najde také u PG bez dalších asociací.
Splnění všech hlavních složek diagnostických kritérií PG 2017 umožnilo rozhodnout u rizikového polymorbidního pacienta o startu intenzivní glukokortikoidní terapie, a v časovém odstupu – při perzistenci plošného vředu na přední stěně břišní (obr. 3B) – o její kombinaci s cyklosporinem; postupně došlo k jizevnatému zhojení i tohoto defektu (obr. 3C, 3D, 3E). Zvolená kombinace umožnila minimalizovat glukokortikoidní léčbu a vyhnout se imunosupresivním cytostatikům; při volbě cyklosporinu bylo přihlédnuto i k doporučením v referenční literatuře (3). Dynamika PG je charakterizována sklonem k chronicitě a rekurencím: v hodnoceném pozorování je zatím 20 měsíců trvající remise. V případě rekurence přichází v úvahu intenzifikace denních dávek stávající kombinace, a při rezistenci spíše TNFi nebo jiné biologikum než imunosuprese cytostatiky. V ošetřovatelské péči je zapotřebí vyhnout se débridement a injekční farmakoterapii všude, kde to je možné. Při plánování elektivní operace je třeba upozornit chirurga na anamnézu PG.
Image 2. RTG snímek rukou (a) a nohou (b) ve AP projekci: periartikulární poróza (*), zúžení kloubní štěrbiny (↑) a eroze (←). 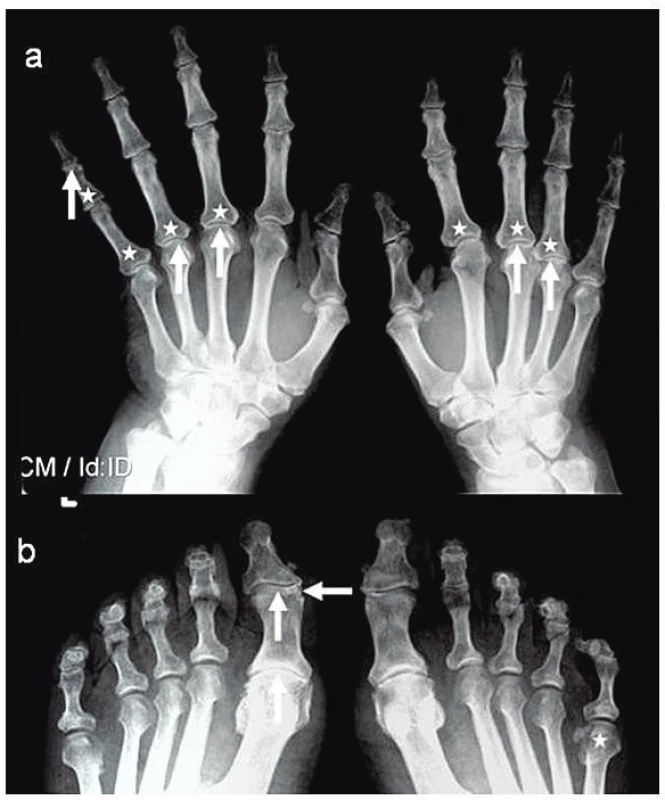
Archiv Radiologické kliniky LFUK a FN Hradec Králové. Image 3. Ulcerózní forma pyoderma gangrenosum na přední stěně břišní v časové řadě 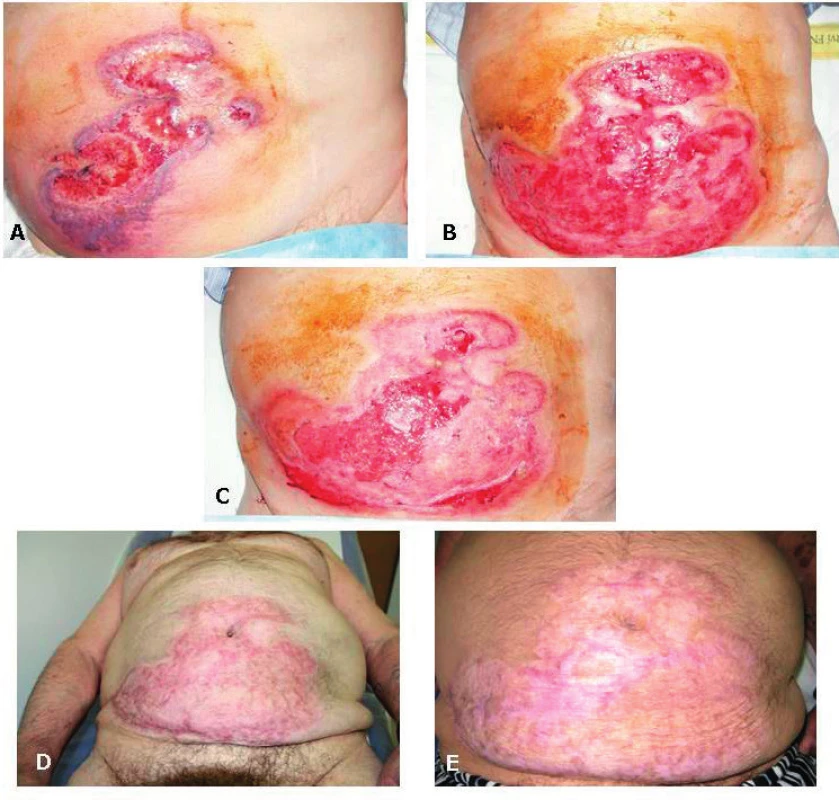
A (3. 8. 2016): Plošný vřed s nepravidelnými indurovanými okraji fialového zabarvení v den biopsie.
B (12. 9. 2016): Rozsah vředové léze před rozhodnutím o kombinaci glukokortikoidu s cyklosporinem.
C (30. 9. 2016): Počínající regrese s epitelizací plošného vředu.
D (23. 1. 2017): Rezidua zhojeného plošného vředu.
E (4. 12. 2017): Rezidua zhojeného plošného vředu.
Archiv III. interní GM kliniky (obr. A–C), archiv II. interní GE kliniky
(obr. D–E) LF UK a FN Hradec Králové.Image 4. A Masivní zánětlivá infiltrace ve formě flegmony až gangrény (nekróza tkáně): epidermis zachována jen částečně (HE, 100x).
B Masivní zánětlivá infiltrace dermis – detail na neutrofily (HE, 400x).
C–D Masivní zánětlivá infiltrace ve formě flegmony až gangrény (nekróza tkáně): uprostřed (šipka) drobná tepna s obrazem nekrotizující arteritidy (fibrinoidní nekróza stěny a infiltrace neutrofily). 4C: HE, 200x, 4D: HE, 400x.
Archiv Fingerlandova ústavu patologie, LF UK a FN Hradec Králové.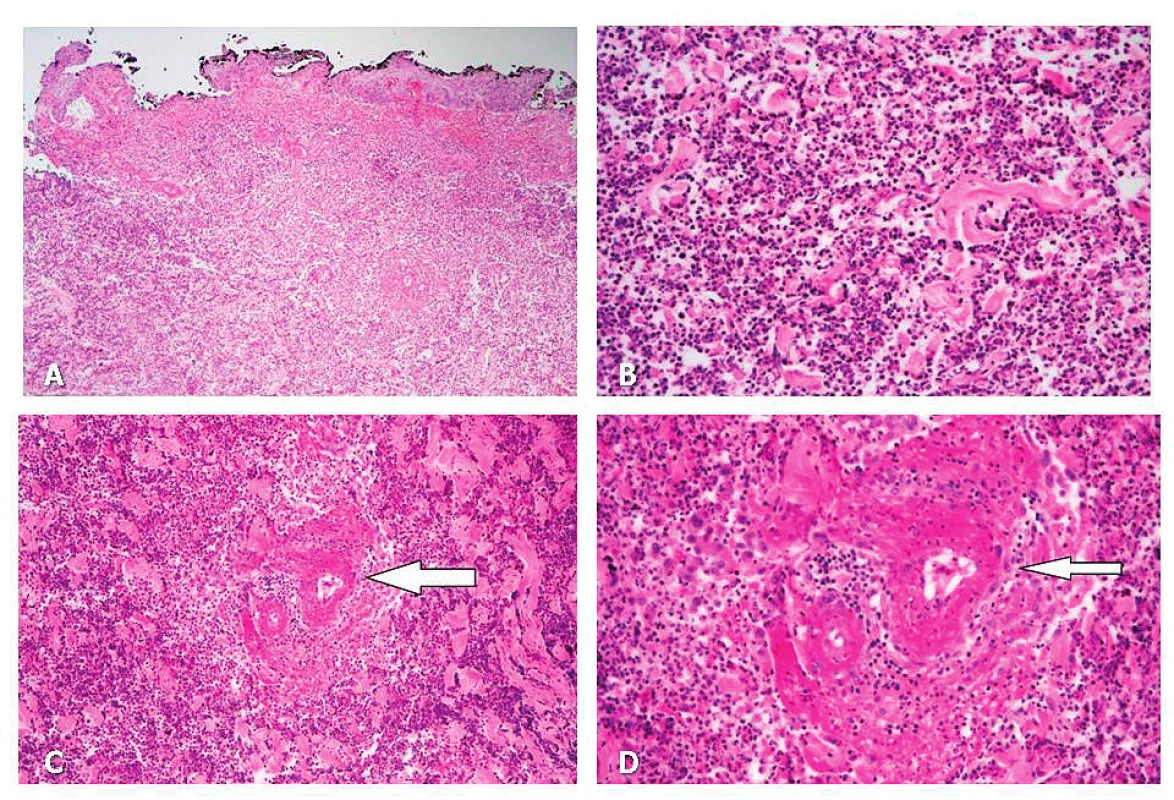
Závěr
Pyoderma gangrenosum je sice vzácnou, ale prognosticky závažnou komorbidní asociací revmatoidní artritidy; sporadicky bylo zaznamenáno také u dalších systémových revmatických onemocnění. Reálná frekvence pyoderma gangrenosum je nejspíše podhodnocena, protože část nemocných uniká evidenci a část histologické kompletizaci z obavy, že biopsie spustí patergní reakci. Jde o syndrom, se kterým se může setkat v každodenní praxi každý revmatolog, a je proto dobré vědět, co je vidět, a tím i vědět, co s tím dělat.
Poděkování: Podpořeno výzkumným projektem Univerzity Karlovy PROGRES Q40-15.
adresa pro korespondenci:
Prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní GE klinika LFUK a FN
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
E-mail: zbynek.hrncir@fnhk.cz
Sources
1. Farhi D. The clinical and histopathological description of geometric phagedenism (pyoderma gangrenosum) by Louis Brocq: one century ago. Arch Dermatol 2008; 144 : 755.
2. Gaimero A, Pereira N, Cardoso JC, Goncalo M. Pyoderma gangrenosum: challenges and solutions. Clinical, Cosmetic and Investigational Dermatology 2015; 8 : 285–293.
3. Moinzadeh P, Krieg Th. Neutrophilic dermatoses. In: Watts RA et al. (eds). Oxford Textbook of Rheumatology. 4th ed., Oxford: Oxford Univ. Press:2013. p. 1426–1433.
4. Langan SM, Groves RW, Card TR, Gulliford MC. Incidence, mortality, and disease assotiations of pyoderma gangrenosum in the United Kingdom: A retrospective cohort study. J Invest Dermatol 2012; 132 : 2166–2170.
5. Hau E, Vignon Pennamen MD, Battistella M, Saussine A, Bergis M, Calevelier-Balloy B et al. Neutrophilic skin lesions in autoimmune connective tissue diseases. Medicine 2014; 93: e346.
6. Zuo KJ, Fung E, Tredget EE, Lin An. A systematic review of post-surgical pyoderma gangrenosum: identification of risk factors and proposed management strategy. J Plast Reconstr Aesthet Surg 2015; 68 : 295–303.
7. Simon A, van der Meer JWS, Drenth JPH. Familiar autoinflammatory syndromes. In: Firestein GS et al. (eds). Kelley´s Textbook of Rheumatology. 9th ed. Philadelphia: Elsevier; 2013, p.1597–1615.
8. Navarini AA, Satoh TK, French LE. Neutrophilic dermatoses and autoinflammatory diseases with skin involvement – innate immune disorders. Semin Immunopathol 2016; 38 : 45–56.
9. Marzano AV, Borghi A, Wallach D, Cugno M. A comprehensive review of neutrophilic diseases. Clinic Rev Allerg Immunol.2017; 54 : 114–130.
10. Gade M, Studsgtrup F, Andersen AK, Hilberg O, Fogh C, Bendstrup E. Pulmonary manifestations of pyoderma gangrenosum: 2 cases and a review of the literature. Respiratory Med 2015; 109 : 443–450.
11. Be M, Cha HJ, Park Ch, Park Y, Jung H, Lee Y et al. Multiple pulmonary cavitary nodules with pyoderma gangrenosum in patients with rheumatoid arthritis. Ann Trans Med 2016; 4 : 39–42.
12. Brooklyn TN, Dunnill MGS, Shetty A, Bowden JJ, Williams JDL Grittiths CEM et al. Infliximab for the treatment of pyoderma gangrenosum: a randomised, double blind, placebo-controlled trial. Gut 2005; 55 : 505–509.
13. Hviščová K, Pavelka K. Kožní manifestace revmatoidní artritidy. Čes Revmatol 2010 : 18 : 125–131.
14. Akahoshi-Ikeda M, Youshizawa S, Motoshita J, Furue M, Takeuchi S. A case of pyoderma gangrenosus in a patient with rheumatoid arthritis treated with Abatacept. Acta Derm Venerol 2016; 96 : 822–823.
15. Devi B, Mohanty J. Pyoderma gangrenosum. Indian J Dermatol Venerol Leprol 2003; 69 : 193.
16. Das SK, Banerjee N, Khaskil S, Mukkherjee SS. Pyoderma gangrenosum and high titter serum anti-CCP2 antibodies. J Nepal Med Assoc 2012; 52 : 36–39.
17. Su WP, Davis MD, Weenig RH, Powel HO. Pyoderma gangrenosum: clinicopathologic correlation and proposed diagnostic criteria. Int J Dermatol 2004; 43 : 790–800.
18. Loetscher J, Fistarol S, Walker UA. Pyoderma gangrenosum and erythema nodosum revealing Takayasu´s arteritis. Case Rep Dermatol 2016; 8 : 354–357.
19. Gastman B, Hashem AM, Djohan R, Bernard S, Hendrickson M, Schwarz G et al. Malignant pyoderma associated with granulomatosis with polyangiitis (Wegener granulomatosis) as a unique indication for facial vascularized composite allotransplantation. Plastic Reconstructive Surgery 2016; 37 : 632–635.
20. De Cambourg G, Mahé A, Banea S, Moulinas C, Blaison G. Granulomatosis with polyangiitis revealed by a cutaneous ulceration mimicking a pyoderma gangrenosum: Two patients. Rev Med Intern 2016; 37 : 632–635
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 2-
All articles in this issue
- Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
-
Získaná hemofilie typu A – vzácná komplikace primárního Sjögrenova syndromu
Kazuistiky a literární přehled - Fertilita a revmatická onemocnění
- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Tocilizumab v léčbě polymyalgia rheumatica
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Fertilita a revmatická onemocnění
- Tocilizumab v léčbě polymyalgia rheumatica
- Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

