-
Medical journals
- Career
Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
Authors: R. Roman 1; Z. Řehák 2; A. Poprach 3; P. Němec 1
Authors‘ workplace: Fakultní nemocnice u sv. Anny v Brně, II. interní klinika, Oddělení revmatologie, Brno 1; Masarykův onkologický ústav, Oddělení nukleární medicíny, Regionální centrum aplikované molekulární onkologie (RECAMO), Brno 2; Masarykův onkologický ústav, Klinika komplexní onkologické péče, Brno 3
Published in: Čes. Revmatol., 26, 2018, No. 2, p. 80-86.
Category: Case Report
Overview
V posledních letech se k léčbě maligního melanomu (MM) využívají také inhibitory kontrolního bodu imunitních reakcí (immune checkpoint inhibitors – ICI). Jejích užití je spojeno s imunitně navozenými nežádoucími účinky (immune related adverse events – irAEs) různé závažnosti v minimálně 80 % případů. Mezi vzácně se vyskytující irAEs patří revmatická polymyalgie (PMR). PMR je autoimunitní onemocnění neznámé etiologie, které postihuje nejčastěji jedince starší 50 let. Manifestuje se bilaterální pletencovou bolestí v oblasti ramen a kyčlí. Formální doporučení pro léčbu irAEs způsobených terapií ICI dosud neexistují. Dosavadní práce zabývající se optimální léčbou vycházejí z klinických zkušeností. Většina irAEs reaguje dobře na glukokortikoidy navozením dočasné imunosuprese. Méně závažné případy mohou být také léčeny symptomaticky či pozastavením aplikace ICI. V závažnějších stavech lze terapeuticky zasáhnout intravenózní (i.v.) aplikací glukokortikoidů či přidáním dalších imunosupresiv. Ložiska maligního melanomu se vyznačují vysokou akumulací 18F-fluorodeoxyglukózy (FDG), a proto je PET/CT vyšetření s použitím tohoto radiofarmaka ideální jak pro diagnostiku, tak i pro sledování léčebné odpovědi maligního melanomu. Vysokou akumulaci FDG, avšak v typických lokalizacích, vykazuje také PMR. Uvádíme kazuistiku úspěšné léčby 76letého pacienta, u kterého se rozvinula PMR následkem léčby MM terapií ICI nivolumabem.
Klíčová slova:
Revmatická polymyalgie, maligní melanom, inhibitory kontrolního bodu imunitních reakcí, FDG PET/C
Úvod do problematiky
Revmatická polymyalgie (PMR) a obrovskobuněčná arteriitida (OBA)
PMR a OBA jsou zánětlivá autoimunitní onemocnění neznámé etiologie, která postihují nejčastěji jedince starší 50 let. Incidence se s věkem zvyšuje, přičemž nejvyšší je mezi 70. a 80. rokem života. Častěji jsou postiženy ženy bílé rasy, v poměru 2–3 : 1. PMR je u starší populace považována za druhé nejčastější revmatické onemocnění. OBA zase za nejčastěji se vyskytující vaskulitidu (1). PMR může předcházet OBA, doprovázet ji či se rozvinout následně po manifestaci OBA a vyskytuje se 2–3krát častěji než OBA (2). Projevy PMR nacházíme u 40–60 % pacientů, kteří mají OBA. Naopak 16–21 % pacientů trpících PMR má současně OBA (1).
PMR se manifestuje bilaterální pletencovou bolestí ramen a kyčlí, nicméně může být přítomna pouze jedna z výše uvedených. Současně přibližně u poloviny pacientů můžeme nacházet synovitidy periferních kloubů (metakarpofalangeální klouby, klouby zápěstí), vzácně jsou postižena i kolena. Kotníky a klouby nohy postiženy nebývají. Dalším z příznaků je ranní svalová ztuhlost delší než 30 minut a průkaz akutní zánětlivé odpovědi. Značná ztuhlost může způsobovat omezení běžných denních aktivit. Nepřítomnost svalové ztuhlosti prakticky vylučuje diagnózu PMR (3, 4). U části pacientů jsou také přítomny systémové příznaky zahrnující slabost, nechutenství, váhový úbytek, zvýšenou tělesnou teplotu nebo horečku (3).
OBA postihuje tepny středního a velkého kalibru. Klinicky se manifestuje celkovými nespecifickými projevy, bolestí hlavy a čelistními klaudikacemi, oslabením pulzace a palpační citlivostí temporálních tepen, poruchou zraku, ischemií v povodí velkých tepen a současnou přítomností příznaků PMR (3).
Bolest hlavy nemá přesně definovanou charakteristiku. Ve dvou třetinách případů se manifestuje bolestmi lokalizovanými do temporální oblasti. Může se však také vyskytovat v okcipitální, frontální oblasti, či difúzně. Jejím nejpodstatnějším znakem je, že je to bolest nově vzniklá, která může v dalším průběhu různě oscilovat (5). Proto v případě, že se u pacienta staršího padesáti let objeví nová bolest hlavy, nebo se změní její charakter, měla by se diagnóza OBA zvažovat. Čelistní klaudikace se vyskytují přibližně v polovině případů. Na rozdíl od bolestí temporomandibulárního kloubu, kdy se potíže objevují hned na počátku žvýkání, se klaudikace objevují až po několikanásobném nebo intenzívním žvýkání. Přítomnost čelistních klaudikací zvyšuje pravděpodobnost pozitivní biopsie z temporální arterie (5).
Maligní melanom (MM)
MM patří mezi nejzhoubnější druhy nádorů. Vzniká neoplastickou transformací pigment produkujících buněk, melanocytů. Jsou pro něj typické časné hematogenní a lymfogenní metastázy. Jeho roční incidence v České republice představuje přibližně 22 nově diagnostikovaných případů na 100 tis. obyvatel. Celosvětově se v incidenci Česká republika řadí na hranici první desítky (6). Rizikové faktory genetické a fenotyp jedince sice zvyšují riziko onemocnění, avšak za nejdůležitější rizikový faktor je považován faktor environmentální, a to je intermitentní expozice slunečnímu záření a eventuálně následná solární dermatitida (7, 8). Histopatologicky rozeznáváme 4 hlavní podtypy. Superficiálně se šířící melanom, nodulární melanom, lentigo maligna melanoma a akrolentiginózní melanom. Nodulární melanom se vyznačuje invazivním vertikálním růstem a představuje jednu z prognosticky nejzávažnějších forem. Klasifikace primárního nádoru dle Breslova hodnotí hloubku invaze. Podle stupně postižení uzlin a orgánů a hloubky invaze pak můžeme MM rozdělit do 4 klinických stadií. Ve III. stadiu je doba pětiletého přežití 60–75 %, ve IV. stadiu pouze 50 % (6).
Inhibitory kontrolního bodu imunitních reakcí (ICI – immune checkpoints inhibitors)
V posledních letech došlo k lepšímu pochopení mechanismu nádorového procesu, což vedlo k objevení monoklonálních protilátek ovlivňujících negativní regulátory T-buněčné odpovědi, ICI. Jako první byl objeven ipilimumab, plně humánní monoklonální protilátka proti CTLA-4 receptoru (cytotoxic T-lymphocyte-associated protein 4) T-lymfocytů. Blokací tohoto receptoru nedojde k vzájemnému působení s CD80/86 receptorem na povrchu APC buněk a výsledkem je trvalá aktivace T-lymfocytů (9).
Druhou skupinu tvoří protilátky proti receptoru programované buněčné smrti 1 (PD-1) nacházejícího se na T-lymfocytech, nebo jeho ligandu PD-L1, který je exprimován na APC a některých nádorových buňkách. Patří sem nivolumab a pembrolizumab, což jsou plně humánní IgG4 protilátky proti PD-1. Atezolizumab zase blokuje ligand PD-L1 a je humanizovanou protilátkou. Tyto látky znovu navozují imunitní odpověď tím, že nedovolí nádorovým buňkám T-lymfocyty deaktivovat
Nežádoucí účinky ICI. Inhibicí negativních imunitních regulátorů lze docílit lepší protinádorové odpovědi organismu, ale také i rozvoje imunitně navozených nežádoucích účinků (9). Mechanismus jejich vzniku není dosud přesně objasněn. Předpokládá se role zvýšené funkce T-lymfocytů. Konkrétně pomocných T lymfocytů 1 a 17 v případě inhibice PD-1 a následné zvýšené tvorby prozánětlivých cytokinů jako například interleukinu 6 a 17 a potenciace humorální imunitní odpovědi. V případě CTLA-4 inhibice se uplatňuje role regulačních T-lymfocytů. V případě blokace PD-1 hraje významnou roli i potenciace humorální imunitní odpovědi (9, 11).
IrAEs se mohou vyskytnout až v 80 % případů, v případě kombinační terapie ipilimumabu s nivolumabem až v 95 % (12). Dochází k nim nejčastěji v prvních třech až čtyřech měsících od započetí léčby. Mohou se také vyskytnout již po podání první dávky nebo i v pozdějších fázích terapie (9). Nejčastější je výskyt dermatitidy, enterokolitidy, endokrinopatií, autoimunitní hepatitidy a pneumonitidy. Z revmatických irAEs jsou to artritidy a sicca syndrom. Mezi méně časté irAEs patří PMR, myozitida, sarkoidóza či lupus-like syndrom (9). Přehled irAEs je shrnut v tabulce 1.
Table 1. Nežádoucí účinky léčby inhibitory kontrolních imunitních bodů (2, 9). 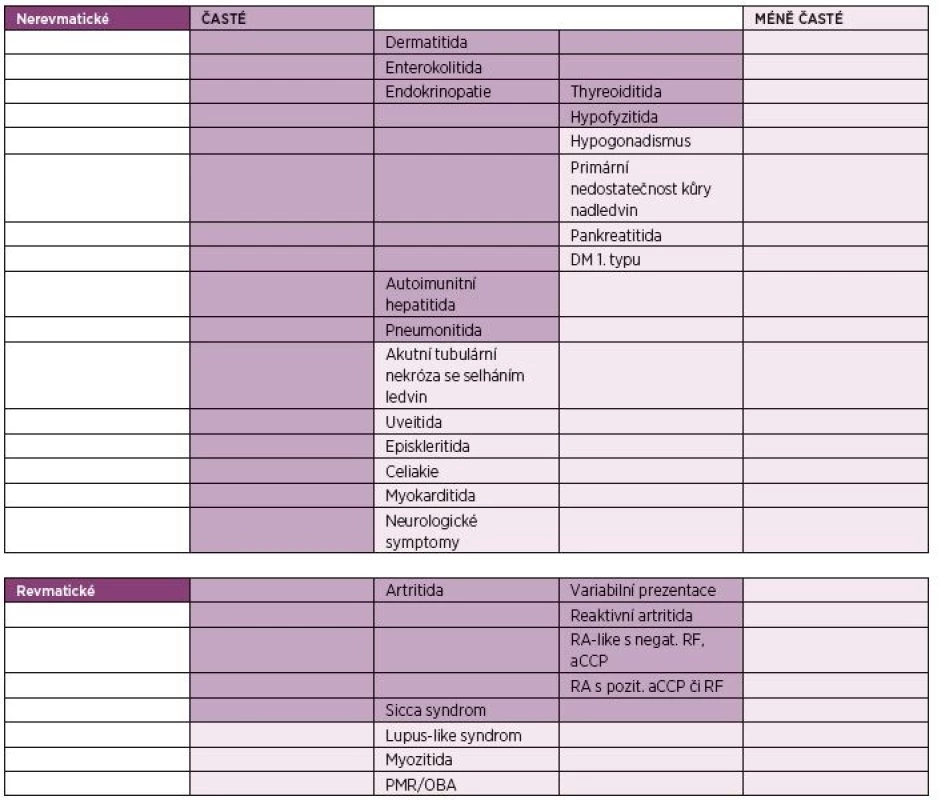
Kazuistika
Popisujeme vzácný případ 76letého pacienta dlouhodobě léčeného pro chronické srdeční selhání na podkladě ischemické choroby srdeční s permanentní fibrilací síní a diabetem 2. typu, který podstoupil terapii ICI nivolumabem. U pacienta byl v dubnu 2015 diagnostikovaný nodulární maligní melanom kůže levého bérce (pT3a pN1 L1 V0, Clark IV, Breslow 2,1 mm, ulcerace 0). Pacient byl indikován k radikální excizi s vyšetřením sentinelové mízní uzliny. V listopadu 2015 byla zjištěna metastáza v lymfatické uzlině levého třísla, což bylo řešeno exstirpací. Následně, v únoru 2016, došlo k lokální recidivě v jizvě levého bérce, což bylo opět řešeno vynětím. Zanedlouho, v srpnu 2016, došlo k relapsu onemocnění, kdy se znovu objevily metastázy v levém třísle, proto byl nasazen nivolumab. V úvodu léčby se vyskytly mírnější nežádoucí účinky ve formě zvýšené únavy, nechutenství a makulo-papulózního exantému na trupu, které spontánně odezněly. Po podání dvacáté série došlo k rozvoji závažné hepatopatie, pro kterou bylo další podání nivolumabu kontraindikováno. Po vyloučení infekčních hepatitid byly v úvodu podány třikrát pulsy methylprednisolonu v dávce 500 mg i.v., poté se pokračovalo v podávání prednisonu. Na této terapii došlo k výraznému zlepšení jaterních testů a pacient mohl být propuštěn. Dávka prednisonu při propuštění byla 50 mg. Ta byla postupně snižována a v průběhu dvou měsíců úplně vysazena (začátek října 2017). Záhy po vysazení glukortikoidů začal pacient pociťovat pletencovou bolest kolem ramenních a kyčelních kloubů. Popisoval ji jako „pocit dřevěných nohou“. S tím souvisel i pocit nejisté chůze. Pacientovi se těžko vstávalo ze židle a při vstávání se musel rukama zapírat o kolena. Bolesti ramen popisoval jako asymetrické, vyjádřené více vpravo, a proto koncem října 2017 navštívil ortopeda. Ten intraartikulárně do pravého ramene aplikoval metylprednisolon a mesokain, ale efekt se dle pacienta nedostavil. Při revmatologickém vyšetření v lednu 2018 však byla popisována symetrická pletencová svalová bolest. Také byla přítomna ranní svalová ztuhlost trvající více než třicet minut. Z konstitučních symptomů byl patrný váhový úbytek 18 kg v průběhu dvou měsíců. Nechutenství ani zvýšení teploty pacient neudával. Na vyšetření s 18F-fluorodeoxyglukózou (FDG), byla popsána symetricky zvýšená akumulace FDG kolem ramenních, kyčelních, kolenních i sternoklavikulárních kloubů a některých burz v okolí (např. subtrochanterických), ale i při sedacích hrbolech v úponech hamstringů. Zmíněný nález odpovídal obrazu revmatické polymyalgie. Pacient je od ledna 2018 dispenzarizován v revmatologické ambulanci, kde byla zahájena terapie prednisonem v dávce 15 mg denně se suplementací vápníkem a vitamínem D. Při své první ambulantní kontrole po jednom měsíci léčby udával pacient rychlé vymizení bolestí již po třech dnech užívání prednisonu. Následně mu byla doporučena redukce dávky na 10 mg v průběhu jednoho měsíce, poté redukce o 1,25 mg měsíčně. Dávka prednisonu k dubnu 2018 činila 7,5 mg denně. Subjektivně je pacient i nadále bez bolestí. Vývoj zánětlivých parametrů pacienta je shrnut v tabulce 2.
Table 2. Hodnoty zánětlivých parametrů pacienta. 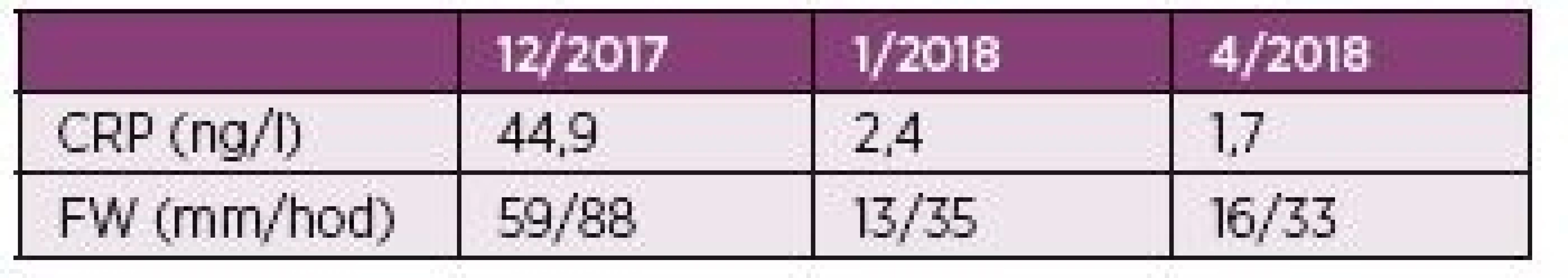
Diskuse
Během příštích let lze očekávat další zlepšení pětiletého přežití nemocných s maligním melanomem vzhledem k dobrým výsledkům nivolumabu a ipilimumabu v klinických studiích. Ve studii CheckMate 066 bylo jednoroční přežití pacientů léčených nivolumabem 72,9 % ve srovnání s dacarbazinem (používaným při chemoterapeutické léčbě), kde jednoroční přežití činilo 42,1 % (13). Ještě větší účinnosti lze docílit kombinací nivolumabu s ipilimumabem (14). Tyto úspěchy jsou však doprovázeny nežádoucími projevy, kdy četnost irAEs dosahuje až 95 % (12). Co se týče závažnosti irAEs, jsou nejčastěji popisovány méně závažné nežádoucí účinky 1. a 2. stupně dle CTCAE (Common Terminology Criteria for Adverse Events). Závažnější irAEs, 3. a 4. stupně, se vyskytují častěji při terapii ipilimumabem (15).
V kontextu časté incidence irAEs je výše popsaná kazuistika významná, a to i z hlediska optimalizace léčby irAEs.
Specificky z pohledu PMR/OBA po léčbě ICI bylo dosud v literatuře popsáno patnáct případů. Pět případů po léčbě nivolumabem (2, 16, 17, 18), dva případy léčených kombinací nivolumabu a ipilimumabu (2, 17), čtyři případy po léčbě pembrolizumabem (17, 19) a dva případy pacientů léčených ipilimumabem (20).
Léčba nežádoucích účinků ICI
Formální doporučení pro léčbu irAEs způsobených terapií ICI dosud neexistují. Dosavadní práce zabývající se optimální léčbou vycházejí pouze z klinických zkušeností (11). Méně závažné případy lze léčit symptomaticky případně orálním prednisonem v dávce 0,5–1 mg/kg nebo oddálením aplikace ICI. Závažnější případy pak vysazením ICI, podáváním i.v. metylprednisolonu v dávce 0,5–2 mg/kg. Refrakterní případy mohou vyžadovat prodloužení terapie glukokortikoidy nebo přidání dalšího imunosupresiva, například inhibitor TNF, mykofenolát mofetil nebo takrolimus. Nejdetailněji se léčbou irAEs způsobených terapií ICI zabývá Haanen et al. (15).
Léčba nežádoucích účinků u PMR
Ve většině výše zmíněných kazuistických sdělení týkajících se irAEs u PMR se iniciální denní dávka prednisonu pohybovala mezi 20–25 mg p.o. V průběhu dvou až tří dnů došlo k vymizení subjektivních potíží pacienta. Denní dávky pak byly postupně snižovány až k 7,5 mg. Není však uvedeno, jak rychle redukce dávek probíhaly. V případě onemocnění nereagujícího na glukokortikoidy nebo tam, kde jsou glukokortikoidy kontraindikovány, bychom volili přidání methotrexátu v dávce 7,5–10 mg/týden (17). Jako další možnost by přicházelo v úvahu užití tocilizumabu, humanizované monoklonální protilátky proti receptoru pro interleukin 16, nejspíše v kombinaci s glukokortikoidy (1). Tocilizumab je nově schválen americkou FDA (Food and Drug Administration) pro léčbu OBA (21). Jeho účinek je dokladován také u PMR, avšak jen v několika kazuistických sděleních či malých nerandomizovaných studiích (1), a proto je potřeba k ověření této indikace provedení dalších studií.
Takto navozená imunosuprese, dle dosud provedených retrospektivních studií, nejspíše nesnižuje účinnost terapie ICI (11).
FDG PET/CT v diagnostice maligního melanomu a revmatické polymyalgie
Maligní melanom, ať už primární ložiska, tak i uzlinové, orgánové, kožní a podkožní metastázy, patří k nádorům, které jsou provázeny vysokou akumulací 18F-fluorodeoxyglukózy (FDG) (23). PET/CT vyšetření s tímto radiofarmakem je zcela rutinně využíváno v různých indikacích, například i pro hodnocení léčebné odpovědi. U našeho pacienta došlo při terapii nivolumabem ke zmenšení velikosti uzlin a ke snížení akumulací FDG v uzlinách levého třísla a k úplnému vymizení metastatických uzlin na krku, v retroperitoneu a vymizení i podkožních metastáz na levé dolní končetině. Nově se však objevil obraz revmatické polymyalgie. Do FDG-PET/CT obrazu revmatické polymyalgie patří akumulace FDG kolem ramenních, sternoklavikulárních, kyčelních, i kolenních kloubů, a také v burzách v blízkém okolí, kolem hrbolů sedacích kostí (pravděpodobně kombinace ischiogluteální burzitidy a tenosynovitidy hamstringů), kolem trnových výběžků obratlů a před symfýzou (tenosynovitidy a entezitidy musculus adductor longus a musculus pectineus) (24). Až na poslední jmenovaný nález bylo vše patrné i v reportované kazuistice. Projevy PMR a MM jsou demonstrovány na obr. 1.
Image 1. FDG-PET/CT vyšetření – MIP obrazy odpovídající rozložení radiofarmaka FDG v trupu a dolních končetinách (vlevo) a fúzované PET/CT obrazy v axiálních řezech (vpravo). Nález odpovídající melanomu (zelené šipky): tři zvětšené uzliny v levém třísle do 20 mm vykazují jen mírně zvýšenou akumulaci FDG (pokles proti předchozím vyšetřením svědčící pro regredující nález). Nález odpovídající PMR (červené šipky): Zvýšená akumulace FDG kolem ramenních, sternoklavikulárních, kyčelních i kolenních kloubů, kolem hrbolů sedacích kostí), v náznaku i u trnových výběžků obratlů krční páteře. Zvýšená akumulace FDG v celém tračníku je obvyklým nálezem provázejícím terapii metforminem. 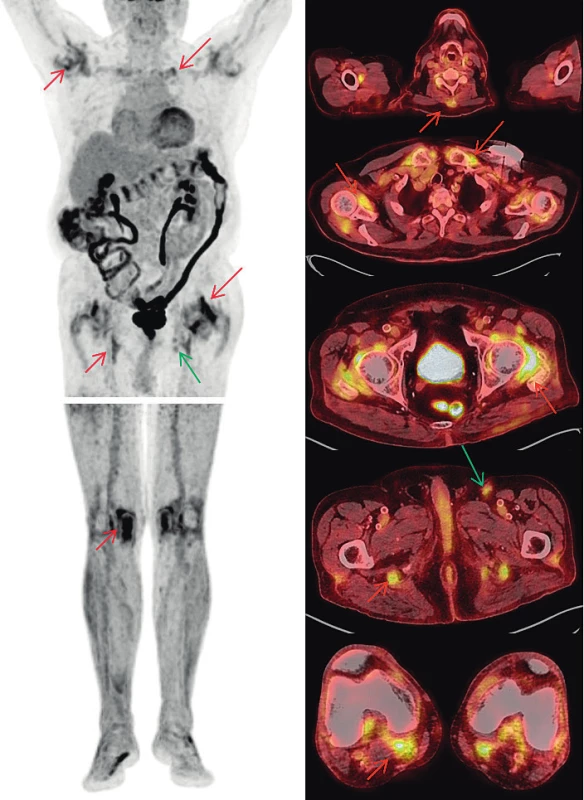
Revmatická polymyalgie indukovaná ICI a revmatická polymyalgie jako paraneoplastický projev
U našeho pacienta jsme zvažovali, zdali nově vzniklá PMR je projev paraneoplastický nebo nežádoucí účinek ICI. Dle kazuistických sdělení (2, 16) se klinický průběh PMR indukované neliší od PMR „klasické“.
PMR jako paraneoplastický syndrom se vyskytuje vzácně. Byl popsán v souvislosti s nádory hematopoetického systému, např. mnohočetným myelomem, lymfomem (25), nejčastěji však s myelodysplastickým syndromem (26). Dále byla popsána souvislost s metastazovanými solidními tumory plic, žaludku, pankreatu, střeva, ledvin, ovaria či prostaty (25). V těchto případech probíhá PMR atypicky, a proto je i v literatuře označována spíše jako PMR-like syndrom. Za atypický průběh se považuje rozvoj v mladším věku (< 50 let), asymetrické postižení, příliš nízká nebo vysoká sedimentace (FW < 40 nebo > 100 mm/h) a špatná odpověď na standardně doporučenou dávku glukokortikoidů. Symptomy se zmírní nebo vymizí v případě léčby vyvolávajícího tumoru (27).
Terapie nivolumabem měla u našeho pacienta za následek rozvoj PMR, což bylo prokázáno FDG PET/CT vyšetřením. Domníváme se, že se o paraneoplastický projev nejedná, a to z následujících důvodů: a) Zmenšení velikosti lymfatických uzlin levého třísla a úplné vymizení uzlin metastatických při terapii nivolumabem. b) Průběh je typický pro revmatickou polymyalgii. c) Promptní odpověď na nízkou úvodní dávku glukokortikoidů. Z těchto důvodů se léčba PMR vyvolaná terapií ICI nelišila od terapie PMR „klasické“.
Revmatická polymyalgie, obrovskobuněčná arteritida a nádorové onemocnění
Stojí za zmínku, že v případě revmatoidní artritidy, systémového lupus erythematodes či Sjörgenova syndromu bylo popsáno vyšší riziko rozvoje některých typů nádorových onemocnění. Zdali je vyšší riziko rozvoje nádorového onemocnění i v případě PMR/OBA, zůstává i nadále kontroverzní. Dosud provedené studie přinesly rozporuplné výsledky. Některé poukazují na zvýšenou incidenci v prvních 6–12 měsících od stanovení diagnózy (28, 29). Dvě nejnovější studie od autorů Pfeifer et al. (2015) (30) a Manzo et al. (2016) (31) však zvýšenou incidenci neprokazují a nádorový screening doporučují provádět jako u zdravé populace stejného věku a pohlaví.
Závěr
Léčba inhibitory imunitních kontrolních bodů nabízí nové možnosti v léčbě nádorů, ale zároveň lze očekávat vyšší incidenci nežádoucích účinků při dalším rozšíření této léčby. Proto by měli lékaři myslet i na tyto vzácné komplikace. Zároveň je nutno mít na paměti, že atypický průběh může souviset s paraneoplastickým projevem nádoru.
Podpořeno: MZ ČR – RVO (MOÚ, 00209805) a projektem LO 1413.
adresa pro korespondenci:
MUDr. Radoslav Roman
Fakultní nemocnice u sv. Anny v Brně, II. interní klinika, Oddělení revmatologie, Brno
e-mail: radoslav.roman@fnusa.cz
Sources
1. Dejaco C, Brouwer E, Mason JC, Buttgereit F, Matteson EL, Dasgupta B. Giant cell arteritis and polymyalgia rheumatica: Current challenges and opportunities. Nat Rev Rheumatol 2017; 13 (10): 1–15.
2. Calabrese C, Kirchner E, Kontzias K, Velcheti V, Calabrese LH. Rheumatic immune-related adverse events of checkpoint therapy for cancer: Case series of a new nosological entity. RMD Open 2017; 3 (2): e000412corr1.
3. Němec P, et al. Revmatologie pro praxi. Praha, Mladá fronta, 2016.
4. Docken W. Clinical manifestations and diagnosis of polymyalgia rheumatica. UpToDate 2018. Online. Dostupné na: http://www.uptodate.com.proxycu.wrlc.org/contents/clinical-manifestations-and-diagnosis-of-polymyalgia-rheumatica?source=search_result&search=polymyalgia+ rheumatica&selectedTitle=1~76#H4
5. Docken W. Clinical manifestations of giant cell (temporal) arteritis. UpToDate 2018. Online. Dostupné na: https://www.uptodate.com/contents/clinical-manifestations-of-giant-cell-temporal-arteritis?search=giant cell arteritis&source=search_result&selectedTitle=2~ 125&usage_type=default&display_rank=2
6. Kodet O, Krajsová I. Maligní melanom, incidence, rizikové faktory a jeho časná diagnostika. Onkologie 2017; 11 (3): 138–43.
7. Karlsson AK, Saleh SN. Checkpoint inhibitors for malignant melanoma: A systematic review and meta-analysis. Clin Cosmet Investig Dermatol 2017; 10 : 325–339.
8. Schadendorf D, Fisher DE, Garbe C, Gershenwald JE, Grob JJ, Halpern A, et al. Melanoma. Nat Rev Dis Primers 2015; 1 : 15003.
9. Suarez-Almazor ME, Kim ST, Abdel-Wahab N, Diab A. Immune-related adverse events with use of checkpoint inhibitors for immunotherapy of cancer. Arthritis Rheumatol 2017; 69 (4): 687–699.
10. Scott JL. Nivolumab: A review in advanced melanoma. Drugs 2015; 75 (12): 1413–1424.
11. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018; 378 (2): 158–68.
12. Larkin L, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, Schadendorf D. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373 (1): 23–34.
13. Robert C, Long GV, Brady B, Dutriaux C, Maio M, Mortier L et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372 (4): 320–330.
14. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017; 377(4): 1345–56.
15. Haanen J, Carbonnel F, Robert C, Kerr KM, Peters S, Larkin J, et al. Management of toxicities from immunotherapy: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl. 4): iv119–iv142.
16. Bernier M, Guillaume C, Leon N, Alexandre J, Hamel-Senecal L, Chretien B, et al. Nivolumab causing a polymyalgia rheumatica in a patient with a squamous non-small cell lung cancer, J Immunother 2017; 40 (4): 129–131.
17. Belkhir R, Burel SL, Dunogeant L, Marabelle A, Hollebecque A,Besse B, et al. Rheumatoid arthritis and polymyalgia rheumatica occurring after immune checkpoint inhibitor treatment. Ann Rheum Dis 2017; 76 (10): 1747–1750.
18. Nakamagoe K, Moriyama T, Maruyama H, Yokosawa M, Hara T, Tanaka S, et al. Polymyalgia rheumatica in a melanoma patient due to nivolumab treatment. J Cancer Res Clin Oncol 2017; 143 (7): 1357–1358.
19. Zimmer L, Goldinger SM, Hofmann L, Loquai C, Ugurel S, Thomas I et al. Neurological, respiratory, musculoskeletal, cardiac and ocular side-effects of anti-PD-1 therapy. Eur J Cancer 2016; 60 : 210–225.
20. Goldstein BL, Gedmintas L, Todd DJ. Drug – associated polymyalgia rheumatica/ giant cell arteritis occurring in two patients after treatment with ipilimumab, an antagonist of CTLA-4. Arthritis Rheumatol 2014; 66 (3): 768–769.
21. ACTEMRA (tocilizumab) injection 2017. (Online). Available: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/125276s114lbl.pdf.
22. Kim ST, et al. Successful treatment of arthritis induced by checkpoint inhibitors with tocilizumab: a case series. Ann Rheum Dis 2017; 76 (12): 2061–2064.
23. Řehák Z, Lakomý R, Fait V. Onkologie v obrazech. Klin Onkol 2015; 28 (2): 143–4.
24. Řehák Z, Sprlakova-Pukova A, Kazda T, Fojtik Z, Vargova L, Němec P. 18F-FDG PET/CT in polymyalgia rheumatica – a pictorial review. Br J Radiol 2017; 90 (1076): 20170198. 25. Randazzo CT, Bernard AW, Rund DA. Metastatic prostate cancer mimicking polymyalgia rheumatica. Case Rep Emerg Med 2011; 2011 : 695320.
26. Azar L, Khasnis A. Paraneoplastic rheumatologic syndromes. Curr Opin Rheumatol 2013; 25 (1): 44–49.
27. Coelho S, Magalhaes H, Correia J. Polymyalgia rheumatica and pulmonary adenocarcinoma: A case report and literature review. Porto Biomed J 2017; 2 (3): 93–95.
28. Ji J, Liu X, Sundquist K, Sundquist J, Hemminki K. Cancer risk in patients hospitalized with polymyalgia rheumatica and giant cell arteritis: A follow-up study in Sweden. Rheumatology 2010; 49 (6): 1158–1163.
29. Muller S, Hider SL, Belcher L, Helliwell T, Mallen CD. Is cancer associated with polymyalgia rheumatica? A cohort study in the General Practice Research Database. Ann Rheum Dis 2014; 73 (10): 1769–1773.
30. Pfeifer EC, Crowson CS. Polymyalgia rheumatica and its association with cancer. Rheumatol Curr Res 2015; Suppl 6 pii: 003.
31. Manzo C, Natale M. Polymyalgia rheumatica and cancer risk: The importance of the diagnostic set. Open Access Rheumatol Res Rev 2016; 8 : 93–95.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 2-
All articles in this issue
- Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
-
Získaná hemofilie typu A – vzácná komplikace primárního Sjögrenova syndromu
Kazuistiky a literární přehled - Fertilita a revmatická onemocnění
- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Tocilizumab v léčbě polymyalgia rheumatica
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Revmatická polymyalgie jako komplikace léčby maligního melanomu nivolumabem
- Fertilita a revmatická onemocnění
- Tocilizumab v léčbě polymyalgia rheumatica
- Pyoderma gangrenosum a nekrotizující arteritida u pozdně začínající revmatoidní artritidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

