-
Medical journals
- Career
Péče o pacienty s autoinflamatorními onemocněními: Česko-slovenská adaptace překladu evropských doporučení SHARE
: Š. Fingerhutová 1; T. Dallos 2; K. Bouchalova 3; I. Brejchová 4; J. Fráňová 5; E. Jančová 6; K. Jarošová 7; K. Kobrová 8; M. Macků 5; H. Malcová 9; L. Minxová 10; D. Němcová 1; M. Schüller 5; E. Skalická 11; V. Vargová 12; P. Doležalová 1*
: Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze, ČR 1; Detská klinika LF UK v Bratislave a NÚDCH, Bratislava, SR 2; Dětská klinika, LF UP a FN Olomouc, ČR 3; Nemocnice České Budějovice, ČR 4; Pediatrická klinika LF MU a FN Br no, ČR 5; Klinika nefrologie 1. LFUK a VFN v Praze, ČR 6; Revmatologický ústav, Praha, ČR 7; Dětská klinika Masarykovy nemocnice, Ústí nad Labem, ČR 8; Oddělení revmatologie dětí a dospělých, Fakultní nemocnice v Motole, Praha, ČR 9; Dětská klinika LF UK a FN Hradec Králové, ČR 10; Dětská klinika LF UK a FN Plzeň, ČR 11; Klinika detí a dorastu, LF UPJŠ a DFN v Košiciach, SR 12
: Čes. Revmatol., 26, 2018, No. 1, p. 8-22.
: Recommendation
Tato publikace je adaptovaným překladem originálního textu se svolením autorů. Autoinflamatorní onemocnění (AID) jsou typická opakujícími se epizodami horečky doprovázené systémovým zánětem s možným rozvojem závažných komplikací. Vzhledem k vzácnosti těchto chorob pro ně dosud chybí daty podložené doporučené postupy. V roce 2012 byla v rámci projektu SHARE (Single Hub and Access point for paediatric Rheumatology in Europe) zahájena snaha o optimalizaci a zveřejnění doporučení pro péči o děti a mladé dospělé s revmatickými chorobami, která by usnadnila klinickou praxi pediatrům a (dětským) revmatologům. Jedním z cílů bylo vypracovat doporučení založená na důkazech pro vybraná autoinflamatorní onemocnění – periodické syndromy asociované s kryopyrinem a s receptorem pro tumor nekrotizující faktor (CAPS, TRAPS) a syndrom deficitu mevalonát-kinázy (MKD). Tato doporučení byla vyvinuta podle standardní metodiky pro tvorbu doporučení Evropské ligy proti revmatismu (EULAR) skupinou odborníků v revmatologii dětí a dospělých. Doporučené postupy vycházejí ze systematického přehledu literatury získaného z definovaných literárních zdrojů, které byly hodnoceny odborníky formou online průzkumu a následně diskutovány za využití Nominální skupinové techniky. K přijetí doporučení došlo na základě dosažení ≥ 80% shody mezi experty. Celkem byly formulovány 4 obecné principy týkající se managementu pacientů s AID, 20 terapeutických doporučení a 14 doporučení pro monitoraci onemocnění. Jednotlivá témata se zabývají zejména hodnocením aktivity onemocnění, léčby a způsoby monitorace pacientů. Vytvoření těchto doporučení by mělo vést k optimalizaci péče o pacienty s CAPS, TRAPS a MKD. Překlad originálního textu byl aktualizován a modifikován údaji specifickými pro český a slovenský systém zdravotní péče.
Klíčová slova:
klinická doporučení, autoinflamatorní onemocnění, syndrom periodické horečky*pro Pracovní skupiny dětské revmatologie při České a Slovenské pediatrické společnosti
Úvod
Hlavním cílem evropského projektu SHARE (Single Hub and Access point for paediatric Rheumatology in Europe) bylo zmapování současného stavu péče v oboru dětská revmatologie v jednotlivých evropských zemích a definování jejího optimálního nastavení prostřednictvím tvorby mezinárodně přijatelných doporučení pro diagnostické a léčebné postupy u dětí a mladistvých s revmatickými chorobami (1). Součástí projektu je rozšíření těchto doporučení v jednotlivých evropských zemích. Zástupci pracovních skupin dětské revmatologie při České a Slovenské pediatrické společnosti přeložili tato doporučení a navrhli jejich česko-slovenskou adaptaci, která byla následně schválena jejich členy a podpořena výbory obou pediatrických společností i České revmatologické společnosti. Po domluvě s hlavními řešiteli projektu SHARE jsou autoři originálního textu publikace „Recommendations for the management of autoinflammatory diseases“ uvedeni v sekci Poděkování.
Autoinflamatorní onemocnění (AID) patří mezi vzácné choroby postihující řadu orgánových systémů a neléčená vedou k významné morbiditě i mortalitě. Včasné stanovení diagnózy a cílená léčba může nyní vzhledem k dostupnosti vysoce efektivních terapeutických možností zabránit vážnému orgánovému poškození. Spolehlivá doporučení tak mohou pomoci pediatrům a revmatologům v péči o pacienty s těmito vzácnými chorobami.
Doporučení se týkají tří zástupců autoinflamatorních onemocnění z podskupiny monogenních periodických horeček:
- Periodické syndromy asociované s kryopyrinem (CAPS), které jsou způsobeny autozomálně dominantně děděnou mutací v genu NLRP3. Jedná se o spektrum chorob od klinicky mírného familiárního chladového autoinflamatorního syndromu (FCAS) přes středně těžký Muckle-Wellsův syndrom (MWS) až k závažnému stavu označovanému jako novorozenecké multisystémové zánětlivé onemocnění (NOMID), známému také pod pojmem chronický infantilní neurologický, kožní a kloubní (CINCA) syndrom. Mezi výše jmenovanými jsou popisovány překryvné fenotypy se smíšenými projevy FCAS-MWS a MWS-CINCA (2). Pro CAPS jsou typické horečky doprovázené vyrážkou, konjunktivitidou a kloubním postižením (u FCAS typicky vyvolané chladem). U pacientů s vážnějším průběhem se může rozvinout postižení sluchu, zraku, chronická meningitida a amyloidóza (3, 4).
- Periodický syndrom asociovaný s receptorem pro tumor nekrotizující faktor (TRAPS) patří také mezi autozomálně dominantně děděná onemocnění. Mutace v genu TNFRSF1A vede k opakovaným epizodám protrahovaných horeček, které trvají v průměru deset dní a jsou doprovázeny různými symptomy včetně artralgií, myalgií a bolestí břicha (5).
- Syndrom deficitu mevalonát-kinázy (MKD) zahrnuje syndrom hyper IgD a dále vážnější formu – mevalonovou acidurii (MA). Jedná se o autozomálně recesivně děděná metabolická zánětlivá onemocnění, která jsou způsobena mutacemi v genu pro mevalonát-kinázu (MVK), jež ovlivňuje metabolismus kyseliny mevalonové (6). Horečky obvykle trvají 3–7 dní a jsou doprovázeny lymfadenopatií, břišními symptomy, artralgiemi a makulopapulózním exantémem (7). Kromě systémových přízna-ků mají pacienti s MA závažný fenotyp zahrnující růstovou retardaci, ataxii a kognitivní deficit (8).
Metodika tvorby doporučení
Konsorcium projektu SHARE ustanovilo mezinárodní skupinu 22 odborníků v oborech dětské a dospělé revmatologie, interní medicíny a nefrologie. Tvorba doporučení se řídila standardními postupy Evropské ligy proti revmatismu (EULAR) pro rozvoj nejlepší klinické praxe (9–10).
Přehled literatury. Rešerše literatury byla uskutečněna v databázích PubMed, Embase a Cochrane k datu 20. června 2013. Všechna synonyma pro CAPS, TRAPS a MKD byla vyhledána v rámci MeSH/Emtree termínů, článků a abstraktů. Další průzkum byl uskutečněn s heslem „autoinflamatorní onemocnění“ a s jeho synonymy. Manuálně byl pak proveden rozbor relevantních výsledků a přehled chybějících článků a byly vybrány publikace vhodné pro validaci. Český překlad byl doplněn o informace z novějších publikací v bezprostředním vztahu k již formulovaným doporučením.
Hodnocení významnosti publikací. Vybraní odborníci (dva pro každý článek) nezávisle hodnotili kvalitu metodiky jednotlivých publikovaných prací a vybrali relevantní podklady. Hodnocení probíhalo formou předdefinovaných skórovacích formulářů pro diagnostické studie (11), terapeutické studie (12) a studie hodnotící prognózu a komplikace onemocnění (13). Nesrovnalosti byly řešeny rozpravou mezi oběma odborníky, ve vybraných případech pak názorem třetího experta. Ke stanovení úrovně důkazů a váhy každého doporučení vycházejícího z dané publikace či publikací byly využity upravené klasifikační tabulky pro diagnostické (14), terapeutické (9) a epidemiologické studie (15).
Vývoj doporučení. Doporučení byla formulována na základě dostupné literatury a rozeslána všem expertům online průzkumem. Jejich předběžné znění bylo upraveno na základě připomínek a poté předloženo na osobním setkání odborníků. Řízená diskuse podle pravidel Nominální skupinové techniky (16) pak vedla k přijetí těch doporučení, na kterých se shodlo minimálně 80 % expertů. V česko-slovenské adaptaci byla obecná doporučení upravena po vzájemné dohodě českých a slovenských odborníků v oboru dětské revmatologie s ohledem na specifika obou zemí.
Výsledky
Přehled literatury. Rešerší literatury bylo získáno 1 698 originálních publikací pro CAPS, 523 pro TRAPS a 618 pro MKD syndrom. Na základě rozboru názvu, abstraktu a následně plného znění bylo vybráno celkem 25 CAPS, 22 TRAPS a 28 MKD publikací k validaci a zhodnocení úrovně důkazů. Z nich se pak stalo zdrojem pro formulaci doporučení 17/25 publikací o CAPS, 17/22 o TRAPS a 17/28 o MKD syndromu.
Doporučení. Jednotlivá doporučení jsou prezentována spolu se zdrojovými literárními odkazy a doplněna diskusí na téma jejich praktického použití. Tabulky 1–3 shrnují vlastní znění jednotlivých doporučení, úroveň příslušných důkazů a z ní plynoucí váhu doporučení. Současně je uvedena procentuální hodnota míry souhlasu expertů. V tabulce 4 jsou uvedena čtyři přídatná doporučení pro diagnózy TRAPS a MKD.
1. Obecné principy péče o pacienty s CAPS, TRAPS a MKD. 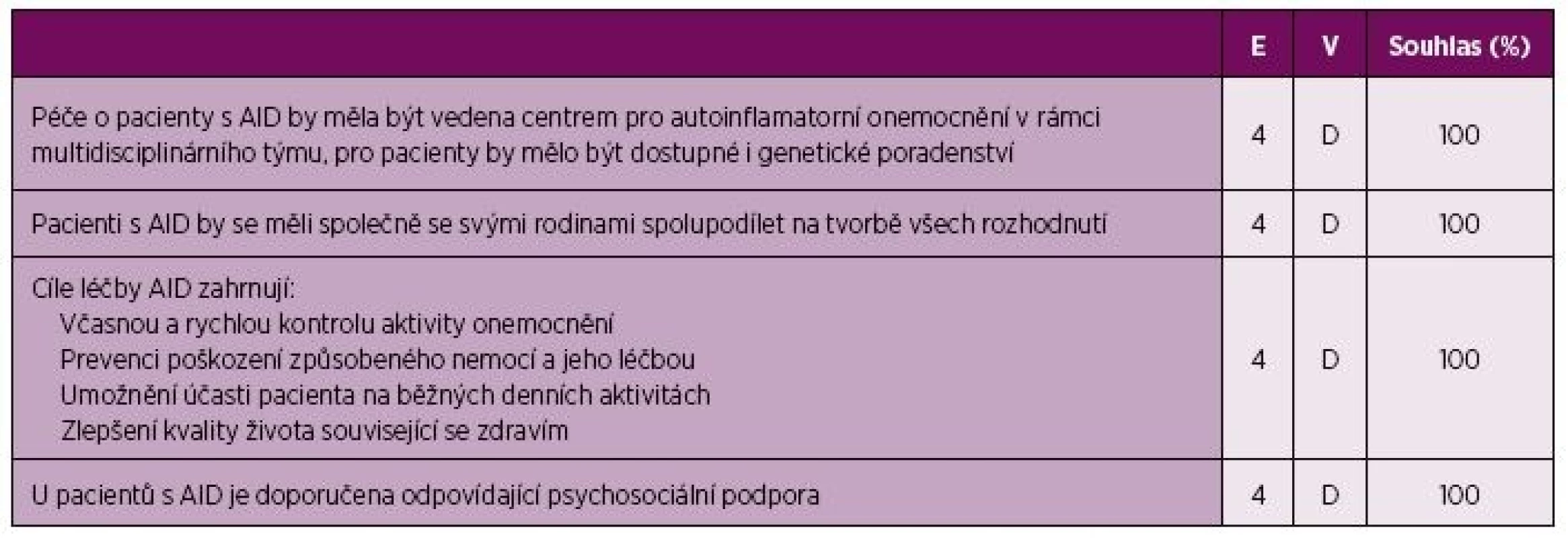
E – úroveň důkazu (evidence), 4 – názor experta, V – váha doporučení, D – založeno na úrovni důkazu 4, Souhlas – procento expertů, kteří souhlasili s doporučením během závěrečného hlasování v průběhu tvorby konsenzu, AID – autoinflamatorní onemocnění, CAPS - Periodické syndromy asociované s kryopyrinem, MKD – deficit mevalonát kinázy, TRAPS – Periodický syndrom asociovaný s receptorem pro TNF, TNF – tumor nekrotizující faktor 2. Doporučení pro léčbu CAPS, TRAPS a MKD. 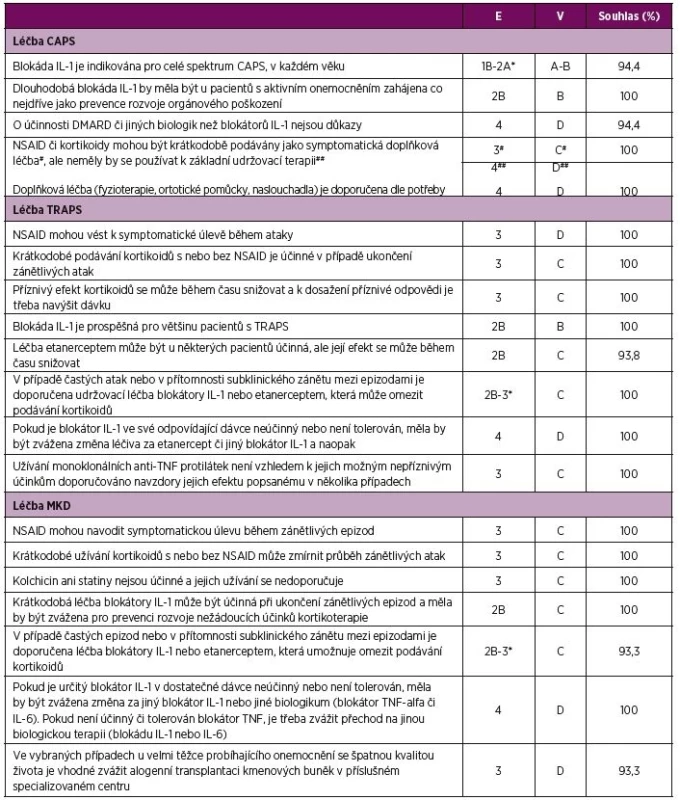
E – úroveň důkazu (evidence), 1B randomizovaná kontrolovaná studie, 2A kontrolovaná studie bez randomizace, 2B quasi-experimentální studie, 3 deskriptivní studie, 4 názor experta, V – váha doporučení, A – založená na úrovni důkazu 1, B – založená na úrovni důkazu 2 nebo extrapolace z úrovně 1, C – založená na úrovni důkazu 3 nebo extrapolovaná z úrovně 1 nebo 2, D – založená na úrovni důkazu 4 nebo extrapolovaná z úrovně 3 nebo 4, Souhlas – procento expertů, kteří souhlasili s doporučením během závěrečného hlasování v průběhu tvorby konsenzu *viz tabulka č. 4 pro bližší informace ohledně úrovně důkazu a schválení léčby blokátory IL-1 a TNF. CAPS – Periodické syndromy asociované s kryopyrinem, MKD – deficit mevalonát kinázy, TRAPS – Periodický syndrom asociovaný s receptorem pro TNF, TNF – tumor nekrotizující faktor 3. Doporučení pro monitoraci CAPS, TRAPS a MKD 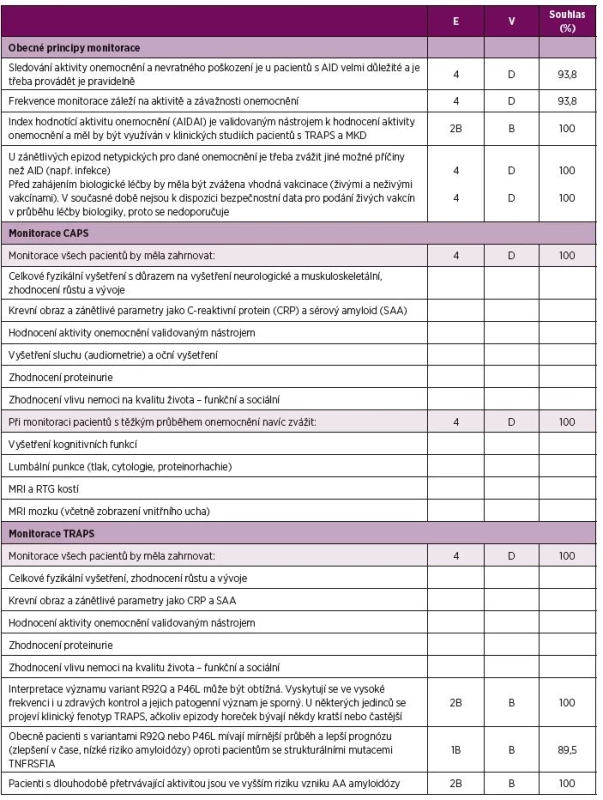
CR 2018/1 tab4 
E – úroveň důkazu (evidence), 1B prospektivní kohortová studie s dobrým sledováním pacientů; 2B retrospektivní kohortová studie nebo prospektivní s horším sledováním pacientů, 3 nekonsekutivní nebo limitovaná kohortová studie, 4 názor experta, V – váha doporučení, B – založená na úrovni důkazu 2 nebo exrapolovaná z úrovně 1, C – založená na úrovni důkazu 3 nebo extrapolovaná z úrovně 1 nebo 2, D – založená na úrovni důkazu 4 nebo extrapolovaná z úrovně 3 nebo 4, Souhlas – procento expertů, kteří souhlasili s doporučení během závěrečného hlasování v průběhu tvorby konsenzu, AID – autoinflamatorní onemocnění, CAPS - Periodické syndromy asociované s kryopyrinem, MKD – deficit mevalonát kinázy, TRAPS - Periodický syndrom asociovaný s receptorem pro TNF, TNF – tumor nekrotizující faktor 4. Doporučení pro diagnostiku TRAPS a MKD. 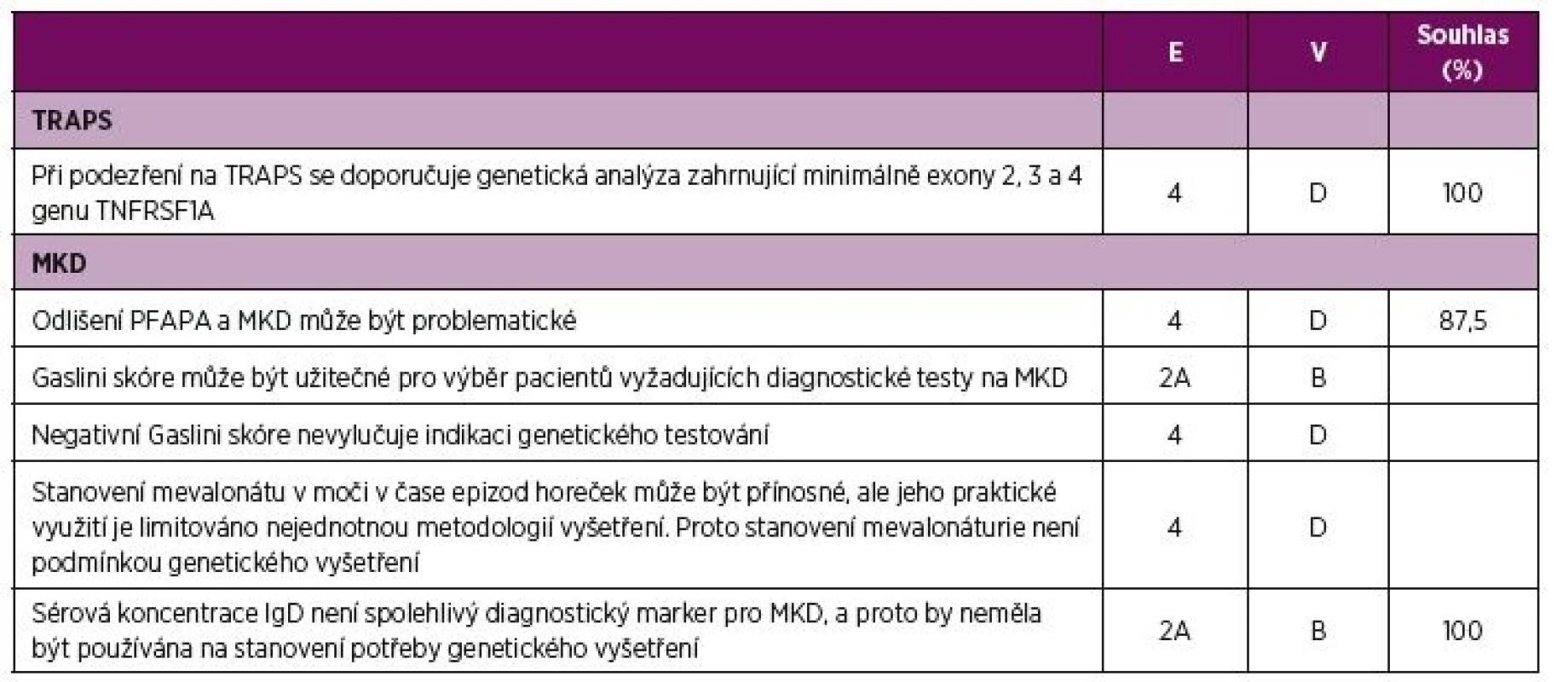
E – úroveň důkazu, 2A kohortová studie, 4 názor experta, V – váha doporučení, B – založená na úrovni důkazu 2 nebo exrapolovaná z úrovně 1, D – založená na úrovni důkazu 4 nebo extrapolovaná z úrovně 3 nebo 4, Souhlas - procento expertů, kteří souhlasili s doporučením během závěrečného hlasování v průběhu tvorby konsenzu. V rámci AID dochází k mnohočetnému orgánovému postižení s rizikem rozvoje závažných komplikací (4, 5, 7, 8, 17–26). Komplexní péče vyžaduje multidisciplinární přístup za účasti pediatra, revmatologa, fyzioterapeuta a dalších specialistů podle typu orgánového postižení, např. z oborů ORL, oftalmologie či nefrologie. Interpretace výsledků genetického vyšetření a genetické poradenství v rodinách pacientů vyžaduje vysokou úroveň genetické erudice (27). V případě mevalonové acid-urie je zapotřebí i péče odborníka na metabolická onemocnění.
Vzhledem k celoživotnímu trvání AID a jejich nezanedbatelnému vlivu na kvalitu života by měla být péče cíleně zaměřena na pacienta a jeho rodinu, stejně jako je tomu u většiny chronických onemocnění (28). Kvalita života pacientů s CAPS, TRAPS a MKD je ovlivněna v její fyzické i psychické složce, denní aktivity i vzdělávání těchto pacientů mohou být velmi citelně omezeny (7, 15, 19). V indikovaných případech je proto velmi důležité zajistit všem odpovídající psychosociální podporu.
Cílem léčby by měla být kontrola aktivity onemocnění a prevence poškození orgánů, protože účinná léčba mu může předejít nebo ho stabilizovat (21, 30, 31). Vhodná terapie může také zlepšit možnosti účastnit se běžných denních aktivit a přispět ke zvýšení kvality života pacientů, což je jedním z dalších cílů léčby (31–33).
Stanovení diagnózy. Časné stanovení diagnózy je rozhodující pro zahájení léčby před vznikem nevratného poškození. I když se diagnostická prodleva v posledních dekádách zkrátila, její průměrné trvání je stále 1–2 roky (34). Diagnostické skóre k provedení molekulární analýzy u pacientů s opakovanými horečkami (35) a nedávno publikovaná klinická klasifikační kritéria ke stanovení diagnózy monogenních AID (36) mohou usnadnit diagnostický proces a snížit dobu tohoto zpoždění. Diagnostická kritéria pro CAPS jsou v současné době ve stadiu vývoje.
Interpretace výsledků genetické analýzy nebývá vždy jednoznačná, zvláště pak u mutací TNFRSF1A s nízkou penetrancí či u pacientů s CAPS bez prokázané mutace. Nedávno publikovaná doporučení pro genetickou diagnostiku AID mohou pomoci lékařům a genetikům se správnou interpretací (27). Doporučujeme užívat tato doporučení při stanovování diagnózy. Specifická diagnostická doporučení, např. hodnocení sérového imunoglobulinu D a mevalonáturie v diagnostice MKD, jsou uvedena v tabulce 4. Česká pracovní skupina doporučuje jako screeningový test vyšetření mevalonáturie z moči odebrané v začátku typické epizody horečky, ideálně ze vzorku získaného smícháním několika porcí v průběhu 6–12 hodin během prvního až druhého dne horeček. Vyšetření provádí např. metabolická laboratoř Kliniky dětského a dorostového lékařství Všeobecné fakultní nemocnice v Praze. Žádanka na vyšetření je k dispozici na webových stránkách pracoviště (http://udmp.lf1.cuni.cz/ustav-dedicnych-metabolickych-poruch). Na Slovensku je stanovení organických kyselin z jednorázové ranní porce moči možné na Oddělení laboratorní medicíny Národního ústavu dětských chorob v Bratislavě.
Léčba
Periodické syndromy asociované s kryopyrinem (CAPS)
V současné době jsou k léčbě CAPS užívány tři blokátory interleukinu (IL)-1. Informace o nich jsou uvedeny v tabulce 5 a na webových stránkách lékových agentur EMA (European Medicines Agency) a FDA (Food and Drug Administration) (37, 38). V České republice je v současné době stanovena úhrada pro canakinumab (přípravek Ilaris), jehož použití je vázáno na centrum pro autoinflamatorní onemocnění. Ve Slovenské republice je canakinumab registrován pro léčbu CAPS a dalších autoinflamatorních onemocnění. Anakinra (přípravek Kineret) je v obou zemích registrován pro léčbu CAPS, i když nemá stanovenu úhradu.
Účinnost anakinry byla doložena výsledky observačních studií u pacientů s CINCA/NOMID syndromem (od 9 měsíců do 42 let) (31, 39–40), MWS (3–75 let) (40–42) a dospělých pacientů s FCAS (40, 43). Počáteční dávka anakinry se pohybovala mezi 0,5–2 mg/kg/den (u dětí) a 100 mg (u dospělých) podkožně. Někteří pacienti, především pak malé děti, vyžadovali k dosažení trvalé remise navýšení dávky na 5 až 8 mg/kg/den (31, 42). Tuto skutečnost potvrdila i farmakokinetická studie s anakinrou, kde mladší děti potřebovaly vyšší dávky anakinry k dosažení efektivní rovnovážné koncentrace (44).
Léčba canakinumabem byla účinná u pacientů s CAPS (MWS a CINCA/MWS překryvný syndrom, věk 9–74 let) (32, 45) ve dvou randomizovaných studiích a ve čtyřech studiích observačních (pacienti se všemi fenotypy CAPS, všechny věkové kategorie) (40, 42, 46, 47). Canakinumab byl podáván podkožně jedenkrát za osm týdnů v dávce 2 mg/kg (u dětí) nebo 150 mg (u dospělých). V jedné ze studií 24 % ze 166 pacientů potřebovalo navýšení dávky až na 8 mg/kg nebo 600 mg. Tato skutečnost byla pozorována především u dětí nebo u pacientů s těžkým fenotypem onemocnění (47).
Účinnost rilonaceptu (2,2 mg/kg nebo 160 mg jedenkrát týdně) byla prokázána jednou randomizovanou studií (dospělí pacienti s MWS a FCAS) (48) a dvěma studiemi observačními (pacienti s MWS a FCAS ve věku 12–80 let) (40, 49). Rilonacept zatím není Evropě k dispozici.
V případě CAPS nebyla prokázána efektivita chorobu modifikujících protirevmatických léků ani jiných biologik kromě blokátorů IL-1 (50). Některým pacientům symptomaticky pomůže podání nesteroidních antirevmatik (NSAID) a kortikoidů při souběžné léčbě blokátorem IL-1 (39-50). S ohledem na nedostatek validních údajů o účinnosti a spolehlivosti v prevenci rozvoje komplikací nedoporučujeme podávat kortikoidy a NSAID izolovaně bez současné léčby blokátorem IL-1.
Poškození orgánů jako je ztráta sluchu, neurologické postižení nebo kloubní deformity jsou zdrojem významné morbidity pacientů s CAPS, která může být příznivě ovlivněna blokádou IL-1 (21, 30, 31, 51). Proto je důležité zahájit tuto léčbu co nejdříve, tedy před vlastní manifestací poškození. Pokud již k tomuto nevratnému poškození dojde, měl by komplexní přístup k pacientovi zahrnovat i doplňkovou léčbu včetně fyzioterapie, použití ortotických pomůcek a naslouchadel.
Periodický syndrom asociovaný s receptorem pro tumor-nekrotizující faktor (TRAPS)
Důkazy týkající se účinnosti léčby pacientů s TRAPS byly donedávna založené hlavně na retrospektivních kohortových nebo malých prospektivních studiích. Jedna z retrospektivních kohort popisuje úlevu od příznaků po podání NSAID cca u 75 %pacientů, zřídka však podání těchto léků vedlo k ústupu zánětlivé epizody (50). Podání kortikoidů bylo v retrospektivních studiích účinné u většiny pacientů (23, 50, 52–4). Tato počáteční odpověď bohužel s časem postupně mizela (53).
Souhrn dostupných dat a indikací k léčbě blokátory IL-1 a TNF je uveden v tabulce 5. Účinnost etanerceptu byla zhodnocena ve dvou malých prospektivních studiích. Výsledkem bylo jednoznačné zlepšení stavu a pokles zánětlivých parametrů u většiny pacientů. Tento trend však v čase postupně klesal. Uvedená skutečnost vedla v jedné studii k přerušení léčby etanerceptem u 11/13 pacientů (55–57). Postupná ztráta účinnosti etanerceptu byla dále dokumentována velkou retrospektivní studií, která popisovala pouze dočasnou odpověď pacientů na etanercept a úplnou remisi onemocnění u méně než třetiny pacientů (50, 58). Léčba anakinrou v rámci malé prospektivní studie byla hodnocena jako účinná, jak ve schématu nárazového podávání při potížích („on-demand“), tak v dlouhodobé udržovací léčbě (59). Retrospektivní studie toto tvrzení podporují, úplné odpovědi na léčbu bylo dosaženo u dvou třetin pacientů (50, 58). Selhání léčby anakinrou bylo však rovněž popsáno (50, 60). Dosud plně nepublikované výsledky kontrolované studie Umbrella NCT02059291 (http://dx.doi.org/10.1136/annrheumdis-2016-eular.3881) hodnotící efekt canakinumabu u periodických horeček včetně TRAPS vedly k jeho schválení lékovými agenturami v této indikaci (37, 38).
U pacientů s častými epizodami onemocnění nebo trvalým (subklinickým) zánětlivým stavem doporučujeme vzhledem k riziku rozvoje AA amyloidózy (5) a vedlejším účinkům dlouhodobé kortikoterapie (61–63) udržovací léčbu blokátory IL-1 nebo etanerceptem. V retrospektivních studiích se zdá být lepší léčba blokátorem IL-1 (50), nicméně důkazy nadřazující jeden přípravek proti druhému nejsou k dispozici, takže biologikum první volby nelze jednoznačně stanovit.
Podklady pro přechod z jednoho biologika na druhé jsou u pacientů s TRAPS omezeny na jedinou studii, která ukázala efekt anakinry po ztrátě účinku etanerceptu (55). Zkušenosti u ostatních onemocnění napovídají, že přechod z jednoho přípravku na druhý může být prospěšný a měl by být zvážen, pokud je počáteční léčba neefektivní nebo ji pacient netoleruje (42, 64). V případě blokády IL-1 může být k dosažení kompletní odpovědi zapotřebí úprava jeho dávkování, jako tomu je u pacientů s CAPS (31, 42, 44, 47).
Podávání adalimumabu a infliximabu bylo popsáno v jednotlivých kazuistikách, a to s různými výsledky, včetně selhání léčby nebo zhoršení příznaků TRAPS. Tyto léky nejsou tedy k léčbě TRAPS doporučeny (60, 56, 57).
Deficit mevalonát-kinázy (MKD)
Účinnost léčby je u MKD popsána především v retrospektivních kohortách. Obtíže většiny pacientů se zlepšují při užívání NSAID podávaných v průběhu zánětlivých epizod (7, 8, 50), tato léčba však nevede k jejich ukončení. Podobně je tomu s účinností kortikoidů, která byla hodnocena retrospektivně a u většiny pacientů vedla alespoň k částečnému zlepšení (7, 8, 50). Podávání kolchicinu a statinů je neúčinné, navíc statiny u pacienta s MA vyvolaly závažnou ataku (7, 8, 26, 50).
Malá prospektivní studie ukázala, že nárazové podávání anakinry v atakách choroby zmírňuje všechny příznaky horečnatých epizod ve srovnání s pacienty neléčenými anakinrou (65). U pacientů s častými epizodami onemocnění nebo trvalým (subklinickým) zánětlivým stavem doporučujeme udržovací léčbu blokátorem IL-1 nebo etanerceptem. Trvalá léčba blokátory IL-1 anakinrou či canakinumabem nebo blokátory TNF etanerceptem či adalimumabem byla účinná přibližně u dvou třetin pacientů (7, 26, 50, 66). Dosud plně nepublikované výsledky kontrolované studie Umbrella NCT02059291 (http://dx.doi.org/10.1136/ann-rheumdis-2016-eular.3881) hodnotící efekt canakinumabu u periodických horeček včetně MKD vedly k jeho schválení lékovými agenturami i v této indikaci (27, 38). Tabulka 5 shrnuje důkazy pro léčbu blokátory IL-1 a TNF u pacientů s MKD. Vzhledem k chybějícímu přímému porovnání těchto biologik v rámci studií nelze jednoznačně doporučit některý ze zmiňovaných přípravků jako lék první volby. Přínos záměny jednoho biologika za jiné v případě selhání iniciální léčby není v současné době prokázán, avšak úspěch tohoto postupu u jiných onemocnění vede k doporučení jeho zvážení i u MKD (42, 64). V případě léčby blokátorem IL-1 je při nedostatečném efektu úvodní dávky vhodné zkusit její navýšení.
U vybraných jedinců s těžkým průběhem onemocnění a špatnou kvalitou života přichází v úvahu alogenní transplantace hematopoetických kmenových buněk (HSCT). Dosud byly popsány čtyři případy úspěšné transplantace. Ve všech došlo k potlačení systémového zánětu a zlepšení neurologických příznaků (67–69). Vzhledem k riziku spojenému se samotnou HSCT je tato léčebná možnost zvažována pouze u těžce postižených pacientů rezistentních nebo netolerujících všechny ostatní výše jmenované léčebné možnosti.
Monitorace
Obecná doporučení
Pravidelné sledování pacientů je nezbytné s ohledem na významnou morbiditu spojenou s nemocí samotnou i s její léčbou. V tomto kontextu má monitorování význam i pro adekvátní úpravu dávkování blokátorů IL-1 (39–47). Tíže onemocnění je v rámci spektra pacientů velmi variabilní a frekvence kontrol by měla být proto přísně individuální.
Standardizované monitorování pacientů s AID vyžaduje použití validovaného skóre aktivity onemocnění. Index aktivity autoinflamatorních onemocnění (Autoinflammatory Diseases Activity Index, AIDAI) je jediným validovaným indexem pro hodnocení aktivity TRAPS a MKD a jedním z několika skórovacích systémů pro aktivitu CAPS (70,71). Dalším z nich je skóre aktivity onemocnění u MWS (MWS-DAS) (72). Tyto hodnotící nástroje (AIDAI u TRAPS a MKD a AIDAI nebo MWS-DAS u pacientů s CAPS) doporučujeme používat v klinických studiích v rámci standardizace dat a umožnění jejich porovnání mezi studiemi. Český překlad AIDAI je k dispozici u autorů.
Během monitorace pacientů s AID je důležité odlišit jiné příčiny způsobující atypický průběh zánětlivých epizod. Infekční etiologie teplot a zánětlivých projevů je častá především u dětských pacientů. Infekční komplikace se mohou vyskytovat častěji a probíhat závažněji u pacientů s AID v důsledku nemoci samé i díky imunosupresivní léčbě (26, 31, 39, 41–43, 45, 47, 49, 73). Před zahájením podávání biologické léčby by měla být zvážena individuální potřeba vakcinace neživými i živými atenuovanými vakcínami. Podle doporučení EULAR pro očkování pacientů s revmatickými chorobami by pacientům na biologické léčbě neměly být podávány žádné živé vakcíny (74, 75). Některé studie naznačují, že booster živých atenuovaných vakcín proti spalničkám-příušnicím-zarděnkám a žluté zimnici může být bezpečně podán i pacientům léčeným blokátory TNF (76–78). Data týkající se bezpečnosti očkování pacientů během jejich léčby blokátorem IL-1 jsou omezena na jedinou randomizovanou studii zdravých subjektů (79) a zkušenost s 25 pacienty s CAPS léčenými canakinumabem. U nikoho z výše jmenovaných nebyla po očkování popsána abnormální imunitní odpověď ani patogenem způsobená infekce (47). Důkazy o bezpečnosti podávání živých atenuovaných vakcín jsou však stále omezené, a nelze proto očkování živými vakcínami v průběhu biologické léčby (zvláště pak blokátorem IL-1) doporučit.
CAPS
V tabulce 3 je uveden seznam parametrů, které je vhodné monitorovat u všech pacientů s CAPS. Tento seznam je založen na popsaných příznacích a komplikacích CAPS (17, 18, 20, 21, 30, 32, 72, 80–83). U závažnějších fenotypů je doporučeno také zobrazení skeletu a mozku (včetně zobrazení vnitřního ucha), monitorace kognitivních funkcí, lumbální punkce při podezření na chronickou meningitidu. Vzhledem k riziku rozvoje kostního přerůstu především v oblasti dolních končetin je doporučováno zobrazení (RTG a MRI) femurů, patel a tibií.
TRAPS
Většina symptomů TRAPS může být zhodnocena na základě odebrané anamnézy a fyzikálního vyšetření (5, 22–25). Amyloidóza je popisována u přibližně 10 % nemocných s TRAPS a vyskytuje se především u pacientů s dlouhotrvajícím průběhem onemocnění (5, 22, 23, 84). Monitorace zánětlivých parametrů a proteinurie by proto měla být prováděna pravidelně (5, 22, 23). Seznam obzvláště důležitých parametrů ke sledování u pacientů s TRAPS je uveden v tabulce 3.
Interpretace klinického významu variant s nízkou penetrancí R92Q a P46L může být s ohledem na jejich výskyt u 1–2 % asymptomatických kontrol velmi obtížná (22, 84). Pacienti s R92Q a P46L variantou, u nichž se objevují příznaky odpovídající TRAPS, mají podobný fenotyp jako pacienti s jinou TNFRSF1A mutací, ačkoli jejich epizody horeček mohou být kratší a častější (5, 23, 25). Tito jedinci mívají v porovnání s pacienty se strukturální mutací TNFRSF1A mírnější průběh onemocnění ve smyslu vymizení nebo snížení frekvence epizod a nižší riziko rozvoje AA amyloidózy (5, 22, 23, 25).
MKD
Většina pacientů s mírnými projevy MKD může být monitorována odebráním anamnézy, fyzikálním vyšetřením a běžnými laboratorními testy jako je krevní obraz, C-reaktivní protein (CRP) a sérový amyloid A (SAA). Tyto parametry hodnotí především přítomnost systémového zánětu (7, 26). Z důvodu možných renálních komplikací jako je AA amyloidóza, glomerulonefritida či renální angiomyolipom by měla být prováděna pravidelná analýza moči (7, 26). Oční sledování je potřeba pro možný výskyt retinitis pigmentosa nebo katarakty (26, 85).
Pacienti s těžšími fenotypy MKD mívají neurologické komplikace jako je ataxie, hypotonie a psychomotorická retardace. Z těchto důvodů by měli podstoupit testování kognitivních funkcí a vyšetření neurologem (8, 26). Kontrola svalových a jaterních enzymů by měla být prováděna kvůli možné přítomnosti hepatitidy či myopatie. Seznam vyšetření obzvláště důležitých v monitoraci MKD je uveden v tabulce 3.
Kromě zvýšeného rizika infekcí je třeba pomýšlet i na možnost rozvoje syndromu aktivace makrofágů (MAS), který může být příčinou atypicky probíhající horečky u pacientů s MKD. MAS je život ohrožující komplikace některých revmatických chorob (např. systémové juvenilní idiopatické artritidy) charakterizovaná vysokou horečkou, pancytopenií a hepatopatií (86). V jedné kohortě pacientů s MKD byla frekvence MAS překvapivě vysoká (6/50, 12 %) (26).
Diskuse
Výstupem projektu SHARE je 42 doporučení pro management pacientů s autoinflamatorními onemocněními CAPS, TRAPS a MKD, která jsou založena na systematické analýze literatury a následném konsenzu skupiny odborníků.
Biologická léčba dramaticky zlepšila prognózu pacientů s AID, především nemocných s CAPS léčených blokátory IL-1. V době originální publikace těchto doporučení nebyly ještě k dispozici výsledky studií s použitím blokády IL-1 u TRAPS a MKD, které vedly ke schválení canakinumabu pro léčbu těchto chorob v uplynulých dvou letech (37, 38). V České republice v těchto indikacích nemá canakinumab zatím stanovenu úhradu. Je známo, že závažné manifestace CAPS u malých dětí mohou vyžadovat podání blokátoru IL-1 dříve než je v současné době oficiálně uváděno. Výsledky studie bezpečnosti užití canakinumabu u velmi malých dětí by měly být brzy publikovány.
Základními předpoklady strategie léčby k cíli („treat to target“) je pečlivé sledování projevů onemocnění, stejně jako rozvoje nevratného poškození a posuzování kvality života pacientů. Kontrolované studie založené na dlouhodobém sledování pacientů s AID by měly objasnit rizika rozvoje komplikací těchto onemocnění. Vzhledem k vzácnosti těchto chorob je pro získání dostatečného počtu pacientů ve studiích nezbytná mezinárodní spolupráce. Validované skórovací systémy pro hodnocení aktivity onemocnění a poškození jsou důležité k posouzení vývoje nemoci, celkové prognózy a zejména k hodnocení dlouhodobé účinnosti léčby i s ní spojené morbidity. Indexy hodnocení aktivity onemocnění i poškození již byly vytvořeny, index poškození (Autoinflammatory Disease Damage Index, ADDI) je v současné době ve fázi validace (87).
Hlavním limitujícím faktorem těchto doporučení je nedostatek kvalitních důkazů daný vzácným charakterem a relativně nedávným zavedením genetické diagnostiky těchto chorob. S výjimkou blokády IL-1 není většina témat dostatečně prostudována, díky tomu má řada doporučení sílu C nebo D a jsou založená především na názoru expertů. Pro zvýšení úrovně důkazů v této oblasti je nezbytné další studium komplikací, monitorace a používání biologik.
Současně prezentovaná doporučení založená na dostupné evidenci a názoru expertů poskytují informace o optimální diagnostice, léčbě a monitoraci pacientů s CAPS, TRAPS a MKD a pomohou tak optimalizovat péči o pacienty s těmito vzácnými onemocněními.
Poděkování
Autoři česko-slovenské adaptace doporučení děkují autorům originálního textu:
Nienke M ter Haar,1,2 Marlen Oswald,3 Jerold Jeyaratnam,4 Jordi Anton,5 Karyl S Barron,6 Paul A Brogan,7 Luca Cantarini,8 Caroline Galeotti,9 Gilles Grateau,10 Veronique Hentgen,11 Michael Hofer,12 Tilmann Kallinich,13 Isabelle Kone-Paut,14 Helen J Lachmann,15 Huri Ozdogan,16 Seza Ozen,17 Ricardo Russo,18 Anna Simon,19 Yosef Uziel,20 Carine Wouters,21 Brian M Feldman,22 Sebastiaan J Vastert,2 Nico M Wulffraat,2 Susanne M Benseler,23 Joost Frenkel,4 Marco Gattorno,24 Jasmin B Kuemmerle-Deschner3
1Laboratory for Translational Immunology, University Medical Center Utrecht,Utrecht, Netherlands
2Department of Paediatric Immunology, University Medical Center Utrecht, Utrecht,The Nether-lands
3Division of Paediatric Rheumatology, University Hospital Tuebingen, Tuebingen,Germany
4Department of Paediatrics, University Medical Center Utrecht, Utrecht, The Netherlands
5Paediatric Rheumatology Unit, Hospital Sant Joan de Déu, University of Barcelona,Barcelona, Spain
6Division of Intramural Research, National Institute of Health, Bethesda, USA
7Department of Rheumatology, UCL Institute of Child Health, London, UK
8Rheumatology Unit, Policlinico Le Scotte, University of Siena, Siena, Italy
9Department of Pediatric Rheumatology, Reference Centre for Autoinflammatory Disorders CEREMAI, Bicêtre Hospital, Paris, France
10Department of Internal Medicine, APHP, Hôpital Tenon, University Pierre-et-Marie-Curie, Paris, France
11French Reference Centre for Auto-Inflammatory Diseases in Children, Centre Hospitalier de Versailles, Le Chesnay Cedex, France
12Department of Paediatrics, University of Lausanne, Lausanne, Switzerland
13Department of Paediatric Pneumology and Immunology, Charité UniversityMedicine, Berlin, Germany
14Department of Paediatric Rheumatology, Reference Centre for AutoinflammatoryDisorders CEREMAI, Bicêtre Hospital, University of Paris SUD, Paris, France
15National Amyloidosis Centre, University College London Medical School, London,UK
16Division of Rheumatology, Cerrahpasa Ic Hastaliklari Klinigi, University Istanbul,Istanbul, Turkey
17Department of Paediatrics, Hacettepe University Faculty of Medicine, Ankara,Turkey
18Service of Immunology and Rheumatology, Hospital de Pediatría Garrahan, Buenos Aires, Argentina,
19Department of Internal Medicine, Radboud University Medical Center, Nijmegen,The Netherlands
20Department of Paediatrics, Meir Medical Center, Tel-Aviv University, Tel-Aviv, Israel
21Department of Microbiology and Immunology, University Hospital Leuven, Leuven,Belgium
22Division of Rheumatology, The Hospital for Sick Children, Toronto, Canada
23Department of Paediatrics, Rheumatology, Alberta Children’s Hospital, University of Calgary, Calgary, Canada
24Division of Paediatrics II, G. Gaslini Institute, Genoa, Italy
adresa pro korespondenci:
Prof. MUDr. Pavla Doležalová, CSc.
KDDL 1. LFUK a VFN v Praze
Ke Karlovu 2 121 09 Praha
E-mail: Pavla.Dolezalova@vfn.cz
Sources
1. Wulffraat NM, Vastert B, SHARE consortium. Time to share. Pediatr Rheumatol Online J 2013; 11 : 15.
2. Aksentijevich I, D Putnam C, Remmers EF, et al. The clinical continuum of cryopyrinopathies: novel CIAS1 mutations in North American patients and a new cryopyrin model. Arthritis Rheum 2007; 56 : 1273–1285.
3. Neven B, Prieur AM, Quartier dit Maire P. Cryopyrinopathies: update on pathogenesis and treatment. Nat Clin Pract Rheumatol 2008; 4 : 481–489.
4. Levy R, Gerard L, Kuemmerle-Deschner J, et al. Phenotypic and genotypic characteristics of cryopyrin-associated periodic syndrome: a series of 136 patients from the Eurofever Registry. Ann Rheum Dis 2014; 74 : 2043–2049.
5. Lachmann HJ, Papa R, Gerhold K, et al. The phenotype of TNF receptor-associated autoinflammatory syndrome (TRAPS) at presentation: a series of 158 cases from the Eurofever/EUROTRAPS international registry. Ann Rheum Dis 2014; 73 : 2160–2167.
6. van der Burgh R, Ter Haar NM, Boes ML, et al. Mevalonate kinase deficiency, a metabolic autoinflammatory disease. Clin Immunol 2013; 147 : 197–206.
7. van der Hilst Jeroen CH, Bodar EJ, Barron KS, et al. Long-term follow-up, clinical features, and quality of life in a series of 103 patients with hyperimmunoglobulinemia D syndrome. Medicine 2008; 87 : 301–310.
8. Hoffmann GF, Charpentier C, Mayatepek E, et al. Clinical and biochemical phenotype in 11 patients with mevalonic aciduria. Pediatrics 1993; 91(5 I): 915–921.
9. Dougados M, Betteridge N, Burmester GR, et al. EULAR standardised operating procedures for the elaboration, evaluation, dissemination, and implementation of recommendations endorsed by the EULAR standing committees. Ann Rheum Dis 2004; 63 : 1172–1176.
10. van der Heijde D, Aletaha D, Carmona L, et al. 2014 Update of the EULAR standardised operating procedures for EULAR-endorsed recommendations. Ann Rheum Dis 2015; 74 : 8–13.
11. Whiting P, Rutjes AW, Dinnes J, et al. Development and validation of methods for assessing the quality of diagnostic accuracy studies. Health Technol Assess 2004; 8: iii, 1–234.
12. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration. http://www.cochrane-handbook.org (přístup v 07/2013).
13. Laupacis A, Wells G, Richardson WS, et al. Users’ guides to the medical literature. V. How to use an article about prognosis. Evidence-Based Medicine Working Group. JAMA 1994; 272 : 234–237.
14. Zhang W, Doherty M, Pascual E, et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65 : 1301–11.
15. OCEBM Levels of Evidence Working Group. “The Oxford Levels of Evidence 1.” http://www.cebm.net/index.aspx?o=1025 (přístup v 07/2014).
16. Harvey N, Holmes CA. Nominal group technique: an effective method for obtaining group consensus. Int J Nurs Pract 2012; 18 : 188–194.
17. Prieur A-M, Griscelli C, Lampert F, et al. A chronic, infantile, neurological, cutaneous and articular (CINCA) syndrome. A specific entity analysed in 30 patients. Scand J Rheumatol Suppl 1987; 66 (Suppl 66): 57–68.
18. Hoffman HM, Wanderer AA, Broide DH. Familial cold autoinflammatory syndrome: Phenotype and genotype of an autosomal dominant periodic fever. J Allergy Clin Immunol 2001; 108 : 615–620.
19. Arostegui JI, Aldea A, Modesto C, et al. Clinical and genetic heterogeneity among Spanish patients with recurrent autoinflammatory syndromes associated with the CIAS1/PYPAF1/NALP3 gene. Arthritis Rheum 2004; 50 : 4045–4050.
20. Caroli F, Pontillo A, D’Osualdo A, et al. Clinical and genetic characterization of Italian patients affected by CINCA syndrome. Rheumatology 2007; 46 : 473–478.
21. Kuemmerle-Deschner JB, Koitschev A, Ummenhofer K, et al. Hearing loss in Muckle-Wells syndrome. Arthritis Rheum 2013; 65 : 824–831.
22. Hull KM, Drewe E, Aksentijevich I, et al. The TNF receptor-associated periodic syndrome (TRAPS): Emerging concepts of an autoinflammatory disorder. Medicine 2002; 81 : 349–368.
23. Ravet N, Rouaghe S, Dode C, et al. Clinical significance of P46L and R92Q substitutions in the tumour necrosis factor superfamily 1A gene. Ann Rheum Dis 2006; 65 : 1158–1162.
24. Lainka E, Neudorf U, Lohse P, et al. Incidence of TNFRSF1A mutations in German children: epidemiological, clinical and genetic characteristics. Rheumatology 2009; 48 : 987–991.
25. Pelagatti MA, Meini A, Caorsi R, et al. Long-term clinical Profile of children with the low-penetrance R92Q mutation of the tNFRSF1A gene. Arthritis Rheum 2011; 63 : 1141–1150.
26. Bader-Meunier B, Florkin B, Sibilia J, et al. Mevalonate kinase deficiency: a survey of 50 patients. Pediatrics 2011; 128: e152–159.
27. Shinar Y, Obici L, Aksentijevich I, et al. Guidelines for the genetic diagnosis of hereditary recurrent fevers. Ann Rheum Dis 2012; 71 : 1599–1605.
28. Dwamena F, Holmes-Rovner M, Gaulden CM, et al. Interventions for providers to promote a patient-centred approach in clinical consultations. Cochrane Database Syst Rev 2012; 12: CD003267.
29. Stych B, Dobrovolny D. Familial cold auto-inflammatory syndrome (FCAS): Characterization of symptomatology and impact on patients’ lives. Curr Med Res Opin 2008; 24 : 1577–1582.
30. Koitschev A, Gramlich K, Hansmann S, et al. Progressive familial hearing loss in Muckle-Wells syndrome. Acta Otolaryngol 2012; 132 : 756–762.
31. Sibley CH, Plass N, Snow J, et al. Sustained response and prevention of damage progression in patients with neonatal-onset multisystem inflammatory disease treated with anakinra: a cohort study to determine three - and five-year outcomes. Arthritis Rheum 2012; 64 : 2375–2386.
32. Kone-Paut I, Lachmann HJ, Kuemmerle-Deschner JB, et al. Sustained remission of symptoms and improved health-related quality of life in patients with cryopyrin-associated periodic syndrome treated with canakinumab: Results of a double-blind placebo-controlled randomized withdrawal study. Arthritis Res Ther 2011; 13: R202.
33. Lepore L, Paloni G, Caorsi R, et al. Follow-up and quality of life of patients with cryopyrin-associated periodic syndromes treated with Anakinra. J Pediatr 2010; 157 : 310–315.e1.
34. Toplak N, Frenkel J, Ozen S, et al. An international registry on autoinflammatory diseases: the Eurofever experience. Ann Rheum Dis 2012; 71 : 1177–1182.
35. Gattorno M, Sormani MP, D’Osualdo A, et al. A diagnostic score for molecular analysis of hereditary autoinflammatory syndromes with periodic fever in children. Arthritis Rheum 2008; 58 : 1823–1832.
36. Federici S, Sormani MP, Ozen S, et al. Evidence-based provisional clinical classification criteria for autoinflammatory periodic fevers. Ann Rheum Dis 2015; 74 : 799–805.
37. European public assessment reports. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Summary_for_the_public/human/001109/WC500031677.pdf (přístup 01/2018).
38. FDA Approval labels. https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/BLA125319_858687lbl.pdf (přístup 01/ 2018).
39. Goldbach-Mansky R, Dailey NJ, Canna SW, et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1(beta) inhibition. N Engl J Med 2006; 355 : 581–392.
40. Wittkowski H, Kuemmerle-Deschner JB, Austermann J, et al. MRP8 and MRP14, phagocyte-specific danger signals, are sensitive biomarkers of disease activity in cryopyrin-associated periodic syndromes. Ann Rheum Dis 2011; 70 : 2075–2081.
41. Kuemmerle-Deschner JB, Tyrrell PN, Koetter I, et al. Efficacy and safety of anakinra therapy in pediatric and adult patients with the autoinflammatory Muckle-Wells syndrome. Arthritis Rheum 2011; 63 : 840–849.
42. Kuemmerle-Deschner JB, Wittkowski H, Tyrrell PN, et al. Treatment of Muckle-Wells syndrome: Analysis of two IL-1-blocking regimens. Arthritis Res Ther 2013; 15: R64.
43. Ross JB, Finlayson LA, Klotz PJ, et al. Use of anakinra (Kineret) in the treatment of familial cold autoinflammatory syndrome with a 16-month follow-up. J Cutan Med Surg 2008; 12 : 8–16.
44. Urien S, Bardin C, Bader-Meunier B, et al. Anakinra pharmacokinetics in children and adolescents with systemic-onset juvenile idiopathic arthritis and autoinflammatory syndromes. BMC Pharmacol Toxicol 2013; 14 : 40.
45. Lachmann HJ, Kone-Paut I, Kuemmerle-Deschner JB, et al. Use of canakinumab in the cryopyrin-associated periodic syndrome. N Engl J Med 2009; 360 : 2416–2425.
46. Kuemmerle-Deschner JB, Ramos E, Blank N, et al. Canakinumab (ACZ885, a fully human IgG1 anti-IL-1beta mAb) induces sustained remission in pediatric patients with cryopy-rin-associated periodic syndrome (CAPS). Arthritis Res Ther 2011; 13: R34.
47. Kuemmerle-Deschner JB, Hachulla E, Cartwright R, et al. Two-year results from an open-label, multicentre, phase III study evaluating the safety and efficacy of canakinumab in patients with cryopyrin-associated periodic syndrome across different severity phenotypes. Ann Rheum Dis 2011; 70 : 2095–2102.
48. Hoffman HM, Throne ML, Amar NJ, et al. Efficacy and safety of rilonacept (Interleukin-1 Trap) in patients with cryopyrin-associated periodic syndromes: results from two sequential placebo-controlled studies. Arthritis Rheum 2008; 58 : 2443–2452.
49. Hoffman HM, Throne ML, Amar NJ, et al. Long-Term Efficacy and Safety Profile of Rilonacept in the Treatment of Cryopryin-Associated Periodic Syndromes: results of a 72-Week Open-Label Extension Study. Clin Ther 2012; 34 : 2091–2103.
50. ter Haar NM, Lachmann H, Ozen S, et al. Treatment of autoinflammatory diseases: results from the Eurofever Registry and a literature review. Ann Rheum Dis 2013;72 (5):678–685.
51. Neven B, Marvillet I, Terrada C, et al. Long-term efficacy of the interleukin-1 receptor antagonist anakinra in ten patients with neonatal-onset multisystem inflammatory disease/chronic infantile neurologic, cutaneous, articular syndrome. Arthritis Rheum 2010; 62 : 258–267.
52. Williamson LM, Hull D, Mehta R. Familial hibernian fever. Q J Med 1982; 51 : 469–480.
53. McDermott EM, Smillie DM, Powell RJ, et al. Clinical spectrum of familial Hibernian fever: a 14-year follow-up study of the index case and extended family. Mayo Clin Proc 1997; 72 : 806–817.
54. Stojanov S, Dejaco C, Lohse P, et al. Clinical and functional characterisation of a novel TNFRSF1A c.605T>A/V173D cleavage site mutation associated with tumour necrosis factor receptor-associated periodic fever syndrome (TRAPS), cardiovascular complications and excellent response to etanercept. Ann Rheum Dis 2008; 67 : 1292 –1298.
55. Bulua AC, Mogul DB, Aksentijevich I, et al. Efficacy of etanercept in the tumor necrosis factor receptor-associated periodic syndrome: a prospective, open-label, dose-escalation study. Arthritis Rheum 2012; 64 : 908–913.
56. Drewe E, McDermott EM, Powell PT, et al. Prospective study of anti-tumour necrosis factor receptor superfamily 1B fusion protein, and case study of anti-tumour necrosis factor receptor superfamily 1A fusion protein, in tumour necrosis factor receptor associated periodic syndrome (TRAPS): Clinical and laboratory findings in a series of seven patients. Rheumatology 2003; 42 : 235–439.
57. Drewe E, Powell RJ, Mcdermott EM. Comment on: Failure of anti-TNF therapy in TNF Receptor 1-Associated Periodic Syndrome (TRAPS). Rheumatology 2007; 46 : 1865–1866.
58. Lane T, Loeffler JM, Rowczenio DM, et al. AA amyloidosis complicating the hereditary periodic fever syndromes. Arthritis Rheum 2013; 65 : 1116–1121.
59. Gattorno M, Pelagatti MA, Meini A, et al. Persistent efficacy of anakinra in patients with tumor necrosis factor receptor-associated periodic syndrome. Arthritis Rheum 2008; 58 : 1516–1520.
60. Quillinan N, Mannion G, Mohammad A, et al. Failure of sustained response to etanercept and refractoriness to anakinra in patients with T50M TNF-receptor-associated periodic syndrome. Ann Rheum Dis 2011; 70 : 1692–1693.
61. Hoes JN, Jacobs JW, Boers M, et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2007; 66 : 1560–1567.
62. van der Goes MC, Jacobs JW, Boers M, et al. Monitoring adverse events of low-dose glucocorticoid therapy: EULAR recommendations for clinical trials and daily practice. Ann Rheum Dis 2010; 69 : 1913–1919.
63. Duru N, van der Goes MC, Jacobs JW, et al. EULAR evidence-based and consensus-based recommendations on the management of medium to high-dose glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2013; 72 : 1905–1913.
64. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73 : 492–509.
65. Bodar EJ, Kuijk LM, Drenth JPH, et al. On-demand anakinra treatment is effective in mevalonate kinase deficiency. Ann Rheum Dis 2011; 70 : 2155–2158.
66. Galeotti C, Meinzer U, Quartier P, et al. Efficacy of interleukin-1-targeting drugs in mevalonate kinase deficiency. Rheumatology (United Kingdom) 2012; 51(1462–0332 (Electronic)): 1855–1859.
67. Arkwright PD, Abinun M, Cant AJ. Mevalonic aciduria cured by bone marrow transplantation. N Engl J Med 2007; 357 : 1350.
68. Neven B, Valayannopoulos V, Quartier P, et al. Allogeneic bone marrow transplantation in mevalonic aciduria. N Engl J Med 2007; 356 : 2700–2703.
69. Chaudhury S, Hormaza L, Mohammad S, et al. Liver transplantation followed by allogeneic hematopoietic stem cell transplantation for atypical mevalonic aciduria. Am J Transplant 2012; 12 : 1627–1631.
70. Piram M, Frenkel J, Gattorno M, et al. A preliminary score for the assessment of disease activity in hereditary recurrent fevers: Results from the AIDAI (Auto-Inflammatory Diseases Activity Index) consensus conference. Ann Rheum Dis 2011; 70 : 309–314.
71. Piram M, Koné-Paut I, Lachmann HJ, et al. Validation of the Auto-Inflammatory Diseases Activity Index (AIDAI) for hereditary recurrent fever syndromes. Ann Rheum Dis 2014; 73 : 1–6.
72. Kummerle-Deschner JB, Tyrrell PN, Reess F, et al. Risk factors for severe Muckle-Wells syndrome. Arthritis Rheum 2010; 62 : 3783–3791.
73. Singh JA, Wells GA, Christensen R, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev 2011; 2: CD008794.
74. Heijstek MW, Ott de Bruin LM, Bijl M, et al. EULAR recommendations for vaccination in paediatric patients with rheumatic diseases. Ann Rheum Dis 2011; 70 : 1704–1712.
75. van Assen S, Agmon-Levin N, Elkayam O, et al. EULAR recom-mendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2011; 70 : 414–422.
76. Heijstek MW, Kamphuis S, Armbrust W, et al. Effects of the live attenuated measles-mumps-rubella booster vaccination on disease activity in patients with juvenile idiopathic arthritis: a randomized trial. JAMA 2013; 309 : 2449–2456.
77. Borte S, Liebert UG, Borte M, et al. Efficacy of measles, mumps and rubella revaccination in children with juvenile idiopathic arthritis treated with methotrexate and etanercept. Rheumatology (Oxford) 2009; 48 : 144–148.
78. Scheinberg M, Guedes-Barbosa LS, Mangueira C, et al. Yellow fever revaccination during infliximab therapy. Arthritis Care Res (Hoboken) 2010; 62 : 896–898.
79. Chioato A, Noseda E, Felix SD, et al. Influenza and meningococcal vaccinations are effective in healthy subjects treated with the interleukin-1 beta-blocking antibody canakinumab: results of an open-label, parallel group, randomized, single-center study. Clin Vaccine Immunol 2010; 17 : 1952–1957.
80. Dollfus H, Hafner R, Hofmann HM, et al. Chronic infantile neurological cutaneous and articular/neonatal onset multisystem inflammatory disease syndrome: Ocular manifestations in a recently recognized chronic inflammatory disease of childhood. Arch Ophthalmol 2000; 118(0003–9950 (Print)):1386–1392.
81. Hill SC, Namde M, Dwyer A, et al. Arthropathy of neonatal onset multisystem inflammatory disease (NOMID/CINCA). Pediatr Radiol 2007; 37 : 145–152.
82. Lainka E, Neudorf U, Lohse P, et al. Analysis of Cryopyrin-associated periodic syndromes (CAPS) in German children: Epidemiological, clinical and genetic characteristics. Klin Padiatr 2010; 222 : 356–361.
83. Rowczenio DM, Trojer H, Russell T, et al. Clinical characteristics in subjects with NLRP3 V198M diagnosed at a single UK center and a review of the literature. Arthritis Res Ther 2013; 15: R30.
84. Aksentijevich I, Galon J, Soares M, et al. The tumor-necrosis-factor receptor-associated periodic syndrome: new mutations in TNFRSF1A, ancestral origins, genotype-phenotype studies, and evidence for further genetic heterogeneity of periodic fevers. Am J Hum Genet 2001; 69 : 301–314.
85. Siemiatkowska AM, van den Born LI, van Hagen PM, et al. Mutations in the mevalonate kinase (MVK) gene cause nonsyndromic retinitis pigmentosa. Ophthalmology 2013; 120 : 2697–2705.
86. Minoia F, Davi S, Horne A, et al. Clinical features, treatment, and outcome of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: a multinational, multicenter study of 362 patients. Arthritis Rheumatol 2014; 66 : 3160 –3169.
87. ter Haar NM, Annink KV, Al-Mayouf SM, et al. Development of the autoinflammatory disease damage index (ADDI) Annals of the Rheumatic Diseases 2017;76 : 821–830
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 1
Most read in this issue- The significance of cerebrospinal fluid examination in neuropsychiatric systemic lupus erythematosus
- Non-pharmacological treatment in systemic sclerosis
- Ten Haar NM et al. Recommendations for the management of autoinflammatory diseases. Ann Rheum Dis 2015; 74: 1636–1644.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

