-
Medical journals
- Career
Současné normativní systémy a rizikové faktory u polymyalgia rheumatica
: Hrnčíř Zb 1; J. Brtková 2
: II. interní gastroenterologická klinika Lékařské fakulty UK a Fakultní nemocnice, Hradec Králové 1; Radiologická klinika Lékařské fakulty UK a Fakultní nemocnice, Hradec Králové 2
: Čes. Revmatol., 24, 2016, No. 2, p. 38-46.
: Review Article
Polymyalgia rheumatica (PMR) je klinický syndrom charakterizovaný bolestí a ztuhlostí šíje, ramenního a pánevního pletence; u starší (kavkazské) populace to je nejčastější zánětlivé revmatické onemocnění. Náročná diferenciální diagnostika, problematika léčebných protokolů a technologický pokrok (zvl. v ultrasonografickém zobrazování) vedly v poslední dekádě k vypracování přesnějších doporučení (BSR/BHPR 2010), původních klasifikačních kritérií (EULAR/ACR 2012) a standardizovaných přístupů v péči o PMR nemocné (EULAR/ACR 2015): představují „State-of-the-Art“ u PMR a jsou těžištěm tohoto článku. Paralelně došlo k význačnému pokroku v informacích o hlavních rizikových faktorech PMR, především pokud jde o překryv s obrovskobuněčnou arteritidou, pravděpodobnost zhoubných nádorů a responzivitu/toxicitu dlouhodobé (glukokortikoidní) terapie. Současné normativní systémy přispívají k limitaci závažnosti rizikových faktorů u PMR a jejich respektování je zejména v revmatologii předpokladem dobré klinické praxe.
Klíčová slova:
Polymyalgia rheumatica, klasifikační kritéria, skórovací algoritmy, glukokortikoidy, obrovskobuněčná arteritida, onkogenní rizikoÚvod
Polymyalgia rheumatica (PMR) je klinický syndrom nemocných středního a vyššího věku, charakterizovaný především bolestivou ztuhlostí šíje, ramenního a pánevního pletence. U kavkazské populace Evropy a Severní Ameriky je to nejčastější zánětlivé onemocnění pohybového aparátu u osob nad 50 let, s vrcholem v osmém decenniu; ženy jsou postiženy zhruba třikrát častěji než muži. Z pohledu historické epidemiologie je pozoruhodné to, že prevalence PMR se ve značné míře kryje s geografickou expanzí Vikingů v druhé polovině prvního millenia našeho letopočtu (1). PMR byla prvně věrohodně popsána v roce 1888 praktickým lékařem Williamem Brucem v lázních Spa Strathpeffer pod názvem „senilní revmatická dna“ (2); termín PMR (3) navrhl Barber (1957). Rozhodující většina hlubších poznatků o PMR je ziskem klinického výzkumu z posledních 50 let. Význačným rysem tohoto období je úsilí o spolehlivé rozpoznávání PMR a včasná detekce nebezpečí spojených s jejím výskytem, průběhem a léčbou: v relativně krátkém časovém období (1979–1989) byla navržena čtveřice kritérií pro diagnózu PMR (4–7). V časovém odstupu (2005) byla z iniciativy EULAR ustanovena pracovní skupina pro komparativní posouzení jejich spolehlivosti (8): analýza dat 213 PMR nemocných z osmi revmatologických center osmi nestejných zemí Evropy vedla k doporučení používat kritéria podle Birda (4) nebo podle Hundera (6) s tím, že alternativní přístupy mají menší senzitivitu. Diferenciálně diagnostická náročnost PMR a technologický pokrok, zvl. v zobrazování změn v měkkých tkáních, byly v deceniu 2006–2015 podnětem pro zpracování dalších upřesňujících postupů v péči o PMR: k nejvýznamnějším patří doporučení BSP/BHPR 2010 (9), předběžná klasifikační kritéria pro PMR z iniciativy EULAR/ACR 2012 (10) a doporučení pro péči o PMR nemocné z iniciativy EULAR/ACR 2015 (11): představují „State-of-the-Art“ pro PMR a jsou těžištěm tohoto článku.
Aktuální klasifikační kritéria pro polymyalgia rheumatica EULAR/ACR 2012
Hodnotící systémy PMR z druhé poloviny 20. století byly deklarovány jako diagnostické. Předběžný hodnotící systém PMR podle EULAR/ACR 2012 (10) je klasifikací, která odpovídá konceptu klasifikačních kritérií ACR (12) jako standardizované definice u nemocí bez „zlatého standardu“, s relativní homogenizací skupiny, důrazem na vysokou specificitu a s akcentem univerzality. Primárně jde o přístup nezbytný pro klinické studie a bez předpokladu přímého vodítka pro start terapie, ovšem s dovětkem, že u řady nemocí jsou klasifikační a diagnostická kritéria velmi podobná. Kandidátní kohortou klasifikačních kritérií EULAR/ACR 2012 je šestiměsíční prospektivní studie 125 nemocných s primoatakou PMR a paralelně 169 nemocných mimo PMR, ale s mimikry tohoto syndromu. Východiskem pro hodnocení byla systematická analýza literatury, která vedla k vymezení 68 možných kritérií, z nichž bylo akceptováno 7 základních požadavků. Posuzování se zúčastnilo 111 revmatologů a 53 dalších specialistů ze Severní Ameriky a západní Evropy. Výsledkem je skórovací algoritmus (tab. 1 a 2, obr. 1–5) pro klasifikaci PMR u nemocných, kteří splnili tyto vstupní/předběžné podmínky: věk ≥ 50 let, oboustranná bolestivost ramen a zjištění abnormální hodnoty SE nebo CRP. Kohorta PMR se skóre ≥ 4 tak byla odlišena od kontrolní skupiny s mimikry PMR s 68% senzitivitou a 78% specificitou; pozitivní prediktivní hodnota byla 69 % a negativní prediktivní hodnota 77 %. US změny (obr. 1–5) samy o sobě nejsou specifické pro PMR, ale selektivně zvyšují specificitu systému.
1. Předběžná klasifikační kritéria EULAR/ACR (2012) pro PMR (10) 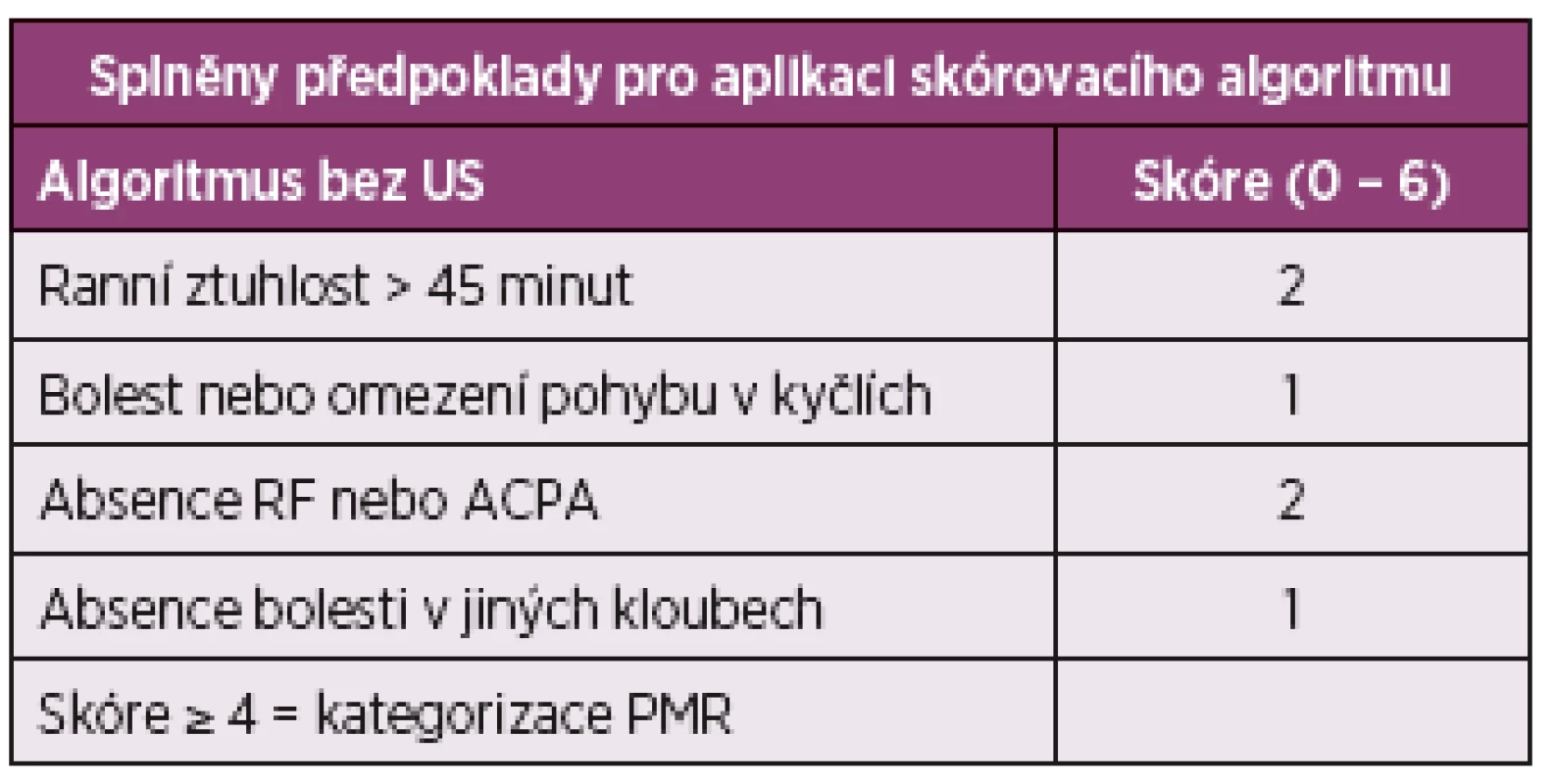
PMR: Polymyalgia rheumatica, US: Ultrasonografie, RF: Revmatoidní faktory, ACPA: Protilátky proti citrulinovaným peptidům 2. Předběžná klasifikační kritéria EULAR/ACR (2012) pro PMR (10) 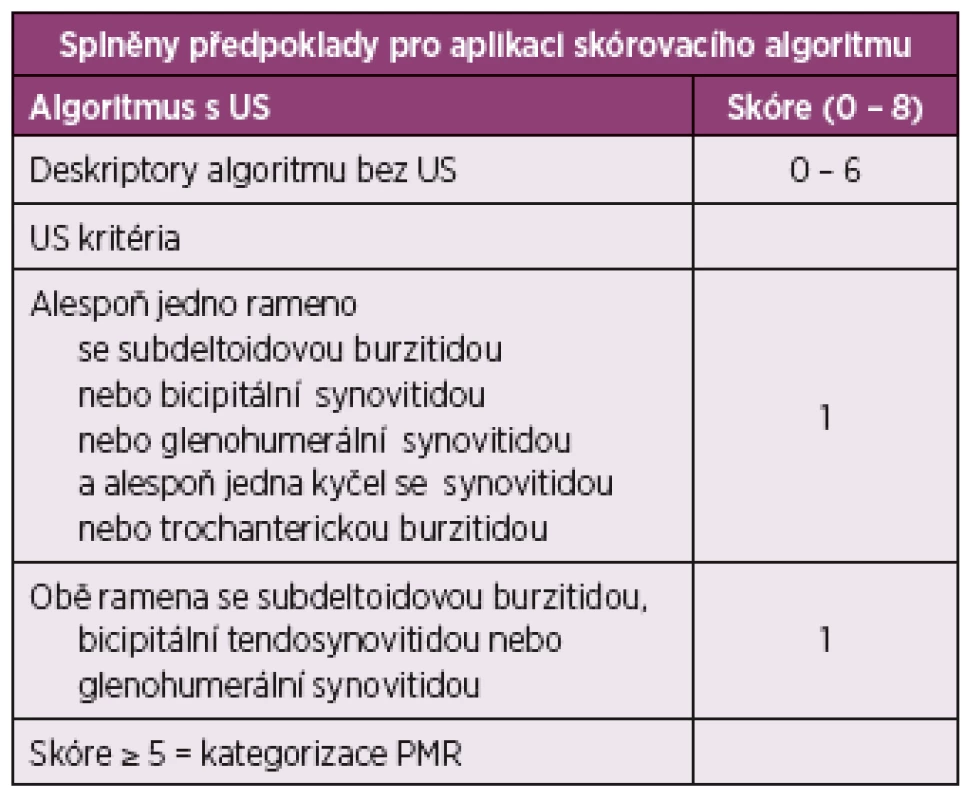
PMR: Polymyalgiea rheumatica, US: Ultrasonografie 1. Bicipitální tendosynovitida. 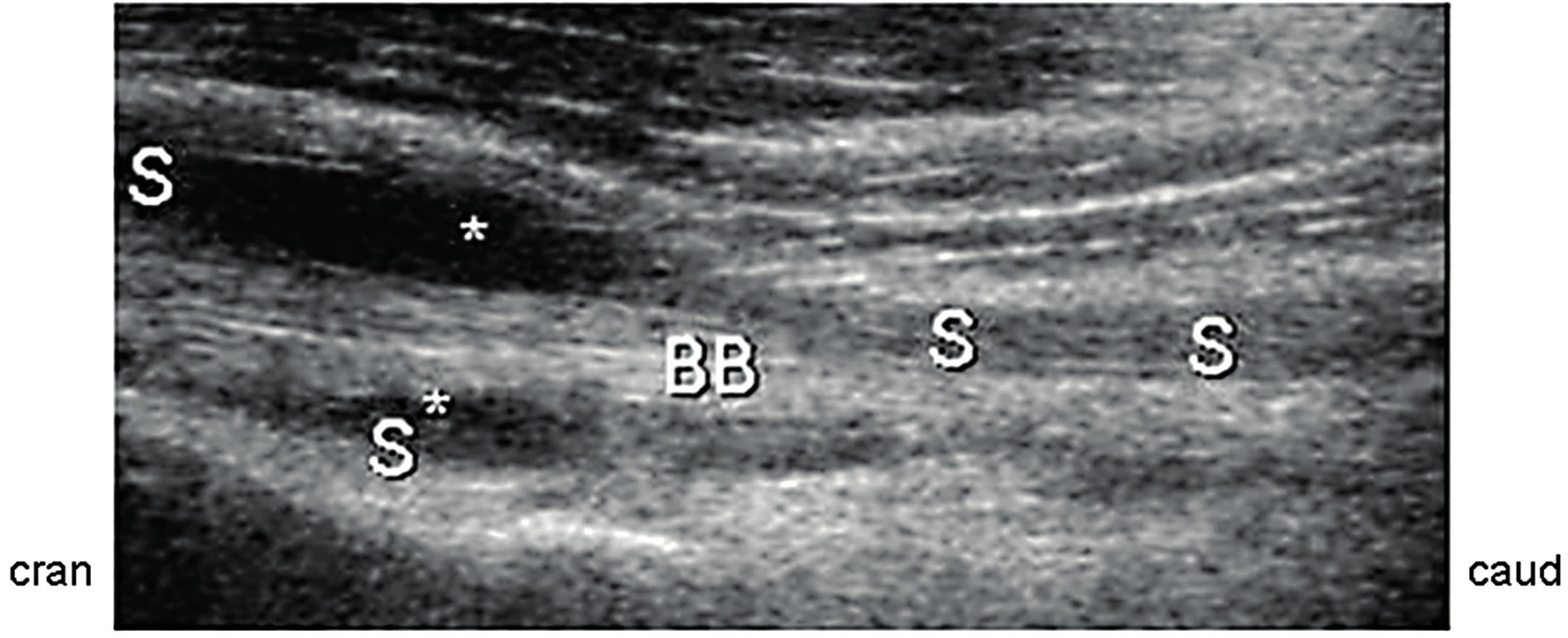
Sulcus bicipitalis longitudinálně: Tekutina (*) a incipientně zbytnělá synoviální výstelka (S) v recessu kloubního pouzdra s pokračováním kolem šlachy dlouhé hlavy m. biceps brachii (BB). 2. Subakromiální-subdeltoidová burzitida. 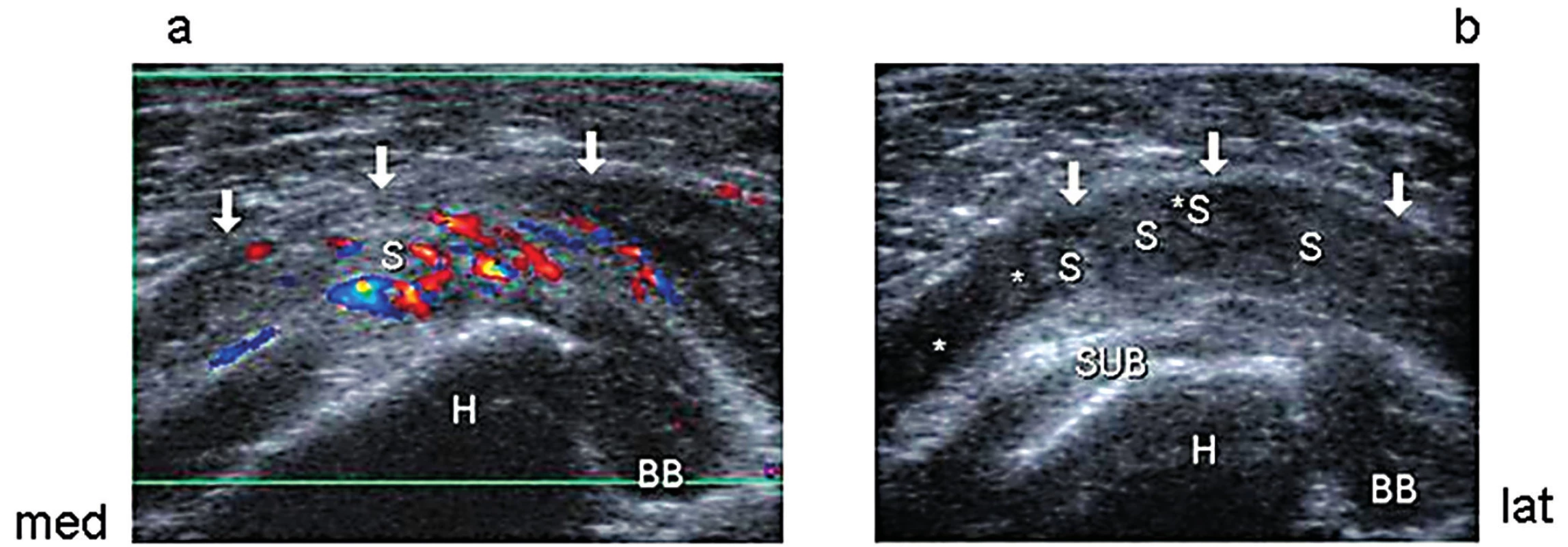
a, b (transverzálně): Hlavice humeru (H), šlacha dlouhé hlavy m. biceps brachii (BB), m. subscapularis (SUB), ventrální recessus burzy (↓), zbytnělá synoviální výstelka (S) a reziduální prostor burzy vyplněný tekutinou (*); a: hyperémie při barevné dopplerovské US. 3. Glenohumerální synovitida. 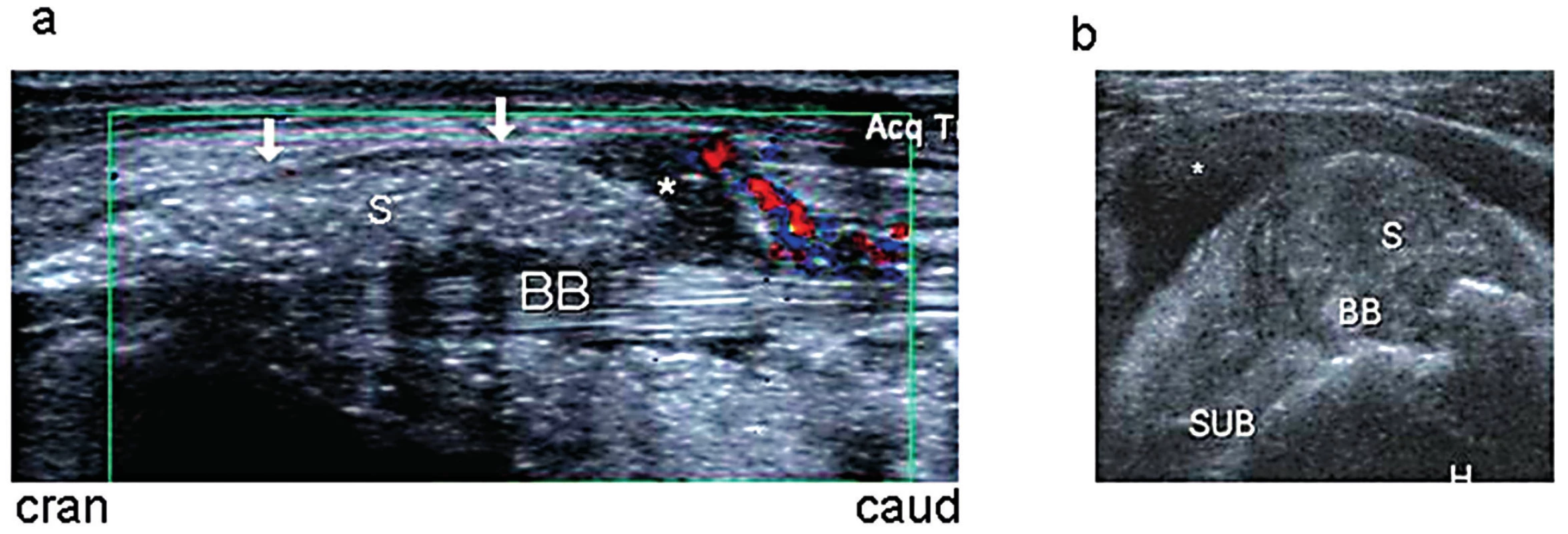
a (longitudinálně): Recessus kloubního pouzdra (↓), šlacha dlouhé hlavy m. biceps brachii (BB), zbytnělá synoviální výstelka (S), tekutina (*) a hyperémie kloubního pouzdra dle barevné dopplerovské US; b (transverzálně): šlacha dlouhé hlavy m. biceps brachii (BB), zbytnělá synoviální výstelka (S), m. subscapularis (SUB), tekutina (*). 4. Synovitida kyčelního kloubu. 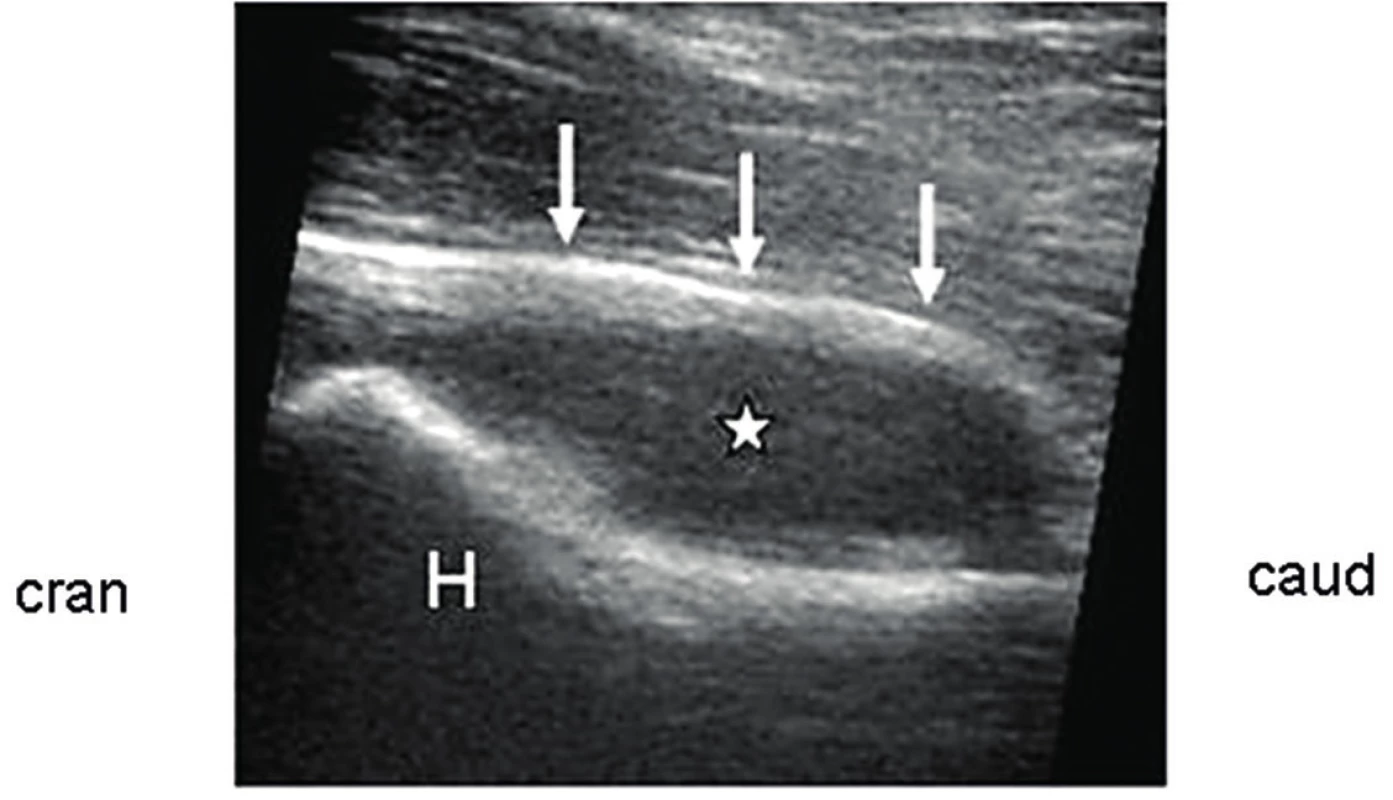
Šikmo parasagitálně: Hlavice femoru (H), recessus kloubního pouzdra na krčku femoru (↓), tekutina (*). 5. Trochanterická burzitida. 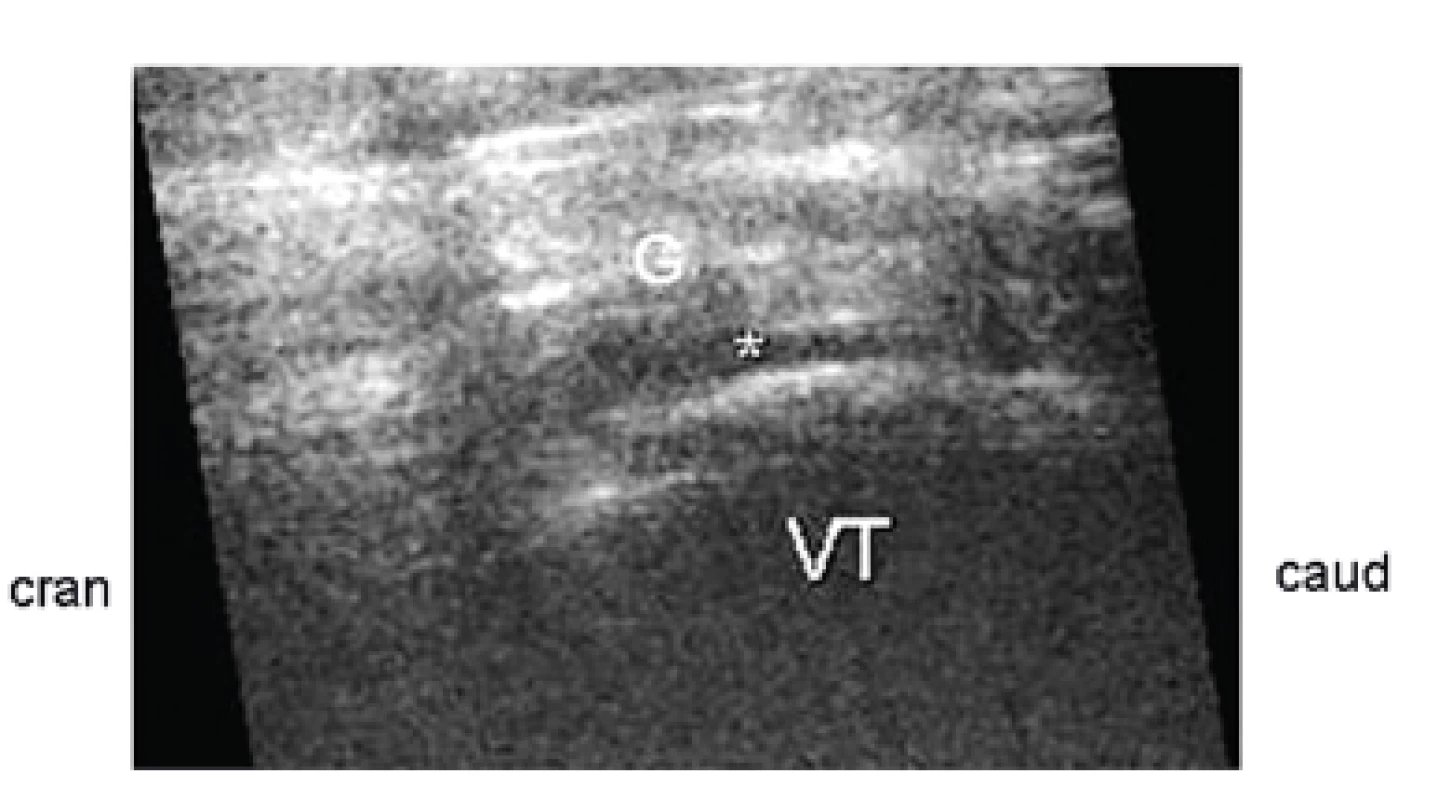
Longitudinálně z boku: Oblast velkého trochanteru (VT), úpony gluteálních svalů G), tenká vrstva tekutiny (*). Nejčastější US patologií je v daném kontextu tendosynovitida šlachy dlouhé hlavy m. biceps brachii; v téměř současně zveřejněné observační studii (13) bylo zjištěno, že její průkaz nemá vliv na senzitivitu deskriptorů PMR podle EULAR/ACR 2012. PMR má obsáhlou diferenciální diagnostiku, ve které představuje zejména pozdně začínající revmatoidní artritida (EORA) jedno z předních míst. V monocentrické observační studii (14) bylo zjištěno porovnáním 136 nemocných s nově zjištěnou diagnózou PMR a 149 kontrol vč. 94 s RA, že zařazení US zvyšuje specificitu skórovacího algoritmu klasifikačních kritérií EULAR/ACR 2012 oproti RA ze 79,7 % na 89,9 %. V této souvislosti je třeba dodat, že v komparativní observační studii PMR a EORA byly zjištěny protilátky proti citrulinovaným peptidům (ACPA) u 65 % EORA při nulovém záchytu u PMR (15): klinické projevy časné EORA a PMR přitom mohou mít velmi podobné mimikry a séropozitivita revmatoidních faktorů není spolehlivým diskriminátorem. V gerontologické populaci např. graduje prevalence abnormálního titru LFT; lze to považovat za jeden z projevů měnící se imunologické identity v průběhu stárnutí, což znesnadňuje klinickou interpretaci.
Koncept PMR podle klasifikačních kritérií EULAR/ACR 2012 zpochybnil paradigma o příznivé terapeutické odpovědi PMR na relativně malé denní dávky glukokortikoidů (GK); i typicky vyjádřený syndrom PMR může být provázen nedostatečnou odpovědí na glukokortikoidy. V celkovém hodnocení významu klasifikačního algoritmu EULAR/ACR 2012 nelze opomenout to, že sice není určen pro rutinní klinickou diagnostiku, ale jeho 81% spolehlivost převyšuje hodnotu 80 %, která je konvenčně považována za limitní pro klinické rozhodování.
Riziko obrovskobuněčné arteritidy (OBA) u polymyalgia rheumatica
Překryv PMR a OBA lze charakterizovat tak, že 18–26 % PMR pacientů má i projevy OBA a naopak 27 – 53 % pacientů s OBA má projevy PMR (16). Při pátrání po OBA u PMR je třeba se zaměřit na skutečnosti, které shrnuje doporučení BSR/PHPR (British Society for Rheumatology/British Health Professionals in Rheumatology) do šestibodového memoranda:
- bolest/ztuhlost kalvy, zvláště temporálně;
- poruchy vizu, zvláště diplopie;
- klaudikace žvýkacích svalů nebo jazyka;
- nález na spánkové tepně a změna jejího pulzu;
- parézy kraniálních nervů;
- klaudikace končetin a jiné změny na tepnách, včetně aorty (9).
Vztah PMR a OBA není obvyklou diferenciální diagnostikou, ale mnohdy především asymetrickou manifestací komplexu PMR-OBA/OBA-PMR s kategorickým imperativem pátrat po obou komponentách i při klinické manifestaci jedné z nich. Při manifestaci PMR je třeba pátrat po OBA nejen klinicky, ale současně i pomocnými metodami. Má to dva hlavní důvody: prvním je depistáž ischemické neuropatie optiku s rizikem náhlého oslepnutí, které je nezvratné, a druhým je skrytá aortitida s rizikem aortální inkompetence a výdutí, popř. stenóza renální arterie s renovaskulární hypertenzí. Metaanalýzou 41/114 studií (1966–2000), jež splnily inkluzní kritéria pro OBA, byly zjištěny vizuální symptomy u 2 083 vč. diplopie u 708 a ztráty zraku u 341 nemocných (17). Vstupním krokem k depistáži je vyšetření oftalmologem vč. fundoskopie sítnice, podle potřeby s doplněním o fluorescenční angiografii. K postižení vizu může vzácně dojít i při normálním nálezu na očním bulbu, pokud je příčinou mozková ischemie při postižení vertebrobazilárních arterií. Pozoruhodným upozorněním je nižší frekvence závažných ischemických projevů OBA tam, kde je provázena febrilním stavem (18–20).
Riziko časné onkogenity u polymyalgia rheumatica
Prevalence PMR i maligních nádorů se vyznačuje regionální geografickou a etnickou variabilitou: na onkogenní riziko u PMR upozorňují hlavně početná kazuistická pozorování. Pro přesnější posouzení tohoto vztahu v Evropě jsou tč. k dispozici dvě široce založené studie: údaje z GPRD (General Practice Research Database) britských praktických lékařů a data ze švédského nemocničního registru (21, 22). Na základě údajů v GPRD databázi (1987–1999) bylo provedeno porovnání 2 877 PMR bez pre-existujícího karcinomu s 9 942 pacienty bez PMR: zvýšené riziko karcinomu u PMR bylo zjištěno pouze v prvních šesti měsících od stanovení diagnózy s HR (95 % CI): 1,69 (1,18–2,42). V letech 1965–2006 bylo ve Švédsku hospitalizováno s diagnózou PMR 35 918 nemocných: u 3 941 z nich byl následně prokázán karcinom při celkovém ukazateli rizika SIR (Standardized Incidence Ratios) 1,19 s tím, že při diagnóze nádoru po dvanáctiměsíčním odstupu byla hodnota SIR pouze 1,06.
Péče o polymyalgia rheumatica podle doporučení EULAR/ACR 2015
Léčebná strategie EULAR/ACR 2015 (11) navazuje na klasifikační systém EULAR/ACR 2012 (10) s důrazem na skutečnost, že nedostatečná responzivita na vstupní terapii GK byla zjištěna u 29–45 % PMR; předpokládá se, že mezinárodně kodifikovaná doporučení pomohou nejen standardizovat, ale také zlepšit péči zejména o tyto nemocné. Souhrnné memorandum je výčtem opatření, která je třeba respektovat před startem terapie a souborem požadavků na start a průběh komplexní terapie. Vstupní kroky zahrnují vedle požadavku bezpečné diagnózy eliminací široké škály symptomů s mimikry PMR, rozsah laboratorního standardu (SE, CRP, krevní obraz, standardní biochemie, revmatoidní faktory, ACPA, kostní profil, výběrově ANA, ANCA, aj.) a determinaci komorbidit, hlavně takových, co mají vztah k toleranci/rizikovosti GK; cíleně je zdůrazněna rizikovost prolongované GK terapie u žen. Speciální pozornost je třeba věnovat atypiím u PMR (věk < 60 let, systémová symptomatologie, periferní artritida), protože jsou více spjaty s rizikem nedostatečné responzivity a s větším nebezpečím toxicity při GK terapii. Předpokladem zásadního významu pro zajištění setrvalé adherence nemocných k terapii je kvalitní edukace nejenom vstupně, ale s opakovanou reedukací v průběhu terapie jak lékařem, tak zdravotnickými pracovníky; kontrolou efektivnosti edukace je to, že pacient získal schopnost klást otázky (23).
Po splnění podmínek přípravné fáze a bezpečném vyloučení komplexu PMR-OBA je indikován start vstupní dávkou Prednisonu 12,5–25 mg podle algoritmu EULAR/ACR 2015 (11) (obr. 6), a to v jedné denní dávce s individuálními diferencemi podle předvídatelného rizika, ale rozhodně ne méně jak 7,5 mg nebo více než 30 mg denně. V rozmezí 4–8 týdnů lze následně denní dávku GK postupně snižovat na hodnotu 10 mg Prednisonu nebo jeho ekvivalentu, při relapsu s návratem na původní vstupní dávku. Alternativou p. o. terapie může být metylprednisolon i. m. v třítýdenních intervalech, v týdnech 0–9 v dávce 120 mg a následně v režimu postupného snižování podle doporučeného protokolu (11). Při vysokém riziku relapsu nebo toxicity prolongované terapie (např. u nemocných s cukrovkou) je doporučován včasný start MTX v týdenní dávce 7,5–10 mg. Zařazení TNF inhibitorů je zamítáno s odkazem na rizika uváděná v doporučení EULAR 2013 (21) o bezpečnosti chorobu modifikující léčby u RA, hodnocení dalších biologik odloženo pro absenci validních podkladů a používání čínských herbálních přípravků (Yanche a Biqi) je zamítnuto. U starších pacientů je neoddělitelnou složkou komplexního léčebného režimu úsilí udržet je v dobré pohybové kondici formou individuálně sestavených rehabilitačních programů.
Při nedostatečné responzivitě PMR na standard léčebného protokolu je třeba znovu posoudit optimální způsob aplikace u konkrétního pacienta, jeho adherenci k terapii a v neposlední řadě prověřit věrohodnost diagnózy. Hallemann (25) např. doporučuje v Kelleyho referenční učebnici revmatologie (2013) zvýšit Prednison na 30 mg denně, a pokud nedojde do 7 dnů k očekávané odpovědi, tak revidovat diagnózu. Léčebný protokol pro PMR je kontraindikován u komplexu PMR-OBA, kdy je třeba léčit podle protokolu pro OBA, jak to jednoznačně indikují doporučení BSR/BHPR 2010 (9).
Terapii mimo doporučené postupy je nutno považovat za personalizovaný – v podstatě experimentální – přístup tam, kde jde o nedostatečnou responzivitu u repetitivně ověřené správnosti diagnózy PMR nebo – a častěji – intoleranci u polymorbidních pacientů. V této situaci jsou lékem volby biologika ze skupiny anti-TNF alfa nebo proti receptoru IL-6 (26-28).
Hodnocení remise a rizika relapsu u polymyalgia rheumatica
Pro numerické vyjádření remise je u PMR už přes 10 let k dispozici skórovací systém podle Leeba a Birda (29), založený na pěti deskriptorech (tab. 3). Výpočet skóre celkové aktivity PMR (PMR-AS) je dán součtem dílčích hodnot a umožňuje srovnatelným způsobem sledovat dynamiku aktivity PMR v čase, hodnotit responzivitu i riziko hrozícího relapsu: PMR-AS < 7 svědčí pro nízkou, 7–4 pro střední a > 14 pro vysokou aktivitu nemoci. Skórovací systém PMR-AS byl recentně rozsáhle přezkoumán na principech Delphské analýzy (30): výsledkem je konstatování, že uvedené deskriptory jsou významné pro průběžné sledování PMR s tím, že byly rozšířeny o symptomy z oblasti kyčlí. V této modifikaci svědčí PMR-AS skóre 0–1,5 pro remisi a > 6,6 pro relaps s poukazem na skutečnost, že dynamika časové řady má větší vypovídací hodnotu, než jednorázová hodnota. Pro posouzení rizika relapsu jsou cenná data z longitudinálních observačních studií, zacílených na reaktanty akutní fáze. Např. v kohortě 94 PMR byl sledován klinický průběh, sedimentace, CRP a IL-6 po dobu 12 měsíců (31): jednorázový relaps byl zjištěn u 47 nemocných (50 %) a dvoj - nebo vícenásobný u 24 (25,5 %). Pozoruhodnou skutečností v této souvislosti byla perzistence zvýšené hodnoty CRP a IL-6 i tam, kde sedimentace už byla v rozmezí normálu, tedy s obráceným protnutím křivek CRP a sedimentace, než je to obvyklé při tomto laboratorním sledování ústupu aktivity u zánětlivých onemocnění.
3. Skóre aktivity polymyalgia rheumatica (PMR-AS) podle Leeba a Birda (28). 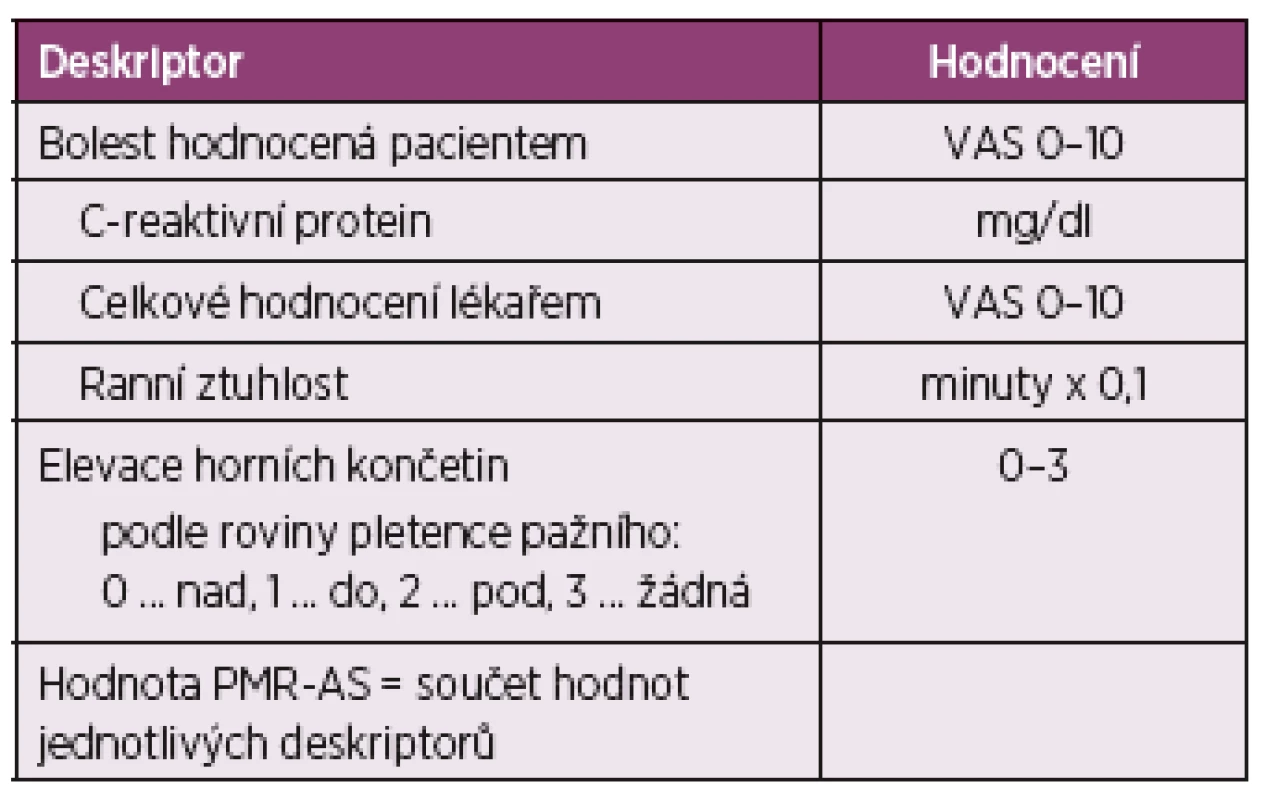
Riziko glukokortikoidy indukované osteoporózy u polymyalgia rheumatica
Dlouhodobá expozice GK je vždy spjata s rizikem osteoporózy. V předpokladech celkové doby trvání GK terapie se v doporučeních EULAR/ACR 2015 (11) zdůrazňuje individuální přístup s tím, že je třeba počítat nejméně s dobou 12 měsíců a navíc s poukazem, že bližší časová specifikace není tč. možná pro absenci studií cílených na tento problém. Uvedený přístup samozřejmě nevylučuje individuálně opodstatněný protokol 2–5leté terapie, jako např. tam, kde nebylo možno využít začlenění MTX. Podnětem pro včasné rozšíření léčebného protokolu o MTX jsou nejenom důvody zmiňované v algoritmu farmakoterapie PMR (obr. 6), ale nepřímo i doklady o osteoprotektivním potenciálu MTX u časné RA, jak to bylo doloženo např. ve dvojslepé RKS pro Prednison v denní dávce 10 mg (32). Nehledě na tyto okolnosti představuje osteoporóza hlavní plíživé riziko dlouhodobé GK terapie a je imperativem profylaktického podávání vápníku a vitaminu D: v doporučeních ACR/2010 (33) to je 1200–1500 mg kalcia a 800–1000 IU vitaminu D denně.
6. Algoritmus terapie PMR podle doporučení EULAR/ACR 2015 (11). 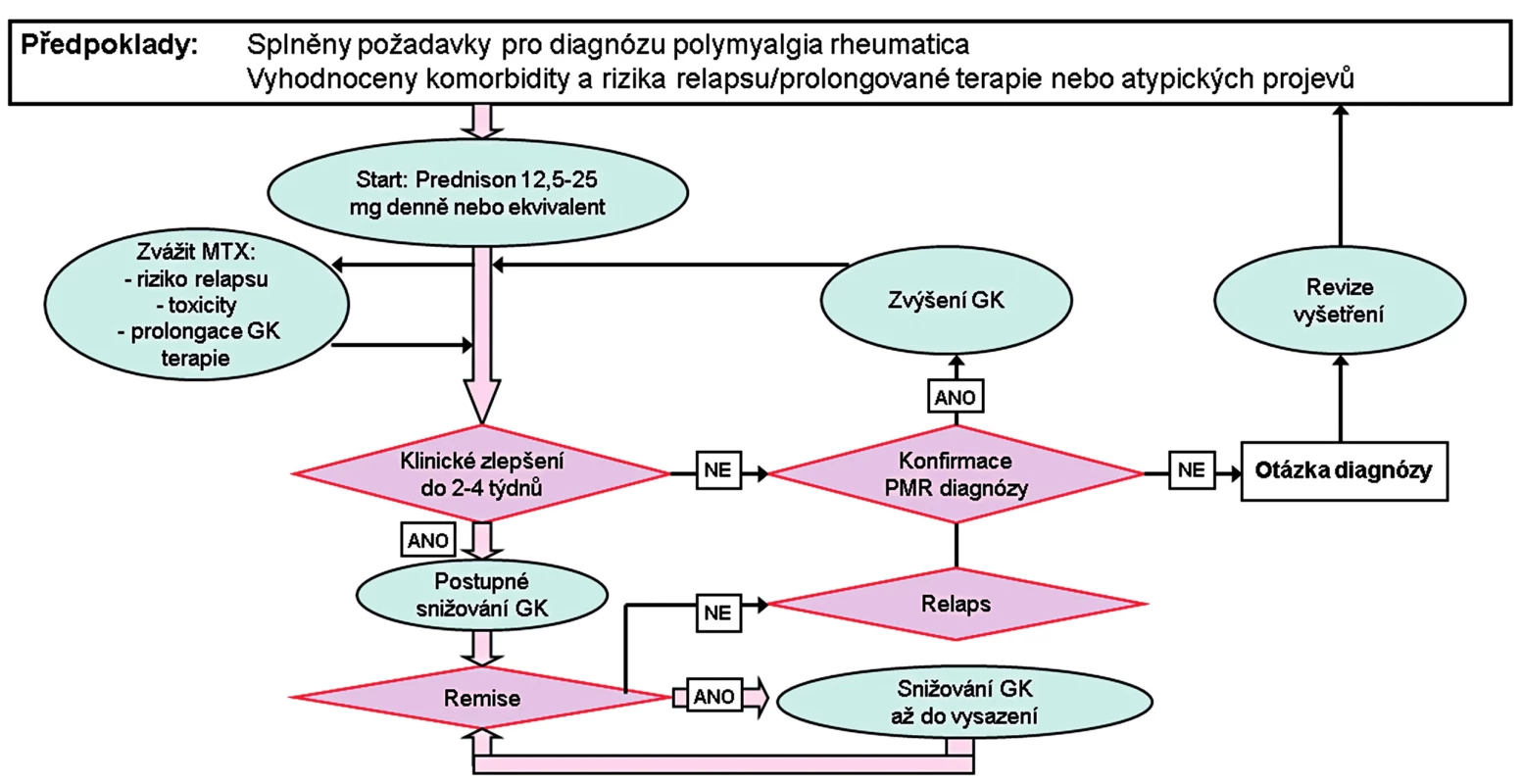
Závěr
PMR je předmětem racionálních analýz teprve něco přes 50 let. Za tuto historicky krátkou dobu se ukázalo, že u kavkazského etnika Evropy a Severní Ameriky jde o nejčastější zánětlivé revmatické onemocnění u osob nad 50 let. Naléhavost pohotové a současně věrohodné diagnózy, včasného rozpoznávání prognostických nástrah a optimalizace dlouhodobé, a tím i rizikové farmakoterapie byla recentně reflektována iniciativní multicentrickou součinností EULAR a ACR. Umožnilo to vypracování normativů pro klasifikaci PMR, které splňují i požadavky na klinické rozhodování a doporučení pro terapii a akcentem na individuální přístup a variantní možnosti tak, aby cíle, tj. úspěšného a bezpečného vyléčení, bylo dosaženo v optimální možné míře. Stěžejním motivem tohoto příspěvku bylo usnadnit přehledným způsobem inkorporaci těchto skutečností do běžné revmatologické praxe.
Poděkování: Podpořeno výzkumným projektem Univerzity Karlovy PRVOUK P37-08.
Adresa pro korespondenci:
Prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní gastroenterologická klinika
Lékařské fakulty UK a Fakultní nemocnice,
500 05 Hradec Králové
email: zbynek.hrncir@fnhk.cz
Sources
1. Rooney PJ, Rooney J, Balint G, Balint P. Polymyalgia rheumatica: 25 years of epidemiological progress? Scotish Med J 2015; 60 : 50–7.
2. Bruce W. Senile rheumatic gout. Brit Med J 1888; 2 : 811–3.
3. Barber HS. Myalgic syndrome with constitutional effects. Polymyalgia rheumatica. Ann Rheum Dis 1957;16 : 230-7.
4. Bird HA, Esselinckx W, Dixon AStJ, Mawat AG, Wood PHN. An evaluation of criteria for polymyalgia rheumatica. Ann Rheum Dis 1979; 38 : 434–9.
5. Jones JG, Hazleman BL. Prognosis and management of polymyalgia rheumatica. Ann Rheum Dis 1981;40 : 1-5.
6. Chuang TY, Hunder GG, Ilstrup DM, Kurland LT. Polymyalgia rheumatica: a 10-year epidemiologic and clinical study. Ann Intern Med 1982; 97 : 672–80.
7. Nabunaga M, Yashioka K, Yasuada M, Shingu M. Clinical studies of polymyalgia rheumatica: a proposal diagnostic criteria. Jap J Med 1989; 28 : 452–6.
8. Bird HA, Leeb BF, Montecucco CM, Misiuniene N, Nesher G, Pai S, et al. A comparison of the sensitivity of diagnostic criteria for polymyalgia rheumatica. Ann Rheum Dis 2005; 64 : 626–9.
9. Dasgupta B, Borg FA, Hassan N, Barraclough K, Bourke B, Fulcher J, et al. BSR and BHPR guidelines for the management of polymyalgia rheumatica. Rheumatology 2010; 49 : 186–90.
10. Dasgupta B, Cimmino MA, Kremers HM, Schmidt WA, Schirmer M, Salvarani C, et al. 2012 provisional classification criteria for polymyalgia rheumatica. Arthritis Rheum 2012; 64 : 943–54.
11. Dejaco Ch, Singh YP, Perel P, Hutchings A, Camellino D, Mackie S, et al. 2015 recommendation for the management of polymyalgia rheumatica. Arthritis Rheum 2015; 67 : 2569–80.
12. Aggarwal R, Ringold S, Khanna D, Neogi T, Johnson SR, Miller A, et al. Distinctions between diagnostic and classification criteria? Arthritis Care Res 2015; 67 : 891–7.
13. Weigand S, Ehrenstein B, Fleck M, Hartung W. Joint involvement in patients with early polymyalgia rheumatica using high-resolution ultrasound and its contribution to the EULAR/ACR 2012 classification criteria for polymylagia rheumatica. J Rheumatol 2014;41 : 730–34.
14. Macchioni P, Boiardi L, Catanoso M, Pazzola G, Salvarani C. Performance of the new 2012 EULAR/ACR classification criteria for polymyalgia rheumatica: comparison with the previous criteria in a single-centre study. Ann Rheum Dis 2014; 73 : 1190–3.
15. Lopez-Hoyos M, Ruiz de Alegria C, Blanco R, Crespo J, Peňa M, Rodrigez-Valverde V, et al. Clinical utility of anti-CCP antibodies in the differential diagnosis of elderly-onset rheumatoid arthritis and polymyalgia rheumatica. Rheumatology 2004; 43 : 655–7.
16. Caylor TL, Perkins A. Recognition and management of polymyalgia rheumatica and giant cell arteritis. Am Fam Physician 2013; 88 : 676–684.
17. Smetana GW, Shmerling RH. Does this patient have temporal arteritis? JAMA 2002; 287 : 92–101.
18. Warrington KJ, Weyand CM. Giant cell arteritis and polymyalgia rheumatica. In: Ball GV, Fessler FJ, Bridges SL Jr (eds) Oxford Textbook of Vasculitis. 3rd ed. Oxford: Oxford University Press; 2014, p. 307–18.
19. Gonzales-Gay MA, Carcia-Porrua C, Amor-Dorado JC. Llorca J. Fever in biopsy-proven giant cell arteritis: clinical implication in a defined population. Arthritis Care Res 2004; 51 : 652–5.
20. Rencová E, Hrnčíř Zb, Rozsíval P. Oční projevy u revmatických chorob. In: Rozsíval P (editor) Trendy soudobé oftalmologie. 1st ed. Praha: Galén; 2006, p. 135–82.
21. Muller S, Hider SL, Belcher J, Helliwell T, Mallen ChD. Is cancer associated with polymyalgia rheumatica? A cohort study in the General Practice Research Database. Ann Rheum Dis 2014; 73 : 1769–73.
22. Jinguang J, Xiangdong L, Sundquist K, Sundquist J, Hemminki K. Cancer risk in patients hospitalized with polymyalgia rheumatica and giant cell arteritis: a follow-up study in Sweden. Rheumatology 2010; 49 : 1158–63.
23. Witlock M, Hollywood J. Treatment guidelines for polymyalgia rheumatica: the nursing perspective. Rheumatology 2014; 53 (Suppl 2): 10.
24. Ramiro S, Gaujoux-Viala C, Nam JL, Smolen JS, Buch M, Gossec L, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 529–35.
25. Hellmann DB. Giant cell arteritis, polymyalgia rheumatica, and Takayasu´s arteritis. In: Firestein GS, Budd RC, Gabriel SE, McInnes IB, O´Dell JR. (eds) Kelley´s Textbook of Rheumatology. 9th ed. Philadelphia: Elsevier; 2013, p. 1461–80.
26. Aikawa NE, Pereira RMR, Lage L, Bonfá E, Carvalho JF. Anti-THF therapy for polymyalgia rheumatica: report of 99 cases and review of the literature. Clin Rheumatol 2012; 31 : 575–79.
27. Rashidi A, Hegazi MO, Mohammad SA, Varghese A. Effective control of polymyalgia rheumatica with tocilizumab. J Clin Rheumatol 2013; 19 : 400–1.
28. Unizony S, Arias-Urdaneta L, Miroslavsky E, Arvikar E, Khosroshahi A, Keroak B, et al. Tocilizumab for the treatment of large-vessel vasculitis (Giant cell arteritis, Takayasu arteritis) and polymyalgia rheumatica. Arthritis Care Res 2012; 64 : 1720–9.
29. Leeb BF, Bird HA. A disease aktivity score for polymyalgia rheumatica. Ann Rheum Dis 2004; 63 : 1279–83.
30. Dejaco Ch, Duftner Ch, Cimmino MA, Dasgupta B, Salvarani C, Crowson CS, et al. Definition of remission and relapse in polymyalgia rheumatica: data from a literature search compared with a Delphi-based expert consensus. Ann Rheum Dis 2011; 70 : 447–53.
31. Salvaranti C, Cantini F, Niccoli L, Machioni P, Consonni D, Bajocchi G, et al. Acute-phase reactants and the risk of relapse/recurence in polymyalgia rheumatica: a prospective follow up study. Arthritis Care Res 2005; 53 : 33–8.
32. van der Goes MC, Jacobs JWG, Jurgens MS, Bakker MF, van der Veen, van der Werf et al. Are changes in bone mineral density different between groups of early rheumatoid arthritis patients treated according to a tight control strategy with or without prednisone of osteoporosis prophylaxis in applied? Osteoporos Int 2013; 24 : 1429–36.
33. Grossman JM, Gordon R, Ranganath VK, Deal C, Caplan L, Chen W et al.: „American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis“. Arthritis Care Res 2010; 62 : 1515–26.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2016 Issue 2
Most read in this issue- Severe case of Crohn’s disease with extraintestinal joint manifestation and psoriasis
- Recent normative systems and risk factors in polymyalgia rheumatica
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

