-
Medical journals
- Career
Osteonekróza asociovaná se systémovou kortikoterapií
Authors: S. Skácelová; K. Jarošová; J. Vencovský; J. Gatterová; H. Vondřichová 1; H. Štěňhová 1
Authors‘ workplace: Revmatologický ústav, Praha ; DC Mediscan, Praha 1
Published in: Čes. Revmatol., 15, 2007, No. 2, p. 112-120.
Category: Case Report
Overview
Avaskulární osteonekróza je závažným onemocněním převážně středního věku. Je definována jako odumření buněk kosti a kostní dřeně s následným kolapsem kosti. V pozadí tohoto procesu stojí porucha krevního zásobení subchondrální kosti. V klinické praxi je rozvoj netraumatické osteonekrózy asociován s celou řadou stavů, mezi něž patří také systémové podávání glukokortikoidů. Patogeneze kortikoidy navozené osteonekrózy zatím není zcela objasněna. Na základě experimentálních výsledků se zdá, že významnou roli hrají změny lipidového metabolismu, alterace hemokoagulačních, fibrinolytických a mikrocirkulačních poměrů či přímé ovlivnění buněk kosti. Podkladem změn je nespíše ovlivnění genové transkripce kortikoidy na lokální úrovni. Jednoznačná kauzalita mezi podáním kortikoidu a následnou osteonekrózou v humánní medicíně zatím prokázána nebyla a ani být nemohla. Důvodem je fakt, že samotná onemocnění, pro která jsou glukokortikoidy podávány, mohou být predispozicí k osteonekróze. Asociace mezi podáváním steroidů a výskytem osteonekrózy je však vysoká, a to zejména v případě mnohočetné osteonekrózy (až 91 %). Osteonekrózou jsou více ohroženi ti nemocní, kteří jsou léčeni intravenózními pulzy metylprednisolonu a kterým je na počátku léčby podávána vysoká iniciální denní dávka perorálního kortikoidu. Výše kumulativní nebo průměrné denní udržovací dávky hraje pravděpodobně menší roli. Osteonekróza je postupný proces, který se rozvíjí několik měsíců až let asymptomaticky. Díky moderním zobrazovacím metodám (magnetická rezonance) lze časná stadia osteonekrózy diagnostikovat již za dva až tři měsíce po začátku expozice kortikoidům. V počátečních fázích nekrotického procesu probíhají reparativní děje a proces může být reverzibilní. Pokud stav progreduje, dochází postupně ke kolapsu kosti a proces se stává nevratným. Pro další prognózu je tedy stěžejní detekovat onemocnění v časném, reparabilním, většinou asymptomatickém stadiu. Vzácnějším, ale svou závažností významným fenomenem je multifokální osteonekróza, které autoři věnují zvláštní pozornost. Celá problematika mnohočetné a s glukokortikoidy asociované osteonekrózy je pak dokumentována dvěma kazuistikami.
Klíčová slova:
osteonekróza, glukokortikoidy, mnohočetná osteonekrózaÚVOD
Avaskulární osteonekróza je progresivní proces vedoucí k odumření buněk kosti a kostní dřeně s následným kolapsem kosti. Je způsobena nedostatečným krevním zásobením subchondrálních okrsků kosti. Ischemii předcházejí složité patofyziologické děje, jejichž role v patogenezi není zatím zcela objasněna. Patří mezi ně např. mechanické poškození cévní stěny, zvýšení intraoseálního tlaku, cévní okluze při tromboembolismu – nejčastěji na podkladě tukových embolů či patologické intravaskulární koagulace.
Osteonekróza je závažným onemocněním převážně středního věku. Uvádí se, že nekróza hlavice femuru nejčastěji postihuje nemocné ve 3.–5. životní dekádě (1). V pokročilých stadiích je spojena s těžkou sekundární artrózou vyžadující chirurgické řešení, většinou implantaci kloubní náhrady. Obvykle bývá diagnostikována v oblasti hlavice stehenní kosti, kolenních kloubů (kondyly femuru, proximální tibie) či hlavice humeru. Vzácněji je lokalizována v oblasti hlezna a zápěstí, drobných kostí ruky a nohy, případně čelistních kostí. Postižení může být jednostranné nebo oboustranné, solitární nebo vícečetné. Nejběžnější příčinou osteonekrózy je trauma. S odumřením kostní tkáně bez předchozího traumatu je asociována řada stavů (viz tab. 1). V praxi bývá netraumatická osteonekróza většinou sdružena s léčbou glukokortikoidy, se systémovým lupus erythematodes, s alkoholismem, se stavy po orgánových transplantacích nebo s maligními chorobami. U části případů se nezdaří rizikový faktor identifikovat. Stav potom hodnotíme jako idiopatickou osteonekrózu (2).
Table 1. Stavy asociované s netraumatickou osteonekrózou. Upraveno podle Assouline-Dayan (2). 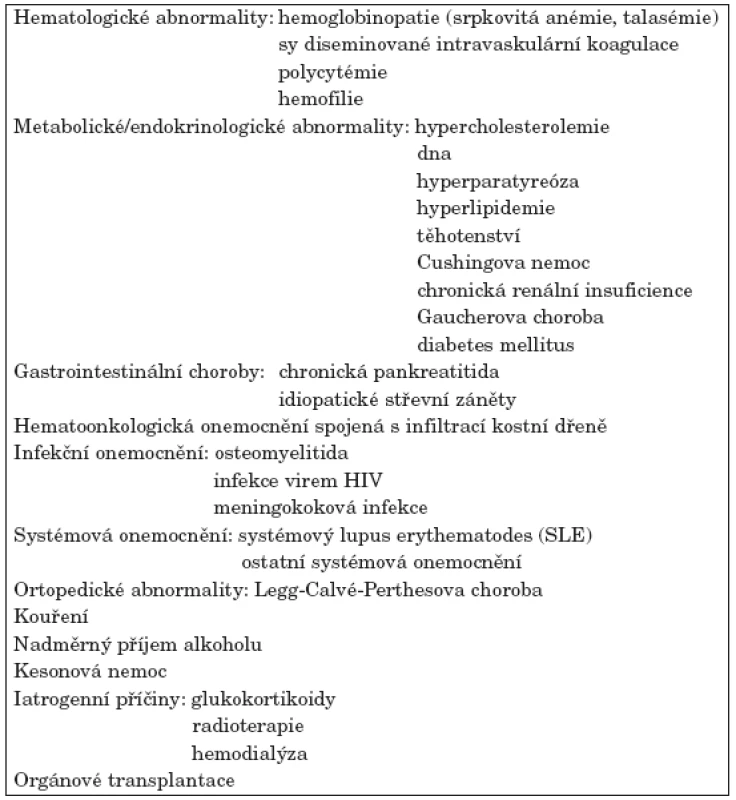
V léčbě systémových onemocnění jsou kortikoidy nezbytným lékem. Zároveň jsou považovány za jeden z nejvýznamnějších rizikových faktorů netraumatické osteonekrózy. V následujících řádcích je podán přehled současných znalostí o glukokortikoidy navozené osteonekróze. Zvláštní pozoronost je věnováná relativně vzácnému fenoménu multifokální osteonekrózy. Problematika je dokumentována dvěma případy z naší revmatologické praxe, kdy rozvoj mnohočetných osteonekróz s několikaletým odstupem po úspěšném zvládnutí aktivity systémového onemocnění komplikoval stav nemocných a snižoval kvalitu jejich života.
Osteonekróza asociovaná s léčbou glukokortikoidy
Osteonekróza (ON) je spolu s imunosupresí, myopatií a osteopenií považována za závažný vedlejší efekt masivní steroidní terapie. Incidence osteonekrózy po aplikaci kortikoidů se však liší u jednotlivých stavů či chorob. Zdá se tedy, že glukokortikoidy jsou spíše významným spouštěcím faktorem v celém patogenetickém řetězci dějů vedoucích k ON v predisponovaném terénu. Ve vysokém riziku jsou zejména ti nemocní, kteří jsou léčeni kortikoidy pro choroby či stavy predisponující k nekróze kosti, jako jsou např. systémový lupus erythematodes, maligní onemocnění nebo orgánové transplantace. Avšak případy rozvoje ON po steroidní terapii při současné absenci jiného rizikového faktoru byly také popsány (3, 4).
Vztah mezi aplikací kortikoidů a rozvojem ON byl v posledních letech studován na souborech pacientů se syndromem akutního respiračního selhání (SARS). Tito nemocní bývají v krátkém časovém úseku léčeni vysokými dávkami glukokortikoidů. Pomocí magnetické rezonance byl časný rozvoj osteonekrózy v oblasti kyčelních a kolenních kloubů detekován až u 10 % nemocných SARS. Výše kumulativní dávky kortikoidu (v ekvivalentech prednisonu) byla identifikována jako nejvýznamnější prediktor ON (5). Pulzní intravenózní aplikace metylprednisolonu byla ve srovnání s perorálním podáním prednisonu spojena s ON častěji (6). Probandy těchto studií byli spíše mladší jedinci, premorbidně zdraví, bez faktorů predisponujících k nekróze kosti. Avšak vzhledem k některým histopatologickým abnormalitám (známky intravaskulární koagulace v sekčních nálezech) nelze zcela vyloučit, že samotné onemocnění SARS je rizikovým faktorem osteonekrózy. Z tohoto pohledu jsou zajímavé výsledky práce, která se zabývala prevalencí ON u nemocných s roztroušenou sklerózou. Sclerosis multiplex není považována za chorobu zvyšující riziko ON. Prevalence ON hlavice femuru byla 15 % ve skupině léčené pulzy metylprednisolonu, zatímco v kontrolní steroidy neléčené skupině nebyl diagnostikován žádný případ nekrózy v této lokalizaci (7).
Stejné prediktory ON, tj. výše kumulativní dávky steroidu a pulzní intravenózní podání metylprednisolonu, byly identifikovány i dalšími autory (8).
Díky moderním zobrazovacím metodám (magnetická rezonance) lze diagnostikovat asymptomatickou osteonekrózu již v rozmezí dvou až tří měsíců po expozici kortikoidům (9). Dojde-li k progresi patologického procesu, pak se první typické symptomy projevují nejdříve za 6 měsíců, nejčastěji však s odstupem několika let po vystavení vysokým dávkám kortikoidů (10).
Možné patogenetické mechanismy glukokortikoidy indukované osteonekrózy
Glukokortikoidy mají široké spektrum účinků. Mimo jiné ovlivňují lipidový metabolismus, hemokoagulační pochody a poměry v mikrocirkulaci. Po podávání vysokých dávek steroidů stoupají plazmatické hladiny lipidů. Kortikoidy pravděpodobně interferují s koagulačním a fibrinolytickým systémem. Podle některých autorů jsou vysoké hladiny steroidů, ať už endogenního nebo exogenního původu, spojovány se zvýšeným rizikem tromboembolických komplikací (11, 12).
V klinické praxi je však obtížné odlišit míru uplatnění patofyziologických mechanismů onemocnění, pro něž jsou steroidy podávány, od vlivu steroidů samotných.
V experimentu in vitro na tkáňových kulturách kortikoidy zvyšovaly produkci některých hemostatických a trombolytických faktorů, např. von Willebrandova faktoru (vWF), endothelinu a inhibitoru aktivátoru plasminogenu typu 1 (PAI-1) (13). Brotman zkoumal vliv krátkodobého podávání dexametazonu na hemostázu a fibrinolýzu u souboru zdravých dobrovolníků a zaznamenal mírný vzestup plazmatické hladiny fibrinogenu a hemokoagulačního faktoru VII a VIII. Snížení fibrinolytické aktivity neprokázal (14). V roce 2005 uveřejnil Frank se spoluautory práci, ve které se zaměřil na vliv vysokých dávek kortikoidů na hemokoagulační a fibrinolytickou kaskádu u pacientů s roztroušenou sklerózou. Pacienti byli léčeni pulzy metylprednisolonu (500 mg metylprednisolonu intravenózně po 5 po sobě jdoucích dnech), následně perorálním prednisonem (1 mg/kg hmotnosti po dobu jednoho týdne s rychlou detrakcí v průběhu tří týdnů). Byl zaznamenán pokles hematokritu a plazmatických hladin fibrinogenu, daný však pravděpodobně spíše sníženou proteosyntézou než zvýšenou konsumpcí. Změnu markerů charakterizujících aktivaci nebo supresi koagulace či fibrinolýzy však nezjistil (15).
Pro patogenezi glukokortikoidy navozené osteonekrózy má pravděpodobně daleko větší význam změna lokálních poměrů v kostním mikroprostředí indukovaná kortikoidem než výše uvedené systémové změny. Výzkum lokálních změn v kostní tkáni a hemopoetické kostní dřeni po aplikaci steroidů se ubíral několika směry. V roce 1997 publikoval Yamamoto se spolupracovníky výsledky své práce, ve které studoval vliv pulzů metylprednisolonu na kostní tkáň a kostní dřeň v experimentu na zvířeti (japonský bílý králík). Podařilo se mu vytvořit model, který byl svým morfologickým charakterem velice podobný histopatologickým rysům osteonekrózy u člověka. Jednorázovou aplikací metylprednisolonu (v dávce 20 mg/kg) byl u pokusných zvířat navozen vzestup plazmatických hladin lipidů, pokles počtu trombocytů a pokles hladiny fibrinogenu v plazmě. Byla pozorována jaterní steatóza, na úrovni kostní tkáně pak tuková embolie. U 43 % zvířat se rozvinula multifokální osteonekróza. Překvapivě však nebyly nalezeny signifikantní rozdíly v plazmatických hladinách lipidů, fibrinogenu nebo v počtu trombocytů mezi skupinou zvířat s osteonekrózou a bez ní (16). Miyanishi a spolupracovníci na stejném zvířecím modelu podali důkazy o kortikoidy navozeném zvětšení tukových buněk kostní dřeně s následným vzestupem intraoseálního tlaku a poklesem krevního průtoku kostí u zvířat, které vyvinuly osteonekrózu (17). Přítomnost tukových embolů v kostních lézích, akumulaci lipidů v osteocytech, zvětšení adipocytů kostní dřeně a následné zvýšení intraoseálního tlaku prokázali i mnozí další autoři (18–22).
Jiná skupina výzkumníků pod vedením Wolfa Dreschera se zabývala vlivem metylprednisolonu na kontraktilitu cévní stěny tepen zásobujících hlavici femuru. V pokusném modelu na zvířeti (vepř) prokázali zvýšenou pohotovost cévní stěny k vazokonstrikci a následný pokles krevního průtoku hlavicí stehenní kosti po aplikaci metylprednisolonu. (23) V poslední době byla intenzivně studována role oxidativního stresu. Oxidativní poškození DNA buněk hemopoetické kostní dřeně bylo patrno již za 3–5 dní po aplikaci metylprednisolonu pokusnému zvířeti a předcházelo osteonekróze (24). K rozvoji osteonekrózy však nedošlo, byl-li zvířeti včas podán antioxidant (glutathion) (25). Kortikoidy pravděpodobně mají i přímý vliv na buněčné elementy kosti. Byla popsána zvýšená apoptóza osteoblastů a osteocytů, ale i osteoklastů po aplikaci steroidu (26).
Patogeneze kortikoidy navozené osteonekrózy je tedy složitý, dosud ne zcela objasněný proces. Dosavadní experimentální výsledky jsou jen střípky prozatím nesložené mozaiky. Napovídají, že důležitou roli zřejmě hrají změny lipidového metabolismu, hemokoagulačních, fibrinolytických a mikrocirkulačních poměrů, přímé ovlivnění buněk kosti a další mechanismy. Podkladem těchto změn je pravděpodobně ovlivnění genové transkripce kortikoidy, a to zejména na lokální úrovni (27).
Table 2. Klasifikace avaskulární osteonekrózy hlavice femuru (podle 39). 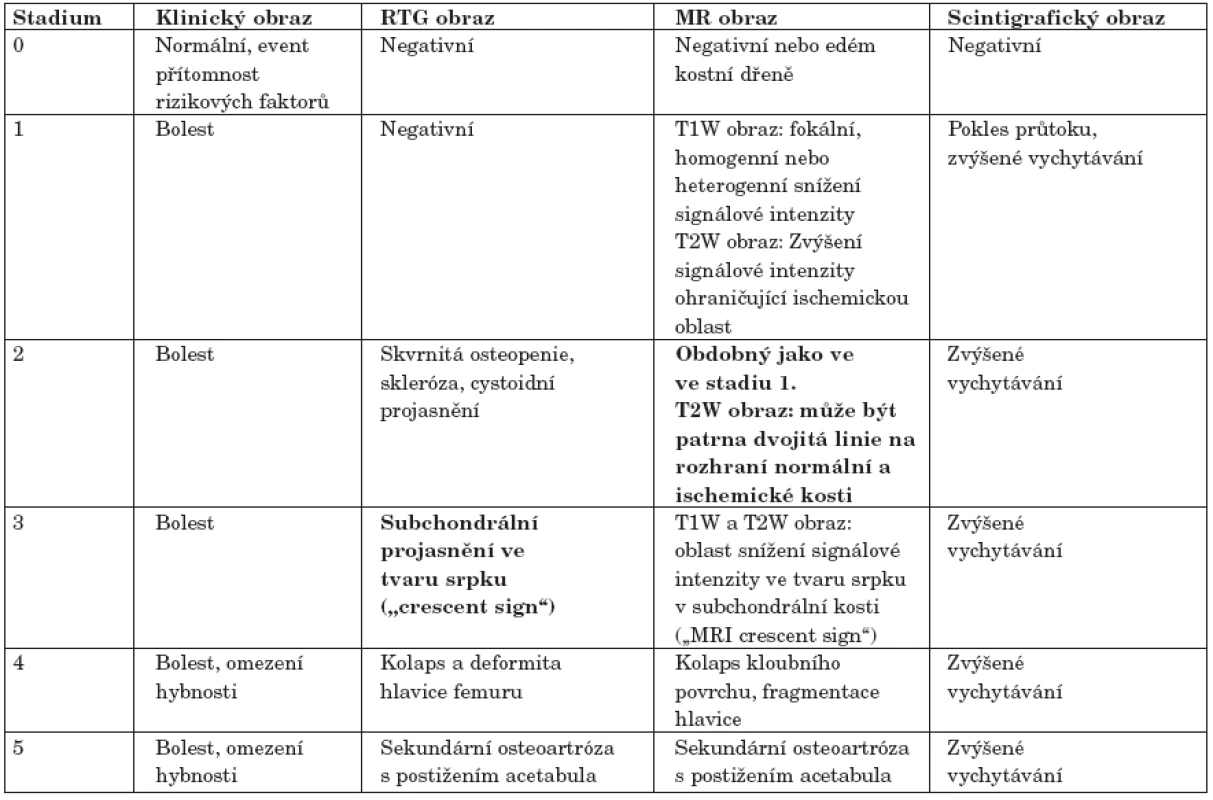
Zobrazením magnetickou rezonancí (MR) lze detekovat osteonekrózu v časných fázích jejího vývoje – MR obraz je senzitivní již ve stadiu 1. Na klasickém skiagrafickém snímku lze prokázat jednoznačné známky osteonekrózy až ve stadiu 3. Rozhraní mezi specifickým a nespecifickým obrazem v obou vyšetřovacích modalitách je v tabulce zvýrazněno tučným písmem. Výskyt a rizikové faktory osteonekrózy u systémových onemocnění
Asociace mezi užíváním kortikoidů a rozvojem osteonekrózy u pacientů se systémovým lupusem byla opakovaně potvrzena. Incidence symptomatické osteonekrózy hlavice femuru u nemocných systémovým lupus erythematodes (SLE) se uvádí mezi 4–15 %. Po zahrnutí asymptomatických lézí však počet případů vzroste až na 40 % (28).
Nekróza hlavice femuru se rozvíjí časně po nasazení steroidů. Vyšetření magnetickou rezonancí detekovalo známky asymptomatické ON hlavice femuru až u jedné třetiny pacientů již po 3 měsících od zahájení léčby vysokými dávkami kortikoidů (> 40 mg prednisonu denně). Při pulzním podávání methylprednisolonu (1 g/den po 3 dny) bylo riziko ON hlavice stehenní kosti signifikantně vyšší ve srovnání se samotnou perorální aplikací. Je zřejmé, že z hlediska následného rozvoje ON jsou rizikové hlavně vysoké iniciální dávky steroidů a zejména jejich pulzní podání po nástupu choroby. Výše průměrné denní či kumulativní dávky glukokortikoidu má pravděpodobně v patogeneze ON u SLE již menší význam (29–32).
Postižení bývá často mnohočetné. Nekrotické léze jsou nejčastěji lokalizovány v oblasti kyčelních kloubů, ramen a kolen (33).
Dalším důležitým rizikovým faktorem ON u SLE je cytotoxická terapie (cyklofosfamid, aza-thioprin). Někteří autoři uvádějí i další možné rizikové faktory: vaskulitidu, Raynaudův fenomén, přítomnost antifosfolipidových protilátek, artritidu a jiné (34, 35).
Ucelená epidemiologická data o výskytu osteonekrózy u jiných systémových zánětlivých onemocnění nejsou známa.
Table 3. ARCO mezinárodní klasifikace osteonekrózy (podle 41). 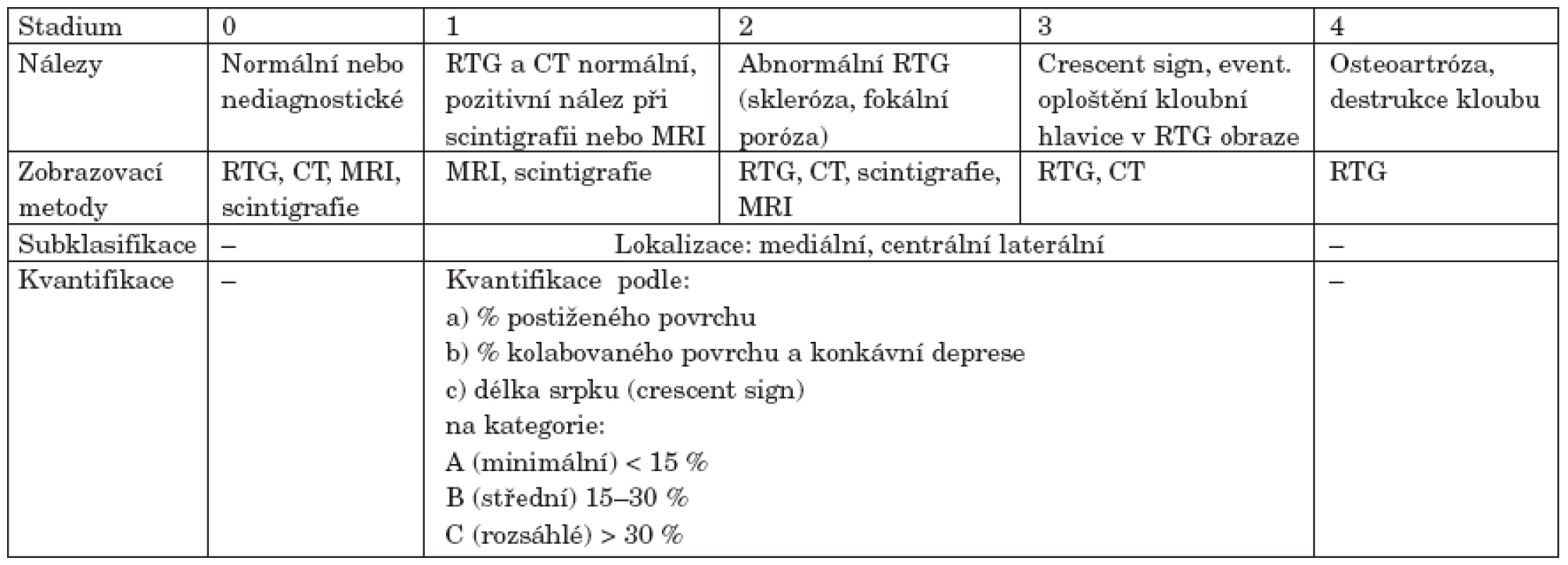
Klinický obraz, diagnostické metody a klasifikace osteonekrózy
Osteonekróza (ON) je postupný proces, který zpočátku probíhá asymptomaticky.
V pokročilých fázích je charakterizován trvalou bolestí postižené oblasti, zhoršující se při zátěži. Rozsah hybnosti nemocného kloubu bývá omezený. V iniciálních stadiích probíhají v kosti současně reparativní změny a může dojít ke spontánnímu vyhojení léze (36, 37). Při selhání reparativních dějů stav progreduje, dochází ke strukturální deterioraci a kolapsu kosti. Tento stav je již ireverzibilní.
Klasický rentgenový snímek je v diagnostice ON široce používaný. Specificita rentgenového vyšetření je vysoká, nezachytí však časné léze. První známkou nekrózy na prostém rentgenovém snímku je difuzní projasnění ve tvaru srpku (tzv. crescent sign), které je ohraničeno reaktivním sklerotickým lemem a odpovídá dekalcinaci ischemizované části kosti. Tento obraz již představuje subchondrální frakturu. V dalších stadiích má nekrotická část kosti typický trojúhelníkový tvar s bazí otočenou k obvodu hlavice. Hlavice kloubu se postupně oplošťuje, dochází k její fragmentaci a kolapsu, rozvíjí se sekundární artróza.
Scintigrafickým vyšetřením lze zachytit časná stadia ON s vysokou senzitivitou. Specificita kostní scintigrafie je však nižší a mohou nastat problémy v rozlišení osteonekrózy od fraktur, artrózy nebo jiných stavů. Tuto zobrazovací metodu lze s výhodou použít při detekci mnohočetné osteonekrózy (38).
Přelom v diagnostice ON znamenalo zavedení magnetické rezonance (MR), neboť přineslo možnost identifikovat časná stadia. Magnetická rezonance se pro svou vysokou senzitivitu, specificitu a možnost detekce raných stadií ON stala suverénním vyšetřením v této indikaci. MR zobrazování je citlivé ke změnám ve složení kostní dřeně. Difuzní edém hemopoetické kostní dřeně bývá první, i když nespecifickou známkou ON. Současná přítomnost subchondrálních či fokálních abnormalit je již pro ON specifická.
Jednotlivá stadia osteonekrózy jsou charakterizována klinickým obrazem a nálezem při zobrazovacích vyšetřeních. Zajímavé srovnání výtěžnosti všech tří zobrazovacích modalit (klasické skiagrafie, magnetické rezonance a scintigrafie) v jednotlivých stadiích ON hlavice femuru přináší tabulka 2 (39).
Klasifikačních systémů charakterizujících stupeň, pokročilost a rozsah nekrotických změn byla vyvinuta celá řada. Za nejdůležitější je považováno rozhraní mezi reparabilitou procesu a jeho nevratností. Mezi nejčastěji citované systémy patří klasifikace dle Ficat a Arlet, stagingový systém trojice autorů Marcus, Enneking a Massam, dále systém vyvinutý kolektivem autorů University of Pennsylvania či klasifikace vytvořené japonskými autory (Sugioka, Japanese Investigation Committee for Avascular Necrosis). Naléhavá potřeba jednotného, mezinárodně používaného stagingového systému vedla v devadesátých letech Association Research Circulation Osseous (ARCO) k vytvoření v současnosti nejpoužívanější klasifikace (viz tab. 3). Tato tzv. ARCO klasifikace spojuje výhody předchozích systémů. Je již založena na využití moderních zobrazovacích metod a lze jí využít i k lokalizaci a kvantifikaci postižení (40, 41).
Terapie osteonekrózy
Konzervativní léčba má naději na úspěch pouze v časných fázích onemocnění. Spočívá v odlehčení postiženého kloubu, analgetické medikaci, opatrné fyzioterapii a v minimalizaci působení ovlivnitelných rizikových faktorů, jako jsou hyperlipidemie, kouření, přísun alkoholu, obezita. Snížení dávek kortikoidů je vhodné, pokud to dovoluje aktivita základního onemocnění. V pokročilém stadiu zůstává jediným východiskem chirurgická léčba, u nás většinou aloplastika nebo artrodéza.
Mnohočetná osteonekróza
Multifokální osteonekróza je definována jako současné postižení ve třech a více anatomických lokalitách, ať už unilaterálně nebo bilaterálně. Za mnohočetnou osteonekrózu je tedy považováno např. onemocnění v oblasti kyčlí, kolen a ramen, nikoliv však už např. postižení dvou kyčelních a jednoho kolenního kloubu.
První velké studie zaměřené na problematiku mnohočetné osteonekrózy byly provedeny v USA koncem devadesátých let minulého století (42, 43). Incidence mnohočetného postižení se v souborech všech nemocných osteonekrózou pohybovala kolem 3 %. Na jednoho takového pacienta s multifokálním postižením pak v průměru připadalo přibližně šest kostních lézí. U všech nemocných byla diagnostikována nekróza hlavice femuru. Dalšími nejčastěji postiženými lokalitami byly distální femur (96 %), proximální humerus (80 %) a talus (44 %). Oboustranné onemocnění bylo běžné. U kyčelních kloubů bylo popisováno v 98 %, u kolen v 87 % a u ramen v 83 % případů. Z hlediska další terapie bylo významné, že většina (přibližně 69 %) nekrotických kloubů byla zastižena v časném, prekolapsovém stadiu. Až 91 % nemocných mělo v lékové anamnéze údaj o systémové kortikoterapii. Jiní autoři však nalezli mnohem nižší asociaci mezi užíváním kortikoidů a osteonekrózou (44–46). Nejběžnější kombinací rizikových faktorů byla systémová léčba steroidy a kuřáctví cigaret.
Většina kostních lézí se vyznačovala bezpříznakovým průběhem. V klinické praxi tedy vyvstává zajímavá otázka, v jakém rozsahu je účelné a ekonomické vyšetřovat u rizikových nemocných asymptomatické klouby. V případě osteonekrózy kyčle je při vysoké incidenci bilaterálního postižení doporučováno vyšetřit kontralaterální kloub vždy. Asociace mezi postižením kyčelního kloubu a multifokální osteonekrózou je pouze 3 %. Rutinní vyšetřování ostatních kloubů u nemocných trpících pouze nekrózou kyčle tedy není vhodné. Je-li však diagnostikována nekróza kolena, ramena, hlezna či jiného kloubu s výjimkou kyčle, pak je asi 50 % pravděpodobnost multifokálního postižení. S přihlédnutím k rizikovým faktorům, zejména užívání kortikoidů, kuřáctví nebo poruchám hemokoagulace je v takovém případě nutné zvážit i vyšetření asymptomatických kloubů, aby bylo možno včas zahájit léčebná opatření.
Popis případu 1
23letá žena, kuřačka, s osmiletou anamnézou juvenilní dermatomyozitidy, byla přijata k hospitalizaci pro bolesti a otok pravého kotníku. Rodinná anamnéza nemocné a předchorobí byly bez pozoruhodností. V úvodu systémového onemocnění dominovala svalová slabost a tvorba podkožních i svalových kalcifikací, byly přítomny systémové příznaky, polyartritida, dysfagie, raš a sicca syndrom. Nemocná byla léčena kombinovanou imunosupresí. Glukokortikoidy byly podávány perorálně (iniciální dávka 50 mg, udržovací dávka 10–15 mg ekvivalentu prednisonu denně) a v intravenózních pulzech (0,5–1 g metylprednisolonu ą 4 týdny, dle dostupné dokumentace minimálně po dobu dvou let). Z bazální terapie vystřídala metotrexát, cyklosporin A, leflunomid a azathioprin. Byla také léčena intravenózními imunoglobuliny. Navzdory agresivní terapii byl vývoj onemocnění zprvu nepříznivý. Dominovaly vaskulitické kožní léze na rukou a tvorba kalcifikací v měkkých tkáních. Navíc došlo k infekčním komplikacím, z nichž nejzávažnější byl opakovaně chirurgicky sanovaný absces v pravé axile. V průběhu adolescence zánětlivá aktivita onemocnění částečně ustoupila, přetrvávala však polyartritida a tvorba ojedinělých kalcifikací. V klinickém obrazu začaly převládat projevy komplikací předchozí intenzivní imunosuprese. Rozvinula se arteriální hypertenze, glukokortikoidy indukovaná osteoporóza, porucha metabolismu lipidů, oboustranná steroidní katarakta. Nemocná jevila výrazně cushingoidní habitus. Při převzetí nemocné do péče naší ambulance jí bylo 20 let. Již tehdy jsme konstatovali přítomnost četných osteonekróz, které postihovaly oboustranně mediální kondyl femuru, obě pately, na pravé noze pak talus, os naviculare, bazi 5. metatarzu a hlavičku 2. metatarzu (viz obr. 1–3). V následujících třech letech nekrotické změny progredovaly zejména v oblasti kolen a pravé nohy. Pokročilost nálezu (kolaps talokrurálního skloubení i subtalárně, reaktivní synovitida, valgózní deformita, zborcení nožní klenby) vylučovala možnost implantace endoprotézy. V následujících letech bude stav zřejmě řešen artrodézou.
Image 1. Kolenní klouby (předozadní rtg snímek). Nekrózy mediálního kondylu femuru oboustranně, fragmentace horního pólu pately oboustranně. Rozsáhlé kalcifikace v měkkých částech při základním onemocnění. 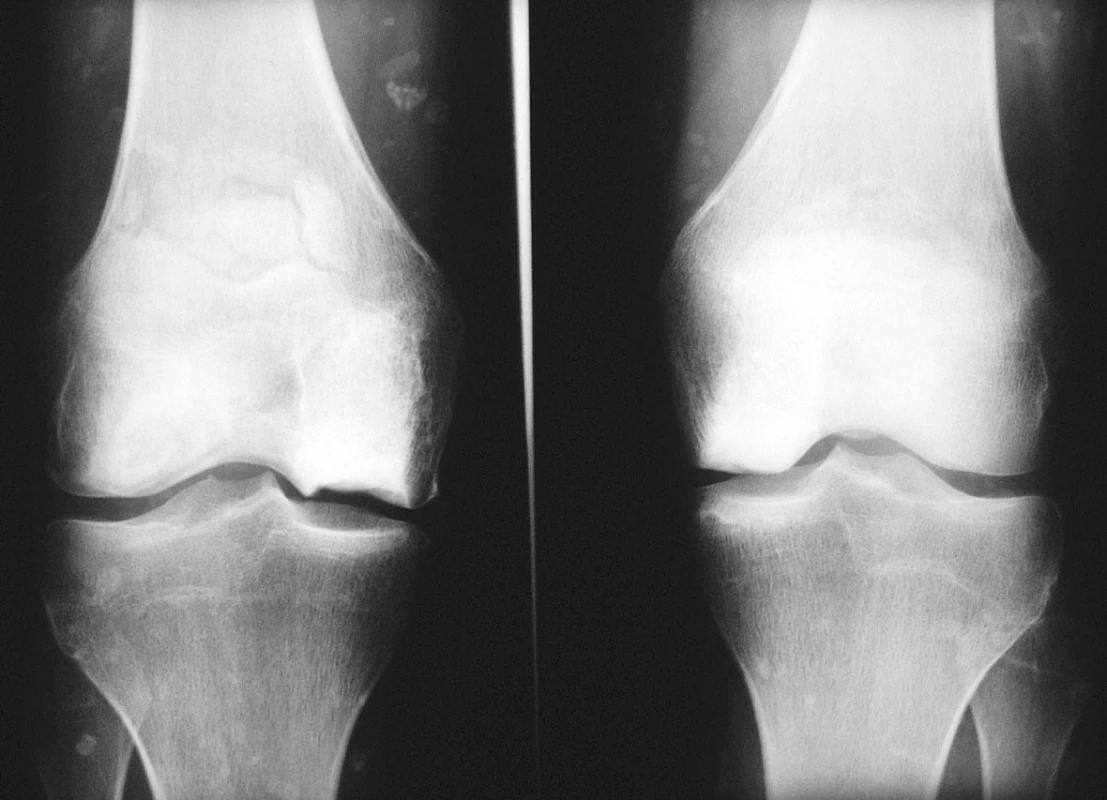
Image 2. Kolenní klouby (bočný RTG snímek). Nekrózy mediálního kondylu femuru oboustranně, fragmentace horního pólu pately oboustranně. Rozsáhlé kalcifikace v měkkých částech při základním onemocnění. 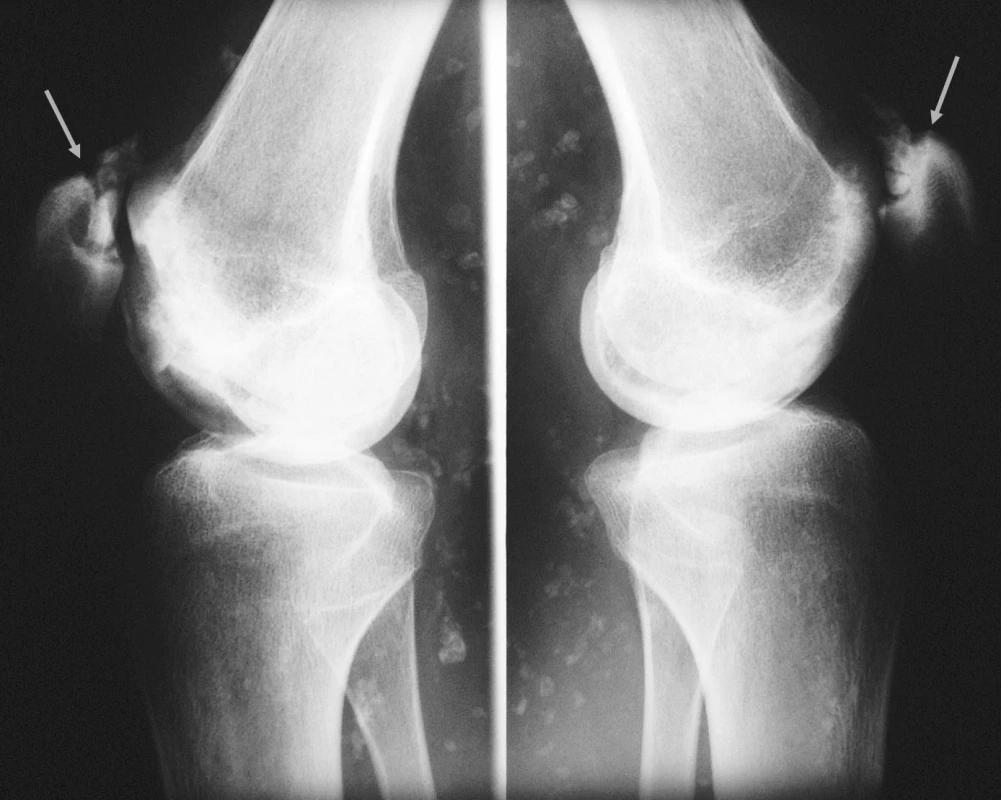
Image 3. Pravé hlezno (předozadní RTG snímek). Rozsáhlá osteonekróza talu pravého hlezna. 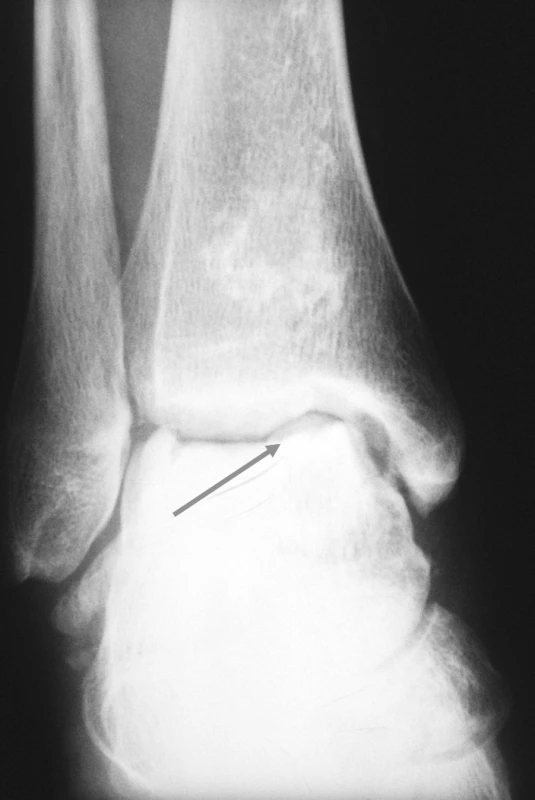
Popis případu 2
31letá žena, která je v naší ambulanci sledována pro dermatomyozitidu, přichází pro nově vzniklé bolesti a omezení hybnosti velkých kloubů – kolen, kyčlí a ramen.
V rodinné anamnéze nemocné se nevyskytla žádná závažná onemocnění. Pacientka od útlého věku trpí atopickou, potravinovou a polékovou alergií (jablka, lískové oříšky, prach, pyl, chloramfenikol, penicilin). Je nekuřačka, alkoholické nápoje pije výjimečně. Má zdravou dceru – průběh gravidity i porodu byl fyziologický. V adolescenci prodělala infekční mononukleózu.
Ve 26 letech byla u nemocné diagnostikována dermatomyozitida. Pacientka měla typické kožní léze, periorbitální edém, dysfagické a dysfonické obtíže, polyartritidu. Záhy došlo k rozvoji plicní fibrózy a k vyjádření antisyntetázového syndromu. Nemocná byla léčena kortikoidy ve vysokých dávkách (zpočátku Prednison 60 mg denně, posléze Medrol 48 mg denně) a metotrexátem v týdenní dávce 15 mg. Stav byl nadále vážný – nemocná ubyla na váze 20 kg, byla unavená, slabá, námahově dušná. Pro elevaci jaterních testů bylo nutno vysadit metotrexát. Pacientka přestala spolupracovat a užívat léky, docházela k léčiteli. O měsíc později byla hospitalizována pro prudké zhoršení celkového stavu a febrilie. Během pobytu byla zjištěna pancytopenie a těžká hepatopatie, obojí nejspíše toxické etiologie. Nemocná měla symetrickou polyartritidu, postihující lokty, zápěstí, ramena a kolena, progredující svalovou slabost, kožní projevy (vaskulitida s trofickými defekty zejména v oblasti sakra, dorza rukou, heliotropní raš, „ruce mechanika“, Gottronovy papuly, alopecie). Hojení vaskulitických lézí bylo komplikováno abscedujícími infekčními komplikacemi. Nemocná byla léčena kortikoidy (perorálně, intravenózní pulzy) a byly jí podávány intravenózní imunoglobuliny. Po zlepšení stavu byla zavedena terapie cyklofosfamidem v denní dávce 100 mg. Během následujícího roku aktivita základního onemocnění klesala, postupně se upravily laboratorní parametry (krevní obraz a jaterní testy), pomalu se odhojovaly rozsáhlé kožní defekty, plicní postižení neprogredovalo.
V průběhu dalších dvou let nedošlo k obnovení aktivity systémového onemocnění. Nemocná dosti přibrala na hmotnosti, měla hypercholesterolemii, jevila výrazně cushingoidní habitus. Byla zjištěna osteoporóza, již komplikovaná kompresí obratlových těl L1 a Th 11. Pacientce byly podávány bisfosfonáty (alendronát, risedronát) s dobrým efektem. Perorální steroid byl postupně detrahován na denní dávku 8/4 mg alternativně, posléze byl vysazen zcela. V léčbě cyklofosfamidem nebylo pokračováno.
Kumulativní dávka perorálního kortikoidu, kterou pacientka obdržela, byla přibližně 21 g ekvivalentu prednisonu. Průměrná denní dávka byla vypočtena na 16 mg ekvivalentu prednisonu. Navíc byly nemocné na jiném pracovišti aplikovány intravenózní pulzy steroidu, jejichž počet není znám. Z cytotoxických léčiv bylo pacientce celkem podáno přibližně 75 mg metotrexátu a 14 g cyklofosfamidu.
V roce 2004, tedy s odstupem 4 let od nástupu onemocnění, začaly pacientku trápit bolesti kolen, kyčlí a ramen. Zobrazovací metody (rtg, MR) potvrdily podezření na mnohočetnou osteonekrózu, postihující oboustranně oba kondyly distálního femuru, hlavici femuru a humeru (viz obr. 4–6).
Image 4. Kyčelní klouby (T1W obraz ve frontální rovině). Pokročilá osteonekróza hlavic femuru postihující oboustranně v celém rozsahu horní části hlavic s jejich oploštěním. 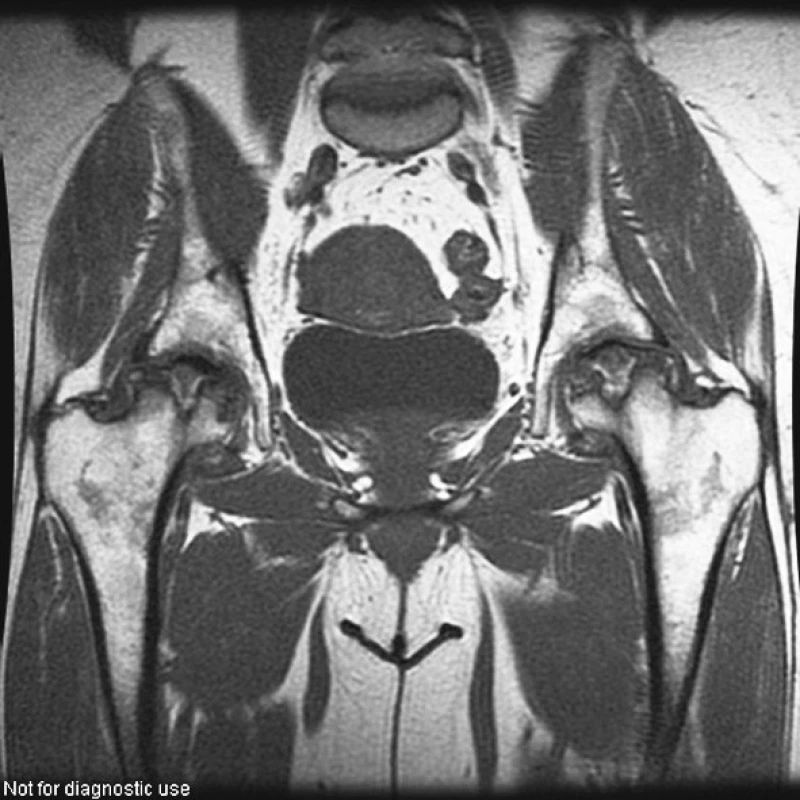
Image 5. Pravé rameno (PDW obraz ve frontální rovině). Rozsáhlá osteonekróza hlavice humeru vpravo postihující celý vrchlík hlavice, s výrazným nepravidelným oploštěním horní části hlavice 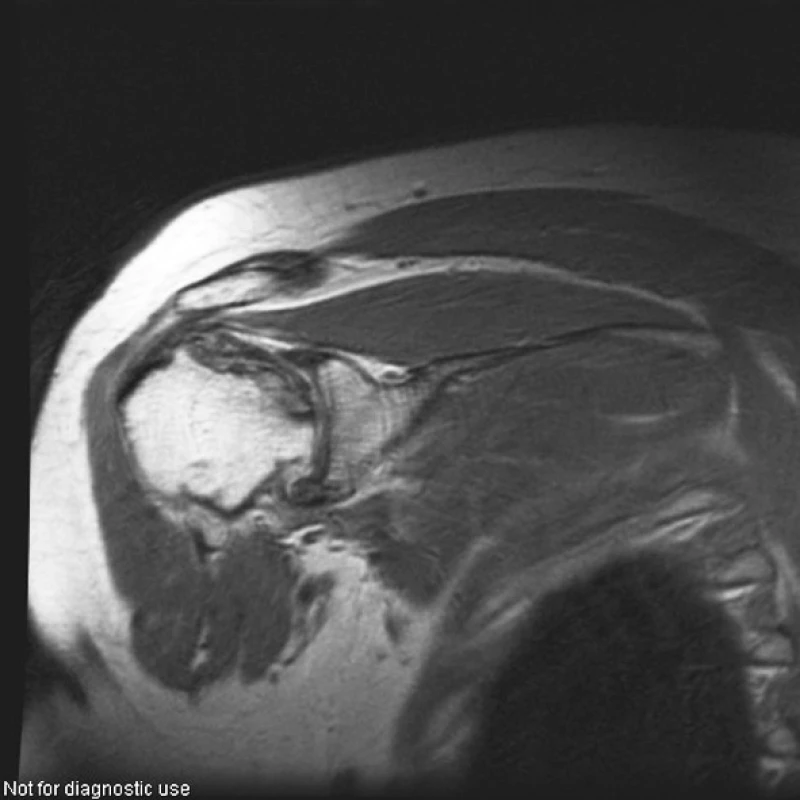
Image 6. Pravé rameno (PDW obraz v sagitální rovině). Rozsáhlá osteonekróza hlavice humeru vpravo postihující celý vrchlík hlavice, s výrazným nepravidelným oploštěním horní části hlavice 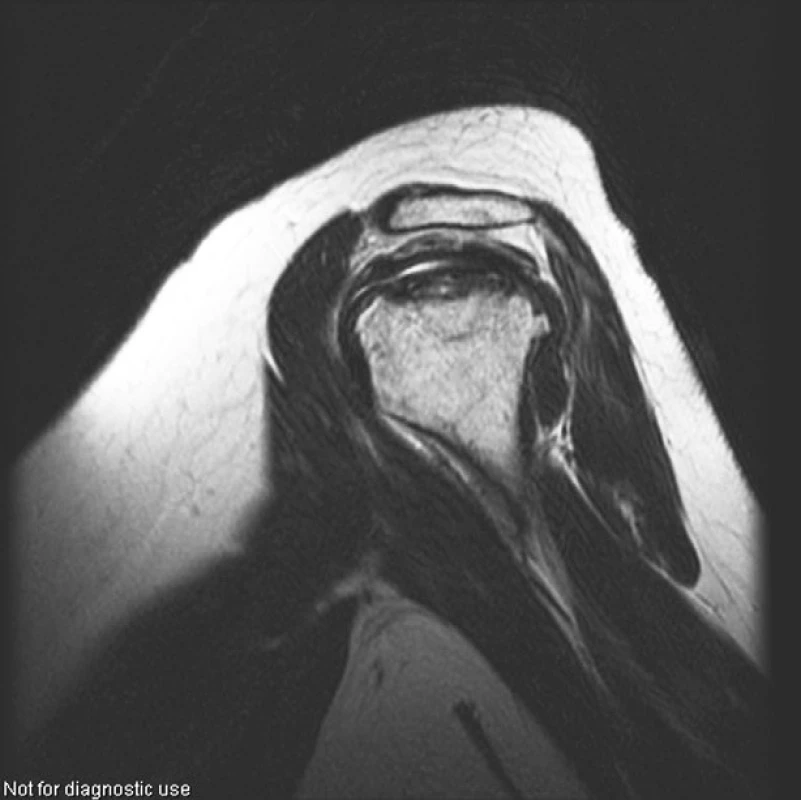
ZÁVĚR
Jednoznačná kauzalita mezi podáním kortikoidu a následnou osteonekrózou dosud v humánní medicíně nebyla prokázána. Je to dáno mimo jiné i tím, že základní onemocnění pro něž jsou glukokortikoidy podávány, může samo o sobě být predispozicí k osteonekróze. Významná asociace mezi systémovým podáváním steroidů a rozvojem osteonekrózy však opakovaně doložena byla, a to zejména v případě osteonekrózy mnohočetné. Za rizikové z hlediska vývoje osteonekrózy je u revmatických nemocných považováno především podávání vysokých úvodních dávek a pulzní intravenózní aplikace kortikoidů, intenzivní cytotoxická terapie, kouření, poruchy metabolismu lipidů, poruch hemokoagulace a fibrinolýzy, event. přítomnost vaskulitidy. Pozornost je třeba věnovat i dalším možným rizikovým faktorům osteonekrózy (viz tab. 1). Stěžejní pro další prognózu je časná detekce osteonekrotických změn a s tím související zavedení adekvátních léčebných opatření v ještě reverzibilních stadiích nekrotického procesu.
MUDr. Simona Skácelová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: skac@revma.cz
Sources
1. Collaborative Osteonecrosis Group. Symptomatic Multifocal Osteonecrosis. Clin Orthop 1999; 369 : 312–326.
2. Assouline-Dayan Y, Chang Ch, Greenspan A, Shoenfeld Y, et al. Pathogenesis and natural history of osteonecrosis. Seminars in Arthritis and Rheumatism 2002; 32(2): 94–124.
3. Clinkscales A, Cleary JD. Steroid induced avascular necrosis. Annals of Pharmacotherapy 2002; 36 : 1105.
4. Pavelka K, Gatterová J, Sainerová A. Multiple osteonecroses in a patient with systemic connective tissue disease. Čes Revmatol 1999; 3 : 142–145.
5. Griffith JF, Antonio GE, Kumta SM, et al. Osteonecrosis of hip and knee in patients with severe acute respiratory syndrome treated with steroids. Radiology 2005; 235 : 168–175.
6. Chan MHM, Chan PKS, Griffith JF, Chan IHS, et al. Steroid-induced osteonecrosis in severe acute respiratory syndrome: a retrospective analysis of biochemical markers of bone metabolism and corticosteroid therapy. Pathology 2006; 38(3): 229–235.
7. Ce P, Gedizlioglu M, Gelal F, Coban P, et al. Avascular necrosis of the bones: an overlooked complication of pulse steroid tratment of multiple sclerosis. European Journal of Neurology 2006; 13 : 857–861.
8. Torii Y, Hasegawa Y, Kubo T, Kodera Y, et al. Osteonecrosis of the femoral head after allogenic bone marrow transplantation. Clin Orthop 2001; 382 : 124–132.
9. Sakamoto M, Shimizu K, Iida S, Akita T, et al. Osteonecrosis of the femoral head: a prospective study with MRI. J Bone Joint Surg Br 1997; 79 : 213–219.
10. Nagasawa K, Tsukamoto H, Tada Y, Mayumi T, et al. Imaging study on the mode of development and changes in avascular necrosis of the femoral head in systemic lupus erythematosus: long term observations. Br J Rheumatol 1994; 33 : 342–347.
11. Cosgriff SW. Thromboembolic complications associated with ACTH and cortisone therapy. Jama 1951; 147 : 924–926.
12. Sjöberg HE, Blombäck M, Granberg PO. Thromboembolic complications, heparin treatment and increase in coagulation factors in Cushing’s syndrome. Acta Med Scand 1976; 199 : 95–98.
13. Kohler HP, Grant PJ. Plasminogen-activator inhibitor type 1 and coronary artery disease. N Engl J Med 2000; 342 : 1792–801.
14. Brotman DJ, Girod JP, Posch A, Jani JT, et al. Effect of short-term glucocorticoids on hemostatic factors in healthy volunteers.Thromb Res 2006; 118 : 247–252.
15. Frank FD. Effect of intravenous high-dose methylprednisolone on coagulation and fibrinolysis markers. Thromb Haemost 2005; 94 : 466–468.
16. Yamamoto T, Irisa T, Sugioka Y, Sueishi K. Effects of pulse methylprednisolone on bone and marrow tissues. Arthritis Rheum 1997; 40(11): 2055–2064.
17. Miyanishi K, Yamamoto T, Irisa A, et al. Bone marrow fat cell enlargement and a rise in intraosseous pressure in steroid-treated rabbits with osteonecrosis. Bone 2002; 30(1): 185–190.
18. Wang GJ, Sweet DE, Reger Si, Thompson RC. Fat-cell changes as a mechanism of avascular necrosis of the femoral head in cortisone-treated rabbits. J Bone Joint Surg Am 1997; 59A: 729–735.
19. Kawai K, Tamaki A, Hirohata K. Steroid-induced accumulation of lipid in the osteocytes of the rabbit femoral head: a histological and electron micorscopic study. J Bone Joint Surg. Am 1985; 67A: 755–763.
20. Fisher DE, Bickel WH, Holley KE, Ellefson RD. Corticosteroid-induced aseptic necrosis. Clin Orthop 1972; 84 : 200–206.
21. Gold EW, Fox OD, Wissfeld S, Curtiss PH. Corticosteroid-induced avascular necrosis: an experimental study in rabbits. Clin Orthop 1978; 135 : 272–280.
22. Wang GJ, Lennox DW, Reger SI, Stamp WG, et al. Cortisone-induced intrafemoral head pressure change and its response to a drilling decompression method. Clin Orthop 1981; 159 : 274–278.
23. Drescher W, Bünger MH, Weigert K, Bünger C, et al. Methylprednisolone enhances contraction of porcine femoral head epiphyseal arteries. Clin Orthop 2004; 423 : 112–117.
24. Ichiseki T, Kaneuji A, Katsuda S, Ueda Y, et al. DNA oxidation injury in bone early after steroid administration is involved in the pathogenesis of steroid-induced osteonecrosis. Rheumatology 2005; 44 : 456–460.
25. Ichiseki T, Matsumoto T, Nishino M, Kaneuji A, et al. Oxidative stress and vascular permeability in steroid-induced osteonecrosis model.J Orthop Sci 2004; 9(5): 509–515.
26. Weinstein RS, Jilka RL, Parfitt AM, Manolagas SC. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. Potential mechanism of their deleterious effects on bone. J Clin Invest 1998; 102 : 274–282.
27. Herkert O, KuhlH, Sandow J, Busse R, et al. Sex steroids used in hormonal treatment increase vascular procoagulant activity by inducing thrombin receptor (PAR 1) expression: role of the glucocorticoid receptor. Circulation 2001; 104 : 2826–31.
28. Calvo-Alén J, McGwin G, Toloza S, Fernández M, et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA): XXIV. Cytotoxic treatment is an additional risk factor for the development of symptomatic osteonecrosis in lupus patients: results of a nested matched case-control study. Ann Rheum Dis 2006; 65 : 785–790.
29. Nagasawa K, Tada Y, Koarada S, Horiuchi T, et al. Very early development of steroid-associated osteonecrosis of femoral head in systemic lupus erythematosus: prospective study by MRI. Lupus 2005; 14 : 385–390.
30. Oinuma K, Harada Y, Nawata Y, Takabayashi K, et al. Osteonecrosis in patients with systemic lupus erythematosus develops very early after starting high dose corticosteroid treatment. Ann Rheum Dis 2001; 60 : 1145–1148.
31. Massardo L, Jacobelli S, Leissner M, Gonzales M, Villarroel L, Rivero S. High-dose intravenous methylprednisolone therapy associated with osteonecrosis in patients with systemic lupus erythematosus. Lupus 1992; 1 : 401–405.
32. Pavelka K. Osteonecrosis. Baillieres Best Pract Res Clin Rheumatol 2000; 14(2): 399–414.
33. Zizic TM, Marcoux C, Hungerford DS, Dansereau JV, Stevens MB. Corticosteroid therapy associated with ischemic necrosis of bone in systomic lupus erythematosus. Am J Med 1985; 789 : 596–604.
34. Mok MY, Farewell VT, Isenberg DA. Risk factors for avascular necrosis of bone in patients with systemic lupus erythematosus: is there a role for antiphospholipid antibodies ?Ann Rheum Dis 2000; 59 : 462–467.
35. Mok CC, Lau CS, Wong RW. Risk factors for avascular bone necrosis in systemic lupus erythematosus. Br J Rheumatol 1998; 37 : 895–900.
36. Inoue A, Ono K. A histological study of idipathic avascular necrosis of the head of the femur. J Bone Joint Surg Br 1979; 61-B: 138–143.
37. Solomon L. Drug-induced arthropathy and necrosis of the femoral head. J Bone Joint Surg Br 1973; 55 : 246–261.
38. Sakai T, Sugano N, Nishii T, Haraguchi K, et al. Bone scintigraphy for osteonecrosis of the knee in patients with non-traumatic osteonecrosis of the femoral head: comparison with magnetic resonance imaging. Ann Rheum Dis 2001; 60 : 14–20.
39. Burgener FA, Meyers SP, Tan RK, Zanhbauer W. Differential diagnosis in magnetic resonance imaging.Thieme New York: Georg Thieme Verlag, 2002 : 388.
40. Steinberg ME, Steinberg DR. Classification systems for osteonecrosis: an overview. Orthop Clin N Am 2004; 35 : 273–283.
41. ARCO Comittee on Terminology and Staging. Report on the comittee meeting at Santiago de Compostella. ARCO Newsletter 1993; 5 : 79–82.
42. Collaborative Osteonecrosis Group. Symptomatic Multifocal Osteonecrosis. Clin Orthop 1999; 369 : 312–326.
43. LaPorte DM, Mont MA, Mohan V, Jonex LC, et al. Multifocal osteonecrosis. J Rheumatol 1998; 25 : 1968–74.
44. Jacobs B. Epidemiology of traumatic and nontraumatic osteonecrosis. Clin Orthop 1978; 130 : 51–67.
45. Sugano N, Nishii T, Shibuya T, et al. Contralateral hip in patients with unilateral nontraumatic osteonecrosis of the femoral head. Clin Orthop 1997; 334 : 85–90.
46. Zizic TM, Marcoux C, Hungerford DS, Stevens MB. The early diagnosis of ischaemic necrosis of bone. Arthritis Rheum 1986; 29 : 1177–1186.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2007 Issue 2-
All articles in this issue
- Stanovení pentosidinu v moči a tkáních kloubního kompartmentu pacientů s pokročilou osteoartrózou
- Výskyt echokardiograficky detekovatelných kardiovaskulárních manifestací systémového lupus erythematodes
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Monitorování léčby osteoporózy
- Zobrazovací metody v hodnocení strukturální progrese u ankylozující spondylitidy
- Bezpečnost podání anti-TNF alfa léčby u revmatických pacientů s chronickou hepatitidou B nebo C
- Osteonekróza asociovaná se systémovou kortikoterapií
- Trombotická trombocytopenická purpura u nemocných se systémovým lupus erythematodes
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteonekróza asociovaná se systémovou kortikoterapií
- Trombotická trombocytopenická purpura u nemocných se systémovým lupus erythematodes
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Zobrazovací metody v hodnocení strukturální progrese u ankylozující spondylitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

