-
Medical journals
- Career
Typický rozštěp rtu a patra v 2D ultrasonografii
Authors: E. Matějková; A. Kordasová; I. Lukáčová
Authors‘ workplace: Gynekologicko‑porodnické oddělení Vítkovické nemocnice a. s., Ostrava
Published in: Ceska Gynekol 2020; 85(5): 309-313
Category: Case Report
Overview
Cíl studie: Přehled prenatální diagnostiky typického rozštěpu rtu a patra v 2D ultrasonografii v ambulantní praxi demonstrovaný na konkrétní kazuistice.
Typ studie: Kazuistika, souhrnný přehled.
Název a sídlo pracoviště: Gynekologicko-porodnické oddělení, Vítkovická nemocnice a.s., Ostrava.
Metodika: Literární rešerše a popis konkrétního případu.
Závěr: Typický rozštěp rtu a patra je často asociovaný s genetickými syndromy. Izolovaná vada nezřídka uniká prenatální diagnostice, která je možná již v prvním trimestru gravidity. Znalost přítomnosti vady prenatálně může zabezpečit časnou primární rekonstrukci rtu, která je spojena s lepší reparační schopností tkání.
Cíl studie: Přehled prenatální diagnostiky typického rozštěpu rtu a patra v 2D ultrasonografii v ambulantní praxi demonstrovaný na konkrétní kazuistice.
Typ studie: Kazuistika, souhrnný přehled.
Název a sídlo pracoviště: Gynekologicko-porodnické oddělení, Vítkovická nemocnice a.s., Ostrava.
Metodika: Literární rešerše a popis konkrétního případu.
Závěr: Typický rozštěp rtu a patra je často asociovaný s genetickými syndromy. Izolovaná vada nezřídka uniká prenatální diagnostice, která je možná již v prvním trimestru gravidity. Znalost přítomnosti vady prenatálně může zabezpečit časnou primární rekonstrukci rtu, která je spojena s lepší reparační schopností tkání.
Klíčová slova:
rozštěp rtu – rozštěp patra – ultrasonografie
ÚVOD
Rozštěp rtu a patra patří do skupiny kraniofaciálních malformací. Typický rozštěp rtu s rozštěpem patra nebo bez něj postihuje častěji mužské pohlaví. V kavkazské populaci se pohybuje prevalence mezi 1 : 700 až 1 : 1000 živě rozených dětí. Izolovaný rozštěp patra je ale častější u žen, jeho prevalence je 0,4 : 1000 živě narozených. Etiologie je multifaktoriální a může být spojena s genetickými syndromy, numerickými chromozomálními abnormalitami nebo teratogeny působícími v průběhu embryogeneze [5, 14].
EMBRYOGENEZE OBLIČEJE A PATRA
Vývoj obličeje (obr. 1a, 1b, 1c) počíná ukončeným 4. postkoncepčním týdnem postupným srůstem pěti hrbolků proliferujícího mezenchymu. Prominentia fontonasalis, párové processus maxillares a párové processus mandibulares jsou hranicemi primitivní ústní dutiny. Srůstem processus mandibulares vzniká dolní ret a dolní čelist. Na processus frontalis se vytvoří bilaterálně ploténky ektodermy – nazální plakódy, které postupně invaginují a tvoří základ budoucí nosní dutiny. Kolem nazálních plakód se utvoří oboustranně laterální a mediální nazální výběžky vyrůstající z prominentia frontalis. Laterální je základem pro allae nasi, mediální výběžky srůstají ve středové čáře a dále proliferují kaudálním směrem. Tvoří tzv. intermaxilární segment, z kterého vzniká filtrum a praemaxilla (primární patro, ventrálně od foramen incisivum). Intermaxilární segment srůstá s maxilárním výběžkem laterálně. Z maxilárního výběžku se utvoří laterální část horního rtu, maxilla a sekundární patro (dorzálně od foramen incisivum). Palatinní výběžky vycházející z maxilárních výběžků původně rostou vertikálním směrem, posléze se ale stáčí horizontálně a dochází k jejich fúzi, která probíhá ventrodorzálním směrem [1, 7, 14]. Vývoj rtu je ukončen v 7+2 týdnu [12] a vývoj patra je ukončený u plodu s temeno-kostrční délkou 50 mm, tj. v 11+5 týdnu gestace [9].
Image 1. a, b, c 1. nosní plakóda, 2. maxilární výběžek, 3. mandibulární výběžek, 4. frontální výběžek, 5. oko, 6. laterální nazální výběžek, 7. mediální nazální výběžek 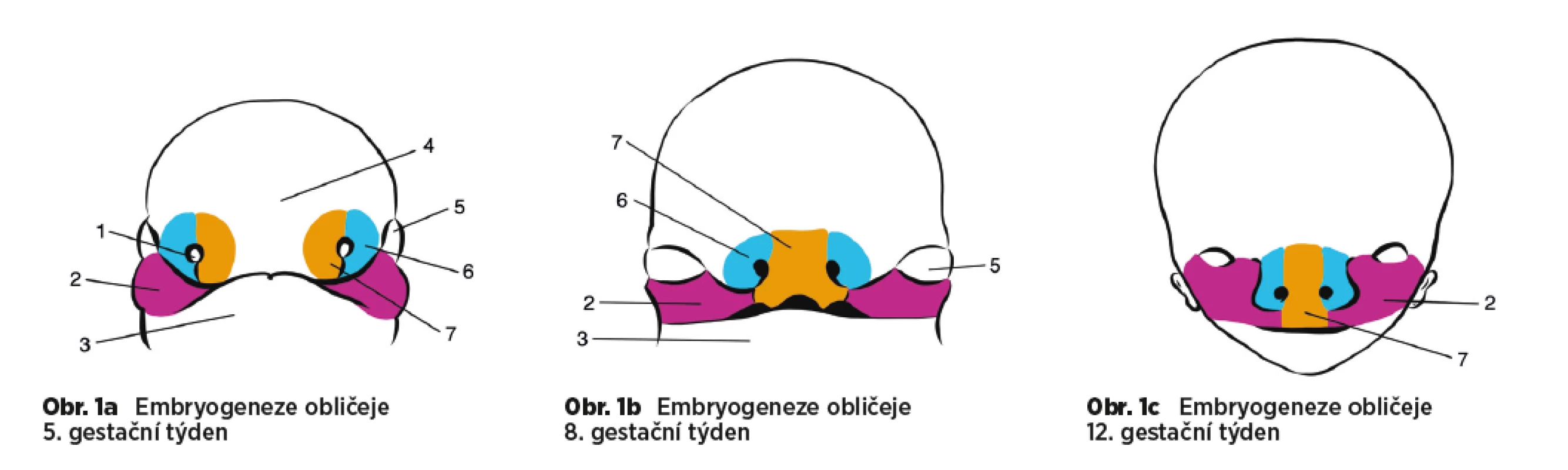
METODIKA
V průběhu prvotrimestrálního screeningu se k diagnostice rozštěpu rtu a patra využívají ve 2D ultrasonografii především markery maxillary gap a retronasal triagle (schéma 1). Maxillary gap (obr. 2) poprvé popsal v roce 2015 Chaoui [6]. Zobrazuje se v mediosagitálním řezu, což je vzhledem k úspoře času vyšetřujícího jeho eminentní výhodou. Je definován jako přerušení kontinuity hyperechogenní linie sekundárního patra. V ukončeném 12. gestačním týdnu je sekundární patro definitivně uzavřené, nicméně mohou se v něm vyskytovat místa s nižší osifikací, což se v mediosagitálním řezu projeví jako parciální přerušení. Maxillary gap pod 1,5 mm je považován za fyziologický nález. Tento marker nemá senzitivitu vůči rozštěpu primárního patra. V mediosagitální rovině se ale u 18,9 % až 40,8 % plodů s rozštěpem rtu s rozštěpem nebo bez rozštěpu praemaxilly zobrazí protruze maxilly [6]. Retronazální trojúhelník (obr. 3) poprvé popsal v roce 2010 Sepulveda [13]. K jeho provedení se využívá koronární řez obličeje plodu, kde se v místě primárního patra zobrazí hyperechogenní trojúhelník. Dvě strany trojúhelníku tvoří frontální výběžky maxilly, základnu tvoří primární patro. V případě porušení kontinuity základny je vyjádřeno podezření na rozštěp rtu a primárního patra [13].
Image 2. Mediosagitální řez v 1. trimestru; maxillary gap označen šipkou 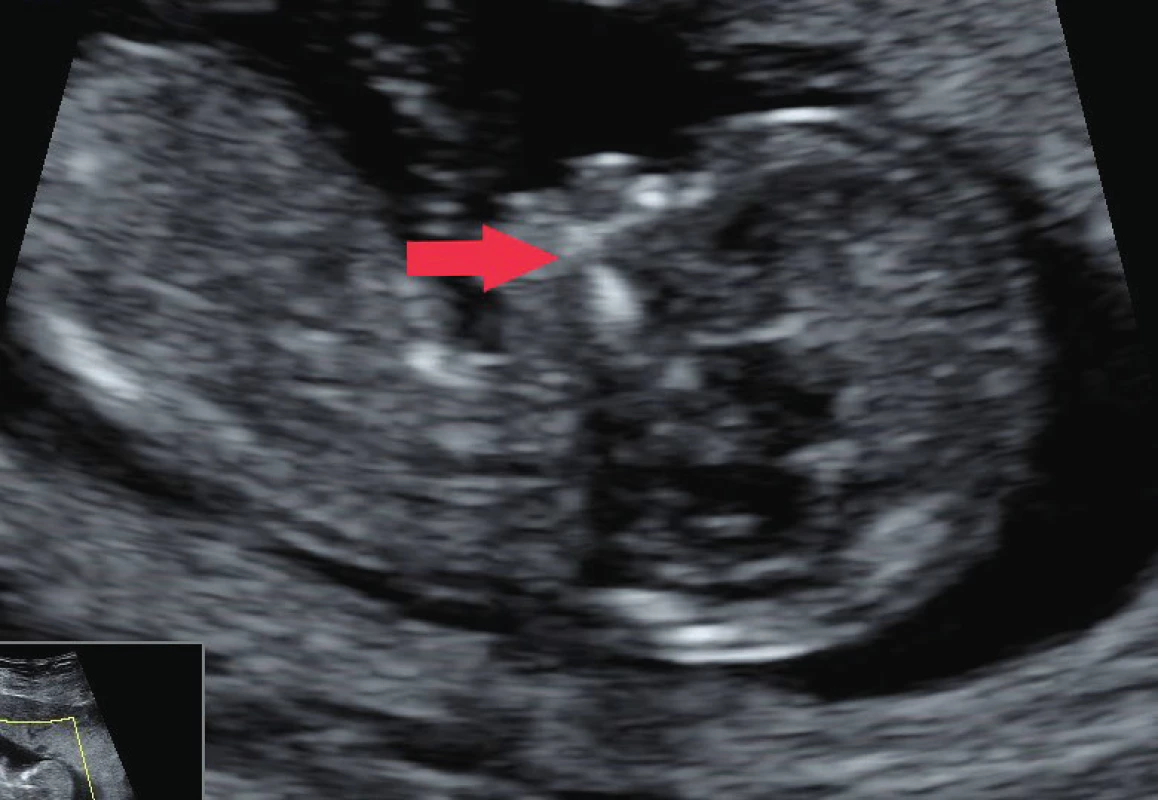
Image 3. Retronazální triangl; fyziologický obraz celistvého primárního patra v 1. trimestru 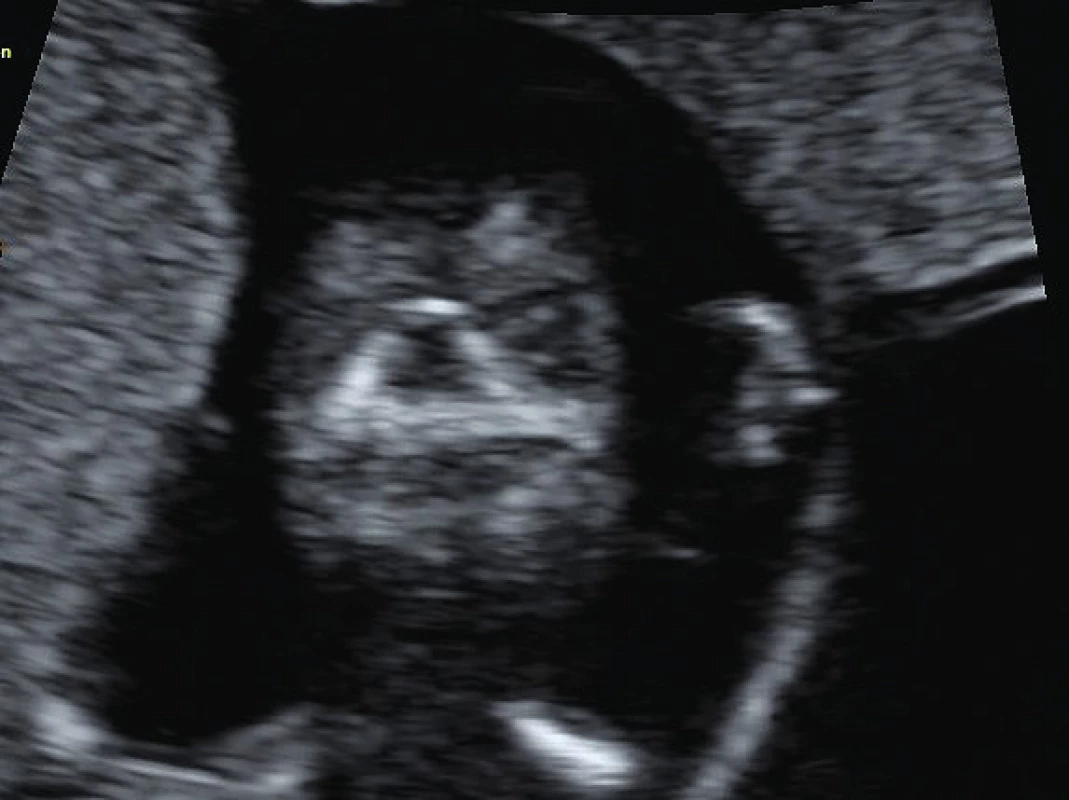
Schéma 1 Diagnostické markery
A. Izolovaný rozštěp sekundárního patra. Fyziologický obraz retronazálního trianglu. Přítomný maxillary gap – patologický obraz.
B. Kompletní typický oboustranný rozštěp rtu a patra. Patologický retronazální triangl. Přítomný maxillary gap a protruze praemaxilly.
C. Oboustranný rozštěp rtu. Patologický retronazální triangl. Celistvé patro v mediosagitálním řezu, bez přítomnosti maxillary gap.
D. Unilaterální rozštěp rtu. Patologický retronazální triangl. Celistvé patro v mediosagitálním řezu, bez přítomnosti maxillary gap.
Ve 20. týdnu gestace k diagnostice využíváme koronární, axiální a mediosagitální řez (obr. 4 a 5). V koronárním řezu zobrazujeme celistvost rtů a nos plodu. Ve správně zobrazené axiální rovině svírá lamina horizontalis patra s horizontální osou insonace úhel 0 až 30°, tzn. plod „hledí“ na sondu. Lamina horizontalis je jasně vizualizovaná. Diferencujeme kompletně maxillu s celým alveolárním obloukem. Na snímku jsou přítomné processus pterygoidei [4] [11].
Image 4. Sagitální řez ve 20. týdnu gravidity; protruze premaxily označena šipkou 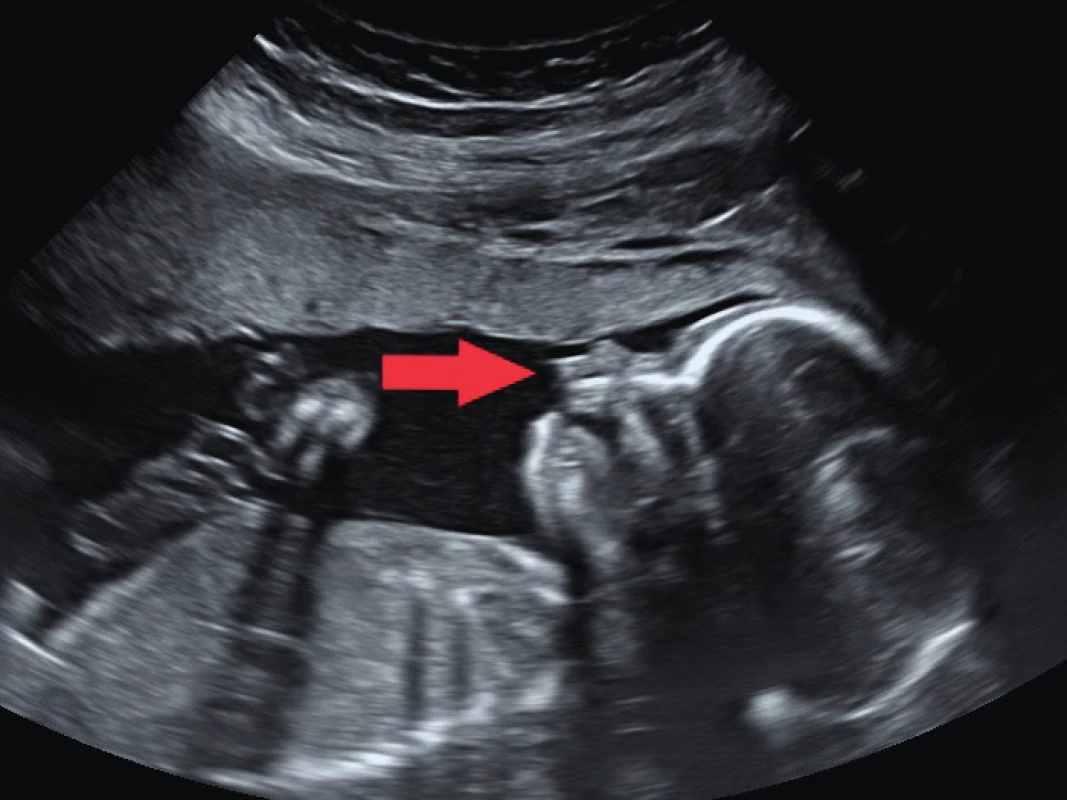
Image 5. Koronární řez ve 20. týdnu gravidity; rozštěp rtu označen šipkou 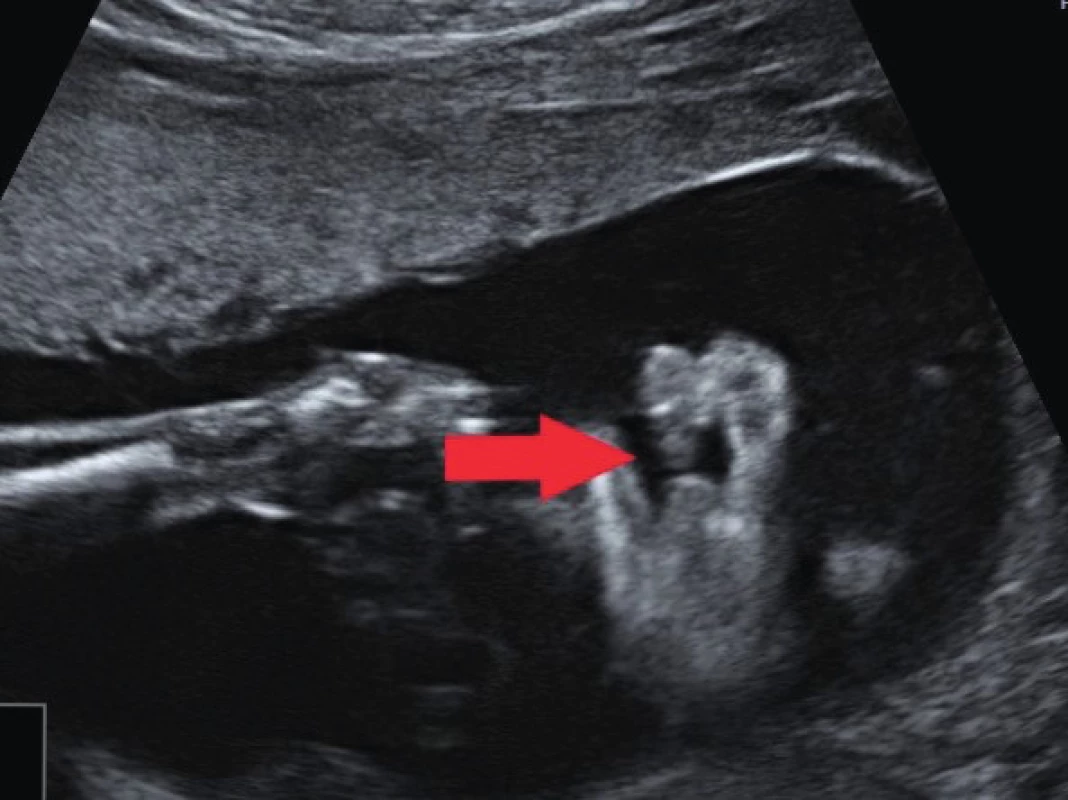
VLASTNÍ POZOROVÁNÍ
Chlapec pochází z první gravidity 26leté rodičky. Matka byla dispenzarizována pro kompenzovanou hypotyreózu na substituci a asthma bronchiale na terapii singulairem a symbicortem. Symbicort podle doporučení Státního ústavu pro kontrolu léčiv není kontraindikován v graviditě. Ve studiích na zvířatech byl po podání budesonidu pozorován rozštěp patra a malformace skeletu. Tyto výsledky ale nebyly vyhodnoceny jako rizikové pro člověka při podání doporučovaných dávek [15].
Prvotrimestrální screening shledal nízké riziko na genetické vady a neprokázal suspekci na vývojovou anomálii. U druhotrimestrálního screeningu byla diagnostikována levostranná cheilognatoschíza a pacientka byla referována na vyšší pracoviště k expertní ultrasonografii, kde nález rozšířili o levostrannou cheilognathopalatoschízu a pravostrannou cheiloschízu, další patologii neshledali. Těhotná byla odeslána na genetické vyšetření. Podstoupila aminocentézu se závěrem karyotyp 46XY. V průběhu gravidity byla opakovaně hospitalizována pro inkompetenci děložního hrdla bez nutnosti podání kortikoterapie. Porod proběhl v ukončeném 37. gestačním týdnu spontánně záhlavím, 3170 gramů/50 cm.
Bezprostřední adaptace novorozence sice byla normální, ale po několika hodinách se rozvinula desaturace kyslíkem s nutností krátkodobé aplikace kyslíku. Další poporodní průběh byl již klidný. Dítě bylo pro rozštěp patra kojeno odstříkaným mateřským mlékem přes speciální savičku. V novorozeneckém screeningu byly oboustranně nevýbavné otoakustické emise. Dítě (obr. 6 a 7) bylo propuštěno čtvrtý poporodní den. Devátý poporodní den byla provedena časná rekonstrukce rtu komplikovaná infekcí a částečnou dehiscencí sutury pravostranného rozštěpu se sekundárním hojením rány.
Image 6. Novorozenec před korekční operací 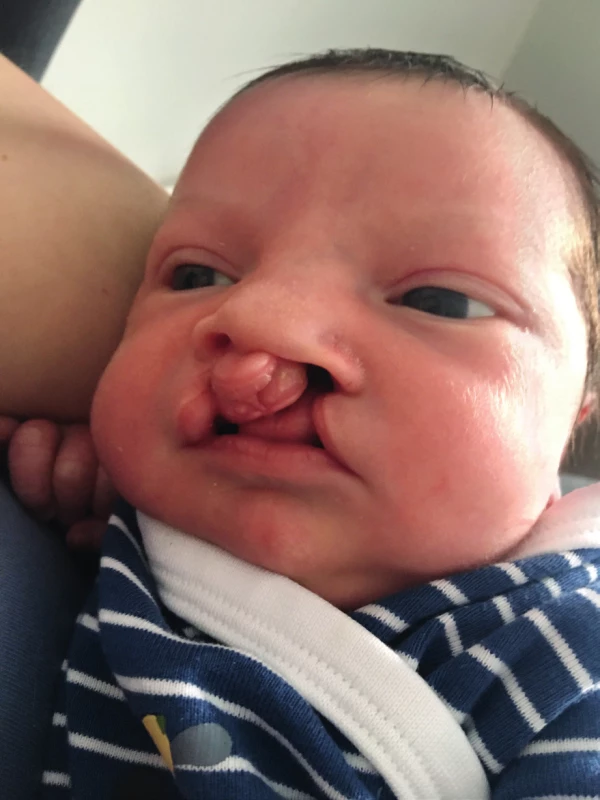
Image 7. Rozsáhlý rozštěp patra 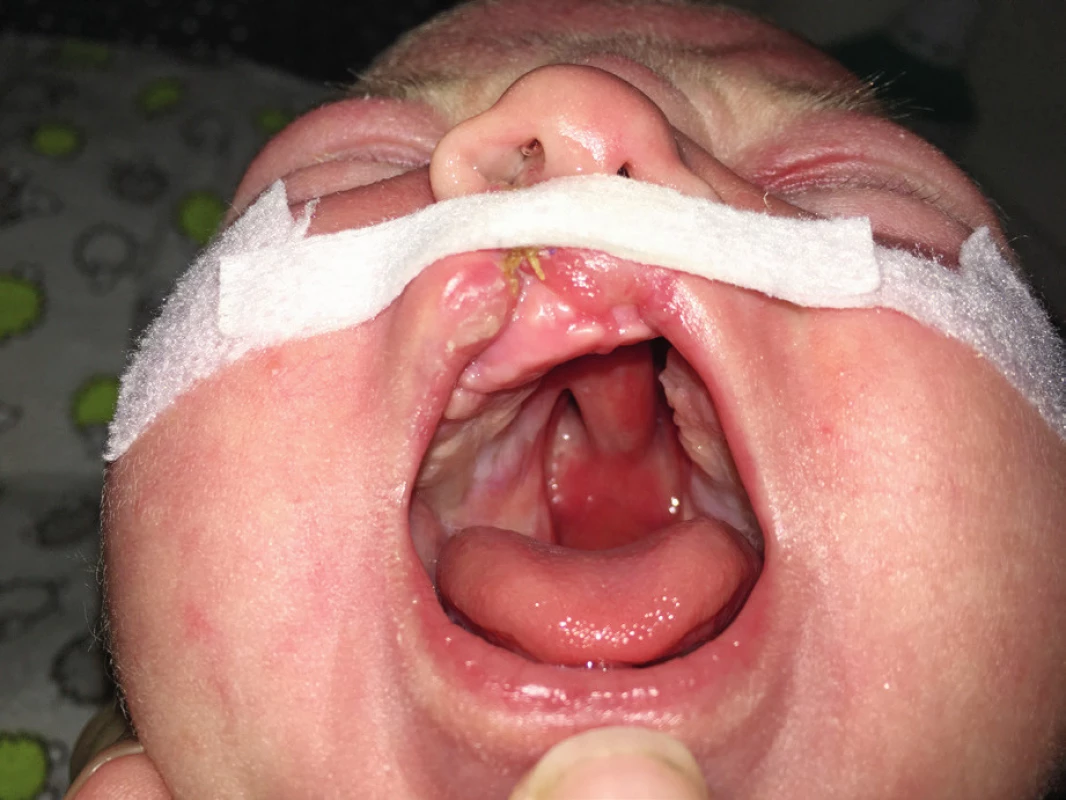
V devátém měsíci života byla provedena rekonstrukce patra bez komplikací. Psychomotorický vývoj dítěte dnes odpovídá jeho věku. Podle otorinolaryngologického vyšetření je vlevo fyziologický nález, přetrvává mírná nedoslýchavost vpravo s předpokladem úpravy stavu v průběhu věku. Další rekonstrukční operace patra je plánována v pátém roce života.
DISKUSE
Podle doporučení International Society of Ultrasound in Obstetrics and Gynecology (ISUOG) z roku 2013 by měl být ultrasonografista již v průběhu prvotrimestrálního screeningu schopen posoudit vývoj obličeje – očnice a kontinuitu rtů. Není-li vyšetření validní, další ultrazvuk obličeje plodu není indikován dříve než v průběhu screeningu ve 20. týdnu gravidity [12]. I když jsou rozštěpové vady obličeje relativně častou vývojovou anomálií, jejich záchyt se v průběhu I. trimestru pohybuje mezi 5–13 % [16]. Syngelaki zařadil rozštěp rtu a patra do skupiny potenciálně detekovatelných vad v 1. trimestru gravidity.
Detekce vady závisí na čase vyhrazeném pro vyšetření plodu, odbornosti ultrasonografisty a kvalitě použitého ultrazvukového přístroje [16]. Ve 20. týdnu gestace se detekce rozštěpových vad obličeje při využití 2D ultrasonografie podle různých studií pohybuje mezi 0 až 73 %. Budeme-li mluvit o izolovaném rozštěpu sekundárního patra, potom je prenatální nález vad pouze 0–22 % [10]. Nízká prenatální detekce rozštěpu sekundárního patra je zdůvodňovaná především náročným provedením snímku patra a problematickou identifikací struktur patra [4]. Ke správné diagnostice je nutné znát embryogenezi obličeje, díky které může ultrasonografista lehce pochopit vznik a postižení jednotlivých struktur u kompletních i inkompletních kraniofaciálních rozštěpů. V případě prenatálně diagnostikovaného rozštěpu rtu a patra je předporodně rodička odeslaná do specializovaného centra pro léčbu rozštěpů obličeje k edukaci a domluvě na strategii postnatální operační léčby. Centralizace plodů s izolovanou rozštěpovou vadou obličeje však není nutná.
Poporodně je stanoven termín rekonstrukční operace rtu podle rozhodnutí rodičů v neonatálním období nebo od třetího měsíce věku. Operace ve třetím měsíci věku je preferovaná pro menší technickou náročnost. Časná operace v neonatálním věku má výrazný psychosociální benefit. Reparační schopnost tkání je vyšší, dochází k tzv. fetálnímu způsobu hojení, kdy nevzniká jizva [2, 17]. Rekonstrukce patra se provádí mezi 6. až 12. měsícem života, což umožní správný vývoj řeči. Mimo četné plastické a maxilofaciální operační rekonstrukce, které je často nutné opakovat v průběhu růstu dítěte, se rodiče potýkají se stomatochirurgickou intervencí, dispenzarizací ortodontisty, logopeda, foniatra, otorinolaryngologa, protetika, genetika a psychologa [3, 8].
ZÁVĚR
Znalost přítomnosti vady před porodem může zabezpečit časnou primární rekonstrukci rtu, která je spojena s lepší reparační schopností tkání. Rovněž rodiče mají čas vyrovnat se se situací a připravit se na časovou a psychosociální náročnost starostlivosti o dítě s rozštěpem. Perinatální i peripartální péče o těhotnou a plod s izolovanou vadou a normokaryotypem je standardní.
MUDr. Eva Matejková
Gynekologicko-porodnické oddělení
VTN a.s
Zalužanského 1192/15
703 84 Ostrava Vítkovice
e-mail: ewa.matejkova@gmail.com
Sources
1. Abramson, ZR., Peacock, ZS., Cohen, HL., Choudhri, AF. Radiology of cleft lip and palate: imaging for the prenatal period and throughout life. Radiographics, 2015, 35, 7, p. 2053–2063.
2. Borský, J., Hubáček, M., Kozák, J., Kašparová, M. Rozštěpy rtu a patra, plánování počáteční fáze léčby a interdisciplinární péče u pacientů v novorozeneckém a batolecím věku. Čes Stomatol Prakt zubní Lék, 2012, 112, s. 12–14.
3. Dvořák, Z., Veselý, J., Konvičková, E., Výška, T. Standardy multidisciplinární péče o dítě s rozštěpem obličeje. Čes-Slov Pediatrie, 2009, 64, s. 236–241.
4. Fuchs, F., Burlat, J., Grosjean, F., et al. A score-based method for quality control of fetal hard palate assessment during routine second-trimester ultrasound examination. Acta Obstet Gynecol Scand, 2018, 97, 11, p. 1300–1308.
5. Hoopmann, M., Sonek, J., Esser, T., et al. Frontal space distance in facial clefts and retrognathia at 11–13 weeks‘ gestation. Ultrasound Obstet Gynecol, 2016, 48, 2, p. 171–176.
6. Chaoui, R., Orosz, G., Heling, KS., et al. Maxillary gap at 11–13 weeks‘ gestation: marker of cleft lip and palate. Ultrasound Obstet Gynecol, 2015, 46, 6, p. 665–669.
7. Kappeler, K., Pospíšilová, V. Embryológia človeka: učebnica pre lekárske fakulty [online]. 2001.
8. Kolínová, M. Současné trendy péče o dítě s orofaciálním rozštěpem. Prakt Lék, 2011, 91, 3, s. 134–137.
9. Lakshmy, SR., Deepa, S., Rose, N., et al. First-trimester sonographic evaluation of palatine clefts: a novel diagnostic approach. J Ultrasound Med, 2017, 36, 7, p. 1397–1414.
10. Maarse, W., Berge, SJ., Pistorius, L., et al. Diagnostic accuracy of transabdominal ultrasound in detecting prenatal cleft lip and palate: a systematic review. Ultrasound Obstet Gynecol, 2010, 35, 4, p. 495–502.
11. Salomon, LJ., Alfirevic, Z., Berghella, V., et al. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol, 2011, 37, 1, p. 116–126.
12. Salomon, LJ., Alfirevic, Z., Bilardo, CM., et al. ISUOG practice guidelines: performance of first-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol, 2013, 41, 1, p. 102–113.
13. Sepulveda, W., Wong, AE., Martinez-Ten, P., Perez-Pedregosa, J. Retronasal triangle: a sonographic landmark for the screening of cleft palate in the first trimester. Ultrasound Obstet Gynecol, 2010, 35, 1, p. 7–13.
14. Smarius, B., Loozen, C., Manten, W., et al. Accurate diagnosis of prenatal cleft lip/palate by understanding the embryology. World J Methodol, 2017, 7, 3, p. 93–100.
15. SUKL. Souhrn údajů o přípravku Sp. zn. sukls 261225/2018.
16. Syngelaki, A., Chelemen, T., Dagklis, T., et al. Challenges in the diagnosis of fetal non-chromosomal abnormalities at 11–13 weeks. Prenat Diagn, 2011, 31, 1, p. 90–102.
17. Vokurková, J., Elstnerová, L., Lukášová, O., Hufová, I. Vývoj neonatální péče a zhodnocení zkušeností prvních pěti let operací rozštěpu rtu v neonatálním období. Čes-Slov Pediatrie, 2011, 66, 6, s. 356–362.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2020 Issue 5-
All articles in this issue
- Mají ženy rodící vaginálně po předchozím císařském řezu větší riziko avulzního poranění musculus levator ani?
- Typický rozštěp rtu a patra v 2D ultrasonografii
- Kompletní mola hydatidosa u perimenopauzální pacientky imitující zhoubný nádor dělohy
- Úspešné podanie trombolytickej liecby tehotnej pacientke s ischemickou náhlou cievnou mozgovou príhodou
- Laparoskopická sterilizace bilaterální salpingektomií – profylaktický benefit araritní komplikace
- Simplifikace odběru dělohy k transplantaci: robotický přístup a odtok krve ovariálními žílami
- Význam sentinelové uzliny u pacientek s časným karcinomem děložního hrdla
- Prehabilitace
- Klinický význam rutinního ultrazvukového screeningu růstové restrikce ve třetím trimestru gravidity
- Cervikální sekret – důležitý faktor reprodukce
- Suplementace vitaminem D a kalciem – význam v gynekologii
- Extrakorporeální rázová vlna v terapii indukované bolesti po perineálním poranění
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinický význam rutinního ultrazvukového screeningu růstové restrikce ve třetím trimestru gravidity
- Laparoskopická sterilizace bilaterální salpingektomií – profylaktický benefit araritní komplikace
- Kompletní mola hydatidosa u perimenopauzální pacientky imitující zhoubný nádor dělohy
- Cervikální sekret – důležitý faktor reprodukce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

