-
Medical journals
- Career
Incidence a terapie lymfocyst po provedené systematické pánevní a paraaortální lymfadenektomii – vlastní soubor
Authors: Z. Felsingerová; Luboš Minář; Vít Weinberger
Authors‘ workplace: Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
Published in: Ceska Gynekol 2014; 79(5): 388-392
Overview
Cíl studie:
Analýza incidence a terapie lymfocyst v souboru pacientek, které podstoupily systematickou pánevní a paraaortální lymfadenektomii v Onkogynekologickém centru Gynekologicko-porodnické kliniky v Brně v letech 2010–2012.Typ studie:
Retrospektivní studie.Název a sídlo pracoviště:
Onkogynekologické centrum, Gynekologicko-porodnická klinika LF MU a FN Brno.Metodika a soubor:
Hodnotíme retrospektivně soubor 111 operovaných pacientek, u kterých byla v letech 2010–2012 na naší Gynekologicko-porodnické klinice provedena pánevní a paraaortální lymfadenektomie. Zjišťujeme celkovou incidenci lymfocyst, které byly diagnostikovány na základě ultrazvukového vyšetření. Z celkového počtu lymfocyst pátráme po incidenci symptomatických lymfocyst a zjišťujeme, zda jejich incidence byla závislá na typu provedení systematické lymfadenektomie (pánevní a/nebo paraaortální), na typu gynekologického tumoru a jakým způsobem byly tyto symptomatické lymfocysty řešeny.Výsledky:
V letech 2010–2012 jsme provedli u 111 onkologických pacientek 78 pánevních a 33 pánevních a paraaortálních systematických lymfadenektomií. V souboru těchto pacientek jsme retrospektivně pátrali po incidenci lymfocyst. Lymfocysty byly detekovány pooperačně vaginálním či transabdominálním ultrazvukem (UZ) u 37 pacientek (33,3 %). Z celkového počtu 37 detekovaných lymfocyst bylo 24 lymfocyst klinicky asymptomatických a 13 symptomatických. Incidence symptomatické lymfocysty v našem souboru je 11,7 %. Prostou punkcí pod UZ kontrolou či chirurgicky jsme řešili pouze symptomatické lymfocysty. Z celkového počtu 37 lymfocyst jsme je pooperačně detekovali u 19 pacientek s karcinomem ovaria (51,4 %), u 12 pacientek s karcinomem hrdla dělohy (32,4 %), u čtyř pacientek s karcinomem těla dělohy (10,8 %), u jedné pacientky s karcinomem vejcovodu a u jedné pacientky s karcinomem peritonea (obě 2,7 %). V našem souboru jsme nezaznamenali statisticky významnou závislost incidence lymfocysty na typu provedené (pánevní a/nebo paraaortální) lymfadenektomie.Závěr:
Asymptomatické lymfocysty po provedené lymf-adenektomii nepředstavují pro pacientky takové riziko jako lymfocysty symptomatické, které vyžadují řešení. V našem souboru se pooperačně lymfocysta vyskytla s incidencí 33,3 %. Na celkový počet 111 pacientek, které podstoupily lymfadenektomii, jsme pozorovali 11,7 % symptomatických lymfocyst.
Do budoucna je zcela nutné standardizovat podmínky, za kterých je indikováno provedení systematické lymfadenektomie, abychom zachovali onkologickou bezpečnost chirurgického výkonu a zároveň dále zbytečně nezvyšovali pooperační morbiditu pacientek. Problematika prevence vzniku lymfocyst a detekce validních rizikových a protektivních faktorů jejich vzniku vyžaduje do budoucna prospektivní studie, které budou rozdělené dle jednotlivých typů gynekologických zhoubných nádorů.Klíčová slova:
pánevní a paraaortální lymfadenektomie, lymfocysty, incidenceÚVOD
Lymfocysta či lymfokéla je cystická rezistence vznikající v retroperitoneu po provedené systematické pánevní a/nebo paraaortální lymf-adenektomii. Lymfocysta je kolekce lymfy se silnou fibrotickou stěnou bez epiteliální výstelky. Patofyziologickým podkladem jejího vzniku je nekompletní lymfostáza s pooperačním únikem lymfy v tak velkém množství, že není možná její zpětná resorpce peritoneem. V lymfatických cévách není dostatek buněk hladké svaloviny, což brání jejich vazokonstrikci a lymfa obsahuje jen minimální množství trombocytů a koagulačních faktorů. Díky kombinaci těchto faktorů se lymfa hromadí v retroperitoneálním prostoru a může dojít ke zformování lymfocysty [15]. Většina lymfocyst je asymptomatických a jsou náhodným nálezem při pooperační kontrole (obr. 1, obr. 2).
Incidence lymfocyst po onkogynekologických výkonech s lymfadenektomií se pohybuje v širokém rozmezí 1–58 % [2, 9]. Medián jejich výskytu je zhruba 3 až 8 týdnů po operaci, někdy se mohou objevit až za jeden rok po operaci. Symptomatické lymfocysty vykazují incidenci 5–34,5 % [6]. Symptomy závisí na velikosti a útlaku okolních anatomických struktur. Lymfocysty mohou nejčastěji způsobovat bolest, sekundárně se infikovat, vést k tvorbě otoků dolních končetin, vzniku hluboké žilní trombózy, utlačovat močový měchýř a způsobovat obstrukci ureterů [7, 14].
METODIKA
Do této retrospektivní studie bylo konsekutivně zařazeno celkem 111 pacientek s pooperačním nálezem lymfocysty, které v letech 2010–2012 podstoupily v rámci radikálního onkogynekologického operačního výkonu systematickou pánevní či aortopelvickou lymfadenektomii bez uzavření peritonea nad operovanou oblastí. V souboru zjišťujeme incidenci symptomatických i asymptomatických lymfocyst, které byly diagnostikovány pomocí ultrazvuku. Ve skupině symptomatických lymfocyst sledujeme způsob a efektivitu jejich terapie. Popisujeme incidenci lymfocyst pooperačně v závislosti na typu gynekologického zhoubného nádoru a hodnotíme, zda přidání paraaortální lymfadenektomie statisticky významně zvyšuje incidenci pooperační lymfocysty oproti samostatně provedené pánevní lymfadenektomii. Analýza byla prováděna na hladině významnosti 0,05.
VÝSLEDKY
V letech 2010–2012 jsme provedli celkem 78 pánevních a 33 aortopelvických lymfadenektomií. V souboru 111 pacientek s provedenou pánevní a/nebo paraaortální lymfadenektomií jsme diagnostikovali pomocí UZ 37 lymfocyst, což odpovídá incidenci 33,3 %. Ze souboru 37 lymfocyst bylo 24 asymptomatických a 13 symptomatických. Incidence symptomatické lymfocysty je v našem souboru 11,7 %. Z celkového počtu 37 pacientek byl nejvyšší počet lymfocyst pooperačně pozorován u pacientek s karcinomem ovaria – celkem 19 (51,4 %), dále jsme lymfocystu detekovali u 12 pacientek s karcinomem hrdla dělohy (32,4 %), u čtyř pacientek s karcinomem dělohy (10,8 %), u jedné pacientky s karcinomem peritonea a jedné pacientky s karcinomem vejcovodu (obě 2,7 %), (graf 1).
Graph 1. Zastoupení jednotlivých malignit v souboru pacientek s detekovanou lymfocystou po provedené systematické lymfadenektomii 
Zajímalo nás, jestli incidence lymfocyst je závislá na typu provedené systematické lymf-adenektomie (pánevní a/nebo paraaortální). U 78 pacientek po provedené samostatné pánevní lymfadenektomii jsme detekovali 25 lymfocyst (36,36 %), u 33 pacientek s provedenou aortopelvickou lymfadenektomií jsme diagnostikovali 12 lymfocyst (32,05 %). Podle statistického vyhodnocení je tento rozdíl 4,31 % signifikantně nevýznamný, p = 0,6657 (tab. 2).
Téměř všechny lymfocysty byly diagnostikovány do šesti měsíců po operaci (tab. 1). Jejich detekce byla buď náhodná při dispenzarizační kontrole, nebo při kontrole z důvodů potíží pacientky. V našem souboru jsme přistoupili k operačnímu řešení jen v případě symptomatické lymfocysty. U celkem 13 symptomatických pacientek jsme provedli 10 punkcí pod UZ kontrolou (77 %), ve dvou případech (15 %) jsme marsupializovali lymfocystu laparoskopicky a v jednom případě (8 %) laparotomicky. Zjistili jsme, že u 10 lymfocyst (10 pacientek) řešených jednoduchou punkcí, došlo v průběhu 4 týdnů v šesti případech k recidivě. V jednom případě recidivy byla nutná laparotomická marsupializaci lymfocysty, u ostatních pěti recidiv byl zvolen konzervativní postup a lymfocysta v průběhu tří měsíců vymizela.
Table 1. Doba od operace, kdy byla lymfocysta poprvé detekována u všech pacientek po lymfadenektomii v našem souboru 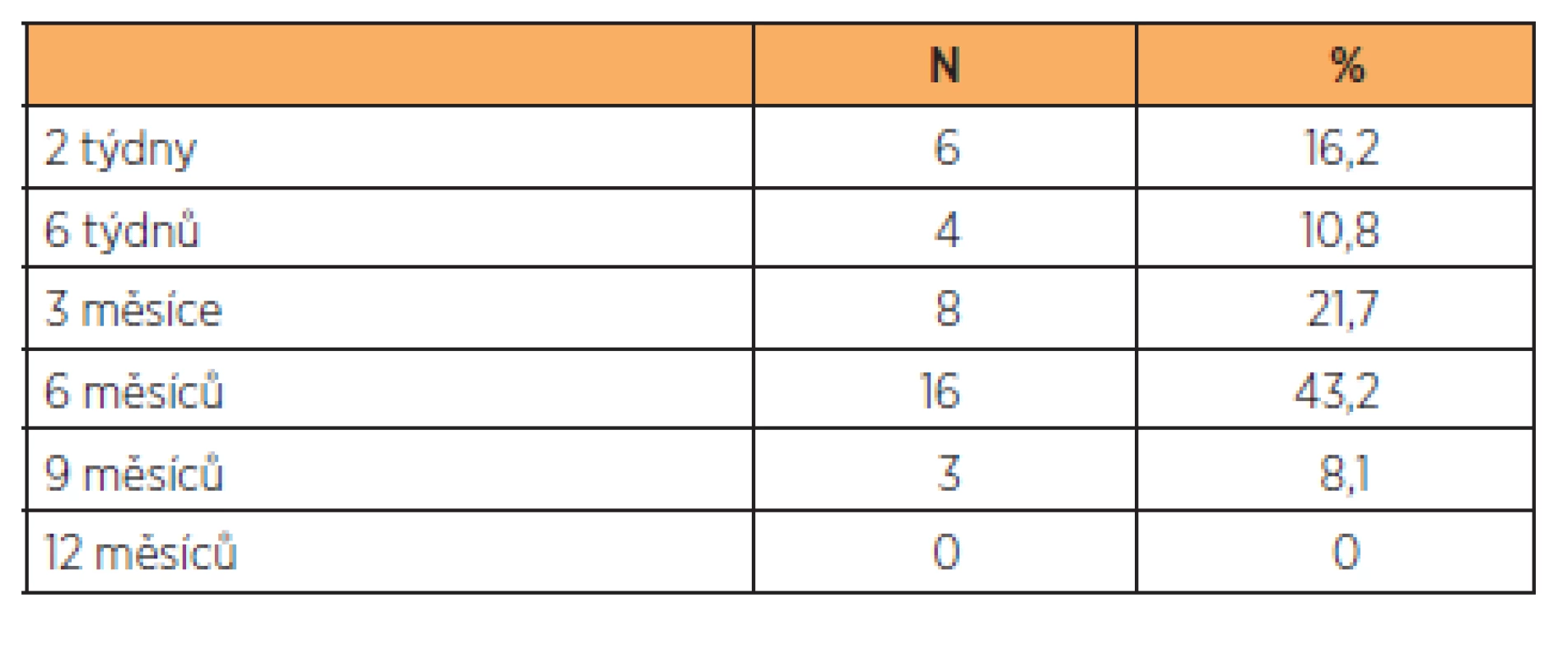
DISKUSE
V poslední době jsou zkoumány jak rizikové, tak protektivní faktory vzniku lymfocyst. Jako potenciálně rizikový faktor vzniku lymfocyst je zvažován počet a pozitivita odstraněných lymfatických uzlin s předpokladem růstu incidence lymfocyst s růstem počtu a pozitivity uzlin [11]. Mezi dalšími rizikovými faktory vzniku lymfocyst se zmiňují neoadjuvantní a adjuvantní chemoterapie a radioterapie [8]. Některé studie zaznamenaly nejvyšší incidenci lymfocyst po operacích u zhoubných nádorů hrdla dělohy, nižší u ovariálních nádorů a nejnižší u nádorů těla děložního [8]. V našem souboru bylo nejvíce lymfocyst detekováno u pacientek po operaci pro karcinom ovaria.
Dalším diskutovaným rizikovým faktorem je vliv laparoskopického či laparotomického operačního přístupu. V dosud největším publikovaném souboru srovnávajícím oba operační přístupy je popsána signifikantně nižší incidence lymfocyst ve skupině operované laparoskopicky [5]. Na druhou stranu v recentní retrospektivní Achouriho práci nebyl shledán rozdíl v incidenci vzniku lymfocyst mezi laparoskopickým a laparotomickým přístupem (z celkového počtu 31 pacientek s lymfocystou bylo 11 operováno laparoskopicky a 20 laparotomicky; OR 0,61; 95% CI 0,25–1,52). Dále se diskutuje o vlivu BMI a miniheparinizace na vznik lymfocyst [1]. Žádný z výše uvedených rizikových faktorů ale nebyl dosud jednoznačně akceptován a potvrzen v dosud publikovaných studiích.
Prokázaným protektivním faktorem je operační technika, při které je ponecháno otevřené peritoneum nad operovanou oblastí retroperitonea při onkochirurgickém výkonu. Za další protektivní faktor se považuje ponechání otevřeného poševního pahýlu, omentoplastika nebo využití nových metod, jako je ultracision a ligaclip. Ligaclip může uzavřít lymfatické cévy selektivně, a zabránit tak lymforee v pooperačním období. Podle výsledků studie Galotta a kolektivu byla zjištěna nižší incidence lymfocyst ve skupině pacientek operovaných pomocí ligaclipu než ve skupině s bipolární koagulací [4]. Z farmakoterapie je zmiňována jako slibná metoda pooperační aplikace oktreotidu. Preventivní drenáž za účelem snížení incidence lymfocyst po operaci se ukázala jako zcela neúčinná. Ve studii z let 1998–2000, která zkoumala vliv pooperační drenáže na tvorbu lymfocyst, se po 12 měsících od operace ukázala incidence symptomatické lymfocysty v rameni bez drénu 0,9 % a v rameni s drénem 5,9 %, což téměř dosáhlo statistické významnosti pro hypotézu, že drenáž retroperitonea naopak zvyšuje incidenci tvorby lymfocysty [3].
Zobrazovací metodou první volby v diagnostice lymfocyst je ultrazvuk. I v našem souboru jsme s výhodou kombinovali vaginální i abdominální přístup pro detailní zhodnocení retroperitonea. Lymfocysty nejčastěji obklopují externí ilické cévy nebo se nacházejí ve fossa obturatoria. Méně často jsou detekovány podél společných ilických cév a výše paraaortálně. V UZ obraze má lymfocysta (obr. 1, 2)tenkou stěnu a tekutý obsah různé echogenity. V případě zánětlivě změněné lymfocysty je patrný její nehomogenní nebo smíšený obsah a při zatlačení ultrazvukovou sondou bývá bolestivá. Další metodou zobrazení lymfocysty je CT vyšetření nebo magnetická rezonance malé pánve. Diferenciální diagnostika zahrnuje vyloučení urinomu, seromu, hematomu, abscesu a cystické recidivující neoplazie [6].
Image 1. UZ obraz unilokulární „ground glas“ lymfocysty v oblasti levé fossa obturatoria 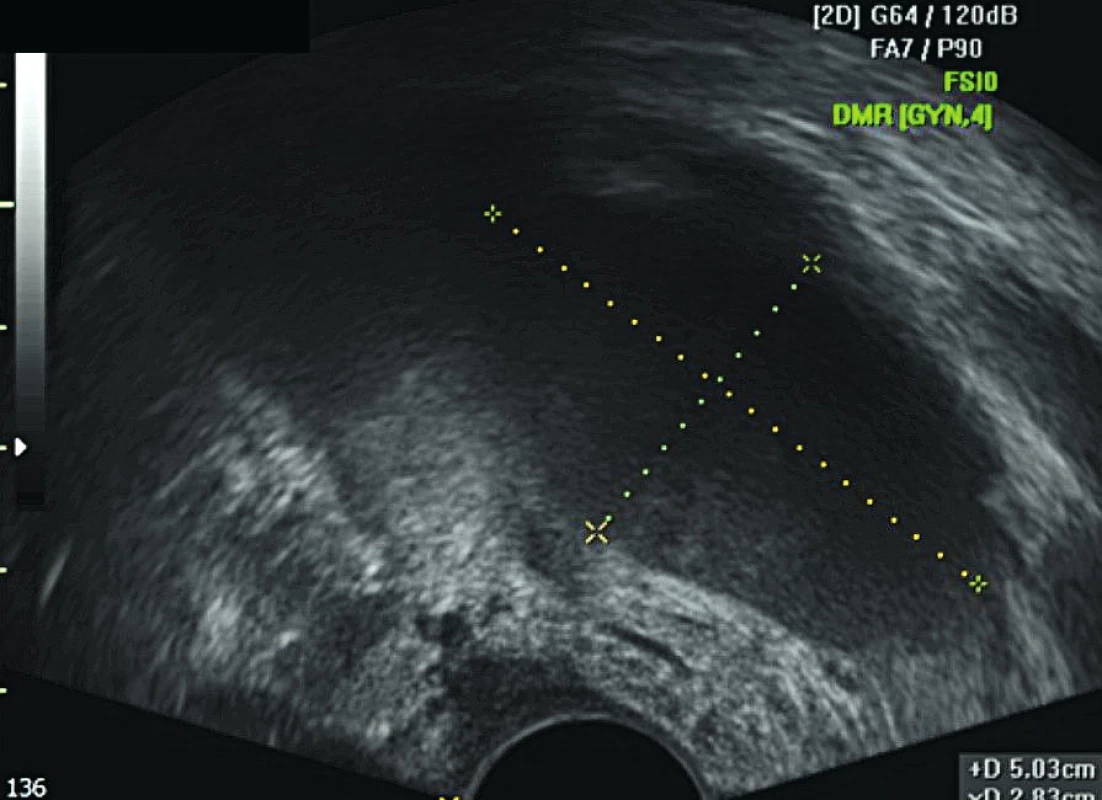
Image 2. UZ obraz unilokulární hypoechogenní lymfocysty s debris 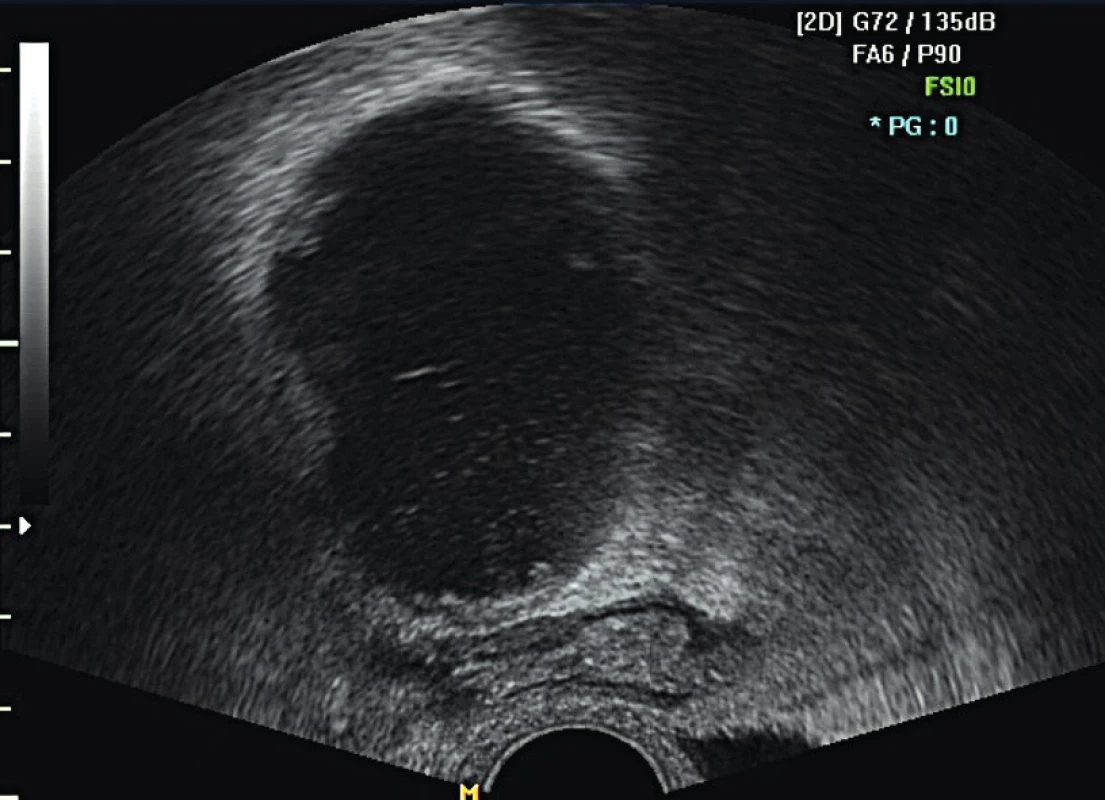
Lymfocysty bez klinických symptomů nevyžadují léčbu. U symptomatických lymfocyst jsme v našem souboru přistoupili aktivně k léčbě. Vždy se snažíme o co nejméně invazivní přístup. Perkutánní punkce a drenáž pod kontrolou UZ nebo CT je jednoduchá metoda, kterou lze kombinovat s aplikací sklerotizující látky, nejčastěji etanolu nebo betadine. Pouhá aspirace obsahu lymfocysty jehlou vykazuje nízkou úspěšnost, recidiva lymfocysty se uvádí v 80–90 %. I v našem souboru jsme zaznamenali recidivu lymfocysty po prosté punkci a odsátí v šesti případech z deseti, což znamená recidivu v 60 % případů. Klasickým chirurgickým řešením je otevřená břišní operace s marsupializací lymfocysty. Laparoskopicky provedená marsupia-lizace lymfocysty má výhodu miniinvazivního výkonu, ale není ve všech případech technicky proveditelná vzhledem k adhezím v dutině břišní po předchozím radikálním onkochirurgickém výkonu. Podle velké retrospektivní studie Lucewicze a kol. byla zaznamenána mnohem menší recidiva po laparoskopické intervenci v porovnání s otevřenou břišní operací nebo jednoduchou aspirací (8 % vs. 16 % vs. 59 %) [10]. Chirurgická léčba symptomatické lymfocysty v poslední době ustupuje do pozadí na úkor metod intervenční radiologie. V současnosti se klade důraz na včasnou prevenci lymfocyst.
Podle posledních pilotních studií jsou vyvíjeny nové metody, tzv. chirurgické zátky. Začíná se zkoušet kolagenová zátka připravená z koagulačních faktorů, která se jeví jako užitečná doplňková metoda redukce pooperační lymforey a prevence tvorby lymfocyst po systematické lymfadenektomii [12, 13].
ZÁVĚR
V našem souboru dosáhla celková incidence lymfocyst 33,3 %, což koresponduje s průměrnou incidencí popisovanou v literatuře. Nejvyšší výskyt lymfocyst jsme pozorovali pooperačně ve skupině pacientek s nádorem vaječníku. Rozšíření systematické pánevní lymfadenektomie o paraaortální oblast statisticky významně nezvyšovalo incidenci lymfocysty (tab. 2). Asymptomatické lymfocysty nepředstavují větší zdravotní riziko pro pacientky. Klinicky významné jsou především symptomatické lymfocysty, které vyžadují řešení. V předložené práci jsme pozorovali 11,7 % symptomatických lymfocyst na celkový počet 111 pacientek, které podstoupily lymfadenektomii. Do budoucna je nutné standardizovat podmínky, za kterých je indikováno provedení systematické lymfadenektomie, abychom zachovali onkologickou bezpečnost chirurgického výkonu a zároveň dále zbytečně nezvyšovali pooperační morbiditu pacientek. Problematika prevence vzniku lymfocyst a detekce validních rizikových a protektivních faktorů jejich vzniku vyžaduje do budoucna prospektivní studie rozdělené dle jednotlivých typů gynekologických zhoubných nádorů.
Table 2. Rozdělení lymfocyst podle typu provedené lymfadenektomie 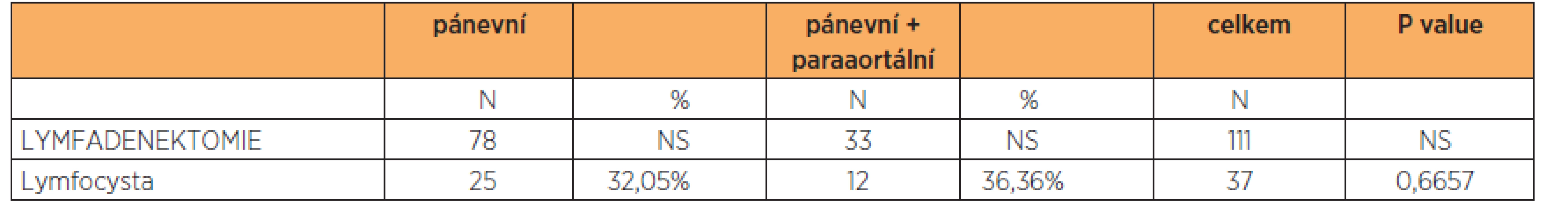
Rozdíl je 4,31 %, což dle Fisher exact test: p=0.6657 Práce vznikla za podpory MZ ČR – RVO (FNBr, 65269705).
korespondující autor
as. MUDr. Vít Weinberger
Onkogynekologické centrum
Gynekologicko-porodnická klinika FN a LF MUNObilní trh 11602 00 Brnoe-mail: v.weinberger@email.cz
Sources
1. Achouri, A., Huchon, C., Bats, AS., et al. Complications of lymphadenectomy for gynecological cancer. Eur J Surg Oncol, 2013, 39(1), p. 81–88.
2. Benedetti-Panici, P., Maneschi, F., Cutillo, G., et al. A randomized study comparing retroperitoneal drainage with no drainage after lymphadenectomy in gynecologic malignancies. Gynecol Oncol, 1997, 65(3), p. 478–482.
3. Franchi, M., Trimbos, JB., Zanaboni, F., et al. Randomised trial of drains versus no drains following radical hysterectomy and pelvic lymph node dissection: A European Organisation for Research and Treatment of Cancer Group (EORTCC - GCG) study in 234 patients. Eur J Cancer, 2007, 43(8), p. 1265–1268.
4. Gallotta, V., Fanfani, F., Rossitto, C., et al. A randomized study comparing the use of the Ligaclip with bipolar energy to prevent lymphocele during laparoscopic pelvic lymphadenectomy for gynecologic cancer. Am J Obstet Gynecol, 2010, 203(5), 483, e481–e486
5. Ghezzi, F., Uccella, S., Cromi, A., et al. Lymphoceles, lymphorrhoea, and lymphedema after laparoscopic and open endometrial cancer staging. Ann Surg Oncol, 2012, 19(1), p. 259–267.
6. Kim, HY., Kim, JW., Kim, SH., et al. An analysis of the risk factors and management of lymphocele after pelvic lymphadenectomy in patients with gynecologic malignancies. Cancer Res Treatment, 2004, 36(6), p. 377–383.
7. Ilancheran, A., Monaghan, JM. Pelvic lymphocyst – a 10 year experience. Gynecol Oncol, 1988, 29, p. 333–336.
8. Kim, HY., Kim, JW., Kim, SH., et al. An analysis of the risk factors and management of lymphocele after pelvic lymphadenectomy in patients with gynecologic malignancies. Cancer Res Treatment: official journal of Korean Cancer Association 2004, 36(6), p. 377–383.
9. Logmans, A., Kruyt, RH., De Bruin, HG., et al. Lymphedema and lymphocysts following lymphadenectomy may be prevented by omentoplasty: A pilot study. Gynecol Oncol, 1999, 75(3), p. 323–327.
10. Lucewicz, A., Wong, G., Lam, VW., et al. Management of primary symptomatic lymphocele after kidney transplantation: a systematic review. Transplantation, 2011, 92(6), p. 663–673.
11. Petru, E., Tamussino, K., Lahousen, M., et al. Pelvic and paraaortic lymphocysts after radical surgery because of cervical and ovarian cancer. Am J Obstet Gynecol, 1989, 161(4), p. 937–941.
12. SimonatoHYPERLINK „http://www.ncbi.nlm.nih.gov/pubmed?term=Simonato%20A%5BAuthor%5D&cauthor=true&cauthor_uid=19762048“ A, Varca V, Esposito M, Venzano F, Carmignani G. The use of a surgical patch in the preventionof lymphoceles after extraperitoneal pelvic lymphadenec-tomy for prostate cancer: a randomized prospective pilot study. J HYPERLINK „http://www.ncbi.nlm.nih.gov/pubmed/19762048“Urol 2009, 182(5), p. 2285–2290.
13. Tinelli, A., Mynbaev, OA., Tsin, DA., et al. Lymphocele prevention after pelvic laparoscopic lymphadenectomy by a collagen patch coated with human coagulation factors: a matched case-control study. Int J Gynecol Cancer, 2013, 23(5), p. 956–963.
14. Varga, Z., Hegele, A., Olbert, P., et al. Laparoscopic peritoneal drainage of symptomatic lymphoceles after pelvic lymph node dissection using methylene blue installation. Urol Int, 2006, 76, p. 335–338.
15. Weinberger, V., Zikán, M., Cibula, D. Lymphocele: prevalence and management in gynecological malignancies: Expert Rev Anticancer Ther, 2014, 3, p. 307–317.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 5-
All articles in this issue
- Vaginální vedení porodu koncem pánevním po ukončeném 36. týdnu gravidity u selektované skupiny těhotenství – analýza perinatálních výsledků let 2008–2011
- The influence of breach position of the second twinon perinatal outcomes in vaginal births of bichorial - biamniotic twins after 33rd week of gravidity
- Preeklampsie v těhotenství – predikce, prevence a další management
- Psychosomatické aspekty a léčba psychofarmaky v etiopatogenezi karcinomu endometria
- Genetické aspekty defektov panvového dna a stresovej močovej inkontinencie u žien
- Incidence a terapie lymfocyst po provedené systematické pánevní a paraaortální lymfadenektomii – vlastní soubor
- Extramamární Pagetova choroba vulvy – kazuistika
- Condylomata acuminata (genitální bradavice)
- Herbal terapie v průběhu těhotenství – mýty a fakta
- Významní gynekologové a porodníci pocházející z Klatovska
-
Zavedení systému léčby pooperační bolesti po císařském řezu v perinatologickém centru a jeho vyhodnocení:
retrospektivní observační studie - Individualizovaná chirurgická léčba cervikálních prekanceróz
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Condylomata acuminata (genitální bradavice)
- Preeklampsie v těhotenství – predikce, prevence a další management
- Vaginální vedení porodu koncem pánevním po ukončeném 36. týdnu gravidity u selektované skupiny těhotenství – analýza perinatálních výsledků let 2008–2011
- Extramamární Pagetova choroba vulvy – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

