-
Medical journals
- Career
Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
: D. Seidlová 1; J. Blatný 2
: II. ARO, FN Brno, LF MU Brno, prim. MUDr. D. Seidlová, Ph. D. 1; Oddělení dětské hematologie, FN Brno, PMDV, prim. MUDr. J. Blatný, Ph. D. 2
: Ceska Gynekol 2013; 78(4): 379-384
Peripartální život ohrožující krvácení je závažná a častá komplikace provázející porod. Diagnostika se opírá o stanovení velikosti krevní ztráty a příčiny krvácení, následuje porodnická a chirurgická léčba včetně využití i invazivních radiologických metod v kombinaci s resuscitační péčí založenou na podpoře orgánových funkcí a na míru přizpůsobené razantní substituci koagulačních komponent. Snahou je záchrana života rodičky a zachování jejích reprodukčních schopností.
Klíčová slova:
poporodní krvácení – porucha koagulace – děložní atonie – hysterektomie – fibrinogen – rFVIIaÚVOD
Peripartální krvácení je celosvětově nejčastější příčinou smrti v souvislosti s těhotenstvím a porodem, v České republice zemře každý rok na peripartální krvácení kolem 7–10 žen. Incidence PŽOK se ve vyspělém světě pohybuje kolem 2–5 % všech porodů [16, 22, 29]. Z tohoto důvodu vzešla z konsenzu českých odborných společností gynekologických, porodnických, anesteziologických, intenzivistických, hematologických a dalších klinická doporučení; byla poprvé publikována v roce 2008 a v roce 2011 byla podrobena revizi, přepracována a vydána jako mezioborové konsenzuální stanovisko pro léčbu peripartálního život ohrožujícího krvácení [3]. V tomto článku jsou specializované gynekologické postupy podány přehledově, autoři se soustředili především na patofyziologii vzniku koagulační poruchy spojené s PPH a celkových komplikací vznikajících na jejím podkladě a prezentují společný pohled intenzivisty a hematologa na léčbu takto závažného stavu.
DEFINICE, PATOFYZIOLOGIE
Fyziologická krevní ztráta u porodu je odhadována na 300–400 ml, ovšem kvalifikovaný odhad je v porodnictví obtížný. Je to způsobeno přítomností amniové tekutiny, možným zadržením krve v děloze či dutině břišnía/nebo ztrátami vznikajícími postupně v průběhu protrahovaného či obtížného porodu, zvláště pokud je spojen s porodnickým traumatem. Peripartální krvácení (peripartal haemorrhage – PPH) je definováno jako krevní ztráta vyšší než 500 ml u spontánního porodu, u císařského řezu vyšší než 1000 ml [7, 21, 25]. Život ohrožující krvácení (PŽOK) je, pokud krevní ztráta rychle narůstá a přesáhne 1500 ml a je-li spojena s rozvojem klinických a/nebo laboratorních známek tkáňové hypoperfuze [3]. Díky matrimoniálním kompenzačním mechanismům (zvýšený krevní volum v těhotenství, těhotenský hyperkoagulační stav a turniketový efekt kontrakce myometria po porodu) je rodička na krevní ztrátu do 1000–1500 ml připravena [25]. Pokud však velikost peripartální krevní ztráty převýší kompenzační možnosti organismu a/nebo jsou těhotenství a porod komplikovány i poruchou koagulace, dochází u rodičky k rozvoji koagulační poruchy spojené s různou měrou vyjádřené alterace celkového stavu vyúsťující k obrazu život ohrožujícího peripartálního krvácení. Příčiny PPH jsou rozličné, nejčastěji jsou nechirurgické a až z 80 % je velká krevní ztráta způsobená děložní hypotonií nebo atonií [2, 3, 4, 7, 16, 19, 21, 29]. Další častou příčinou bývá porodnické trauma nebo poruchy placentace. Koagulopatie vznikající na podkladě rozvoje DIC např. po embolii plodovou vodou nebo při HELLP syndromu jsou poměrně méně časté. Často však jde o různé kombinace výše uvedených mechanismů [2, 3, 4, 7, 16, 19, 21, 29.]
Při masivním krvácení vznikajícím z jakékoli příčiny je kapacita normálních koagulačních procesů limitovaná a při jejím překročení může docházet ke koagulopatii, a tím k dalšímu nekontrolovatelnému krvácení a případně exsangvinaci i u pacientů s primární normální hemostázou. Příčiny podmiňující rozvoj koagulopatie spojené s život ohrožujícím krvácením jsou multifaktoriální a vzájemně propojené [2, 15, 18, 20, 23]. Tkáňové poškození, anoxie a z ní rezultující acidóza spolu s hypotermií aktivují jak koagulační, tak fibrinolytický systém, což vede k dysfunkci a/nebo konzumpci destiček a koagulačních faktorů včetně kalcia. Dochází k aktivaci systémové zánětlivé odpovědi (SIRS). Je narušeno množství celulárních a humorálních mechanismů podílejících se na procesu hemostázy, prohlubuje se koagulační porucha a krvácení progreduje. Zmenšuje se rezerva koagulačních faktorů a trombocytů nutných pro adekvátní srážení. Masivní volumoterapie většinou chladnými roztoky krystaloidů, koloidů nebo aplikací erytrocytárních koncentrátů vede k dalšímu poklesu teploty a k extrémní diluci v té chvíli již omezeného množství koagulačních faktorů a destiček a to celou situaci dále zhoršuje. Preeklampsie, HELLP syndrom, chronická onemocnění primárně s těhotenstvím nesouvisející, jako diabetes mellitus, renální onemocnění nebo primární poruchy koagulace atd., jsou samy o sobě již velmi závažným rizikovým faktorem při vzniku ŽOK [21, 24, 28]. Zároveň je nutno zdůraznit, že rutinní koagulační testy se provádějí za teploty odpovídající normální tělesné teplotě a nereflektují stupeň hemostatické poruchy vznikající in vivo při hypotermii a odrážejí stav koagulace v době, kdy byly odebrány, nikoli v čase, kdy dostáváme výsledky [23, 26, 28].
Terapie ŽOK se opírá o aplikaci krevních komponentů umožňující na míru přizpůsobené podání erytrocytů, destiček, plazmy, fibrinogenu či dalších koagulačních faktorů. Tato strategie je konstruována tak, aby se snížilo riziko vzniku potenciálně škodlivých účinků podání transfuzí a krevních derivátů a odstranění nadbytečných součástí transfuzí. Krevní ztráta a reakce organismu na ni je velmi dynamický proces, do kterého vstupují i fyziologické rozdíly mezi jednotlivci, již podaný objem a druh krevní náhrady, vzniklý stupeň koagulopatie a klinický stav pacienta [23, 26, 28].
Na závěr je třeba zmínit, že příčiny peripartálního krvácení jsou rozličné, často se navzájem kombinují a spolupůsobí a označit jednu konkrétní nozologickou jednotku je velmi obtížné. Do takto již patofyziologicky komplikovaného stavu zasahujeme medicínsky. Rozvoj krvácivých projevů je u rodiček velmi rychlý, děloha představuje obrovskou rannou plochu; riziko exsangvinace v průběhu několika málo minut je extrémně vysoké. Situaci dále komplikuje i nutný ohled na bezpečnost rodícího se dítěte a snaha porodníka o zachování reprodukčních schopností rodičky [3].
Predikce PŽOK je velmi obtížná, existují rizikové faktory, se kterými je spojen častější výskyt PPH: Předchozí abrupce placenty a poruchy placentace, urgentní sectio caesarea, preeklampsie, retence placenty, mediolaterální epiziotomie, mnohočetné těhotenství, operativní vaginální porod, prolongovaný porod (>12 hod) a velký plod (>4 kg), pokles hladiny fibrinogenu [7, 19, 22].
Diagnostika se opírá o gynekologické vyšetření se snahou o lokalizaci krvácení vyšetřením v zrcadlech, palpačně bimanuálně i sonograficky s kvalifikovaným odhadem krevní ztráty, za zhodnocení celkového stavu pacientky. Laboratorní vyšetření mají jen pomocný charakter.
TERAPEUTICKÝ POSTUP
Kontrola krvácení pomocí gynekologických i chirurgických postupů, eventuálně v kombinaci s embolizací přívodných cév, za kontinuálně probíhající celkové léčby, jejímž cílem je normalizace koagulačních pochodů a stabilizace stavu pacientky. Rozdělení na část chirurgickou a konzervativní, tedy nechirurgickou, je čistě didaktické, nelze je od sebe oddělit. Každé gynekologicko-porodnické pracoviště musí mít vypracovaný pro PŽOK tzv. krizový plán, který vymezuje organizační a odborné role jednotlivých členů krizového týmu, určuje minimální rozsah vybavení pracoviště [3] a je přizpůsoben personálním a technickým možnostem daného zdravotnického zařízení.
Gynekologická diagnostika a léčba
Gynekologická diagnostika a léčba [3] jsou spolu se speciálními porodnickými postupy a medikamenty včetně podání uterotonik plně v rukou porodníka a probíhají současně s konzervativní léčbou. Porodník ve spolupráci s porodní asistentkou musí především identifikovat příčinu a zdroj krvácení a správně odhadnout krevní ztrátu. Základem je vyšetření v zrcadlech, palpační bimanuální vyšetření a vyšetření ultrazvukem. Je nutno odlišit, zda se jedná o krvácení způsobené poruchou koagulace (embolie plodovou vodou), traumatem, nebo ato/hypotonií dělohy. Tyto příčiny se samozřejmě mohou kombinovat. Pokud ovšem nebude dosaženo kontroly zdroje krvácení, je nereálné očekávat zlepšení celkového stavu pacientky.
Při rozvratu koagulace, např. po embolii plodovou vodou, je na místě především celková léčba, která je zmíněna dále, a eventuální okamžité ukončení gravidity s ohledem na záchranu plodu.
V případech traumatu dělohy a porodních cest je zásadní odhalení místa traumatu a následné chirurgické řešení. Je nutná pečlivá revize porodních cest a při podezření na poranění dělohy neváhat s laparotomickou intervencí a následným výkonem podle nálezu. S výhodou je možno využít i pomoci intervenční radiologie, pokud je dostupná.
Při poruchách placentace je přístup k pacientce velmi individuální, postup závisí na vlastním nálezu. U komplikovaných stavů je na místě zvážit transport pacientky na adekvátně personálně i technicky vybavené pracoviště.
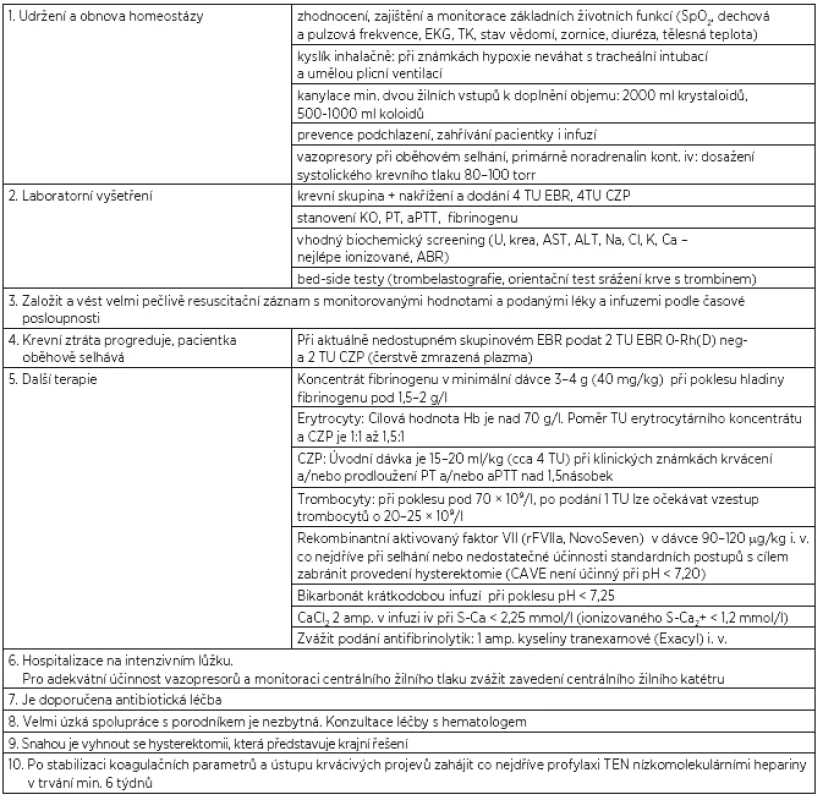
Pokud je diagnostikována hypo/atonie dělohy, je indikováno podání uterotonik i.v. a další léčba v několika krocích, které následují při neúspěchu léčby krokem předchozím. Léčbu hypo/atonie obsahuje v přehledu tabulka 1.
Hysterektomie představuje pro ženu radikální zákrok. Proto by k jejímu provedení mělo být přistupováno velmi uvážlivě: je indikována pouze při pokračující PŽOK přes vyčerpání všech dostupných léčebných postupů nebo u devastujícího poranění dělohy, eventuálně pokud je děloha předpokládaným zdrojem sepse.
Konzervativní – celková léčba [3] je většinou v rukou anesteziologa/intenzivisty, který je přivolán při stanovení diagnózy PŽOK – tedy krevní ztráty převyšující 1500 ml a/nebo při alteraci celkového stavu rodičky.
Dostatečná hladina fibrinogenu (nad 2 g/l!!) má pro obnovení normálního koagulačního stavu naprosto zásadní význam [1, 2, 11, 13, 23, 26]. Není-li k dispozici fibrinogen, je možno podat kryoprecipitát (CAVE! dostatečné množství představuje 12–14 TU kryoprecipitátu s nutností AB0 kompatibility!!) [1]. Okamžitá dostupnost koncetrátu fibrinogenu je v porodnictví nezbytná. Autoři doporučují, aby každé porodnické pracoviště mělo k dispozici minimálně 8 g koncentrátu fibrinogenu. Podání rekombinantního aktivovaného faktoru VII (rFVIIa, NovoSeven) v dostatečné dávce je indikováno v případě, že selhávají standardní postupy a hrozí provedení hysterektomie; podání je možno opakovat. Dostupnost rFVIIa je pro porodnické pracoviště rovněž výhodou. Lze v tomto případě využít i hot-line na jeho dovoz z nejbližší krevní banky, kde je na skladě [6, 24, 25]. Cílem diagnostického a terapeutického postupu je zlepšení celkového stavu pacientky, nikoli normalizace laboratorních hodnot.
Postup při celkové léčbě zachycuje tabulka 2.
ZÁVĚR
PŽOK je závažná a častá komplikace provázející porod. Naprosto zásadní roli v léčbě hraje diagnostika – tedy odhalení a stanovení velikosti krevní ztráty a příčiny krvácení. Pouze velmi rychlá porodnická a chirurgická léčba a využití i invazivních radiologických metod v kombinaci s resuscitační péčí založenou na podpoře orgánových funkcí a na míru přizpůsobené razantní substituci koagulačních komponent může vést k záchraně života rodičky a zachování jejích reprodukčních schopností.
MUDr. Dagmar Seidlová, Ph.D.
II. ARO, FN
Jihlavská 20
600 00 Brno
e-mail: dseidlova@fnbrno.cz
Sources
1. Ahmed, S., Harrity, C., Johnson, S., et al. The efficacy of fibrinogen concentrate compared with cryoprecipitate in major obstetric haemorrhage–an observational study. Transfusion Med, 2012, 22, 5, p. 344–349.
2. Alfirevic, Z., Elbourne, D., Pavord, S., et al. Use of recombinant activated factor VII in primary postpartum hemorrhagie. The northern european registry 2000–2004. Obstet Gynecol, 2007, 110, p. 1270–1278.
3. Balík, M., Binder, T., Blatný, J., et al. Peripartální život ohrožující krvácení – mezioborové konsenzuální stanovisko. Čes Gynek, 2013, suppl., s. 38–40.
4. Barillari, G., Frigo, M., Casarotto, M., et al. Use of recombinant activated factor VII in severe post-partum haemorrhage: Data from Italian Registry A multicentic observational retrospective study. Trombosis Res, 2009, 6, p. 41–47.
5. Blatný, J., Cvachovec, K., Černý, V., et al. Zásady podpory koagulace u život ohrožujícího a neztišitelného krvácení – konsenzuální stanovisko. Anest Intenziv Med, 2006, 6.
6. Blatný, J., Seidlová, D., Penka, M., et al. Severe postpartum haemorrhage treated with recombinant activated factor VII in 80 Czech patients: analysis of the UniSeven registry. Int J Obstet Anest, 2011, 20, 4, s. 367–368. doi:10.1016/j.ijoa.2011.07.008.
7. Binder, T. Šokové stavy v porodnictví. Moderní porodnictví. Praha: Grada, 2008, s. 303–304.
8. Duffy, MR. Guidelines for use of recombinant factor VIIa in life-threatening post-partum haemorrhage. Int J Obstet Anesth, 2007, 16, p. 299–300.
9. Feyereisl, J. Závažné postpartální hemoragie a doporučený postup k léčbě. Čes Gynek, 2008, 73, 6, s. 375–376.
10. Haynes, J., Laffan, M., Platt, F. Use of recombinant activated factor VII in massive obstetric haemorrhage. Int J Obstet Anesth, 2007, 16, p. 40–49.
11. Hedner, U. Mechanism of action, development and clinical experience of recombinant FVIIa. J Biotechnol, 2006, 124, p. 747–757.
12. Franchini, M., et al. A critical review on the use of recombinant factor viia in life-threatening obstetric postpartum hemorrhage. Semin Thromb Hemost, 2008, 34, p. 104–112.
13. Hedner, U. Mechanism of action, development and clinical experience of recombinant FVIIa. J Biotechnol, 2006, 124, p. 747–757.
14. Holub, Z., Feyereisl, J., Kabelik, L. Successful treatment of severe post-partum bleeding after caesarean section using recombinant activated factor VII. Ces Gynek, 2005, 70, p. 144–148.
15. Hsia, CC., Chin-Yee, IH., McAlister, VC. Use of recombinant activated factor VII in patients without hemophilia. A meta-analysis of randomized control trials. Ann Surg, 2008, 248, p. 61–68.
16. Khan, KS., Wojdyla, D., Say, L., et al. WHO analysis of maternal death; a systematic review. Lancet, 2006,367, p. 1066–1074.
17. Mannová, J., Petrenko, M., Seidlová, D. Aktivovaný rekombinantní faktor VII u závažného poporodního krvácení: kazuistiky Prakt Gyn, 2007, 14, 4, s. 171–176.
18. Mayo, A., Martinowitz, U., Kluger, Y. Coagulopathy in the critically injured patient. Yearbook of Intensive Care and Emergency Medicine, 2006, p. 232–243.
19. Mousa, HA., Cording, V., Alfirevic, Z. Risk factors and interventions associated with major primary postpartum hemorrhage unres-ponsive to first-line conventional therapy. Acta Obstet Gyn Scand, 2008, 87, p. 652–661.
20. Rossaint, R., Bouillon, B., Cerny, V., et al. Management of bleeding following major trauma: an updated European guideline. ccforum.com/content/pdf/cc8943.pdf 2010.
21. Roztočil, A. Nepravidelnosti III. doby porodní. Moderní porodnictví. Praha: Grada, 2008, s. 298–301, 307–309.
22. Rodička a novorozenec 2008, 2007. Praha: Ústav zdravotnických informací a statistiky ČR.
23. Rossaint, R., Spahn, DR. Trauma: bleeding, coagulopathy and blood component transfusion. Yearbook of Intensive Care and Emergency Med, 2006, p. 255–264.
24. Seidlová, D., Blatný, J., Penka, M., et al. Rekombinantní aktivovaný faktor VII v léčbě závažného poporodního krvácení. Data z registru UniSeven v České republice. Anest Intenziv Med, 2010, 5.
25. Seidlová, D., Blatný, J. Konzervativní léčba poporodního krvácení. In Kritické stavy v porodnictví. 1. vyd. Praha, Kamenice: Galén, MCC Publishing, 2012. s. 119–122. ISBN 978-80-7262-949-7.
26. Spahn, DR., Bouillon, B., Cerny, V., et al. Management of bleeding and coagulopathy following major trauma: an updated European guideline. Crit Care, 2013, 17, R76.
27. Sobieszczyk, S., Breborowiciz, GH., Platicanov, V. Recombinant factor VIIa in the management of postpartum bleeds; an audit of clinical use. Acta Obstet Gyn, 2006, 85, p. 1239–12347.
28. Vincent, JL., Rossaint, RB., Ozier, YZDD., Spahn, DR. Recommendations on the use of recombinant activated factor VII as an adjunctive treatment for massive bleeding – a European perspective. Crit Care, 2006, 10, 4, p. 120.
29. Zhang, W., Alexander, S., Bouvier-Colle MacFarlane, A., MOMS-B Group. Incidence of severe pre-eclampsia, postpartum haemorrhage and sepsis as a surrogete marker of severe maternal morbidity in a European population-based study: the MOMS-B survey. BJOG, 2005, 112, p. 89–96.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 4-
All articles in this issue
- The injury of bladder without penetrate during the TVT surgery for stress incontinence
- Antibiotical prophylaxy in gynecology
- Umbilical cord blood soluble Toll-like receptor 2 in pregnancies complicated by preterm premature rupture of membranes
- Rapid detection of the most common chromosomal aneuploidies in the second-trimester amniotic fluid using QF-PCR
- Peripartal life-threating haemorrhage – intensive care and haematological treatment
- Nocturnal polyuria, treatment with desmopressin
- Current issues of assisted reproductionin the Czech Republic
- Theoretic and practical content of the clinical embryology
- Department of Gynecology and Obstetricin Faculty Hospital KV fifty years ago and today
- Diagnosis of minimal breast cancers
- Laparoscopic treatment of borderline ovarian tumorsin fertile women
- Cooperation between mammologist and radiodiagnostic in the management of mammary leasions in the University Hospital Kralovské Vinohrady
- Retrospective analysis of effectiveness of transvaginal ultrasound in the detection of ectopic pregnancy
- The importance of circulating tumor cells in the diagnostic and therapeutic process in ovarian cancer
- Position of targeted therapy in ovariancancer management
- Vulvar melanoma
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vulvar melanoma
- Laparoscopic treatment of borderline ovarian tumorsin fertile women
- Nocturnal polyuria, treatment with desmopressin
- Peripartal life-threating haemorrhage – intensive care and haematological treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career