-
Medical journals
- Career
Obstrukční spánková apnoe ve vztahu k ortodontické léčbě u dětských pacientů
Authors: Z. Vranková 1; P. Turčáni 2; P. Horník 3; A. Bryšová 1; L. Izakovičová Hollá 1; P. Černochová 1; P. Bořilová Linhartová 1,4
Authors‘ workplace: Stomatologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice u sv. Anny, Brno 1; Klinika nemocí plicních a tuberkulózy, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Bohunice, Brno 2; Dětské ORL, s. r. o., Brno 3; Ústav patologické fyziologie, Lékařská fakulta Masarykovy univerzity, Brno 4
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 120, 2020, 1, s. 13-25
Category: Review Article
Overview
Předmět sdělení, cíl: Obstrukční spánková apnoe (OSA) je definována jako úplný nebo částečný kolaps horních cest dýchacích (HCD) vedoucí k hypopnoe až apnoe. Tento kolaps se během noci může několikrát opakovat. Vzhledem k tomu, že se tato porucha dýchání vázaná na spánek (SRBD, Sleep-related breathing disorder) projevuje jinak u dospělých a u dětí, existuje samostatná diagnóza, tzv. OSA dětského věku. U většiny dětí s OSA můžeme pozorovat hlasité noční chrápání, dýchání ústy, narušenou kontinuitu spánku a jeho architekturu, tedy střídání spánkových stadií. OSA má proto vliv nejen na fyzické, ale i na mentální zdraví dítěte a jeho správný vývoj. Stanovení diagnózy, nejpřesněji pomocí polysomnografického vyšetření (PSG), a následně zvolení adekvátní terapie by mělo proběhnout co nejdříve. Mezi rizikové faktory OSA u dětí se řadí neuromuskulární onemocnění, obezita, zvětšené krční či nosní mandle nebo kraniofaciální malformace.
Cílem tohoto přehledového článku je nastínit vztah mezi OSA a ortodontickými anomáliemi u dětí a shrnout současné postupy při jejich terapii.
Z kefalometrických studií u dětských pacientů trpících OSA vyplývají určité kraniofaciální znaky, které mohou ovlivňovat průchodnost HCD, a podílet se tak na vzniku či zhoršení této poruchy. Jedná se například o růstovou posteriorotaci mandibuly a zvýšenou divergenci čelistních bazí, často viditelnou i na frontálně otevřeném skusu a nedostatečném retním uzávěru. U pacientů bývá přítomna druhá skeletální třída s výraznějším incizálním schůdkem, mají retrognátní typ obličejového skeletu a je redukována anterio-posteriorní dimenze kostěné části nazofaryngu. Riziková je i mikrognácie či mikrogenie, zúžený nazomaxilární komplex, vysoké a úzké patro, projevující se často zkříženým skusem. Zkoumá se také vliv ageneze či předčasných ztrát zubů. Nerovnováha ve vývoji orofaciálních struktur v raném dětství může vést k narušení normálního vývoje kostěné opory HCD, a tím i ke zvýšení rizika jejich kolapsu a rozvoji SRBD.
Závěr: Správně načasovaná ortodontická léčba u dětí s dysmorfismem, vedoucím k zúženým HCD, může stimulovat růst či změnu polohy čelistí, zlepšit tak jejich správný vývoj a zároveň snížit riziko kolapsu HCD. Ortodontická léčba proto patří mezi terapeutické přístupy u OSA dětských pacientů s kraniofaciálními anomáliemi, přičemž klíčovým aspektem při terapii tohoto onemocnění je interdisciplinární přístup.
Klíčová slova:
obstrukční spánková apnoe dětského věku – poruchy dýchání vázané na spánek – kraniofaciální znaky – dysmorfismus – ortodontická terapie – polysomnografie
OBSTRUKČNÍ SPÁNKOVÁ APNOE DĚTSKÉHO VĚKU, SYMPTOMY A PREVALENCE
Obstrukční spánková apnoe (OSA) se řadí mezi poruchy vázané na spánek. Základní pojmy k problematice těchto poruch jsou definovány v tab. 1 [1–4].
Table 1. Základní definice k problematice poruch dýchání vázaných na spánek
Tab. 1 Basic definitions often used in the problematics of sleep-related breathing disorders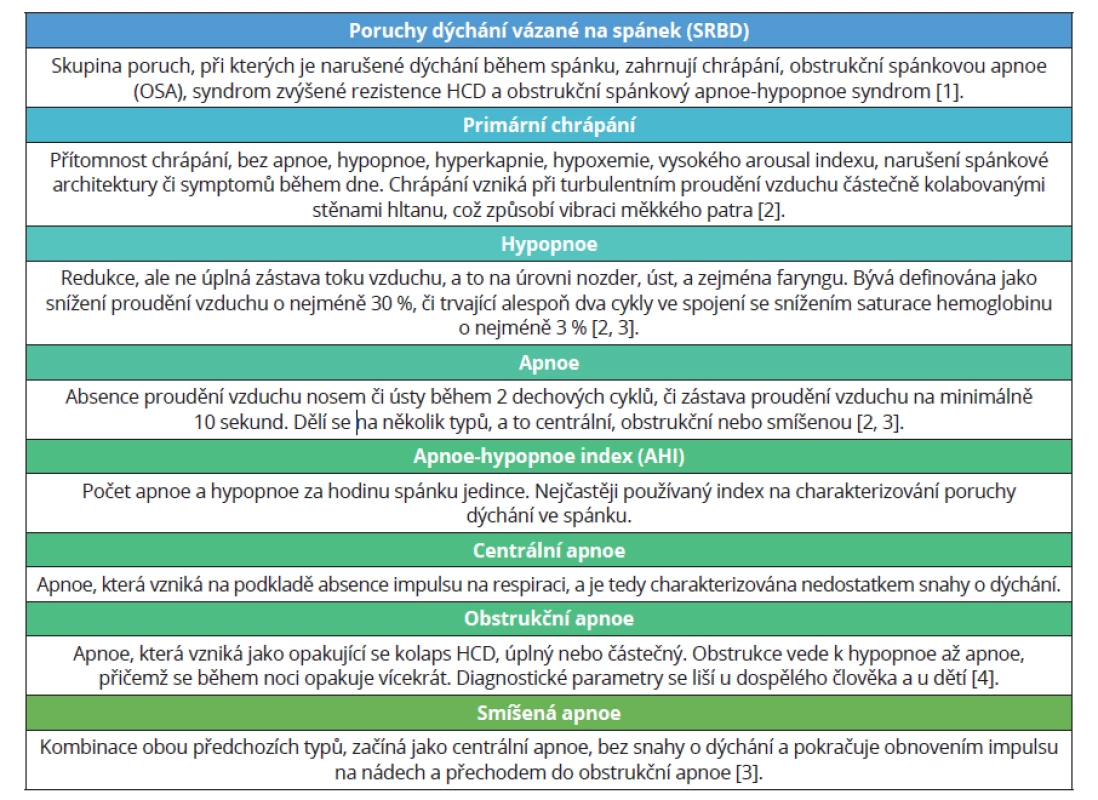
Několik studií poukazuje na odlišné projevy a management OSA u dětí a dospělých pacientů. U dospělých se mezi rizikové faktory řadí zejména nadváha až obezita s centrální distribucí tuku, široký obvod krku, abnormality v HCD. Za suspektní faktory zvyšující riziko onemocnění se považuje menopauza, kouření či požívání alkoholu před spánkem. Mezi symptomy patří hlasité chrápání nebo kašel a projevuje se zejména excesivní denní únavou, ospalostí a psychosociálními problémy [5].
V rámci OSA se v roce 1976 poprvé vyčlenila jako samostatná diagnóza OSA dětského věku, kterou lze diagnostikovat podle specifických symptomů [6]. U dětí se mezi nejčastější symptomy řadí denní únava, ospalost či naopak hyperaktivita, neschopnost soustředit se a s tím spojené horší výsledky ve škole, nesociální, problémové chování a změny osobnosti. Z klinických symptomů šlo hlavně o hypertenzi, akutní srdeční nebo kardiopulmonální selhání a časté infekce HCD. Ve většině případů bylo zjištěno hlasité noční chrápání, dýchání ústy, narušená kontinuita spánku a jeho architektura, noční můry, probouzení, pocení, nespavost, pomočování, náměsíčnost, deprese či jiné problémy [6–12]. Vzhledem k výše zmíněným projevům je očividné, že OSA neovlivňuje pouze fyzické, ale i mentální zdraví a psychický vývoj dítěte. I z tohoto důvodu je důležité OSA diagnostikovat a správně léčit co nejdříve.
Ve skupině OSA dětského věku se navíc vymezuje zvláštní kategorie vyskytující se u kojenců, a to vzhledem k jejich odlišné anatomické a fyziologické predispozici k abnormalitám ve výměně plynů a případné obstrukci (např. výše uložený larynx, zvýšená poddajnost hrudní stěny, poruchy v rámci párování ventilace a perfuze či nestabilní kontrola výměny plynů) [13].
Prevalence poruch dýchání vázaných na spánek u dětí je pravděpodobně vyšší, než se kdysi předpokládalo, a to v důsledku nedostatku standardů pro jejich diagnostiku [14, 15].
MECHANISMUS VZNIKU OSA U DĚTÍ
Kontrola svalového tonu hltanu, jakož i schopnost jeho reflexní odpovědi, je během bdění a spánku odlišná. Jeho změna může vést k snadnějšímu zúžení hltanu, zvýšení odporu v HCD a k jejich rychlejšímu kolapsu. V noci ke snadnějšímu kolapsu dýchacích cest přispívá i horizontální poloha ve spánku. I když je hltan schopný měnit svůj průsvit, na průměr horních cest dýchacích mají vliv i okolní kostěné struktury, jejichž anatomie může přispívat k snadnějšímu kolapsu [16].
Apnoe a hypopnoe, které se během OSA několikrát opakují, jsou ukončeny tzv. probouzející reakcí, která nastane na základě neustále stoupající inspirační svalové snahy během apnoe. K této reakci napomáhají i chemoreceptory, které zaznamenají navozenou hypoxii a hyperkapnii. Probuzení, ať už částečné, nebo úplné, ukončí apnoe a odpor v dýchacích cestách opět poklesne. Toto probouzení však způsobuje fragmentaci spánku, a narušuje tak jeho kvalitu a kvantitu se všemi následky, které se přenesou do života jedince [17].
RIZIKOVÉ FAKTORY
Rizikové faktory vzniku OSA u dětí jsou komplexní. Různé studie k nim zařazují například obezitu, adenoidní vegetaci v souvislosti s lokální infekcí či zánětem, neuromuskulární faktory, jako např. abnormálně snížený tonus svalů během spánku.
Rodinný výskyt OSA i studie na dvojčatech poukazují také na genetický podklad; podíl genetické složky se odhaduje na 35–40 %. Předpokládá se, že v etiopatogenezi OSA jsou zapojeny geny související s vývojem kraniofaciálních struktur, distribucí tělesného tuku a s nervovou kontrolou dýchacích svalů, tedy svěračů a zdvihačů hltanu [18]. Také epigenetické vlivy mohou u OSA představovat důležitý determinant zánětlivého fenotypu [19]. U závažné OSA byly také zjištěny zvýšené počty bakterií rodu Streptococcus, Prevotella a Veillonella oproti složení nazálního mikrobiomu u zdravých osob. Kompozice orálního mikrobiomu byla rovněž u pacientů s OSA asociována se zánětlivými biomarkery [20].
Mezi rizikové faktory OSA u dětí, k jejichž diagnostice mohou přispět právě zubní lékaři, se řadí krátká sublinguální uzdička, ústní dýchání, ageneze či předčasná ztráta zubů a kraniofaciální malformace [21–23]. Riziko vzniku OSA u dětí samozřejmě stoupá při kombinaci několika současně se vyskytujících rizikových faktorů, schematicky znázorněných na obr. 1, a s jejich rostoucí závažností.
Image 1. Souhrn faktorů objevujících se často u dětí trpících OSA
Fig. 1 Summary of factors often occurring in children suffering from OSA
Krátké sublinguální frenulum
Sublinguální frenulum neboli slizniční řasa, která spojuje jazyk a spodinu dutiny ústní, se po narození fyziologicky ztenčuje. Pokud však nedochází k dostatečnému ztenčení, může zůstat krátká a pevná, a zabraňovat tak pohybům jazyka v plném rozsahu, zejména jeho elevaci. Nejlehčí forma, známá jako blanitá uzdička, si většinou nevyžaduje chirurgický zákrok, protože jsou svaly jazyka správně utvářeny a jazyk je pohyblivý. Druhou formou je střední podjazykové frenulum, kde je přítomna pevná vazivová struna mezi karunkulami a jazykem, a jazyk tak nelze zcela vypláznout. Levá a pravá polovina jazyka může obsahovat jizevnatou tkáň, takže chirurgické uvolnění je plně indikováno. Nejzávažnější formou poruchy je jazyk plně nasedající na spodinu dutiny ústní. Nacházíme zde širokou bázi svalu nasedající za dolní řezáky s minimem sliznice, tudíž není možná koordinace mezi pohybem jazyka a sáním. Plastická chirurgie je nutná již v neonatálním či kojeneckém věku [24]. Pokud v indikovaném případě není frenulum včas uvolněno, jsou narušeny funkce, jako je sání, polykání, žvýkání či řeč, které jsou důležité pro správný vývoj kraniofaciálních struktur. Nedochází ani k dostatečné stimulaci patrového švu, což může vést k abnormálnímu růstu maxilly, vzniku laterálně zkříženého skusu, disproporci v mandibulárním růstu či retrognácii, tedy k vytvoření znaků asociovaných s OSA u dětí [24, 25]. V jiné studii autoři poukazují na to, že samotné odstranění krátkého frenula nemusí vést k automatické či úplné úpravě dýchání, a proto je někdy vhodné u starších dětí doplnit tento zákrok i myofunkční terapií [26].
Studie z roku 2016 od Guilleminault a kol. se účastnilo 150 dětí s diagnostikovanou OSA, přičemž 63 z nich mělo krátké sublinguální frenulum a nebyla u nich přítomna hypertrofie nosní mandle, zatímco 87 dětí mělo fyziologické sublinguální frenulum, ale trpělo hypertrofií nosní mandle. U dětí trpících OSA a krátkým sublinguálním frenulem byly často patrné abnormální anatomické nálezy ve formě vysokého a úzkého patra. U 60 z nich byla pozitivní rodinná anamnéza zkráceného frenula [27, 28].
Ústní dýchání
Ústní dýchání vede k nefyziologickému tvaru dýchacích cest při ventilaci a k jejímu omezení změnou průsvitu faryngu. Nejenže zvyšuje odpor v HCD, ale také přispívá ke vzniku mikrotraumat v zadní části hrdla, což může vyvolat zánětlivou reakci a následně výraznější hyper - trofii adenoidní vegetace [26, 29].
Kombinace nedostatečné stimulace růstu kostí a absence nosního dýchání s preferencí dýchání ústy má za následek narušený vývoj orofaciálních kostěných struktur, čímž se opět zvyšuje riziko kolapsu HCD během spánku. Potvrzují to i experimentální data s uměle vyvolanou nosní obstrukcí u primátů, u nichž neuromuskulární změny, které byly nezbytné pro navození a udržení ústního dýchání, vedly ke změně morfologie skeletu a měkkých tkání. Data však poukázala na značnou individuální variaci v odezvě na identický podnět [30–33].
Ageneze a předčasná ztráta zubů
Mnoho autorů se ve svých studiích zaměřuje na vliv ageneze či předčasné ztráty zubů na rozvoj kraniofaciálních struktur a případný vznik OSA. Shodují se, že ztráta zubů nebo jejich nezaložení ovlivňuje anatomii alveolárního výběžku. Nezávisle na příčině, proč zuby chybí, je u dětí popisována abnormální orofaciální anatomie ve formě, která je riziková pro kolaps HCD ve spánku [16, 34, 35].
Kraniofaciální znaky
Některé základní funkce, jako nosní dýchání, polykání, mastikace a sání, jsou funkcemi, které v raném dětství pomáhají k normálnímu rozvoji orofaciálních struktur. Kostěné části těchto struktur mají na rozměr HCD velký vliv. Jejich správná anatomie by se dala zařadit mezi klíčové faktory pro dýchání člověka, a to zejména ve spánku, kdy bez dostatečné kostěné opory a šířky dýchací cesty snadněji kolabují a dochází k jejich okluzi.
Vývoj transverzální části nazomaxilárního komplexu ovlivňuje rozvoj nosní dutiny, očních důlků a aktivita intermaxilárního švu. Postnatálně aktivní intermaxilární sutura a formování alveolárního výběžku jsou pod neustálým vlivem výše zmíněných činností, pro jejichž správnou funkci je zase důležitá správná pozice zubů či aktivita svalů obličeje a jazyka, které se při těchto činnostech zapojují, a tak ovlivňují správný rozvoj orofaciální oblasti [30].
V souvislosti se vznikem OSA dětského věku je zmiňován i tzv. koncept dysfunkcí, které mohou vést ke vzniku dysmorfismu ovlivňujícího velikost dýchacích cest. Autoři tohoto konceptu říkají, že nerovnováha v rozvoji orotaciálních struktur v raném dětství vede k narušení normálního vývoje kostěné opory HCD, a tím ke zvýšenému riziku jejich kolapsu a rozvoji SRBD. Tento koncept zdůrazňuje negativní efekt léčby, která není zaměřena přímo na dysfunkci vedoucí ke vzniku OSA, a také nutnost řešit její příčinu [30].
Několik kefalometrických studií s dětskými pacienty trpícími OSA poukazuje na charakteristické, ale různorodé kraniofaciální znaky, které mohou ovlivnit průchodnost HCD, a podílet se tak na vzniku OSA. Mezi nejčastěji se vyskytující znaky patří například: růstová posteriorotace, zvýšení divergence čelistních bazí, projevující se i frontálním otevřeným skusem a nedostatečným uzávěrem rtů. Dalšími znaky jsou retrognátní typ obličejového skeletu, maxilo-mandibulární mikrognácie vedoucí k redukované anterio-posteriorní dimenzi kostěného nazofaryngu. Nazomaxilární komplex bývá úzký, tvrdé patro zúžené a klenuté, často jde o typ tzv. gotického patra. U těchto pacientů popisujeme často II. skeletální třídu, někdy kombinovanou i s II. Angleovou třídou a výraznější incizální schůdek; laterálně můžeme vidět jednostranně či oboustranně zkřížený skus [13, 30, 36–50]. Obr. 2 znázorňuje kefalometrickou analýzu, kterou ve své studii roku 2014 používali Min Gu a kol. při hodnocení HCD [51]. Na obr. 3 je laterální kefalogram zhotovený u dětské pacientky na vstupním ortodontickém vyšetření, který upozorňuje pomocí šipek na rizikové znaky pro OSA. Na obr. 4–6 jsou prezentovány intraorální fotografie pacientů s výše zmíněnými kraniofaciálními znaky rizikovými pro rozvoj poruchy dýchání ve spánku.
Image 2. Kefalometrická analýza a měření HCD použitá při stanovování kefalometrických norem u dvanáctiletých dětí; převzato z Min GU a kol. [51]
Po – porion, Or – orbitale, ANS – anteriorní spina nasalis,
PM – pterygomaxilare, U – uvula, UPW – horní bod stěny faryngu, MPW – střední bod stěny faryngu, LPW – dolní část stěny faryngu, V – vallecula, AH – anteriorní část hyoidní kosti, C2 a C3 – druhý a třetí krční obratel, FH – frankfurtská horizontála, NL – nazální linie, CV – linie mezi C2 a C3
Fig. 2 Cephalometric analysis and UR tract measurement used in the determination of cephalometric standards in 12-year-olds; taken from Min GU et al. [51]
Po – porion, Or – orbitale, ANS – anterior nasal spine, PM – pterygo-maxillare, U – uvula, UPW – upper pharyngeal wall, MPW – middle pharyngeal wall, LPW – lower pharyngeal wall, V – vallecula, AH – anterior hyoid, C2 and C3 - 2nd and 3rd cervical vertebrae, FH – Frankort horizontal plane, NL – nasal line, CV – cervical vertebrae, the line joining the C2 and C3![Kefalometrická analýza
a měření HCD použitá
při stanovování
kefalometrických norem
u dvanáctiletých dětí;
převzato z Min GU a kol. [51]<br>
Po – porion,
Or – orbitale,
ANS – anteriorní spina
nasalis,<br>
PM – pterygomaxilare,
U – uvula,
UPW – horní bod stěny
faryngu,
MPW – střední bod stěny
faryngu,
LPW – dolní část stěny
faryngu,
V – vallecula,
AH – anteriorní část hyoidní
kosti,
C2 a C3 – druhý a třetí krční
obratel,
FH – frankfurtská horizontála,
NL – nazální linie,
CV – linie mezi C2 a C3<br>
Fig. 2
Cephalometric analysis and UR
tract measurement used in the
determination of cephalometric
standards in 12-year-olds;
taken from Min GU et al. [51]<br>
Po – porion,
Or – orbitale,
ANS – anterior nasal spine,
PM – pterygo-maxillare,
U – uvula,
UPW – upper pharyngeal wall,
MPW – middle pharyngeal wall,
LPW – lower pharyngeal wall,
V – vallecula,
AH – anterior hyoid,
C2 and C3 - 2nd and 3rd
cervical vertebrae,
FH – Frankort horizontal plane,
NL – nasal line,
CV – cervical vertebrae,
the line joining the C2 and C3](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/52cea7975bb1566ad55f71e441c3f30f.jpeg)
Image 3. Laterální kefalogram – šipky upozorňují na rizikové znaky: nedostatečný retní uzávěr (1), zvětšený incizální schůdek (2), posteriorotační růstový vzor (3) a viditelná je i tonsila lingualis (4) a hypertrofie nosní mandle (5)
Fig. 3 Lateral cephalogram – arrows pointing to risk factors: insufficient lip incompetence (1), enlarged overjet (2), vertical growth pattern (3), tonsila lingualis (4) adenoid hypertrophy (5)
Obr. 4a Transverzální konstrikce tvrdého patra – pohled z okluze
Fig. 4a Transverse maxillary deficiency – occlusal view
Obr. 4b Laterálně zkřížený skus – boční pohled z pravé strany
Fig. 4b Posterior crossbite – right side view
Obr. 4c Laterálně zkřížený skus – boční pohled z levé strany
Fig. 4c Posterior crossbite – left side view
Obr. 4d Oboustranně zkřížený skus – frontální pohled
Fig. 4d Bilateral crossbite – frontal view
Obr. 5a Zúžená horní čelist, tendence k frontálně otevřenému skusu
Narrowing of the upper jaw – tendency to open bite
Obr. 5b Zúžená horní čelist, tendence k frontálně otevřenému skusu – boční pohled
Fig. 5b Narrowing of the upper jaw – tendency to open bite – side view
Obr. 6 Frontálně otevřený skus
Fig. 6 Anterior open bite
Existují také výzkumy poukazující na zvýšenou frekvenci výskytu OSA u dětí s vrozenou kraniofaciální malformací. Driessen a kol. se věnovali dětem se syndromickými kraniosynostózami a MacLean a kol. dětským pacientům s rozštěpem rtu a/nebo patra ještě před jejich operací. Obě studie podpořily asociaci mezi kraniofaciálními malformacemi a OSA u dětí [21, 22]. Kraniofaciální růst může být ovlivněn přítomností geneticky podmíněných syndromů spojených s poruchami dýchání ve spánku (Appertův syndrom, Crouzonův, Treacher-Collinsův syndrom nebo syndrom Pierre Robin) [52, 75].
SCREENING DĚTSKÉ OSA A MOŽNOSTI DIAGNOSTIKY V ORDINACI ZUBNÍHO LÉKAŘE/ORTODONTISTY
V rámci screeningu populace a odhalení zvýšeného rizika OSA je vhodným nástrojem dotazník a využití zobrazovacích metod, což je v možnostech zubního lékaře/ortodontisty. Pro záchyt OSA lze tedy použít jednoduché postupy a běžně používané přístroje a následně, v případě podezření na přítomnost OSA u pacienta, jej odeslat k podrobnému dovyšetření na specializovaném pracovišti. Podle doporučení České́ společnosti pro výzkum spánku a spánkovou medicínu je jedinou spolehlivou diagnostickou metodou OSA u dětí celonoční videopolysomnografie, kdy je při diagnostice poruch dýchání ve spánku nutná kombinace vyšetření u somnologa a dále podle potřeby u otorinolaryngologa, neurologa, plicního lékaře, pediatra, a/nebo stomatochirurga [53].
Dotazníky určené pro děti nebo rodiče dětí
K primárnímu záchytu a odhalení poruchy spánku slouží několik způsobů, mezi oblíbené patří dotazníky. Používá se například: The Sleep-Related Breathing Scale of the Pediatric Sleep Questionnaire, 18-item Obstructive Sleep apnea QoL, který je hodnocen několika studiemi jako dotazník s dobrou spolehlivostí. V České republice je pravděpodobně nejčastěji používaný Epworth Sleepiness Scale (Epwothova spánková stupnice), v zahraničí existující i v modifikované verzi pro děti [54–57]. Dotazník sestává z několika dotazů, které pacient nebo jeho zákonný zástupce hodnotí přiřazením číselné hodnoty s výpovědí. Tento dotazník je srozumitelný, jednoduchý a časově nenáročný, díky čemuž je pravděpodobně často využíván v rámci screeningu. Zároveň je však málo komplexní, je složen z pouhých osmi dotazů. V České republice bohužel neexistuje dotazník použitelný pro screening OSA v dětské populaci.
I když jsou dotazníky efektivní a jednoduchou screeningovou metodou, upozorňují Constantin a kol. ve své studii na to, že by se pro zjištění OSA u dětí neměly používat namísto objektivních testů [58].
Zobrazovací metody
Telerentgen zobrazující lebku v boční projekci je snadno dostupným a při vstupním ortodontickém vyšetření běžně zhotovovaným snímkem. Ortodontista, který komplexně popisuje tento snímek, dokáže díky němu odhalit důležité prediktory vzniku OSA, a to hlavně ve faryngeálních rozměrech [45, 59]. Vzhledem k tomu, že se obstrukce při OSA může objevit kdekoli v rámci dýchacích cest, tj. od špičky nosu až po larynx, má tento snímek určité limity. Nemohou být zobrazeny změny, které nastanou v transverzální dimenzi [60] a také je omezen svou dvourozměrností (2D). Zato 3D zobrazení, Cone Beam výpočetní tomografie (CBCT, cone beam computer tomography) a magnetická rezonance (MRI, magnetic resonance imaging), jsou v současnosti ve stomatologii běžně využívány. Tyto metody dovolují 3D segmentování a analýzu zobrazovaných částí. U pacientů je tak možné lépe hodnotit funkční vztahy mezi skeletálními, orálními a faryngeálními dimenzemi a zjistit případnou obstrukci dýchacích cest i přesné místo zúžení. Je tak možné se zaměřit na příčiny, které obstrukci vyvolávají a efektivně je řešit [42, 58, 59]. U každého zobrazování je důležité dosáhnout anatomické a funkční zobrazení s co nejmenší nutnou radiační zátěží organismu [60, 63, 64].
Diagnostické nástroje k určení OSA u dětí – polysomnografie, spánkový monitoring
Diagnostika OSA u dětí může probíhat několika způsoby. Čím je vyšetření podrobnější a citlivější, tím je zpravidla obtížněji použitelné pro širší populaci. Nejpřesnějším vyšetřením OSA je polysomnografie [60]. Toto vyšetření může být podle Tsara a kol. použito v jakémkoli věku pacienta. Jde o šestikanálové zařízení vyvinuté oddělením Klinické neurofyziologie Univerzitní nemocnice v Oulu (Finsko), které zaznamenává: respirační pohyby, oronazální průtok vzduchu, saturaci hemoglobinu kyslíkem, koncový vydechovaný oxid uhličitý, dále elektrokardiogram, elektroencefalogram, elektrookulogram a elektromyogram brady a tibie. Kombinovaná analýza těchto parametrů může vést k velmi přesné diagnostice [3, 45]. Vzhledem k náročnosti vybavení a samotnému průběhu vyšetření je však častokrát nedostupná. I když je celonoční PSG stále považována za zlatý standard pro diagnostiku OSA, jako vhodná alternativa se nabízejí domácí přístroje pro monitorování spánku, například přístroji ApneaLink Air a SOMNOcheck micro cardio. Záznam přístrojů je sice oproti kompletnímu PSG redukovaný, nicméně stále více studií je označuje za nákladově efektivní ve srovnání s celonoční PSG. Je dostupnější a v rámci prvotního záchytu OSA dostatečně účinné [65–67].
TERAPIE OSA U DĚTSKÝCH PACIENTŮ
V historii se využívala k terapii OSA tracheostomie, později převážně domácí přetlaková zařízení, která však nebyla vždy dobře tolerována. Běžnými postupy léčby byly i tonzilektomie a adenotomie. Po těchto zákrocích však nemusí dojít k úplnému vyléčení poruchy dýchání ve spánku, a to ani navzdory výraznému zlepšení ihned po operaci [68–70]. Tyto terapeutické postupy jsou v některých případech samozřejmě stále indikovány, ale v poslední době je častěji zastáván názor, že vzhledem k variabilitě faktorů vyvolávajících a podílejících se na vzniku OSA je těžké hovořit o univerzální terapii pro všechny dětské pacienty. Za důležité se považuje diagnostikovat OSA co nejdříve a terapii zaměřit na faktor, který ji u konkrétního jedince vyvolává. Z tohoto důvodu je klíčová mezioborová spolupráce, která zahrnuje již výše zmíněné odbornosti a komplexní vyšetření pacienta [30, 71].
Vliv ortodontické terapie při managmentu OSA u dětí
Výše zmíněné, u dětských OSA pacientů často se vyskytující kraniofaciální znaky, jsou těmi, které děti přivedou k ortodontistovi, a protože ortodontická terapie ovlivňuje orofaciální struktury, zasahuje i do kostěné opory HCD. Změna jejího rozměru může problém s OSA pozitivně ovlivnit, až eliminovat. Několik studií potvrzuje, že ortodontická terapie může u některých dětí trpících OSA vést k jejímu odstranění, a to i bez nutnosti tonzilektomie a adenotomie [72–74].
Myofunkční terapie
Správná poloha jazyka dosažená pomocí myofunkční terapie (MFT) je již od roku 1918 popisována jako hlavní faktor vedoucí ke stimulaci mandibulárního růstu a dýchání nosem [75]. Množství dat nashromážděných za několik let naznačuje asociaci mezi napětím orofaciálních svalů a fyziologickým vývojem nazomaxilárního komplexu a mandibuly. Narušení normálního tonu a hypotonie jazyka, bylo spojeno s ústním dýcháním či nesprávnou polohou jazyka a vedlo k narušení rozvoje orofaciálního komplexu. Pochopení významu myofunkční terapie souvisí s porozuměním vztahům mezi propojením svalové aktivity jazyka s orofaciálním svalstvem a vývojem anatomických struktur, které mimo jiné ovlivňují i dýchací cesty [76].
MFT je souhrnem izotonických a izometrických cvičení ovlivňujících rty, jazyk, orofaryngeální struktury, jako měkké patro či laterální stěnu hltanu. Má za úkol zajistit správné držení hlavy, pozici jazyka na patře oproti horním zubům, polykání, mastikaci, řeč a artikulaci. K jejímu správnému procvičování u dětí je nutná aktivita rodičů. Huang na základě výsledků několika metaanalýz ve své studii uvádí, že aktivní a denně prováděná MFT může ve spojení s další léčbou vést k úplné remisi OSA až u 60 % dětí [16, 77]. Naopak absence MFT může být spojena s recidivou poruchy dýchání vázané na spánek [67].
Metaanalýza z roku 2015, která obsahovala devět studií dospělých pacientů a dvě pediatrické studie, říká, že myofunkční terapie může snížit AHI přibližně u 50 % dospělých pacientů a u 62 % dětí. Nabízí se také jako vhodná doplňková terapie k jiným metodám léčby OSA [78].
Pasivní MFT
I když MFT patří mezi terapie doporučené při OSA, často je u dětských pacientů problém s jejím dodržováním, což vedlo ke vzniku pasivní MFT ve formě využití ortodontických aparátů na noc.
Chuang a kol. zkoumali vliv monobloku, což je zařízení sloužící k předsunu mandibuly, které je zároveň modifikováno v jeho spodní části vloženým korálkem. Aparát se nosil na noc a pacienti měli za úkol jazykem rolovat korálek, což vedlo jazyk do přední polohy, a otevíralo tak dýchací cesty. Byl zhotoven na základě předpokladu, že korálek v blízkosti špičky jazyka stimuluje jeho aktivitu alespoň během lehčí fáze spánku a tato aktivita vede celkově ke správné funkci a poloze jazyka, a tím i k podpoře správného rozvoje orální kavity. Po šesti měsících pasivní terapie byl sledován signifikantní pokles AHI a probouzení se v noci [79].
Maxilární expanze
V rámci ortodontické terapie je poměrně častým výkonem maxilární expanze, případně rychlá maxilární expanze (RME). Poprvé ji zmínil v roce 1860 E. C. Angell a v dnešní době se řadí mezi často využívanou terapii aplikovanou při transverzálním zúžení maxilly [80].
Vzhledem k tomu, že u dětí s vysokým rizikem poruchy dýchání vázané na spánek byla často zjištěna redukovaná transverzální šířka maxilly, mohla by RME pomoci zlepšit kvalitu jejich života, což potvrzují víceré výzkumy. Shodují se, že při RME dochází k expanzi maxilly, rozšíření zubního oblouku a zvýšení intranazální kapacity, rozšíření nosních dutin a snížení nosní rezistence. U pacientů trpících maxilární konstrikcí a zároveň příznaky OSA tak RME prokazatelně zlepšuje nosní ventilaci a nabízí se jako vhodná terapie [81–92]. Aby se upřesnil její vliv na polohu jazyka a objem faryngeální části dýchacích cest, používalo se před léčbou a po ní v některých studiích zobrazovací zařízení CBCT, případně ve spojení s analýzami pomocí výpočetní dynamiky tekutin (CFD, computational fluid dynamics). Ukázalo se, že u dětí s nosní obstrukcí může RME nejenom tuto obstrukci zredukovat, ale také zvýšit polohu jazyka a zvětšit faryngeální část dýchacích cest [93, 94]. Výsledky CBCT vyšetření ukazují i na významnou expanzi přední i zadní části nosní spodiny a zvětšení objemu nazofaryngu a nosních dutin po expanzi patra [95].
Pirelli a kol. sledovali po RME rozšíření maxilly a pokles AHI ze 12 na <1 již po čtyřech měsících, anteriorní rinometrie byla také v normě [70]. V další studii se 42 dětmi, demonstrovali autoři po RME u pacientů značné zlepšení OSA a zvýšenou průchodnost dýchacích cest [94]. Follow-up studie zaznamenaly po rychlé maxilární expanzi pokles AHI, který zůstal v průběhu času konzistentně normalizovaný. Stabilitu získané expanze prokázaly měřením šířky báze maxilly a vzdáleností pterygoidních výběžků pomocí CT (výpočetní tomografie) zobrazení, a to po dvacetičtyřměsíčním i po dvanáctiletém follow-up [74, 96, 97]. Výzkum Cistulli a kol. rovněž potvrzuje, že se zvětšením šířky maxilly dochází k redukci odporu v nose a snižuje se AHI u OSA pacientů [92]. V neposlední řadě i autoři metaanalýzy publikované v roce 2016 uvádějí, že RME u dětí trpících OSA patří mezi efektivní terapii [98].
Změna polohy dolní čelisti a terapie skeletální II. třídy
U dětí trpících OSA a zároveň s II. skeletální třídou kombinovanou s II. Angleovou třídou lze použít několik různých ortodontických aparátů a terapeutických postupů vedoucích ke změně polohy dolní čelisti. Po terapii aparátem Twin Block, sloužícím na předsun dolní čelisti, se u dětí ve věku 8–14 let zvýšil sagitální rozměr orofaryngu a hypofaryngu. Korekcí polohy mandibuly se také zlepšily délka, tloušťka a sklon měkkého patra [99]. V jiné studii se uvádí, že po používání tohoto aparátu po dobu přibližně 10,8 měsíců došlo ke zlepšení symptomů OSA, jakož i profilu pacientů a výsledků jejich polysomatického vyšetření. Kefalometrické analýzy prokázaly významné zvětšení prostoru dýchacích cest, změnu úhlu pozice mandibuly vůči lební bázi a konvexitě obličeje, které naznačují zvýšení růstu mandibuly a změnu délky měkkého patra [100]. Nárůst objemu dýchacích cest v části orofaryngu i laryngu a snížená četnost probouzení u dětí trpících II. skeletální třídou a OSA byl sledován také po použití Herbstova aparátu [101, 102]. Podle metaanalýzy z roku 2005, sestávající ze 178 článků, patří mandibulární distrakční osteogeneze, což je chirurgická metoda k prodloužení mandibuly, mezi efektivní terapie při kraniofaciálních deformitách. Byl pozorován pokles symptomů u 97 % dětských a 100 % dospělých pacientů s OSA [103]. Novější metaanalýza z roku 2018, do které bylo zařazeno 98 studií, ukázala, že k dramatickému zlepšení OSA u dětských pacientů trpících nedostatečným růstem mandibuly došlo po její léčbě předsunutím nebo distrakční osteogenezí [104].
Kombinovaná terapie
U mnoha pacientů se v rámci ortodontické terapie kombinuje několik terapeutických principů. U předsunu mandibuly musí být adekvátně upravena šířka obou zubních oblouků, často se jedná o rozšíření horního zubního oblouku. Pozitivní výsledky takové kombinované terapie potvrzuje několik studií. Schütz a kol. poukázali na zlepšené dýchání a snížení OSA příznaků u pacientů po léčbě, při které se použila maxilární expanze i předsun mandibuly Herbstovým aparátem [105]. Výsledek potvrzuje i kazuistika popisující léčbu jednoho dětského pacienta ortodontickým zařízením Sleep apnea Twin Expander, který současně provádí expanzi patra a předsunutí mandibuly. Po ortodontické léčbě se v dotazníku OSA-18 prokázalo zlepšení hlavních respiračních symptomů, přičemž i domácí spánková studie odhalila snížení obstrukčních apnoických událostí. Po léčbě, klinickém hodnocení a kefalometrické analýze se zjistilo zmenšení maxilo-mandibulární diskrepance v sagitální i vertikální rovině a rozšíření horních cest dýchacích. Tato kazuistika naznačuje, že ortodontická léčba může být hodnotnou léčbou u dětí s OSA, u nichž jsou přítomny kraniofaciální anomálie [106].
MEZIOBOROVÁ SPOLUPRÁCE PŘI MANAGEMENTU OSA U DĚTÍ
Při diagnostice i terapii OSA dětského věku je důležitá mezioborová spolupráce. Pokud praktický zubní lékař/ortodontista získá podezření na zvýšené riziko OSA, měl by pacienta důkladně vyšetřit v rámci své odbornosti a následně doporučit vyšetření i u ostatních specialistů, a to podle doporučení České́ společnosti pro výzkum spánku a spánkovou medicínu, které je připomenuto výše [53]. Uvedení stomatochirurga jako jednoho ze specialistů v doporučeních managementu OSA u dětí [53] by mohlo být nahrazeno vybídnutím ke spolupráci se zubním lékařem/ortodontistou (zejména pokud se orientují v problematice OSA), jelikož se stomatochirurgické zákroky k terapii kraniofaciálních abnormalit u rostoucích dětských pacientů zpravidla neprovádí, s výjimkou distrakční osteogeneze, zmíněné v předešlé kapitole. Stomatochirurg proto obvykle s dětskými pacienty nepřichází do kontaktu. Je vhodné požádat o spolupráci i logopeda a rehabilitačního pracovníka nebo specialistu na myoterapii orofaciální soustavy. Analýzou informací z jednotlivých vyšetření lze následně správně stanovit diagnózu a zvolit vhodnou/adekvátní terapii vedoucí k eliminování příčiny, která OSA nejpravděpodobněji vyvolala, ale i dalších faktorů, jež toto onemocnění mohou zhoršovat nebo vést k jeho recidivě.
Zubní lékaři, zejména z řad ortodontistů, jsou často prvními ošetřujícími lékaři, kteří mají možnost odhalit u dětského pacienta riziko existence či potenciálního vzniku OSA. Zároveň svou léčbou ovlivňují kraniofaciální struktury, které mohou hrát roli při vzniku OSA u dětí. V neposlední řadě se ortodontická terapie celosvětově postupně začíná řadit mezi terapie používané při léčbě tohoto onemocnění [16].
ZÁVĚR
Na základě výše uvedeného stručného přehledu problematiky obstrukční spánkové apnoe dětského věku je zřejmá specifičnost a komplexnost tohoto onemocnění i jeho možný dopad na celkový zdravotní stav dětského pacienta. Mezi nejzávažnější následky patří nedostatečná kvantita i kvalita spánku, noční můry, problematické probouzení, výrazná denní ospalost a také problémové chování, nesoustředěnost, hyperaktivita a špatné výsledky ve škole.
Při dětské OSA by měla být snaha o co nejvčasnější záchyt a následné vhodné zvolení kauzální terapie, což je možné pouze na základě přesného určení příčiny vzniku OSA.
Poměrně jednoduchou, rychlou a efektivní cestou primárního záchytu rizika OSA u dětí jsou již výše zmíněné dotazníky pro ně specificky modifikované. I když se v zahraničí používá několik dotazníků pro screening dětské OSA, v České republice existují pouze verze pro dospělé osoby, používána je pak zejména Epworthova spánková stupnice. Ani tento dotazník pro zhodnocení OSA u dětské populace v ordinacích zubních lékařů a ortodontistů není běžně k dispozici. Zubní lékaři však určitě mohou napomoci zvýšit povědomí o existenci poruchy dýchání ve spánku u dětí. K odhalení zvýšeného rizika OSA u dětí mohou dospět zubní lékaři i jednoduchým anamnestickým dotazem na spánek dětského pacienta, přítomnost nočního chrápání a upřením své pozornosti v rámci stomatologického vyšetření na výše uvedené kraniofaciální znaky, zkrácené sublinguální frenulum nebo ztrátu/agenezi zubů a ústní dýchaní.
Pro kvalitnější screening a simplifikaci při tvorbě anamnézy, a to nejen v ordinaci zubního lékaře/ortodontisty, by bylo jistě vhodné používat komplexní a validovaný dotazník, vytvořený na základě fúze stávajících cizojazyčných dotazníků určených pro dětskou populaci. Dotazník by měl být zaměřen nejenom na samotné noční projevy OSA, ale také na následky, které onemocnění způsobuje během dne a kterých si rodiče nebo děti častokrát mohou všimnout a definovat je. Na podobě dotazníku specifického pro záchyt OSA u českých dětí pracujeme a pro jeho validaci jsme navrhli metodický postup (validační studie je plánována na rok 2020).
V případě, že se u dětského pacienta obstrukční spánkovou apnoe podaří včas odhalit, zvětšuje se škála terapeutických možností. Existují možnosti ovlivňovat správný růst a rozvoj orofaciálních struktur rostoucího jedince ortodontickou léčbou, která v případě pozdního záchytu již není aplikovatelná. Největším přínosem časného záchytu a úspěšné léčby obstrukční spánkové apnoe u dětí je zvýšení kvality a kvantity spánku, který je pro celkový rozvoj a růst dětí nesmírně důležitý.
Studie byla podpořena z grantu NV17-30439A, ze specifického výzkumu MUNI/A/1546/2018 a z prostředků poskytnutých Lékařskou fakultou MU juniorskému výzkumníkovi Petře Bořilové Linhartové.
Prohlášení k fotodokumentaci
Obrázky jsou publikovány s písemným souhlasem pacienta.
Seznam zkratek
- AHI apnoický/hypopnoický index
- CFD výpočetní dynamika tekutin
- HCD horní cesty dýchací
- MFT myofunkční terapie
- OSA obstrukční spánková apnoe
- PSG polysomnografické vyšetření
- RME rychlá maxilární expanze
- SRBD porucha dýchání vázaná na spánek
Korespondující autorka
RNDr. Petra Bořilová Linhartová, Ph.D.
Stomatologická klinika
a Ústav patologické fyziologie LF MU
Kamenice 5 625 00 Brno
e-mail: peta.linhartova@gmail.com
Sources
1. Farlex Partner Medical Dictionary. S.v. „sleep-disordered breathing." [cit. Farlex 8. 3. 2019] Dostupné z: https://medical-dictionary.thefreedictionary.com/sleep-disordered+breathing 1981; 159(1): 275–287.
2. Staevska MT, Baraniuk JN. Rhinitis and sleep apnea. Clin Allergy Immunol. 2007; 19 : 449.
3. Tsara V, Amfilochiou A, Papagrigorakis JM, Georgopoulos D, Liolios E, Kadiths A, Koudoumnakis E, Aulonitou E, Emporiadou M, Tsakanikos M, Chatzis A. Guidelines for diagnosing and treating sleep related breathing disorders in adults and children (Part 3: obstructive sleep apnea in children, diagnosis and treatment). Hippokratia. 2010; 14(1): 57.
4. Crummy F, Piper AJ, Naughton MT. Obesity and the lung: 2·Obesity and sleep-disordered breathing. Thorax. 2008; 63(8): 738–746.
5. Young T, Skatrud J, Peppard PE. Risk factors for obstructive sleep apnea in adults. Jama. 2004; 291(16): 2013.
6. Guilleminault C, Eldridge FL, Simmons FB, Dement WC. Sleep apnea in eight children. Pediatrics. 1976; 58(1): 23–30.
7. Guilleminault C, Korobkin R, Winkle R. A review of 50 children with obstructive sleep apnea syndrome. Lung. 1981; 159(1): 275–287.
8. Galievsky M, Lambert A. Sleep respiratory problems in children: Diagnosis and contribution of the orthodontist. Int Orthod. 2017; 15(3): 405–423.
9. Owens J, Opipari L, Nobile C, Spirito A. Sleep and daytime behavior in children with obstructive sleep apnea and behavioral sleep disorders. Pediatrics. 1998; 102(5): 1178–1184.
10. Chervin RD, Dillon JE, Bassetti C, Ganoczy DA, Pituch KJ. Symptoms of sleep disorders, inattention, and hyperactivity in children. Sleep. 1997; 20(12): 1185–1192.
11. Chervin RD, Archbold KH. Hyperactivity and polysomnographic findings in children evaluated for sleep-disordered breathing. Sleep. 2001; 24(3): 313–320.
12. O’Brien LM, Holbrook CR, Mervis CB, Klaus CJ, Bruner JL, Raffield TJ, Rutherford J, Mehl RC, Wang M, Tuell A, Hume BC. Sleep and neurobehavioral characteristics of 5 - to 7-year-old children with parentally reported symptoms of attention-deficit/hyperactivity disorder. Pediatrics. 2003; 111(3): 554–563.
13. Katz ES, D'ambrosio CM. Pathophysiology of pediatric obstructive sleep apnea. Proc Am Thorac Soc. 2008; 5(2): 253–262.
14. Carroll JL. Obstructive sleep-disordered breathing in children: new controversies, new directions. Clin Chest Med. 2003; 24(2): 261–282.
15. Lumeng JC, Chervin RD. Epidemiology of pediatric obstructive sleep apnea. Proc Am Thorac Soc. 2008; 5(2): 242–252.
16. Huang YS, Guilleminault C. A review of treatment options in paediatric sleep-disordered breathing. Pediatr Respirol Crit Care Med. 2017; 1(3): 54.
17. Příhodová MI. Obstrukční spánková apnoe u dětí – opomíjená diagnóza. Pediatr pro Praxi. 2010; 11(1): 26–28.
18. Casale M, Pappacena M, Rinaldi V, Bressi F, Baptista P, Salvinelli F. Obstructive sleep apnea syndrome: from phenotype to genetic basis. Curr Genomics. 2009; 10(2): 119–126.
19. Kheirandish-Gozal L, Khalyfa A, Gozal D, Bhattacharjee R, Wang Y. Endothelial dysfunction in children with obstructive sleep apnea is associated with epigenetic changes in the eNOS gene. Chest. 2013; 143(4): 971–977.
20. Wu BG, Sulaiman I, Wang J, Shen N, Clemente JC, Li Y, Laumbach RJ, Lu SE, Udasin I, Le-Hoang O, Perez A. Severe obstructive sleep apnea is associated with alterations in the nasal microbiome and an increase in inflammation. Am J Respir Crit Care Med. 2019; 199(1): 99–109.
21. Driessen C, Joosten KF, Florisson JM, Lequin M, van Veelen ML, Dammers R, Bredero Boelhouwer H, Tasker RC, Mathijssen IM. Sleep apnoea in syndromic craniosynostosis occurs independent of hindbrain herniation. Childs Nerv Syst. 2013; 29(2): 289–296.
22. MacLean JE, Fitzsimons D, Fitzgerald DA, Waters KA. The spectrum of sleep-disordered breathing symptoms and respiratory events in infants with cleft lip and/or palate. Arch Dis Child. 2012; 97(12): 1058–1063.
23. Moraleda-Cibrián M, Edwards SP, Kasten SJ, Buchman SR, Berger M, O'Brien LM. Obstructive sleep apnea pretreatment and posttreatment in symptomatic children with congenital craniofacial malformations. J Clin Sleep Med. 2015; 11(01): 37–43.
24. Queiroz IM. Lingual frenulum: classification and speech interference. Int J Orofacial Myology. 2004; 30 : 31–38.
25. Wallace H, Clarke S. Tongue tie division in infants with breast feeding difficulties. Int J Pediatr Otorhinolaryngol. 2006; 70(7): 1257–1261.
26. Guilleminault C, Huseni S, Lo L. A frequent phenotype for paediatric sleep apnoea: short lingual frenulum. ERJ Open Res. 2016; 2(3): 00043–2016.
27. Pola M, Garcia MG, Martín JM, Gallas M, Lestón JS. A study of pathology associated with short lingual frenum ASDC J Dent Child. 2002; 69(1): 59–62.
28. Huang YS, Quo S, Berkowski JA, Guilleminault C. Short lingual frenulum and obstructive sleep apnea in children. Int J Pediatr Res. 2015; 1(003).
29. Fitzpatrick MF, McLean H, Urton AM, Tan A, O'donnell D, Driver HS. Effect of nasal or oral breathing route on upper airway resistance during sleep. Eur Respir J. 2003; 22(5): 827–832.
30. Huang YS, Guilleminault C. Pediatric obstructive sleep apnea: Where do we stand? In: Lin HC. Sleep-related breathing disorders. vol. 80. Basel: Karger; 2017, 136–144.
31. Pacheco MC, Fiorott BS, Finck NS, Araújo MT. Craniofacial changes and symptoms of sleep-disordered breathing in healthy children. Dental Press J Orthod. 2015; 20(3): 80–87.
32. Vargervik K, Miller AJ, Chierici G, Harvold E, Tomer BS. Morphologic response to changes in neuromuscular patterns experimentally induced by altered modes of respiration. Am J Orthod. 1984; 85(2): 115–124.
33. Harvold EP, Tomer BS, Vargervik K, Chierici G. Primate experiments on oral respiration. Am J Orthod. 1981; 79(4): 359–372.
34. Ben-Bassat Y, Brin I. Skeletal and dental patterns in patients with severe congenital absence of teeth. Am J Orthod Dentofacial Orthop. 2009; 135(3): 349–356.
35. Guilleminault C, Abad V, Chiu H, Quo S. Obstructive-sleep-apnea and alveolo-dental synchondrosis. Sleep Med. 2015; 16 : 80.
36. Shintani T, Asakura K, Kataura A. Adenotonsillar hypertrophy and skeletal morphology of children with obstructive sleep apnea syndrome. Acta Otolaryngol Suppl. 1996; 523 : 222–224.
37. Ågren K, Nordlander B, Linder-Aronsson S, Zettergren-Wijk L, Svanborg E. Children with nocturnal upper airway obstruction: postoperative orthodontic and respiratory improvement. Acta Otolaryngol. 1998; 118(4): 581–587.
38. Löfstrand-Tideström B, Thilander B, Ahlqvist-Rastad J, Jakobsson O, Hultcrantz E. Breathing obstruction in relation to craniofacial and dental arch morphology in 4-year-old children. Eur J Orthod. 1999; 21(4): 323–332.
39. Zucconi M, Caprioglio A, Calori G, Ferini-Strambi L, Oldani A, Castronovo C, Smirne S. Craniofacial modifications in children with habitual snoring and obstructive sleep apnoea: a case-control study. Eur Respir J. 1999; 13(2): 411–417.
40. Finkelstein Y, Wexler D, Berger G, Nachmany A, Shapiro-Feinberg M, Ophir D. Anatomical basis of sleep-related breathing abnormalities in children with nasal obstruction. Arch Otolaryngol Head Neck Surg. 2000; 126(5): 593–600.
41. Kawashima S, Niikuni N, Chia-hung L, Takahasi Y, Kohno M, Nakajima I, Akasaka M, Sakata H, Akashi S. Cephalometric comparisons of craniofacial and upper airway structures in young children with obstructive sleep apnea syndrome. Ear Nose Throat J. 2000; 79(7).
42. Zettergren-Wijk L, Forsberg CM, Linder-Aronson S. Changes in dentofacial morphology after adeno-/tonsillectomy in young children with obstructive sleep apnoea – a 5-year follow-up study. Eur J Orthod. 2006; 28(4): 319–326.
43. Raffaele IR. Habitual snoring, OSA and craniofacial modification. Orthodontic clinical and diagnostic aspects in a case control study. Minerva Stomatol. 1999; 48(4): 125–137.
44. Kim JH, Guilleminault C. The nasomaxillary complex, the mandible, and sleep-disordered breathing. Sleep Breath. 2011; 15(2): 185–193.
45. Pirilä-Parkkinen K, Löppönen H, Nieminen P, Tolonen U, Pirttiniemi P. Cephalometric evaluation of children with nocturnal sleep-disordered breathing. Eur J Orthod. 2010; 32(6): 662–671.
46. El Aouame A, Daoui A, El Quars F. Nasal breathing and the vertical dimension: a cephalometric study. Int Orthod. 2016; 14(4): 491–502.
47. Hultcrantz E, Tideström BL. The development of sleep disordered breathing from 4 to 12 years and dental arch morphology. Int J Pediatr Otorhinolaryngol. 2009; 73(9): 1234–1241.
48. Isono S, Shimada A, Utsugi M, Konno A, Nishino T. Comparison of static mechanical properties of the passive pharynx between normal children and children with sleep-disordered breathing. Am J Respir Crit Care Med. 1998; 157(4): 1204–1212.
49. Fregosi RF, Quan SF, Kaemingk KL, Morgan WJ, Goodwin JL, Cabrera R, Gmitro A. Sleep disordered breathing, pharyngeal size and soft tissue anatomy in children. J Appl Physiol. 2003; 95(5): 2030–2038.
50. Ikävalko T, Närhi M, Eloranta AM, Lintu N, Myllykangas R, Vierola A, Tuomilehto H, Lakka T, Pahkala R. Predictors of sleep disordered breathing in children: the PANIC study. Eur J Orthod. 2017; 40(3): 268–272.
51. Min GU, McGrath CP, Wong RW, Hägg U, Yang Y. Cephalometric norms for the upper airway of 12-year-old Chinese children. Head Face Med. 2014; 10(1): 38.
52. Dibelka F. The Pierre Robin syndrome. Čes Stomatol. 1978; 78(3): 199–202.
53. Česká společnost pro výzkum spánku a spánkovou medicínu. Doporučený postup u dětských pacientů s poruchami dýchání ve spánku. [cit. 28. 8. 2019]. Dostupné z: http://www.sleep-society.cz/images/odborne/doporucene-postupy/Guidelines-2016-def-deti-13.9..pdf
54. Garetz SL, Mitchell RB, Parker PD, Moore RH, Rosen CL, Giordani B, Muzumdar H, Paruthi S, Elden L, Willging P, Beebe DW. Quality of life and obstructive sleep apnea symptoms after pediatric adenotonsillectomy. Pediatrics. 2015; 135(2): e477–486.
55. Chervin RD, Hedger K, Dillon JE, Pituch KJ. Pediatric sleep questionnaire (PSQ): validity and reliability of scales for sleep-disordered breathing, snoring, sleepiness, and behavioral problems. Sleep med. 2000; 1(1): 21–32.
56. Sohn H, Rosenfeld RM. Evaluation of sleep-disordered breathing in children. Otolaryngol Head Neck Surg. 2003; 128(3): 344–352.
57. De Serres LM, Derkay C, Astley S, Deyo RA, Rosenfeld RM, Gates GA. Measuring quality of life in children with obstructive sleep disorders. Arch Otolaryngol Head Neck Surg. 2000; 126(12): 1423–1429.
58. Constantin E, Tewfik TL, Brouillette RT. Can the OSA-18 quality-of-life questionnaire detect obstructive sleep apnea in children? Pediatrics. 2010; 125(1): e162–168.
59. Isaiah A, Kiss E, Olomu P, Koral K, Mitchell RB. Characterization of upper airway obstruction using cine MRI in children with residual obstructive sleep apnea after adenotonsillectomy. Sleep Med. 2018; 50 : 79–86.
60. Hatcher DC. Cone beam computed tomography: craniofacial and airway analysis. Dent Clin North Am. 2012; 56(2): 343–357.
61. Shi H, Scarfe WC, Farman AG. Upper airway segmentation and dimensions estimation from cone-beam CT image datasets. I Int J Comput Assist Radiol Surg. 2006; 1(3): 177–186.
62. Ogawa T, Enciso R, Shintaku WH, Clark GT. Evaluation of cross-section airway configuration of obstructive sleep apnea. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 103(1): 102–108.
63. McCrillis JM, Haskell J, Haskell BS, Brammer M, Chenin D, Scarfe WC, Farman AG. Obstructive sleep apnea and the use of cone beam computed tomography in airway imaging: a review. Semin Orthod. 2009; 15(1): 63–69.
64. Aboudara CA, Hatcher D, Nielsen IL, Miller A. A three–dimensional evaluation of the upper airway in adolescents. Orthod Craniofac Res. 2003; 1 : 173–175.
65. Michaelson PG, Allan P, Chaney J, Mair EA. Validations of a portable home sleep study with twelve-lead polysomnography: comparisons and insights into a variable gold standard. Ann Otol Rhinol Laryngol. 2006; 115(11): 802–809.
66. Kirk V, Baughn J, D'Andrea L, Friedman N, Galion A, Garetz S, Hassan F, Wrede J, Harrod CG, Malhotra RK. American Academy of Sleep Medicine position paper for the use of a home sleep apnea test for the diagnosis of OSA in children. J Clin Sleep Med. 2017; 13(10): 1199–1203.
67. Loughlin GM, Brouillette RT, Brooke LJ, Carroll JL, Chipps BE, England SJ, Ferber P, Ferraro NF, Gaultier C, Givan DC, Haddad GG. Standards and indications for cardiopulmonary sleep studies in children. Am J Respir Crit Care Med. 1996; 153(2): 866–878.
68. Huang YS, Guilleminault C, Lee LA, Lin CH, Hwang FM. Treatment outcomes of adenotonsillectomy for children with obstructive sleep apnea: a prospective longitudinal study. Sleep. 2014; 37(1): 71–76.
69. Bhattacharjee R, Kheirandish-Gozal L,Spruyt K, Mitchell RB, Promchiarak J, Simakajornboon N, Kaditis AG, Splaingard D, Splaingard M, Brooks LJ, Marcus CL. Adenotonsillectomy outcomes in treatment of obstructive sleep apnea in children: a multicenter retrospective study. Am J Respir Crit Care Med. 2010; 182(5): 676–683.
70. Guilleminault C, Huang YS, Quo S, Monteyrol PJ, Lin CH. Teenage sleep-disordered breathing: recurrence of syndrome. Sleep Med. 2013; 14(1): 37–44.
71. Saito M, Yamaguchi T, Mikami S, Watanabe K, Gotouda A, Okada K, Hishikawa R, Shibuya E, Lavigne G. Temporal association between sleep apnea-hypopnea and sleep bruxism events. J Sleep Res. 2014; 23(2): 196–203.
72. Villa MP, Castaldo R, Miano S, Paolino MC, Vitelli O, Tabarrini A, Mazzotta AR, Cecili M, Barreto M. Adenotonsillectomy and orthodontic therapy in pediatric obstructive sleep apnea. Sleep Breath. 2014; 18(3): 533–539.
73. Pirelli P, Saponara M, Guilleminault C. Rapid maxillary expansion in children with obstructive sleep apnea syndrome. Sleep. 2004; 27(4): 761–766.
74. Pirelli P, Saponara M, Guilleminault C. Rapid maxillary expansion (RME) for pediatric obstructive sleep apnea: a 12-year follow-up. Sleep Med. 2015; 16(8): 933–935.
75. Rogers AP. Exercises for the development of the muscles of the face, with a view to increasing their functional activity. Dental Cosmos LX. 1918; 59(857): e76.
76. Guilleminault C. Pediatric obstructive sleep apnea and the critical role of oral-facial growth: evidences. Front Neurol. 2013; 3 : 184.
77. Guilleminault C, Akhtar F. Pediatric sleep-disordered breathing: New evidence on its development. Sleep Med Rev. 2015; 24 : 46–56.
78. Camacho M, Certal V, Abdullatif J, Zaghi S, Ruoff CM, Capasso R, Kushida CA. Myofunctional therapy to treat obstructive sleep apnea: a systematic review and meta-analysis. Sleep. 2015; 38(5): 669–675.
79. Chuang LC, Lian YC, Hervy-Auboiron M,Guilleminault C, Huang YS. Passive myofunctional therapy applied on children with obstructive sleep apnea: a 6-month follow-up. J Formos Med Assoc. 2017; 116(7): 536–541.
80. Timms DJ. The dawn of rapid maxillary expansion. Angle Orthod. 1999; 69(3): 247–250.
81. Haas AJ. The treatment of maxillary deficiency by opening the midpalatal suture. Angle Orthod. 1965; 35(3): 200–217.
82. Biederman W. A hygienic appliance for rapid expansion. JPO J Pract Orthod. 1968; 2(2): 67–70.
83. Schmidt-Nowara W, Lowe A, Wiegand L, Cartwright R, Perez-Guerra F, Menn S. Oral appliances for the treatment of snoring and obstructive sleep apnea: a review. Sleep. 1995; 18(6): 501–510.
84. Hershey HG, Stewart BL, Warren DW. Changes in nasal airway resistance associated with rapid maxillary expansion. Am J Orthod. 1976; 69(3): 274–284.
85. Hartgerink DV, Vig PS, Orth D, Abbott DW. The effect of rapid maxillary expansion on nasal airway resistance. Am J Orthod Dentofacial Orthop. 1987; 92(5): 381–389.
86. Hilberg OA, Jackson AC, Swift DL, Pedersen OF. Acoustic rhinometry: evaluation of nasal cavity geometry by acoustic reflection. J Appl Physiol. 1989; 66(1): 295–303.
87. Enoki C, Valera FC, Lessa FC, Elias AM, Matsumoto MA, Anselmo-Lima WT. Effect of rapid maxillary expansion on the dimension of the nasal cavity and on nasal air resistance. Int J Pediatr Otorhinolaryngol. 2006; 70(7): 1225–1230.
88. Bicakci AA, Agar U, Sökücü O, Babacan H, Doruk C. Nasal airway changes due to rapid maxillary expansion timing. Angle Orthod. 2005; 75(1): 1–6.
89. Compadretti GC, Tasca I, Bonetti GA. Nasal airway measurements in children treated by rapid maxillary expansion. Am J Rhinol. 2006; 20(4): 385–393.
90. Katyal V, Pamula Y, Martin AJ, Daynes CN, Kennedy JD, Sampson WJ. Craniofacial and upper airway morphology in pediatric sleep-disordered breathing: systematic review and meta-analysis. Am J Orthod Dentofacial Orthop. 2013; 143(1): 20–30.
91. Basciftci FA, Mutlu N, Karaman AI, Malkoc S, Küçükkolbasi H. Does the timing and method of rapid maxillary expansion have an effect on the changes in nasal dimensions? Angle Orthod. 2002; 72(2): 118–123.
92. Cistulli PA, Palmisano RG, Poole MD. Treatment of obstructive sleep apnea syndrome by rapid maxillary expansion. Sleep. 1998; 21(8): 831–835.
93. Iwasaki T, Saitoh I, Takemoto Y, Inada E, Kakuno E, Kanomi R, Hayasaki H, Yamasaki Y. Tongue posture improvement and pharyngeal airway enlargement as secondary effects of rapid maxillary expansion: a cone-beam computed tomography study. Am J Orthod Dentofacial Orthop. 2013; 143(2): 235–245.
94. Pirelli P, Saponara M, Attanasio G. Obstructive Sleep Apnoea Syndrome (OSAS) and rhino-tubaric disfunction in children: therapeutic effects of RME therapy. Prog Orthod. 2005; 6(1): 48–61.
95. Izuka EN, Feres MF, Pignatari SS. Immediate impact of rapid maxillary expansion on upper airway dimensions and on the quality of life of mouth breathers. Dental Press J Orthod. 2015; 20(3): 43–49.
96. Villa MP, Rizzoli A, Miano S, Malagola C. Efficacy of rapid maxillary expansion in children with obstructive sleep apnea syndrome: 36 months of follow-up. Sleep Breath. 2011; 15(2): 179–184.
97. Villa MP, Malagola C, Pagani J, Montesano M, Rizzoli A, Guilleminault C, Ronchetti R. Rapid maxillary expansion in children with obstructive sleep apnea syndrome: 12-month follow-up. Sleep med. 2007; 8(2): 128–134.
98. Júnior AJ, Zancanella E, Crespo AN. Rapid maxillary expansion and obstructive sleep apnea: A review and meta-analysis. Med Oral Patol Oral Cir Bucal. 2016; 21(4): e465–e469.
99. Ghodke S, Utreja AK, Singh SP, Jena AK. Effects of twin-block appliance on the anatomy of pharyngeal airway passage (PAP) in class II malocclusion subjects. Prog Orthod. 2014; 15(1): 68.
100. Zhang C, He H, Ngan P. Effects of twin block appliance on obstructive sleep apnea in children: a preliminary study. Sleep Breath. 2013; 17(4): 1309–1314.
101. Iwasaki T, Takemoto Y, Inada E, Sato H, Saitoh I, Kakuno E, Kanomi R, Yamasaki Y. Three-dimensional cone-beam computed tomography analysis of enlargement of the pharyngeal airway by the Herbst appliance. Am J Orthod Dentofacial Orthop. 2014; 146(6): 776–785.
102. Schütz TC, Dominguez GC, Hallinan MP, Cunha TC, Tufik S. Class II correction improves nocturnal breathing in adolescents. Angle Orthod. 2011; 81(2): 222–228.
103. Ow AT, Cheung LK. Meta-analysis of mandibular distraction osteogenesis: clinical applications and functional outcomes. Plast Reconstr Surg. 2008; 121(3): 54e–69e.
104. Noller MW, Guilleminault C, Gouveia CJ, Mack D, Neighbors CL, Zaghi S, Camacho M. Mandibular advancement for pediatric obstructive sleep apnea: a systematic review and meta-analysis. J Craniomaxillofac Surg. 2018; 46(8): 1296–1302.
105. Schütz TC, Dominguez GC, Hallinan MP, Cunha TC, Tufik S. Class II correction improves nocturnal breathing in adolescents. Angle Orthod. 2011; 81(2): 222–228.
106. Galeotti A, Festa P, Pavone M, De Vincentiis GC. Effects of simultaneous palatal expansion and mandibular advancement in a child suffering from OSA. Acta Otorhinolaryngol Ital. 2016; 36(4): 328.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2020 Issue 1
Most read in this issue- The impact of neglect and failed treatment of early childhood caries
- Universal adhesives – a new direction in the development of adhesive systems
- Obstructive sleep apnea in relation to orthodontic treatment in children
- Profesor Zdeněk Broukal zemřel
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

