-
Medical journals
- Career
Stevens-Johnsonův syndrom a jeho projevy v ústní dutině (Kazuistika)
Authors: J. Vokurka 1; Fassmann. A. 1; S. Zgažarová 2; P. Augustín 1; L. Izakovičová Hollá 1,3; J. Vaněk 1
Authors‘ workplace: Stomatologická klinika LF MU a FN u sv. Anny, Brno, 21. dermatovenerologická klinika LF MU a FN u sv. Anny, Brno, 3Ústav patologické fyziologie LF MU, Brno 1
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 110, 2010, 3, s. 39-44
Category: Case Report
Overview
Stevens-Johnsonův syndrom (SJS) je onemocnění s typickými kožními a slizničními projevy. Jeho etiologie je multifaktoriální. Charakteristickým projevem na kůži je výskyt cihlově červených skvrn nebo papul s centrální vkleslinou, tzv. forma iris. V centru eflorescencí se tvoří puchýřky. Na sliznicích ústní dutiny nacházíme plošné eroze, které vznikají stržením krytu puchýřů mastikačními pohyby.
Na parodontologickém oddělení Stomatologické kliniky LF MU a FNUSA v Brně jsme vyšetřili devatenáctiletého pacienta s hemoragickými krustami na retní červeni a erozemi s exsudací a fibrinovým náletem, které se vyskytovaly na bukálních sliznicích. Jazyk byl edematózní se zmnoženým bělavým povlakem a laterálními impresemi zubů. Pacient měl zvýšenou salivaci a udával bolestivost při příjmu potravy a nemožnost provádění ústní hygieny, byl schvácený a dehydratovaný. Po dvou dnech se objevily kožní eflorescence v oblasti kolen, beder a glans penis. Projevy v ústní dutině jsme léčili na parodontologickém oddělení a pacienta jsme odeslali k hospitalizaci na 1. dermatovenerologickou kliniku LF MU a FNUSA v Brně.
V kazuistice uvádíme etiologii, klinický průběh, diagnostiku a terapii tohoto onemocnění.Klíčová slova:
Stevens-Johnsonův syndrom (SJS) - erythema exsudativum multiforme Hebrae - SCAR - iris - kortikoidy - IVIG - cyklosporinÚVOD
Stevens-Johnsonův syndrom (SJS) je kožní onemocnění se slizničními projevy. SJS postihuje kromě kůže nejčastěji sliznice ústní dutiny, oční spojivky a urogenitálního ústrojí. Řadíme ho do skupiny závažných nepříznivých kožních reakcí (severe cutaneous averse reactions – SCAR), která se dělí do čtyř podskupin [3, 23]. Nejlehčí variantou je multiformní erytém (erythema exsudativum multiforme - EEM). Závažnější, co do rozsahu a klinického průběhu, je Stevens-Johnsonův syndrom, při kterém je postiženo více jak jedno a méně než deset procent celkové plochy kůže a u něhož převažuje postižení sliznic. Při rozsahu více než třicet procent povrchu těla hovoříme o toxické epidermální nekrolýze (TEN), dříve známé jako Lyellův syndrom. Při zasažení kožního povrchu od deseti do třiceti procent mluvíme o přechodu SJS k toxické epidermální nekrolýze. Jednotlivé formy se považují za jednu chorobu se širokým spektrem kožních a slizničních lézí s různou závažností a odlišným rozsahem odlučování epidermis od dermis [3].
Etiologii tohoto onemocnění dosud přesně neznáme. Předpokládá se, že se jedná o následek imunologické reakce na různé zevní faktory u geneticky disponovaného jedince [28, 29]. Mezi nejvýznamnější exogenní mediátory patří léky (sulfonamidy, fenobarbital, carbamazepin, lamotrigin, acetaminophen, peniciliny, rituximab, allopurinol a další) [18]. Dále se uplatňují infekční podněty (herpes simplex [2], mycoplasma pneumonie) [19].
Patogeneze
Základním histologickým znakem SCAR je apoptóza keratinocytů. Na rozdíl od EEM, kde jsou aktivní především CD4+ T lymfocyty [4], je u SJS hlavním efektorem apoptózy klonální expanze CD8+ cytotoxických T lymfocytů [7]. Cytolýza je mediovaná sekrecí granzymu B, perforinu a některých cytokinů jako je TNF-α [21]. Jinou významnou cestou pro indukci apoptózy je zvýšená hladina Fas ligandů (FasL) [21, 26], zvláště pak její rozpustné formy (sFasL) [26].
Klinické projevy SJS
SJS začíná obvykle prodromálními symptomy (teploty, kašel, rýma, bolesti v krku, zvracení, průjmy a nechutenství). Za několik dní (1-14) dochází k erupci kožních a slizničních projevů. U plně rozvinutého onemocnění je klinický obraz SJS typický. Na červeni rtů vidíme hemoragické buly, které po prasknutí splývají v plošné krusty. Na sliznicích jsou patrny plošné eroze vzniklé stržením jednotlivých puchýřků a kryté fibrinovým náletem. Podle stupně postižení nalézáme místy až obraz pseudomembrán a hlubších vředů. Anulární eflorescence – iris – zachycujeme v ústech jen výjimečně na mastikační sliznici. Dáseň je edematózní, lividní a silně bolestivá na jakýkoli podnět. Povlak jazyka bývá zmnožený, vlhký a bělavý. Na hranách jazyka nacházíme eroze, ulcerace a někdy i imprese zubů [25]. Při rozsáhlém postižení pacient odmítá pro bolestivost příjem potravy a tekutin. Častá je i generalizovaná lymfadenopatie. Méně častými komplikacemi jsou hepatosplenomegalie, artritida, myokarditida a nefritida.
KAZUISTIKA
Na parodontologickém oddělení Stomatologické kliniky LF MU a FNUSA v Brně jsme vyšetřili devatenáctiletého pacienta. V osobní anamnéze udával Gilbertovu chorobu a dvě recidivy SJS v dětství, které byly léčeny za hospitalizace na pediatrickém oddělení nemocnice v Boskovicích. Výsledky imunohistochemického vyšetření verifikovaly klinickou diagnózu SJS. Při prvních dvou recidivách v klinickém obraze dominovalo postižení orofaciální oblasti, urogenitální sliznice postižena nebyla.
Při prvním vyšetření na parodontologickém oddělení pokrývaly retní červeň hemoragické krusty (obr. 1), na kůži však nebyly přítomny patologické změny. Jazyk byl edematózní se zmnoženým bělavým povlakem a laterálními impresemi zubů (obr. 2). Sliznice alveolárního výběžku měla charakter deskvamativní gingivitidy a byla velmi citlivá (obr. 3). Na tvářové sliznici byly rozsáhlé eroze s exsudací a fibrinovými nálety (obr. 4, obr. 5). Pacient udával zvýšenou produkci slin, bolestivost při příjmu potravy a nemožnost provádění ústní hygieny. Byl schvácený a dehydratovaný.
Image 1. Na retní červeni eroze kryté krustami medové barvy. 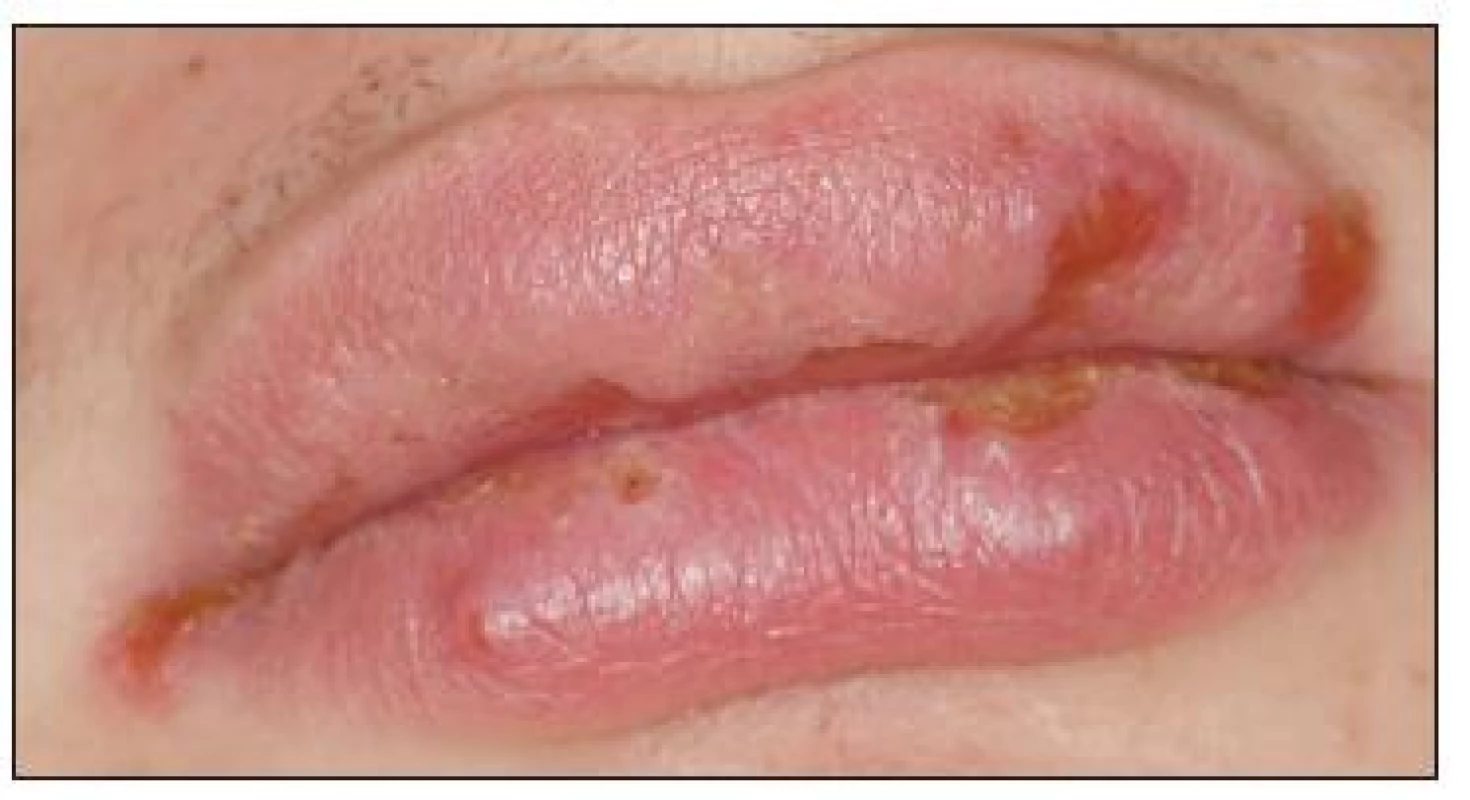
Image 2. Jazyk se zmnoženým povlakem, výsevem drobných vesikul a s laterálními impresemi zubů. 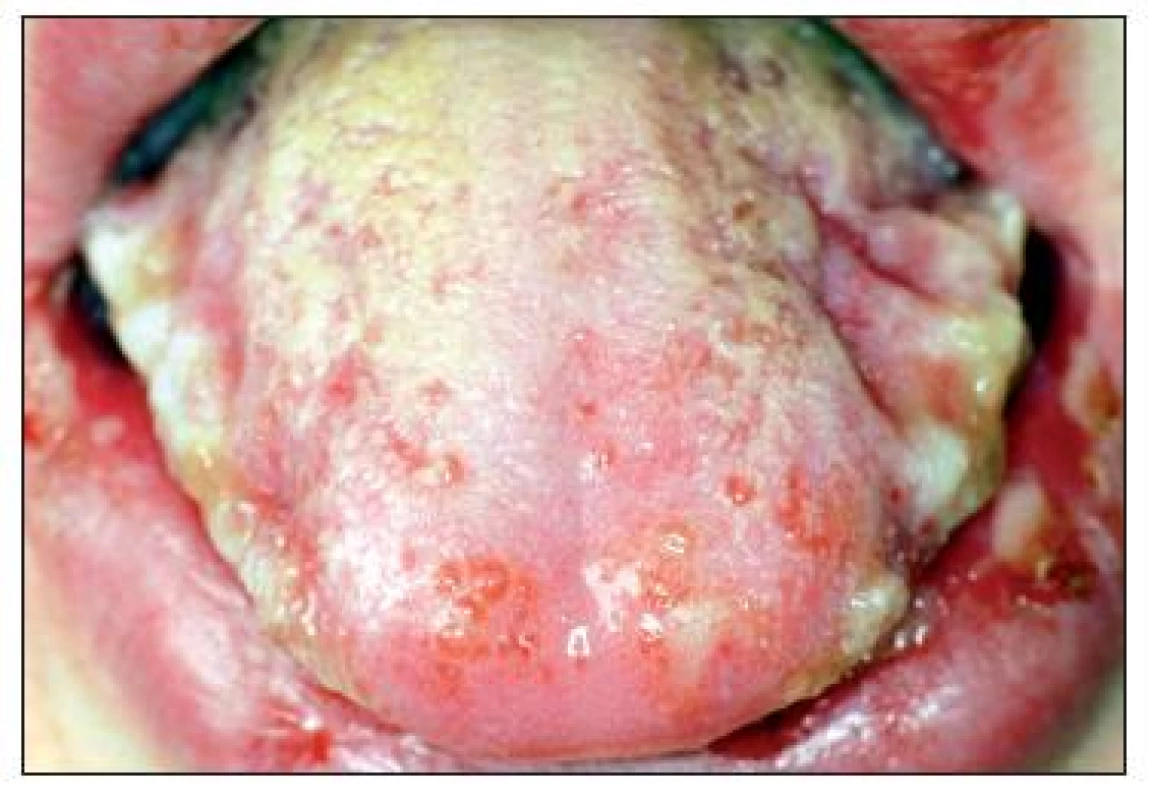
Image 3. Obraz deskvamativní gingivitidy v horní čelisti. 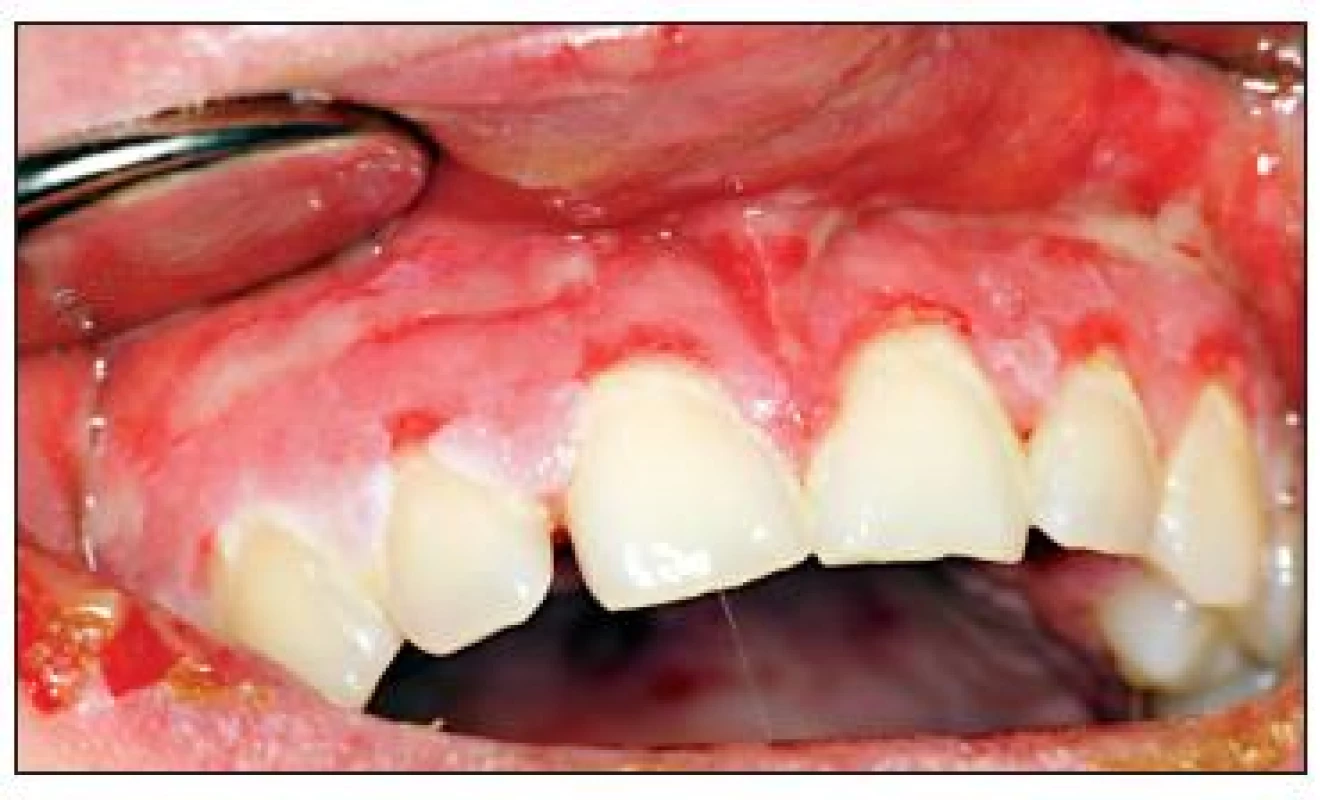
Image 4. Plošné eroze pravé tvářové sliznice kryté fibrinovými nálety. 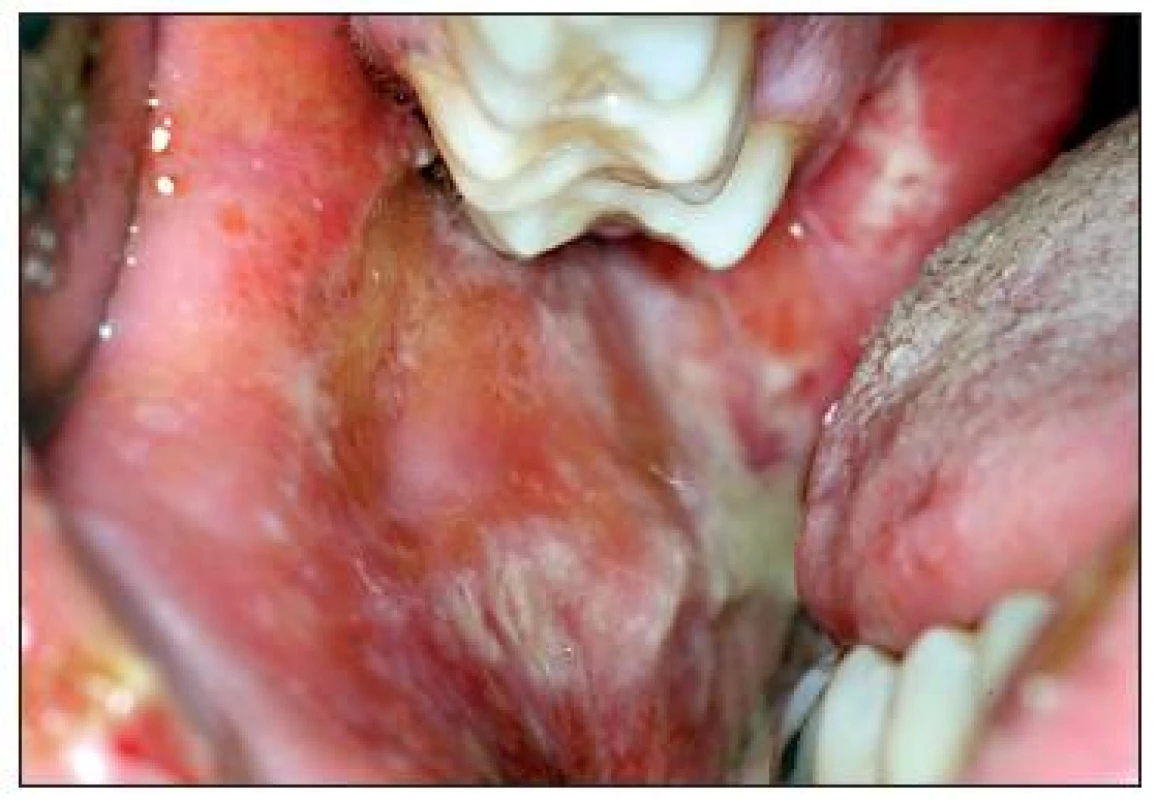
Image 5. Rozsáhlé eroze na bukání sliznici vlevo. 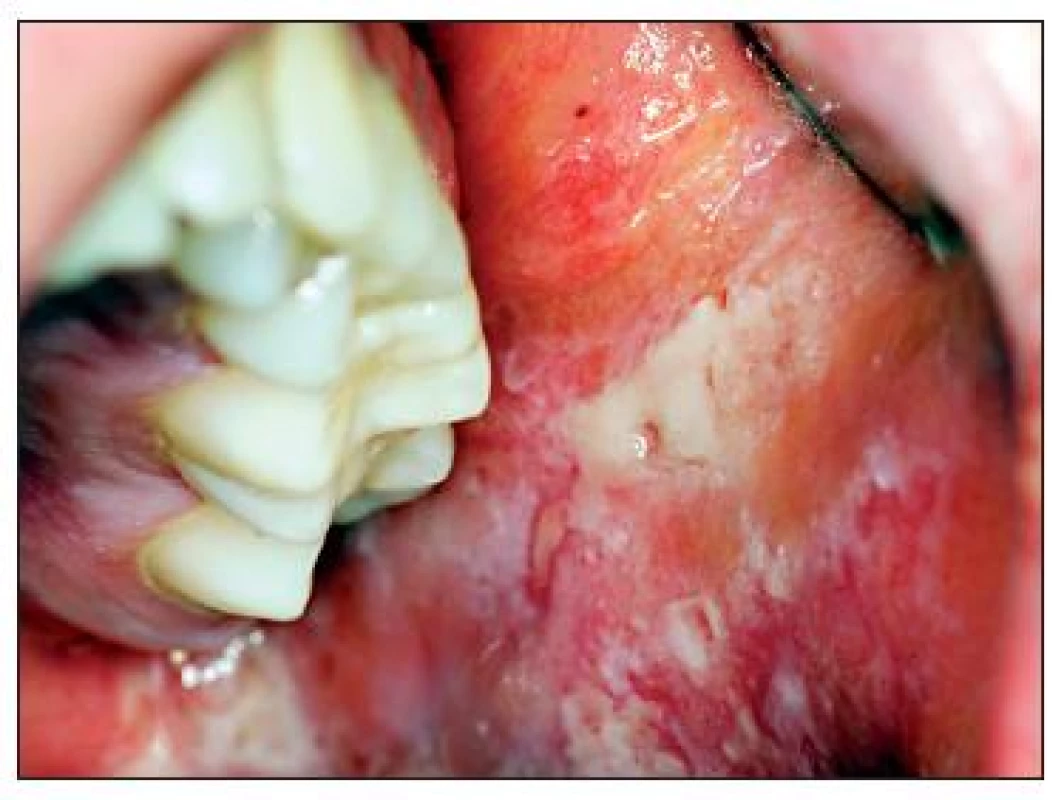
Po dvou dnech se objevily kožní eflorescence v oblasti kolen (obr. 6), beder (obr. 7) a na glans penisu (obr. 8), proto jsme pacienta hospitalizovali na lůžkovém oddělení 1. dermatovenerologické kliniky LF MU a FNUSA v Brně.
Image 6. Anulární polycyklický exantém na kůži pravého kolena. Naznačeny jsou iris formy a bělavé zbytky masti. 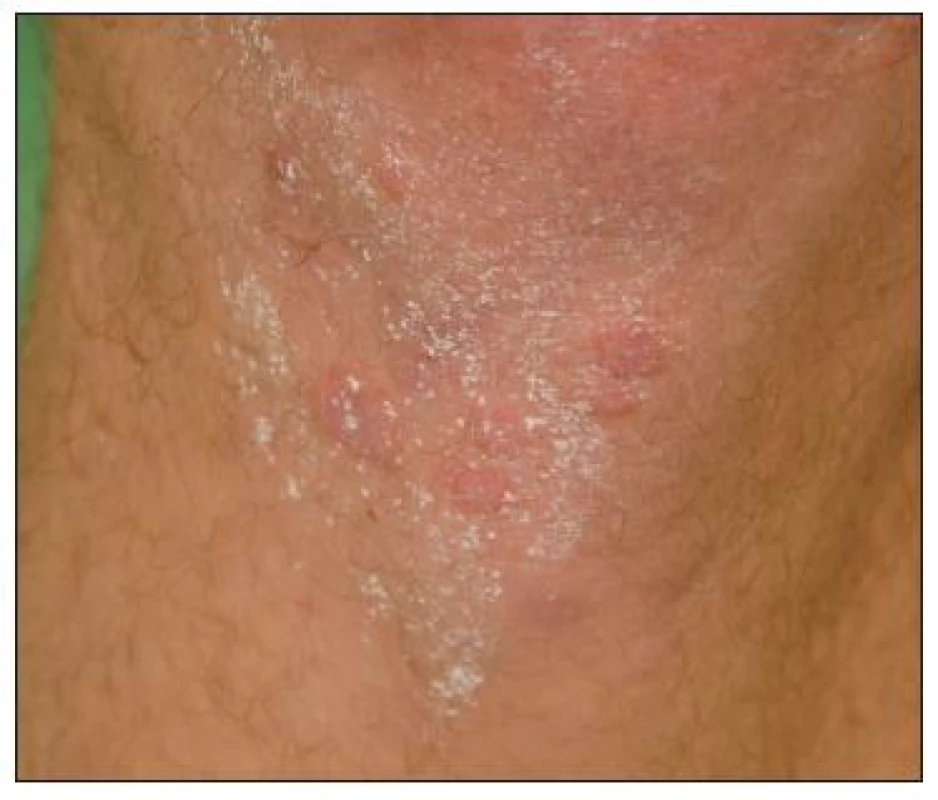
Image 7. Hemoragické krusty na kůži v oblasti beder se zarudlou spodinou. 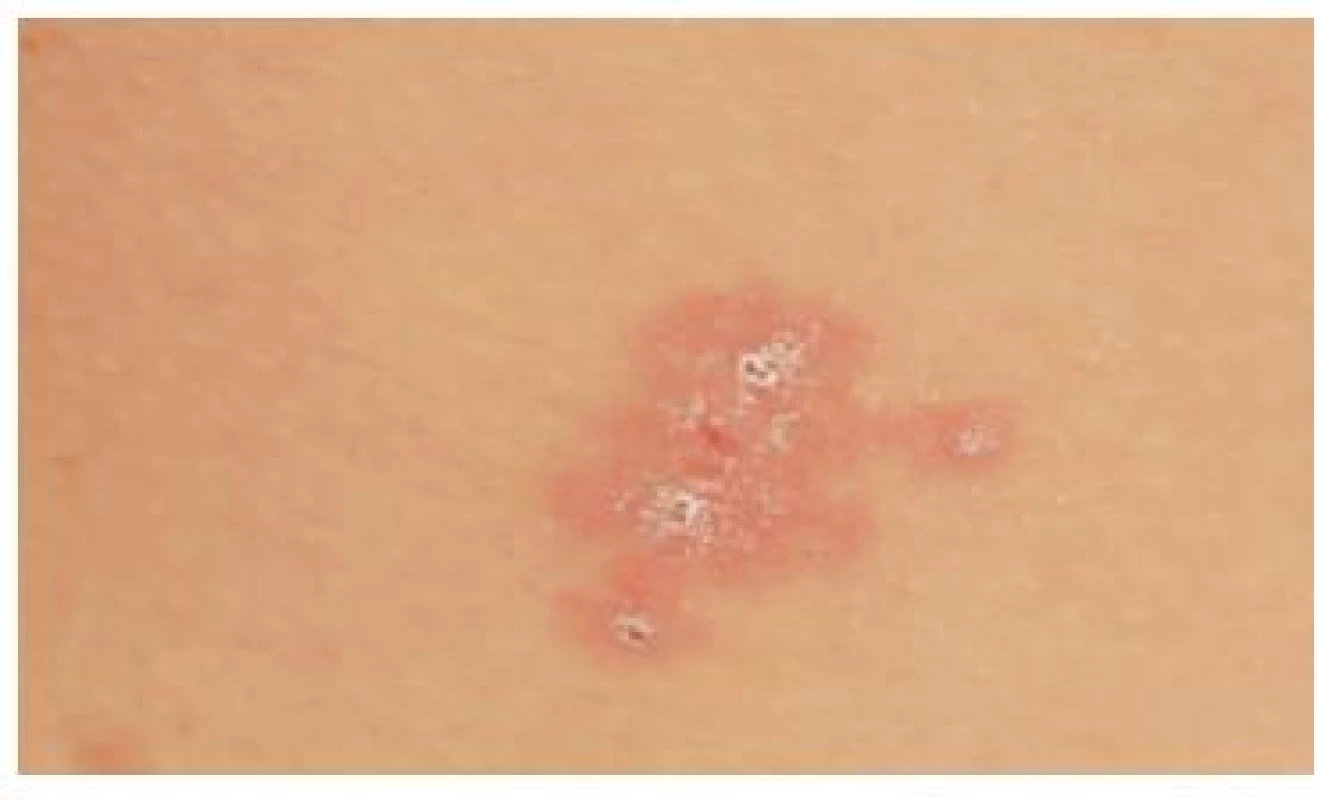
Image 8. Povleklé eroze nepravidelného geografického tvaru na glans penisu. 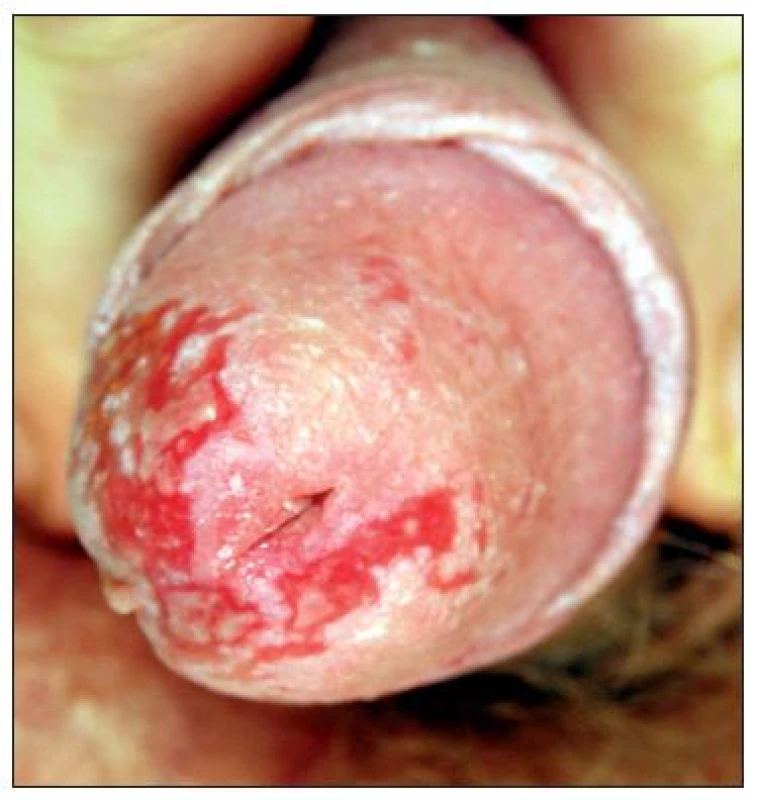
Celkově byly podávány kortikoidy (hydrokortizon, Prednison), antibiotika (Zinacef i.m. a následně Zinnat per os), Dithiaden, Herpesin, Ulcosan a KCl, k výplachům ústní dutiny šalvěj a Tantum Verde. Na kožní ložiska byl aplikován Beloderm, Fucidin a Jarischův roztok. Během hospitalizace jsme pacienta pravidelně kontrolovali na parodontologickém oddělení. Po zklidnění slizničních projevů jsme provedli nejprve supragingivální a následně i subgingivální ošetření. Pacient byl motivován k pečlivé péči o ústní dutinu. Po ukončení čtrnáctidenní hospitalizace se stav kožních a slizničních lézí výrazně zlepšil (obr. 9, obr. 10). Na bukální sliznici přetrvávaly pouze dvě drobné eroze, na kůži barevné pigmentace. Po propuštění do domácí péče pacienta pravidelně sledujeme jak na stomatologické, tak i na kožní klinice.
Image 9. Po ukončení léčby dáseň a sliznice ústní dutiny bez zánětlivých změn. 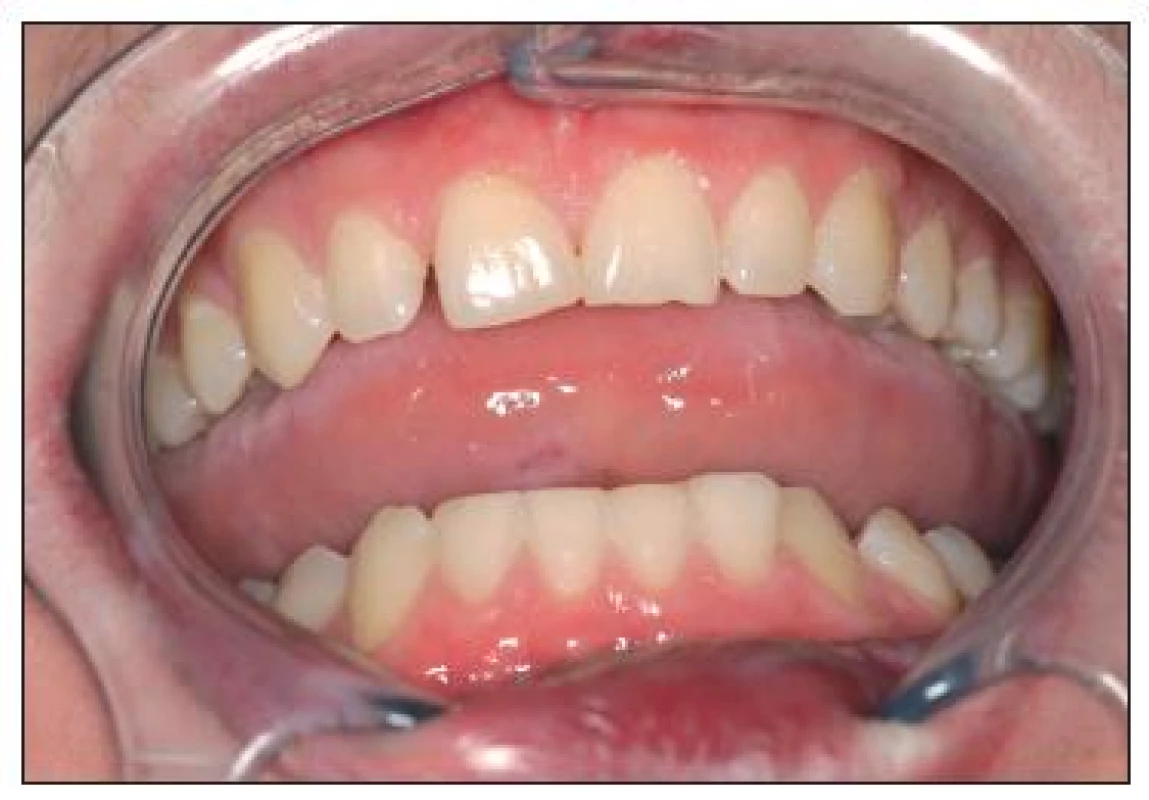
Image 10. Jazyk bez patologických eflorescencí s fyziologickým povlakem po terapii. 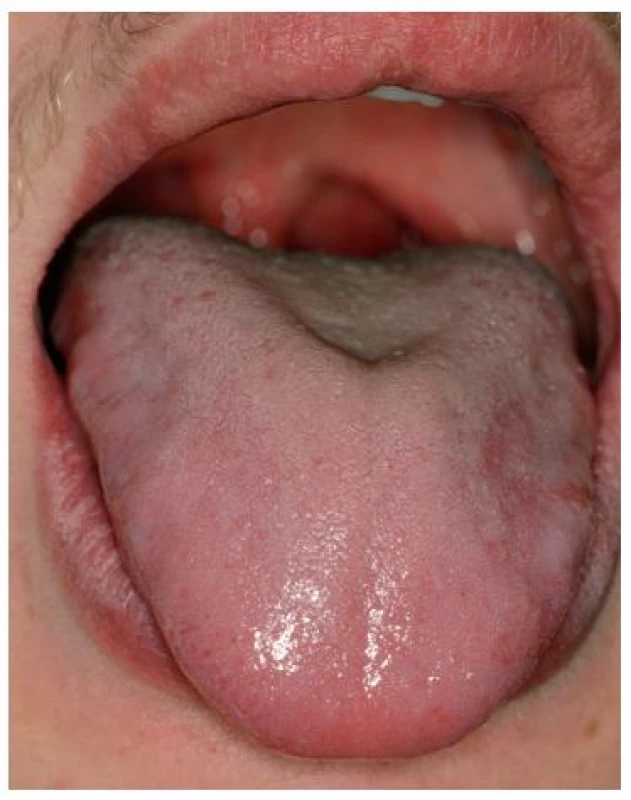
DISKUSE
Stevens-Johnsonův syndrom je onemocnění, které postihuje kůži i sliznice. Ačkoliv jeho etiopatogeneze dosud není zcela objasněna, předpokládá se účast zejména CD8+ cytotoxických lymfocytů spouštějících apoptózu keratinocytů [12]. SJS se vyskytuje s incidencí přibližně 1-2 případy na milion obyvatel za rok. Podobná incidence je i u multiformního erytému, pro který je typický sezonní výskyt [8]. Ačkoliv u některých případů SJS (i jeho závažnější formy – TEN) se vyvolávající příčinu nepodaří objasnit, u jiných pacientů bývá v anamnéze přítomna virová infekce (např. virem herpes simplex). Dalšími častými spouštěcími faktory mohou být mykoplazmové (a jiné atypické) pneumonie a užívání řady léků, které mohou vyvolávat postižení typu SCAR, do něhož patří i SJS [13, 18].
Farmaka se podílejí také v přibližně 70 % případů na rozvoji toxické epidermální nekrolýzy. V současné době známe více než 200 léků, které jsou schopny vyvolat SJS/TEN [24] . Sulfonamidy (zejména sulfamethoxazol v kombinaci s trimethoprimem), carbamazepin, phenytoin, phenobarbital, nesteroidní antiflogistika (oxicamového typu), allopurinol, chlormezanon, aminopeniciliny, cefalosporiny a chinolony patří k lékům, po jejichž podání dochází k rozvoji SCAR nejčastěji. U některých z nich roste riziko významně se zvyšující se dávkou. Dalším faktorem, který může zvyšovat riziko rozvoje SJS/TEN, je imunosupresivní stav navozený např. infekcí HIV/AIDS a radioterapií. Řada recentních studií poukazuje při rozvoji SJS/TEN také na důležitou roli genetických faktorů. HLA-B*1502 alela byla významně asociována s rozvojem SJS a TEN po podání carbamazepinu v asijské populaci.
Tato alela byla přítomna u 100 % pacientů se SJS, který se rozvinul po podání carbamazepinu, ale jen u 3 % pacientů s tolerancí tohoto léku a u 9 % osob v běžné populaci [8]. Další studie tyto pilotní výsledky potvrdily [14, 16], což naznačuje, že Asiaté nesoucí zmiňovanou alelu mají významně vyšší riziko rozvoje SJS/TEN po expozici carbamazepinu. HLA-B*1502 alela se vyskytuje ve frekvenci 10-15 % u osob z jižní Asie, ale je vzácná v Japonsku a Koreji (<1 %), a také u Evropanů (0-0,1 %) [17]. Genetická souvislost k reakcím na jiné léky než carbamazepin byla prokázána v evropské studii, kde alela HLA-B*5801 byla přítomna u 61 % pacientů s allopurinolem, indukovaným SJS/TEN [15]. Genetickým podkladem onemocnění, která se vztahují ke tkáním ústní dutiny, se zabýváme v rámci projektu SVC 1M0528 [9].
V rámci diferenciální diagnostiky je nutno odlišit jiná onemocnění, která mohou napodobovat SCAR. Jde zejména o novorozeneckou exfoliativní dermatitidu (staphylococcal scalded skin syndrome), TEN asociovanou s lupus erythematosus, Changovu nemoc, lineární IgA dermatózu, paraneoplastický pemfigus, léky indukovaný pemfigoid a akutní generalizovanou exantematózní pustulózu [20]. Pro finální diagnózu SJS/TEN se proto doporučuje provést kožní biopsii. V rámci suspektní diagnózy je vhodné vyšetřit kompletní krevní obraz, jaterní enzymy, renální funkce a rentgenogram hrudníku k posouzení případného postižení vnitřních orgánů u závažných forem onemocnění.
Nejdůležitějším aspektem terapie pacientů se SJS/TEN je rychlé stanovení diagnózy, časné vynechání „podezřelého“ léku a multidisciplinární přístup. V terapii SJS se používají kortikoidy v dávkách jeden až dva mg na kg váhy za den [11]. Použití kortikoidů v terapii vážnějších forem SCAR je však kontroverzní. Kortikoidy totiž způsobují snížení hladin nukleárního faktoru kappa beta (NF-κβ), což v přítomnosti zvýšených hladin tumor nekrotizujícího faktoru alfa (TNF-α) může zesilovat apoptózu [22]. Tato hypotéza však nebyla zatím dostatečně ověřena [27]. Araki doporučuje použít pulzní dávky kortikoidů pro terapii SJS/TEN u pacientů s oftalmologickými komplikacemi [1], jiní autoři naopak doporučují kortikoidy co nejdříve vysadit a zahájit léčbu pomocí intravenózně aplikovaných imunoglobulinů (IVIG) nebo cyklosporinu [6]. IVIG obsahují protilátky proti Fas, což zpomaluje apoptózu keratinocytů kompetitivní inhibicí s FasL [30]. Účinnost IVIG je vysoká v případě včasného nasazení – tedy co nejdříve po rozvoji onemocnění a při podání dostatečně vysoké dávky (alespoň 2 g/kg) [5]. IVIG zkracují dobu hojení a zamezují případnému dalšímu rozvoji onemocnění. Cyklosporin inhibuje aktivaci CD8+ lymfocytů, čímž redukuje epidermální destrukci. Jak IVIG tak cyklosporin se zdají být vhodnými kandidáty na účinnější a především rychlejší zvládnutí vážných forem SCAR [10]. Porovnání účinnosti terapie kortikoidů s IVIG je však obtížné kvůli velmi rozdílným léčebným postupům v jednotlivých léčebných centrech [27]. V experimentech se v současné době zkouší k terapii SCAR také cyklofosfamid, plazmaferéza, nebo anti-TNFα (Infliximab). Výsledky těchto studií je třeba ještě ověřit jak experimentálně, tak i klinicky.
ZÁVĚR
V příspěvku jsme prezentovali kazuistiku pacienta se SJS, u něhož byla diagnóza zřejmá a potvrzená histologickým vyšetřením při první atace choroby. Onemocnění se manifestovalo po infekci virem herpes simplex. Pokusili jsme se zdůraznit nutnost multidisciplinárního přístupu k léčbě atak, které nemusí být vždy stejného charakteru a rozsahu. Léčba našeho pacienta s použitím kortikoidů vedla ke zlepšení a stabilizaci onemocnění. Závěrem lze říci, že pacienti, u nichž je podezření na SCAR, by měli být léčeni ve specializovaných centrech, která mají s terapií těchto stavů zkušenosti.
Podpora: Stomatologické výzkumné centrum 1M0528.
MUDr. Jan Vokurka
Stomatologická klinika LF MU a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: vok@mail.muni.cz
Sources
1. Araki, Y., Sotozono, C., Anatomi, T., Ueta, M., Yokoi, N., Ueda, E., Kishimoto, S., Kinoshita, S.: Successful treatment of Stevens-Johnson syndrome with steroid pulse therapy at disease onset. Am. J. Ophthalmol., roč. 147, 2009, s. 1004-1011.
2. Aurelian, L., Ono, F., Burnett, J.: Herpes simplex virus (hsv)-associated erythema multiforme (haem): A viral disease with an autoimmune component. Dermatol. Online J., roč. 9, 2003, s. 1.
3. Bastuji-Garin, S., Rzany, B., Stern, R., Sudar, N., Naldi, L., Roujeau, J.: Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch. Dermatol., roč. 129, 1993, s. 92-96.
4. Caproni, M., Torchia, D., Schincaglia, E., Volpi, W., Frezzolini A., Schena D., Marzano A., Quaglino P., De Simone C., Parodi A., Barletta E., Fabbri P.: The cd40/cd40 ligand system is expressed in the cutaneous lesions of erythema multiforme and Stevens - Johnson syndrome/toxic epidermal necrolysis spectrum. Br. J. Dermatol., roč. 154, 2006, s. 319-324.
5. French, L., Trent, J., Krdel, F.: Use of intravenous immunoglobulin in toxic epidermal necrolysis and Stevens-Johnson syndrome: Our current understanding. Int. Immunopharmacol, roč. 6, 2006, s. 543-549.
6. Fromowitz, J., Ramos-Caro, F., Flowers, F.: Practical guidelines for the management of toxic epidermal necrolysis and Stevens-Johnson syndrome. Int. J. Dermatol., roč. 46, 2007, s. 1092-1094.
7. Chave, T. A., Mortimer, N. J., Sladden, M. J., Hall, A. P., Hutchinson, P. E.: Toxic epidermal necrolysis: Current evidence, practical management and future directions. British Journal of Dermatology, roč. 153, 2005, s. 241-253.
8. Chung, W., Hung, S., Hong, H., Hsih, M., Yang, L., Ho, H., Wu, J., Chen, Y.: Medical genetics: A marker for Stevens-Johnson syndrome. Nature, roč. 428, 2004, s. 486.
9. Izakovičová Hollá, L., Fassmann, A., Kupletová, M., Sazmová, V.: Papillon-Lefevre syndrom: kazuistika. Praktické zubní lékařství, roč. 57, 2009, s. 31-36.
10. Khalili, B., Bahna, S.: Pathogenesis and recent therapeutic trends in Stevens-Johnson syndrome and toxic epidermal necrolysis. Ann Allergy Asthma Immunol., roč. 97, 2006, s. 272-280.
11. Lam, N., Yang, Y., Wang, L., Lin, Y., Chiang, B.: Clinical characteristics of childhood erythema multiforme, Stevens-Johnson syndrome and toxic epidermal necrolysis in taiwanese children. J. Microbiol. Immunol. Infect, roč. 37, 2004, s. 366-370.
12. Le Clech, L., Delaire, S., Boumsell, L., Bagot, M., Bourgault-Villada, I., Bensussan, A., Roujeau, J.: Blister fluid t lymphocytes during toxic epidermal necrolysis are functional cytotoxic cells which express human natural killer (nk) inhibitory receptors. Clin. Exp. Immunol., roč. 119, 2000, s. 225-230.
13. Levi, N., Bastuji-Garin, S., Mockenhaupt, M., Roujeau, J. C., Flahault, A., Kelly, J. P., Martin, E., Kaufman, D. W., Mason, P.: Medications as risk factors of Stevens-Johnson syndrome and toxic epidermal necrolysis in children: A pooled analysis. Pediatrics, roč. 123, 2009, s. 297-304.
14. Locharernkul, C., Loplumlert, J., Limotai, C., Korkij, W., Desudchit, T., Tongkobpetch, S., Kangwanshiratada, O., Hirankarn, N., Suphapeetiporn, K., Shotelersuk, V.: Carbamazepine and phenytoin induced Stevens-Johnson syndrome is associated with hla-b*1502 allele in thai population. Epilepsia, roč. 49, 2008, s. 2087-2091.
15. Lonjou, C., Borot, N., Sekula, P., Ledger, N., Thomas, L., Halevy, S., Naldi, L., Bouwes-Bavinck, J., Sidoroff, A., de Toma, C., Schumacher, M., Roujeau, J., Hovnanian, A., Mockenhaupt, M.: A european study of hla-b in Stevens-Johnson syndrome and toxic epidermal necrolysis related to five high-risk drugs. Pharmacogenet Genomics, roč. 18, 2008, s. 99-107.
16. Man, C., Kwan, P., Baum, L., Yu, E., Lau, K., Cheby, A., Ng, M.: Association between hlab* 1502 allele and antiepileptic drug-induced cutaneous reactions in han chinese. Epilepsia, roč. 48, 2007, s. 1015-1018.
17. Miller, J.: Of race, ethnicity, and rash: The genetics of antiepileptic drug-induced skin reactions. Epilepsy Curr, roč. 8, 2008, s. 120-121.
18. Mockenhaupt, M., Vinouc, C., Dunant, A., Naldi, L., Halevy, S., Bouwes Bavinck, J., Sidoroff, A., Schneck, J., Roujeau, J., Flahault, A.: Stevens-Johnson syndrome and toxic epidermal necrolysis: Assessment of medication risks with emphasis on recently marketed drugs. The euroscar-study. J. Incest. Dermatos., roč. 128, 2008, s. 35-44.
19. Mulvey, J., Padowitz, A., Lindley-Jones, M., Nickels, R.: Mycoplasma pneumonie associated with Stevens Johnson syndrome. Anaesth Intensive Care, roč. 35, 2007, s. 414-417.
20. Pereira, F., Mudgil, A., Rosmarin, D.: Toxic epidermal necrolysis. J. Am. Acad. Dermatol., roč. 56, 2007, s. 181-200.
21. Posada, S., Padial, A., Torres, M., Katorga, C., Leyva, L., Sanchez, E., Alvarez, J., Romano, A., Juarez, C., Blanca, M.: Delayed reactions to drugs show levels of perforin, granzyme b, and fas-l to be related to disease severity. J. Allergy Clin. Immunol., roč. 109, 2002, s. 155-161.
22. Qin, J., Chaturvedi, V., Denning, M., Choubey, D., Diaz, M., Nickoloff, B.: Role of nfkappab in the apoptotic-resistant phenotype of keratinocytes. J. Biol. Chem., roč. 274, 1999, s. 37957-37964.
23. Roujeau, J.: The spectrum of Stevens-Johnson syndrome and toxic epidermal necrolysis: A clinical classification. J. Incest. Dermatol., roč. 102, 1994, s. 28-30.
24. Roujeau, J., Kelly, J., Naldi, L., Rzany, B., Stern, R., Anderson, T., Auquier, A., Bastuji-Garin, S., Correia, O., Počati, F.: Medication use and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. N. Engl. J. Med., roč. 333, 1995, s. 1600-1607.
25. Scully, C., Bagan, J.: Oral mucosal diseases: Erythema multiforme. Br. J. Oral Maxillofac. Surg., roč. 46, 2008, s. 90-95.
26. Stur, K., Karlhofer, F., Stingl, G.: Soluble fas ligand: A discriminating feature between drug-induced skin eruptions and viral exanthemas. J. Incest. Dermatol., roč. 127, 2007, s. 802-807.
27. Schneck, J., Fagot, J., Sekula, P., Sassolas, B., Roujeau, J., Mockenhaupt, M.: Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective euroscar study. J. Am. Acad. Dermatol., roč. 58, 2008, s. 33-40.
28. Tassaneeyakul, W., Jantararoungtong, T., Chen, P., Lin, P., Tiamkao, S., Khunarkornsiri, U., Chucherd, P., Konyoung, P., Vannaprasaht, S., Choonhakarn, C., Pisuttimarn, P., Sangviroon, A.: Strong association between hla-b*5801 and allopurinol-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in a thai population. Pharmacogenet Genomics, roč. 19, 2009, s. 704-709.
29. Ueta, M., Sotozono, C., Anatomi, T., Kojima, K., Hamito, J., Kinoshita, S.: Association of fas ligand gene polymorphism with Stevens-Johnson syndrome. Br. J. Ophthalmol., roč. 92, 2008, s. 989-991.
30. Viard, I., Wehrli, P., Bullani, R., Schneider, P., Holler, N., Salomon, D., Hunziker, T., Saurat, J. H., Tschopp, J., French, L. E.: Inhibition of toxic epidermal necrolysis by blockade of cd95 with human intravenous immunoglobulin. Science, roč. 282, 1998, s. 490-493.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2010 Issue 3-
All articles in this issue
- Povrch dentálních implantátů a jeho vliv na interakci s biologickým prostředím (Souborný referát)
- Kam směřuje vývoj polymeračních lamp?
- Stav orálního zdraví žen s fyziologickým a rizikovým těhotenstvím – předběžné výsledky
- K problematice poruch tvorby tvrdých zubních tkání a prořezávání zubů (Kazuistika)
- Stevens-Johnsonův syndrom a jeho projevy v ústní dutině (Kazuistika)
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stevens-Johnsonův syndrom a jeho projevy v ústní dutině (Kazuistika)
- K problematice poruch tvorby tvrdých zubních tkání a prořezávání zubů (Kazuistika)
- Povrch dentálních implantátů a jeho vliv na interakci s biologickým prostředím (Souborný referát)
- Kam směřuje vývoj polymeračních lamp?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

