-
Medical journals
- Career
Onemocnění parodontu u dětí a adolescentů
: K. Musilová 1; M. Kukletová 1; L. Izakovičová Hollá 1,2
: Stomatologická klinika LF MU a FN, Brno 1; Ústav patologické fyziologie LF MU, Brno 2
: Česká stomatologie / Praktické zubní lékařství, ročník 108, 2008, 2, s. 16-22
:
Onemocnění parodontu patří mezi nejběžnější chronické choroby postihující lidstvo. V současnosti se tyto nemoci dostávají do centra zvýšené pozornosti, protože se ukázalo, že souvisejí nejenom s orálním zdravím, ale že také mohou mít vztah k řadě celkových nemocí, jakými jsou např. diabetes mellitus či kardiovaskulární onemocnění. Nomenklatura a klasifikační systémy používané k popisu onemocnění parodontu se v průběhu posledních dekád výrazně měnily, což vede k problémům při porovnávání literárních údajů o prevalenci, etiopatogenezi a léčbě v různých časových obdobích. U dětí a adolescentů se onemocnění parodontu může vyskytovat v různých formách od limitovaného postižení pouze gingivy až po formy manifestující se destrukcí kosti s eventuální ztrátou zubů. V práci je prezentována v současnosti používaná klasifikace onemocnění parodontu a jsou zde podrobněji rozebrány klinické jednotky postihující děti a mladé osoby.
Klíčová slova:
gingiva - parodontitida - dětský věk - adolescence - plakÚVOD
Onemocnění parodontu patří mezi nejběžnější chronické choroby postihující lidstvo. V současnosti se tyto nemoci dostávají do centra zvýšené pozornosti, protože se ukázalo, že souvisejí nejenom s orálním zdravím, ale že také mohou mít vztah k celkovému zdravotnímu stavu (zejména k diabetu, ke kardiovaskulárním chorobám nebo cévním mozkovým příhodám) [15, 22, 38]. Onemocnění parodontu je tak dnes chápáno jako multifaktoriální problém iniciovaný a udržovaný bakteriemi, ale významně ovlivňovaný odpovědí organismu na bakteriální plak [41]. Zatímco nekomplikovaná gingivitis může být běžným průvodním jevem nedostatečné orální hygieny, progrese do parodontitidy se ztrátou podpůrných tkání je ovlivňována řadou faktorů, včetně genetické predispozice [19]. Přesné mechanismy této progrese jsou nejasné. V některých případech může zánět dásní představovat časné stadium vývoje parodontitis. Naopak u jiných osob může gingivitida existovat jako nezávislá klinická jednotka bez progrese do parodontitidy, což nevylučuje možnost, že gingivitis a parodontitis jsou zcela samostatné nemoci [9]. Primárním etiologickým faktorem u řady chorob parodontu je mikrobiální plak. Přítomnost určitých mikroorganismů v plaku se zdá být nezbytnou, ale sama o sobě není dostatečnou podmínkou vzniku onemocnění [32]. Řada jak lokálních (např. supragingivální či subgingivální zubní kámen, anatomické anomálie, malokluze, nesprávně zhotovené výplně či protetické práce, ortodontické aparátky) tak i systémových faktorů může negativně ovlivňovat účinek plaku. Mezi systémové faktory, které jsou pokládány za „rizikové“ pro rozvoj onemocnění parodontu, patří věk, pohlaví, socioekonomický status, kouření, systémové choroby (diabetes mellitus, HIV/AIDS, příp. další imunodeficience, „dobře definované“ genetické nemoci – Papillon-Lefevre a Downův syndrom) a užívání některých léků [21].
KLASIFIKACE CHOROB PARODONTU
Nomenklatura a klasifikační systémy používané k popisu onemocnění parodontu se periodicky měnily v průběhu posledních dekád (tab. 1) [31]. To vede k určitým problémům při porovnávání literárních údajů o prevalenci, etiopatogenezi a léčbě v různých časových obdobích. Konsenzus z roku 1989 používal k rozlišení různých forem onemocnění následující kritéria: 1. věk vývoje, 2. rychlost progrese onemocnění, 3. lokalizace postižených míst, 4. přítomnost či nepřítomnost systémových onemocnění, 5. přítomnost či absence specifických mikrobiálních či hostitelských faktorů, a 6. odpověď na terapii [1]. Tato klasifikace byla zjednodušena v roce 1994 [4] a později, v roce 1999, bylo popsáno nové rozdělení [2], u něhož je kladen větší důraz na klinický průběh onemocnění než na dobu vzniku a rozvoje onemocnění (tab. 2).
1. Klasifikace chorob parodontu. 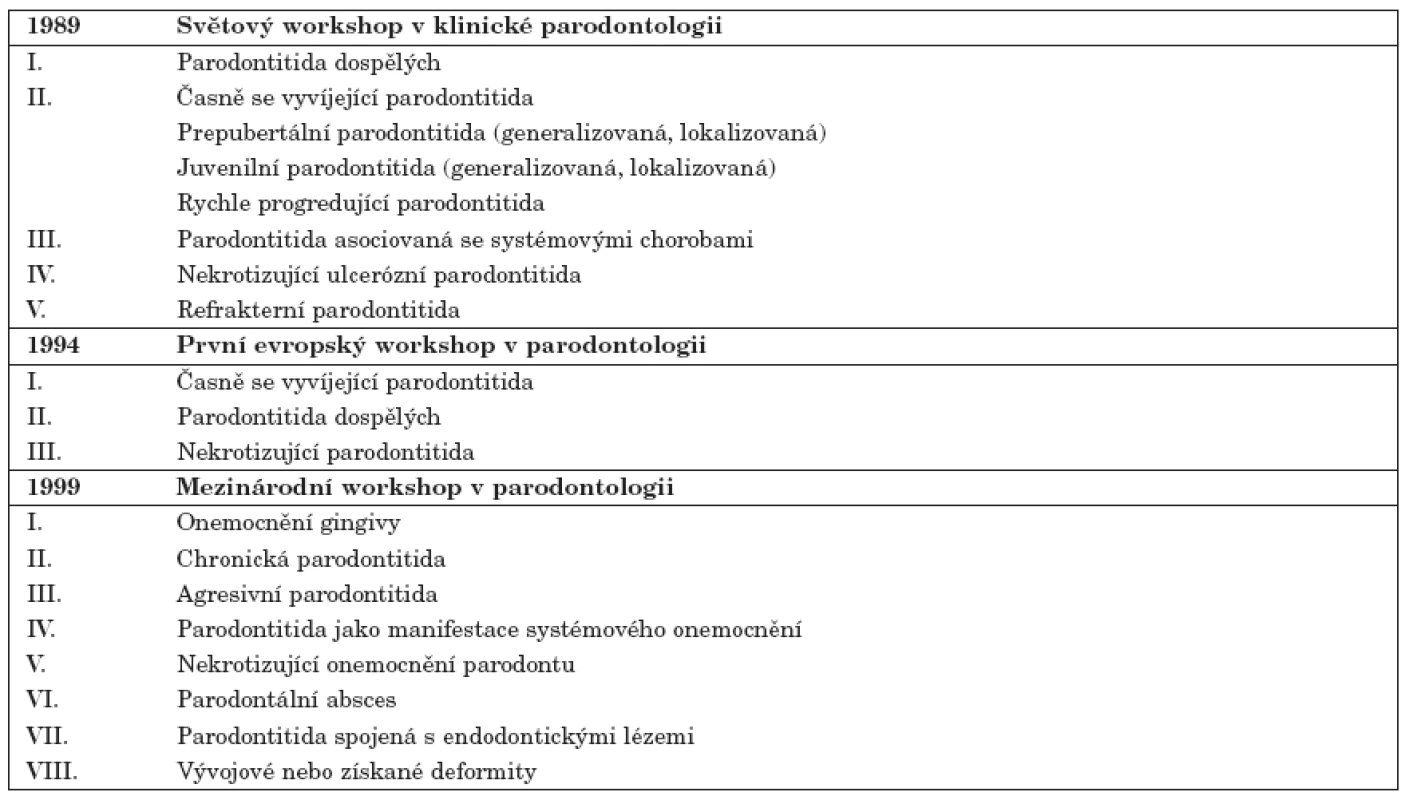
2. Klasifikace chorob parodontu (Armitage 1999.) 
ONEMOCNĚNÍ PARODONTU U DĚTÍ A DOSPĚLÝCH
U dětí a adolescentů se může onemocnění parodontu vyskytovat v různých formách od limitovaného postižení pouze gingivy až po formy manifestující se destrukcí kosti s eventuální ztrátou zubů. Klinicky odlišné formy postižení parodontu, postihující mladé osoby, zahrnují zejména následující skupiny:
- I.Plakem podmíněné postižení gingivy (dental plaque-induced gingival diseases)
- II . Chronickou parodontitidu (chronic periodontitis)
- III. Agresivní parodontitidu (aggressive periodontitis)
- IV. Parodontitidu manifestující se v rámci systémového onemocnění (periodontitis as a manifestation of systemic diseases)
- V.Nekrotizující onemocnění parodontu (necrotizing periodontal diseases)
1. ONEMOCNĚNÍ GINGIVY
Řadíme sem zejména plakem indukovanou chronickou gingivitidu a onemocnění gingivy modifikované systémovými faktory endokrinní povahy. Jsou charakterizovány přítomností zánětu marginální gingivy bez detekovatelné ztráty kosti nebo závěsného aparátu [3].
Plakem indukovaná gingivitis je běžným nálezem u dětí i adolescentů. Mikrobiologie tohoto onemocnění je celkem složitá a není dosud zcela pochopena; zvýšené hladiny Actinomyces sp., Capnocytophaga sp., Leptotrichia sp. a Selenomonas sp. byly popsány u experimentálně vyvolané gingivitidy u dětí [28]. U plakem indukované gingivitis můžeme histopatologicky rozlišit 3 stadia [33]. V první, iniciální fázi, která se vyvíjí po dvou až čtyřech dnech tvorby plaku, dochází k rozvoji akutní zánětlivé reakce s charakteristickou vazodilatací, zrychlením průtoku krve postiženou tkání a zvýšenou permeabilitou cévní stěny, což vede k zánětlivému edému gingivy a zvýšené exsudaci tekutiny z gingiválního sulku. Díky chemotaktickému působení látek uvolňovaných bakteriemi i aktivovanými buňkami postižené tkáně dochází ke zvýšené migraci neutrofilních leukocytů do spojovacího epitelu a gingiválního sulku. Mediátory leukocytů, spolu se složkami aktivovaného komplementu, kininového systému a produkty kyseliny arachidonové dále amplifikují zánětlivou reakci, což vede k rozvolnění koronární části spojovacího epitelu a degradaci kolagenních vláken. Ve druhé, časné fázi, která se vyvíjí v průběhu cca 14 dnů, dochází ve vazivu, v těsném sousedství spojovacího epitelu, k nahromadění lymfocytů. V infiltrátu dominují zejména T-lymfocyty (70-90 %) a aktivované makrofágy (7-16 %). Počíná proliferace spojovacího epitelu laterálním směrem do vazivové tkáně a tvorba epiteliálních lišt. Ve třetí fází, která se rozvíjí v průběhu několika týdnů, je v infiltrátu patrný přesun k B-lymfocytům a plazmatickým buňkám. Pokračuje proliferace spojovacího epitelu apikálně a laterálně. Pokud proces pokračuje neovlivněn dále, rozšíří se na závěsný aparát a alveolární kost; dochází k jejich destrukci a k tvorbě pravého parodontálního chobotu. Nutno je ovšem zmínit, že patologický proces neprobíhá stále ve stejné intenzitě, střídají se fáze akutní exacerbace a chronické stagnace.
Hormonálně vyvolaná gingivitida se manifestuje v období nárůstu hladin pohlavních hormonů. Kolísání hormonů během puberty (ale také při užívání orálních kontraceptiv a u dospělých v průběhu těhotenství) je spojeno se zvýšeným prokrvením a modifikací zánětlivé odpovědi na přítomný plak [29]. Podobně také změny hladin inzulinu u pacientů s diabetem mohou ovlivňovat stav gingivy a zvyšovat zánětlivou odezvu [34]
2. PARODONTITIDA
U dětí i adolescentů se může vyvinout některá z forem parodontitidy popsaných v pojednání mezinárodního workshopu pro klasifikaci onemocnění parodontu (International Workshop for a Classification of Periodontal Diseases and Conditions) z roku 1999 (agresivní parodontitida, chronická parodontitida a parodontitida manifestující se v rámci systémového onemocnění). Chronická parodontitida je běžnější u dospělých, kdežto agresivní forma se může častěji vyskytovat právě u dětí a adolescentů [2].
Základními rysy agresivní parodontitidy jsou rychlý průběh ztráty závěsného aparátu a kosti, často s familiárním výskytem. Sekundárními znaky mohou být abnormality fagocytárních funkcí leukocytů u nemocných. Agresivní parodontitidu můžeme rozdělit do dvou skupin: na formu lokalizovanou (LAgP) a generalizovanou (GAgP). U pacientů s LAgP nalézáme interproximální ztráty úponu u nejméně dvou stálých prvních molárů a řezáků, přičemž nejsou postiženy více než dva další zuby jiné než první moláry a řezáky. Pacienti s GAgP vykazují generalizované postižení závěsného aparátu u nejméně tří zubů jiných než první moláry či řezáky. Vývoj těchto onemocnění často spadá do pubertálního období.
LAgP se vyskytuje u dětí a adolescentů bez klinických známek systémového onemocnění a je provázeno závažnými ztrátami alveolární kosti kolem stálých zubů, přičemž některé retrospektivní nálezy poukazují i na kostní ztráty v dočasné dentici [37]. Vazebné studie na segregované populaci v Marylandu prokázaly vztah agresivní parodontitidy k markeru na chromozomu 4 [8]. Další studie nepotvrdily tuto vazbu, což naznačuje, že při rozvoji tohoto onemocnění lze předpokládat určitou genetickou a/nebo etiologickou heterogenitu [25]. Prevalence se pohybuje mezi 0,02 % – 0,8 % v geograficky odlišných populacích, přičemž častější výskyt je u Afro-americké populace [35]. I přesto, že řada studií poukázala na relativně nízký výskyt plaku a zubního kamene u pacientů s LAgP, některé další práce toto nepotvrdily. Také není znám specifický bakteriální druh, který by se našel u všech pacientů s LAgP, což opět naznačuje jistou heterogenitu, tentokrát mikrobiální flóry, podílející se na rozvoji onemocnění. Mezi nejčastěji detekované bakterie patří zejm. Actinobacillus actinomycetemcomitans (A.a.) v kombinaci s Bacteroides [18]. U některých populací byla popsána též přítomnost Eubacterium sp.[17]. Mezi funkčními defekty neutrofilů, popisovanými u pacientů s LAgP, jsou nalézány zejména abnormality chemotaxe [39], fagocytózy [10], baktericidní aktivity a produkce superoxidů [36], exprese FcgRIIIB (CD16), tvorby leukotrienu B4 (LTB4) a Ca2+ kanálu s následným defektem intracelulární signalizace [13, 20].
GAgP může začít v kterémkoliv věku, i když nejčastěji se manifestuje u adolescentů a mladých dospělých. Postihuje dentici ve větším rozsahu a je provázena výrazným zánětem s velkou kumulací plaku a zubního kamene. V subgingiválním plaku jsou často zastoupeny nepohyblivé, fakultativně anaerobní G - bakterie druhu Porphyromonas gingivalis (P.g.) či Treponema denticola (T.d.) [11]. Neutrofily u pacientů s GAgP mohou vykazovat nižší chemotaktickou aktivitu, podobně jako u pacientů s LAgP [23]. U nemocných s agresivní parodontitidou bývají prokazovány i změny některých dalších imunologických parametrů, jako jsou např. hladiny IgG v séru, což může ovlivňovat protilátkovou imunitní odpověď na infekci parodontálními patogeny [7].
Klasifikace z roku 1989 obsahovala kategorii označenou jako „prepubertální parodontitida“ (PP), která měla dvě formy: lokalizovanou (LPP) a generalizovanou (GPP). Tato kategorie byla vytvořena k popsání vzácných stavů, kde u dětí s dočasnou denticí byla přítomna těžká destrukce parodontu s rychlou ztrátou kosti, pohyblivostí zubů a jejich časnými ztrátami. Nyní je zřejmé, že většina pacientů, kteří byli klasifikováni jako nemocní s generalizovanou prepubertální parodontitidou, trpí některým systémovým onemocněním, které interferuje s odolností k bakteriálním infekcím. Takovými chorobami mohou být stavy vrozené imunodeficience [5], defekt adherence leukocytů[27]) nebo cyklická neutropenie. V nové klasifikaci [2] je proto tato skupina řazena mezi parodontitidy asociované se systémovými chorobami.
Chronická parodontitida se nejčastěji manifestuje u dospělých, ale může se vyskytnout také u dětí a adolescentů. Je charakterizována pomalým stupněm progrese a může mít jak formu lokalizovanou (s postižením méně než 30 % dentice) tak i generalizovanou. Závažnost onemocnění klasifikujeme ve třech stupních: jako mírné při ztrátě 1-2 mm úponu, střední při ztrátě 3-4 mm, nebo těžké při ztrátě úponu větší než 5 mm [2].
U pacientů se závažným systémovým onemocněním, které predisponuje k rozvoji destruktivního postižení parodontu, se parodontitida označuje jako parodontitida manifestující se v rámci systémového onemocnění [27]. Klasifikace z roku 1999 [2] uvádí seznam systémových onemocnění, u nichž je parodontitida často přítomná. Mezi tyto choroby patří genetické poruchy, např. Papillon-Lefévre syndrom [19, 30], Chediak-Higashi syndrom, Downův syndrom [24], hypofosfatémie [40], defekt adherence leukocytů, geneticky podmíněná agranulocytóza [12] a hematologická onemocnění, jako je cyklická neutropenie [14] či leukémie. Diabetes mellitus není zařazen mezi tyto nemoci vzhledem k tomu, že může modulovat průběh všech forem onemocnění parodontu a neexistuje „specifický typ parodontitidy“ asociovaný s DM.
3. NEKROTIZUJÍCÍ ONEMOCNĚNÍ PARODONTU
Nekrotizující onemocnění parodontu se u dětí vyskytuje s variabilní, ale nízkou frekvencí (méně než 1% u evropských populací). Vyšší frekvence (2-5%) jsou popisovány v Africe, Ázii či Jižní Americe. U postižených osob jsou přítomny nekrózy a ulcerace parodontálních tkání, které bývají značně bolestivé. Faktory predisponující k rozvoji onemocnění zahrnují infekce (včetně HIV), malnutrici, emoční stres a různé systémové choroby [6].
ZÁVĚR
Závěrem lze shrnout, že děti a adolescenti mohou trpět různorodým onemocněním parodontu, které se u nich sice vyskytuje s nižší prevalencí, ale zato častěji se závažnějším průběhem než u dospělých [31]. V některých případech je destruktivní postižení parodontu součástí známého systémového onemocnění, jindy je příčina neznámá. Onemocnění mívá často familiární výskyt, což naznačuje důležitou roli genetických faktorů v etiopatogenezi. Výzkumem genů hrajících úlohu u parodontopatií se zabývá několik světových pracovišť, avšak na rozdíl od řady dalších multigenně podmíněných nemocí (kardiovaskulárních, nádorů či alergických chorob) je problematika „genetického pozadí“ u onemocnění parodontu prozkoumána velmi málo a dosažené výsledky jsou často protichůdné.
Protože dosud nedokážeme předcházet vzniku onemocnění parodontu u všech jedinců (primárně preventivní intervence je možná až při detailním objasnění etiopatogeneze těchto chorob), o to naléhavěji vystupuje do popředí potřeba sekundárně preventivních zásahů. Vzhledem k tomu, že časná diagnostika (zejména v presymptomatických či incipientních stadiích) představuje zatím největší šanci na úspěšnou terapii, je důležité na onemocnění parodontu u dětí myslet a provádět vyšetření parodontálních tkání jako součást standardní zubní prohlídky i v těchto věkových kategoriích.
Poděkování
Práce byla podporována grantem IGA NR8394-3/05, MZ ČR.
MUDr. Kristina Musilová
Stomatologická klinika LF MU
a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: kristina.musilova@fnusa.cz
Sources
1. AAP (The American Academy of Periodontology): Consensus report on periodontal diagnosis and diagnostic aids. Proceedings of the World Workshop in Clinical periodontics. American Academy of Periodontology, Chicago, 1989, č. 1.s. 3-31.
2. Armitage, G. C.: Development of a classification systém for periodontal diseases and conditions. Ann. Periodontol, 1999, č. 4, s. 1-6.
3. Arnlaugsson, S., Magnusson, T. E..: Prevalence of gingivitis in 6-year-olds in Reykjavik, Iceland. Acta Odontol Scand , 1996, č. 54, s. 247-250.
4. Attström, R., van der Velden, U.: Consensus report on epidemiology. Proceedings of the 1st European Workshop on periodontology, London, Quintessence, 1994, s. 120.
5. Batista, E. L. Jr, Novaes, A. B. Jr, Calvano, L. M. et al.: Necrotizing ulcerative periodontitis associated with severe congenital immunodeficiency in a prepubescent subject: clinical findings and response to intravenous immunoglobulin treatment. J. Clin. Periodontol, 1999, č. 26, s. 499-504.
6. Bermejo-Fenoll, A., Sanchez-Perez, A.: Necrotising periodontal diseases. Med Oral Patol Oral Cir Bucal, 2004, č. 9, s. 114-119, 108-114.
7. Bimstein, E., Sapir, S., Houri-Haddad, Y. et al.: The relationship between Porphyromonas gingivalis infection and local and systemic factors in children. J. Periodontol, 2004, č. 75, s. 1371-1376.
8. Boughman, J. A., Halloran, S. L., Roulston, D. et al.: An autosomal-dominant form of juvenilie periodontitis: Its localization to chromosome 4 and linkage to dentinogenesis imperfecta nad Gc. J Craniofac Genet Dev Biol, 1986, č. 6, s. 341-350.
9. Brown, L. J., Löe, H.: Prevalence, extent, severity and progression of periodontal disease. Periodontol, 2000, 1993, č. 2, s. 57-71.
10. Cogen, R. B., Roseman, J. M., Al-Joburi, W. et al.: Host factors in juvenile periodontitis. J Dent Res, 1986, č. 65, s. 394-399.
11. Darby, I. B., Hodge, P. J., Riggio, M. P., Kinane, D. F.: Clinical and microbiological effect of scaling and root planing in smoker and non-smoker chronic and aggressive periodontitis patients. J Clin Periodontol, 2005, č. 32, s. 200-206.
12. Deus, D. E., Mackey, S. A., McDonnell, H. T.: Systemic disease and periodontitis: manifestations of neutrophil dysfunction. Periodontol, 2000, 2003, č. 32, s. 82-104.
13. Emingil, G., Cinarcik, S., Baylas, H. et al.: Levels of leukotriene B4 in gingival crevicular fluid and gingival tissue in specific periodontal diseases. J Periodontol, 2001, č. 72, s. 1025-1031.
14. Genco, R. J.: Current view of risk factors for periodontal diseases. J Periodontol, 1996, č. 67, s. 1041-1049.
15. Grossi, S. G., Genco, R. J.: Periodontal disease and diabetes mellitus: a two-way relationship. Ann Periodontol, 1998, č. 3, s. 20-29.
16. Meyle, J.: Leukocyte adhesion deficiency and prepubertal periodontitis. Periodontol, 2000, 1994, č. 6, s. 26-36.
17. Han, N., Xiao, X., Zhang, L. et al.: Bacteriological study of juvenile periodontitis in China. J Periodontol Res, 1991, č. 26, s. 409-414.
18. Haraszthy, V., Hariharan, G., Finovo, E. et al.: Evidence for the role of highly leukotoxic Actinobacillus actinomycetemcomitans in the pathogenesis of localized and other forms of early-onset periodontitis. J Periodontol, 2000, č. 71, s. 912-922.
19. Hart, T. C., Kornman, K. S.: Genetic factors in the pathogenesis of periodontitis. Periodontol, 2000, 1997, č. 14, s. 202-215.
20. Hurttia, H. M., Pelto, L. M., Leino, L.: Evidence of an association between functional abnormalities and defective diacylglycerol dinase activity in peripheral blood neutrophils from patients with localized juvenile periodontitis. J Periodontol Res, 1997, č. 32, s. 401-407.
21. Kinane, D. F.: Causation and pathogenesis of periodontal disease. Periodontology, 2000, 2001, č. 25, s. 8-20.
22. Liébana, J., Castillo, A. M., Álvarez, M..: Periodontal diseases: microbiological considerations. Med Oral Patol Oral Cir Bucal, 2004, č. 9, s. 75-91.
23. Liu, R. K., Cao, C. F., Meng, H. X., Gao, Y.: Polymorphonuclear neutrophils and their mediators in gingival tissues from generalized aggressive periodontitis. J Periodontol, 2001, č. 72, s. 1545-1553.
24. Lopez-Perez, R., Borges-Yanez, S. A. et al.: Oral hygiene, gingivitis, and periodontitis in persons with Down syndrome. Spec Care Dentist, 2002, č. 22, s. 214-220.
25. Parazita, M. L., Burmeister, J. A., Gunsolley, J. C. et al.: Evidence for autosomal dominant inheritance and race-specific heterogenity in early-onset periodontitis. J Periodontol, 1994, č. 65, s. 623-630.
26. Meyle, J.: Leukocyte adhesion deficiency and prepubertal periodontitis. Periodontol, 2000, 1994, č. 6, s. 26-36.
27. Meyle, J., Gonzales, J. R.: Influences of systemic diseases on periodontitis in children and adolescents. Periodontol, 2000, 2001, č. 26, s. 92-112.
28. Moore, W., Holdeman, L., Smibert, R. et al.: Bakteriology of experimental gingivitis in children. Infect Immun, 1984,č. 46, s. 1-6.
29. Nakagawa, S., Fujii, H., Machina, Y., Okuda, K.: A longitudinal study from prepuberty to puberty of gingivitis. Correlation between the occurrence of Prevotella intermedia and sex hormones. J Clin Periodontol, 1994, č. 21, s. 658-665.
30. Noack, B., Gorgens, H., Hoffmann, T. et al.: Novel mutations in the cathepsin C gene in patients with pre-pubertal aggressive periodontitis and Papillon-Lefèvre syndrome. J Dent Res, 2004, č. 83, s. 368-370.
31. Oh, T. J., Eber, R., Wang, H. L.: Periodontal diseases in the child and adolescent. J Clin Periodontol, 2002, č. 29, s. 400-410.
32. Page, R. C.: Milestones in periodontal research and the remaining critical issues. J Periodont Res, 1999, č. 34, s. 331-339.
33. Page, R. C., Schroeder, H.: Periodontitis in man and other animals. A comparative review. Basel and New York, 1982.
34. Salvi, G. E., Kandylaki, M., Troendle, A. et al.: Experimental gingivitis in type 1 diabetics: a controlled clinical and microbiological study. J Clin Periodontol, 2005, č. 32, s. 310-316.
35. Saxby, M. S.: Juvenile periodontitis: an epidemiological study in the west Midlands of the United Kingdom. J Clin Periodontol, 1987, č. 14, s. 594-598.
36. Shapira, L., Borinski, R., Sela, M. N., Soskolne, A.: Superoxide formation and chemiluminiscence of peripheral polymorphonuclear leukocytes in rapidly progressive periodontitis patients. J Clin Periodontol, 1991, č. 18, s. 44-48.
37. Sjödin, B., Matsson, L., Unell, L., Egelberg, J.: Marginal bone loss in the primary dentition of patients with juvenile periodontitis. J Clin Periodontol, 1993, č. 20, s. 32-36.
38. Tailor, G. W., Burt, B. A., Becker, M. P. et al.: Severe periodontitis and risk for poor glycemic control in patients with non-insulin-dependent diabetes mellitus. J Periodontol, 1996, č. 67, s. 1085-1093.
39. Van Dyke, T. E., Zinney, W., Winkel, K. et al.: Neutrophil function in localized juvenile periodontitis. Phagocytosis, superoxide production and specific granule release. J Periodontol, 1986, č. 57, s. 703-708.
40. Watanabe, H., Goseki-Sone, M., Limura, T. et al.: Molecular diagnosis of hypophosphatasia with severe periodontitis. J Periodontol, 1999, č. 70, s. 688-691.
41. Wolff, L., Drhlen, G., Aeppli, D.: Bacteria as risk marker for periodontitis. J Periodontol, 1994, č. 65, s. 498-510.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2008 Issue 2
Most read in this issue- Oral Lichen Planus – Present Knowledge
- Dental Metal Alloys Part 1. Classification of Dental Alloys, Physical and Chemical Properties
- Periodontal Diseases in Children and Adolescents
- Minor Salivary Gland Biopsy in Evaluation Algorithm of Sjögren’s Syndrome
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

