-
Medical journals
- Career
Zapojení klinického farmaceuta do managementu pádů u polymorbidního geriatrického pacienta s opakovanými pády v anamnéze
Authors: Martin Doseděl; Josef Malý; Jan Vosátka; Petr Mikolášek; Iva Brabcová; Hana Hajduchová; Sylva Bártlová; Valérie Tóthová; Jiří Vlček
Authors‘ workplace: Ústav ošetřovatelství, porodní asistence a neodkladné péče, Zdravotně sociální fakulta, Jihočeská univerzita v Českých Budějovicích
Published in: Čes. slov. Farm., 2018; 67, 205-211
Category:
Overview
Pády pacientů představují významnou zátěž pro zdravotnická zařízení projevující se zejména prodloužením hospitalizace a zvýšením finančních nákladů na následnou zdravotní péči. Pád je ve většině případů výsledkem kombinace několika ovlivnitelných a neovlivnitelné rizikových faktorů. Jedním z ovlivnitelných rizikových faktorů je užívání léčiv pacientem, která jsou mnohdy neracionálně podávána ve vztahu ke zdravotnímu stavu a vzájemné kombinaci. Ve sdělení je na příkladu kazuistiky z praxe ukázán možný vliv farmakoterapie na pád pacienta a ukázána činnost klinického farmaceuta, který zapojením do multidisciplinárního týmu a svým zaměřením na rizika farmakoterapie a jejich management může přispívat ke snížení rizika pádů.
Klíčová slova:
pád – léčiva zvyšující riziko pádu – klinický farmaceut
Úvod
Pády představují významný zdravotnický problém z pohledu zvýšené morbidity a mortality pacientů1). Více než 84 % nežádoucích událostí v nemocnicích bylo spojeno s pádem a v 33 % došlo k poranění pacienta. Prevalence pádů je nejčastější u hospitalizovaných dospělých pacientů, zejména u pacientů starších 65 let2). Pád je obvykle způsoben vlivem několika rizikových faktorů zahrnujících farmakoterapii, diagnózy a ostatní rizikové faktory (např. vliv okolního prostředí, použití zdravotnických pomůcek)1, 3).
Zdravotní stav pacienta patří mezi hlavní prediktory pádu a z pohledu rizikovosti se jedná o nejčastější příčinu pádu4). Mezi rizikové diagnózy lze zařadit např. demenci, Parkinsonovu nemoc (PN), poruchy vizu a ostatní komorbidity snižující mobilitu pacientů5–7). Neméně významným rizikovým faktorem je farmakoterapie pacientů. Neracionálně podávaná léčiva ve vztahu k anamnéze pacienta nebo jiným užívaným léčivům mohou riziko pádu rovněž zvyšovat. Populační riziko pádu mají podle dostupné literatury zejména léčiva ovlivňující kardiovaskulární a centrální nervový systém8).
Jedním z možných způsobů jak snížit riziko pádu, je multidisciplinární přístup se zahrnutím klinického farmaceuta jako experta na farmakoterapii a její racionalizaci. Jedním z preventivních způsobů jak minimalizovat lékové příčiny pádů, je zohlednit změny farmakokinetiky a farmakodynamiky léčiv dané věkem, přítomnost komorbidit a ostatních léčiv8, 9).
Cílem sdělení bylo ukázat na konkrétním případu pacienta zapojení klinického farmaceuta do managementu pádů se zaměřením na revizi farmakoterapie a její racionalizaci.
Popis případu
Popis pacienta
Polymorbidní 72letý pacient s rozsáhlou osobní anamnézou (tab. 1), který žil dosud sám na chalupě a původně pracoval v dopravním podniku, byl hospitalizován v srpnu na neurologickém oddělení nemocnice v jižních Čechách pro dekompenzaci PN projevující se zhoršením chůze a záškuby svalů. Následující den byl beze změn v terapii přeložen pro progresi renální insuficience na interní oddělení téže nemocnice. Pacient nekouřil, nepil alkohol a netrpěl žádnou alergií.
Table 1. Osobní anamnéza pacienta 
ICHS – ischemická choroba srdeční, PCI – perkutánní koronární intervence Hospitalizace na interním oddělení – první pád pacienta
Po příjmu na interní oddělení byla chronická terapie ponechána beze změn (tab. 2), pouze byla podána infuze Plazmalyte 1000 ml (167 ml/hod.) a z důvodů pozitivity močového nálezu (leukocyty a erytrocyty) a zvýšeného CRP (52,3 mg/l) byl empiricky nasazen ciprofloxacin 500 mg tbl. (1-0-1) a odebrána byla moč na kultivaci s negativním nálezem. Třetí den hospitalizace v 7 : 20 hod. pacient upadl na pokoji, když se snažil přelézt postranice lůžka. Pacient byl po pádu při vědomí, avšak zmatený a nedokázal zdravotnickému personálu vysvětlit, jak k pádu došlo. Pacient byl zdravotnickým personálem hodnocen jako dezorientovaný. Krevní tlak (TK) byl bezprostředně po pádu 90/60 mm Hg a srdeční frekvence 62/min. Hodnoty dalších laboratorních parametrů jsou uvedeny v tabulce 3. Během pádu nedošlo k žádnému poranění a pád nebyl důvodem prodloužení hospitalizace. Pacient byl zadán do interaktivní databáze sledující rizikové faktory pádů a sloužící i pro komunikaci mezi ošetřujícím lékařem a klinickým farmaceutem. Klinický farmaceut reportoval, že kromě diagnóz se na pádu mohla podílet i léčiva, k jejichž riziku mohla přispět i nízká funkce ledvin. Za nejrizikovější léčiva byla označena: rivastigmin, gabapentin, amantadin a levodopa. Klinický farmaceut reportoval kontraindikaci amantadinu a dále nutnost snížení dávky gabapentinu, rivastigminu a ciprofloxacinu v závislosti na funkci ledvin. U gabapentinu navíc nebyla nalezena jednoznačná diagnóza pro jeho podávání. Byl též navržen vhodnější statin při ledvinném selhání a v případě trvající hypotenze též nutnost redukovat dávky betablokátoru. Intervence klinického farmaceuta jsou blíže vysvětleny v diskuzi. Následující 3 dny po pádu však dochází k vzestupu TK až na hodnoty 162/82 mm Hg, na což je reagováno nasazením perindoprilu 5 mg (1-0-0) a doporučením amlodipinu 5 mg (1-0-0) v propouštěcí zprávě při překladu na ošetřovatelské lůžko téže nemocnice. Pacientův stav se postupně upravil, byl uzavřen jako chronická renální insuficience s akutní progresí při hypotenzi a retenci moči, byla diagnostikována objemná cysta pravé ledviny a zaveden permanentní močový katétr. Pro nutnost dalšího doléčení a zlepšení funkčního stavu byl pacient 10. den přeložen na oddělení následné péče.
Table 2. Vývoj farmakoterapie pacienta v průběhu hospitalizace 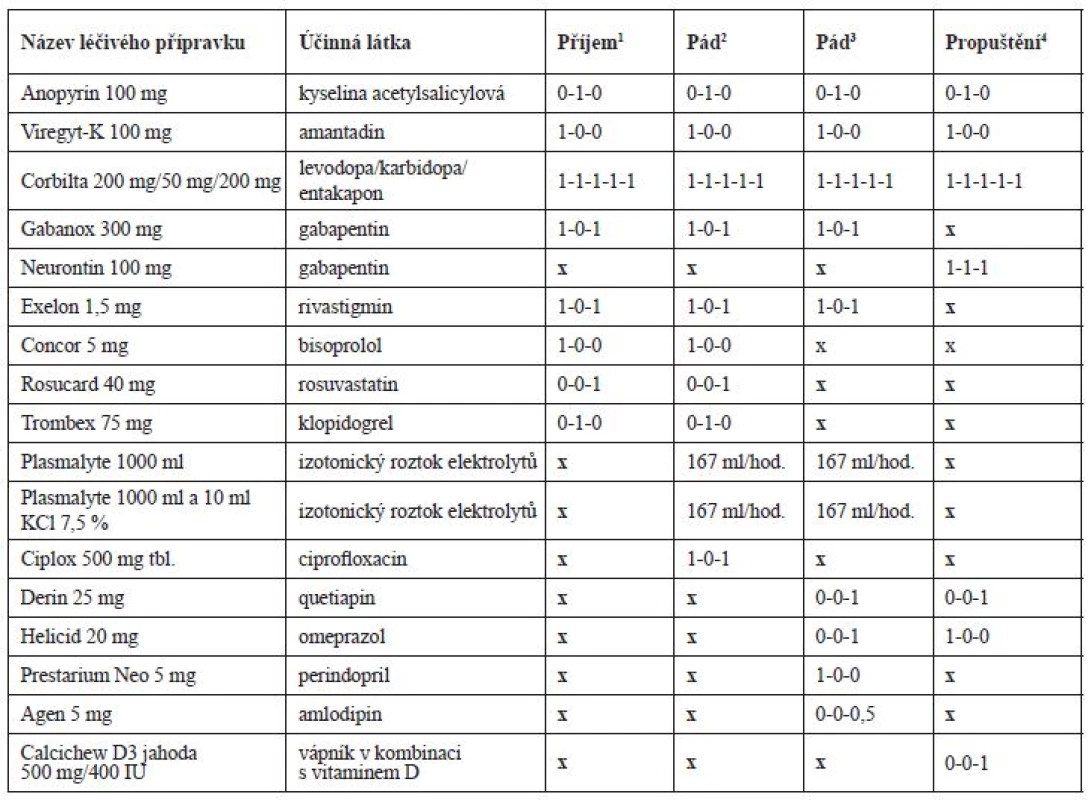
1příjem pacienta na neurologické oddělení
2pád pacienta na interním oddělení
3pád pacienta na oddělení následné péče
4propuštění pacienta z oddělení následné péčeTable 3. Vývoj laboratorních hodnot v průběhu hospitalizace 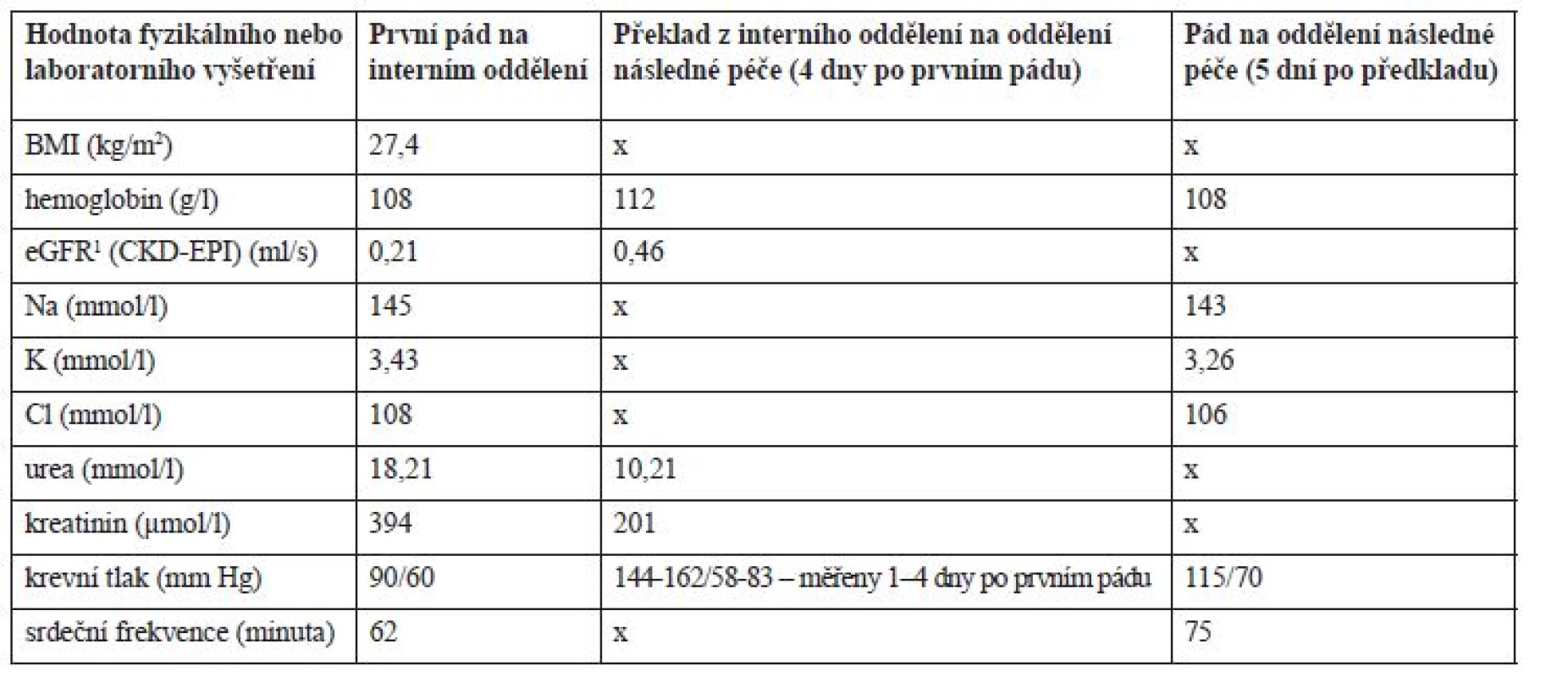
1odhad glomerulární filtrace podle The Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) Hospitalizace na oddělení následné péče – druhý pád pacienta
Pět dní po přeložení na oddělení následné péče pacient opět upadl. K pádu došlo v 19 hod. na pokoji, kde ho nalezla ošetřující sestra, jak sedí vedle křesla. Pacient byl po pádu při vědomí, orientovaný. TK byl bezprostředně po pádu 115/70 mm Hg a srdeční frekvence 75/min. Během pádu nedošlo k žádnému poranění. Opět byl pád zadán do interaktivní databáze a klinický farmaceut hodnotil opět jako riziková tato léčiva: rivastigmin, levodopa, gabapentin a amantadin. Ciprofloxacin a rosuvastatin již pacient neužíval. Navíc zařadil mezi riziková i perindopril, jehož dávkování bylo vzhledem k funkci ledvin velmi vysoké. Bylo též upozorněno na možné riziko hypokalemie (K+ = 3,26 mmol/l), které by mohlo zvyšovat riziko arytmií při užívání quetiapinu.
Diskuze
Jedním z rizikových faktorů, který se mohl podílet na pádu pacienta, byl bezpochyby jeho zdravotní stav a podíl rizikových diagnóz, tj. arteriální hypertenze, demence, PN a anemie, která není uvedena v diagnózách, ale je nutné s jejím vlivem počítat s ohledem na aktuální hodnoty hemoglobinu.
Dalším možným rizikovým faktorem těchto pádů byla užívaná farmakoterapie pacienta, která zahrnovala podle odborné literatury některá populačně riziková léčiva, tj. gabapentin, amantadin, rivastigmin, quetiapin, levodopa, perindopril, amlodipin, bisoprolol a ciprofloxacin. V případě tohoto pacienta byl vliv farmakoterapie navíc posílený kromě samotné polyfarmakoterapie i zhoršenou funkcí ledvin, kdy mohlo docházet ke kumulaci léčiv vylučovaných ledvinami a dala se předpokládat klinická manifestace nežádoucích účinků.
Při chronickém onemocnění ledvin s akutní progresí doprovázené retencí moči a hypotenzí bylo nutné upravit dávky některých léčiv nebo je zcela vysadit. Bohužel se tak nestalo, což mohlo přispět k pádům pacienta nebo být i jedním z hlavních důvodů pádů diskutovaného pacienta. Léčiva z anamnézy pacienta, která jsou při snížených renálních funkcích kontraindikovaná nebo musí být jejich dávka upravena, jsou zejména gabapentin, amantadin, rivastigmin, ciprofloxacin, perindopril a rosuvastatin.
Podání gabapentinu bylo v konkrétním případě nejasné, v anamnéze chyběly racionální indikace k podání (neuropatická bolest, epilepsie). Denní dávky gabapentinu při renálních funkcích v době prvního pádu by neměly přesáhnout 150–300 mg, tzn., že pacient v době prvního pádu užíval dvojnásobnou dávku. V době druhého pádu by měla být dávka v rozmezí 150–600 mg/denně, tzn., že byla podávána maximální možná dávka. Zvýšená plazmatická koncentrace mohla přispět ke zvýšení rizika pádu na základě manifestace častých nežádoucích účinků, jakými jsou např. somnolence, závratě, vertigo a zmatenost (tab. 4)10). V průběhu hospitalizace byla dávka gabapentinu snížena na 300 mg/denně, která odpovídala dle souhrnu údajů o přípravku (SPC) doporučené dávce při glomerulární filtraci 0,46 ml/s. I přes úpravu denní dávky v kontextu ledvinných funkcí se dle dostupných údajů z anamnézy jednalo o spíše zbytné léčivo a bylo by vhodné zvážit jeho vysazení při sledování pacienta, zda nedochází k dekompenzaci bolesti či jinému zhoršení stavu.
Table 4. Souhrn potenciálně rizikových léčiv a rizikových nežádoucích účinků stran pádu 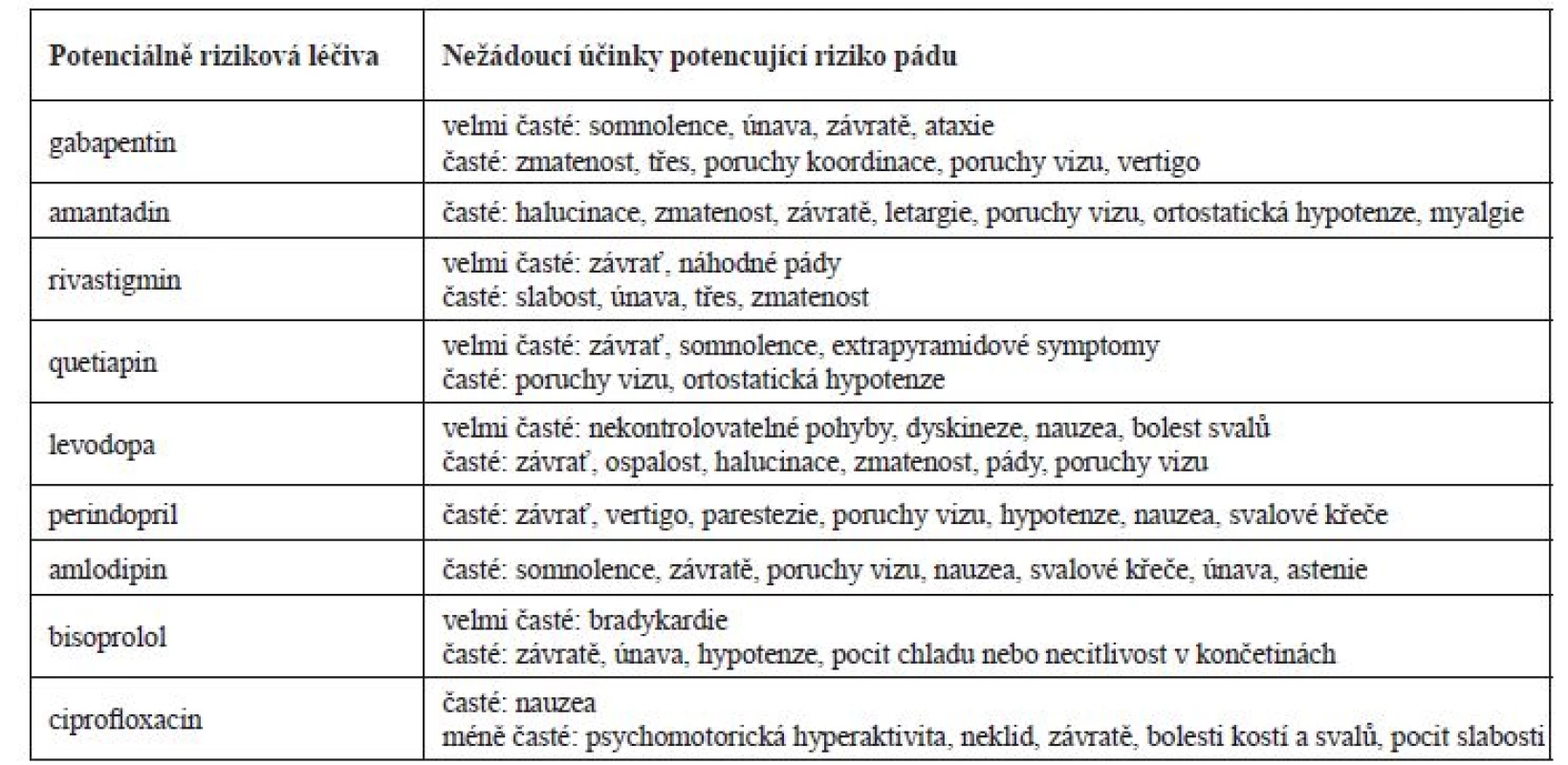
V terapii PN pacient užíval amantadin v kombinaci s levodopou, karbidopou a entakaponem. U pacientů s glomerulární filtrací do 15 ml/min je amantadin kontraindikován a při glomerulární filtraci v rozmezí 15–35 ml/min je doporučeno podávat 100 mg každé 2–3 dny. V důsledku předávkování byl u amantadinu sledován výskyt psychotických reakcí (např. zmatenost, dezorientace, motorický neklid atd.)10). Amantadin může také zhoršit kognitivní funkce a retenci moči svým mírným anticholinergním účinkem11). Možná manifestace nežádoucích účinků amantadinu by proto měla vést ke zvážení vysazení léčiva a zvolení jiné terapeutické strategie PN. Farmakokinetika entakaponu není při renální insuficienci ovlivněna a není nutné upravovat dávku. Zvýšená pozornost by měla být u podání levodopy a karbidopy, pro které nejsou dle SPC studie u pacientů s těžkou renální insuficiencí. Potenciace psychotických projevů (např. halucinace a zmatenost) byla pozorována u pacientů užívajících kombinaci levodopa a amantadin. Ovlivnění kardiovaskulárního systému se sklonem k hypotenzi bylo pozorováno u pacientů užívajících levodopu společně s antihypertenzivy10). Dávka levodopy/karbidopy/entakaponu nebyla navržena k úpravám z důvodu, že se jednalo o esenciální léčiva v terapii PN a bylo dle názoru klinického farmaceuta vhodné nejdříve upravit dávky jiných léčiv (diskutováno v textu).
V terapii demence byl pacientovi podáván rivastigmin. U pacientů se signifikantním snížením renálních funkcí je doporučeno rivastigmin individuálně titrovat k dosažení terapeutického efektu s cílem minimalizovat vliv nežádoucích účinků (např. nauzea, závratě, zmatenost)10). Cholinergní efekt rivastigminu může také způsobit bradykardie u pacientů, kteří užívají i jiná léčiva ovlivňující srdeční sval10). U těchto pacientů může docházet častěji k výskytu synkop a následně pádům. Zde podobně jako u levodopy bylo doporučeno nejdříve upravit další léčiva a případně pak, pokud by se stav pacienta nezlepšil, zvážit snížení dávky rivastigminu nebo jej zaměnit za donepezil, u kterého nejsou úpravy dávek při ledvinném selhání nezbytné12).
Empiricky nasazený ciprofloxacin v terapii močové infekce by měl být v závislosti na renálních funkcích v době prvního pádu podáván každých 24 hodin v dávce 250–500 mg. Fluorochinolony mají obecně vliv na centrální nervový systém a je u nich prokázán výskyt psychotických reakcí a polyneuropatií. Tyto reakce mohou vést k rozvinutí deprese, psychóz, u neuropatií k rozvoji bolesti, slabosti, brnění a pálení. V případech předávkování byly hlášeny případy závratí, třesu, zmatenosti10). Ciprofloxacin patří současně mezi léčiva prodlužující QT interval s možným rozvojem torsades de pointes. Riziko prodloužení QT intervalu je u daného pacienta nezanedbatelné kvůli kombinaci několika rizikových faktorů, tj. akutní infarkt myokardu v anamnéze, léčiva s potenciálem prodloužit QT interval (amantadin, ciprofloxacin a posléze i quetiapin), hypokalemie a věk nad 65 let. Pro minimalizaci rizik prodloužení QT intervalu by bylo vhodné zvolit jiné antibiotikum (vyjma makrolidů a fluorochinolonů). Pokud nebylo možné podávat jiné antibiotikum, bylo by na místě provést monitoring EKG (QT interval), nepřekračovat doporučené dávkování při selhání ledvin a suplementovat chybějící draslík13, 14).
V sekundární prevenci ICHS byl pacientovi podáván rosuvastatin, kyselina acetylsalicylová, klopidogrel a betablokátor. Při současné funkci ledvin je podání rosuvastatinu kontraindikováno (clearance kreatininu < 30 ml/min) a měla být zvážena jiná alternativa. Zvýšené plazmatické koncentrace rosuvastatinu zvyšují pravděpodobnost rhabdomyolýzy, která je riziková u méně pohyblivých pacientů a může vést k akutnímu selhání ledvin10). Vhodnou alternativou u pacientů s těžkou renální insuficiencí je např. atorvastatin (10–80 mg/den) či fluvastatin (20–80 mg/den)15), zde však vzhledem k věku pacienta, jeho aktuálnímu stavu a času od proběhlé kardiovaskulární příhody bychom doporučili dávky v dolní polovině dávkového intervalu. Duální protidestičková léčba byla pacientovi pravděpodobně nasazena během hospitalizace po perkutánní koronární intervenci a zavedení stentů. Po uplynutí 12 měsíců od jejich nasazení by mělo být u pacientů s anamnézou infarktu myokardu zváženo pokračování této terapie. Užívání klopidogrelu je spojeno s rizikem anemie, která byla na základě laboratorních hodnot hemoglobinu aktuální, a vysazení klopidogrelu se zdá být z pohledu minimalizace rizik racionální16). Bisoprolol patří mezi betablokátory, které jsou eliminovány ledvinami a játry z 50 %, u závažného selhání ledvin (glomerurální filtrace pod 0,33 ml/s) by neměla být překročena dávka 10 mg denně, což v tomto případě sice nebylo, ale zvýšená plazmatická koncentrace mohla vést k vyššímu výskytu nežádoucích účinků (např. hypotenze, bradykardie). Vhodnější variantou u snížené funkce ledvin jsou betablokátory eliminované pouze játry (např. metoprolol).
Pro dekompenzaci TK během hospitalizace byla pacientovi krátkodobě nasazena antihypertenzní terapie zahrnující perindopril a amlodipin. Hypotenze na začátku terapie je častým nežádoucím účinkem inhibitorů angiotenzin konvertujícího enzymu (ACEi) a dávka by měla být u pacientů titrována, zvláště mají-li další rizikové faktory pro vznik hypotenze (např. dehydratace, snížená funkce ledvin)17). Podání perindoprilu je u pacientů s glomerulární filtrací 15–30 ml/min doporučeno v dávce 2,5 mg/obden, tzn., že pacient během druhého pádu užíval 4krát vyšší dávku10). U pacientů se sníženou funkcí ledvin nebo u geriatrických pacientů je na začátku terapie ACEi vyšší riziko akutního selhání ledvin a je nutné po nasazení kontrolovat hodnoty sérového kreatininu, který by se neměl zvýšit o více než 30 %. Vhodnou variantou u renální insuficience jsou některé ACEi, které jsou mimo ledvin vylučovány také játry (např. fosinopril a trandolapril) nebo sartany (např. valsartan, telmisartan, losartan) metabolizované převážně játry, u kterých není nutné při glomerulární filtraci pod 0,30 ml/s redukovat dávky10). Amlodipin je u starších pacientů snášen stejně dobře jako u mladší populace a v závislosti na stavu ledvin není nutná redukce dávky. Častým nežádoucím účinkem amlodipinu jsou závratě, poruchy vidění a somnolence10). Druhý pád pacienta byl provázen také hypotenzí, která mohla být způsobena nově nasazenou antihypertenzní terapií.
V době druhého pádu byl pacientovi nasazen quetiapin v dávce 25 mg. U pacientů s PN jsou často přidruženy psychotické epizody, které mohou být někdy indukovány i samotnými antiparkinsoniky. Prokáže-li se souvislost antiparkinsonik a psychotických epizod, je nutné zvážit jiný management nemoci, v opačném případě je vhodné přidat antipsychotikum. V terapii psychóz u PN jsou preferovány atypická antipsychotika (preferenčně klozapin a quetiapin) bez významného negativního ovlivnění extrapyramidových drah18). Quetiapin je vhodné nasadit v dávce 12,5 mg a postupně titrovat do požadovaného efektu (udržovací dávka 12,5–150 mg/den). Podání quetiapinu je spojené s útlumem pacienta a s možným ovlivněním TK se sklonem k hypotenzi. Dávku není nutné upravovat v závislosti na stavu ledvinných funkcí10). Možný proarytmogenní účinek byl popsán již výše.
K pádu mohla přispět také kombinace akutních stavů, jako jsou hypokalemie, dehydratace, anemie a těžká renální insuficience. Ve studii zkoumající vliv hyponatremie a hypokalemie byl jasně prokázaný vliv hypokalemie (3,5–3,0 mmol/l) u pacientů starších 65 let na riziko pádu OR 2,56 (95% CI: 1,44–4,52) v porovnání s pacienty, kteří nespadli. Příznaky hypokalemie zahrnují celkovou slabost, únavu pacienta a proarytmogenní působení19). Anemie může být dalším rizikovým faktorem stran pádu s manifestací celkové únavy, slabosti a může být doprovázena řadou kardiovaskulárních onemocnění. U hospitalizovaných geriatrických pacientů, kterým byla diagnostikována anemie, bylo riziko pádu zvýšeno – OR 1,86 (95 % CI: 1,16–2,82) oproti pacientům bez anemie20). Podíl hydratace pacienta na riziku pádu nemůže být opomenut. Dehydratace může vést ke zhoršení kognitivních funkcí, výskytu deliria a následně k pádům21). Stav hydratace pacienta je spojen s funkcí ledvin a odráží se v clearance kreatininu. Clearance kreatininu pod 65 ml/min byla v dříve publikované studii označena jako signifikantní prediktor pádu u geriatrických pacientů22).
Na základě anamnestických a laboratorních údajů bylo u pacienta vhodné korigovat suplementací draslíku suspektní hypokalemii. Dále zvážit podrobnější diagnostickou rozvahu u anemie a dle výsledků indikovat další terapii.
Ke zvážení by též bylo nasazení vitaminu D v kombinaci s vápníkem, které jsou vhodné u starších pacientů s opakovanými pády v anamnéze pro prevenci osteoporózy a následných popádových komplikací. V některých studiích byla suplementace vitaminem D vyhodnocena jako protektivní faktor pádů. Vitamin D má nejen pozitivní vliv na kostní denzitu, ale také by měl zlepšovat svalovou sílu a tím zvyšovat stabilitu pacientů23). Důvod nasazení omeprazolu byl v daném případě nejasný a jeho efekt na vstřebání vápníku z gastrointestinálního traktu mohl naopak zvýšit riziko popádových komplikací. Stejně tak mohl zhoršit současnou anemii vlivem sníženého vstřebávání železa a možného vlivu na vitamin B12 (při jejich deficitu)24). U geriatrických pacientů je navíc doporučeno podávat omeprazol v dávce 10 mg/den, popř. pantoprazol v dávce 20 mg, tzn. indikovat poloviční dávku oproti současné25).
Závěr
Na příkladu této kazuistiky byl ukázán možný vliv léčiv na pád. Ošetřujícími lékaři byl vliv léčiv spíše upozaďován, což je patrné z vývoje farmakoterapie, a pád byl připisován akutnímu stavu pacienta souvisejícímu se zhoršením renálních funkcí, pokročilou demencí s progresí zmatenosti a dehydratací. I když v praxi je většinou obtížné posoudit vliv konkrétních léčiv na pád, domníváme se, že v tomto případě byl velmi významný, k čemuž přispěla hlavně výrazně snížená funkce ledvin, díky níž docházelo pravděpodobně ke kumulaci některých léčiv a i manifestaci nežádoucích účinků. Z vlastních zkušeností se domníváme, že multioborová spolupráce mezi ošetřujícím lékařem, klinickým farmaceutem a sestrou by mohla vést k menší prevalenci pádů ve zdravotnických zařízeních (a nejen tam), což dokládají i pilotní výsledky dlouhodobého sledování pádů ve vybraných nemocnicích Jihočeského kraje a zapojení klinických farmaceutů a sester do minimalizace tohoto rizika26).
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-33463A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Jan Vosátka děkuje za podporu grantu Univerzity Karlovy (SVV 260 417).
Konflikt zájmů: žádný.
Došlo 3. prosince 2018
Přijato 9. ledna 2019
M. Doseděl
Katedra sociální a klinické farmacie, Farmaceutická fakulta UK v Hradci Králové
Interní oddělení a ošetřovatelský úsek, Nemocnice Šumperk, Šumperk
PharmDr. Josef Malý, Ph.D. (∗)
Katedra sociální a klinické farmacie
Farmaceutická fakulta UK v Hradci Králové
Ak. Heyrovského 1203, 500 05 Hradec Králové
e-mail: malyj@faf.cuni.cz
Oddělení klinické farmacie, Nemocniční lékárna, Fakultní nemocnice v Motole, Praha
J. Vosátka
Katedra sociální a klinické farmacie, Farmaceutická fakulta UK v Hradci Králové
P. Mikolášek
Interní oddělení, Nemocnice Písek, a.s., Písek
J. Vlček
Katedra sociální a klinické farmacie, Farmaceutická fakulta UK v Hradci Králové
Oddělení klinické farmacie, Nemocniční lékárna, Fakultní nemocnice Hradec Králové
Sources
1. Park H., Satoh H., Miki A., Urushihara H., Sawada Y. Medications associated with falls in older people: systematic review of publications from a recent 5-year period. European journal of clinical pharmacology 2015; 71(12), 1429–1440.
2. Callis N. Falls prevention: Identification of predictive fall risk factors. Applied nursing research: ANR 2016; 29, 53–58.
3. Ambrose A. F., Paul G., Hausdorff J. M. Risk factors for falls among older adults: a review of the literature. Maturitas 2013; 75(1), 51–61.
4. Lerdal A., Sigurdsen L. W., Hammerstad H., Granheim T. I., Gay C. L. Associations between patient symptoms and falls in an acute care hospital: A cross-sectional study. Journal of clinical nursing 2018; 27(9–10), 1826–1835.
5. Paul S. S., Harvey L., Canning C. G., Boufous S., Lord S. R., Close J. C., Sherrington C. Fall-related hospitalization in people with Parkinson’s disease. European journal of neurology 2017; 24(3), 523–529.
6. Bansal S., Hirdes J. P., Maxwell C. J., Papaioannou A., Giangregorio L. M. Identifying fallers among home care clients with dementia and Parkinson’s disease. Canadian journal on aging = La revue canadienne du vieillissement 2016; 35(3), 319–331.
7. Zhang X. Y., Shuai J., Li L. P. Vision and relevant risk factor interventions for preventing falls among older people: A Network Meta-analysis. Scientific reports 2015; 5, 10559.
8. Blachman N. L., Leipzig R. M., Mazumdar M., Poeran J. High-risk medications in hospitalized elderly adults: are we making it easy to do the wrong thing? Journal of the American Geriatrics Society 2017; 65(3), 603–607.
9. Meer H. G., Wouters H., van Hulten R., Pras N., Taxis K. Decreasing the load? Is a Multidisciplinary Multistep Medication Review in older people an effective intervention to reduce a patient’s Drug Burden Index? Protocol of a randomised controlled trial. BMJ open 2015; 5(12), e009213.
10. Databáze léků – Státní ústav pro kontrolu léčiv. SPC – Viregyt K, Corbilta, Gabanox, Exelon, Concor, Ciplox, Derin, Prestarium neo, Agen, Rosucard, Fosinopril-TEVA, Gopten, Valsacor, Micardis, Lorista. http://www.sukl.cz/modules/medication/search.php (29. 11. 2018).
11. Snow B. J., Macdonald L., Mcauley D., Wallis W. The effect of amantadine on levodopa-induced dyskinesias in Parkinson’s disease. A Double-blind, Placebo-controlled Study 2000; 23(2), 82–85.
12. Tiseo P. J., Foley K., Friedhoff L. T. An evaluation of the pharmacokinetics of donepezil HCl in patients with moderately to severely impaired renal function. British journal of clinical pharmacology 1998; 46(Suppl 1), 56–60.
13. Tisdale J. E., Jaynes H. A., Kingery J. R., Mourad N. A., Trujillo T. N., Overholser B. R., Kovacs R. J. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circulation Cardiovascular quality and outcomes. 2013; 6(4), 479–487.
14. Schächtele S., Tümena T., Gaßmann K-G., Fromm M. F., Maas R. Co-Prescription of QT-Interval Prolonging Drugs: An Analysis in a Large Cohort of Geriatric Patients. PloS One 2016; 11(5), e0155649-e.
15. Rosenson S. R. Statins: Actions, side effects, and administration. UpToDate Inc. [internet]. Poslední revize textu 27. 11. 2018. Dostupné na URL: www.uptodate.com (30. 11. 2018).
16. Moťovská Z., Varvařovský I., Ošťádal P. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Summary of the document prepared by the Czech Society of Cardiology. Cor et Vasa 2017; 59, e592–e612.
17. Raymond T. R. Major side effects of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers. UpToDate Inc. [internet]. Poslední revize textu 27. 6. 2018. Dostupné na URL: www.uptodate.com (29. 11. 2018).
18. Goldman J. G., Vaughan C. L., Goetz C. G. An update expert opinion on management and research strategies in Parkinson‘s disease psychosis. Expert opinion on pharmacotherapy 2011; 12(13), 2009–2024.
19. Tachi T., Yokoi T., Goto C., Umeda M., Noguchi Y., Yasuda M., Minamitani M., Mizui T., Tsuchiya T., Teramachi H. Hyponatremia and hypokalemia as risk factors for falls. European journal of clinical nutrition 2015; 69(2), 205–210.
20. Dharmarajan T. S., Avula S., Norkus E. P. Anemia increases risk for falls in hospitalized older adults: an evaluation of falls in 362 hospitalized, ambulatory, long-term care, and community patients. Journal of the American Medical Directors Association 2006; 7(5), 287–293.
21. Duarte M., Bouça-Machado R., Domingos J., Godinho C., Ferreira J. J., and on behalf of central nervous system risk prompt display study group. Feasibility of using risk prompts to prevent falls, dehydration and pulmonary aspiration in nursing homes: a clinical study protocol. Pilot and feasibility studies 2018; 4, 39.
22. Dukas L. C., Schacht E., Mazor Z., Stahelin H. B. A new significant and independent risk factor for falls in elderly men and women: a low creatinine clearance of less than 65 ml/min. Osteoporosis international: a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA 2005; 16(3), 332–338.
23. Halfon M., Phan O., Teta D. Vitamin D: a review on its effects on muscle strength, the risk of fall, and frailty. BioMed research international 2015; 2015, 953241.
24. Eusebi L. H., Rabitti S., Artesiani M. L., Gelli D., Montagnani M., Zagari R. M., Bazzoli F. Proton pump inhibitors: Risks of long-term use. Journal of gastroenterology and hepatology 2017; 32(7), 1295–1302.
25. Červený R., Topinková E. Geriatrie: Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Praha: Společnost všeobecného lékařství ČLS JEP 2014.
26. Malý J., Doseděl M., Vosátka J., Malá-Ladová K., Kuběna A. A., Brabcová I., Hajduchová H., Bártlová S., Tóthová V., Vlček J. Pharmacotherapy as major risk factor of falls – analysis of 12 months experience in hospitals in South Bohemia. J Appl Biomed 2019 (in press).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2018 Issue 5-6-
All articles in this issue
- Pivo se sníženým obsahem cukru a alkoholu vhodné pro diabetiky
- The beginnings of health libraries of the Czech Brothers Hospitallers in the 18th century
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I
- Zapojení klinického farmaceuta do managementu pádů u polymorbidního geriatrického pacienta s opakovanými pády v anamnéze
- Společně zpracované pomocné látky pro přímé lisování tablet
- Nevyužívaná léčiva a jejich finanční dopad na zdravotní systém v České republice
- NMR a IR analýza přírodních látek izolovaných z léčivých hub Cordyceps
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pivo se sníženým obsahem cukru a alkoholu vhodné pro diabetiky
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I
- Společně zpracované pomocné látky pro přímé lisování tablet
- Zapojení klinického farmaceuta do managementu pádů u polymorbidního geriatrického pacienta s opakovanými pády v anamnéze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

