-
Medical journals
- Career
Léčiva a lékové formy jako rizikové faktory pro zubní kaz
Authors: Petra Bořilová Linhartová; Lydie Izakovičová Hollá
Published in: Čes. slov. Farm., 2017; 66, 103-106
Category: Review Articles
Overview
Zubní kaz je multifaktoriální onemocnění, které i přes řadu preventivních opatření zůstává nejrozšířenější infekční chorobou na světě. Náchylnost nebo odolnost jedince k/proti zubnímu kazu je důsledkem interakce rizikových nebo ochranných faktorů, genetické predispozice, nevhodného životního stylu spojeného s úrovní vzdělání, behaviorálními a socioekonomickými faktory.
Cílem přehledového článku je upozornit na rizika spojená s užíváním některých léčiv a lékových forem ve vztahu ke vzniku a rozvoji zubního kazu. Dle mechanismu působení v tomto procesu je lze rozdělit na ty, které 1. ovlivňují vývoj zubu a hlavně skloviny, 2. poškozují přímo nebo nepřímo strukturu zubu a/nebo 3. narušují protektivní schopnosti sliny a způsobují dysbiózu orální mikroflóry. V přehledu jsou pak zhodnoceny i současné možnosti terapie a prevence zubního kazu pomocí léčiv, potravinových doplňků a podpůrných prostředků.
Závěr článku se věnuje doporučením pro předcházení nežádoucím účinkům farmakoterapie v dutině ústní, a to pomocí preventivních opatření a/nebo zvážení délky léčby pro dosažení optimálního poměru mezi benefity a riziky. Jelikož je téma publikace mezioborového charakteru, informace o prevenci v rámci zlepšení orálního zdraví v populaci mohou využít nejen farmaceuti, kteří by primárně měli na rizika spojená s farmakoterapií pacienty upozornit, ale také zubní lékaři, pediatři/praktičtí lékaři a široká veřejnost.Klíčová slova:
zubní kaz • prevence • léčivo • léková forma • nežádoucí účinekEtiologie zubního kazu v dočasné a stálé dentici
Zubní kaz raného dětství (ECC – early childhood caries) i zubní kaz ve stálé dentici patří k onemocněním, která postihují tvrdé tkáně zubu, mohou vést k jeho ztrátě a v krajních případech až k rozsáhlému systémovému zánětu (sepsi). Prevalence zubního kazu je v populaci vysoká i přesto, že etiopatogeneze je do značné míry známá a existuje řada preventivních doporučení.
Za hlavní příčinné agens jsou považovány patogenní bakterie zubního plaku (Streptococcus mutans, Actinobacillus sp., Lactobacillus sp.), jejichž koncentrace bývá zvýšená po narušení rovnováhy složení orálního mikrobiomu. V procesu demineralizace tvrdých tkání zubu: skloviny, dentinu a cementu, hraje roli přítomnost H+ iontů, a tedy kyselé prostředí, které působí na tyto struktury. V počátečním stadiu tvorby zubního kazu je kyselinám vystavena sklovina pokrývající korunku zubu, která je z asi 93–98 % tvořena krystaly hydroxyapatitu [Ca10(PO4)6(OH)2] a je tak nejtvrdším materiálem v lidském těle.
Ke snížení pH v plaku pod fyziologické rozmezí 6,4–7,0 dochází při příjmu potravy obsahující kyseliny (např. kyselina citronová v ovocných šťávách, H3PO4 v kolových nápojích aj.) nebo sacharidy s kariogenním potenciálem. Fermentovatelné sacharidy (sacharóza, glukóza, maltóza, fruktóza, laktóza aj.) mohou sloužit jako substrát pro bakterie, které je metabolizují na organické kyseliny (k. pyrohroznová, k. mléčná, k. octová aj.). Také při refluxu žaludečního obsahu (HCl) do dutiny ústní se zde pH snižuje, dále pak v přítomnosti zánětu (např. zánětu dásní), při příjmu nebo po metabolizaci určitých xenobiotik může docházet ke zvýšení koncentrace H+ iontů zejména v plaku, ale také ve slině.
Důležitou roli v ochraně proti zubnímu kazu hraje právě slina, a to nejenom svými fyzikálně-chemickými vlastnostmi (množství, viskozita, pufrovací kapacita) ale i přítomností proteinů (imunoglobulin A, lysozym, laktoferin, defenzin, osteopontin aj.), které se podílejí na imunitních reakcích a pomáhají udržovat fyziologické složení orálního mikrobiomu. Při optimální produkci sliny, vzhledem k jejím pufrovacím schopnostem a obsahu minerálů (Ca2+, PO4–), se redukuje mikroflóra, odstraňují se zbytky jídla ulpívající na povrchu tvrdých tkání zubu, neutralizují se kyseliny v ústech a je zajištěn remineralizační proces. Pokud však pH plaku klesne pod hodnotu 5,5, dochází k demineralizaci povrchových vrstev skloviny.
Rizikové faktory pro vznik/rozvoj zubního kazu
Za rizikové faktory při vzniku a rozvoji zubního kazu jsou nejčastěji považovány: nedostatečná orální hygiena, vysoká frekvence příjmu kariogenních sacharidů v potravě, dysbióza v dutině ústní, autoimunitní onemocnění (např. Sjögrenův syndrom) a také vrozená náchylnost k zubnímu kazu.
I užívání mnohých léků a doplňků stravy může být spojováno se zvýšeným rizikem rozvoje zubního kazu1). Jedná se o léčiva a lékové formy, které dle mechanismů působení můžeme rozdělit do několika skupin:
- ovlivňují vývoj zubů, a hlavně skloviny
- poškozují přímo nebo nepřímo struktury zubu
- a/nebo narušují protektivní schopnosti sliny a vedou k dysbióze v dutině ústní
Léčiva ovlivňující vývoj zubu
Běžné chemikálie (Pb, Hg, anorganické fluoridy, tabák, polycyklické aromatické uhlovodíky) a fyzikální agens (trauma) mohou negativně ovlivnit zuby, a to jak v průběhu embryogeneze, tak i po jejich erupci v dutině ústní2). Také užívání některých léčiv může být spojeno s patologickým vývojem zubů, změnou jejich morfologie a struktury, nebo s narušením správného vývoje imunitního systému dítěte. Je však nutné podotknout, že užívání léčiv u gravidních a kojících žen a dětí je v současnosti přísně regulováno.
Asi nejznámějším příkladem negativního vlivu léčiva v tomto kontextu je užívání tetracyklinů, jejichž nežádoucím účinkem je mimo jiné poškození zubní skloviny tvarově i žlutohnědým zabarvením a vznikem tzv. „tetracyklinových zubů“ (obr. 1). Na míru závažnosti poškození zubů pak má velký vliv nejenom období, po které se léčivo užívalo (perinatálně, nebo postnatálně – působí však jen v období amelogeneze, tj. cca do 8–10 let věku), ale i jeho dávka a délka léčby.
Image 1. Poškození skloviny stálých řezáků po podávání tetracyklinových antibiotik v raném dětství 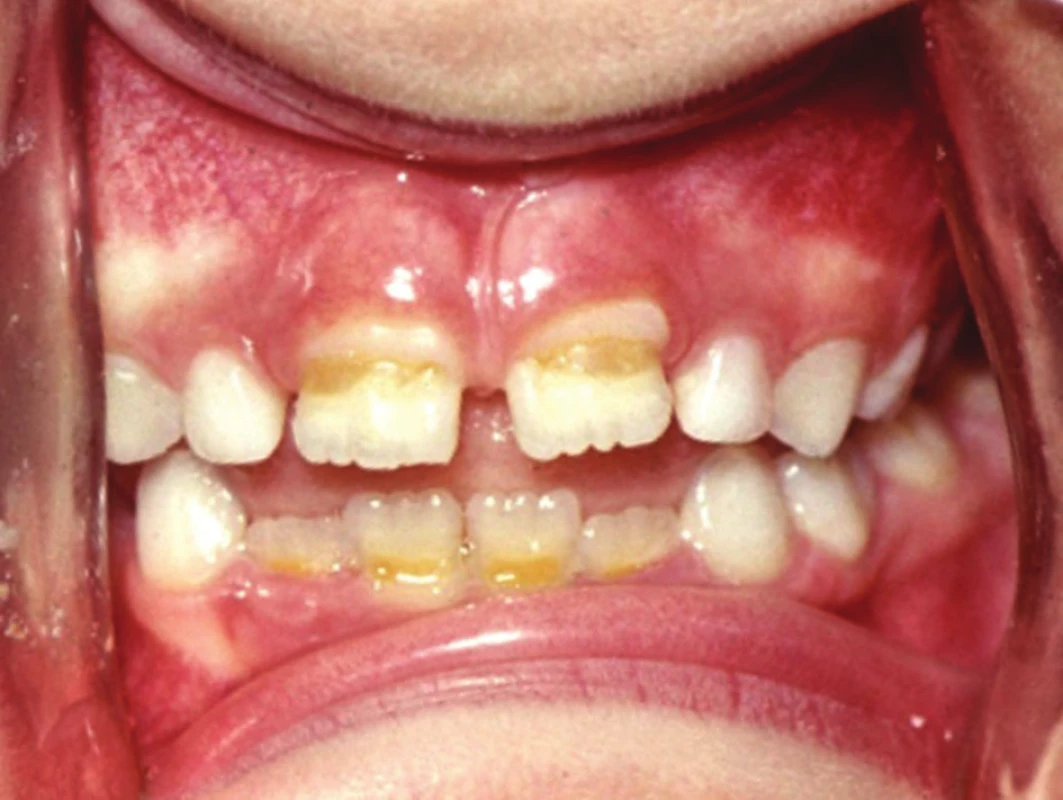
(fotografie z archivu Dětského oddělení Stomatologické kliniky, Fakultní nemocnice u sv. Anny v Brně) V souvislosti s podáváním léčiv ze skupiny antikonvulziv se nedávno prokázalo, že děti jim prenatálně vystavené mají zvýšené riziko vzniku bílých skvrn na zubech dočasné i stálé dentice a hypoplazie skloviny u dočasných zubů3). U dětí, které užívaly během prvních 4 let svého života antiastmatika, byly také nalezeny vývojové vady skloviny, a to u prvních stálých stoliček4). Pochopitelně i užívání chemoterapeutik s cytotoxickými vlastnostmi při protinádorové terapii u dětí je spojováno s poruchami vývoje zubu, ať už se jedná o změny v jejich tvaru, počtu, nebo o anomálie skloviny5).
Uvažuje se také o negativním vlivu kyseliny acetylsalicylové na správný vývoj skloviny dítěte. Ve studii od Nazir et al. byly sledovány zuby novorozených králíků, jejichž matkám byl během těhotenství dlouhodobě podáván aspirin. U novorozených mláďat došlo k hypomineralizaci (Ca2+, Mg2+) řezáků a stoliček6). I když se u člověka obdobný proces dosud nezpozoroval, opatrnost je na místě a ani užívání volně prodejných léčiv u těhotných nebo kojících matek a dětí by nemělo probíhat bez porady s lékařem a/nebo lékárníkem.
Léčiva a lékové formy poškozující přímo nebo nepřímo struktury zubu
K léčivům a lékovým formám přímo poškozujícím zubní sklovinu (ve formě erozí) se mohou řadit ta, která:
- snižují pH v dutině ústní
Při užívání práškových inhalátorů pacienty s astmatem je prášek s účinnou látkou částečně zachycen již v dutině ústní, a protože některá antiastmatika (kortikosteroidy, beta2-agonisté) jsou kyselé povahy, snižují v ní pH7) a mohou tak podporovat demineralizační proces skloviny zubů především při dlouhodobé terapii.
Také mnoho antibiotických přípravků je kyselé povahy a ovlivňují tak pH v dutině ústní, pokud jsou podávány perorálně, např. ve formě sirupů dětem. Kritických hodnot pH optimálních pro rozpouštění hydroxyapatitu ve sklovině dosahují např. antibiotické přípravky s kyselinou klavulonovou8).
K léčivům a lékovým formám nepřímo poškozujícím zubní sklovinu se mohou řadit ta, která:
- obsahují kariogenní sacharidy
Různá léčiva (antibiotika, antitusika, analgetika, antihistaminika aj.), ale i doplňky stravy (vitaminové preparáty) jsou dětem batolecího věku podávána v podobě sirupů obsahujících sacharidy s kariogenním potenciálem, aby jejich užívání bylo pro dítě přijatelné. Častý příjem takové lékové formy může být důvodem ke zvýšené prevalenci ECC. Proto by při jejím opakovaném či dlouhodobém užívání měla být hygiena dutiny ústní zvláště pečlivá a měla by být dodržována i další preventivní opatření. Již před přibližně 40 lety byla publikována studie zabývající se rozvojem zubního kazu u dětí předškolního věku, které pravidelně po dobu alespoň 6 měsíců užívaly léčiva ve formě sirupů. U dětí, které přijímaly sirupy s obsahem sacharózy, byla zaznamenána podstatně vyšší kazivost zubů, a dokonce i častější výskyt zánětu dásní oproti kontrolní skupině. Proto se tehdy navrhovalo, aby léky podávané dětem v této formě neobsahovaly sacharidy, nebo pouze sacharidy nekariogenní9).
U dospělých mohou být příkladem lékových forem s obsahem cukru, a tudíž potenciálně zvyšujících riziko zubního kazu, žvýkací tablety (např. antacida), pastilky nebo granule. Pomocnými látkami v případě homeopatických granulí jsou glukóza a laktóza, což jsou sacharidy s nejvyšším kariogenním potenciálem10, 11).*
*Kariogenní potenciál těchto sacharidů může být v různých potravinách (např. mléce, mléčných výrobcích a dalších) vyvážen přítomností proteinů a minerálních látek s protektivními vlastnostmi ve vztahu k zubnímu kazu, což ve výsledku znamená nízké riziko nebo dokonce ochranu před vznikem a rozvojem zubního kazu při jejich konzumaci.
- jsou příčinou nauzey
Léčiva (antidepresiva, anticholinergika, antiastmatika, sedativa, estrogeny aj.), jejichž nežádoucím účinkem je kyselý reflux ze žaludku do horní části trávicího traktu v důsledku relaxace svalů dolního jícnového svěrače nebo nesnášenlivosti léčby, můžeme označit za rizikový faktor pro vznik erozí a rozvoj zubního kazu.
Léčiva narušující protektivní schopnosti sliny a spojená s dysbiózou v dutině ústní
Slinné žlázy jsou inervovány sympatickým (adrenergním) a parasympatickým (cholinergním) nervovým systémem, který ovlivňuje produkci slin. Jelikož slina hraje důležitou roli v ochraně před zubním kazem, dlouhodobé užívání léčiv, u kterých je nežádoucím efektem poškození slinných žláz, zpomalení toku sliny a/nebo změna jejích vlastností, může být rizikovým faktorem pro toto onemocnění. Slina nemůže plnit svou funkci v procesu remineralizace zubní tkáně a udržování rovnováhy ve složení orální mikroflóry.
Suchost úst (xerostomie) je nežádoucím účinkem celé řady léčiv. Za taková jsou považována některá léčiva ze skupiny anticholinergik, antimuskarinik, antidepresiv, antihypertenziv, sympatolytik, beta2-agonistů, anxiolytik, sedativ, opioidů a kanabinoidů, antihistaminik, nesteroidních analgetik a protizánětlivých léčiv, antiparkinsonik, inhibitorů protonové pumpy, cytotoxik, retinoidů, inhibitorů proteáz, diuretik, myorelaxancií, antiepileptik a dalších12).
S užíváním antiepileptika fenytoinu, antihypertenziva nifedipinu a imunosupresiva cyklosporinu a dalších léčiv je spojován výskyt hyperplazie gingivy, která má negativní vliv na orální hygienu a zvyšuje riziko orálních infekcí13).
V posledních letech se uvažuje také o významu kandidózy při vzniku a rozvoji zubního kazu; výsledky recentní studie u předškolních dětí dokládají, že vysoká koncentrace kandid ve slinách a přítomnost specifických druhů (Candida albicans a C. dubliniensis) souvisí se závažností ECC14). Dlouhodobé užívání antibiotik může mít vliv na rozvoj kvasinkové infekce na sliznicích dutiny ústní. Dalšími léčivy, jejichž užívání je považováno za rizikový faktor pro rozvoj orální kandidózy, jsou imunosupresiva a systémové nebo inhalační (lokální) kortikosteroidy15, 16).
Léčiva a doplňky stravy ve vztahu k terapii a prevenci zubního kazu
Z výsledků metaanalýz vyplývá, že antimikrobiální léčba pouze dočasně redukuje množství S. mutans v dutině ústní. Neexistují důkazy o tom, že by působení antibiotik mělo protektivní vliv na vznik a rozvoj ECC17). Orální bakterie získávají rezistenci na léčiva v současné době používaná a je zde tedy neustálá potřeba vývoje nových preparátů18).
Ačkoliv se při terapii a prevenci ECC používají různá léčiva, doplňky stravy a podpůrné prostředky, jejich účinek byl shledán v tomto kontextu malý nebo nedostatečný. Efektivitě léčby ECC se věnuje práce od Twetman a Dhar, ve které jsou shrnuty poznatky o vlivu podávání preparátů s fluoridem (past, gelů, tablet, kapek), xylitolu, chlorhexidinu, jódovaného povidonu, probiotických bakterií, remineralizačních činidel (CPP – kasein-fosfo-peptidu), tmelů, dočasných náhrad a významu konzervační (záchovné) stomatologické péče při redukci prevalence ECC19). Výsledky poukazují na potřebu vysoce kvalitního experimentálního i klinického výzkumu, na jejichž základech by se dala navrhnout účinnější preventivní opatření20).
Závěr
Pacienti, kteří jsou vystaveni farmakoterapii spojené s potenciálním rizikem vzniku a rozvoje zubního kazu, by měli být o tomto faktu informováni, především pak při častém nebo dlouhodobém podávání příslušných léčiv. Nejohroženější skupinou jsou lidé s poškozenou sklovinou zubu, ať už v důsledku vývojové vady zubů nebo například po bělení zubů, a děti předškolního i školního věku.
Ačkoliv existuje klesající trend výskytu zubního kazu u dětí, Česká republika má nepochybně potenciál pro další zlepšení orálního zdraví v populaci při realizaci adekvátních preventivních opatření. Dle Světové zdravotnické organizace (WHO) je zubní kaz z hlediska léčby čtvrtým nejdražším onemocněním na světě. Součástí strategického dokumentu WHO Zdraví 21 je Dlouhodobý program zlepšování zdravotního stavu obyvatelstva ČR, kdy jedním z cílů je, aby alespoň 80 % dětí do věku 6 let bylo bez zubního kazu v dočasné dentici. Ve věku 12 let by děti měly mít v průměru maximálně 1,5 KPE (zub kariézní, s výplní nebo extrahován) ve stálé dentici21).
V rámci prevence se doporučuje:
- Po užití preparátů obsahujících kyseliny nebo po zvracení si bezprostředně nečistit zuby (čištění zubů je vhodné až za cca 40–60 minut), pouze dutinu ústní vypláchnout vodou. Pacienti by měli používat měkké zubní kartáčky a zubní pasty s nízkou abrazivitou22).
- Po podávání orálních preparátů s obsahem kariogenních sacharidů vypláchnout ústa/vypít sklenici vody a provést orální hygienu (případně užít žvýkačku bez cukru nebo s xylitolem), neboť tím jsou odstraněny sacharidy z plaku, hydratují se sliznice a podpoří se tvorba slin. Pokud je to možné, je vhodné neužívat výše zmíněné léky a lékové formy před spaním.
- Pro zmírnění příznaků xerostomie vyplachovat ústa neslazenou minerální vodou, a/nebo použít umělé sliny ve formě spreje, kloktadel, gelů nebo tablet (jsou bez sacharidů a obsahují kalciový pufr). Doporučuje se omezit kofein, je možné užít léčiva stimulující tvorbu slin v případě alespoň částečné funkčnosti slinných žláz (např. parasympatomimetikum pilokarpin).
- Důležitým doporučením je častější frekvence preventivních návštěv zubního lékaře a dentální hygienistky u pacientů, kteří procházejí opakovanou a dlouhotrvající terapii spojenou s užíváním léčiv a lékových forem podporujících vznik a rozvoj zubního kazu.
- V neposlední řadě je vhodné upravit dietní návyky, hydratovat organismus, omezit příjem sladkostí, ovocných šťáv apod. a důsledně se věnovat pravidelné orální hygieně.
Článek vznikl s podporou grantu AZV 17-30439A a z prostředků poskytnutých Lékařskou fakultou MU juniorskému výzkumníkovi Petře Bořilové Linhartové.
Střet zájmů: žádný.
Došlo: 20. dubna 2017
Přijato: 8. května 2017
Mgr. Petra Bořilová Linhartová, Ph.D.
L. Izakovičová Hollá
Ústav patologické fyziologie LF MU
Kamenice 5,
625 00 Brno
e-mail: plinhart@med.muni.cz
Stomatologická klinika LF MU a FN u sv. Anny v Brně
Sources
1. Drugs that promote dental caries. Prescrire Int. 2015; 24(157), 41–42, 44.
2. Billings R. J., Berkowitz R. J., Watson G. Teeth. Pediatrics. 2004; 113(4 Suppl), 1120–1127.
3. Jacobsen P. E., Henriksen T. B., Haubek D., Ostergaard J. R. Developmental enamel defects in children prenatally exposed to anti-epileptic drugs. PLoS One. 2013; 8(3), e58213.
4. Mastora A., Vadiakas G., Agouropoulos A., Gartagani-Panagiotopoulou P., Gemou Engesaeth V. Developmental defects of enamel in first permanent molars associated with use of asthma drugs in preschool aged children: A retrospective case-control study. Eur. Arch. Paediatr. Dent. 2017; 18(2), 105–111.
5. Carrillo C. M., Corrêa F. N., Lopes N. N., Fava M., Odone Filho V. Dental anomalies in children submitted to antineoplastic therapy. Clinics (Sao Paulo) 2014; 69(6), 433–437.
6. Nazir S., Naqvi S. N. U. H., Ahmed M., Arain A. H., Nazir, N. Effect of aspirin on the developing teeth of neonates. Int. J. Morphol. 2011; 29(1), 278–285.
7. Kargul B., Tanboga I., Ergeneli S., Karakoc F., Dagli E. Inhaler medicament effects on saliva and plaque pH in asthmatic children. J. Clin. Pediatr. Dent. 1998; 22(2), 137–140.
8. Valinoti A. C., da Costa L. C. Jr., Farah A., Pereira de Sousa V., Fonseca-Gonçalves A., Maia L. C. Are pediatric antibiotic formulations potentials risk factors for dental caries and dental erosion? Open Dent. J. 2016; 10, 420–430.
9. Roberts I. F., Roberts G. J. Relation between medicines sweetened with sucrose and dental disease. Br. Med. J. 1979; 2(6181), 14–16.
10. Chu J., Zhang T., He K. Cariogenicity features of Streptococcus mutans in presence of rubusoside. BMC Oral Health. 2016; 16(1), 54.
11. Assaf D., Steinberg D., Shemesh M. Lactose triggers biofilm formation by Streptococcus mutans. Int. Dairy J. 2015; 42, 51–57.
12. Miranda-Rius J., Brunet-Llobet L., Lahor-Soler E., Farré M. Salivary secretory disorders, inducing drugs, and clinical management. Int. J. Med. Sci. 2015; 12(10), 811–824.
13. Trackman P. C., Kantarci A. Molecular and clinical aspects of drug–induced gingival overgrowth. J. Dent. Res. 2015; 94(4), 540–546.
14. Lozano Moraga C. P., Rodríguez Martínez G. A., Lefimil Puente C. A., Morales Bozo I. C., Urzúa Orellana B. R. Prevalence of Candida albicans and carriage of Candida non-albicans in the saliva of preschool children, according to their caries status. Acta Odontol. Scand. 2017; 75(1), 30–35.
15. Patil S., Rao R. S., Majumdar B., Anil S. Clinical appearance of oral candida infection and therapeutic strategies. Front. Microbiol. 2015; 6, 1391.
16. Jainkittivong A., Kuvatanasuchati J., Pipattanagovit P., Sinheng W. Candida in oral lichen planus patients undergoing topical steroid therapy. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2007; 104(1), 61–66.
17. Li Y., Tanner A. Effect of antimicrobial interventions on the oral microbiota associated with early childhood caries. Pediatr. Dent. 2015; 37(3), 226–244.
18. Kalesinskas P., Kačergius T., Ambrozaitis A., Pečiulienė V., Ericson D. Reducing dental plaque formation and caries development. A review of current methods and implications for novel pharmaceuticals. Stomatologija. 2014; 16(2), 44–52.
19. Twetman S., Dhar V. Evidence of effectiveness of current therapies to prevent and treat early childhood caries. Pediatr. Dent. 2015; 37(3), 246–253.
20. Hajishengallis E., Parsaei Y., Klein M. I., Koo H. Advances in the microbial etiology and pathogenesis of early childhood caries. Mol. Oral. Microbiol. 2017; 32(1), 24–34.
21. Ministerstvo zdravotnictví ČR. Zdraví pro všechny v 21. Století, 2002. http://www.mzcr.cz/Verejne/dokumenty/zdravi-pro-vsechny-v-stoleti_2461_1101_5.html (8. 4. 2017).
22. Bartlett D. W. The role of erosion in tooth wear: aetiology, prevention and management. Int. Dent. J. 2005; 55(4 Suppl 1), 277–284.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2017 Issue 3-
All articles in this issue
- Infekce viru herpes simplex: přehled problematiky, farmakologická terapie a dietní opatření
- Léčiva a lékové formy jako rizikové faktory pro zubní kaz
- Stupeň výskytu syndromu vyhoření u farmaceutů: dílčí studie
- Role nemocničního farmaceuta v managementu astmatu ve Velké Británii
- Vliv vaginálních globulí Melanizol® a Klimedeks® na hladinu glykogenu ve vaginální tkáni potkanů s experimentálně vyvolanou vaginitidou
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infekce viru herpes simplex: přehled problematiky, farmakologická terapie a dietní opatření
- Léčiva a lékové formy jako rizikové faktory pro zubní kaz
- Stupeň výskytu syndromu vyhoření u farmaceutů: dílčí studie
- Role nemocničního farmaceuta v managementu astmatu ve Velké Británii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

