-
Medical journals
- Career
Hodnocení vlivu koncentrace účinné látky a technologie mísení na obsahovou stejnoměrnost směsi pro přípravu tablet s nízkým obsahem warfarinu
: Jan Elbl; Jan Muselík; Aleš Franc; Jana Mikušová; Zuzana Dolejší; David Vetchý
: Veterinární a farmaceutická univerzita Brno ; Ústav technologie léků, Farmaceutická fakulta
: Čes. slov. Farm., 2016; 65, 211-215
: Original Articles
Warfarin je léčivem s úzkým terapeutickým indexem. Individuální titrace dávky a průběžná kontrola terapie je vyvážena dlouhodobou klinickou praxí a nízkými náklady. S ohledem na nízké dávky je jedním z kritických parametrů obsahová stejnoměrnost pevné lékové formy. Ta musí vyhovět nejen lékopisným požadavkům, ale i na definované statistické hladině významnosti zaručit jejich splnění.
Tato práce se zabývá vlivem koncentrace léčiva a časem domísení směsi po přídavku lubrikantu na obsahovou stejnoměrnost směsí a z nich nalisovaných tablet. Výsledky ukazují, že pro dosažení vyhovující obsahové stejnoměrnosti je vhodná koncentrace léčiva 2–2,7 % a její zvýšení nebo snížení má na obsahovou stejnoměrnost negativní vliv. Výsledky rovněž potvrzují čas domísení 5 minut jako adekvátní, neboť při delší homogenizaci dochází k tzv. přemísení směsi.Klíčová slova:
obsahová stejnoměrnost • warfarin • čas mísení • úzký terapeutický indexÚvod
Warfarin, zprvu využívaný jako rodenticid, se po objevení možnosti využití vitaminu K jako antidota začal v padesátých letech 20. století používat jako humánní antikoagulans1). Je derivátem dikumarolu a v lékopisech se uvádí ve formě sodné soli jako amorfát nebo krystalický klatrát isopropanolu. Jako lék byl poprvé registrován v roce 1954 firmou DuPont Pharma ve formě klatrátu v perorálních tabletách pod názvem Coumadine®.
Ochrana původního léku umožňovala nástup generik již od roku 1962. Nicméně až do roku 1996 byla firma DuPont Pharma jeho monopolním dodavatelem na trhu v USA2). Příčinou zpoždění nástupu generických náhrad byly komplikace v osmdesátých letech, pozorované při převedení pacientů na tyto náhrady. Jednalo se o zvýšené riziko úmrtnosti a zdravotních komplikací způsobenými rozdílnými časy ve srážlivosti krve po podání generika3). Jako příčina byla označena amorfní forma warfarinu obsažená v generické náhradě4). Vzhledem k tomu, že se dávka při individuální terapii upravuje pouze o 5–15 %, byly komplikace později přisuzovány i možným chybám v obsahové stejnoměrnosti. První generická substituce byla proto schválena až roku 1997. Toto zpoždění v zavedení generické náhrady bylo zapříčiněno také díky snaze originálního výrobce prosadit vlastní výrobní limity pro obsahovou stejnoměrnost (± 7,5 % a RSD ≤ 3 %) do USP5). Je třeba podotknout, že i přes setrvání původních limitů USP (85–115 % průměru, RSD ≤ 6 %) nastavují generičtí výrobci vlastní, přísnější limity pro obsahovou stejnoměrnost6). V současnosti jsou nároky na obsahovou stejnoměrnost tablet dle USP (čl. <905>), harmonizovaných s Ph.Eur. (čl. 2.9.40), ve srovnání s tehdy platným článkem USP přísnější. Dále byl zaveden zúžený limit pro obsahovou stejnoměrnost tabletové směsi, který v USA prosadil FDA. Ten požaduje hodnocení nejméně deset vzorků směsi, přičemž nalezené obsahy musí být v intervalu 90–110 % průměrného obsahu a hodnota RSD ≤ 5 %. Naopak ale nehodnotí shodu nalezeného průměrného obsahu s obsahem deklarovaným a nepředpokládá chybu vzorkování, která může být v praxi velká a může dokonce převýšit samotnou chybu obsahové stejnoměrnosti.
Výrobní technologie musí v rámci správné výrobní praxe splňovat dané limity obsahové stejnoměrnosti směsi i tablet na deklarované hladině významnosti. Pro hodnocení se v tomto případě využívá procesní index způsobilosti procesu (Cpk). Ve farmaceutické technologii by měl pro sledované limity nabývat hodnoty ≥ 1. Dalším typem hodnocení je porovnáním RSD obsahové stejnoměrnosti s Bergumovym kritériem, to se s výhodou používá u hodnocení tablet7).
Experiment navazuje na již publikované práce, ve kterých byl hodnocen vliv distribuce velikosti částic plniva a účinné látky, času mísení směsi a času domísení na obsahovou stejnoměrnost7–9). Tato práce se zabývá vlivem koncentrace léčiva a času domísení směsi po přídavku lubrikantu na obsahovou stejnoměrnost směsí a z nich nalisovaných tablet.
Pokusná část
Příprava směsí a tablet
Složení směsí a vybrané fyzikálně chemické vlastnosti jednotlivých složek uvedené v tabulce 1 byly vybrány dle patentu VFU Brno a předchozích experimentálních prací7–10). Byly připraveny dvě směsi s obsahem klatrátu sodné soli warfarinu 0,55 % a 5,46 %, odpovídající obsahu 1 a 10 mg sodné soli warfarinu v tabletě. Jako další proměnná byl zvolen celkový čas mísení směsi, tj. součet času mísení bez lubrikantu a po jeho přidání jako 15, 20 a 25 min.
1. Složení tabletových směsí a fyzikálně chemické vlastnosti jednotlivých složek 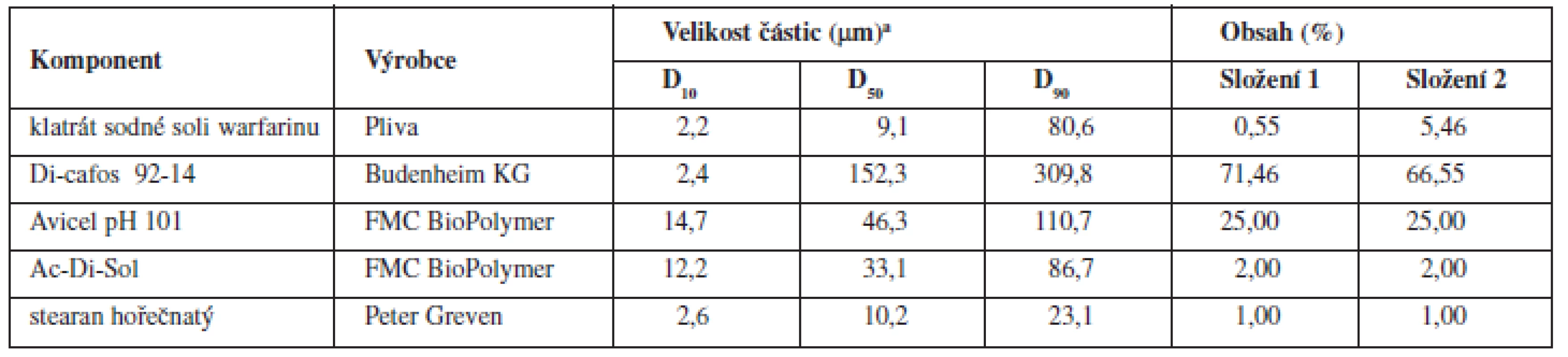
aDx – hraniční mez (μm), do které svou velikostí spadá x % proměřených částic Di-cafos – hydrogenfosforečnan vápenatý, Avicel PH 101 – mikrokrystalická celulosa, Ac-Di-Sol – sodná sůl kroskarmelosy Všechny dílčí komponenty tabletoviny (složení 1 a 2 viz tab. 1.) byly přesítovány sítem o velikosti oka 500 μm a míseny 10 minut. Následně byl přidán stearan hořečnatý a mísení pokračovalo dalších 5, 10 nebo 15 minut (technologie A, B, resp. C). Mísení všech šarží probíhalo v homogenizačním zařízení Turbula (T2C, Švýcarsko) rychlostí 40 otáček/minutu a velikost šarže činila 500 g. Celkem byly připraveny dvě směsi o koncentracích 0,55 % a 5,46 % za použití tří technologií, přičemž každá šarže byla zopakována při stejném složení a identických podmínkách (celkem bylo připraveno 12 šarží směsi).
Bikonvexní tablety o průměru 7 mm, výsledné hmotnosti 200,0 mg a radiální pevnosti 70 N byly připraveny na excentrickém lisu (Korsch EK0, Německo) při rychlosti lisování 50 tablet za minutu.
Hodnocení obsahu warfarinu v tabletových směsích a tabletách
Pro stanovení obsahové stejnoměrnosti byla každá směs vysypána na dno kruhové misky (průměr 25 cm) a horizontálními pohyby zarovnána na výšku cca 2 cm. Povrch hladiny byl rozdělen na deset rovnoměrně rozložených segmentů (devět obvodových a jeden středový) a z každého segmentu byl odebrán vzorek o hmotnosti přibližně 600 mg a jeho hmotnost zaznamenána.
Během lisování bylo v pravidelných časových intervalech postupně odebráno z každé šarže celkem deset tablet na stanovení obsahové stejnoměrnosti.
Odebrané a zvážené vzorky tabletové směsi nebo tablet byly převedeny do odměrných baněk (50 nebo 100 ml podle obsahu warfarinu) a ponechány po dobu 12 hodin v roztoku voda : methanol (9 : 1; v/v). Poté byla směs doplněna roztokem po rysku a centrifugována (10 minut, 5 000 ot. min–1) pro oddělení nerozpustných pomocných látek. Připravené vzorky byly analyzovány pomocí HPLC za podmínek uvedených v literatuře7).
Statistické zpracování výsledků
Získané výsledky obsahu ve směsích a tabletách (n = 10) byly přepočteny relativně vůči teoretickému obsahu sodné soli warfarinu. Na základě těchto hodnot byl pro každou šarži vypočítán průměrný obsah, směrodatná odchylka, RSD a Cpk indexy pro limity dle Ph.Eur. čl. 2.9.6 (85–115 %). Tablety byly hodnoceny i dle Ph.Eur 2.9.40 a nalezené hodnoty RSD porovnány s tabelovanými hodnotami dle Berguma.
Výsledky a diskuze
Připravené tabletové směsi se lišily v obsahu klatrátu sodné soli warfarinu (0,55 % a 5,46 %; které odpovídají obsahu sodné soli warfarinu 1 a 10 mg v tabletě). Následně byly směsi míseny třemi rozdílnými postupy, lišícími se v délce domísení směsi po přídavku lubrikantu (stearan hořečnatý). Nejprve byly všechny složky směsi míseny 10 minut a po přísadě lubrikantu ještě domíseny 5, 10 a 15 minut (technologie A, B a C), celkové časy mísení tedy činily 15, 20 a 25 minut. U směsí a z nich připravených tablet byla hodnocena obsahová stejnoměrnost (viz statistické hodnocení výsledků).
Vyhodnocení obsahové stejnoměrnosti směsí
Z výsledků vyplývá, že pouze jedna šarže ze směsí o koncentraci 0,55 % vyhověla všem sledovaným limitům, a to šarže s domísením 15 minut. V porovnání s předchozími pracemi9, 10) lze konstatovat, že snížení obsahu léčiva ve směsi z 2,73 % na 0,55 % vede k výraznému zhoršení obsahové stejnoměrnosti. Dříve připravené směsi s koncentrací klatrátu sodné soli warfarinu 2,73 % vyhověly lékopisným kritériím, požadavkům FDA i požadavku Cpk ≥ 1,0 pro limit dle Ph.Eur. 2.9.6. Oproti tomu většina směsí o koncentraci 0,55 % nesplnila požadavek Cpk ≥ 1,0 pro limit dle Ph.Eur. 2.9.6 a zákonitě ani požadavky FDA na obsahovou stejnoměrnost tabletové směsi.
Všechny tabletové směsi o koncentraci léčiva 5,46 % vyhověly lékopisným požadavkům Ph.Eur. 2.9.6. Pro technologie využívající 5 a 10 minut domísení platí, že vždy jedna šarže vyhověla jak požadavkům FDA, tak požadavku Cpk ≥ 1,0 pro limit dle Ph.Eur. 2.9.6, zatímco druhá nevyhověla ani v jednom případě. Obě šarže připravené technologií C vyhověly požadavkům FDA, ale nikoliv požadavku Cpk ≥ 1,0 pro limit dle Ph.Eur. 2.9.6.
Obecně lze konstatovat, že zvýšení koncentrace warfarinu ve směsi z hodnoty 0,55 % na 5,46 % vede ke zlepšení obsahové stejnoměrnosti. I přes tento fakt, ne všechny vzorky ze směsi o obsahu 5,46 % vyhověly všem kritériím (tab. 2). V porovnání z předchozí prací9), kdy směsi o koncentraci 2 a 2,73 % vyhověly všem kritériím, lze usoudit, že změna koncentrace v obou směrech negativně ovlivňuje obsahovou rovnoměrnost směsi. Z obrázku 1 vyplývá, že prodloužením délky mísení z pěti na 10 nebo 15 minut se neprokázalo zlepšení uniformity směsí stejně jako v předchozí studii9).
2. Průměrné obsahy a parametry obsahové stejnoměrnosti tabletových směsí 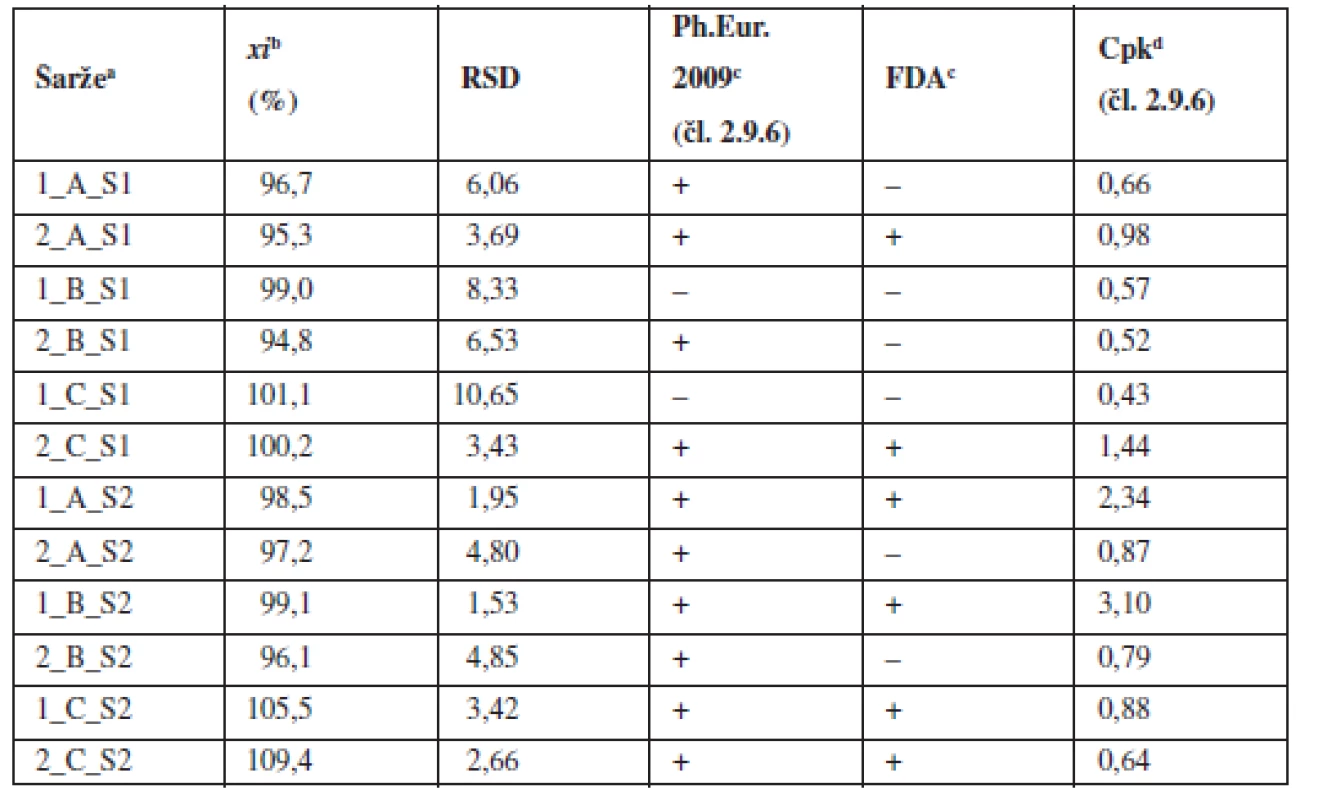
a označení šarží: číslo šarže_technologie mísení_obsah warfarinu, S – složení dle tabulky 1 b průměr z deseti jednotlivých vzorků odebraných z dané šarže c (+) vyhovuje, (–) nevyhovuje d Cpk indexy pro limity dle Ph.Eur. čl. 2.9.6 (85–115 %) 1. Vliv času domísení na obsahovou stejnoměrnost tabletové směsi o složení 1 (■) a 2 (●) – dle tabulky 1; chybové úsečky znázorňují maximální a minimální hodnotu RSD v rámci připravených šarží 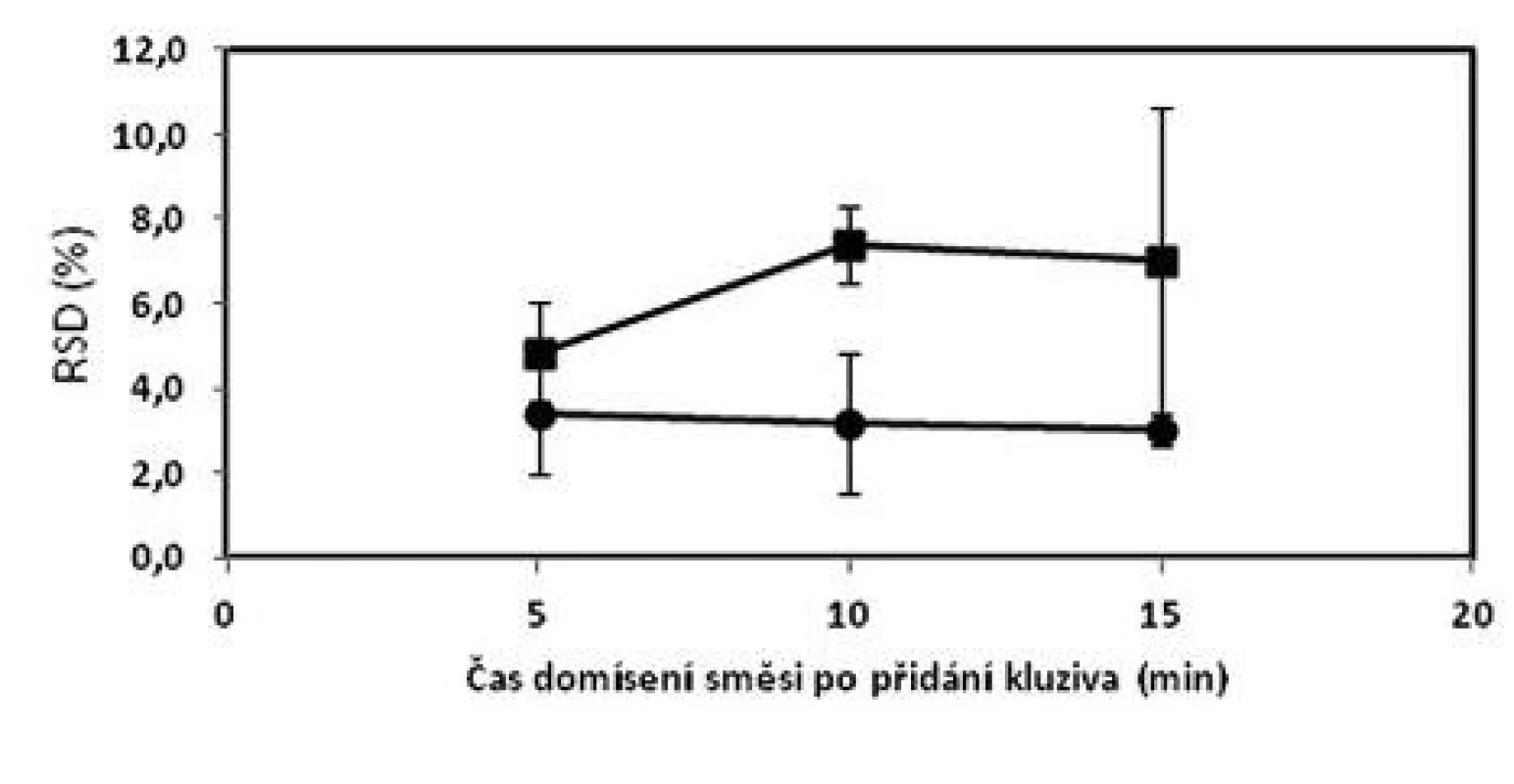
Vyhodnocení obsahové stejnoměrnosti připravených tablet
Výsledky vyhodnocení připravených tablet shrnuje tabulka 3. Tablety s obsahem 1 mg účinné látky nevyhověly mimo jedné šarže požadavkům lékopisu ani požadavku Cpk ≥ 1,0 pro limit dle Ph.Eur. 2.9.6. Bergumovu kritériu nevyhověla ani jedna ze šarží. Z toho vyplývá, že uvedené postupy mísení u této koncentrace účinné látky nejsou vhodné pro opakovanou produkci tabletové směsi a tablet.
3. Průměrné obsahy a parametry obsahové stejnoměrnosti tablet 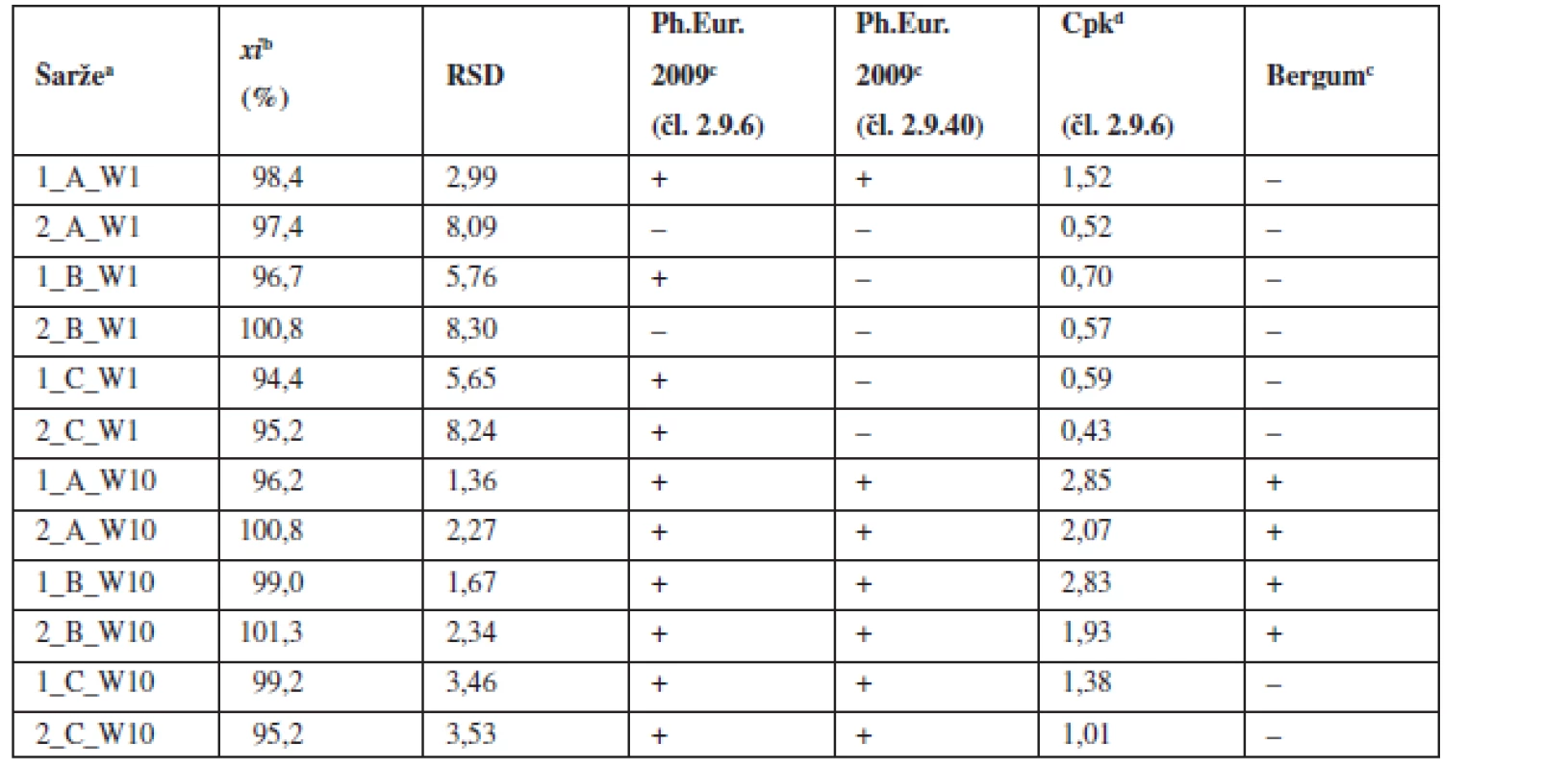
a označení šarží: číslo šarže_technologie mísení_obsah warfarinu, W – warfarin sodná sůl b průměr z deseti jednotlivých vzorků odebraných z dané šarže c (+) vyhovuje, (–) nevyhovuje d Cpk indexy pro limity dle Ph.Eur. 2009 čl. 2.9.6 (85–115 %) e porovnání RSD podle tabulky č.2 Bergumova rozdělení Oproti tomu tablety o obsahu 10 mg sodné soli warfarinu vyhověly lékopisným požadavkům a kritériu Cpk ≥ 1,0 dle Ph.Eur. 2.9.6 ve všech vyrobených šaržích. Nejpřísnějšími kritériu – Bergumovu rozdělení vyhověly pouze šarže domísené 5 a 10 minut po přídavku lubrikantu. Zjištěné hodnoty Cpk byly mírně vyšší v případě šarže domísené po čase 5 minut. Z obrázku 2 vyplývá, že prodloužení délky domísení po přídavku lubrikantu z pěti na 10 nebo 15 minut nevede ke zlepšení obsahové stejnoměrnosti tablet. Při srovnání s obrázkem 1 jsou hodnoty RSD menší u tablet než u odpovídajících směsí. To lze přisoudit chybě při vzorkování směsi. Potvrzuje to i skutečnost, že samotné tablety připravené z nevyhovujících směsí mají vyhovující obsahovou stejnoměrnost.
2. Vliv času domísení na obsahovou stejnoměrnost tablet s obsahem 1 mg (■) a 10 mg (●) sodné soli warfarinu; chybové úsečky znázorňují maximální a minimální hodnotu RSD v rámci připravených šarží 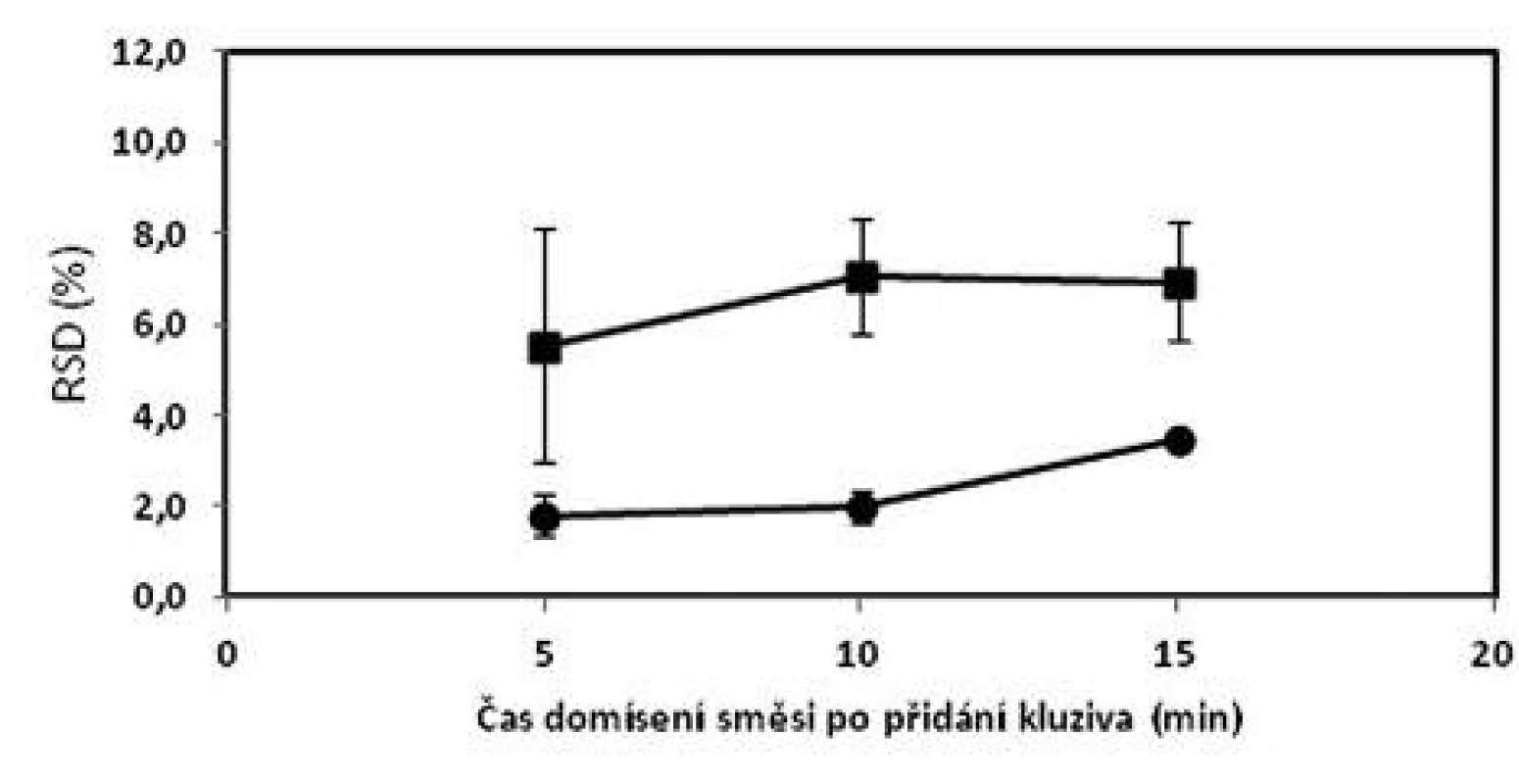
Z výsledků je patrné, že technologické postupy, které byly hodnoceny u šarží o koncentraci 0,55 % (1,09 mg) klatrátu sodné soli warfarinu jsou nevhodné pro opakovanou přípravu tabletových směsí a tablet. Jako nejlepší technologický postup se ukázalo domísení s časem 5 min. Delší homogenizace zhoršuje obsahovou stejnoměrnost tablet pravděpodobně vlivem segregace složek tabletové směsi (tzv. přemísení – overblending). U šarží o koncentraci 5,46 % (10,91 mg) klatrátu sodné soli warfarinu byly při délce domísení 5 minut (technologie A) připraveny tablety odpovídající všem hodnoceným požadavkům na obsahovou stejnoměrnost. Nicméně ani tato technologie nevyhověla všem kritériím při hodnocení tabletové směsi, pravděpodobně vlivem chyby při vzorkování. Chybu vzorkování není možné zcela eliminovat a ovlivňuje ji celá řada faktorů – jako např. distribuce velikosti částic složek směsi, tvar a materiál použité vzorkovnice, tokové vlastnosti směsi nebo elektrostatický náboj směsi. Na základě literatury lze konstatovat, že vyhovující obsahová stejnoměrnost je dosažena při optimální koncentraci klatrátu sodné soli warfarinu v tabletové směsi, která se nachází v rozmezí 2–2,7 % (hm.)7, 9, 10).
Závěr
Práce navazuje na již dříve publikované výsledky zaměřené na popis procesu mísení směsí s nízkým obsahem klatrátu sodné soli warfarinu, určených pro přímé lisování tablet. V této práci byl hodnocen vliv změny koncentrace účinné látky a času domísení směsi po přidání lubrikantu na obsahovou stejnoměrnost. Koncentrace účinné látky 0,55 % a 5,46 % se neukázala jako vhodná pro přípravu tablet s různým obsahem warfarinu. Porovnáním výsledků s literaturou docházíme k závěru, že ideální je obsah 2–2,7 % účinné látky. Z hlediska domísení byl potvrzen čas 5 minut jako ideální pro homogenitu směsí. Při vývoji dalších sil se proto jeví jako nadějná metodika „common blend“, kde by se ze společné směsi o vyhovující koncentraci účinné látky vyrobily další síly změnou hmotností a velikostí tablet.
Seznam zkratek
RSD – relativní směrodatná odchylka
Ph.Eur. – Evropský lékopis
USP – Lékopis USA
FDA – Úřad pro kontrolu potravin a léčiv
Cpk – index způsobilosti procesu
Střet zájmů: žádný.
Došlo 25. listopadu 2016 / Přijato 7. prosince 2016
Mgr. Jan Elbl
Ústav technologie léků, Farmaceutická fakulta
Veterinární a farmaceutická univerzita
Palackého tř. 1/3,
612 42 Brno
e-mail: elblj@vfu.cz
Sources
1. Wardrop D., Keeling D. The story of the discovery of heparin and warfarin. Brit. J. Haem. 2008; 141, 757–763.
2. Cundiff D. K. Insufficient evidence supporting low-intensity warfarin for venous thromboembolism prophylaxis. Med. Gen. Med. 2003; 5(3), 2.
3. Lawren M. V., Zhanel G. Z. Clinical significance of bioequivalence and interchangeability of narrow therapeutic range drugs: focus on warfarins. J. Pharm. Pharmaceut. Sci. 1998; 3, 92–94.
4. Jaffer A., Bragg L. Practical tips for warfarin dosing and monitoring. Clev. Clin. J. Med. 2003; 70, 361–371.
5. Warfarin sodium antitrust litigation. United states court of appeals for the third circuit. http://www2.ca3.uscourts.gov/opinarch/ 023603p.pdf (21. 11. 2016).
6. Sawoniak A. E., Shalansky A. F., Zed P. J., Sundreji R. Formulary considerations related to warfarin interchangeability. Can. J. Hosp. Pharm. 2002; 55, 215–218.
7. Franc A., Muselík J. Způsob přípravy pevné lékové formy se sodnou solí warfarinu ve formě klatrátu izopropanolu. VFU Brno. Patent CZ304136 (2. 10. 2013).
8. Muselík J., Franc A., Doležel P., Goněc R., Krondlová A., Lukášová I. Influence of process parameters on content uniformity of a low dose active pharmaceutical ingredient in a tablet formulation according to GMP. Acta Pharm. 2014; 64, 355–367.
9. Muselík J., Franc A., Štarková J., Matějková Z. Optimalizace technologických postupů pro přípravu tablet s nízkým obsahem warfarinu metodou přímého lisování. Čes. slov. Farm. 2014; 63, 217–221.
10. Franc A., Muselík J., Máslová R., Hadrabová J. Obsahová stejnoměrnost směsí a tablet obsahujících warfarin. Čes. slov. Farm. 2013; 62, 177–181.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2016 Issue 6-
All articles in this issue
- Influence of drug concentration and blending technology on the content uniformity of mixture for low dose warfarin tablets
- Effect of EUDRAGIT® RS on the release behaviour of theophylline solid dispersions
- Level of understanding of medical terms among italian students
- Fractal aspects of the flow and shear behaviour of free-flowable particle size fractions of pharmaceutical directly compressible excipient sorbitol
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Influence of drug concentration and blending technology on the content uniformity of mixture for low dose warfarin tablets
- Fractal aspects of the flow and shear behaviour of free-flowable particle size fractions of pharmaceutical directly compressible excipient sorbitol
- Effect of EUDRAGIT® RS on the release behaviour of theophylline solid dispersions
- Level of understanding of medical terms among italian students
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

