-
Medical journals
- Career
Štúdium lokálnych anestetík – časť 195
Štúdium micelizácie pentakaíniumchloridu v metanolových a etanolových roztokoch
: Jana Gališinová; Jozef Čižmárik; Fils Andriamainty; Ivan Malík
: Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra farmaceutickej chémie
: Čes. slov. Farm., 2011; 60, 290-295
: Original Articles
Kritická micelová koncentrácia pentakaíniumchloridu v metanolových a etanolových roztokoch s rôznou koncentráciou bola stanovená spektrofotometrickou metódou v UV oblasti spektra v teplotnom intervale T = 278,15–308,15 K a pri pH ≈ 4,5–5,0. Závislosť ln (cmc) od teploty mala tvar „U“ („U-shaped“). Sledoval sa vplyv prídavku n-alkanolov – metanolu a etanolu na kritickú micelovú koncentráciu. Hodnoty cmc ukazujú, že micely sa ľahšie tvoria v prostredí metanolu ako v etanolovom roztoku. Zároveň sa sledoval vplyv koncentrácií jednotlivých alkoholových roztokov na cmc. Pri stúpajúcej koncentrácii alkoholu cmc po určitú hodnotu stúpa, potom klesá.
Kľúčové slová:
lokálne anestetiká – pentakaíniumchlorid – etanol – metanol – kritická micelová koncentrácia – micelizácia – spektrofotometriaÚvod
V ostatnom čase je predmetom rozsiahleho štúdia vplyv prítomnosti aditív na kritickú micelovú koncentráciu tenzidov. Zvýšená pozornosť sa venuje štúdiu solubilizácie alebo inkorporácie neutrálnych molekúl do miciel v ich vodných roztokoch. Jedným z najviac študovaných solubilizátorov sú alkoholy, ktoré hrajú dôležitú úlohu pri príprave mikroemulzií. Je všeobecne známe, že alkohol sa viaže k micele v jej povrchovej oblasti, čo vedie k trom hlavným efektom1–3): 1. Molekuly alkoholu sa vsúvajú medzi povrchové iónové hlavičky tenzidu, čím znižujú povrch miciel a zvyšujú ionizáciu. Tento efekt úzko súvisí so zmenou veľkosti a tvaru miciel. 2. Dielektrická konštanta na micelovom rozhraní pravdepodobne klesá v dôsledku náhrady molekúl vody za molekuly alkoholu na rozhraní. 3. Usporiadanie molekúl sa v oblasti rozhrania miciel mení.
Prídavok etanolu alebo iného málo polárneho rozpúšťadla do vodného roztoku zvyšuje rozpustnosť tenzidu, ale súčasne potláča ich micelizáciu, takže cmc v konečnom dôsledku stúpne4).
Prítomnosť alkoholu s rôzne dlhým reťazcom má rozdielny vplyv na formovanie miciel. Akhter uvádza, že so vzrastajúcim počtom atómov uhlíka v alkohole cmc klesá. Výnimku tvorí etanol a metanol, kde vzostup cmc je dôsledkom sily solvatácie. Prídavok týchto dvoch alkoholov narúša štruktúru solvatovanej vrstvy micely (solvatovanej vody na povrchu), alebo prednostne solvatuje molekuly rozpustenej látky1–3).
V predkladanej práci sme sa zamerali na štúdium vplyvu prídavku n-alkanolu (metanolu, etanolu) a vplyvu rôznych koncentrácií jednotlivých alkoholov na micelizáciu lokálneho anestetika pentakaíniumchloridu.
Kritická micelová koncentrácia, cmc, bola stanovená spektrofotometrickou metódou v UV oblasti spektra v teplotnom intervale T = 278,15–308,15 K a pri pH ≈ 4,5–5,0. Hodnoty cmc boli stanovené pomocou zmeny v závislosti absorbancie od koncentrácie tenzidu v roztoku.
POKUSNÁ ČASŤ
Študované látky a prístroje
Študovanou látkou bolo lokálne anestetikum pentakaíniumchlorid, trapenkaín, K 1902, chemicky trans-2-pyrolidínocyklohexylester kyseliny 3-pentyloxyfenylkarbámovej (obr. 1), ktorý bol pripravený na Katedre farmaceutickej chémie FaF UK v Bratislave podľa práce5).
1. Pentakaíniumchlorid, trapenkaín, K 1902 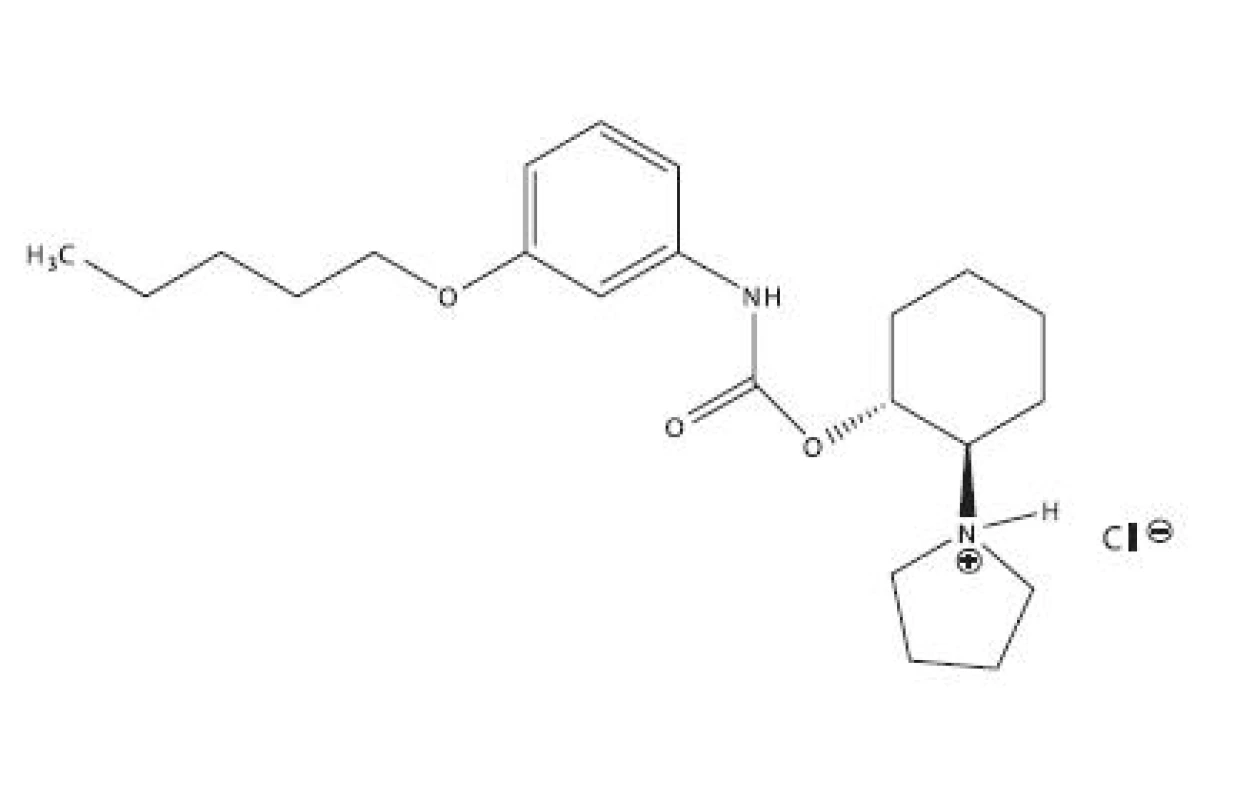
Prístroje
Spectrofotometer HP 8452 A Diode Array (Hewlett Packard, Nemecko); analytické váhy (WA 33 typ PRL T A 13/1, Techma Robot, Poľsko); pH meter (Portamess 943 pH, Elekronische Messgeräte GmbH Co., Nemecko); Termostat (Veb ML W Prüfgerate-Werk Medingen (Sity), Nemecko).
Pracovný postup
Pripravili sme zásobné roztoky meranej látky s koncentráciou rádovo 10-4 mol/l rozpustením výpočtom stanoveného množstva látky (Mr = 374,53) v 2 mol/l, 3 mol/l, 4 mol/l a 5 mol/l metanolovom aj etanolovom roztoku.
Zásobné roztoky sme pripravili rozpúšťaním vo vodnom kúpeli do 40 °C, aby sa látka teplom nedegradovala. Pentakaíniumchlorid sa v jednotlivých metanolových a etanolových roztokoch pri izbovej teplote nerozpúšťa. Nie je rozpustný vo vode ani v roztokoch NaCl, NaBr, NaI, KCl, KBr či KI pri normálnej alebo zvýšenej teplote.
Z jednotlivých zásobných roztokov sme pripravili série roztokov s klesajúcou koncentráciou riedením 2 mol/l, 3 mol/l, 4 mol/l a 5 mol/l metanolových aj etanolových roztokov.
Pri každej koncentrácii sme pri teplotách 278,15 K, 283,15 K, 288,15 K, 293,15 K, 298,15 K, 303,15 K a 308,15 K merali absorbanciu jednotlivých roztokov pri λmax = 234 nm oproti zodpovedajúcemu porovnávaciemu roztoku (príslušný zriedený metanol alebo etanol).
Hodnotu kritickej micelovej koncentrácie sme určili ako priesečník dvoch extrapolovaných kriviek interpretujúcich závislosť absorbancie (A) ako funkciu koncentrácie (c).
VÝSLEDKY A DISKUSIA
Metóda absorpčnej spektrofotometrie v UV oblasti spektra je jedna z tých metód, ktorá nám umožnila stanoviť hodnoty kritickej micelovej koncentrácie pri jednotlivých zriedených metanolových a etanolových roztokoch. Pozorujeme zlom a práve ten predstavuje hľadanú cmc. Exaktný bod je definovaný ako priesečník dvoch extrapolovaných kriviek, ktoré predstavujú závislosť absorbancie (A) od koncentrácie (c). Na extrapoláciu kriviek sme použili komerčný program OriginPro. Zistili sme, že hodnoty cmc v metanolových roztokoch sa pohybovali v rozmedzí od 3,26.10-4 mol/l do 3,98.10-4 mol/l a hodnoty cmc v etanolových roztokoch v rozmedzí od 3,21.10-4 mol/l do 4,28.10-4 mol/l.
Hodnoty cmc a ln (cmc) v závislosti od T sú zaznamenané v tabuľkách 1 až 4 pre metanolové roztoky a v tabuľkách 5 až 8 pre etanolové roztoky. Závislosti ln (cmc) od teploty T pri rozličných koncentráciách alkoholových roztokov majú tvar „U“ („U-shaped“). Hodnoty boli fitované polynómom druhého stupňa. Pre ilustráciu uvádzame graf závislosti ln (cmc) od T v 2 mol/l etanolovom roztoku heptakaíniumchloridu (obr. 2).
1. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 2 mol/l metanolovom roztoku 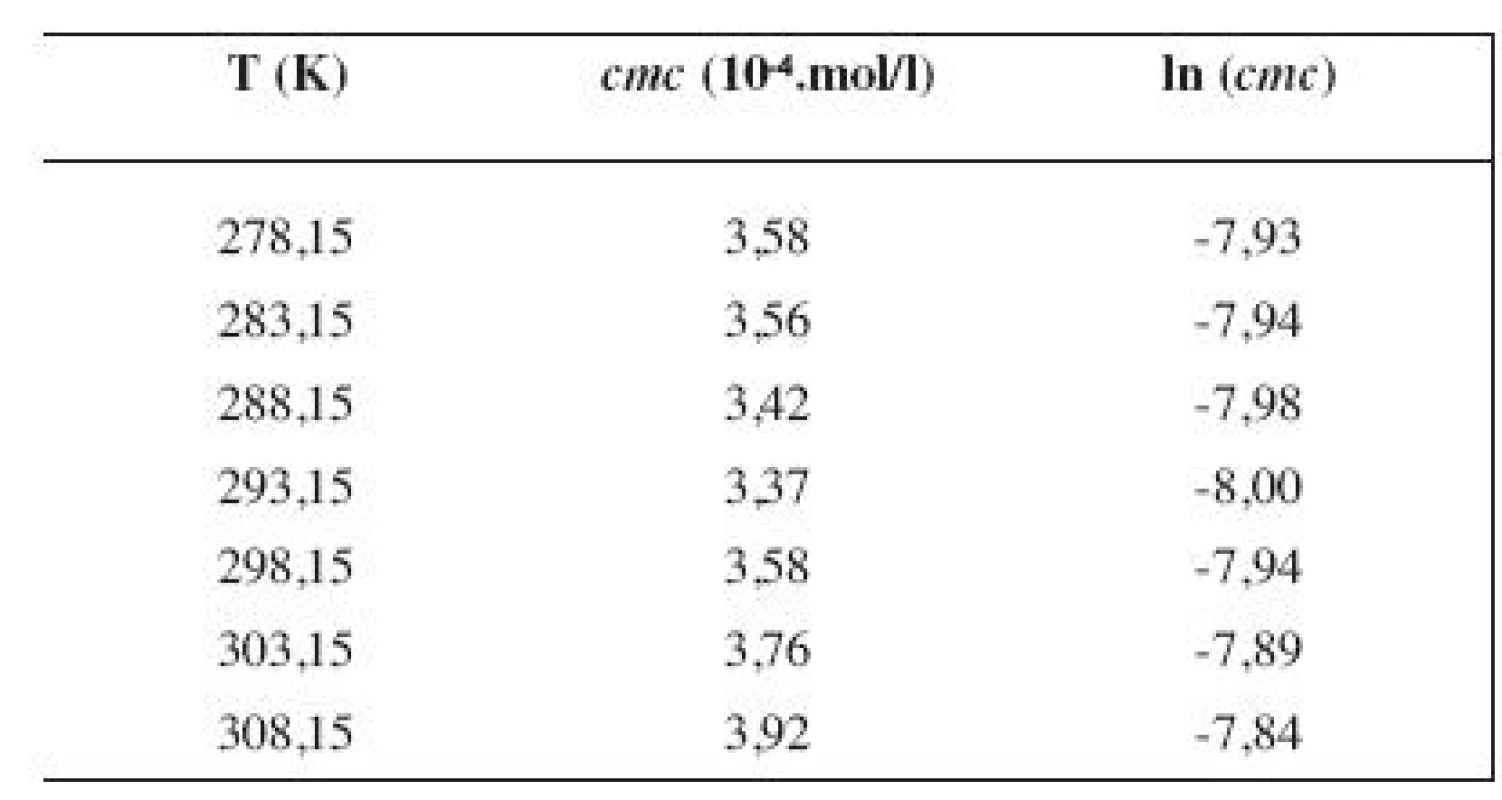
2. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 3 mol/l metanolovom roztoku 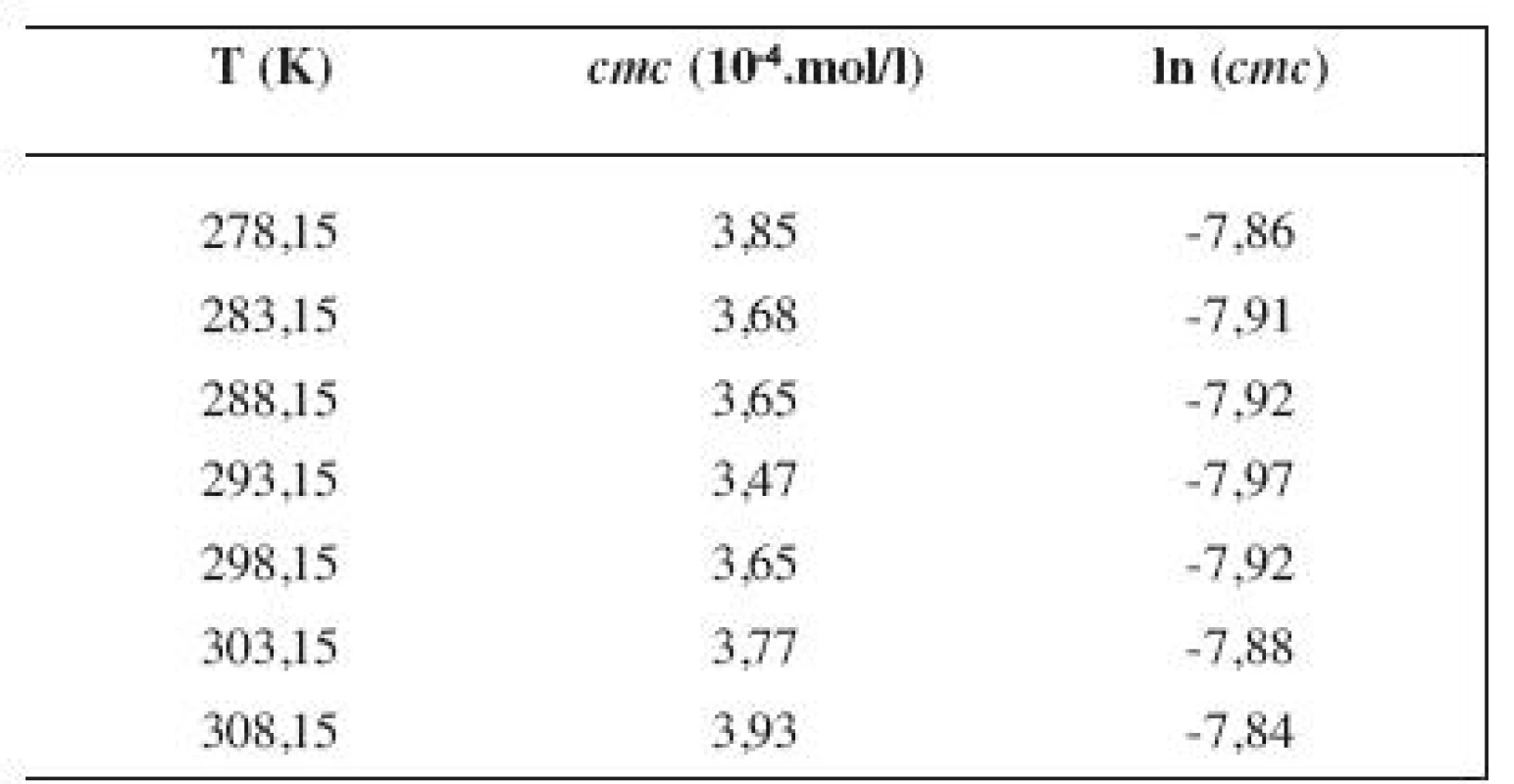
3. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 4 mol/l metanolovom roztoku 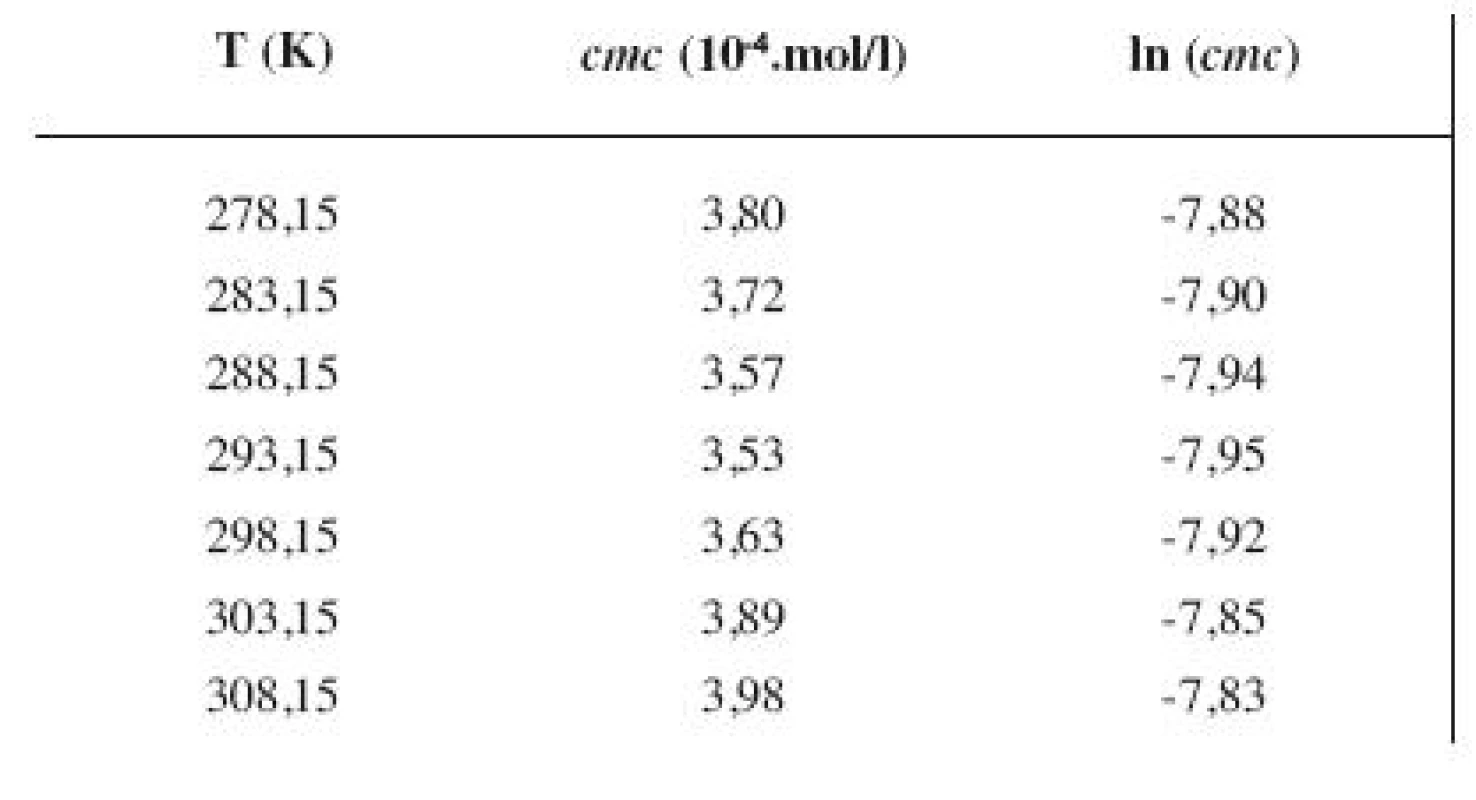
4. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 5 mol/l metanolovom roztoku 
5. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 2 mol/l etanolovom roztoku 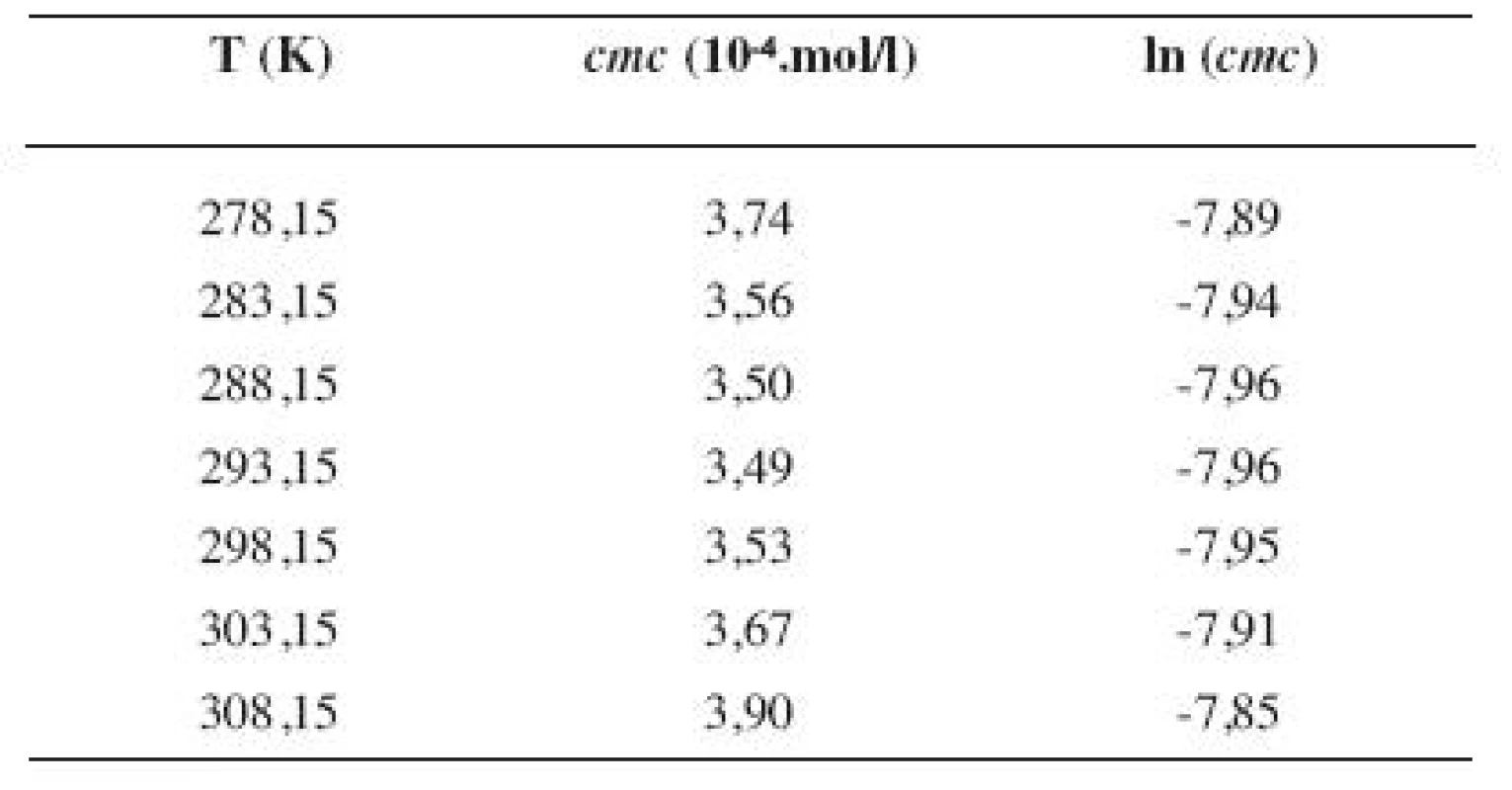
6. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 3 mol/l etanolovom roztoku 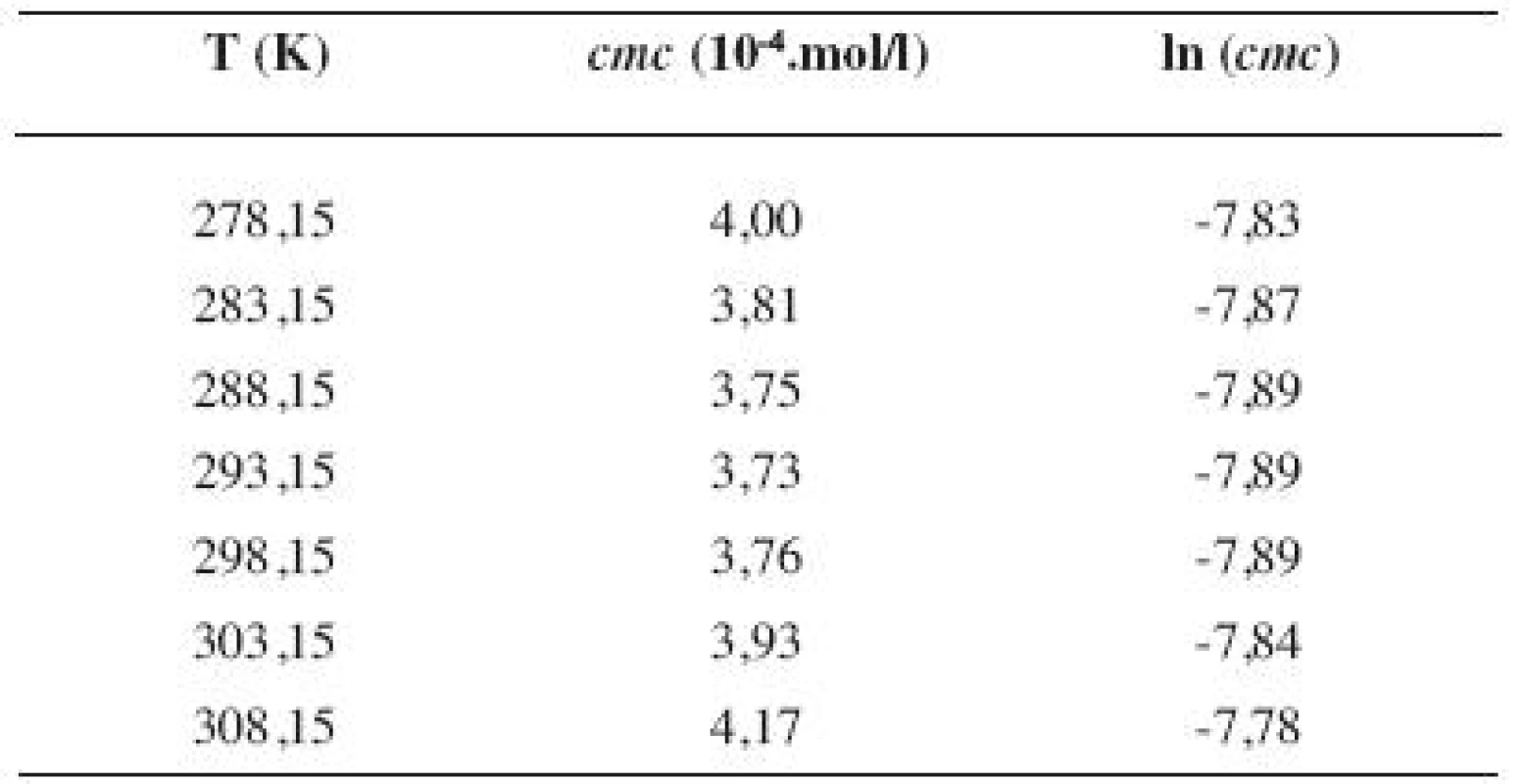
7. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 4 mol/l etanolovom roztoku 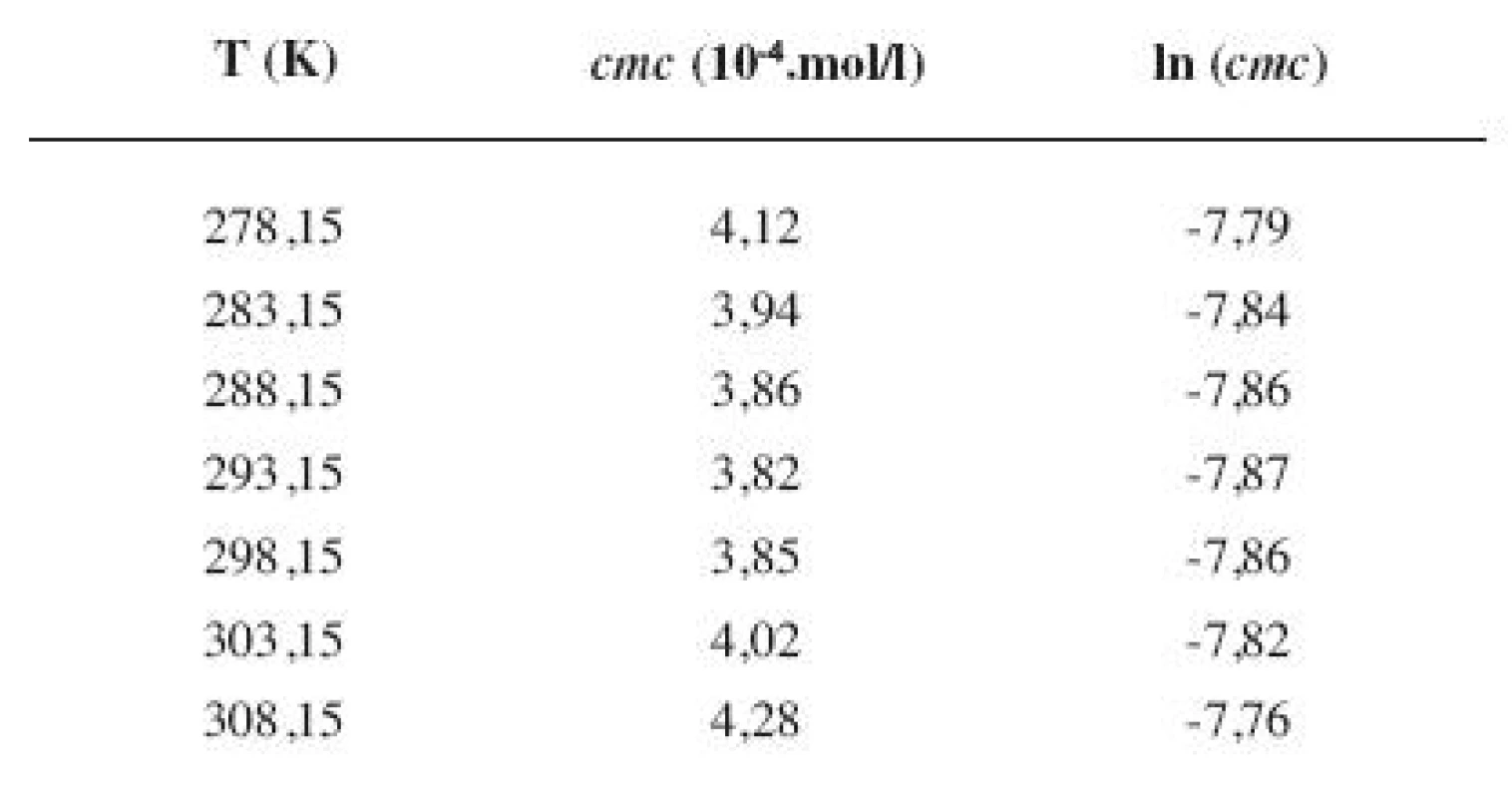
8. Zistené hodnoty <i>cmc</i> a ln (<i>cmc</i>) meranej látky v 5 mol/l etanolovom roztoku 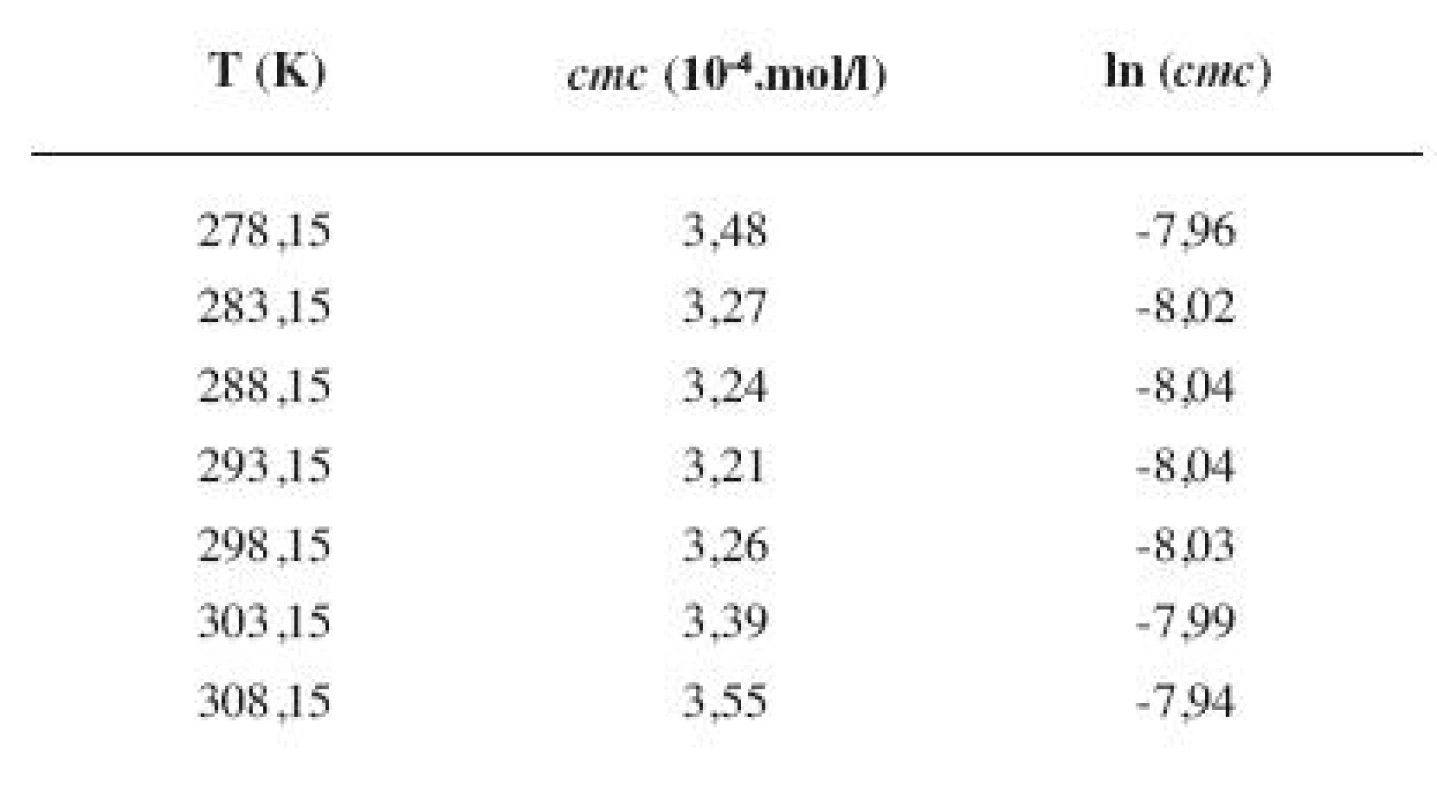
2. Závislosť ln (<i>cmc</i>) od T (K) v 2 mol/l etanolovom roztoku 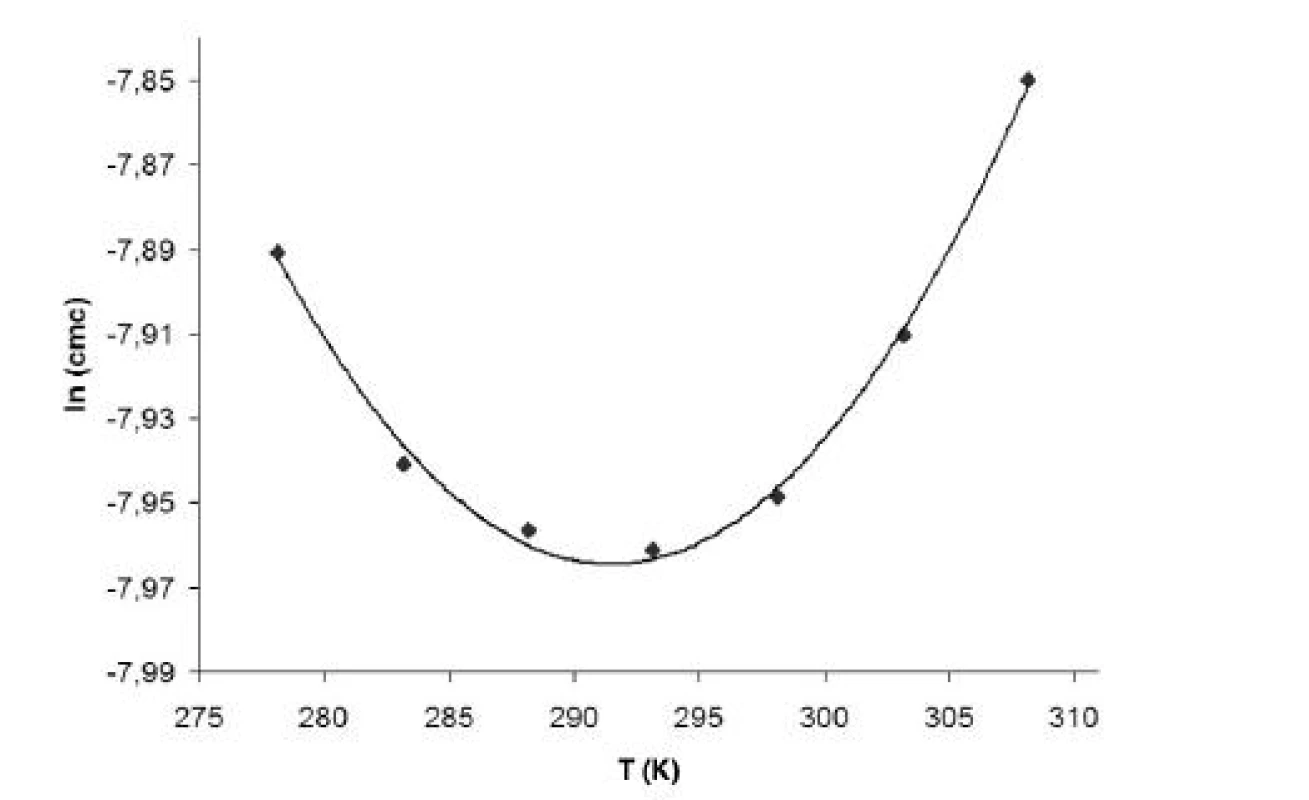
Polynomické rovnice (y = ln (cmc) = A + B.x + C.x2) a koeficienty determinácie (R2) látky pentakaíniumchloridu v 2 mol/l až 5 mol/l metanolovom roztoku boli nasledovné:
y = 25,506 – 0,231 . x + 0,0004 . x2; R2 = 0,909(2 mol/l metanolový roztok)
y = 26,289 – 0,234 . x + 0,0004 . x2; R2 = 0,875(3 mol/l metanolový roztok)
y = 26,683 – 0,238 . x + 0,0004 . x2; R2 = 0,896(4 mol/l metanolový roztok)
y = 18,222 – 0,179 . x + 0,0003 . x2; R2 = 0,952(5 mol/l metanolový roztok)
Polynomické rovnice (y = ln (cmc) = A + B.x + C.x2) a koeficienty determinácie (R2) v 2 mol/l až 5 mol/l etanolovom roztoku boli nasledovné:
y = 26,665 – 0,238 . x + 0,0004 . x2; R2 = 0,994(2 mol/l etanolový roztok)
y = 27,027 – 0,240 . x + 0,0004 . x2; R2 = 0,992(3 mol/l etanolový roztok)
y = 28,273 – 0,248 . x + 0,0004 . x2; R2 = 0,990(4 mol/l etanolový roztok)
y = 25,953 – 0,233 . x + 0,0004 . x2; R2 = 0,976(5 mol/l etanolový roztok)
Hodnoty cmc, resp. ln (cmc) pre metanolové a etanolové roztoky s teplotou klesali po určitú teplotu T* a potom cmc stúpala (tab. 9 a 10). Predpokladáme, že tento postupný pokles cmc je zapríčinený desolvatačným procesom prebiehajúcim na koncovej časti postranného reťazca. V minime cmc (c*cmc) nastal zlom, po ktorom bol pozorovaný nárast cmc, čo je pravdepodobne spôsobené agregáciou uhľovodíkového reťazca a vytvorením miciel6).
9. Hodnoty c*<sub><i>cmc</i></sub> a T* pre pentakaíniumchlorid v jednotlivých metanolových roztokoch 
10. Hodnoty c*<sub><i>cmc</i></sub> a T* pre pentakaíniumchlorid v jednotlivých etanolových roztokoch 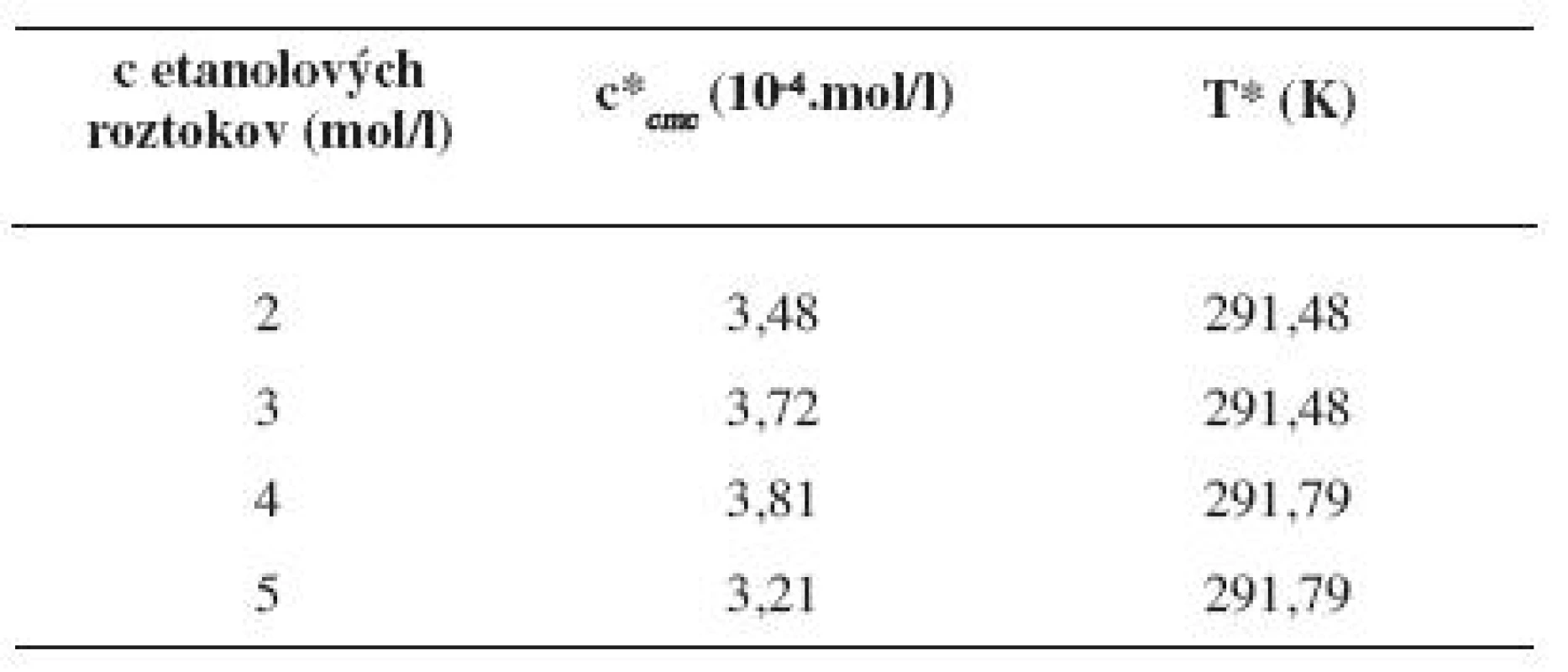
V práci sme sledovali vplyv prídavku jednosýtnych alkoholov – metanolu a etanolu na kritickú micelovú koncentráciu pentakaíniumchloridu. Pri stúpajúcej koncentrácii metanolu či etanolu cmc stúpala (po určitú hodnotu), potom klesala. Pre ilustráciu závislosti kritickej micelovej koncentrácie od koncentrácie metanolových roztokov sme zostrojili graf (obr. 3), ktorý znázorňuje túto závislosť pri teplotách 278,15 K, 283,15 K a 293,15 K. Podobný priebeh závislosti bol pozorovaný aj pri ďalších meraných teplotách. Zároveň uvádzame graf závislosti cmc od koncentrácie etanolových roztokov (obr. 4) pri teplotách 278,15 K, 283,15 K a 293,15 K. Rovnaký priebeh pozorujeme aj pri ďalších teplotách.
3. Závislosť kritickej micelovej koncentrácie od koncentrácie metanolu v roztoku pentakaíniumchloridu pri teplotách 278,15 K, 283,15 K a 293,15 K 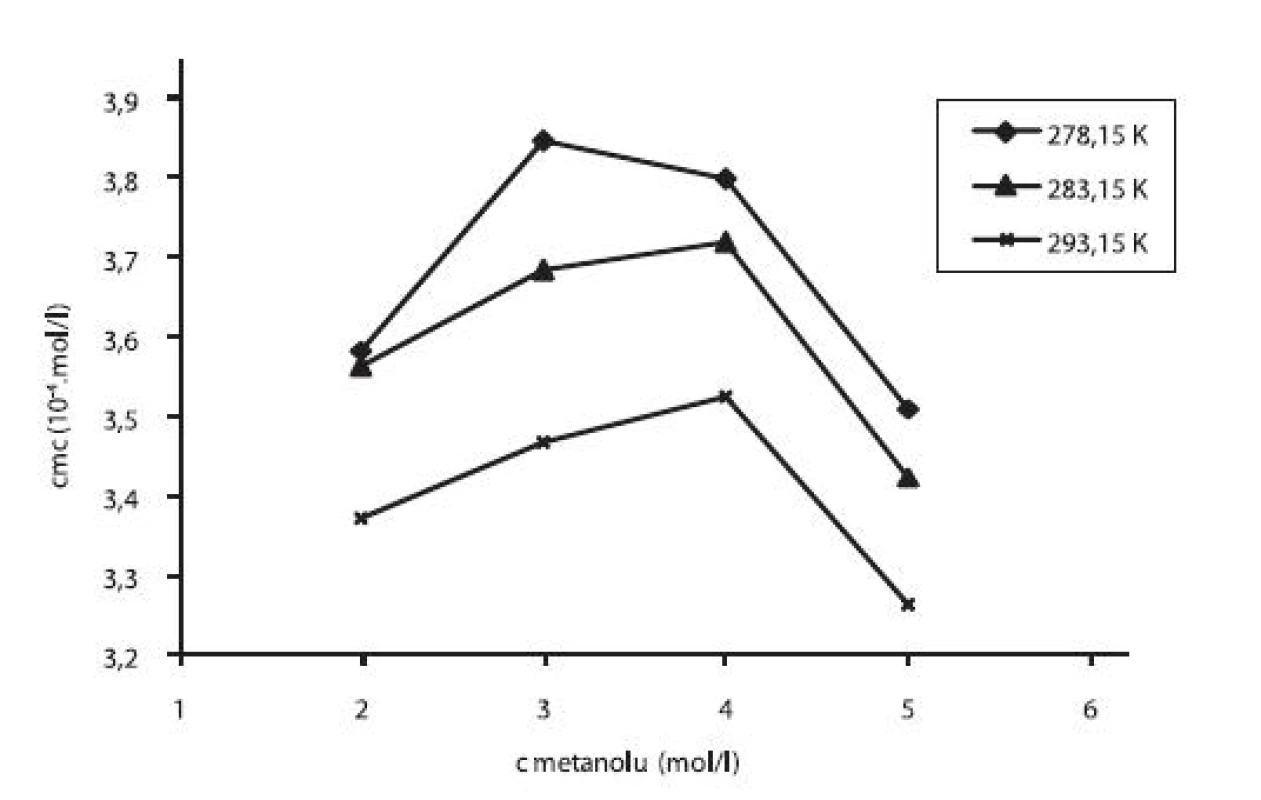
4. Závislosť kritickej micelovej koncentrácie od koncentrácie etanolu v roztoku pentakaíniumchloridu pri teplotách 278,15 K, 283,15 K a 293,15 K 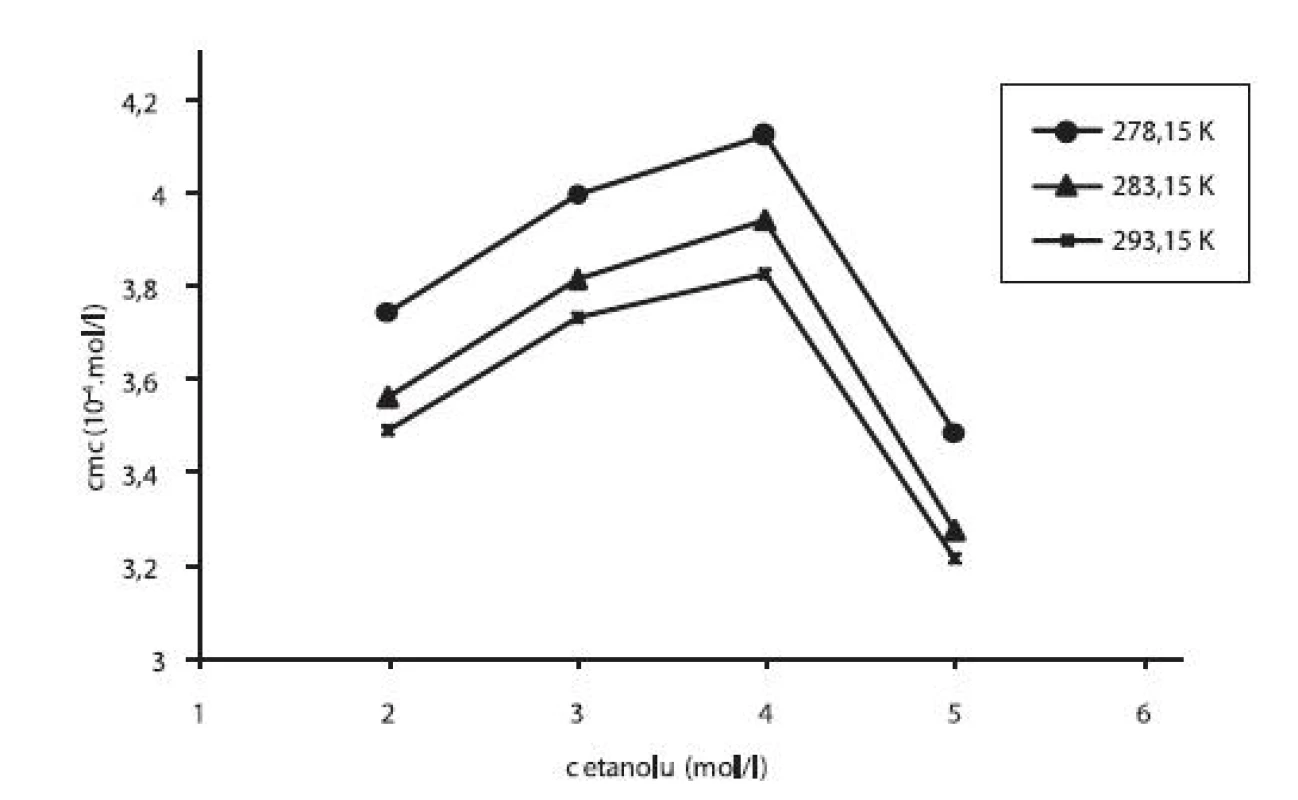
Prídavok alkoholu narúša štruktúru solvatovanej vrstvy micely (solvatovanej vody na povrchu), alebo prednostne solvatuje molekuly rozpustenej látky1–3). Je známe, že alkohol penetruje do palisádovej vrstvy miciel a znižuje cmc surfaktantu. V práci7) sa potvrdilo, že v prítomnosti alkoholu s dlhým reťazcom dochádza k zníženiu cmc. A hoci máme alkohol s krátkym uhlíkovým reťazcom, akým je metanol či etanol, predpokladáme, že pri ich vysokej koncentrácii v roztoku dochádza k penetrácii do micely, čím sa zníži cmc a teda sa podporí schopnosť tvorby miciel. Alebo sa pravdepodobne začnú tvoriť samotné metanolové, resp. etanolové zhluky a dochádza k desolvatácii miciel rozpustenej študovanej látky, teda cmc klesá.
5. Závislosť kritickej micelovej koncentrácie od počtu atómov uhlíka v n-alkanole (n) v roztoku pentakaíniumchloridu pri teplotách 288,15 K, 293,15 K a 303,15 K 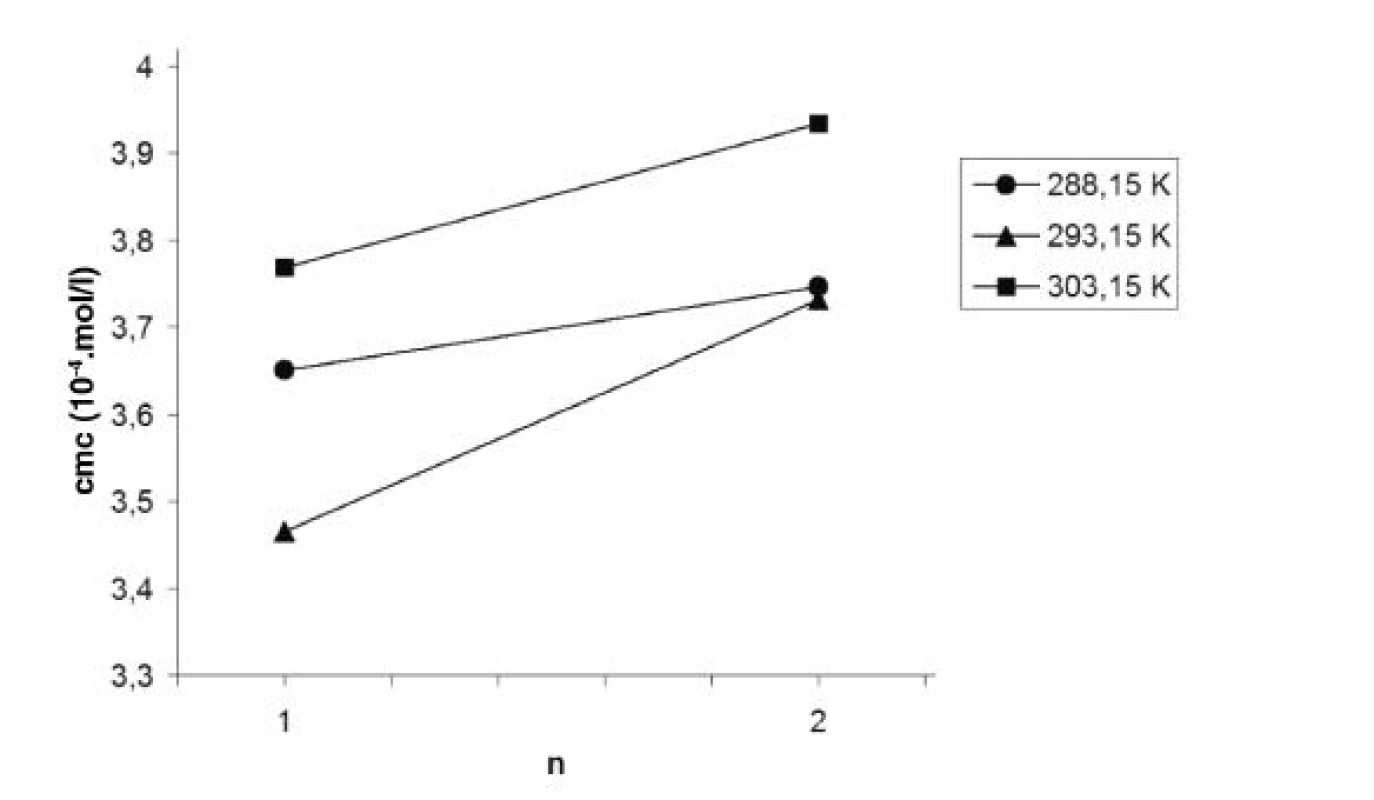
V práci sme ďalej porovnávali hodnoty cmc pentakaíniumchloridu v závislosti od počtu atómov uhlíka v pridanom n-alkanole. Pre ilustráciu uvádzam graf tejto závislosti pri teplotách 288,15 K, 293,15 K a 303,15 K (obr. 5). Z uvedených hodnôt cmc vyplýva, že k formovaniu miciel pentakaíniumchloridu dochádza ľahšie v prostredí metanolu ako v prostredí etanolu. Rovnaký priebeh zaznamenali vo svojich prácach aj Andriamainty a kol.8) a Čižmárik a kol.9).
Adresa pro korespondenci:
PharmDr. Jana Gališinová
Katedra farmaceutickej chémie FaF UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: jana.galisinova@gmail.com
Sources
1. Akhter, M. S.: Effect of solubilization of alcohols on critical micelle concentration of non-aqueous micellar solutions. Colloids and Surfaces 1999; 157, 203–210.
2. Akhter, M. S., Al-Alawi, S. M.: Influence of alcohols on the critical micelle concentration of non–aqueous micellar solutions. Colloids and Surfaces 2000; 164, 247–255.
3. Akhter, M. S., Al-Alawi, S. M.: Micellar behaviour of cetyltrimethylammonium bromide in N-methyl acetamide – alkanol and N,N-dimethyl acetamide – alkanol mixtures. Colloids and Surfaces 2002; 196, 163–174.
4. Chalabala, M. a kol.: Technologie léků. Praha: Galén 1997; 66–261.
5. Beneš, L., Borovanský, A., Kopáčová, L.: Alkoxycarbanilic Acid Esters with High Local Anaesthetic Activity. Arzneim. Forsch. 1969; 19, 1902–1903.
6. Chen, L. J., Lin, S. Y., Huang, C. C.: Effect of Hydrophobic Chain Length of Surfactants on Enthalpy – Entropy Compensation of Micellization. J. Phys. Chem. 1998; 102, 4350–4356.
7. Vlachy, N. a kol.: Influence of additives and cation chain length on the kinetic stability of supersaturated catanionic systems. Colloids and Surfaces 2009; 338, 135–141.
8. Andriamainty, F., Čižmárik, J., Zúdorová, Z., Malík, I., Sedlárová, E.: Influence of alcohols on the critical micelle concentration of heptacainium chloride. Pharmazie 2007; 62, 77–78.
9. Čižmárik, J., Andriamainty, F., Malík, I., Sedlárová, E.: Štúdium micelizácie a termodynamických parametrov heptakaíniumchloridu vo vodnom a alkoholickom prostredí. Farm. Obzor 2007; 56, 133–138.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 6-
All articles in this issue
- Clinical significance of cytochrome P450 genetic polymorphism – part IV. Cytochrome P450 3A4 and 3A5
- Analytical profile of 1-[3-(3-propoxyphenylcarbamoyloxy)-2-hydroxypropyl]-4-(3-tri-fluoromethylphenyl)piperazinium chloride
-
Reakce na článek „Měření viskozity a konzistence dle ČL 2009“
(Čes. slov. Farm., 2011; 60, 241–246) -
Study of local anesthetics – Part 195
Study of micellization of pentacainium chloride in methanol and ethanol solutions -
Medicinal preparations in this country at the end of the 18th century
Part II – Semisolid and solid dosage forms - On the question of special over-the-counter drugs
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- On the question of special over-the-counter drugs
-
Medicinal preparations in this country at the end of the 18th century
Part II – Semisolid and solid dosage forms - Clinical significance of cytochrome P450 genetic polymorphism – part IV. Cytochrome P450 3A4 and 3A5
-
Study of local anesthetics – Part 195
Study of micellization of pentacainium chloride in methanol and ethanol solutions
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

