-
Medical journals
- Career
Antioxidační aktivita tinktur připravených z hlohových plodů a nati srdečníku
: R. Masteiková 1; J. Muselík 1; J. Bernatonienė 2; D. Majienė 2,3; A. Savickas 2; F. Malinauskas 4; R. Bernatonienė 4; R. Pečiūra 2; Z. Chalupová 1; K. Dvořáčková 1
: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 1; Kaunasská univerzita medicíny, Farmaceutická fakulta, Katedra technologie léků a sociální farmacie, Litva 2; Kaunasská univerzita medicíny, Institut biomedicínského výzkumu, Litva 3; Kaunasská univerzita medicíny, Farmaceutická fakulta, Katedra farmaceutické chemie a farmakognozie, Litva 4
: Čes. slov. Farm., 2008; 57, 35-38
: Original Articles
Cílem práce bylo stanovit a porovnat antioxidační aktivitu dvou tinktur a vybraných flavonoidů přítomných v tinkturách. Tinktury byly připraveny z hlohových plodů a nati srdečníku. Skupina vybraných flavonoidů zahrnovala rutin, kvercetin, hyperozid, epikatechin a procyanidin B2. Ke stanovení antioxidační aktivity sloužily dvě metody: Byla měřena inhibice peroxynitritem indukované nitrace tyrosinu a schopnost zhášet radikály byla sledována pomocí stabilního radikálu 2,2-difenyl-1-pikrylhydrazylu (DPPH). Obě zkoumané tinktury byly schopné zhášet radikály a reaktivní formy kyslíku a dusíku. Účinnější byla tinktura z nati srdečníku, avšak neprokázal se přímý vliv fenolických sloučenin na rozsah antioxidační aktivity. Celkový obsah polyfenolů byl v tinktuře z nati srdečníku o 163 % větší, přesto antiperoxynitritová aktivita byla vyšší jen o 19 % (p < 0,05), a schopnost redukce DPPH se u obou tinktur lišila minimálně. Z jednotlivých flavonoidů se nejvíce na antioxidační aktivitě podílely látky, přítomné v tinkturách ve vyšších koncentracích. V tinktuře z hlohových plodů to byly epikatechin a hyperozid, kdežto v tinktuře z nati srdečníku rutin.
Klíčová slova:
Crataegi fructus – Leonuri herba – tinktury – flavonoidy – antioxidační aktivitaÚvod
Mezi faktory, kterým je v současnosti připisován stále větší význam v rozvoji patologických procesů v organismu, patří volné radikály. Tyto částice vznikají jako vedlejší produkty buněčného metabolismu a představují vysoce reaktivní formy kyslíku a dusíku, velmi rychle interferující s vhodnou biologickou strukturou (např. DNA, lipidy či proteiny) 1). Taková reakce pak často vede k dočasnému nebo trvalému poškození biomolekul 2).
Volné radikály hrají klíčovou úlohu při vzniku a rozvoji kardiovaskulárních a nádorových onemocnění, zánětlivých procesů, cukrovky, neurodegenerativních poškození, urychlují rovněž stárnutí organismu 3–7). Protože vznikají jako přirozený produkt buněčného metabolismu, je za normálních okolností každá buňka vybavena specifickými mechanismy, které ji chrání před těmito reaktivními částicemi 1). Takový systém tvoří některé enzymy (superoxiddismutasa, katalasa, glutathionperoxidasa), proteiny a další látky (glutathion, α-tokoferol, kyselina askorbová aj.) 8, 9). Při porušení obranných mechanismů může dlouhodobě docházet k poškozování buněčných struktur.
Účinnou zbraní proti negativnímu působení reaktivních forem kyslíku a dusíku jsou látky s antioxidačním účinkem – antioxidanty, jako jsou vitaminy, enzymy, stopové prvky (Se, Zn, Cu) a látky rostlinného původu 6, 10, 11). Mezi antioxidanty rostlinného původu patří polyfenoly, zejména flavonoidy, které mohou vykazovat celou řadu dalších biologických aktivit, např. antikancerogenní, imunostimulační, antialergické, protizánětlivé, antibakteriální a další 3, 11). Proto některé fytopreparáty současně s hlavním farmakologickým efektem zvyšují ochranu organismu proti následkům oxidačního stresu.
K tradičním léčivým rostlinám ovlivňujícím kardiovaskulární systém se řadí hloh jednosemenný (Crataegus monogyna Jacq.) nebo obecný (Crataegus laevigata (Poir.) Dc.) z čeledi růžovitých (Rosaceae) 12, 13). Jako droga se používá květ (Crataegi flos), list s květem (Crataegi folium cum flore) nebo plod (Crataegi fructus). Z těchto drog se ve světě vyrábí celá řada fytopreparátů, které se uplatňují jako hypotonika, kardiotonika, antisklerotika, sedativa, spazmolytika či diuretika 14). Převážnou část účinných látek v droze tvoří flavonoidy, triterpenové kyseliny, puriny a některé další látky 14–16), u nichž byl v literatuře popsán antioxidační efekt 16, 17).
Mnohem méně prozkoumanou rostlinou, rovněž charakteristickou kardiovaskulárním působením, je srdečník obecný (Leonurus cardiaca L.) z čeledi hluchavkovitých (Lamiaceae), u něhož jako droga slouží nať (Leonuri herba). Přípravky z nati srdečníku mají účinek kardiotonický, hypotonický, sedativní, spazmolytický a diuretický 18). Droga obsahuje glykosidy, flavonoidy, labdanové diterpeny, saponiny, některé organické kyseliny a další látky 19, 20).
Litevské farmaceutické podniky vyrábějí tinktury z hlohových plodů a nati srdečníku, které slouží jako podpůrná léčba ve výše zmíněných indikacích, proto je studium antioxidační aktivity těchto přípravků v současné době aktuální.
Cílem práce bylo stanovení antioxidační aktivity uvedených tinktur a rovněž hodnocení vlivu vybraných obsahových látek na antioxidační aktivitu tinktur.
Pokusná část
Materiál
Hlohové plody (Crataegi fructus) a nať srdečníku (Leonuri herba) poskytla Kaunasská botanická zahrada Univerzity Vytautase Velikého. Drogy splňovaly požadavky Evropského lékopisu. Ze zmíněných drog byly klasickou perkolací připraveny tinktury v poměru 1 : 5, kde jako vyluhovadlo sloužil ethanol 50% (tinktura z hlohových plodů) nebo ethanol 70% (tinktura z nati srdečníku). Látky k přípravě standardů (rutin, kvercetin, hyperozid, epikatechin, procyanidin B2) dodala firma UAB „Grida LAB“ (Litva).
Ke stanovení fenolických sloučenin a antioxidační aktivity byly použity chemikálie: tyrosin (BDH Chemicals, 3-nitrotyrosin (Aldrich), DPPH (Sigma), Folin-Ciocalteuovo činidlo a kyselina galová (Fluka). Další pro experiment potřebné chemikáliebyly běžně komerčně dostupné. Roztok peroxynitritu byl připraven podle metody popsané v literatuře 21).
Metodika
Stanovení flavonoidů HPLC 22)
K těmto účelům sloužil chromatografický systém Waters 2690 (detektor UV Waters 2487, kolona X-terra RP18 3,0 × 150 mm, velikost částic sorbentu 3,5 μm). Složení mobilní fáze bylo 0,1% vodný roztok kyseliny trifluoroctové (A) a 0,1% roztok kyseliny trifluoroctové v acetonitrilu (B). Změny gradientu: od 5 % (B) do 45 % (B) za 45 min. Průtok mobilní fáze byl 0,4 ml/min. Pro chromatografickou analýzu byly vybrány vlnové délky 360 nm a 275 nm. Množství flavonoidů bylo vypočítáno z kalibračních grafů na základě plochy píku.
Stanovení fenolických sloučenin
Celkový obsah fenolů byl stanoven pomocí kolorimetrické metody 23); 700 μl vodou naředěné tinktury bylo oxidováno Folin-Ciocalteuovým činidlem (400 μl) a poté byla reakční směs doplněna do 10,0 ml roztokem uhličitanu sodného (75 g/l). Po 2 hodinách byla suspenze odstředěna (10 min při 5000 ot./min) a změřena výsledná absorbance při 760 nm. Kvantifikace byla provedena na základě kalibrační křivky pro kyselinu galovou. Výsledky byly vyjádřeny jako ekvivalent kyseliny galové (GAE) v mg na 100 ml tinktury.
Ke stanovení antioxidační aktivity sloužily dvě metody. Byla měřena inhibice peroxynitritem indukované nitrace tyrosinu 21, 24) a schopnost zhášet radikály byla sledována pomocí stabilního radikálu 2,2-difenyl-1-pikrylhydrazylu (DPPH) 25, 26). Zjišťovala se antioxidační aktivita samotných tinktur a rovněž antioxidační aktivita vybraných flavonoidů (rutin, kvercetin, hyperozid, epikatechin, procyanidin B2). Koncentrace uvedených sloučenin ve zkoumaných roztocích (standardech) byly totožné s koncentracemi daných látek v tinkturách.
Inhibice nitrace tyrosinu
K měření sloužil kapalinový chromatograf HP 1100 (Agilent Technologies) obsahující kvaternární pumpu, autosampler a detektor s diodovým polem. Analýzy byly prováděny na koloně Supelcosil ABZ+Plus (250 × 4,6 mm, 5 μm) s mobilní fází kyselina mravenčí a acetonitril (90 : 10, v/v) isokraticky při průtoku 1 ml/min. Samotné měření proběhlo následujícím způsobem: roztok 2,0 mM peroxynitritu (8 μl) v 0,05 M NaOH byl nabrán a smíchán v injektoru HPLC s 1,0 mM roztokem tyrosinu a vhodně naředěnou tinkturou či standardem v 0,11 M fosfátovém pufru (42 μl). Reakční směs byla injektována přímo na kolonu HPLC, chromatogramy byly detekovány při 276 nm. Inhibice nitrace tyrosinu byla vypočítána relativně ke zjištěné ploše píku 3–nitrotyrosinu v kontrolním měření.
Redukce DPPH
Odpovídající množství tinktury nebo standardu bylo doplněno do 2,0 ml 0,1 mM DPPH v methanolu a po 5 minutách byla změřena absorbance při 517 nm. Redukce DPPH byla vypočítána relativně k hodnotě absorbance v kontrolním měření.
Výsledky experimentu byly zpracovány statisticky s použitím Studentova testu (p < 0,05).
Výsledky a diskuze
Stanovení celkového obsahu fenolických látek ukázalo, že tinktura z nati srdečníku obsahuje výrazně více těchto sloučenin nežli tinktura z hlohových plodů – 227 mg/100 ml oproti 139 mg /100 ml (tab. 1). HPLC analýza prokázala, že ze zkoumaných látek převažuje v tinktuře z nati srdečníku rutin (54,91 μg/ml) a v tinktuře z hlohových plodů hyperozid (29,32 μg/ml) a epikatechin (44,92 μg/ml).
1. Množství sledovaných látek v tinkturách 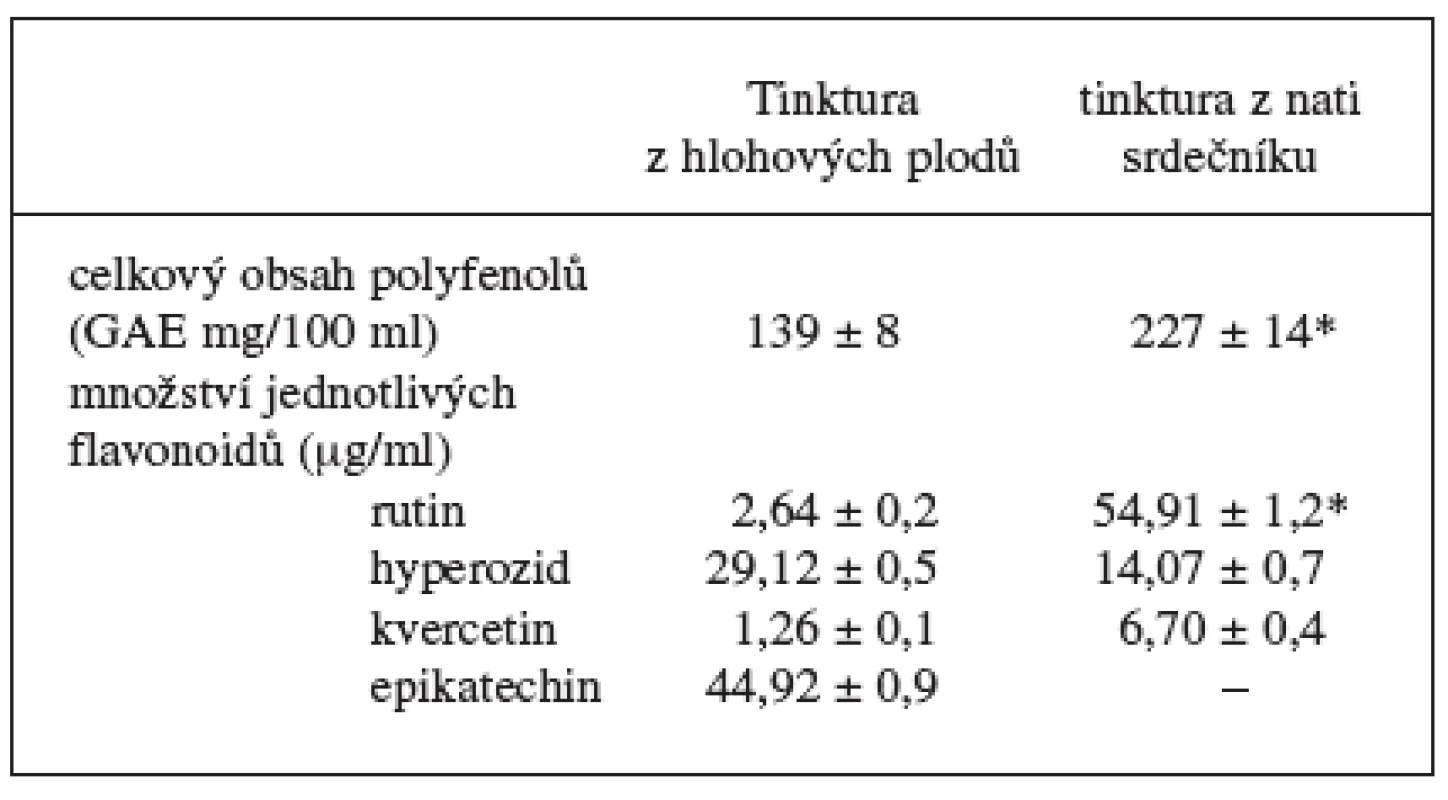
* p < 0,05 ve srovnání s tinkturou z hlohových plodů Obě zkoumané tinktury byly schopné zhášet radikály a reaktivní formy kyslíku a dusíku. Účinnější byla tinktura z nati srdečníku, avšak rozdíl nebyl tak výrazný jako v případě fenolických sloučenin. Celkový obsah polyfenolů byl v tinktuře z nati srdečníku o 163 % větší, přesto antiperoxynitritová aktivita byla vyšší jen o 19 % (p < 0,05), a schopnost redukce DPPH se u obou tinktur lišila minimálně (54,8 % u tinktury z nati srdečníku a 51,7 % u tinktury z hlohových plodů) (obr. 1). V četných literárních zdrojích se uvádí, že se na antioxidační aktivitě rostlinných přípravků významným způsobem podílejí fenolické sloučeniny 3, 27, 28). Vyskytují se však i práce, kde se přímý vliv fenolických sloučenin u některých rostlin nepotvrdil 29). V naší předchozí práci 30) se rovněž zjistilo, že přesto, že množství fenolických sloučenin bylo v tinktuře z jinanu dvoulaločného statisticky významně vyšší, antioxidační aktivita této tinktury byla slabší než tinktur připravených ze zázvorových oddenků či nati třapatky nachové. Lze předpokládat, že i v případě zkoumaných tinktur, zejména tinktury z hlohových plodů, budou antioxidační aktivitu ovlivňovat další účinné látky,nebo že aktivita některých fenolických sloučenin, zjištěných v tinktuře z nati srdečníku,bude prakticky bezvýznamná.
1. Antioxidační aktivita tinktur 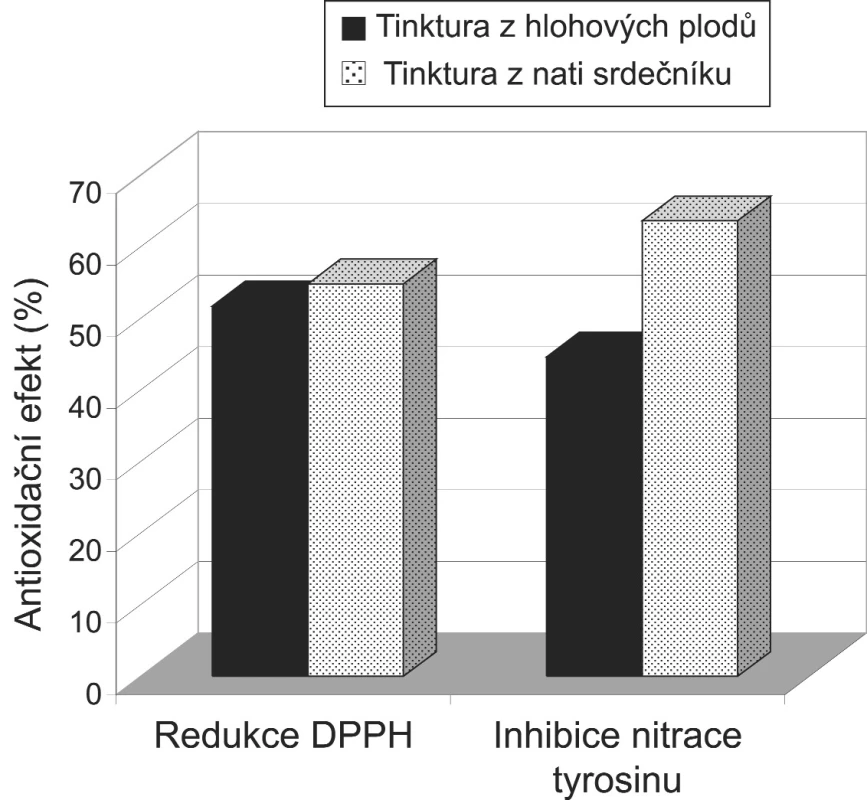
V dalších experimentech bylo naší snahou zjistit, jak se na antioxidační aktivitě podílejí vybrané flavonoidy přítomné ve zkoumaných tinkturách. Výsledky ilustruje obrázek 2. Celkově největší podíl měly látky přítomné v tinkturách ve vyšších koncentracích. V tinktuře z hlohových plodů to byly epikatechin a hyperozid (obr. 2A).Další látky se podílely na antioxidační aktivitě tinktury menší mírou, což odpovídá jejich relativně nízkým koncentracím. Zajímavá však je poměrně výrazná antiperoxynitritová aktivita procyanidinu B2 – byla větší než u rutinu a kvercetinu přítomných v tinktuře ve vyšších koncentracích. Ve vztahu k epikatechinu a hyperozidu byla rovněž, vzhledem ke koncentraci,antiperoxynitritová aktivita vyšší – koncentrace epikatechinu byla v tinktuře 63× a hyperozidu 42× vyšší, kdežto aktivita byla vyšší jen 20 resp. 6,5×. Zjištění, že procyanidin vykazuje větší aktivitu než vybrané flavonoidy,souhlasí s výsledky naší předchozí práce 24) a poznatky některých dalších autorů 31).
V tinktuře z nati srdečníku celkovou antioxidační aktivitu nejvíce ovlivňoval rutin, jehož koncentrace v tinktuře byla rovněž nejvyšší (obr. 2B). Přesto tento vliv nebyl přímo úměrný koncentraci. Koncentrace rutinu byla oproti kvercetinu osminásobná, kdežto antioxidační aktivita jen trojnásobná. Nižší účinnost rutinu byla rovněž prokázána v tinktuře z hlohových plodů, kde při vyšší koncentraci rutinu (2,64 μg/ml oproti 1,26 μg/ml) byla procentuálně vyjádřená antioxidační aktivita kvercetinu větší.
2. Vliv vybraných flavonidů na antioxidační aktivitu tinkur A. Tinktura z hlohových plodů; B. Tinktura z nati srdečníku **p<0,05 ve srovnání s ostatními flavonidy **p<0,05 ve srovnání s procyanidinem B2, quercetinem a rutinem 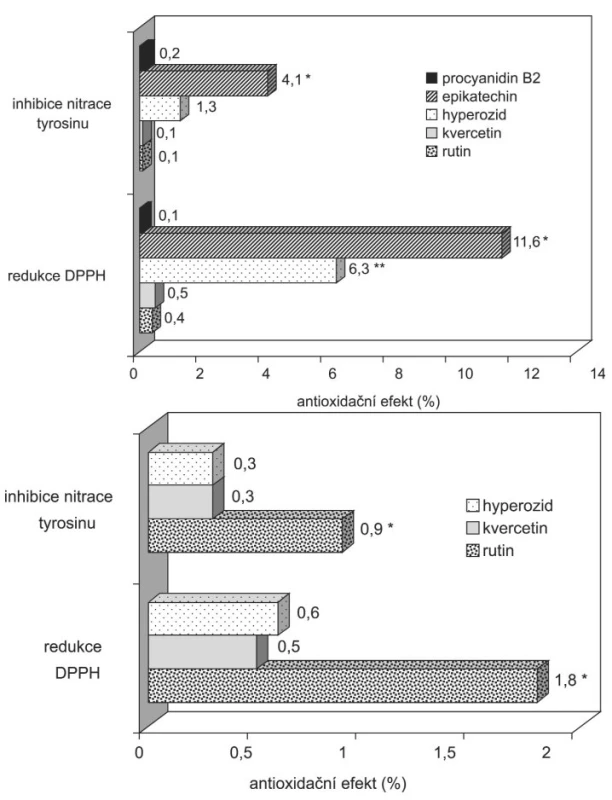
Závěr
V literatuře se vyskytují četné odkazy na pozitivní účinek fenolických sloučenin a vybraných flavonoidů na různé systémy organismu 32, 33). Tyto látky jsou důležité v léčbě a prevenci různých onemocnění včetně kardiovaskulárních. Výsledky naší práce prokázaly, že tinktury z hlohových plodů a nati srdečníku, stejně jako v nich přítomné účinné látky,mají výraznou antioxidační aktivitu, proto užívání těchto tinktur může být prospěšné nejen z hlediska podpůrné léčby kardiovaskulárních onemocnění,ale i ke zmírnění negativních účinků oxidačního stresu.
Došlo: 6. listopadu 2007
Přijato: 26. listopadu 2007
Adresa pro korespondenci:
doc. PharmDr. Ruta Masteiková, CSc.
Ústav technologie léků FaF VFU
Palackého 1/3, 612 42 Brno
e-mail: masteikovar@vfu.cz
Sources
1. Halliwell, B. et al.: Food Chem. Toxicol., 1995; 33(7), 601–617.
2. Citog-lu, G. S. et al.: J. Ethnopharmacol., 2004; 92, 275–280.
3. Cai, Y. et al.: Life Sci., 2004; 74, 2157–2184.
4. El Naggar, E. B. et al.: Acta Vet. Brno, 2005; 74, 347–352.
5. Simone, C. B. et al.: J. Alter. Ther. Health Med., 2007, 13(1), 22–28.
6. Balaraman, R., Bafna, P. A., Kolhapure, S. A.: J. Ethnopharmacol., 2004; 94, 135–141.
7. Vetchý, D., Ceral, J.: Neurologie pro praxi, 2005; 4, 218–220.
8. Pieta, P.-G. J.: Nat. Prod., 2000; 63, 1035–1042.
9. Kolečkář, V. et al.: Čes. slov. Farm., 2007; 56, 73–76.
10. Cornelli, U. et al.: J. Nutr., 2001; 131, 3208–3211.
11. Aguay, D. et al.: Burns, 2005; 31(3), 366–371.
12. Rigelsky, J. M., Sečet, B. V.: Am. J. Health Syst. Pharm., 2002, 59, 417–422.
13. Daniele, C. et al.: Drug safety, 2006, 29(6), 523–535.
14. WHO monograph of selected medicinal plants. Vol. 2. Ženeva, WHO, 2001, s. 66.
15. Vierling, W. et al.: Phytomedicine, 2003; 10, 8–16.
16. Zhang, Z. Z. et al.: J. Nutr. Biochem., 2001; 12, 144–152.
17. Yoo, K. M. et al.: Food Chem., 2008, 106, 929–936.
18. Milkowska-Leyck, K., Filipek, B., Strzelecka, H. J.: Ethnopharmacol., 2002; 80, 85–90.
19. Ali, M. S. et al.: Phytother. Res., 2007; 21, 558–561.
20. Matkowski, A., Piotrowska, M.: Fitoterapia, 2006, 77, 346–353.
21. Muselík, J., Hytych, P., Žemlička, M.: Čes. slov. Farm., 2005; 54, 114–117.
22. Merken, H. M., Beecher, G. R.: J. Agric. Food Chem., 2000; 48, 577–599.
23. Middleton, E., Kandaswami, C.: Biochem.Pharmacol., 1992; 43(6), 1167–1179.
24. Muselík, J. et al.: Int. J. Mol. Sci., 2007; 8, 797–809.
25. Lee, J. Y., Hwang, W.-I., Lim, S.-T.: J. Ethnopharmacol., 2004; 93, 409–415.
26. Huang, A., Ou, B., Prior, R. L.: J. Agric. Food Chem., 2005; 53, 1841–1856.
27. Pellati, F. et al.: J. Pharm. Biomed. Anal., 2004; 35, 289–301.
28. Fenglin, H. et al.: Fitoterapia, 2004; 75, 14–23.
29. Bozan, B., Karakaplan, U.: Acta Aliment., 2007; 36 (3), 321–328.
30. Masteiková, R. et al.: Medicina, 2007; 43(4), 306–309.
31. Soobrattee, M. A. et al.: Mutation Res., 2005; 579, 200–213.
32. Havsteen, B. H.: Pharmacol. Ther., 2002; 96(2–3), 67–202.
33. Lee, K. W., Lee, H. J.: Biofactors, 2006; 26(2), 105–121.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 1-
All articles in this issue
- Antioxidant activity of tinctures prepared from hawthorn fruits and motherwort herb
- Signal pathways of cell proliferation and death as targets of potential chemotherapeutics
- Hemostatic effects of oxidized cellulose
- Substances Modifying the Activity of Caspases
- Effects of auxins on growth and scopoletin accumulation in cell suspension cultures of Angelica archangelica L.
- A study of the properties of tablets made of directly compressible maltose
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Signal pathways of cell proliferation and death as targets of potential chemotherapeutics
- Hemostatic effects of oxidized cellulose
- Substances Modifying the Activity of Caspases
- Antioxidant activity of tinctures prepared from hawthorn fruits and motherwort herb
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

