-
Medical journals
- Career
NESKORÉ CHOROIDÁLNE NEOVASKULÁRNE KOMPLIKÁCIE U PACIENTA LIEČENÉHO NA RETINOBLASTÓM. KAZUISTIKA
Authors: V. Popová 1; D. Tomčíková 1; B. Bušányová 1; K. Hodálová 1; D. Havalda 2; A. Gerinec 1
Authors‘ workplace: Klinika detskej oftalmológie Národného ústavu detských chorôb a Lekárskej fakulty Univerzity Komenského v Bratislave 1; Očné oddelenie Nemocnice sv. Michala v Bratislave 2
Published in: Čes. a slov. Oftal., 78, 2022, No. 6, p. 320-324
Category: Case Report
doi: https://doi.org/10.31348/2022/32Overview
Cieľ: Kazuistika záchytu choroidálnej neovaskularizácie (CNV) u pacienta v ranom detstve liečeného pre obojstranný retinoblastóm.
Materiál a metodika: Pacient v 1,5 roku života liečený na endofytický retinoblastóm 4. štádia (podľa Reese-Ellsworthovej klasifikácie) obojstranne, s pozitívnou mutáciou v Rb1 géne. Po 3-násobnom absolvovaní obojstranného laserového ošetrenia sietnice a 6-tich cykloch systémovej chemoterapie zostal tumor bez aktivity a iných komplikácii. V 14-tich rokoch sa u chlapca objavilo zhoršenie videnia na ľavom oku s prítomnými metamorfopsiami. Na základe lokálneho nálezu a ďalších pomocných vyšetrení mu bola diagnostikovaná CNV v makulárnej oblasti na rozhraní jazvy po tumore a zdravej sietnice ľavého oka.
Výsledky: Po troch podaniach anti-VEGF(antibodies blocking vascular endothelial growth factor) preparátu intravitreálne (bevacizumab 1,2 mg) došlo k redukcii CNV a tiež k zlepšeniu zrakových funkcii.
Záver: Vitreoretinálne komplikácie po liečbe retinoblastómu nie sú časté, avšak môžu sa vyskytnúť ako dôsledok lokálnej a celkovej liečby tumoru. U nášho pacienta sa jednalo o raritnú komplikáciu so vznikom CNV v dlhšom časovom odstupe od liečby s dobrou reakciou na intravitreálne podanie anti-VEGF preparátu.
Klíčová slova:
komplikácie – retinoblastom – neovaskularizácia
ÚVOD
Retinoblastóm je najčastejší malígny vnútroočný nádor u detí ktorý je zodpovedný za 1 % detských úmrtí a 5 % detskej slepoty [1]. Incidencia tumoru sa pohybuje od 15 000 do 18 000 živonarodených detí [2]. Pochádza z embryonálnych retinoblastov a takmer úplná väčšina prípadov sa manifestuje do 5 rokov života. Najčastejšie sa klinicky prejaví leukóriou v 56 % alebo strabizmom v 20 %. Poznáme nededičnú a dedičnú formu v pomere cca 3 : 1. Dedičný výskyt je u všetkých bilaterálnych nálezov a cca u 15 % jednostranných pacientov, kým výlučne jednostranná je etiológia u nededičných retinoblastómov [1].
V rámci diferenciálnej diagnostiky môžeme zvažovať perzistujúci primárny sklovec (PHPV), morbus Coats, očnú formu toxokarózy, retinopatiu nedonosených [3] alebo iné lézie simulujúce retinoblastóm popri rôznych typoch odlúčenia sietnice [4,5]. Klinicky sa prejavuje v troch rôznych formách a to forma endofytická, kedy rastie z vnútornej jadrovej vrstvy šíri sa priamo do sklovca, ďalej je to forma exofytická, kedy tumor rastie z vonkajšej nukleárnej vrstvy a šíri sa subretinálne a difúzna forma, kedy tumor plošne postihuje celú sietnicu [1]. V šesťdesiatych rokoch minulého storočia bola zavedená tzv. Reese-Ellsworthova klasifikácia ako pomôcka na stanovenie zachovania oka pri externej rádioterapii, ktorá má 5 štádií [6]. So zavedením celkovej chemoterapie v liečbe retinoblastómu bola prijatá tzv. International Intraocular Retinoblastoma Classification (IIRC). Schéma IIRC rozdeľuje nádory od A po E v závislosti od ich veľkosti, umiestnenia a ďalších znakov, vrátane prítomnosti rozsevu retinoblastómu v sklovci alebo odlúpenia sietnice [7].
Cieľom liečby je vyliečenie ochorenia, ale aj zachovanie zraku. K výberu liečebného postupu sa pristupuje individuálne vzhľadom na klinické aspekty akými sú vek pacienta v čase manifestácie, veľkosť, lokalizácia, staging tumoru, uni - alebo bilateralita a dedičnosť (mutácia v Rb1 géne). Vďaka celkovej chemoterapii (vinkristín, etopozid, karboplatin), trans - sklerálnej brachyterapii, laserovej fotokoakulácii, kryoterapii, termoterapii a intravitrálnej chemoterapii sa väčšine pacientov podarí trvalo vyliečiť. K enukleácii pristupujeme v ťažších prípadoch kedy už nie je šanca na záchranu zraku, je prítomný neovaskulárny glaukóm, intravitreálna disseminácia resp. nekontrolovaný rast tumoru. Externá rádioterapia sa v súčasnosti v liečbe retinoblastómu používa menej [2].
Komplikáciou rádioterapie sú sekundárne malignity, kraniofaciálne abnormality, katarakta, radiačná neuropatia a retinopatia, glaukóm, nekróza skléry [8]. Systémová chemoterapia používaná pri retinoblastóme bola spojená s nežiaducimi účinkami, ako je myelosupresia, následné infekcie a potreba krvnej transfúzie [9]. Vitreoretinálne komplikácie nie sú časté, objavili sa u 6,8 % pacientov liečených na retinoblastóm. Častejšie vznikajú pri kombinácii terapie systémovej alebo regionálnej s rôznymi lokálnymi spôsobmi ošetrenia. Túto skupinu tvoria sietnicové trhliny, regmatogénna a trakčná amócia sietnice, pre - a subretinálna fibróza, sklovcové trakčné pruhy a pseudo-sklovcový rozsev [10].
KAZUISTIKA
14 ročný chlapec, v detstve liečený na endofytický retinoblastóm 4. štádia (podľa Reese-Ellsworthovej klasifikácie) obojstranne bol v auguste 2019 odoslaný na Kliniku detskej oftalmológie Národného ústavu detských chorôb v Bratislave pre akútne zhoršenie zraku na ľavom oku s prítomnými metamorfopsiami. Vo veku 16 mesiacov (marec 2006) mu bol diagnostikovaný retinoblastóm bilaterálne s pozitívnou mutáciou v Rb1 géne. Absolvoval 6 cyklov celkovej chemoterapie (vinkristín, etopozid, karboplatina) a trikrát podstúpil v celkovej anestézii lokálne ošetrenie s diodovým laserom na oboch očiach. V decembri 2006 bol nález na sietnici bez aktivity tumoru a pacient bol ďalej sledovaný na rajóne bez komplikácii až do augusta 2019.
V auguste 2019 bola najlepšia korigovaná zraková ostrosť (NKZO) na pravom oku 5/30 a na ľavom oku 5/15. V lokálnom fundoskopickom náleze dominovali na oboch očiach po zhojených tumoroch početné jazvy a koraliformné depozity, vpravo prechádzal vertikálne stredom makuly fibrózny pruh (Obrázok 1) a vľavo na okraji jazvy susediacej s makulou nasadala choroidálna neovaskulárna membrána (CNV) veľkosti 1/3 x 1 PD (Obrázok 2), ktorú sme potvrdili aj pomocou OCT (optická koherentná tomografia). Realizovali sme aj fluoroangiografické vyšetrenie (FAG) kde vľavo v mieste CNV sme zaznamenali presakovanie v neskorších fázach (Obrázok 3). Následne sme sa do ľavého oka rozhodli aplikovať intravitreálne blokátor vaskulárneho endoteliálneho rastového faktoru bevacizumab 1,2 mg dvakrát v mesačnom odstupe. Už po prvej aplikácii sa pacientovi zlepšila NKZO na ľavom oku na 5/7,5. Pacient sa na ďalšiu plánovanú kontrolu dostavil oneskorene až o 6 mesiacov, v máji 2020, z dôvodu začínajúcej pandémie COVID-19, kedy NKZO na ľavom oku bola nezmenená. Realizovalo sa kontrolné FAG vyšetrenie, kde pretrvávalo diskrétne presakovanie v mieste CNV a toho času už bolo možné realizovať na našej klinike aj OCT-angiografiu (Obrázok 4), následne bol do ľavého oka tretíkrát podaný bevacizumab 1,2 mg intravitreálne. Kontrolné FAG vyšetrenia v auguste a v decembri 2020 boli bez známok aktivity CNV (Obrázok 5) a NKZO ľavého oka zostala nezmenená 5/7,5. Pacient ostáva v našom sledovaní.
Image 1. Fundoskopický nález na pravom oku. Početné jazvy a koraliformné depozity po zhojených tumoroch a fibrotický prúžok prechádzajúci cez makulárnu oblasť (2019) 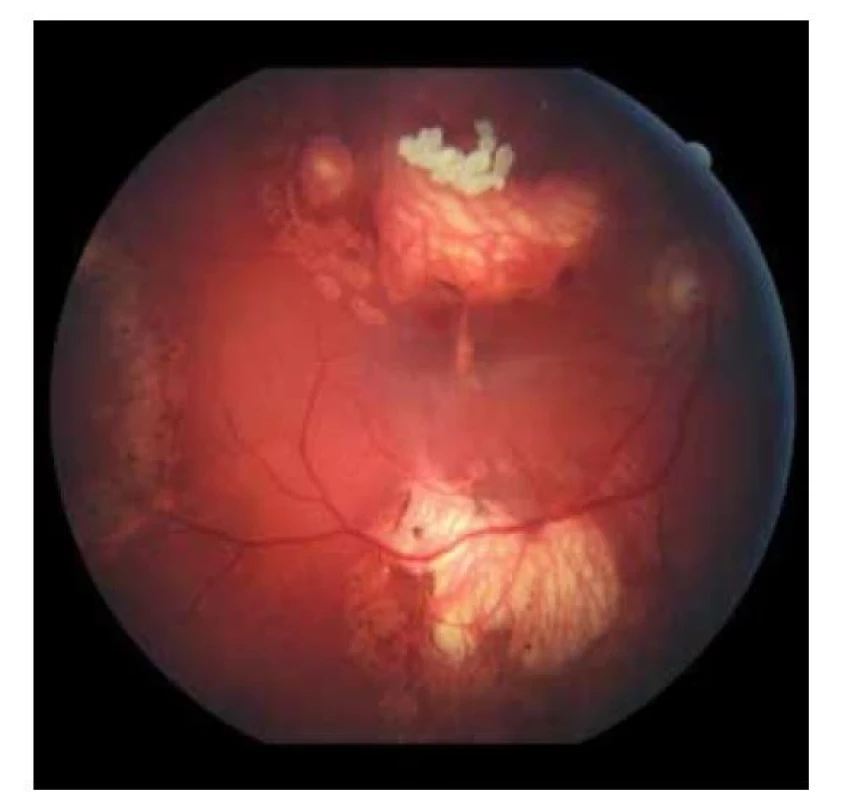
Image 2. Fundoskopický nález na ľavom oku. Na okraji jazvy v makule nasadajúca subretinálna neovaskularizácia (2019) 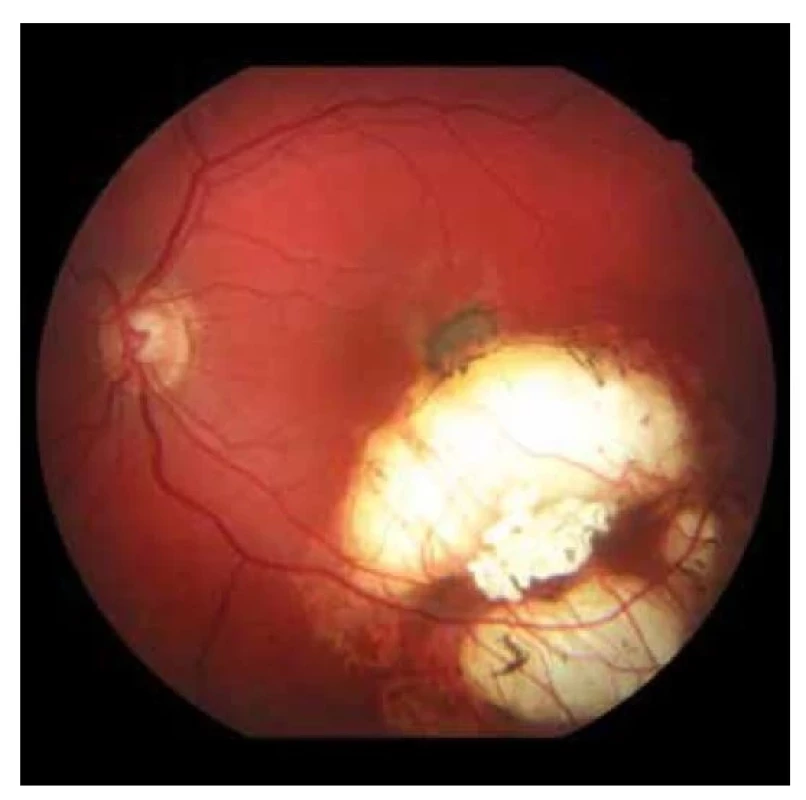
Image 3. Fluoroangiografické vyšetrenie ľavého oka, skorá a neskorá fáza s presakovaním v mieste CNV (2019) 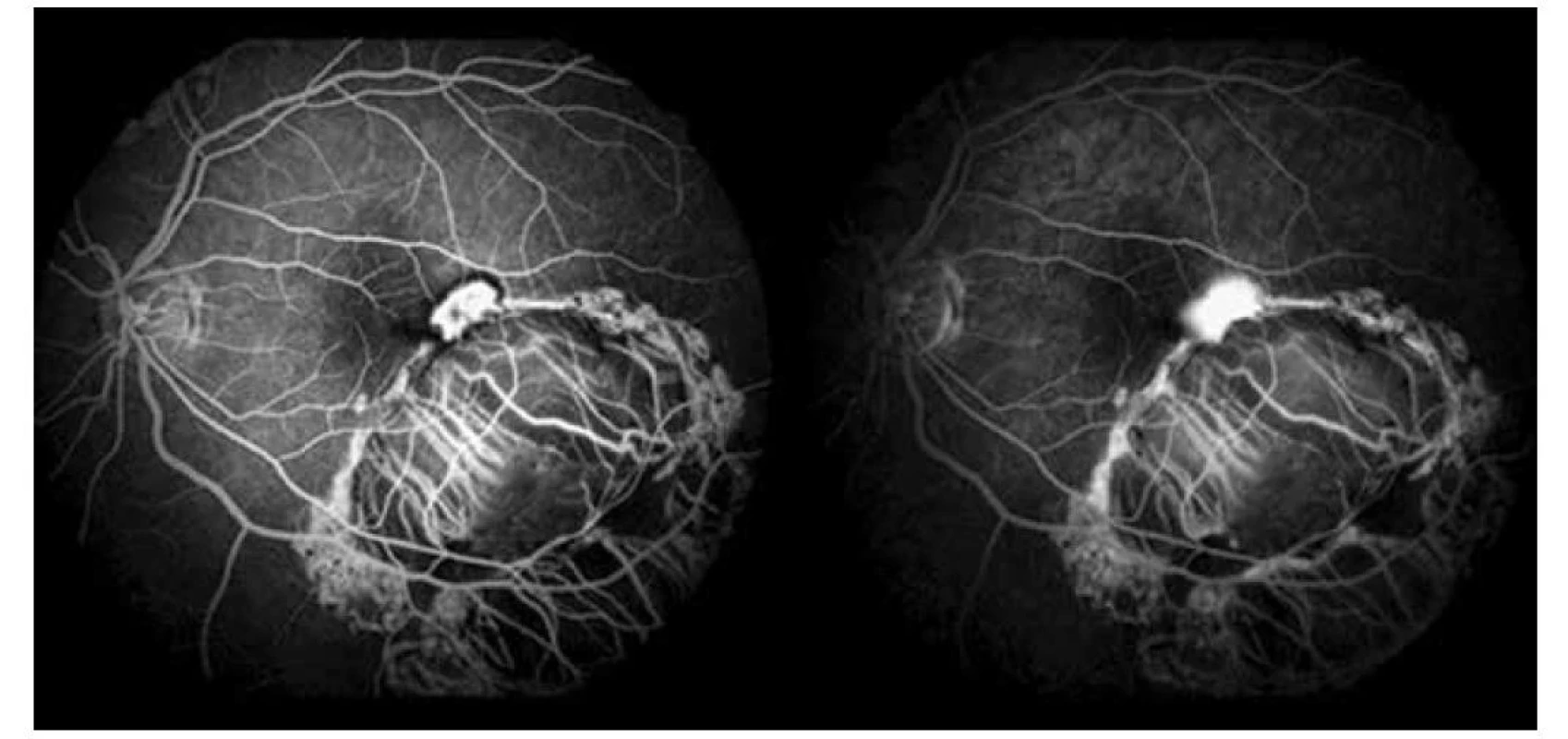
Image 4. OCT – angiografia s neovaskulárnou membránou na okraji makuly (2020) 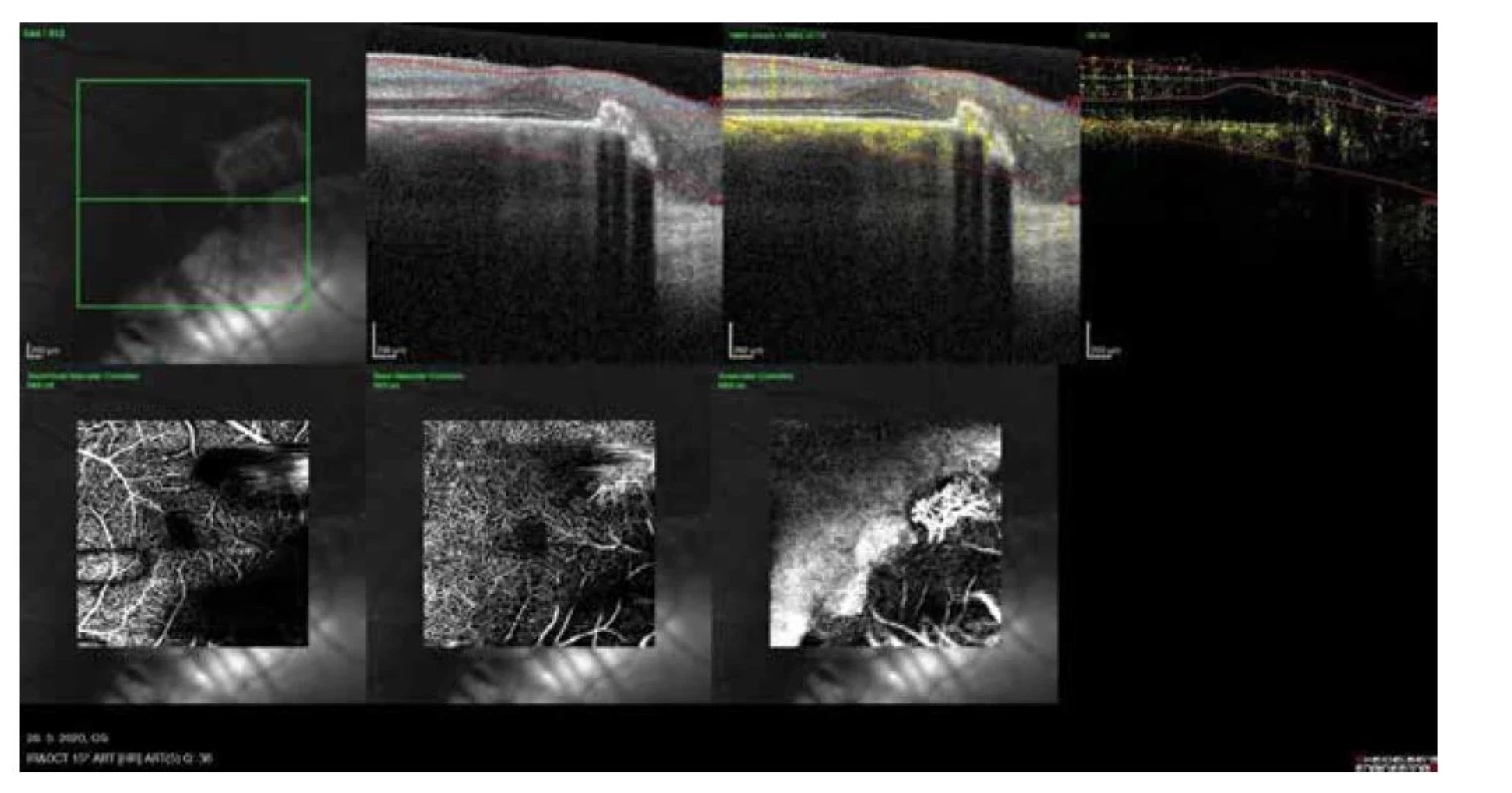
Image 5. Kontrolné fluoroangiografické vyšetrenie a fotografia očného pozadia (2020) 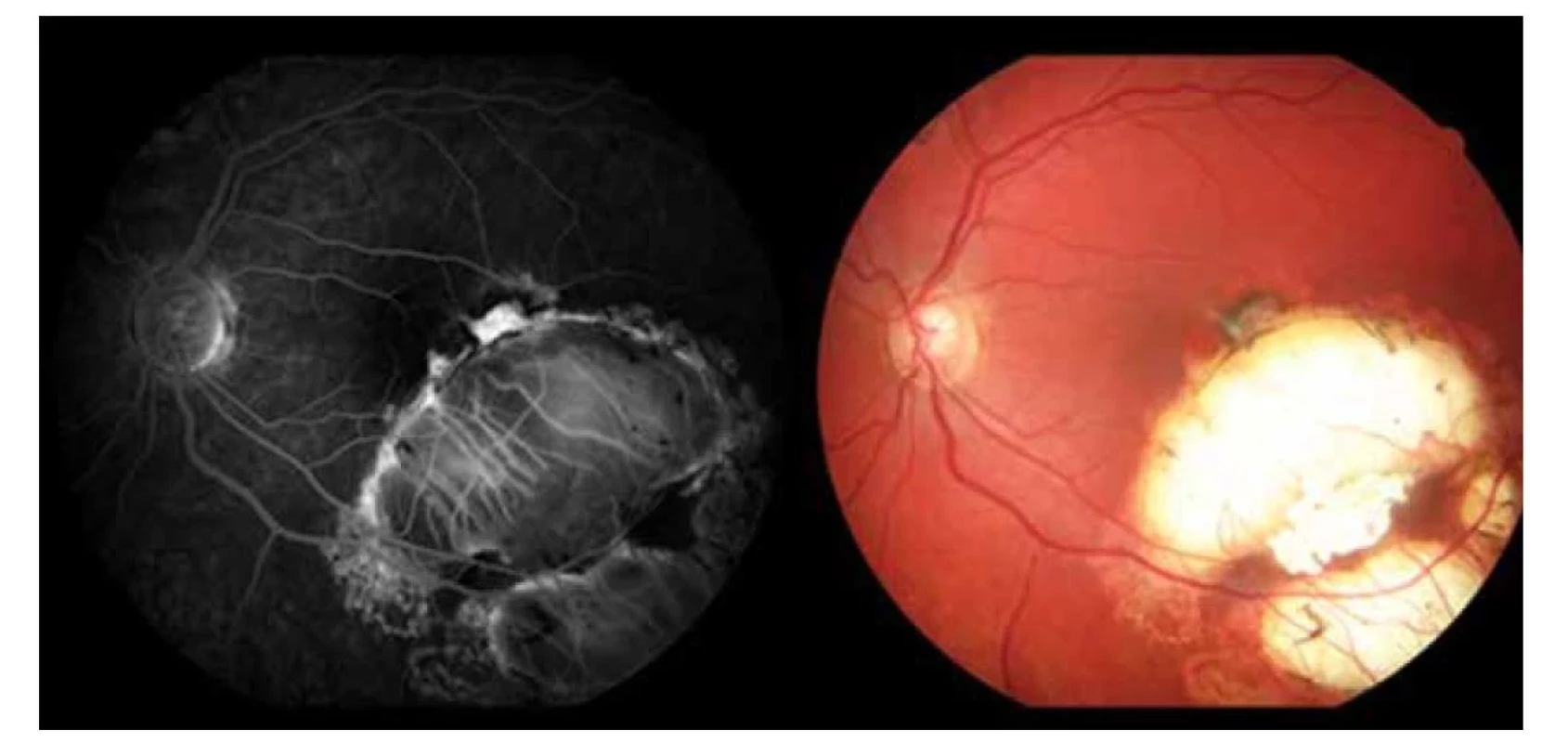
DISKUSIA
Vitreoretinálne komplikácie po liečbe retinoblastómu nie sú časté, avšak môžu sa vyskytnúť ako dôsledok lokálnej a celkovej liečby tumoru. Patria sem hemorágie (vitreálne, retinálne aj choroidálne), retinálne vaskulárne oklúzie, preretinálne a subretinálne fibrovaskulárne proliferácie, retinálne trhliny a záhyby ako aj regmatogénna a trakčná amócia sietnice [10].
Choroidálna neovaskularizácia (CNV) je u detí a dospievajúcich pomerne zriedkavá. Väčšinou je spôsobená inou etiológiou ako infekciou alebo zápalom, pri anomáliach terča zrakového nervu, sietnicových dystrofiách, vysokej myopii, choroidálnych tumoroch a traume. Často sa príčina nenájde a sú označené ako idiopatické. Hoci je prevalencia slepoty spôsobenej CNV u detí nižšia ako u dospelých, následky slepoty sú u nich ťažšie. Liečba CNV zahŕňa fotodynamickú terapiu (PDT), aplikáciu anti-VEGF resp. submakulárnu membranektómiu [11].
So zvyšujúcim sa trendom používania anti-VEGF aj u mladších pacientov, stále ostáva otázna bezpečnosť a dlhodobé výsledky tejto terapie u detí a dospievajúcich. VEGF (vascular endothelial growth factor) má dôležitú úlohu pri normálnej angiogenéze, regulácii priepustnosti ciev a pri udržiavaní hematoencefalickej a hematoretinálnej bariéry. Dlhodobé účinky inhibície týchto funkcií, použitím anti-VEGF látok u detí je preto naďalej nutné sledovať aby sme sa mohli spoľahnúť, že ich použitie je úplne bezpečné. Zdá sa, že na stabilizáciu CNV u detí je potrebných menej injekcií anti-VEGF látok v porovnaní s dospelými. Dôvodom môže byť lepší funkčný stav retinálneho pigmentového epitelu (RPE) u mladších jedincov ako u starších. Menej aplikovaných injekcií môže potenciálne znížiť riziko nežiaducich účinkov anti-VEGF látok u mladších pacientov [12]. Ako uvádza Avery et al., použitie ranibizumabu namiesto bevacizumabu u detí, môže znížiť systémovú expozíciu vzhľadom na jeho oveľa kratší sérový polčas, ako sa zistilo v niekoľkých štúdiách na zvieratách [13]. V pediatrickej populácii možno zvážiť PDT s verteporfínom. Viaceré kazuistiky naznačujú, že detskí pacienti vyžadujú menej opakovaných terapií v porovnaní s dospelými pacientmi na stabilizáciu CNV a dosiahnutie zlepšenia zrakovej ostrosti. Môžu však nastať atrofické zmeny v RPE [14,15].
U nášho pacienta sa pravdepodobne jednalo o vznik CNV pri porušení Bruchovej membrány v rámci hojacich a liečebných procesov sietnicového tumoru. Vzhľadom na blízku lokalizáciu k fovey sme u nášho pacienta nepredpokladali iatrogénne porušenie Bruchovej membrány laserom, ktorý bol použitý pri lokálnom ošetrení. Avšak Laovirojjanakul, W. et al. popisujú takúto možnú etiológiu najmä ak sa jedná o ošetrenie do vzdialenosti 0,5 PD (papilárneho diametra) od fovey resp. pri silnejších alebo opakovaných zásahoch [16]. U nášho pacienta bol na liečbu použitý intravitreálne aplikovaný bevacizumab 1,2 mg trikrát, bez pozorovaných nežiadúcich účinkov s dobrým terapeutickým efektom.
ZÁVER
U pacientov v detstve liečených na retinoblastóm, sú aj vo vyššom veku prítomné mnohé riziká, či už v zmysle sekundárnych malignít alebo iných očných komplikácii. V našom prípade sa jednalo o raritnú komplikáciu so vznikom CNV v dlhšom časovom odstupe od liečby s dobrou reakciou na intravitreálnu liečbu s anti-VEGF.
Autori práce prehlasujú, že vznik aj téma odborného oznámenia a jeho zverejnenia nie je v strete záujmov a nie je podporené žiadnou farmaceutickou firmou. Ďalej autori prehlasujú, že práca nebola zadaná inému časopisu ani inde vytlačená, s výnimkou kongresových abstraktov a odporúčaných postupov.
Do redakce doručeno dne: 21. 9. 2022
Přijato k publikaci dne: 15. 10. 2022
MUDr. Veronika Popová
Klinika detskej oftalmológie
Národného ústavu detských
chorôb a LF UK v Bratislave
Limbová 1
833 40 Bratislava
E-mail: veronika.labuzova@gmail.com
Sources
1. Gerinec A. Detská oftalmológia.1st ed. Martin: Osveta; 2005. 592.
2. Pandey AN. Retinoblastoma: An overview. Saudi J Ophthalmol. 2014;28(4):310-315.
3. Balmer A, Munier F. Differential diagnosis of leukocoria and strabismus, first presenting signs of retinoblastoma. Clin Ophthalmol. 2007;1(4):431-439.
4. Shields CL, Schoenberg E, Kocher K, Shukla SY, Kaliki S, Shields JA. Lesions simulating retinoblastoma (pseudoretinoblastoma) in 604 cases: results based on age at presentation. Ophthalmology. 2013;120(2):311-316.
5. Popov I, Popova V, Krasnik V. Comparing the Results of Vitrectomy and Sclerectomy in a Patient with Nanophthalmic Uveal Effusion Syndrome. Medicina. 2021;57(2):120.
6. Fabian ID, Reddy A, Sagoo MS. Classification and staging of retinoblastoma. Community Eye Health. 2018;31(101):11-13.
7. Murphree AL. Intraocular retinoblastoma: the case for a new group classification. Ophthalmol Clin North Am. 2005;18(1):41 - 53.
8. Shields CL, Shields JA, Cater J, Othmane I, Singh AD, Micaily B. Plaque radiotherapy for retinoblastoma: long-term tumor control and treatment complications in 208 tumors. Ophthalmology. 2001;108(11):2116-2121.
9. Benz MS, Scott IU, Murray TG, Kramer D, Toledano S. Complications of Systemic Chemotherapy as Treatment of Retinoblastoma. Archives of Ophthalmology. 2000;118(4):572-575.
10. Tawansy KA, Samuel MA, Shammas M, Murphree AL.Vitreoretinal complications of retinoblastoma treatment. Retina. 2006;26(7):47-52.
11. Özdek Ş, Atalay HT. Chhablani J. (eds) Choroidal Neovascularization. 1st ed. Singapore (Singapore): Springer; 2020. Choroidal Neovascularization in Pediatric Population p. 203-215.
12. Kohly RP, Muni RH, Kertes PJ, Lam WC. Management of pediatric choroidal neovascular membranes with intravitreal anti-VEGF agents: a retrospective consecutive case series. Can J Ophthalmol. 2011Feb;46(1):46-50.
13. Avery RL. Extrapolating anti-vascular endothelial growth factor therapy into pediatric ophthalmology: promise and concern. J aapos. 2009;13(4):329-331.
14. Mimouni KF, Bressler SB, Bressler NM. Photodynamic therapy with verteporfin for subfoveal choroidal neovascularization in children. Am J Ophthalmol. 2003;135(6):900-902.
15. Rishi P, Gupta A, Rishi E, Shah BJ. Choroidal neovascularization in 36 eyes of children and adolescents. Eye (Lond). 2013; 27(10):1158-1168.
16. Laovirojjanakul W, Sanguansak T, Yospaiboon Y, Sinawat S, Sinawat S. Laser-Induced Choroidal Neovascularizations: Clinical Study of 3 Cases. Case Rep Ophthalmol. 2017;8(2):429-435.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology
2022 Issue 6-
All articles in this issue
- INTRAOPERATIVNÍ OPTICKÁ KOHERENČNÍ TOMOGRAFIE – DOSTUPNÉ TECHNOLOGIE A MOŽNOSTI VYUŽITÍ. PŘEHLED
- VYUŽITÍ LASEROVÉ VITREOLÝZY U PACIENTŮ SE SKLIVCOVÝMI OPACITY
- TUBE VERSUS TRABECULECTOMY IN JUVENILE-ONSET OPEN ANGLE GLAUCOMA – TREATMENT OUTCOMES IN TERTIARY HOSPITALS IN MALAYSIA
- HODNOCENÍ ENDOTELOVÉ VRSTVY ROHOVKY U NOSITELŮ KONTAKTNÍCH ČOČEK POMOCÍ ENDOTELIÁLNÍHO MIKROSKOPU
- TUBULOINTERSTICIÁLNÍ NEFRITIDA S UVEITIDOU (TINU SYNDROM). KAZUISTIKA
- NESKORÉ CHOROIDÁLNE NEOVASKULÁRNE KOMPLIKÁCIE U PACIENTA LIEČENÉHO NA RETINOBLASTÓM. KAZUISTIKA
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- VYUŽITÍ LASEROVÉ VITREOLÝZY U PACIENTŮ SE SKLIVCOVÝMI OPACITY
- TUBULOINTERSTICIÁLNÍ NEFRITIDA S UVEITIDOU (TINU SYNDROM). KAZUISTIKA
- INTRAOPERATIVNÍ OPTICKÁ KOHERENČNÍ TOMOGRAFIE – DOSTUPNÉ TECHNOLOGIE A MOŽNOSTI VYUŽITÍ. PŘEHLED
- HODNOCENÍ ENDOTELOVÉ VRSTVY ROHOVKY U NOSITELŮ KONTAKTNÍCH ČOČEK POMOCÍ ENDOTELIÁLNÍHO MIKROSKOPU
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


