-
Medical journals
- Career
IMUNITNĚ PODMÍNĚNÉ NITROOČNÍ ZÁNĚTY. PŘEHLED
Authors: A. Klímová; M. Brichová; E. Říhová; prof. MUDr. Jarmila Heissigerová, Ph.D., MBA; P. Svozílková
Authors‘ workplace: Oční klinika, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze
Published in: Čes. a slov. Oftal., 77, 2021, No. 4, p. 163-168
Category: Review Article
doi: https://doi.org/10.31348/2021/7Overview
Imunitně podmíněná zánětlivá onemocnění se dělí na autoimunitní a autoinflamatorní. Autoimunitní onemocnění jsou charakterizována přítomností autoreaktivních lymfocytů či autoprotilátek, např. primární Sjögrenův syndrom či revmatoidní artritida. Izolovaným očním onemocněním s předpokládanou autoimunitní etiologií je sympatická oftalmie či birdshot chorioretinopatie. Autoinflamatorní onemocnění jsou způsobena genetickými mutacemi v oblastech zapojených do regulace mechanismů vrozené imunity. Mezi monogenně podmíněná autoinflamatorní onemocnění patří hereditární periodické horečky, z očních onemocnění je to Blauův syndrom neboli sarkoidóza s časným začátkem.
Článek shrnuje přehled současných znalostí patogeneze imunitně podmíněných uveitid, jejich imunologických mechanismů a možného iniciačního podílu infekce. Imunologické privilegium zajišťuje ochranu oka před silnou imunitní reakcí na cizí antigen, a to na úrovni fyzikální, imunitní, buněčné a molekulární. Narušení hematoretinální bariéry infekcí či mechanickým vlivem odkryje antigeny skryté v oku, vůči kterým nebyla během vývoje vytvořena tolerance, a tak dochází ke vzniku imunitního zánětu.
Podle současných znalostí je významným zdrojem uveogenních podnětů i vlastní mikrobiom, zejména při jeho dysregulaci, tzn. dysbióze. U lidí je známá asociace nespecifických střevních zánětů s ankylózující spondylitidou a přední uveitidou. Vazbou mezi mikrobiomem a imunitně podmíněnými záněty se zabývá mnoho výzkumných záměrů s cílem terapeuticky ovlivnit střevní mikrobiom. Vzhledem k relativně vzácnému výskytu imunitně podmíněných uveitid u lidí jsou využívány experimentální modely ke studiu imunopatologických mechanismů a k testování nových terapeutických možností.
Klíčová slova:
uveitida – autoimunitní onemocnění – autoinflamatorní onemocnění – imunitně podmíněná zánětlivá onemocnění – oko – nitrooční zánět
Úvod
Imunitně podmíněné nitrooční záněty jsou zrak ohrožující onemocnění postihující ve vyspělých zemích pacienty mladšího a středního věku. Léčebné možnosti se stále rozšiřují, přesto však zůstává uveitida u řady pacientů k léčbě rezistentní a 10 % z nich ztratí zrak v důsledku komplikací uveitidy [1,2]. Pochopení imunopatologických mechanismů vedoucích k imunitně podmíněnému nitroočnímu zánětu je nezbytné pro zavedení nových cílených terapeutických možností. Přehledový článek má za cíl přiblížit mikrobiální teorii vzniku nitroočního zánětu a definovat skupinu autoimunitních a autoinflamatorních onemocnění.
Oko a imunita
Oko patří mezi imunoprivilegované orgány, což znamená, že v nitroočním prostředí je imunitní reakce na prezentovaný antigen různými způsoby potlačována. Obdobně se imunologickým privilegiem vyznačují centrální nervový systém a varlata [3]. Tento fenomén je výsledkem evoluční snahy k ochraně před poškozením orgánů a tkání s limitovanou možností regenerace.
Před poškozením je oko chráněno fyzikálními bariérami a produkcí protizánětlivých a imunosupresivních faktorů (Tabulka 1).
Table 1. Mechanismy imunitní obrany oka 
Table 2. Charakteristika autoimunitních a autoinflamatorních onemocnění 
Fyzikální bariéra mezi okem a vnitřním prostředím je tvořena na 2 úrovních. Hematookulární bariéru představují těsné spoje mezi endotelovými buňkami duhovkových cév a ciliárního tělíska a epitelovými buňkami ciliárního tělíska. Hematoretinální bariéru (Obrázek 1) tvoří těsné spoje mezi endotelovými buňkami sítnicových cév a buňkami retinálního pigmentového epitelu (RPE). Kromě této mechanické funkce hematoretinální bariéra zajišťuje také imunologickou ochranu prostřednictvím buněk tzv. neurovaskulární jednotky (endotel sítnicových cév, perivaskulární makrofágy, pericyty, mikroglie, výběžky Müllerových buněk tvořící vnitřní limitující membránu) [4,5] a buněk RPE, které produkují imunosupresivní mediátory a pomocí kyseliny retinové indukují přeměnu naivních T lymfocytů na T regulační lymfocyty [6,7]. Mikroglie v sítnici představují heterogenní populaci migrujících buněk s dlouhými výběžky. Aktivované mikroglie mění svou morfologii, interagují s infiltrujícími makrofágy, při traumatu inhibují zánik fotoreceptorů nebo se podílí na fagocytóze již odumřelých fotoreceptorů. Předpokládá se, že aktivované perivaskulární mikroglie mají zásadní roli v začátku autoimunitního procesu ovlivněním adherence leukocytů a jejich permeability přes hematoretinální bariéru [8]. Avaskulární rohovka a minimální lymfatická drenáž oka přispívají k udržení imunologického privilegia.
Řadu let je znám fenomén odchylky imunitní odpovědi spojený s přední komorou oka „anterior chamber-associated immune deviation“ (ACAID) [3,9]. Ignorance imunitního systému může být nastolena proti jakémukoliv antigenu – rozpuštěnému, buněčnému, virovému, nádorovému, autolognímu či alogennímu. Tento antigen je pomocí antigen prezentujících buněk z oka transportován krevní cestou do sleziny, kde je indukována tvorba antigen specifických CD4+ a CD8+ regulačních T lymfocytů, přičemž do procesu jsou zapojeny také B lymfocyty a NK buňky (natural killer, přirození zabíječi). Tyto regulační T lymfocyty inhibují indukci a expresi specifických Th1 a Th2 lymfocytů, které obvykle vedou k eliminaci antigenu [10]. Obdobný fenomén oslabené imunitní odpovědi se vyskytuje také ve sklivci a v subretinálním prostoru [11,12].
V předněkomorové tekutině byly prokázány imunosupresivní látky, protizánětlivé cytokiny (transformující růstový faktor β (TGF - β), IL-10) a protizánětlivé faktory, např. α-melanocyty stimulující hormon (α-MSH), vasoaktivní intestinální peptid (VIP), somatostatin aj. [13].
Na imunitních rezidentních buňkách v oku (dendritické buňky, makrofágy, mikroglie) je exprimován Fas ligand (FasL, CD95L). Pokud je během zánětu na Fas ligand navázán Fas receptor (CD95) přítomný na povrchu leukocytů, je aktivována kaskáda reakcí vedoucí k apoptóze cílové buňky. Apoptóza indukovaná vazbou „FasL-Fas receptor“ reprezentuje mechanismus tlumící v imunoprivilegovaných orgánech silnou zánětlivou odpověď [14].
Molekuly HLA I a II (human leukocyte antigen, hlavní histokompatibilní komplex) podílející se na prezentaci antigenů T lymfocytům jsou na rezidentních imunitních buňkách v oku exprimovány méně či vůbec. Dále je v oku významně snížena úloha komplementu odstraňovat infikované buňky či mikroby lýzou či opsonizací pro následnou fagocytózu.
Uveitida
Uveitida vzniká v případě, kdy imunitní systém překoná mechanismy imunitního privilegia a dojde k porušení hematookulární či hematoretinální bariéry. Dochází k extravazaci složek plazmy a migraci leukocytů přes endoteliální buňky cév.
Uveitidy se dělí podle etiologie na infekční a neinfekční [15]. U neinfekčních uveitid se předpokládá etiologie autoimunitní, podobně jako u orgánově specifických autoimunitních procesů, kde jsou známy autoantigeny. Podle některých autorů je pravděpodobné, že uveitidy označované jako neinfekční nebo idiopatické mohou být způsobeny infekcí, a to přímo či nepřímo [7,16]. Experimentálně byl prokázán vliv dysregulace mikrobiomu na vznik imunitně podmíněného nitroočního zánětu. I po vymizení infekčního agens může dále přetrvávat imunitní reakce způsobující destrukci tkáně. Tato teorie předpokládá, že na patogenezi těchto uveitid se více podílí infekce a méně autoimunita [7].
Autoimunitní a autoinflamatorní zánětlivá onemocnění
Společným rysem skupiny chorob označovaných názvem imunitně podmíněná zánětlivá onemocnění (immune mediated inflammatory diseases, IMID) je zánět, přestože etiologie u některých onemocnění není objasněna. Pokroky v pochopení patogeneze imunitně podmíněných onemocnění vedou k jejich dělení na autoimunitní a autoinflamatorní onemocnění (Tabulka 2) [7,16,17,18]. Autoimunitní onemocnění postihují především získanou imunitu a jsou charakteristické vznikem autoprotilátek nebo autoreaktivních T lymfocytů rozpoznávajících specifické buňky nebo tkáně [18]. Jednotlivé autoprotilátky jsou specifické pro jednotlivé autoimunitní choroby, ačkoliv jejich přesná role v patogenezi onemocnění je neznámá. Pouhá přítomnost protilátek neznamená přítomnost autoimunitního onemocnění. U autoinflamatorních onemocnění je zánět způsoben genetickými mutacemi, prostřednictvím makrofágů a neutrofilů je ovlivněn vrozený imunitní systém [16,18].
Autoimunitní onemocnění vznikají dysregulací imunitního systému, kdy aktivace imunitních buněk namířená proti autoantigenům vede k poškození vlastní tkáně (Tabulka 3). Mechanismy namířené proti zdravé tkáni vznikají v důsledku získané (nazývané také adaptivní nebo specifické) imunitní odpovědi zprostředkované pomocí T a B lymfocytů. Destrukce tkání je výsledkem aktivity autoprotilátek či autoreaktivních T lymfocytů (Th1 a Th17). Některé protilátky jsou specifické pro určitá onemocnění, např. u revmatoidní artritidy revmatoidní faktor (RF) a protilátky proti cyklickému citrulinovému peptidu (anti-CCP). Většina pacientů s primárním Sjögrenovým syndromem má pozitivní protilátky proti Ro a La (anti-SSA/Ro a anti-SSB/La, anti-Sjögren syndrom antigen A, B, protilátky proti antigenu Sjögrenova syndromu typu A a B, nazývané Ro a La).
Table 3. Autoimunitní onemocnění s charakteristickými autoprotilátkami (*) a předpokládaná autoimunitní onemocnění 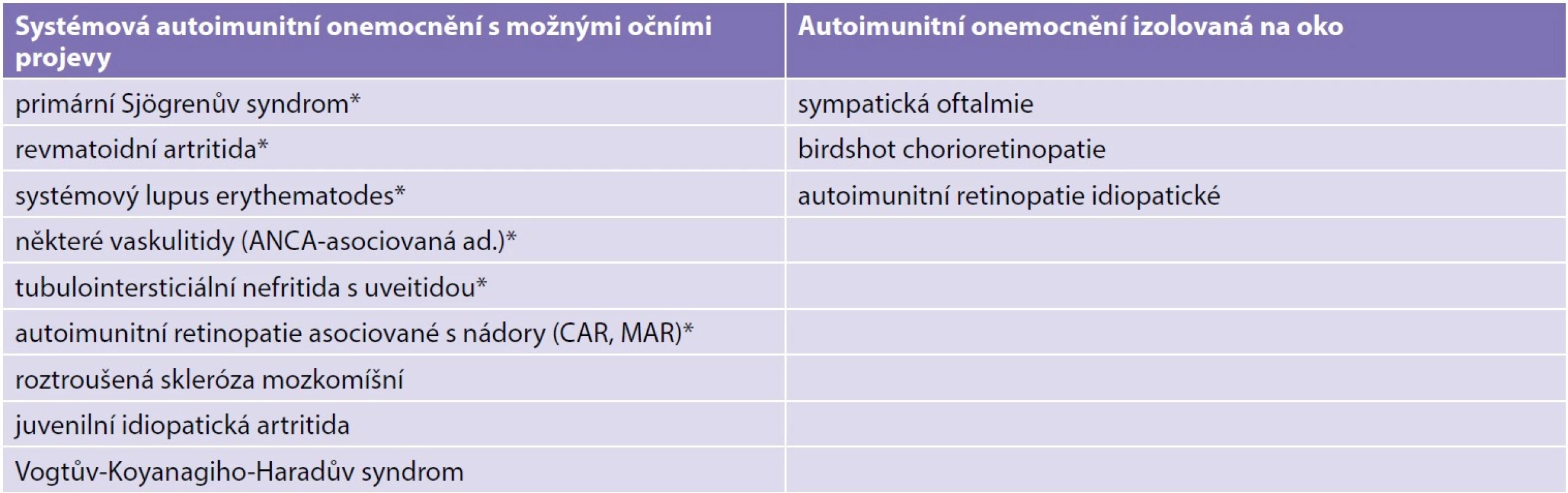
Některé protilátky jsou nespecifické (např. ANA, antinukleární), jsou přítomny také u zdravých jedinců a nemusí znamenat přítomnost autoimunitního onemocnění [19]. ANA protilátky jsou standardně vyšetřovány u dětských pacientů s juvenilní idiopatickou artritidou (JIA), jelikož je známo, že pozitivita ANA protilátek zvyšuje riziko vzniku uveitidy [20].
Velkou skupinu tvoří autoimunitní onemocnění, kde specifická protilátka nebyla identifikována. Mezi tato onemocnění patří sympatická oftalmie a birdshot chorioretinopatie, u kterých je předpokládaná protilátka proti strukturám zadního segmentu. U Vogtova-Koyanagiho-Haradova (VKH) syndromu se předpokládá protilátka proti melanocytům, u roztroušené sklerózy mozkomíšní protilátky proti myelinu, u JIA protilátky proti kloubní chrupavce. U tubulointersticiální nefritidy s uveitidou (TINU) jsou přítomny protilátky proti modifikovanému C-reaktivnímu proteinu (mCRP), u autoimunitní retinopatie recoverin, alfa-enoláza, karboanhydráza II, tubby-like protein 1, u systémového lupusu erythematodes jsou protilátky ANA, ENA (proti extrahovatelným nukleárním antigenům, anti SM (anti-Smith, podle prvního pacienta, u kterého byly tyto protilátky detekovány), ANCA (proti cytoplazmě neutrofilů), anti dsDNA (proti dvoušroubovici DNA) [18].
Předpokládá se, že autoimunitní reakce proti retinálním antigenům hrají základní roli u různých typů uveitid. Přímé důkazy autoimunitní patogeneze byly opakovaně popsány u retinopatie asociované s některými nádory (CAR, cancer-associated retinopathy; MAR, melanoma-associated retinopathy) pomocí transferu autoprotilátek [21]. Přesto je průkaz autoimunitních reakcí a spouštěcích antigenů u uveitid limitovaný.
Autoimunitní uveitidy lze předpokládat u klinických jednotek se silnou vazbou na HLA, například u VKH syndromu (HLA-DRB1*0405) [22,23], sympatické oftalmie (HLA-DRB1*04 a DQA1*03) [24] a birdshot chorioretinopatie (HLA-A29) [25].
Vedle autoimunitních onemocnění je skupina autoinflamatorních onemocnění, která jsou způsobena genetickými mutacemi v oblastech zapojených do regulace mechanismů vrozené (nazývané také nespecifické) imunity (Tabulka 4). U těchto onemocnění je známa genetická dispozice k nemoci a předpokládá se, že spouštěcími mechanismy jsou environmentální faktory, infekce (molekulární mechanismy asociované s patogeny (pathogen associated molecular pattern, PAMP) a poškození tkání (molekulární mechanismy asociované s poškozením tkání, damage associated molecular pattern, DAMP).
Table 4. Příklady monogenních autoinflamatorních onemocnění 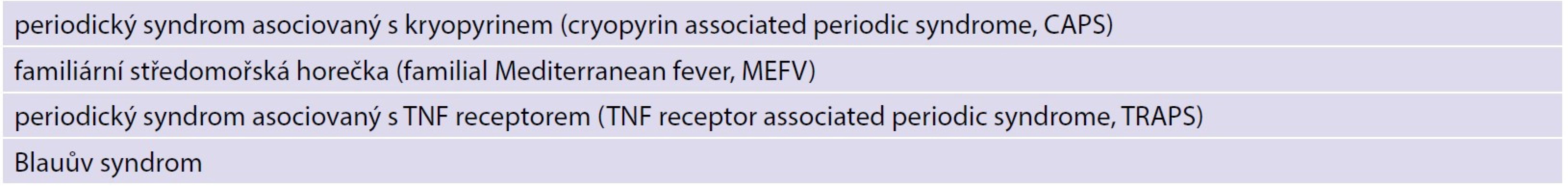
Monogenní autoinflamatorní onemocnění zahrnují hereditární periodické horečky, např. periodický syndrom asociovaný s kryopyrinem (cryopyrin associated periodic syndrome, CAPS), familiární středomořskou horečku (familial Mediterranean fever, MEFV), periodický syndrom asociovaný s TNF receptorem (TNF receptor associated periodic syndrome, TRAPS). Tato onemocnění jsou charakteristická epizodami horečky, vyrážkou na kůži, serozitidou, artralgií a myalgií. Tyto epizody obvykle odezní spontánně a nejsou spojeny s tvorbou autoprotilátek či autoreaktivních lymfocytů [26].
Blauův syndrom (nazývaný též sarkoidóza s časným začátkem, early onset sarcoidosis, EOS) je příkladem monogenního autoinflamatorního procesu s postižením očí, je způsoben získanou mutací genu NOD2. Projevuje se obvykle v prvním roce života dermatitidou, ve věku 1–2 let granulomatózní polyartritidou; uveitida se objevuje kolem druhého roku u 60-80 % pacientů. V důsledku artritidy může být přítomna trvalá flexe některých prstů ruky (kamptodaktylie). Na sítnici jsou přítomny charakteristické léze připomínající sarkoidózu [16,27].
Mezi polygenní autoinflamatorní onemocnění je zařazována sarkoidóza či nespecifické střevní záněty a ANCA negativní vaskulitidy [28].
U některých onemocnění se předpokládá, že se skupiny překrývají či klasifikace není jednoznačná. Autoimunitně-autoinflammatorní, polygenní či komplexní autoinflamatorní onemocnění jsou dle některých autorů například Crohnova choroba, morbus Behçet, HLA B27 uveitida, ankylózující spondylitida, psoriáza/psoriatická artritida a reaktivní artritida, věkem podmíněná makulární degenerace, JIA, TINU [7,28].
Berge et al. [28] u souboru 1327 pacientů s uveitidou a/nebo skleritidou zjistili, že autoimunitní onemocnění bylo příčinou pouze v 5 %, v 15 % se jednalo o onemocnění autoinflamatorní a ve 14 % o kombinaci autoimunitního a autoinflamatorního onemocnění. Nejčastějším autoimunitním onemocněním byla revmatoidní artritida a granulomatóza s polyangiitidou a nejčastějším projevem byla skleritida, a to v 53 % případů. Nízký počet pacientů s autoimunitním zánětem z celkového počtu uveálních pacientů potvrzuje, že označení uveitidy autoimunitní by mělo být rezervováno na případy zřejmého autoimunitního původu.
Nepřímý průkaz autoimunity u uveitid byl pozorován na zvířecích modelech. Uveitida byla indukována po imunizaci zvířat humánním sítnicovým antigenem, imunitní reakce byla potencována Freundovým adjuvans obsahujícím usmrcené mykobakterie a pertusovým toxinem. Tyto zvířecí modely experimentální autoimunitní uveitidy (EAU) umožňují studium patogeneze uveitidy. Především na myších modelech byly aplikovány různé antigeny (např. sítnicové antigeny interphotoreceptor retinoid-binding protein nebo S-arrestin nebo lipopolysacharid endotoxin) způsobující nitrooční zánět imitující lidskou uveitidu. Na jiných modelech byla uveitida vyvolána transferem specifických T lymfocytů proti sítnicovým antigenům [29].
Autoimunitní uveitidy u lidí poskytují pouze nepřímé důkazy autoimunitní patogeneze, například zvyšující se počet Th17 lymfocytů během aktivní uveitidy a skleritidy a jejich snížení během léčby [30]. Autoimunitní mechanismus uveitidy u lidí byl prokázán pouze pokud byla součástí systémového autoimunitního onemocnění a je velmi pravděpodobný u sympatické oftalmie. Je možné, že poškození a následná expozice dosud ukrytých sítnicových či choroidálních antigenů způsobuje autoimunitní reakce, které mohou hrát roli u některých typů uveitid [31].
Infekční teorie vzniku „neinfekční uveitidy“ některými autory nově nazývané nediferencovaná či idiopatická uveitida se v literatuře objevuje stále častěji [7,16]. Autoimunitní teorie je odvozena od mechanismů uveitidy u zvířecích modelů, kdy dochází k prolomení hematoretinální bariéry a stimulaci získané imunitní reakce proti sítnicovým antigenům. Nicméně pokud zánět nepostihuje sítnici, může převážit vrozená imunitní reakce a autoinflamatorní proces. Příkladem je přední uveitida na myším modelu indukována endotoxinem (nazývaným také lipopolysacharid, což je toxin uvolněný při lýze bakterie) aplikovaným na vzdáleném místě od oka – subkutánně, intravenózně nebo intraperitoneálně. Podobně u lidí, u 50 % pacientů s ankylózující spondylitidou se vyskytuje přední uveitida [32,33]. S ankylózující spondylitidou jsou asociovány nespecifické střevní záněty u 6–14 % pacientů, častěji Crohnova nemoc než ulcerózní kolitida. Asymptomatické zánětlivé změny střevní sliznice jsou pozorovány až u 60 % pacientů s ankylózující spondylitidou [34]. Předpokládá se aktivace imunitního systému bakteriálními produkty, kdy bakteriální fragmenty mohou účinkovat jako adjuvans aktivující vrozené imunitní reakce a pravděpodobně sekundárně také reakce získané imunity [35].
ZÁVĚR
Nové poznatky v imunopatologii a dostupnější genetické testování v současné době umožňují rozdělit neinfekční onemocnění na autoimunitní a autoinflamatorní a používá pro ně širší název imunitně podmíněná zánětlivá onemocnění. Předpokládaná linie od autoimunitních k autoinflamatorním onemocněním dává možnost zařadit do této skupiny nemoci s nejasnou patogenezí, u kterých se předpokládá jejich imunitní původ.
V oftalmologii označení nediferencované či idiopatické uveitidy nahrazuje původní název neinfekční, z důvodu možné primární reakce na infekční agens. V současné době se připouští, že chronický zánět a poškození tkání pravděpodobně vzniká v důsledku neadekvátní reakce na infekční podnět. Zdrojem infekčních antigenů může být také vlastní mikrobiom. Lze předpokládat, že perzistující mikrobiální podnět vyvolá chronickou či rekurentní uveitidu. Dysregulace mikrobiomu může být predispozicí nebo zdrojem uveogenních podnětů.
Autoři čestně prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Aneta Klímová Ph.D.
Oční klinika 1. LF UK a VFN Praha
U Nemocnice 2
128 08 Praha 2
E-mail: aneta.klimova@vfn.cz
Do redakce doručeno dne: 5. 8. 2020
Přijato k publikaci dne: 24. 10. 2020
Publikováno on-line dne: 10. 3. 2021
Sources
- Rothova A. Inflammatory cystoid macular edema. Curr Opin Ophthalmol. 2007;18(6):487-492.
- Suttorp-Schulten MS, Jager MJ, Kijlstra A. Recent developments in the treatment of posterior uveitis. Ocul Immunol Inflamm. 1996;4(4):207-217.
- Streilein JW. Ocular immune privilege: the eye takes a dim but practical view of immunity and inflammation. J Leukoc Biol. 2003;74(2):179-185.
- Trost A, Lange S, Schroedl F, et al. Brain and Retinal Pericytes: Origin, Function and Role. Front Cell Neurosci. 2016;10 : 20.
- Spadoni I, Fornasa G, Rescigno M. Organ-specific protection mediated by cooperation between vascular and epithelial barriers. Nat Rev Immunol. 2017;17(12):761-773.
- Imai A, Sugita S, Kawazoe Y, et al. Immunosuppressive properties of regulatory T cells generated by incubation of peripheral blood mononuclear cells with supernatants of human RPE cells. Invest Ophthalmol Vis Sci. 2012;53(11):7299-7309.
- Forrester JV, Kuffova L, Dick AD. Autoimmunity, Autoinflammation, and Infection in Uveitis. Am J Ophthalmol. 2018;189 : 77-85.
- Okunuki Y, Mukai R, Nakao T, et al. Retinal microglia initiate neuroinflammation in ocular autoimmunity. Proc Natl Acad Sci U S A. 2019;116(20):9989-9998.
- Hori J, Vega JL, Masli S. Review of ocular immune privilege in the year 2010: modifying the immune privilege of the eye. Ocul Immunol Inflamm. 2010;18(5):325-333.
- Caspi RR. A look at autoimmunity and inflammation in the eye. J Clin Invest. 2010;120(9):3073-3083.
- Sonoda KH, Sakamoto T, Qiao H, et al. The analysis of systemic tolerance elicited by antigen inoculation into the vitreous cavity: vitreous cavity-associated immune deviation. Immunology. 2005;116(3):390-399.
- Wenkel H, Chen PW, Ksander BR, Streilein JW. Immune privilege is extended, then withdrawn, from allogeneic tumor cell grafts placed in the subretinal space. Invest Ophthalmol Vis Sci. 1999;40(13):3202-3208.
- Taylor AW. Ocular Immune Privilege and Transplantation. Front Immunol. 2016;7 : 37.
- Hořejší V, Bartůňková J, Brdička T, Špíšek R. Základy imunologie. 5. vydání. Praha: Triton; 2013. 320.
- Jabs DA, Nussenblatt RB, Rosenbaum JT. Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol. 2005;140(3):509-516.
- Lee RW, Nicholson LB, Sen HN, et al. Autoimmune and autoinflammatory mechanisms in uveitis. Semin Immunopathol. 2014;36(5):581-594.
- McDermott MF, Savic S. Autoinflammatory diseases: update on classification diagnosis and management. J Clin Pathol. 2017;70(1):1-8.
- McGonagle D, McDermott MF. A proposed classification of the immunological diseases. PLoS Med. 2006;3(8):e297.
- Marin GG, Cardiel MH, Cornejo H, Viveros ME. Prevalence of antinuclear antibodies in 3 groups of healthy individuals: blood donors, hospital personnel, and relatives of patients with autoimmune diseases. J Clin Rheumatol. 2009;15(7):325-329.
- Tappeiner C, Klotsche J, Sengler C, et al. Risk Factors and Biomarkers for the Occurrence of Uveitis in Juvenile Idiopathic Arthritis: Data From the Inception Cohort of Newly Diagnosed Patients With Juvenile Idiopathic Arthritis Study. Arthritis Rheumatol. 2018;70(10):1685-1694.
- Ohguro H, Ogawa K, Maeda T, Maeda A, Maruyama I. Cancer-associated retinopathy induced by both anti-recoverin and anti-hsc70 antibodies in vivo. Invest Ophthalmol Vis Sci. 1999;40(13):3160-3167.
- Damico FM, Kiss S, Young LH. Vogt-Koyanagi-Harada disease. Semin Ophthalmol. 2005;20(3):183-190.
- Patil YB, Garg R, Rajguru JP, et al. Vogt-Koyanagi-Harada (VKH) syndrome: A new perspective for healthcare professionals. J Family Med Prim Care. 2020;9(1):31-35.
- Kilmartin DJ, Wilson D, Liversidge J, et al. Immunogenetics and clinical phenotype of sympathetic ophthalmia in British and Irish patients. Br J Ophthalmol. 2001;85(3):281-286.
- Kuiper J, Rothova A, de Boer J, Radstake T. The immunopathogenesis of birdshot chorioretinopathy; a bird of many feathers. Prog Retin Eye Res. 2015;44 : 99-110.
- Margo CE, Harman LE. Autoimmune disease: Conceptual history and contributions of ocular immunology. Surv Ophthalmol. 2016;61(5):680-688.
- Wouters CH, Maes A, Foley KP, Bertin J, Rose CD. Blau syndrome, the prototypic auto-inflammatory granulomatous disease. Pediatr Rheumatol Online J. 2014;12 : 33.
- Ten Berge JC, Schreurs MWJ, van Daele PLA, Rothova A. Autoimmunity in uveitis. Acta Ophthalmol. 2018;96(5):481-485.
- Caspi RR, Silver PB, Luger D, et al. Mouse models of experimental autoimmune uveitis. Ophthalmic Res. 2008;40(3-4):169-174.
- Amadi-Obi A, Yu CR, Liu X, et al. TH17 cells contribute to uveitis and scleritis and are expanded by IL-2 and inhibited by IL-27/STAT1. Nat Med. 2007;13(6):711-718.
- Whittle RM, Wallace GR, Whiston RA, Dumonde DC, Stanford MR. Human antiretinal antibodies in toxoplasma retinochoroiditis. Br J Ophthalmol. 1998;82(9):1017-1021.
- Robinson PC, Claushuis TA, Cortes A, et al. Genetic dissection of acute anterior uveitis reveals similarities and differences in associations observed with ankylosing spondylitis. Arthritis Rheumatol. 2015;67(1):140-151.
- Rosenbaum JT, Asquith M. The microbiome and HLA-B27-associated acute anterior uveitis. Nat Rev Rheumatol. 2018;14(12):704-713.
- Fragoulis GE, Liava C, Daoussis D, Akriviadis E, Garyfallos A, Dimitroulas T. Inflammatory bowel diseases and spondyloarthropathies: From pathogenesis to treatment. World J Gastroenterol. 2019;25(18):2162-2176.
- Heissigerova J, Seidler Stangova P, Klimova A, et al. The Microbiota Determines Susceptibility to Experimental Autoimmune Uveoretinitis. J Immunol Res. 2016;2016 : 5065703.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2021 Issue 4-
All articles in this issue
- IMMUNE-MEDIATED INTRAOCULAR INFLAMMATION. A REVIEW
- PRE-RETINOPATHY OF TYPE 1 DIABETES IN THE CONTEXT OF FUNCTIONAL, STRUCTURAL AND MICROCIRCULATORY CHANGES IN THE MACULAR AREA
- SPECIFIC CORNEAL PARAMETERS AND VISUAL ACUITY CHANGES AFTER CORNEAL CROSSLINKING TREATMENT FOR PROGRESSIVE KERATOCONUS
- ENCYKLOPÉDIA OFTALMOLÓGIE ANTON GERINEC
- EFFECT OF PHARMACOLOGICAL PUPIL DILATION ON INTRAOCULAR LENS POWER CALCULATION IN PATIENTS INDICATED FOR CATARACT SURGERY
- SYNDROM UVEÁLNÍ EFUZE. KAZUISTIKA
- RECURRENT PERIOCULAR BASAL CELL CARCINOMA. CASE REPORT
- MALÍGNY MELANÓM OKA A OČNÝCH ADNEXOV
- VYBRANÉ KAPITOLY Z HISTÓRIE OFTALMOLÓGIE NA SLOVENSKU
-
POKYNY PRO AUTORY A RECENZENTY
ČASOPIS ČESKÉ OFTALMOLOGICKÉ SPOLEČNOSTI A SLOVENSKÉ OFTALMOLOGICKÉ SPOLEČNOSTI
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- IMMUNE-MEDIATED INTRAOCULAR INFLAMMATION. A REVIEW
- SYNDROM UVEÁLNÍ EFUZE. KAZUISTIKA
- EFFECT OF PHARMACOLOGICAL PUPIL DILATION ON INTRAOCULAR LENS POWER CALCULATION IN PATIENTS INDICATED FOR CATARACT SURGERY
- SPECIFIC CORNEAL PARAMETERS AND VISUAL ACUITY CHANGES AFTER CORNEAL CROSSLINKING TREATMENT FOR PROGRESSIVE KERATOCONUS
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


