-
Medical journals
- Career
ŠÍŘE CHIASMATU U NORMOTENZNÍCH A HYPERTENZNÍCH GLAUKOMŮ
Authors: J. Lešták 1; M. Kyncl 1; M. Fůs 1; K. Marešová 2
Authors‘ workplace: Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze 1; Oční klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 2
Published in: Čes. a slov. Oftal., 76, 2020, No. 3, p. 126-128
Category: Original Article
doi: https://doi.org/10.31348/2020/21Overview
Cíl: Cílem naší práce bylo zjistit, zda u nemocných s hypertenzními glaukomy (HTG) a normotenzním glaukomem (NTG), dochází ke změnám ve velikosti chiasmatu v závislosti na změnách v zorných polích. Proto jsme retrospektivně změřili šíři chiasmatu u nemocných, kterým jsme v roce 2013 měřili velikost corpus geniculatum laterale.
Soubor a metodika: Soubor tvořily dvě skupiny pacientů. Devět s hypertenzním glaukomem (HTG) a devět s normotenzním glaukomem (NTG). Diagnóza byla stanovena na základě komplexního oftalmologického vyšetření a u NTG i elektrofyziologického vyšetření. Zorné pole bylo vyšetřeno rychlým prahovým programem na přístroji Medmont M700. Součet citlivostí z obou zorných polí v rozsahu 0–22 stupňů jsme porovnali se šířkou chiasmatu získané vyšetřením magnetickou rezonancí použitím osmi kanálové hlavové cívky. Naměřené hodnoty všech subjektů jsme analyzovali pomocí párového t-testu a korelačním koeficientem.
Výsledky: Zjistili jsme redukci šířky chiasmatu v obou skupinách s glaukomem. Mezi kontrolní skupinou a skupinou s HTG jsme zjistili statisticky významný rozdíl ve velikosti chiasmatu (p = 0,0003), podobně i u kontrolní skupiny a skupiny s NTG (p = 0,001). Zúžení chiasmatu ukázalo u HTG slabou korelaci se změnami v zorných polích (r = 0,139) a u NTG střední korelaci (r = 0,375).
Závěr: Redukce velikosti chiasmatu jsme zjistili jak u HTG, tak u NTG. Součet citlivostí v centrálních částech zorných polích ale více koreloval s redukcí velikosti chiasmatu u NTG. I tento nález svědčí o tom, že se jedná o dvě odlišné diagnostické skupiny.
Klíčová slova:
Hypertenzní glaukomy – normotenzní glaukom – šířka chiasmatu – MRI – změny v zorných polích
Úvod
Základním uváděným rozdílem mezi hypertenzním glaukomem (HTG) a normotenzním glaukomem (NTG) je výše nitroočního tlaku. I když jsou změny na terči zrakového nervu podobné u obou diagnostických skupin, jejich příčina může být odlišná. Proto se i v našich pracích snažíme poukázat na odlišnost obou onemocnění včetně jejich příčiny.
V předchozí práci, „The anterior visual pathway in normal-tension glaucoma“, kde jsme se zabývali problematikou cerebrospinálního tlaku (cerebrospinal fluid pressure CSF-P), který může mít v patogenezi NTG podobný efekt na retrobulbární oblast orbity jako má zvýšený nitrooční tlak na laminu cribriformis, jsme zjistili i statisticky významný rozdíl v šíři chiasmatu [1]. Zajímalo nás, zda se podobné změny nacházejí i u nemocných s HTG a pokud ano, zda existuje korelace mezi změnami v zorných polích a šířkou chiasmatu.
Proto jsme retrospektivně vyhodnotili výsledky vyšetření periferní části zrakové dráhy, kde jsme v jiné práci porovnávali velikost corpus geniculatum laterale u HTG a NTG [2].
Soubor a metodika
Soubor tvořilo 18 nemocných. Devět s HTG (3 ženy a 6 mužů ve věku od 35 do 81 let) a devět s NTG (6 žen a 3 muži ve věku od 48 do 77 let). Kontrolní skupina byla složena z devíti zdravých jedinců (4 ženy a 5 mužů ve věku od 31 do 73 let). U všech jsme provedli komplexní oftalmologické vyšetření včetně biomikroskopie, gonioskopie, denní křivky nitroočního tlaku (NOT), perimetrie, vyšetření vrstvy nervových vláken a u NTG i elektrofyziologické vyšetření zraku. Zraková ostrost byla po případné korekci menší ±3 dioptrie 1.0. Nemocní neměli žádné jiné neurologické onemocnění a strukturální vyšetření mozku magnetickou rezonancí (MR) bylo u všech normální. Vyšetření zorného pole jsme provedli na přístroji Medmont M700 (Medmont Pty Ltd, Victoria 3124, Australia) s použitím rychlého prahového glaukomového programu. Citlivost v zorných polích jsme stanovili prostým součtem všech vyšetřených bodů v rozsahu 0–22 stupňů v obou zorných polích. Hodnoty jsou v apostilbech (asb = 3,14 cd/m2).
MR vyšetření mozku a optického chiasmatu bylo provedeno na 3T MR přístroji (Philips Achieva TX series release 3.2.1.1, Nederland) za použití 8 kanálové hlavové cívky. Sekvence byly využity následující: sagitální rovina 3D T1 TFE (TR/TE 8/3, 8, 160–170 vrstev, akviziční voxel 1×1×1, FOV 240×240, Sense 1.7, NSA 1) a koronální rovina T2 TSE (TR/TE 3000/80, 28 až 30 vrstev, 4 mm gap, šíře řezu 1 mm, FOV 240×240, TSE faktor 15, ACQ voxel 0,57×0,74×4, NSA 1). Analýzu obrazové dokumentace provedl neuroradiolog s dlouholetou zkušeností, parametry byly kvantifikovány z koronální rekonstrukce 3D T1 TFE obrazu. Data byla hodnocena na pracovní stanici Extended MR Workspace (EWS Philips, verze R2.6.3.1). K měření a matematickému zhodnocení chiasmatu byla využita koronální rekonstrukce T1 obrazu v místě horizontální vizualizace chiasmatu s klasickým činkovitým profilem.
Image 1. Magnetická rezonance, koronální rekonstrukce T1 TFE obrazu. Měření horizontálního rozměru chiasmatu (vyznačeno šipkami) 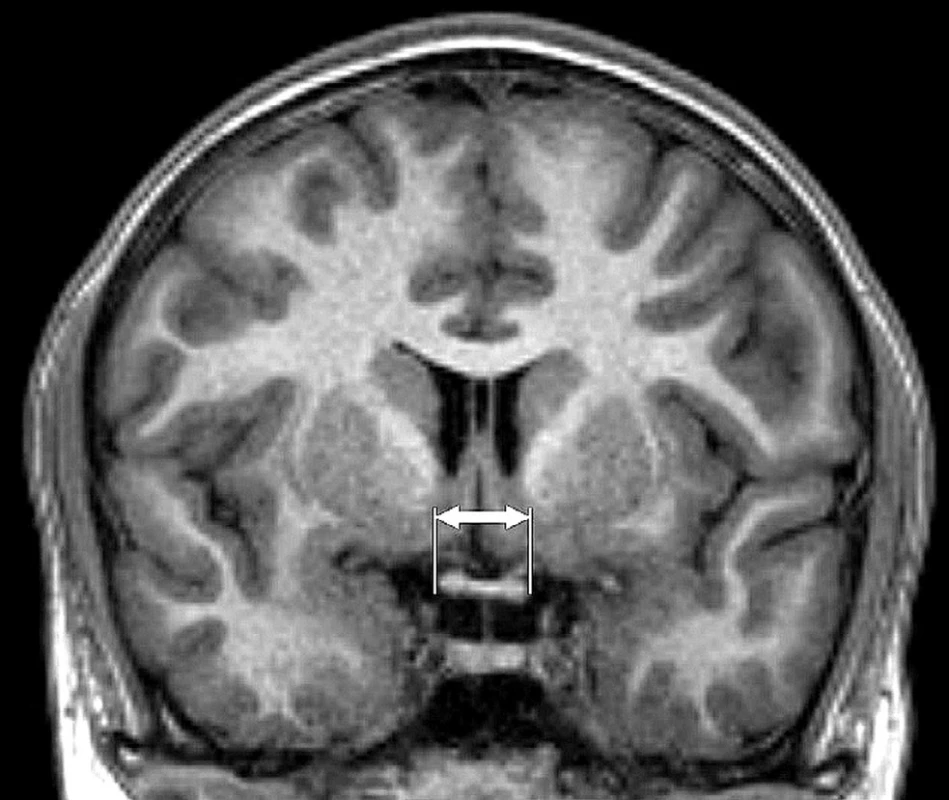
Výsledky
Průměrné naměřené hodnoty jsou uvedeny v tabulce 1. Mezi kontrolní skupinou a skupinou s HTG jsme zjistili statisticky významný rozdíl ve velikosti chiasmatu (p = 0,0003), podobně i u kontrolní skupiny a skupiny s NTG (p = 0,001). Korelace mezi citlivostí zorného pole (VF) a šířkou chiasmatu (WCh) u HTG byla slabá (r = 0,139) a u NTG střední (r = 0,375). Tabulka 2 ukazuje na korelační koeficienty mezi šířkou chiasmatu a součtem citlivostí v zorných polích (p = 0,05) u skupiny s HTG, skupiny s NTG a kontrolní skupiny.
Table 1. Naměřené průměrné hodnoty a jejich směrodatné odchylky u nemocných s HTG, NTG a v kontrolní skupině 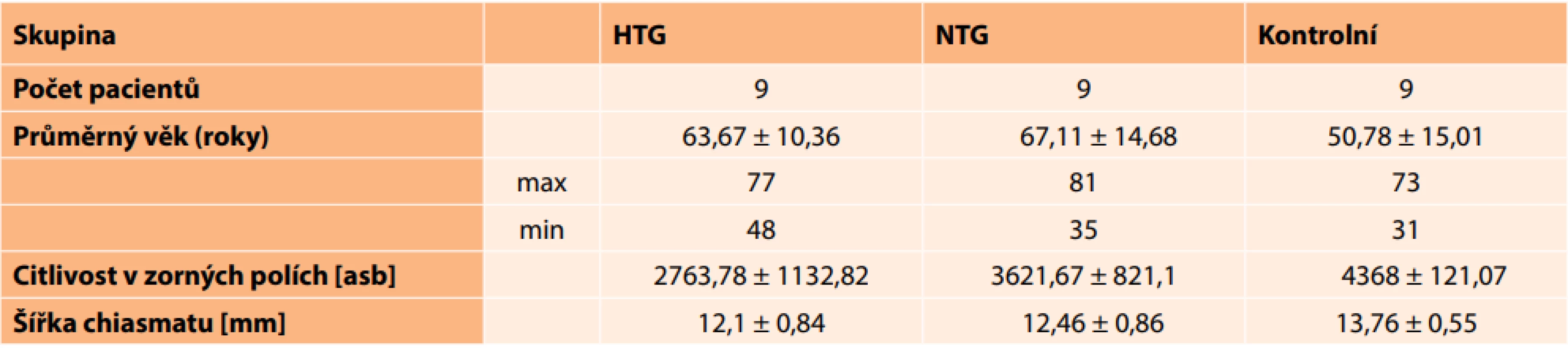
HTG (hypertenzní glaukom), NTG (normotenzní glaukom), asb (apostilb) Table 2. Korelační koeficient mezi šířkou chiasmatu (WCh) a citlivostí v zorných polích (VF) [(p = 0,05). [Slabá (r < 0,3), střední (0,3 < r < 0,8) a silná (r > 0,8)] ![Korelační koeficient mezi šířkou chiasmatu (WCh)
a citlivostí v zorných polích (VF) [(p = 0,05). [Slabá (r < 0,3), střední (0,3 < r < 0,8) a silná (r > 0,8)]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ecd0eedefda04d78e0d56017fdb08ff8.png)
WCh (šíře chiasmatu), VF (citlivost v zorných polích), HTG (hypertenzní glaukom), NTG (normotenzní glaukom) Diskuse
NTG je ve srovnání s HTG (kromě výše nitroočního tlaku) odlišný i ve změnách v zorném poli, kde u NTG nacházíme změny více v centrální části a tyto změny mají hlubší defekty citlivosti [3,4,5], nervová vlákna jsou u NTG více poškozena v centrální části sítnice a poškození mají fokální charakter [6]. U HTG dochází k poškození gangliových buněk difuzně po celé sítnici, přičemž více jsou poškozeny magnocelulární buňky. Následně odumírají i jejich axony. Za jak dlouhou dobu od těchto změn dojde k alteraci podkorových a korových zrakových ústředí v mozku není přesně známo. U NTG je na rozdíl od HTG elektrická odpověď gangliových buněk relativně dobrá. Alterace je ale ve zrakové dráze [7]. V sítnici se nachází cca 80 % parvocelulárních a 10 % magnocelulárních gangliových buněk [8], přičemž většina parvocelulárních se nachází v makule. U HTG dochází k většímu poklesu právě magnocelulárních buněk sítnice [9]. Proto u HTG v počátečních stádiích nelze prokázat podobné změny v centrální části zorného pole jako u NTG. Na základě těchto znalostí lze předpokládat, že u HTG budou změny v centrální části zorného pole, na rozdíl od NTG, méně korelovat se změnami v optickém chiasmatu.
Změny v optickém chiasmatu jsou u glaukomu známé. Některé práce neodlišují tyto změny u HTG a NTG [10,11,12,13,14]. Zhang a spol. vyšetřili pomocí MR periferní část zrakové dráhy u NTG a zjistili, že zúžení optického nervu a zmenšení velikosti chiasmatu a corpus geniculatum laterale koreluje s úbytkem RNFL [15].
Podobně i Kashiwagi a spol. prokázali korelaci ve velikosti optického nervu a chiasmatu s MD (středním defektem) při vyšetření zorného pole u HTG a NTG [16].
V naší práci jsme na rozdíl od předchozích autorů porovnávali součet citlivostí v centrální části zorných polí (0-22 stupňů) s velikostí chiasmatu. Zjistili jsme statisticky významný rozdíl u obou diagnostikovaných skupin, ve skupině s HTG p = 0,0003, ve skupině s NTG p = 0,001. Součet citlivostí v centrálních částech zorných polích ale více koreloval s velikostí chiasmatu u NTG. I tento nález mluví o tom, že se jedná o dvě odlišné diagnostické skupiny.
Uvědomujeme si i nedostatek této práce spočívající v malém počtu subjektů. Přesto jsme prokázali, že i na malém souboru jsou prokazatelné rozdíly mezi HTG a NTG.
Závěr
U HTG i NTG jsme prokázali změny ve velikosti chiasmatu ve srovnání s kontrolní skupinou. Součet citlivostí v centrálních částech zorných polích ale více koreloval s velikostí chiasmatu u NTG. I tento nález mluví o tom, že se jedná o dvě odlišné diagnostické skupiny.
Autoři prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Autoři prohlašují, že práce nebyla zadána jinému časopisu ani jinde otištěna.
Do redakce doručeno dne: 16. 3. 2020
Přijato k publikaci dne: 4. 5. 2020
doc. MUDr. Ján Lešták, CSc, MSc, MBA, LLA, DBA, FEBO, FAOG
Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze
V Hůrkách 1296/10
158 00 Praha 5 - Nové Butovice
Sources
1. Kyncl M, Lestak J, Sverepa M, Ettler L, Rozsival P.: The anterior visual pathway in normal-tension glaucoma. Indian Journal of Research. 2015 Jan;4(1):10–14.
2. Lestak J, Kyncl M, Svata Z, Rozsival P.: Lateral Geniculate Nucleus in Hypertensive and Normotensive Glaucoma. J Clin Exp Ophthalmol. 2013 Feb;4(2): DOI:10.4172/2155-9570.1000269.
3. Araie M, Yamagami J, Suziki Y.: Visual field defects in normal-tension and high-tension glaucoma. Ophthalmology. 1993 Dec;100(12):1808–1814.
4. Lestak J, Nutterova E, Bartosova L, Rozsival P.: The Visual Field in Normal tension and Hypertension Glaucoma. International Journal of Scientific Research. 2014 Dec;3(12):49–51.
5. Lester M, De Feo F, Douglas GR.: Visual field loss morphology in high-and normal-tension glaucoma. J Ophthalmol. 2012 Feb; 327326. [Epub 2012: doi:10.1155/2012/327326].
6. Shin IH, Kang SY, Hong S, Kim SK, Seong GJ, Tak MK. et al.: Comparison of OCT and HRT findings among normal tension glaucoma, and high tension glaucoma. Korean J Ophthalmol. 2008 Dec;22(4): 236–241.
7. Lestak J, Nutterova E, Pitrova S, Bartosova L.: High tension versus normal tension glaucoma. A comparison of structural and functional examinations. J Clin Exp Ophthalmol. 2012 Mar; S:5. [Epub doi.org/10.4172/2155-9570.S5-006].
8. Prasad S, Galetta SL. Handbook of Clinical Neurology. 102. Amsterdam (The Netherlands): Elsevier; 2011. Anatomy and physiology of the afferent pupilary systém; 3–19.
9. Shou T, Liu J, Wang W, Zhou Y, Zhao K.: Differential dendritic shrinkage of alpha and beta retinal ganglion cells in cats with chronic glaucoma. Invest Ophthalmol Vis Sci. 2003 Jul;44(7): 3005–3010.
10. Erzos MG, Peckevik Y, Ayintap E, Gunes IB, Mart DK, Yucel E. et al.: MR Imaging of the Anterior Visual Pathway in Primary Open-Angle Glaucoma: Correlation with Octopus 101 Perimetry and Spectralis Optical Cherence Tomography Findings. Curr Eye Res. 2013 May;42(7): 995–1001.
11. Hernowo AT, Boucard ChC, Jansonius NM, Hooyman JM, Cornelissen FW. et al: Automated Morphometry of the Visual Pathway in Primary Open-Angle Glaucoma. Invest Ophthal & Vis Sci. 2011 Apr;52(5): 2758–2766.
12. Iwata F, Patronas NJ, Caruso RC, Podqor MJ, Remaley NA, Kupfer C. et al: Association of Visual Field, Cup-Disc Ratio, and Magnetic Resonance Imaging of Optic Chiasm. Arch Ophthalmol. 1997 Jun;115(6): 729–733.
13. Murai H, Suzuki Y, Kiyosawa M, Tokumaru AM, Ashii K, Mochizuki M.: Positive correlation between the degree of visual field defect and optic radiation damage in glaucoma patients. Jpn J Ophthalmol. 2013 May;57(3):257–262.
14. Omodaka K, Murata T, Sato S, Takahashi M, Nagasaka T, Doi H. et al.: Correlation of magnetic resonance imaging optic nerve parameters to optical coherence tomography and the visual field in glaucoma. Clin and Exp Ophthalmol. 2014 May-Jun;42(4):360–368.
15. Zhang YQ, Jing LiJ, Xu L, Wang ZC, Yang H, Chen CX. et al.: Anterior visual pathway assessment by magnetic resonance imaging in normal-pressure glaucoma. Acta Ophthalmol. 2012 Jun;90(4):e295–302.
16. Kashiwagi K, Okubo T, Tsukahara S.: Association of magnetic resonance imaging of anterior optic pathway with glaucomatous visual field damage and optic disc cupping. J Glaucoma. 2014 Jun;13(3):189–195.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology
2020 Issue 3-
All articles in this issue
- TRAUMATOLOGIE V OKULOPLASTICKÉ CHIRURGII PŘEHLEDOVÝ ČLÁNEK
- ZMĚNY FOVEÁLNÍ AVASKULÁRNÍ ZÓNY A MAKULÁRNÍ MIKROVASKULATURY V RÁMCI VYŠETŘENÍ OCT ANGIOGRAFIE U MLADÝCH DIABETIKŮ 1. TYPU (PILOTNÍ STUDIE)
- OCT ANGIOGRAFIE A DOPPLEROVSKÁ SONOGRAFIE U NORMOTENZNÍHO GLAUKOMU
- ŠÍŘE CHIASMATU U NORMOTENZNÍCH A HYPERTENZNÍCH GLAUKOMŮ
- ZEVNÍ OFTALMOMYIÁZA ZPŮSOBENÁ LARVOU STŘEČKA OESTRUS OVIS
- PRES SYNDRÓM
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PRES SYNDRÓM
- ZEVNÍ OFTALMOMYIÁZA ZPŮSOBENÁ LARVOU STŘEČKA OESTRUS OVIS
- TRAUMATOLOGIE V OKULOPLASTICKÉ CHIRURGII PŘEHLEDOVÝ ČLÁNEK
- ZMĚNY FOVEÁLNÍ AVASKULÁRNÍ ZÓNY A MAKULÁRNÍ MIKROVASKULATURY V RÁMCI VYŠETŘENÍ OCT ANGIOGRAFIE U MLADÝCH DIABETIKŮ 1. TYPU (PILOTNÍ STUDIE)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

