-
Medical journals
- Career
Inovativní postupy v léčbě sítnicových onemocnění
Authors: Z. Straňák 1*; B. Kousal 2,3*; T. Ardan 4; M. Veith 1
Authors‘ workplace: Oftalmologická klinika, 3. lékařská fakulta, Univerzita Karlova a Fakultní nemocnice Královské Vinohrady Přednosta: doc. MUDr. Pavel Studený, Ph. D., MHA 1; Oční klinika, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze Přednostka: prof. MUDr. Jarmila Heissigerová, Ph. D., MBA 2; Klinika dětského a dorostového lékařství, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze. Přednosta: prof. MUDr. Tomáš Honzík, Ph. D. 3; Centrum PIGMOD, Ústav živočišné fyziologie a genetiky, Akademie věd České republiky. Ředitel centra: prof. MVDr. Jan Motlík, DrSc. 4
Published in: Čes. a slov. Oftal., 75, 2019, No. 6, p. 287-295
Category: Review Article
doi: https://doi.org/10.31348/2019/6/1Overview
Cíl: Práce seznamuje čtenáře s inovativními postupy v léčbě sítnicových onemocnění, které by se mohly v následujících letech dostat do klinické praxe. Popsány jsou retinální protézy, transplantace retinálního pigmentového epitelu (RPE), genová terapie a optogenetika.
Metodika: Literární rešerše zaměřená na charakteristiky a mechanismy jednotlivých druhů terapií.
Výsledky: Retinální protézy, transplantace RPE, genová terapie a optogenetika nabízejí dosud plně neprobádané možnosti a jsou považovány za budoucnost léčby sítnicových onemocnění tam, kde klasická farmakoterapie či chirurgické možnosti léčby nestačí. Nicméně všechny tyto metody jsou výzvou nejen pro samotné inovativní technické provedení, ale také pro etickou, administrativní a ekonomickou náročnost.
Závěr: V léčbě sítnicových onemocnění nás čeká zajímavá budoucnost a nelze nyní odhadnout, která modalita léčby bude dominantní.
Klíčová slova:
optogenetika – indukované pluripotentní kmenové buňky – retinální protézy – genová terapie
ÚVOD
Sítnice je pro svoji unikátní polohu a dobrou vyšetřitelnost velmi oblíbeným cílem inovativních postupů, především genové terapie, optogenetiky, buněčné terapie a bioniky. V následujícím textu uvedeme principy fungování těchto terapeutických modalit a přehled nynějšího stavu vědění na vybraných příkladech.
CÍL
Seznámit čtenáře s inovativními postupy v léčbě sítnicových onemocnění. Popsány budou retinální protézy, transplantace retinálního pigmentového epitelu (RPE), genová terapie a optogenetika.
METODY
Literární rešerše na dané téma s důrazem na mechanismy fungování jednotlivých léčebných modalit a probíhající klinické studie.
VÝSLEDKY
Buněčná terapie
Věkem podmíněná makulární degenerace (VPMD), Stargardtova choroba nebo například retinitis pigmentosa. Ač odlišné klinické jednotky, ve všech těchto případech nacházíme poškození retinálního pigmentového epitelu (RPE) [5]. Jedná se monovrstvu lokalizovanou na Bruchově membráně zodpovědnou za udržování homeostázy fotoreceptorů. Přes výrazné pokroky ve farmakoterapii sítnicových onemocnění (např. inhibitory vaskulárního endotelového růstového faktoru) se nedaří značné množství pacientů s postižením RPE stabilizovat. Do popředí se tak vzhledem k velkým pokrokům v buněčné terapii dostávají metody transplantace RPE. V posledních letech se těmito postupy zabývá mnoho výzkumných pracovišť, jelikož důkazy ověřující koncept (proof-of-concept) jsou obecně přijímány.
První izolace RPE proběhla již téměř před čtyřiceti lety [12], základní charakteristiky buněk jsou tedy dobře známé. Na rozdíl od jiných buněk sítnice není u RPE k vykonávání funkce třeba synaptické napojení, a proto se i pro snadnou vyšetřitelnost buněk, například pomocí optické koherenční tomografie (OCT), stala transplantace RPE zajímavým cílem pro buněčnou terapii.
Na počátku výzkumu stála snaha o autologní transplantace (např. autologní RPE-choroidální štěp nebo subretinální injektáž suspenze autologních buněk RPE) či o makulární translokace. Přestože někteří autoři popsali částečné zlepšení zrakových funkcí [30], v klinické praxi tyto zákroky nejsou rozšířeny pro vysoký výskyt nežádoucích komplikací (krvácení, proliferativní vitreoretinopatie, odchlípení sítnice, distorze obrazu u makulární translokace, špatná apikobazální orientace u suspenzí buněk) [16,21,40].
Pokrok v operačních technikách a buněčné biologii nyní nabízí možnost transplantovat i jiné než autologní buňky. Nejčastěji se v literatuře setkáváme s lidskými embryonálními kmenovými buňkami (hESC-RPE, human embryonic stem cells) [32] a lidskými indukovanými pluripotentními buňkami (iPSC-RPE, human induced stem cells) [6]. Buňky embryonální získáváme po fertilizacii oocytu odběrem z blastocysty, zatímco indukované pluripotentní buňky získáváme reprogramováním somatické buňky, typicky fibroblastu [36]. Za tento objev byla v roce 2012 udělena Nobelova cena (Shinya Yamanaka, Sir John B. Gurdon). Výsledným produktem obou metod je pluripotentní buňka, kterou můžeme dále směrovat do vývoje v RPE. Hlavní výhodou při užití iPSC-RPE je to, že se jedná o autologní zdroj, proto pacienta není nutno zatěžovat imunosupresí. Naopak nevýhodou je stáří buňky (zdrojová buňka je stejně stará jako pacient, ze kterého je odebrána), stejná genetická výbava (přetrvávání případných genetických abnormalit) a dosud nejistý teratogenní potenciál (chybí dlouhodobá data) [20]. Užití hESC-RPE je výhodné především pokud je žádoucí transplantovat buňky s odlišným genetickým základem (geneticky podmíněné choroby včetně mitochondriálních), nutná je ovšem imunosuprese. Hlavní rozdíly mezi iPSC a hESC shrnuje obrázek 1 a tabulka 1.
Image 1. Základní rozdíly mezi buňkami retinálního pigmentového epitelu (RPE) z embryonálních kmenových buněk a indukovaných pluripotentních kmenových buněk. Zatímco indukované pluripotentní kmenové buňky získáváme ze somatických buněk, typicky mezenchymových buněk kůže dárce (v případě autologní transplantace je dárce zároveň příjemce), buňky embryonální odebíráme z blastocysty po fertilizaci oocytu. Následně pluripotentní buňky kultivujeme za působení vhodných růstových mediátorů směrem do RPE 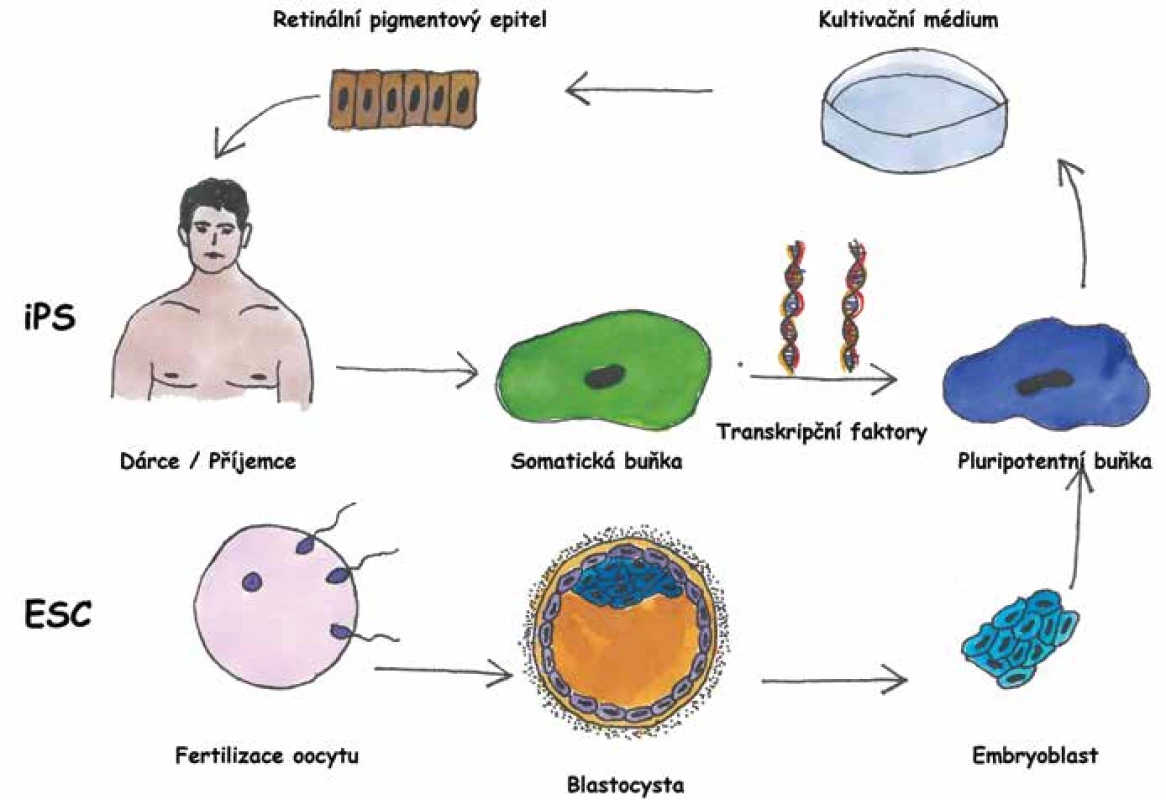
Table 1. Základní rozdíly mezi embryonálními kmenovými buňkami a indukovanými pluripotentními kmenovými buňkami [19] ![Základní rozdíly mezi embryonálními kmenovými buňkami a indukovanými pluripotentními kmenovými buňkami [19]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d2cc1e7440f024ba1dfbeb9ac8ab0228.png)
*v případě autologní transplantace indukovaných pluripotentních kmenových buněk RPE – retinální pigmentový epitel Druhým kritickým okamžikem v buněčné terapii sítnice je operační technika. Dnes jsou ve výzkumu hlavní tři směry: 1. subretinální injekce buněčné suspenze, 2. subretinální implantace buněčného plátu ve formě epitelu, 3. subretinální implantace buněčného plátu na podpůrném nosiči (Obrázek 2). Zatímco injektáž buněčné suspenze je technicky poměrně jednoduchá, nelze zcela odhadnout, zda implantované buňky budou mít správnou apikobazální orientaci a zda budou schopné vytvořit funkční monovrstvu s dostatečnou transepiteliální resistencí (TER, udává odpor měřený mezi apikální a bazální stranou epitelu, hodnota bývá považována za ukazatel integrity epitelu). Na tomto procesu se podílí mj. Bruchova membrána, která bývá u postižených často patologicky změněná [37]. Subretinální implantace buněčného plátu s nebo bez podpůrného nosiče s sebou nese náročnou operační techniku, která je však vyvážena správnou apikobazální orientací a in vitro měřitelným TER, jehož hodnoty nám mohou předem pomoci určit kvalitu implantovaných buněk. Pokud implantujeme bez podpůrného nosiče, buněčný plát se může peroperačně rolovat a buňky se odlupovat. Pokud využijeme podpůrný nosič, je manipulace snazší [21], ale je třeba volit nosič dostatečně porézní, aby nebránil v difúzi živin a odpadních látek.
Image 2. Operační techniky transplantace retinálního pigmentového epitelu. Aplikace buněčné suspenze (A), samonosný buněčný plát (B), buněčný plát na arteficiálním podpůrném nosiči (C) 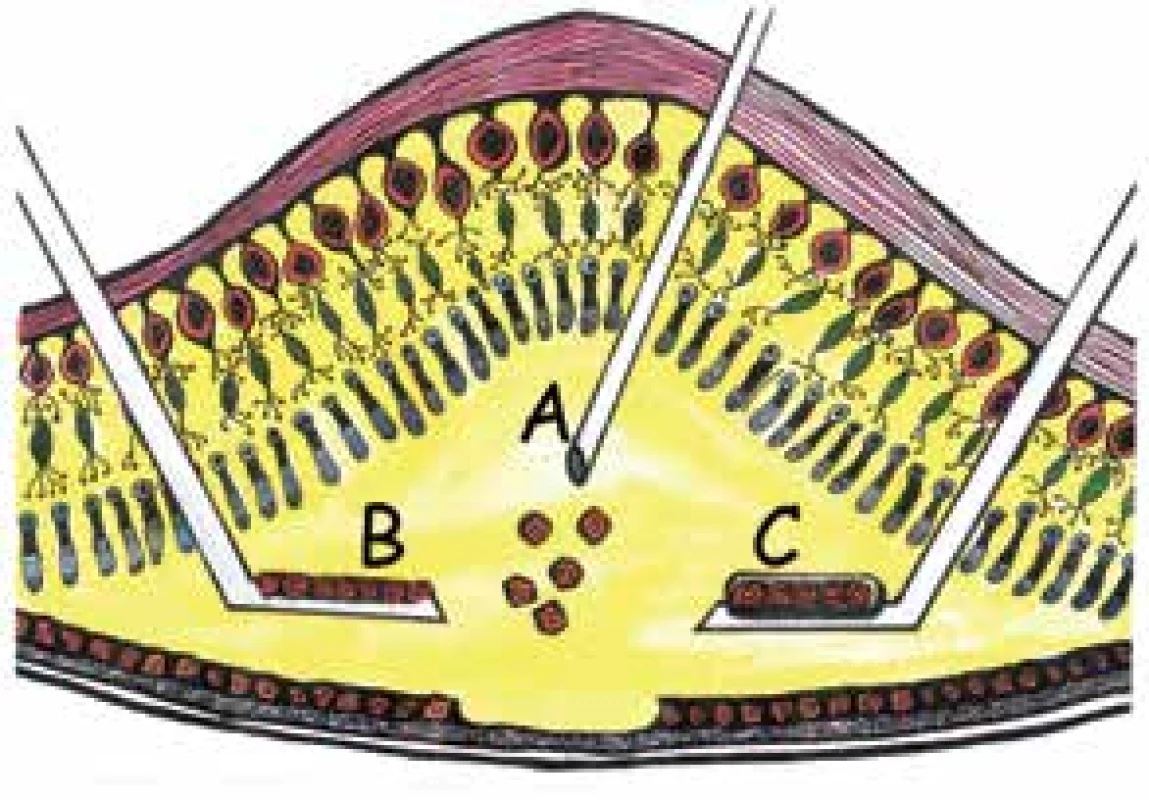
V současné době probíhá více klinických studií, zde představíme jednoho zástupce z každého zkoumaného směru.
V roce 2016 publikoval Schwartz a kol. výsledky subretinální injekce suspenze hESC-RPE do 18 očí 18 pacientů se suchou formou VPMD, Stargardtovou chorobou nebo myopickou makulární degenerací. Buňky byly injikovány do předem vybrané lokality na rozhraní zdravé a nemocné sítnice. Ačkoliv po aplikaci byly na sítnici patrny pigmentové shluky, zvýšená autofluorescence od výchozího stavu, která je považována za aktivitu RPE, byla zjištěna pouze v jednom případě. Přestože se jednalo o studii primárně zaměřenou na bezpečnost, byl u léčených očí ve 12. měsíci zaznamenán zisk 14 písmen optotypů ETDRS (Early Treatment Diabetic Retinopathy Study) oproti zisku 1 písmene u neléčených očí. Frekvence nežádoucích účinků byla relativně nízká (1 endoftalmitida, 1 vitritida). Bylo nutno užít celkovou imunosupresi [33].
O rok později, byla s velkým mediálním ohlasem prezentována studie z Japonska [26], kde byly užity k transplantaci iPSC-RPE. Původně byly odebrány dvěma pacientům s pokročilou vlhkou formou VPMD fibroblasty a z nich následně kultivovány iPSC-RPE. Implantace však proběhla pouze u jednoho z pacientů. Druhý pacient zákrok nepodstoupil z důvodů velkého množství genetických mutací v kultivovaných buňkách a obavám z následného vzniku teratomu. Po roce od implantace byl buněčný plát stabilní, zraková ostrost se ovšem nezměnila. Imunosuprese nutná nebyla [26].
V roce 2018 byla prezentována studie v rámci dosud probíhajícího The London Project to Cure Blindness. Jednalo se o fázi I s užitím hESC-RPE na potaženém syntetickém nosiči [8]. V této práci byly prezentovány výsledky implantace 2 očí 2 pacientů s rozsáhlou subretinální hemoragií, kterým byl implantován subretinálně nosič s monovrstvou hESC-RPE. V obou případech došlo ke zlepšení zrakové ostrosti (ZO) o 29, respektive 21 písmen ETDRS optotypů, nicméně následně došlo u jednoho oka k odchlípení sítnice, která si vyžádala další zákrok, a u jednoho pacienta došlo k dekompenzaci preexistujícího diabetu mellitu vlivem imunosuprese.
K dnešnímu dni nemáme k dispozici výsledky větších klinických studií s užitím kmenových buněk, nicméně vzhledem k prvotním výsledkům a velkému množství probíhajících preklinických studií můžeme očekávat posun v následujících letech. Z hlediska operační techniky se jako nejvýhodnější jeví zákrok s užitím podpůrného nosiče. Obdobné pokusy probíhají i v České republice a po fázi prvotních implantací [31] jsou v Ústavu živočišné fyziologie a genetiky Akademie věd ČR implantovány nanovlákenné nosiče o rozměrech 2 × 5 mm [19] nyní i s iPSC-RPE, či primárním lidským RPE. Výsledky budou k dispozici v následujících měsících.
Retinální protézy
Jedná se o zařízení, která jsou schopna přeměnit světelný signál přicházející do oblasti oka na elektrický stimul přes zařízení umístěné na sítnici. Typickým cílem stimulace nejsou fotoreceptory, které většinou vlivem onemocnění chybí, ale některé výše uložené buňky, jako jsou retinální bipolární buňky (RBCs) a retinální gangliové buňky (RGCs). Částečně je tak narušeno zpracování signálu samotnou sítnicí, kdy je přenos signálu z fotoreceptoru na bipolární buňku a následně gangliovou modifikován velkým množstvím dalších faktorů jako např. amakrinními či horizontálními buňkami (tzn. processing). Retinální protézy se většinou dělí podle umístění na epiretinální, subretinální a suprachoroideální (Obrázek 3). Epiretinální protézy jsou výhodné z hlediska snazšího operačního přístupu a snadné aktivace gangliových buněk. Naopak nevýhodou je zcela nekontrolovatelné zpracování obrazu sítnicí, kdy jsou kromě samotných gangliových buněk aktivovány často i okolo ležící axony, a signál tak nevypadá jako světelný bod [28]. Opačným příkladem jsou subretinální protézy. Zde se musíme připravit na náročnou operační techniku, nicméně aktivovány jsou zbývající fotoreceptory, ev. RBCs, a signál tedy neobchází zpracování v sítnici [22]. Suprachoroideální implantáty jsou používány méně, především pro operační náročnost a větší vzdálenost elektrod od sítnice. Dnes jsou nejčastěji prezentovány implantáty Argus II (Second Sight, Sylmar, USA), Alpha AMS (Retina Implant AG, Reutlingen, Německo) a Photovoltaic Retinal Implant (PRIMA) Bionic Vision System (Pixium vision, Paříž, Francie).
Image 3. Anatomická lokalizace retinálních protéz. Retinální protézy lze implantovat epiretinálně (A), subretinálně (B) nebo suprachoroideálně (C) 
Nejrozšířenějším implantátem je Argus II, který již byl implantován více než 200 pacientům. Jedná se o epiretinální implantát s elektrodami umístěnými v šesti řadách po deseti. Jde o kameru připevněnou na speciálních brýlích generující signál, který je modulován v externím zařízení. Následně je radiofrekvenčně přes cívku přenesen do subkonjuktiválně uloženého příjímače, který se dále přenáší transsklerálně k samotnému implantátu stimulujícímu sítnici [1]. Nejlepší dokumentovaná zraková ostrost byla pouze 20/1260, nicméně implantát výrazně zlepšil orientaci pacienta v prostoru či například hledání předmětů na stole [15]. Mezi nejčastější nežádoucí události patří eroze či dehiscence spojivky, domnělá endoftalmitida nebo hypotonie oka. Byly také hlášeny případy vnímaného nesouladu fixního obrazu z kamery s pohybem očí mimo přímý směr.
Jiný princip využívá PRIMA systém. Speciální brýle s kamerou zaznamenávají obraz, který je poté modulován a pomocí projektoru v brýlích posílán v podobě infračervených paprsků na subretinálně uloženou bezdrátovou fotovoltaickou destičku, která přeměňuje fotovoltaickou energii na energii elektrickou stimulující blízké neurony [22]. Teoreticky je možné s tímto implantátem dosáhnout zrakové ostrosti 20/200. Tříletá klinická studie započala v Evropě a USA (vždy pět pacientů) v roce 2017, resp. 2018, výsledky lze očekávat v roce 2021.
Posledním zástupcem je Alpha AMS. Tento subretinální implantát detekuje světlo a zároveň elektricky stimuluje především bipolární buňky. Energie je dodávána transsklerálním kabelem, který je podkožně veden za ucho a připomíná kochleární implantát. Zde je přes cívku dobíjen. Výhodou tohoto implantátu je respektování očních pohybů. Průměrná zraková ostrost s tímto implantátem je 20/1200, i když byly zaznamenány i hodnoty 20/550 [11,35,42]. Alpha AMS je nyní již nedostupný, jelikož nenaplnil obchodní představy výrobce.
Hlavní rozdíly a specifikace retinálních implantátů jsou shrnuty v tabulce 2 [3].
Table 2. Porovnání nejčastěji užívaných retinálních protéz 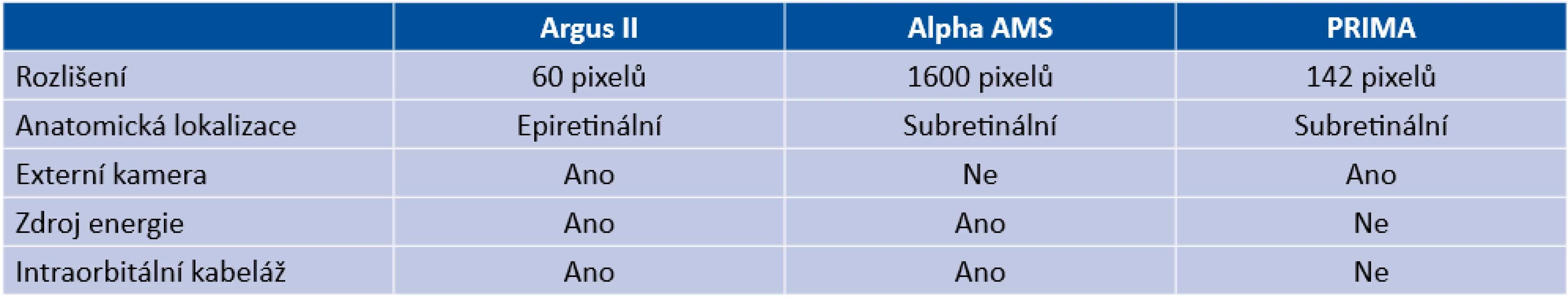
Genová terapie
Možnost stanovení diagnózy na úrovni genu a klinické testování nových cílených terapií umožnily vznik geneticky zaměřené klinické péče v oftalmologii. Terapie založené na znalosti genetické příčiny onemocnění představují zcela nový přístup. Oko je totiž vzhledem ke snadné dostupnosti, malým rozměrům, imunologickému privilegiu, kompartmentalizaci a možnosti kontralaterální kontroly ideálním cílovým orgánem pro klinické hodnocení [9]. Genová terapie je léčebný postup, při němž je do genomu buněk vnesen genetický materiál, který nahrazuje nebo ovlivňuje expresi proteinu účastnícího se patogeneze konkrétního onemocnění. K vývoji a využití genové terapie je třeba určit gen odpovědný za vznik onemocnění a znát jeho funkce. Pokud je příčinou onemocnění nedostatek produktu mutovaného genu, stačí začlenit normální sekvenci genu do genomu příslušných buněk (Obrázek 4A) nebo vnesením terapeutického genu zmírnit projevy onemocnění (Obrázek 4B). Pokud však patologicky působí pozměněný produkt mutovaného genu charakteru aberantního proteinu, je nutné mutovaný gen buď zablokovat (Obrázek 4C) [2], nebo ho opravit (Obrázek 4D) [9,38]. Zároveň léčba nesmí mít negativní dopady na životně důležité funkce organismu.
Image 4. Strategie využívané při genové terapii [8,37] ![Strategie využívané při genové terapii [8,37]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b53ea3107b59d306163fd581709064c3.jpeg)
Genovou terapii lze provádět buď in vivo, kdy jsou cílové buňky po celou dobu léčby součástí organismu, nebo in vitro, kdy jsou cílové buňky z těla organismu odebrány a po provedení léčby vráceny na původní místo [17]. Podmínkou úspěchu je aplikovat léčbu v tzv. terapeutickém okénku, kdy ještě nedošlo k nevratnému poškození tkáně.
Genetická informace se přenáší do cílových buněk pomocí nosičů zvaných vektory. Ideální vektor by měl pronikat do velkého počtu cílových buněk a exprese vneseného genu by měla probíhat po dostatečně dlouhou dobu, aby bylo dosaženo požadovaného terapeutického účinku. Vektor navíc nesmí být pro cílové buňky toxický či vyvolávat u příjemce nežádoucí účinky, jakými jsou virové infekce či autoimunitní reakce [25].
Vektory dělíme na virové a nevirové. Pro řadu nevýhod fyzikálních a chemických vektorů se v současné době v klinických zkouškách, které testují terapie pro onemocnění sítnice u lidí, využívá vektorů virových, zejména adenovirových a retrovirových [25]. Z virových částic jsou odstraněny geny související s patogenitou a množením virů. Geny jsou pak nahrazeny expresní kazetou připravenou úpravou DNA [9].
Riziko použití virových vektorů spočívá v tom, že genetická informace je do genomu příjemce vkládána víceméně náhodně. Tím může dojít k narušení sekvence jiného genu s funkčními následky. Dalším problémem je potenciální imunogenicita virových vektorů způsobující zánětlivé reakce [27]. Opakovaná aplikace terapeutika do subretinální oblasti také nese riziko poškození nebo odchlípení sítnice [4]. Problematické je rovněž stanovení terapeutické dávky a množství aplikovaných virových částic.
Při léčbě onemocnění sítnice se k aplikaci vektorů nejčastěji využívají intravitreální a subretinální injekce. Aplikace do sklivce je sice pro sítnici méně invazivní, ale přenos DNA probíhá zejména ve vnitřních vrstvách sítnice, tedy v buňkách Müllerových a gangliových. Bariéru průniku vektorů a léčiv do větší hloubky sítnice tvoří vnitřní limitující membrána a další sítnicové vrstvy. Pro aplikaci virových vektorů do vrstvy fotoreceptorů a vrstvy buněk RPE je vhodnější subretinální aplikace, kdy je vektor injikován do puchýřku mezi uvedenými vrstvami, a je tak s nimi v těsném kontaktu [4].
Mezi prvními byla pro genovou terapii navržena Leberova kongenitální amauróza 2 (LCA2), a to hlavně kvůli časné manifestaci onemocnění, relativně dlouho zachované struktuře sítnice a dostupnosti zvířecích modelů [24]. LCA2 je autozomálně recesivní choroba vznikající na podkladě mutací v genu RPE65 (retinal pigment epithelium-specific 65 kDa protein) [13]. Tento gen je téměř výlučně exprimován v RPE, kde se podílí na recyklaci opsinu a rodopsinu. Nedostatečná funkce nebo absence RPE65 následně vede k degeneraci fotoreceptorů [7]. Gen RPE65 byl od roku 2007 klinicky testován při zkouškách s genovou terapií [2,14], které vyústily v roce 2017 ve schválení první genové terapie pro klinickou oftalmologickou praxi americkým Úřadem pro kontrolu potravin a léčiv a v roce 2018 Evropskou lékovou agenturou [18].
V České republice se komplexní diagnostice a výzkumu geneticky podmíněných onemocnění oka věnuje Centrum klinické oční genetiky 1. LF UK a VFN v Praze.
Optogenetika
V nejširším slova smyslu je optogenetika definována jako technika, při které je pomocí vektoru do neuronové buňky vnesen gen kódující protein senzitivní na světlo, s jehož pomocí je následně cílová buňka stimulována. V očním lékařství se typicky jedná o vložení světločivého proteinu do některé ze subpopulací buněk sítnice [39], které primárně nemají světločivou funkci.
V praxi je nejdříve třeba najít vhodný fotosenzitivní protein, který následně vložíme do vhodného vektoru (nejčastěji adenovirového) a zacílíme na správnou buňku. Posledním krokem je odpovídající „osvícení“ takto ošetřené sítnice.
Jako světločivý protein lze využít dva typy opsinu: typ 1 (mikrobiální) nebo typ 2 (zvířecí). Nejčastěji se využívá typ 1, který má mnoho poddruhů, ale v zásadě se vždy jedná o iontový kanál, který lze aktivovat světlem (např. channelrhodopsin, halorodopsin, archeorhodopsin) [10]. Po aktivaci iontového kanálu dochází ke změně v polarizaci buňky a následně k přenosu signálu dále. Typ 2 je fotosenzitivní protein spřažený s G-proteinem. Po aktivaci probíhá intracelulární signální kaskáda chemických přeměn s výsledným otevřením spřaženého kationtového kanálu. Hlavní výhodou typu 1 oproti typu 2 je jednodušší molekula obsahující přímo iontový kanál, nevýhodou pak často vyšší nároky na intenzitu světla nutnou ke změně polarizace buňky.
V lidské sítnici nalézáme více než sto různých druhů neuronálních buněk [41], které spolu do určité míry interagují, a tím zajišťují komplexní zpracování obrazu ještě před odesláním signálu dále do centrální nervové soustavy prostřednictvím axonů gangliových buněk. Veškeré snahy o nedodržení přirozeného postupu fotoreceptor-bipolární buňka-gangliová buňka proto povedou k narušení sítnicového zpracování obrazu, a tím ke snížení jeho kvality. Naše snahy proto vždy cílí na co nejzevnější vrstvy sítnice [34]. Je možné užít poškozené fotoreceptory, které již nemají zevní segmenty (zde je výhodou zachované zpracování signálu sítnicí), nebo při obejití tohoto mechanismu rovnou bipolární a ev. gangliové buňky (Obrázek 5).
Image 5. Optogenetika cílená na buňky sítnice. Inkorporace fotosenzitivního receptoru, v tomto případě channelrhodopsinu, do buněčné membrány bipolární buňky 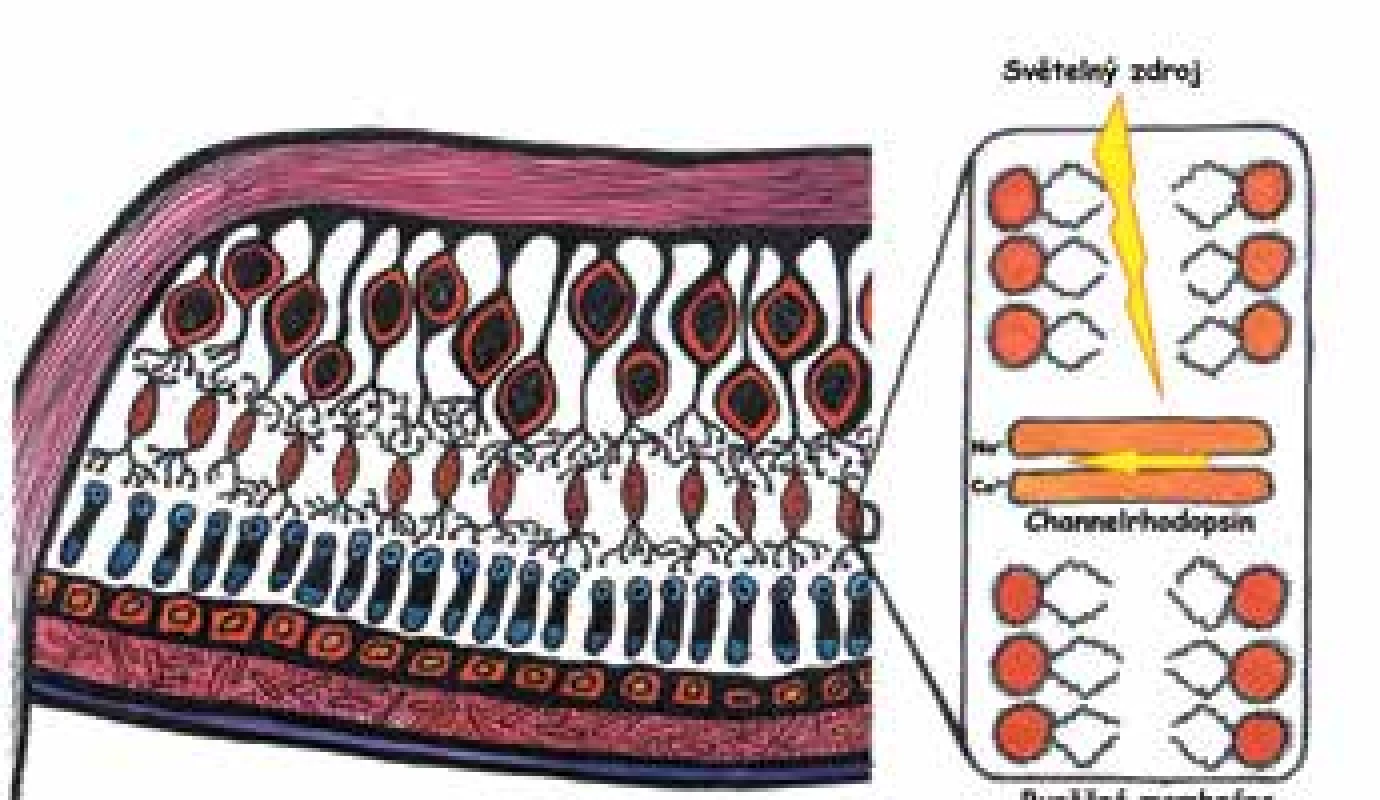
Posledním krokem je zachycení světla ošetřenou buňkou. Různé kanály jsou citlivé na různé vlnové délky světla. To je třeba mít na zřeteli s ohledem na možnost fototoxicity. Například channelrhodopsin je nejcitlivější v krátkých vlnových délkách a vyžaduje, tak jako většina kanálů typu 1, větší počet zásahů fotony. To spolu s nižším podílem modrého světla obzvláště za zhoršených světelných podmínek a nižší propustností těchto vlnových délek optickými prostředími oka [29] vyžaduje pro správné fungování nutnost vyšší intenzity světla v těchto vlnových délkách. Toho lze dosáhnout pouze pomocí externího světelného zdroje, což může mít nepříznivý vliv v důsledku fototoxicity.
Nyní jsou v mezinárodním registru klinických studií „https://clinicaltrials.gov“ registrovány dvě probíhající studie.
Fáze I/II sponsorovaná firmou Allergan (NCT02556736) je určena pro pacienty s pokročilou retinitis pigmentosa, kterým je intravitreálně injikován vektor kódující channelrhodopisin k modulaci gangliových buněk sítnice (látka RST-001). V době psaní článku stále probíhal nábor pacientů s předpokládaným konečným počtem 21.
GenSight Biologics nyní nabírá pacienty pro studii s látkou GS030-DP (NCT03326336), což je modifikovaný adenovirový vektor pro modifikovaný channelrhodopsin, který má citlivost posunutou více do červeného spektra [23], což teoreticky zaručuje lepší bezpečnostní profil z hlediska fototoxicity. Do projektu je zapojena také společnost Pixium Vision (viz PRIMA systém výše) a zdá se, že kombinace optogenetiky a brýlí augmentující realitu (tzn. přirozený obraz je doplněn o digitální vrstvu, která umožňuje například zvýraznit některé předem definované objekty) je slibnou cestou pro posílení účinku.
DISKUSE
Přestože genová terapie, optogenetika, buněčná terapie a bionické oko jsou spíše záležitostí více či méně vzdálené budoucnosti a nesou s sebou velké množství nevyřešených otázek jako např. financování, efektivitu, indikační kritéria, etické problémy nebo technologickou náročnost, několika prvních komerčních úspěchů již bylo dosaženo. Schválení voretigen neparvovec-rzylu, jakožto prvního přípravku pro kauzální léčbu geneticky podmíněného onemocnění, otevřelo cestu dalším nadějným produktům. Lze se tedy domnívat, že podobné léčivé přípravky se budou postupně dostávat na trh a bude umožněna léčba stále většího počtu klinických jednotek.
Dalším dobrým příkladem je implantát Argus II, jehož rozlišení 6 × 10 elektrod dnes nikoho neohromí, přesto je toto zařízení považováno za hybatele a potvrzení správnosti konceptu oboru („proof of concept“). Zároveň se ukázalo jako technologicky velice spolehlivé, přičemž se v prvních třech letech klinické praxe nevyskytla žádná komplikace způsobená poruchou přístroje [15]. To vedlo k dalšímu vývoji pokročilejších systémů, které jsou nyní ve fázi klinického hodnocení (NCT03344848).
Velké naděje jsou vkládány do buněčné terapie, která je ovšem oproti „exaktním“ elektronickým implantátům obtížněji uchopitelná a je zde obrovská variabilita výsledků vzhledem k rozdílné kvalitě implantovaných buněk a možným komplikacím v průběhu velmi náročných operačních zákroků. Stále panuje nejistota ohledně bezpečnostního profilu buněk a obavy z možné teratogenity. Nejasné jsou i otázky etické. Ani implantační techniky nejsou jednotné a velké diskuze se odehrávají nad arteficiálními nosiči pro RPE, kdy na jednu stranu se při použití nosiče výrazně zlepšuje manipulace s buňkami, včetně laboratorní fáze, ale na druhou stranu se jedná o umělou bariéru, která brání difúzi látek z i do sítnice. Určitým východiskem z tohoto problému by mohlo být použití nanotechnologií při výrobě nosiče. Další nejasnou otázkou je, zda peroperačně odsávat či neodsávat původní buňky RPE, zde data chybí zcela.
Optogenetika se jeví jako zajímavá metoda, nicméně na první konkrétní výsledky zatím čekáme. Nevýhodou je nízká senzitivita pro světlo a zdá se, že tato metoda bude muset být doplněna o externí zdroj světla nebo např. brýle umožňující vysílat na sítnici obraz augmentované reality i v jiném vlnovém spektru, než je viditelné světlo, a to za předpokladu, že jsou fotosenzitivní kanály na takovou vlnovou délku citlivé.
ZÁVĚR
V následujících letech nás čeká fascinující pokrok v léčbě sítnicových onemocnění, kdy největší výzvou možná nebudou technologie, ale správná indikace pro zvolení jedné z popsaných metod, které se budou v konečném důsledku doplňovat, a nabídnou tak alternativu pro pacienty, kterým v současnosti pomoci nelze.
*První a druhý autor se na článku podíleli stejnou měrou.
Prezentováno na 19. setkání České společnosti mladých oftalmologů, Železná Ruda, 21.–22. 6. 2019.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou.
Práce byla podpořena granty SVV UK 260367/2017, GAČR 18-04393S a Národním programem udržitelnosti LO1609.
MUDr. Zbyněk Straňák
Oftalmologická klinika, 3. lékařská fakulta, UK a FN Královské Vinohrady
Šrobárova 50, 100 34 Praha 10
Do redakce doručeno dne: 1. 10. 2019
Do tisku přijato dne: 6. 11. 2019
Sources
1. Ahuja, AK., Yeoh, J., Dorn, JD., et al.: Factors Affecting Perceptual Threshold in Argus II Retinal Prosthesis Subjects. Transl Vis Sci Technol, 2; 2013 : 1.
2. Bainbridge, JWB., Mehat, MS., Sundaram, V., et al.: Long-term effect of gene therapy on Leber’s congenital amaurosis. N Engl J Med, 372; 2015 : 1887–1897.
3. Bloch, E., Luo, Y., da Cruz, L.: Advances in retinal prosthesis systems. Ther Adv Ophthalmol, 11; 2019 : 1–16.
4. Boye, SE., Boye, SL., Lewin, AS., et al.: A comprehensive review of retinal gene therapy. Mol Ther J Am Soc Gene Ther, 21; 2013 : 509–519.
5. Bressler, NM., Bressler, SB., Fine, SL.: Age-related macular degeneration. Surv Ophthalmol, 32; 1988 : 375–413.
6. Carr, A-JF., Smart, MJK., Ramsden, CM., et al.: Development of human embryonic stem cell therapies for age-related macular degeneration. Trends Neurosci, 36; 2013 : 385–395.
7. Cideciyan, AV.: Leber congenital amaurosis due to RPE65 mutations and its treatment with gene therapy. Prog Retin Eye Res, 29; 2010 : 398–427.
8. da Cruz, L., Fynes, K., Georgiadis, O., et al.: Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nat Biotechnol, 36; 2018 : 328–337.
9. Dudakova, L., Kousal, B., Kolarova, H., et al.: Gene therapy for inherited retinal and opticnerve disorders: current knowledge. Cesk Slov Oftalmol. 72; 2016; 128–136.
10. Duebel, J., Marazova, K., Sahel, J-A.: Optogenetics. Curr Opin Ophthalmol, 26; 2015 : 226–232.
11. Edwards, TL., Cottriall, CL., Xue, K., et al.: Assessment of the Electronic Retinal Implant Alpha AMS in Restoring Vision to Blind Patients with End-Stage Retinitis Pigmentosa. Ophthalmology, 125; 2018 : 432–443.
12. Flood, MT., Gouras, P., Kjeldbye, H.: Growth characteristics and ultrastructure of human retinal pigment epithelium in vitro. Invest Ophthalmol Vis Sci, 19; 1980 : 1309–1320.
13. Gu, SM., Thompson, DA., Srikumari, CR., et al.: Mutations in RPE65 cause autosomal recessive childhood-onset severe retinal dystrophy. Nat Genet, 17; 1997 : 194–197.
14. Hauswirth, WW., Aleman, TS., Kaushal, S., et al.: Treatment of leber congenital amaurosis due to RPE65 mutations by ocular subretinal injection of adeno-associated virus gene vector: short-term results of a phase I trial. Hum Gene Ther, 19; 2008 : 979–990.
15. Ho, AC., Humayun, MS., Dorn, JD., et al.: Long-Term Results from an Epiretinal Prosthesis to Restore Sight to the Blind. Ophthalmology, 122; 2015 : 1547–1554.
16. Chen, FK., Patel, PJ., Uppal, GS., et al.: Long-term outcomes following full macular translocation surgery in neovascular age-related macular degeneration. Br J Ophthalmol, 94; 2010 : 1337–1343.
17. Kaufmann, KB., Buning, H., Galy, A., et al.: Gene therapy on the move. EMBO Mol Med, 5; 2013 : 1642–1661.
18. Kousal, B., Ďuďáková, Ľ., Moravíková, J., et al.: Vzácná oční onemocnění v oftalmologické praxi. Oftalmol Praxi, 2018 : 7–11.
19. Kozak, I., Stranak, Z., Popelka, S., et al.: Safety and feasibility of new nanofiber subretinal delivery system with injector for RPE cell transplantation. Invest Ophthalmol Vis Sci, 59; 2018 : 5670–5670.
20. Kvanta, A., Grudzinska, MK.: Stem cell-based treatment in geographic atrophy: promises and pitfalls. Acta Ophthalmol (Copenh), 92; 2014 : 21–26.
21. Lee, E., MacLaren, RE.: Sources of retinal pigment epithelium (RPE) for replacement therapy. Br J Ophthalmol, 95; 2011 : 445–449.
22. Lorach, H., Goetz, G., Smith, R., et al.: Photovoltaic restoration of sight with high visual acuity. Nat Med, 21; 2015 : 476–482.
23. Mace, E., Caplette, R., Marre, O., et al.: Targeting channelrhodopsin-2 to ON-bipolar cells with vitreally administered AAV Restores ON and OFF visual responses in blind mice. Mol Ther J Am Soc Gene Ther, 23; 2015 : 7–16.
24. Maguire, AM., Simonelli, F., Pierce, EA., et al.: Safety and efficacy of gene transfer for Leber’s congenital amaurosis. N Engl J Med, 358; 2008 : 2240–2248.
25. Mali, S.: Delivery systems for gene therapy. Indian J Hum Genet, 19; 2013 : 3–8.
26. Mandai, M., Watanabe, A., Kurimoto, Y., et al.: Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration. N Engl J Med, 376; 2017 : 1038–1046.
27. Misra, S.: Human gene therapy: a brief overview of the genetic revolution. J Assoc Physicians India, 61; 2013 : 127–133.
28. Nanduri, D., Fine, I., Horsager, A., et al.: Frequency and amplitude modulation have different effects on the percepts elicited by retinal stimulation. Invest Ophthalmol Vis Sci, 53; 2012 : 205–214.
29. von Noorden, GK.: Application of basic research data to clinical amblyopia. Ophthalmology, 85; 1978 : 496–504.
30. Parolini, B., Di Salvatore, A., Pinackatt, SJ., et al.: Long-term results of autologous retinal pigment epithelium and choroid transplantation for the treatment of exudative and atrophic maculopathies. Retina, 2018.
31. Popelka, S., Studenovska, H., Abelova, L., et al.: A frame-supported ultrathin electrospun polymer membrane for transplantation of retinal pigment epithelial cells. Biomed Mater Bristol Engl, 10; 2015 : 045022.
32. Ramsden, CM., Powner, MB., Carr, A-JF., et al.: Stem cells in retinal regeneration: past, present and future. Dev Camb Engl, 140; 2013 : 2576–2585.
33. Schwartz, SD., Tan, G., Hosseini, H., et al.: Subretinal Transplantation of Embryonic Stem Cell-Derived Retinal Pigment Epithelium for the Treatment of Macular Degeneration: An Assessment at 4 Years. Invest Ophthalmol Vis Sci, 57; 2016: ORSFc1-9.
34. Simunovic, MP., Shen, W., Lin, JY., et al.: Optogenetic approaches to vision restoration. Exp Eye Res, 178; 2019 : 15–26.
35. Stingl, K., Bartz-Schmidt, KU., Besch, D., et al.: Arteficial vision with wirelessly powered subretinal electronic implant alpha-IMS. Proc Biol Sci, 280; 2013 : 1–8.
36. Takahashi, K., Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126; 2006 : 663–676.
37. Tezel, TH., Kaplan, HJ., Del Priore, LV.: Fate of human retinal pigment epithelial cells seeded onto layers of human Bruch’s membrane. Invest Ophthalmol Vis Sci, 40; 1999 : 467–476.
38. Wang, D., Gao, G.: State-of-the-art human gene therapy: part II. Gene therapy strategies and clinical applications. Discov Med, 18; 2014 : 151–161.
39. Yue, L., Weiland, JD., Roska, B., et al.: Retinal stimulation strategies to restore vision: Fundamentals and systems. Prog Retin Eye Res, 53; 2016 : 21–47.
40. van Zeeburg, EJT., Maaijwee, KJM., Missotten, TOAR., et al.: A free retinal pigment epithelium-choroid graft in patients with exudative age-related macular degeneration: results up to 7 years. Am J Ophthalmol, 153; 2012 : 120-127.e2.
41. Zeng, H., Sanes, JR.: Neuronal cell-type classification: challenges, opportunities and the path forward. Nat Rev Neurosci, 18; 2017 : 530–546.
42. Zrenner, E., Bartz-Schmidt, KU., Benav, H., et al.: Subretinal electronic chips allow blind patients to read letters and combine them to words. Proc Biol Sci, 278; 2011 : 1489–1497.
Děkuji Mgr. Štěpánce Elišce Straňákové za přípravu obrázků 1, 2, 3 a 5.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2019 Issue 6-
All articles in this issue
- 100 let od narození prof. MUDr. Heleny Lomíčkové, DrSc. 40 let oční kliniky dětí a dospělých v Motole
- OCENĚNÍ ČLS JEP
- CENA PREZIDENTA ČLK
- Inovativní postupy v léčbě sítnicových onemocnění
- Posouzení účinnosti fotodynamické terapie u pacientů s chronickou centrální serózní chorioretinopatií
- Senzitivita a specificita metod pro měření astigmatismu oka
- Hodnocení rozptylu světla na sítnici, zrakové ostrosti, refrakce a subjektivní spokojenosti u pacientů po implantaci nitrooční čočky Acrysof IQ PanOptix
- Edém mihalníc ako prvý príznak lymfómového ochorenia
- OČNÍ PROJEVY PŘI CELKOVÉM ONEMOCNĚNÍ ROSACEA
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OČNÍ PROJEVY PŘI CELKOVÉM ONEMOCNĚNÍ ROSACEA
- Edém mihalníc ako prvý príznak lymfómového ochorenia
- Posouzení účinnosti fotodynamické terapie u pacientů s chronickou centrální serózní chorioretinopatií
- Inovativní postupy v léčbě sítnicových onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

