-
Medical journals
- Career
Vybrané prognostické faktory malígneho melanómu uvey
: Z. Svetlošáková 1; V. Krásnik 1; H. Gergišáková 2; P. Babál 2; P. Kusenda 1
: Klinika oftalmológie LFUK, Bratislava, prednosta doc. MUDr. Vladimír Krásnik, PhD. 1; Ústav patologickej anatómie LFUK, prednosta prof. MUDr. Ľudovít Danihel, PhD. 2
: Čes. a slov. Oftal., 68, 2012, No. 1, p. 38-42
: Original Article
Malígny melanóm uvey (MMU) je najčastejšie sa vyskytujúci primárny vnútroočný nádor u dospelých. Napriek veľmi dobrým výsledkom lokálnej liečby MMU, nedošlo v posledných desaťročiach k významnej zmene dĺžky prežívania pacientov s týmto ochorením.
Hlavnou príčinou úmrtia je metastatický rozsev, ku ktorému dochádza v rôznom časovom období od stanovenia diagnózy až u 50 % pacientov. Od momentu objavenia metastáz sa priemerné prežívanie skracuje na menej ako 6 mesiacov.
Rozvoj metastáz súvisí s prítomnosťou viacerých prognostických faktorov. Bežne používané klinické a histopatologické prognostické faktory ako vek, veľkosť, lokalita, extrasklerálny rast, histopatologický typ, vaskularizácia nádoru alebo infiltrácia emisárií skléry je v súčasnosti možné doplniť o ďalšie prognostické faktory využitím imunologických, molekulovo-biologických, imunohistochemických a cytogenetických metód.
Súčasný výskum sa taktiež zameriava na vyvinutie adjuvantnej systémovej liečby, ktorá by oddialila, prípadne zabránila rozvoju metastáz a to najmä u pacientov, u ktorých je takýto priebeh ochorenia vysoko pravdepodobný. Na vyčlenenie týchto „rizikových“ pacientov je potrebné stanovenie spoľahlivých prognostických faktorov. V nasledujúcom článku ponúkame stručný prehľad známych prognostických faktorov MMU.Kľúčové slová:
malígny melanóm uvey, metastázy, prognostické faktoryÚvod
Malígny melanóm uvey (MMU) je najčastejšie sa vyskytujúci primárny vnútroočný nádor u dospelých. Môže byť lokalizovaný v dúhovke (6–9 %), vo vráskovci (9–16 %) a najčastejšie v choroidei (75–85 %) (18). Priemerná vekovo štandardizovaná incidencia MMU v heterogénnej populácii, akou disponujú Spojené štáty americké, je 5,1 na 1 milión obyvateľov (37). Najvyšší výskyt bol zaznamenaný vo vekovej skupine 60 až 64 rokov (35). Častejší výskyt MMU bol zaznamenaný u mužov a pacientov prislúchajúcich k bielej rase, ktorí tvoria viac ako 90 % prípadov MMU (35).
Liečba
Možnosti súčasnej liečby MMU možno rozdeliť na bulbus zachovávajúce (pozorovanie s fotografiou očného pozadia, fotokoagulácia, laserkoagulácia, termoterapia, rádioterapia, mikrochirurgická resekcia) a radikálne postupy (enukleácia bulbu, exenterácia orbity) (14, 20). Trendom súčasnej liečby MMU je predísť rozvoju metastatického ochorenia so zachovaním kozmeticky akceptovateľného oka s užitočným videním. Výber liečby je individuálny a zohľadňuje tak lokálny nález (lokalitu, veľkosť, charakter nádoru) ako aj celkový stav pacienta (19).
Napriek veľmi dobrým výsledkom lokálnej liečby MMU nedokážeme súčasnými metódami zabrániť rozvoju smrteľného metastatického ochorenia. Malígny melanóm uvey ako aj jeho metastázy je rezistentný na systémovú liečbu a doterajšie výsledky chemoterapie a imunoterapie sú neuspokojivé. Nakoľko nebola doposiaľ zrealizovaná prospektívna randomizovaná štúdia, porovnávajúca efektívnosť rôznych typov liečby metastáz MMU (chirurgická excízia, chemoterapia aplikovaná do arteria hepatica, transarteriálna embolizácia, imunoembolizácia, izolovaná hepatálna perfúzia a perkutánna hepatálna perfúzia), výber terapie metastatického MMU závisí od dostupnosti liečebných modalít a skúseností jednotlivých pracovísk (31).
Prognóza
Napriek veľmi dobrým výsledkom lokálnej liečby MMU, nedošlo v posledných desaťročiach k významnej zmene dĺžky prežívania pacientov s týmto ochorením (36). Metastatický rozsev je hlavnou príčinou úmrtia pacientov s MMU. Metastázy sa rozvinú v rôznom časovom období od stanovenia diagnózy až u 50 % pacientov a súvisí s prítomnosťou viacerých prognostických faktorov. Kumulatívny výskyt metastáz sa v štúdii Collaborative Ocular Melanoma Study Group (COMS) v odstupe 5 rokov od liečby pohyboval na úrovni 25 % a v odstupe 10 rokov od liečby na úrovni 34 % (9). Malígny melanóm uvey metastázuje výlučne hematogénnou cestou, nakoľko uvea neobsahuje lymfatické cievy. Najčastejším miestom výskytu metastáz je pečeň (90 %), pľúca (24 %), kosti (16 %), zriedkavo koža, podkožie, a CNS (8, 23). Anatomická lokalita metastáz výrazne ovplyvňuje dĺžku prežívania pacientov. Extrahepatálny výskyt metastáz sa spája s významne dlhším prežívaním (medián 19–28 mesiacov) (4). Vo väčšine prípadov sa však metastázy vyskytujú práve v pečeni, čo má za následok 1-ročné prežívanie len u približne 10–15 % pacientov (4). Lokálna progresia nádorového procesu do orbity po enukleácii alebo rádioterapii je veľmi zriedkavá (16).
Hľadanie príčiny rozvoja metastáz, neovplyvniteľného lokálnou liečbou primárneho nádoru oka, je predmetom viacerých prác. V súčasnosti sa však viacerí odborníci zhodujú v názore, že vznik metastáz je podmienený mikrometastázami prítomnými ešte pred zahájením lokálnej liečby. Tieto metastázy ostávajú skryté aj dlhšiu dobu, až kým sa nevyvinú v detekovateľnú formu metastatického ochorenia (12). Vo svetle týchto zistení sa súčasný výskum zameriava na vyvinutie adjuvantnej systémovej liečby, ktorá by oddialila, prípadne zabránila progresii mikrometastáz do neliečiteľnej makrometastatickej formy ochorenia, a to najmä u pacientov, u ktorých je prítomnosť takýchto mikrometastáz vysoko pravdepodobná. Na vyčlenenie týchto „rizikových“ pacientov je potrebné stanovenie spoľahlivých prognostických faktorov.
Prognostické faktory
Klinické prognostické faktory
V priebehu posledných desaťročí poukázali viacerí autori na skutočnosť, že MMU väčších rozmerov majú vyššiu pravdepodobnosť rozvoja metastáz ako malé MMU (9). Nádory corpus ciliare a choroidey rozdeľujeme na základe pravidiel 7. vydania TNM klasifikácie American Joint Committee on Cancer (AJCC) z roku 2010 (10). Štádium jednotlivých kategórií T, N, M sa stanovuje na základe klinických znakov s prípadným doplnením ďalšími vyšetreniami (tabuľka 1).
1. TNM klasifikácia MMU vráskovca a cievovky (časť „T“) podľa AJCC. Podľa Edge a kol. 2010 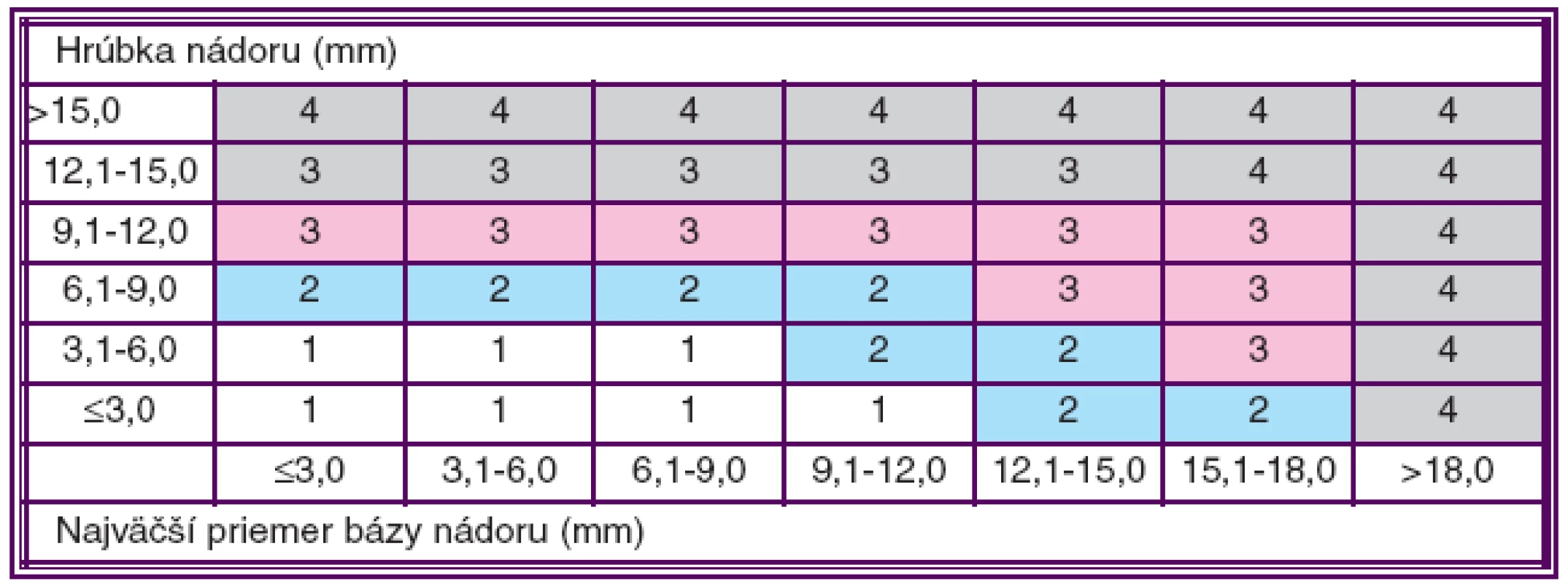
Okrem veľkosti ovplyvňuje prognózu aj tvar nádoru (obr. 1). Za agresívnejšie sa považujú difúzne formy rastu MMU, a v prípade MM dúhovky a corpus ciliare tiež prstencový rast nádoru.
1. Malígny melanóm corpus ciliare v štádiu T3N0M0 so subluxáciou šošovky a prerastaním do prednej očnej komory 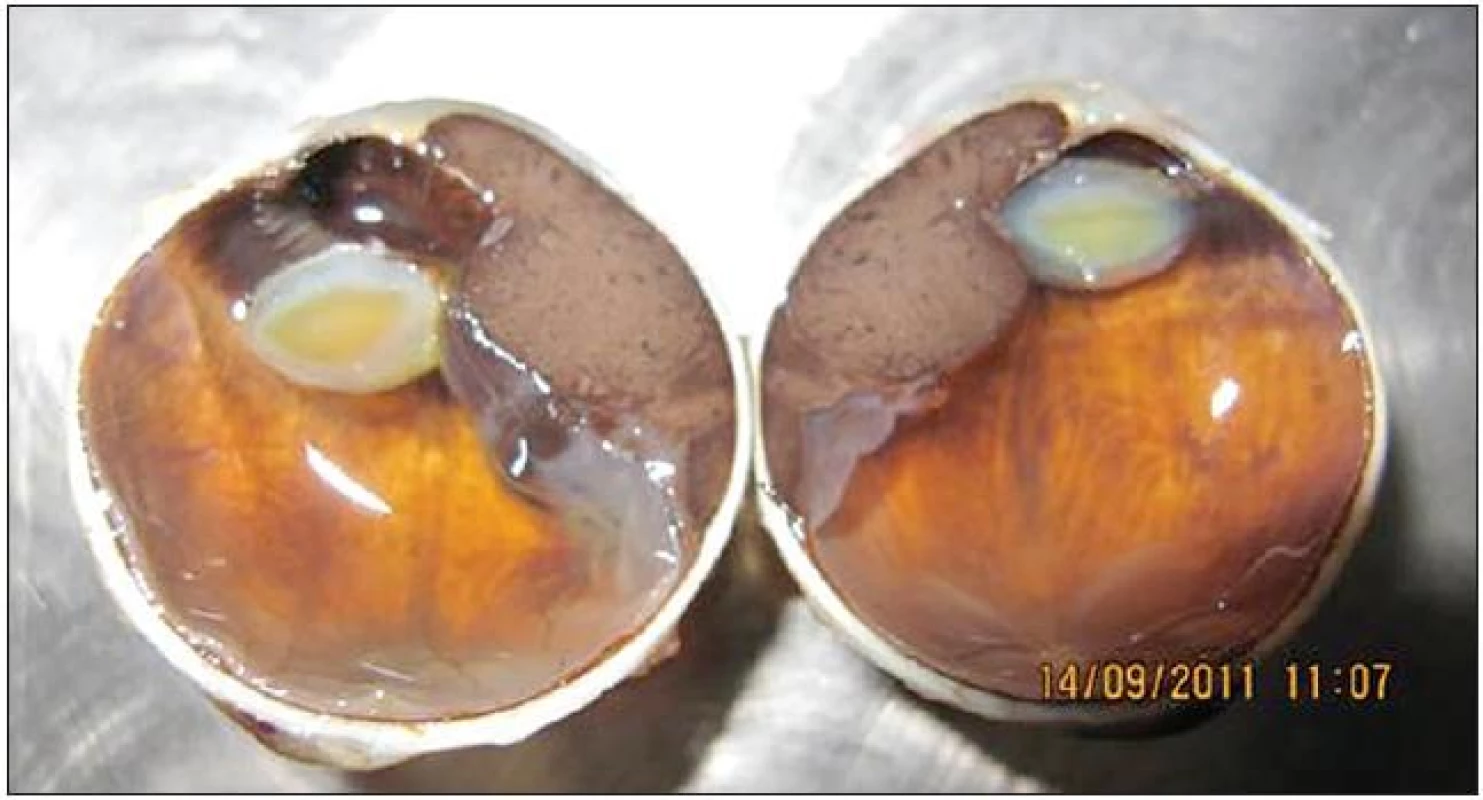
S prognózou ochorenia súvisí aj anatomická lokalita MMU. Malígny melanóm dúhovky má v porovnaní s MM corpus ciliare a MM choroidey lepšiu prognózu (17). Jednou z príčin je pravdepodobne menšia veľkosť v čase stanovenia diagnózy. Zdá sa však, že MM dúhovky má aj nižší metastatický potenciál. Geisse a Robertson (21) vo svojom súbore 1043 pacientov opísali výskyt metastáz 3–5 % pri 10-ročnom sledovaní. Pri interpretácii týchto výsledkov je však potrebná opatrnosť, nakoľko MM dúhovky je zriedkavé ochorenie a vo viacerých štúdiach sa pacienti stratili zo sledovania (21). Dánski autori zaznamenali úmrtie spôsobené metastázami u 10 % pacientov v súbore 81 pacientov, a to bez straty sledovaných pacientov (26). Viacerí autori zaznamenali dlhšie prežívanie pacientov s nodulárnym MM dúhovky v porovnaní s pacientami s difúznym MM zasahujúcim do strómy dúhovky (33).
Medzi ďalšie klinické prognostické faktory možno zahrnúť infiltráciu emisárií skléry, extrasklerálne šírenie, okraj nádoru siahajúci pred ekvátor bulbu, vyšší vek pacienta, mužské pohlavie a neovaskulárny glaukóm.
Histopatologické a cytomorfologické prognostické faktory
Cytologickú a histopatologickú klasifikáciu MMU, zohľadňujúcu prognózu, pôvodne navrhli Callender a kol. (6). Táto klasifikácia rozlišuje dva základné bunkové typy MMU (vretenobunkový a epiteloidný) a je základom v súčasnosti akceptovanej cytologickej klasifikácie MMU podľa WHO (7). Agresívnejším charakterom a zvýšeným rizikom rozvoja metastáz sa vyznačuje epiteloidný bunkový typ MMU. Nepriaznivý prognostický faktor predstavuje aj extrasklerálne šírenie nádoru ako aj infiltrácia emisárií skléry.
Folberg a kol. (13) zaznamenali význam typu vaskularizácie nádoru ako prognostického faktora MMU. Novotvorba ciev je jednak odpoveďou hostiteľa na nádor a na druhej strane aj nevyhnutný krok v procese hematogénneho šírenia metastáz. Použitím farbenia histologických rezov metódou PAS (periodic acid-Schiff) vypracovali klasifikáciu s 9 typmi vaskularizácie, ktoré neskôr zjednodušili McLean a kol. (28) na tri kategórie podľa prítomnosti sľučiek, kedy sľučky môžu byť prítomné, neprítomné alebo nejednoznačne prítomné. Pozitívny nález cievnych sľučiek alebo cievnych sietí kdekoľvek v tkanivovom reze predstavuje nepriaznivý prognostický faktor. Maniotis a kol. (27) v roku 1999 opísali nový proces tvorby cievneho riečiska u ľudského melanómu in vitro aj in vivo. Tento proces pomenovali „vasculogenic mimicry“ a v súčasnosti sa pokladá za jeden z markerov agresívneho správania sa primárnych i metastatických melanómov. „Vasculogenic mimicry“ predstavuje mikrocirkulačné riečisko pozostávajúce z extracelulárnej matrix ohraničenej nádorovými bunkami bez prítomnosti endotelových buniek.
Proliferácia nádorových buniek malígneho melanómu uvey
Viaceré štúdie potvrdili, že stanovenie počtu bunkových mitóz, značenie syntézy DNA (stanovenie frakcie S-fázy DNA) pomocou prietokovej cytometrie a zmeny organizačných oblastí jadierka majú významný vzťah k prognóze MMU.
Imunohistochémia je v porovnaní so stanovením frakcie S-fázy presnejšia metóda vyhodnocovania proliferačnej aktivity. Medzi používané proliferačné markery patria Ki-67 a PCNA, ktoré sa u MMU spájajú so smrťou spôsobenou metastázami (32). Jadrový antigén Ki-67 je exprimovaný počas aktívnych fáz bunkového cyklu a nie je detegovateľný počas pokojovej fázy bunky (obrázok 2). Medzi faktory spájajúce sa s pozitivitou Ki-67 patrí expresia p53, veľký rozmer nádoru, epiteloidný bunkový typ, niektoré typy vaskularizácie a kratšie prežívanie (2).
2. Imunohistochemické vyšetrenie expresie Ki-67 a p53. Vyšetrenie expresie Ki-67 dokumentuje proliferačnú aktivitu MMU. V histologickom preparáte je pozitívnych do 10 % jadier, čo znamená priaznivú prognózu. V prípade p53 predstavuje farbenie jadier v 85% zvýšenú expresiu p53 a svedčí pre menej priaznivú prognózu. Zväčšenie 400x. 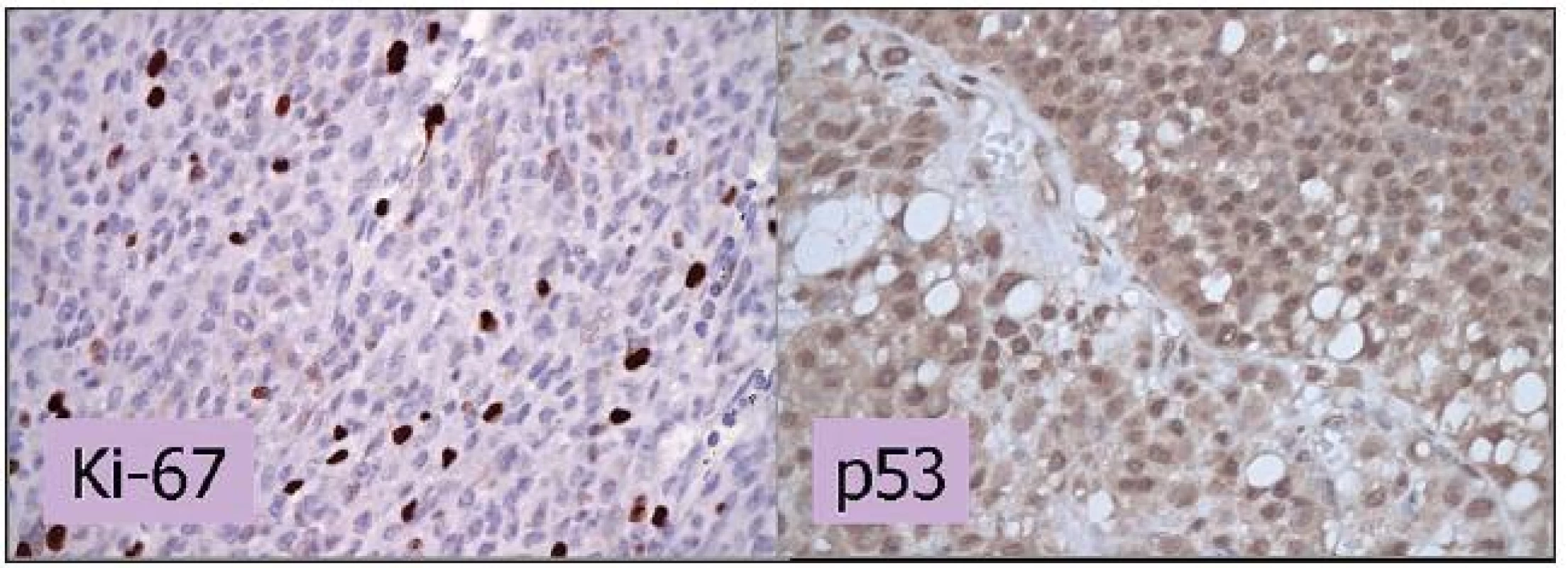
Receptory bunkového povrchu
Receptory bunkového povrchu, ktoré sprostredkovávajú tak medzibunkové spojenie, ako aj spojenie bunky a matrix, zohrávajú v metastatickom procese dôležitú úlohu. Beutel a kol. (5) skúmali imunohistochemickú detekciu expresie adhéznej molekuly Melanoma Cell Adhesion Molecule (MCAM) a poukázali na jej význam ako potenciálneho markera metastázujúceho MMU. Blokáda alebo inhibícia tejto molekuly sa môže v budúcnosti uplatniť v liečbe alebo v prevencii vzniku metastáz MMU. Obdobný súvis s nepriaznivou prognózou opísali aj autori Anastassiou a kol. (3) v prípade ďalšej intercelulárnej adhéznej molekuly Intercellular Cell Adhesion Molecule-1 (ICAM-1).
Imunologické prognostické faktory
Teória o imunologickom dohľade, podľa ktorej nádorové bunky exprimujú nové antigény rozpoznávané a eliminované imunitným systémom, bola prezentovaná už pred 30 rokmi. Jedinečné anatomické, fyziologické a imunoregulačné mechanizmy oka však bránia indukcii a expresii imunitnej odpovede z dôvodu fenoménu známeho ako „imunitné privilégium“. Prítomnosť tumor infiltrujúcich lymfocytov (TIL) a tumor infiltrujúcich makrofágov (TIM) sa pri MMU na rozdiel od MM kože spája s menej priaznivou prognózou a poukazuje na to, že imunitná odpoveď nemusí nádor eliminovať, ale môže naopak podporiť jeho rozvoj (41).
Genetické abnormality
Pokroky v oblasti genetického výskumu umožnili objavenie nových prognostických faktorov na úrovni chromozómov, génov, proteínov, či signálnych dráh.
Chromozómové abnormality
Jednou z prvých a zároveň najdôležitejších chromozómových abnormalít zistených u MMU je monozómia 3, strata jednej z dvoch kópií 3. chromozómu. Monozómia 3 sa spája s rozvojom metastáz a nachádza sa približne u 50 % MMU (34). Prítomnosť tohto defektu redukuje päťročné prežívanie približne na 50 % a spája sa s ďalšími prognosticky nepriaznivými faktormi: epiteloidný bunkový typ, prítomnosť extravaskulárnej matrix, väčší priemer nádoru, výskyt v oblasti corpus ciliare (34). Naopak prítomnosť dizómie 3. chromozómu sa spája s priaznivou prognózou. Zatiaľ však nie je objasnené, či monozómia 3 prispieva deléciou špecifického génu resp. génov kauzálne k progresii melanómu alebo je jednoducho len markerom genómovej instability, ktorá sprevádza progresiu nádoru. Monozómia chromozómu 3 patrí v súčasnosti po stanovení profilov génovej expresie k najspoľahlivejším prediktorom výskytu metastáz.
Približne u jednej štvrtiny MMU boli objavené nadbytočné kópie chromozómu 6p. Na rozdiel od monozómie 3 sa prítomnosť izochromozómu 6p spája s priaznivejšou prognózou a veľmi zriedkavo sa tieto abnormality vyskytujú súbežne. V rámci abnormalít chromozómu 6 opísali niektorí autori aj stratu kópie chromozómu 6q, ktorý sa naopak spája s metastázujúcim nádorom. Táto spojitosť je však menej významná ako v prípade zmien chromozómu 3 a 8 (22).
Prítomnosť abnormalít chromozómu 8 bola zistená u viac ako 40 % MMU (29). Prognostický význam je podobný ako v prípade monozómie 3 a spája sa s vyšším rizikom vzniku metastáz, väčším rozmerom nádoru a agresívnejším histologickým typom (38).
Z ostatných, menej častých, chromozómových abnormalít MMU boli opísané zmeny chromozómov 1, 9, 13 a 21 (1).
Genetické vyšetrenie pravdepodobne ovplyvní v budúcnosti aj terapiu primárneho MMU. Pokiaľ sa potvrdia predpoklady o nemetastatickom charaktere MMU s dizómiou chromozómu 3, asymptomatické nádory so zachovaním zrakových funkcií by sa nemuseli liečiť. Pacienti s vysokým rizikom metastázujúceho MMU by však rovnako nemuseli súhlasiť s enukleáciou a obetovaním ešte užitočného zraku v situácii, keď by nádej na zlepšenie ich prežívania bola márna (15).
Alterácie génov, proteínov a signálnych dráh súvisiacich s malígnou transformáciou bunky
Vyššie opísané alterácie chromozómov poukazujú na to, že progresia MMU súvisí so špecifickými poruchami na úrovni molekúl. V literatúre sa amplifikácia onkogénu c-Myc, zvýšená expresia protoonkogénu HDM2 (human homologue of murine double minute 2) a zmeny v signálnych dráhach Rb, Bcl-2, TGF-β a MAPK spájajú s vyšším rizikom vzniku metastáz.
Jednou z poškodených molekúl pri MMU sa javí byť proteín p53, ktorého hlavnou úlohou je ochrana pred nádorovou transformáciou bunky. U viac ako polovice ľudských nádorov bola zistená mutácia génu kódujúceho p53 (obrázok 2). Doteraz bolo poukázané na súvis p53 s mimoočným šírením nádoru a inváziou do ciev, zvýšenou proliferačnou aktivitou a epiteloidným bunkovým typom (24). Zvýšená expresia p53 bola zistená v prípadoch MMU liečených rádioterapiou ako odpoveď na radiačné poškodenie buniek (25). Erol a kol. (11) však vo svojej práci opísali zvýšenú expresiu p53 len v prípade 2 z celkového počtu 15 nádorov a podobné výsledky publikovala Tokošová a kol. (39), kde bola zvýšená expresia len u 4 z 28 nádorov. Z toho dôvodu nie je postavenie p53 ako prognostického faktora a ani jeho úloha v ovplyvňovaní rádiosenzitivity MMU zatiaľ jednoznačne definované.
Profily génovej expresie
Alterácie chromozómu 3, 6 a 8q sa síce spájajú so smrťou spôsobenou metastázami, ale klinické využitie týchto poznatkov zatiaľ nebolo presne stanovené. Navyše naďalej nepoznáme odpoveď na otázku, či spomenuté chromozómové zmeny súvisia s dereguláciou špecifických génov, alebo sú jednoducho iba markermi progresie nádoru. V snahe odhaliť biologickú podstatu vzniku metastáz rozdelili Onken a kol. (29) primárny MMU na základe profilov génovej expresie do dvoch skupín. Malígne melanómy uvey patriace do prvej skupiny nádorov metastázujú veľmi zriedkavo, kým MMU patriace do druhej skupiny vykazujú častý výskyt metastáz (29, 40, 42). V rámci druhej skupiny je veľmi častým nálezom monozómia tretieho chromozómu. Hoci monozómia 3 nie je natoľko presný prediktor metastáz ako profil génovej expresie, vzťah druhej skupiny a monozómie 3 poukazuje na to, že monozómia 3 môže byť zodpovedná za globálnu zmenu génovej expresie druhej skupiny nádorov (30, 40, 42). Predmetom prospektívnej štúdie vedenej COMS je v súčasnosti porovnanie výpovednej hodnoty dvoch prognostických faktorov, a to abnormalít chromozómu 3 a profilov génovej expresie MMU. V budúcnosti plánuje COMS multicentrickú klinickú štúdiu zameranú na systémovú adjuvantnú liečbu vysoko rizikových pacientov (patriacich do 2. skupiny podľa profilu génovej expresie). Vzťah medzi jednotlivými profilmi génovej expresie a vznikom metastáz ostáva naďalej predmetom intenzívneho vedeckého výskumu.
Záver
Malígny melanóm uvey predstavuje závažnú, doposiaľ stále nedostatočne preskúmanú problematiku oftalmoonkológie. Bližšie stanovenie prognózy, prípadne odhalenie nových potenciálnych cieľov liečby by bolo veľkým prínosom v manažmente pacientov s týmto ochorením.
Podporené grantom Univerzity Komenského č. UK/204/2011.
Do redakce doručeno dne 18. 11. 2011
Do tisku přijato dne 10. 2. 2012
MUDr. Zuzana Svetlošáková
Záporožská 6
851 01 Bratislava
e-mail: zuzana.svetlosakova@gmail.com
Sources
1. Aalto, Y., Eriksson, L., Seregard, S. et al.: Concomitant loss of chromosome 3 and whole arm losses and gains of chromosome 1, 6, or 8 in metastasizing primary uveal melanoma, Invest Ophthalmol Vis Sci, 42, 2001, 2 : 313–7.
2. Al-Jamal, R.T., Kivela, T.: KI-67 immunopositivity in choroidal and ciliary body melanoma with respect to nucleolar diameter and other prognostic factors, Curr Eye Res, 31, 2006, 1 : 57–67.
3. Anastassiou, G., Schilling, H., Stang, A. et al.: Expression of the cell adhesion molecules ICAM-1, VCAM-1 and NCAM in uveal melanoma: a clinicopathological study, Oncology, 58, 2000, 1 : 83–8.
4. Bedikian, A.Y.: Metastatic uveal melanoma therapy: current options, Int Ophthalmol Clin, 46, 2006, 1 : 151–66.
5. Beutel, J., Wegner, J., Wegner, R. et al.: Possible implications of MCAM expression in metastasis and non-metastatic of primary uveal melanoma patients, Curr Eye Res, 34, 2009, 11 : 1004–9.
6. Callender, G.R.: Malignant melanotic tumors of the eye: a study of histologic types in 111 cases, Trans Am Acad Ophthalmol Otolaryngol, 36, 1931, 131-42.
7. Campbell, R.J., Sobin, L.H.: WHO-Histological typing of tumours of the eye and its adnexa, New York, Springer, 1998, 115s.
8. Diener-West, M., Reynolds, S.M., Agugliaro, D.J. et al.: Screening for metastasis from choroidal melanoma: the Collaborative Ocular Melanoma Study Group Report 23, J Clin Oncol, 22, 2004, 12 : 2438–44.
9. Diener-West, M., Reynolds, S.M., Agugliaro, D.J. et al.: Development of metastatic disease after enrollment in the COMS trials for treatment of choroidal melanoma: Collaborative Ocular Melanoma Study Group Report No. 26, Arch Ophthalmol, 123, 2005, 12 : 1639–43.
10. Edge, S.B., Byrd, D.R., Compton, C.C. et al.: AJCC Cancer Staging Handbook, New York, Springer, 2010, 730 s.
11. Erol, N., Oner, U., Artan, S. et al.: Chromosomal abnormalities, p53 and Bcl-2 expression and clinical outcome in choroidal melanoma, Melanoma Res, 14, 2004, 6 : 473–8.
12. Eskelin, S., Pyrhonen, S., Summanen, P. et al.: Tumor doubling times in metastatic malignant melanoma of the uvea: tumor progression before and after treatment, Ophthalmology, 107, 2000, 8 : 1443–9.
13. Folberg, R., Pe’er, J., Gruman, L.M. et al.: The morphologic characteristics of tumor blood vessels as a marker of tumor progression in primary human uveal melanoma: a matched case-control study, Hum Pathol, 23, 1992, 11 : 1298–305.
14. Furdová, A.: Nové trendy v liečbe malígneho melanómu uvey. In Rozsíval, P. (Ed), Trendy soudobé oftalmologie, svazek 4, Galén, 2007, s.13–35.
15. Furdová, A., Böhmer, D., Blaško, M. et al.: Genetika uveálnych melanómov (monozómia 3) – porovnanie karyotypu z buniek nádoru, limbálnych kmeňových buniek a periférnej krvi (prvé výsledky). In (Ed), 6. bilaterálne slovensko-české oftalmologické sympózium – Zborník Bratislava, Slovenská oftalmologická spoločnosť, 2011, s. 26–27.
16. Furdová, A., Chynoranský, M., Krajčová, P.: Orbital melanoma, Bratisl Lek Listy, 112, 2011, 8 : 466–8.
17. Furdová, A., Oláh, Z.: Malígny melanóm v uveálnom trakte, Bratislava, Asklepios, 2002, 175 s.
18. Furdová, A., Oláh, Z.: Nádory oka a okolitých štruktúr, Brno, Akademické nakladatelství CERM, 2010, 151 s.
19. Furdová, A., Slezák, P., Chorváth, M. et al.: No differences in outcome between radical surgical treatment (enucleation) and stereotactic radiosurgery in patients with posterior uveal melanoma, Neoplasma, 57, 2010, 4 : 377–81.
20. Furdová, A., Strmeň, P., Waczulíková, I. et al.: One-day session LINAC-based stereotactic radiosurgery of posterior uveal melanoma, Eur J Ophthalmol, 2011, Published online: 18/04/2011, DOI 10.5301/EJO.2011.7733.
21. Geisse, L.J., Robertson, D.M.: Iris melanomas, Am J Ophthalmol, 99, 1985, 6 : 638-48.
22. Ghazvini, S., Char, D.H., Kroll, S. et al.: Comparative genomic hybridization analysis of archival formalin-fixed paraffin-embedded uveal melanomas, Cancer Genet Cytogenet, 90, 1996, 2 : 95–101.
23. Gragoudas, E.S.: Proton beam irradiation of uveal melanomas: the first 30 years. The Weisenfeld Lecture, Invest Ophthalmol Vis Sci, 47, 2006, 11 : 4666–73.
24. Hussein, M.R.: The relationships between p53 protein expression and the clinicopathological features in the uveal melanomas, Cancer Biol Ther, 4, 2005, 1 : 57–9.
25. Janssen, K., Kuntze, J., Busse, H. et al.: p53 oncoprotein overexpression in choroidal melanoma, Mod Pathol, 9, 1996, 3 : 267–72.
26. Jensen, O.A.: Malignant melanoma of the iris. A 25-year analysis of Danish cases, Eur J Ophthalmol, 3, 1993, 4 : 181–8.
27. Maniotis, A.J., Folberg, R., Hess, A. et al.: Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry, Am J Pathol, 155, 1999, 3 : 739–52.
28. McLean, I.W., Keefe, K.S., Burnier, M.N.: Uveal melanoma. Comparison of the prognostic value of fibrovascular loops, mean of the ten largest nucleoli, cell type, and tumor size, Ophthalmology, 104, 1997, 5 : 777–80.
29. Onken, M.D., Worley, L.A., Ehlers, J.P. et al.: Gene expression profiling in uveal melanoma reveals two molecular classes and predicts metastatic death, Cancer Res, 64, 2004, 20 : 7205–9.
30. Petrausch, U., Martus, P., Tonnies, H. et al.: Significance of gene expression analysis in uveal melanoma in comparison to standard risk factors for risk assessment of subsequent metastases, Eye (Lond), 22, 2008, 8 : 997–1007.
31. Sato, T.: Locoregional management of hepatic metastasis from primary uveal melanoma, Semin Oncol, 37, 2010, 2 : 127–38.
32. Seregard, S., Oskarsson, M., Spangberg, B.: PC-10 as a predictor of prognosis after antigen retrieval in posterior uveal melanoma, Invest Ophthalmol Vis Sci, 37, 1996, 7 : 1451–8.
33. Shields, C.L., Shields, J.A., Materin, M. et al.: Iris melanoma: risk factors for metastasis in 169 consecutive patients, Ophthalmology, 108, 2001, 1 : 172–8.
34. Scholes, A.G., Damato, B.E., Nunn, J. et al.: Monosomy 3 in uveal melanoma: correlation with clinical and histologic predictors of survival, Invest Ophthalmol Vis Sci, 44, 2003, 3 : 1008–11.
35. Singh, A.D., Topham, A.: Incidence of uveal melanoma in the United States: 1973-1997, Ophthalmology, 110, 2003, 5 : 956–61.
36. Singh, A.D., Topham, A.: Survival rates with uveal melanoma in the United States: 1973-1997, Ophthalmology, 110, 2003, 5 : 962–5.
37. Singh, A.D., Turell, M.E., Topham, A.K.: Uveal melanoma: trends in incidence, treatment, and survival, Ophthalmology, 118, 2011, 9 : 1881–5.
38. Sisley, K., Parsons, M.A., Garnham, J. et al.: Association of specific chromosome alterations with tumour phenotype in posterior uveal melanoma, Br J Cancer, 82, 2000, 2 : 330–8.
39. Tokošová, E., Hermanová, M., Uhmannová, R. et al.: Immunohistochemical detection of the gene p53 and p21 expression in cells of the malignant melanoma of the uvea, Čes Slov Oftalmol, 64, 2008, 4 : 153–6.
40. van Gils, W., Lodder, E.M., Mensink, H.W. et al.: Gene expression profiling in uveal melanoma: two regions on 3p related to prognosis, Invest Ophthalmol Vis Sci, 49, 2008, 10 : 4254–62.
41. Whelchel, J.C., Farah, S.E., McLean, I.W. et al.: Immunohistochemistry of infiltrating lymphocytes in uveal malignant melanoma, Invest Ophthalmol Vis Sci, 34, 1993, 8 : 2603–6.
42. Worley, L.A., Onken, M.D., Person, E. et al.: Transcriptomic versus chromosomal prognostic markers and clinical outcome in uveal melanoma, Clin Cancer Res, 13, 2007, 5 : 1466–71.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2012 Issue 1-
All articles in this issue
- Incidence of Retractive Errors with Corrective Aids Subsequent Selection
- Our Fifteen-Year Experience with Lasik
- Floppy Eyelid Syndrome and Obstructive Sleep Apnoea
- Effects of Intravitreal Pegaptanib or Bevacizumab and Laser in Treatment of Threshold Retinopathy of Prematurity in Zone I and Posterior Zone II – Four Years Results
- Selected Prognostic Factors of Malignant Uveal Melanoma
- Comparative Study of Intraocular Pressure Measurements by Goldmann Applanation Tonometer, Noncontact Tonometer and TonoPen
- Gases in Vitreoretinal Surgery
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Gases in Vitreoretinal Surgery
- Floppy Eyelid Syndrome and Obstructive Sleep Apnoea
- Selected Prognostic Factors of Malignant Uveal Melanoma
- Comparative Study of Intraocular Pressure Measurements by Goldmann Applanation Tonometer, Noncontact Tonometer and TonoPen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

