-
Medical journals
- Career
Příspěvek k vyšetřování funkce makulární krajiny při chirurgické léčbě idiopatické makulární díry
Authors: L. Hejsek 1,3; H. Langrová 1; J. Ernest 2; P. Němec 2; L. Rejmont 2
Authors‘ workplace: Oční klinika, Fakultní nemocnice, Hradec Králové, prof. MUDr. Pavel Rozsíval, CSc., FEBO 1; Oční klinika 1. LF UK a ÚVN, Praha, přednosta doc. MUDr. Jiří Pašta, CSc., FEBO 2; Nemocniční základna, 6. polní nemocnice, velitel plk. gšt. prof. MUDr. Jan Österreicher, Ph. D. 3
Published in: Čes. a slov. Oftal., 67, 2011, No. 5-6, p. 159-164
Category: Original Article
Overview
Hodnotíme roční anatomické a funkční výsledky operace makulární díry standardní tříportovou 20G pars plana vitrektomií, s peelingem MLI (membrana limitans interna) a s instalací plynové expanzivní tamponády (20% SF6 – hexafluorosulfid, fluorid sírový).
Sledovaný soubor tvořilo 32 očí 32 pacientů (3 muži a 29 žen), průměrného věku 69 let (rozmezí 59 až 76). Kromě idiopatické makulární díry (IMD) nebyla přítomna jiná nitrooční patologie. Jako metody objektivizace nitrooční anatomie jsme použili techniky: vyšetření předního segmentu štěrbinovou lampou, biomikroskopii při arteficiální mydriáze a optickou koherentní tomografii (Stratus OCT™, Carl Zeiss). Pro vyšetření funkce centrální oblasti sítnice jsme hodnotili: nejlépe korigovanou zrakovou ostrost do dálky (BCVA) na ETDRS optotypech, BCVA do blízka (Jaegerovy tabulky), multifokální elektroretinografii (MfERG) a reverzní elektroretinografii při šachovnicové stimulaci (PERG).
Ke statistickému zpracování výsledků jsme použili neparametrický Wilcoxonův párový test.Výsledky anatomické:
k primárnímu uzavření IMD došlo u 29 (90 %), IMD se neuzavřela, ale okraje neuroretiny byly oploštělé u 2 očí (6 %) a jedenkrát byla IMD neuzavřená s neoploštělými kraji (3 %).Výsledky funkční:
vstupní BCVA testovaná na ETDRS tabulích se pohybovala v rozmezí 0,1 až 0,5 (1,0 až 0,3 logMAR). Po jednom roce od operace se zraková ostrost zlepšila o 2 a více řádků u 27 očí (84 %), o 3 a více řádků u 18 očí (56 %) a o 4 a více řádků u 5 očí (16 %). Amplitudy PERG (N95) všech očí se pohybovaly mezi 4–9 μV, byly v rozmezí normálních hodnot laboratoře; hodnoty amplitudy N95 12 měsíců po operaci se statisticky významně nelišily od hodnot předoperačních. Statisticky významný rozdíl (zlepšení) bylo v prvních dvou centrálních prstencích MfERG. Jednalo se o hodnoty amplitudy vlny P1 před operací a 12 měsíců poté (Wilcoxon p < 0,01). Rozdíl mezi hodnotami latencí N1 a P1 před operací a 12 měsíců poté nebyl statisticky významný, stejně jako změny mezi hodnotami amplitud vlny N1 před operací a 12 měsíců poté.
Vzhledem k příznivým anatomickým a funkčním výsledkům považujeme operační řešení makulární díry cestou PPV s peelingem MLI za bezpečnou techniku. Při indikaci k provedení peelingu je ale třeba zvážit další faktory, zejména dobu trvání IMD, stadium onemocnění, typ nitrooční tamponády a spolupráci pacienta.Klíčová slova:
MLI, peeling, makulární díra, MfERG, PERGÚvod
V současné době dochází k velkým pokrokům a rozvoji v oblasti nitrooční vitreoretinální chirurgie. Nové techniky a technologie se zdokonalují a urychlují prakticky všechny vitreoretinální operace. Operační zákroky jsou bezpečnější a doba pooperační rehabilitace kratší. Současně s vývojem techniky dochází i k výraznému zdokonalení diagnostických metod, které nám zobrazují ultrastrukturu retiny a verifikují její funkci.
Makulární díra byla poprvé popsána koncem devatenáctého století [17] a po následujících asi 100 let byla až do zavedení chirurgické terapie [10] považována za neléčitelnou. Idiopatickou makulární dírou (IMD) rozumíme kompletní poruchu integrity neuroretinální tkáně (zasahuje od membrany limitans interna, MLI, až po zevní segmenty fotoreceptorů, včetně) v oblasti fovey. Přesná příčina rozvoje IMD není jasná, předpokládaným mechanismem je působení tažných (trakčních) sil na centrální krajinu, a to ve smyslu kolmém na makulu (tzv. předozadní trakce sklivce) i ve směru horizontálním (tzv. tangenciální trakce vitreoretinálního rozhraní) [5, 20].
Nejčastěji vzniká IMD kolem sedmého decennia, incidence se pohybuje kolem 33 případů na 100 000 obyvatel, onemocnění častěji postihuje ženy. [12] IMD není t.č. terapeuticky ovlivnitelná konzervativní cestou. Klasický operační postup spočívá v odstranění předního a kortikálního sklivce, odloučení zadní sklivcové membrány, dočištění periferie (vystříhání base sklivce s kontrolou periferní sítnice), odstranění eventuálně přítomných epiretinálních membrán (ERM), obarvení povrchu sítnice, peeling MLI z centrální krajiny, instalace plynové tamponády a polohování obličejem dolů. Úspěšnost operace IMD (kompletní uzávěr defektu) se v aktuálních publikacích pohybuje kolem 90 %. Schopnosti znovu číst může dosáhnout až polovina pacientů s recentním nástupem symptomů onemocnění. Nejčastější komplikace operace zahrnují odchlípení sítnice (kolem 5 %), hnisavou endoftalmitidu, znovuotevření pooperačně uzavřené IMD, či abnormality pigmentového epitelu sítnice (RPE).
Faktory, které determinují anatomickou i funkční úspěšnost operace, jsou: charakteristika makulární díry (stadium, velikost, stáří defektu …), konkomitantní onemocnění, spolupráce pacienta v pooperační době (polohování), použití adjuvancií (obarvující látky pro lepší vizualizaci retinálního povrchu), typ nitrooční tamponády (expanzivní plyny, silikon), operační technika (provedení či neprovedení peelingu MLI, zkušenosti a zručnost chirurga a další faktory).
Jednou z nejčastěji diskutovaných otázek je právě provedení peelingu MLI. Tato část operace má sloužit k eliminaci tangenciální trakce. Příčinou nejasností v indikaci peelingu jsou:
- A) reference autorů, kteří nezaznamenali vliv peelingu na úspěšnost či neúspěšnost operace IMD [19] a naopak autorů, jejichž výsledky jsou lepší, pokud byl peeling proveden [2].
- B) obecná obava, že provedení peelingu MLI může nevratně poškodit Müllerovy buňky sítnice se všemi z toho plynoucími následky. Navíc někteří autoři popisují přítomnost nervových vláken na bioptických vzorcích MLI po jejím peelingu [24].
Tato práce si klade za cíl zhodnotit anatomické a funkční výsledky operace IMD a na jejich základě společně s klinickými zkušenostmi se pokusit navrhnout směr při úvahách v indikaci k operačnímu řešení.
Metodika
Vstupní kritéria pro zařazení do souboru (IMD na jednom oku, ve stadiu 2 až 4 dle Gasse s transparentními očními médii a bez další oční patologie makuly či periferi sítnice) splnilo celkem 61 očí 61 pacientů. Z toho bylo 13 očí artefakických a 48 fakických. V průběhu sledovací doby (nejčastěji do půl roku od provedení operace) se u 29 očí (60 % všech fakických pacientů) projevil určitý stupeň katarakty, která by mohla ovlivnit výsledky elektrofyziologických měření, a proto byli tito pacienti ze sledování vyřazeni. Do souboru nebyli zahrnuti pacienti primárně indikovaní ke kombinované operaci katarakty a IMD. Hodnocený soubor tedy tvořilo 32 očí 32 pacientů (3 muži a 29 žen), průměrného věku 69 let (medián 66).
Pro objektivizaci nitrooční anatomie jsme použili tyto techniky: vyšetření předního segmentu štěrbinovou lampou (hodnocen zejména nález na čočce), biomikroskopii v široké arteficiální mydriáze (nekontaktní čočkou VOLK Super Field, zhodnocení nálezu v makule a vyhledávání event. přítomných rhegmatogenních degenerací) a optickou koherentní tomografii (Stratus OCT™, Carl Zeiss, zhodnocení stadia IMD, její velikosti a nálezu na vitreoretinálním rozhraní).
Stadium 2 (dle Gasse) bylo přítomné u 16 očí, stadium 3 u 11 očí a stadium 4 mělo 5 očí z celkového počtu 32.
Funkční vyšetření probíhalo 1 den před operací, měsíc po operaci a dále 6 a 12 měsíců po operačním zákroku. Hodnotili jsme nejlepší korigovanou zrakovou ostrost do dálky (BCVA) na ETDRS optotypech (celořádková metoda), BCVA do blízka (Jaegerovy tabulky) a elektroretinografii multifokální (MfERG) i reverzační při šachovnicové stimulaci (PERG). Parametry elektrofyziologického měření podléhaly standardu ISCEV (International Society for Clinical Electrophysiology of Vision). Záblesková „klasická“ elektroretinografie nebyla sledována. Tato metoda se využívá v diagnostice předpokládaných generalizovaných chorob (typicky při chorioretinálních dystrofiích) a pro malé lokalizované defekty (například izolovaná makulární léze) není dostatečně citlivá [3].
Table 1. BCVA před a po operaci rozdělené dle stadia IMD 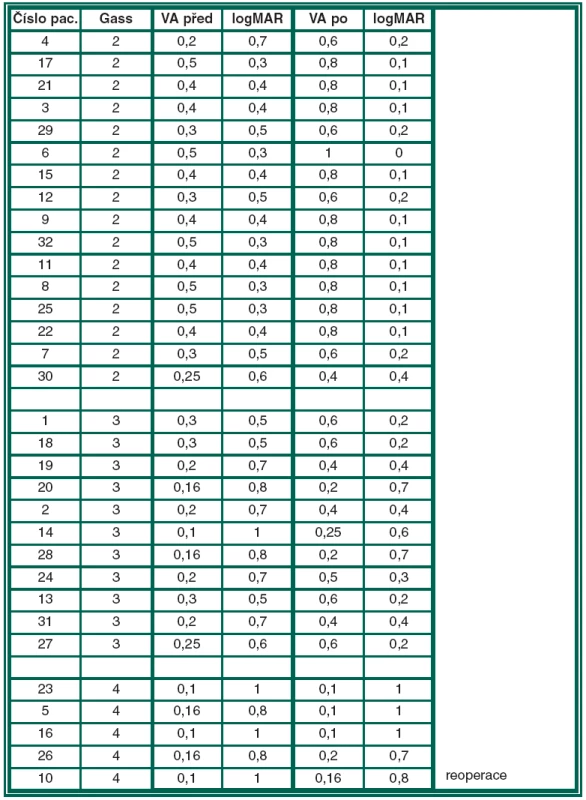
Elektrofyziologická vyšetření probíhala na přístroji Reti-port (Roland-Consult, Německo), zde jen krátce uvádíme základní parametry a využití technik.
PERG (pattern reversal ERG): jedná se o odpověď neuroretiny makulární krajiny, která je stimulována strukturovanými podněty (černobílá šachovnice = pattern, pravidelně měnící polohu bílých a černých míst = reverzace). Pacient nesmí být rozkapaný a nutné je ho korigovat na vyšetřovanou vzdálenost (na 1 metr). Běžná velikost zornice umožňuje stimulaci centrálních 30 stupňů fundu. Strukturované podněty (čtverce o velikosti strany 0,8°) maximálně stimulují vnitřní retinální vrstvy, zejména gangliové buňky. PERG proto udává informaci o funkci gangliových buněk (vlna N95) a o funkci makuly jako celku. Snímaná odpověď je tvořena vlnami N35, P50 a N95. Vlna N35 bývá minimálně vyjádřená, vlnu P50 generují kromě gangliových buněk také struktury uložené distálně od nich, vlna N95 je tvořena prakticky jen gangliovými buňkami. Proto byla hodnocena amplituda vlny N95. MfERG (multifokální ERG): vyšetřuje funkci malých oblastí v centrální části sítnice, vytváří topografickou mapu místních ERG odpovědí. Pacient musí být pro vyšetření rozkapaný [13]. Výsledné signály jsou matematickou extrakcí zaznamenaných potenciálů a mohou být ovlivněné různými adaptačními mechanismy (od předcházejících stimulů) a vlivem rozptylu světla (například od terče zrakového nervu). Výsledná křivka má vlny N1, P1 a N2. Vlna N1 je pravděpodobně obdobou vlně-a při klasické ERG, vlna P1 je obdobou b-vlny a oscilačních potenciálů při ERG. [8] Testovaná oblast pokrývá přibližně centrálních 30 stupňů zorného pole. Tuto plochu jsme rozdělili na 61 šestiúhelníků s centrálním fixačním bodem. Sledovaným parametrem byly vlny N1 a P1 (jejich latence a amplitudy) v centrálních třech prstencích, tedy oblast, která svojí lokalizací lehce přesahuje běžnou velikost peelingu MLI.
Oběma technikám bylo společné standardní umístění elektrod. Jako aktivní elektrodu jsme použili zdvojené vlákno DTL elektrody (W. W. Dawson, G. L. Trick, C. A. Litzkow). Jedná se o tenké nylonové vlákno potažené stříbrem, které snímá potenciály z povrchu oka.
Získané funkční hodnoty neměly charakter normálního Gaussova rozdělení, a proto byl k jejich statistickému zhodnocení použit Wilcoxonův test (pro párová pozorování).
Pro krátkou možnost použití (zapůjčení přístroje) bylo pět pacientů před a měsíc po operaci vyšetřeno pomocí mikroperimetrie (přístroj Micro Perimeter MP-1, NIDEK), výsledky tohoto vyšetření rozvedeme v diskusi [7].
Všichni pacienti podstoupili operaci IMD na pracovišti Oční klinika 1. LF UK a ÚVN Praha, operace prováděli v letech 2006 až 2008 náhodně určení tři zkušení vitreoretinální chirurgové. Operační postup zahrnoval 20G pars plana vitrektomii, provedení peelingu MLI (mikropinzetou) po obarvení membránovou modří, sukci patologického obsahu díry a instilaci 20% SF-6. Polohování obličejem bylo doporučeno na dobu 7 dní.
Výsledky
Výsledky anatomické: z celkových 32 operovaných očí se IMD primárně uzavřela u 29 (90 %), IMD se neuzavřela, ale okraje neuroretiny byly oploštělé u 2 očí (6 %) a jedenkrát byla IMD neuzavřená s neoploštělými kraji (3 %). Tento případ byl řešen reoperací – další pars plana vitrektomií s odstupem 2 měsíců po primárním výkonu. Provedli jsme rozšířením zóny peelingu a instilaci expanzivní tamponády perfluoropropanem (15% C3F8). Po vstřebání plynu byla makulární díra (předoperační stupeň 4, maximální rozměr defektu 610 μm) zcela uzavřená.
Ve sledovaném souboru se v průběhu sledovaných 12 měsíců nevyskytly žádné, v literatuře nejčastěji uváděné komplikace, jako jsou odchlípení sítnice, hnisavá endoftalmitida, či rozvoj abnormalit RPE.
Původně bylo do sledování zahrnuto 61 očí 61 pacientů (13 očí artefakických a 48 fakických). V průběhu sledovací doby se u 29 očí (60 % všech fakických pacientů) rozvinula katarakta (nejčastěji nukleární a zadně-subkapsulární typ). Jednalo se o 2 pacienty po 1 měsíci, 8 pacientů po 3 měsících, 16 pacientů po 6 měsících a 3 pacienty po 12 měsících.
Výsledky funkční: vstupní BCVA testovaná na ETDRS tabulích se pohybovala v rozmezí 0,1 až 0,5 (1,0 až 0,3 logMAR), medián: 0,3 (0,5 logMAR). Pacienti s IMD ve stadiu 2 (16 očí) měli BCVA 0,2 až 0,5. U pacientů s IMD ve stadiu 3 (11 očí) se BCVA pohybovala mezi 0,1 až 0,3 a oči s IMD ve stadiu 4 (5 očí) měly BCVA 0,1 až 0,16.
Po jednom roce od operace se zraková ostrost pohybovala v rozmezí 0,1 až 1,0 (1 až 0 logMAR), medián: 0,6 (0,2 logMAR). BCVA se zlepšila o 2 a více řádků u 27 očí (84 %), o 3 a více řádků u 18 očí (56 %) a o 4 a více řádků u 5 očí (16 %). U 100 % pacientů s IMD druhého stadia se BCVA zlepšila o 2 a více řádků, o 3 a více řádků v 63 %. Nejmenší počet zlepšených BCVA byl v podskupině IMD stadia 4: zlepšení o 2 řádky (více u nikoho) ve 40 %. Zlepšení hodnot BCVA za 12 měsíců po zákroku byl statisticky významně signifikantní (Wilcoxon p = 0,002).
Výsledky PERG: v této práci hodnotíme pouze výsledky (amplitudu vlny N95) předoperační a výsledky při kontrole 12 měsíců po zákroku. Amplitudy N95 všech očí se pohybovaly mezi 4–9 μV, byly v rozmezí normálních hodnot laboratoře a nebyl nalezen statisticky významný rozdíl mezi hodnotami před operací a 12 měsíců poté (Wilcoxon P > 0,05).
Výsledky MfERG: hodnoceny byly vlny N1 a P1 (jejich latence a amplitudy) v centrálních třech prstencích elektroretinogramu, který odpovídá asi 15 úhlovým stupňům centrální části zorného pole. V této práci porovnáváme výsledky předoperační a výsledky při kontrole 12 měsíců po zákroku. První „prstenec“ je kruh o velikost přibližně 3 úhlových stupňů, které pokrývají oblast fovey, druhý prstenec svou plochou zabírá mezikruží velikosti asi 3–8 úhlových stupňů a koresponduje s perifoveální krajinou.
Výsledky v prvním (centrálním prstenci): Průměrná foveolární odpověď (amplituda vlny P1) se pooperačně zvýšila z 65 na 73 nV/deg-2. Zlepšení je statisticky významné (Wilcoxon p = 0,008, graf 1). Nebyl nalezen statisticky významným rozdíl mezi hodnotami latencí N1 a P1 před operací a 12 měsíců poté (Wilcoxon P > 0,05), ani rozdíl mezi hodnotami amplitud vlny N1 před operací a 12 měsíců poté (Wilcoxon P > 0,05).
Výsledky ve druhém (paracentrálním prstenci): Průměrná amplituda vlny P1 se pooperačně zvýšila z 46 na 55 nV/deg-2, toto zlepšení je statisticky významné (Wilcoxon p = 0,006, graf 2). Nenalezli jsme statisticky významný rozdíl u hodnot latencí N1 a P1 (Wilcoxon P > 0,05), ani rozdíl mezi hodnotami amplitud vlny N1 (Wilcoxon P > 0,05).
Výsledky ve třetím prstenci: nebyl nalezen statisticky významný rozdíl mezi všemi sledovanými hodnotami před a po operaci (Wilcoxon P > 0,05).
Diskuse
Z původně zařazených 61 pacientů dokončilo dvanáctiměsíční sledování 32. Důvodem postupného úbytku byl rozvoj katarakty, který jsme pozorovali u 29 (60 %) fakických očí. Nejčastěji se jednalo o nukleární nebo zadně subkapsulární typ katarakty. V celkem 26 případech se katarakta projevila do 6 měsíců od operace IMD. V literatuře autoři udávají 70 i 80% incidenci rozvoje katarakty po PPV s plynovou tamponádou [8, 17, 18].
Za hlavní rizika progrese katarakty po operaci IMD považujeme delší přítomnost plynové tamponády (zejména C3F8) při horší spolupráci v udržování doporučené polohy hlavy („polohování“), věk pacienta a přítomnost zakalení čočky již před operací. V současné době se hlavní autor práce pokouší řešit tento problém alternací operační techniky: místo plynové tamponády použít pouze vzduchovou.
Funkční výsledky (zrakové ostrosti i elektrofyziologické) se významně neliší od publikovaných prací ostatních autorů. [1, 2, 10, 14, 15, 16, 18, 20, 22]
Zejména k výsledkům měření PERG a MfERG ale připomínáme fakta, která mohou hodnocení vyšetření ovlivňovat, či znepřesňovat:
- A) Vlna N95 a někdy i P1 mohou mít tak pozvolný průběh, že může být problém určit přesné místo vrcholu (přesně definovat latenci a amplitudu).
- B) Na kontrolním souboru (vždy vyšetřováno i druhé, zdravé oko) se projevila intra-individuální variabilita výsledků až 20 % mezi jednotlivými měřeními, která je ve shodě s publikovanými výsledky [3].
- C) Několik pacientů bylo současně vyšetřeno pomocí přístroje MP1 (mikroperimetrie). Tato technika umožňuje sledovat nejen změny funkce (citlivost udávaná v dB) centrální krajiny, ale i změny fixace. Po úspěšné operaci makulární díry se fixace koncentruje blíže k jednomu bodu a stává se stabilnější [6]. Pacient tedy může používat trochu jiné místo při následných vyšetřeních, než při vstupním (excentrická fixace, viz obrázek 1), a tento fakt má vliv na měření MfERG. Příklad zlepšení fixace po operaci IMD uvádíme na obrázcích 2 a 3. Naopak anatomický neúspěch operace IMD, která zůstane po operaci otevřená s elevovanými okraji, vede k výraznému zhoršení nálezu mikroperimetrie (viz obrázky 4 před a 5 po operaci).
Image 1. Excentrická fixace před operací IMD 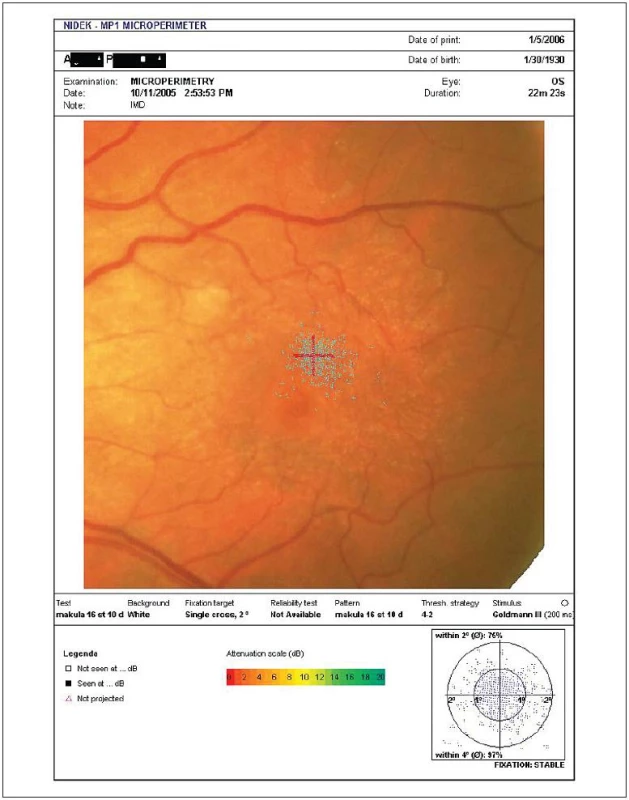
Image 2. Excentrická nestabilní fixace před operací IMD 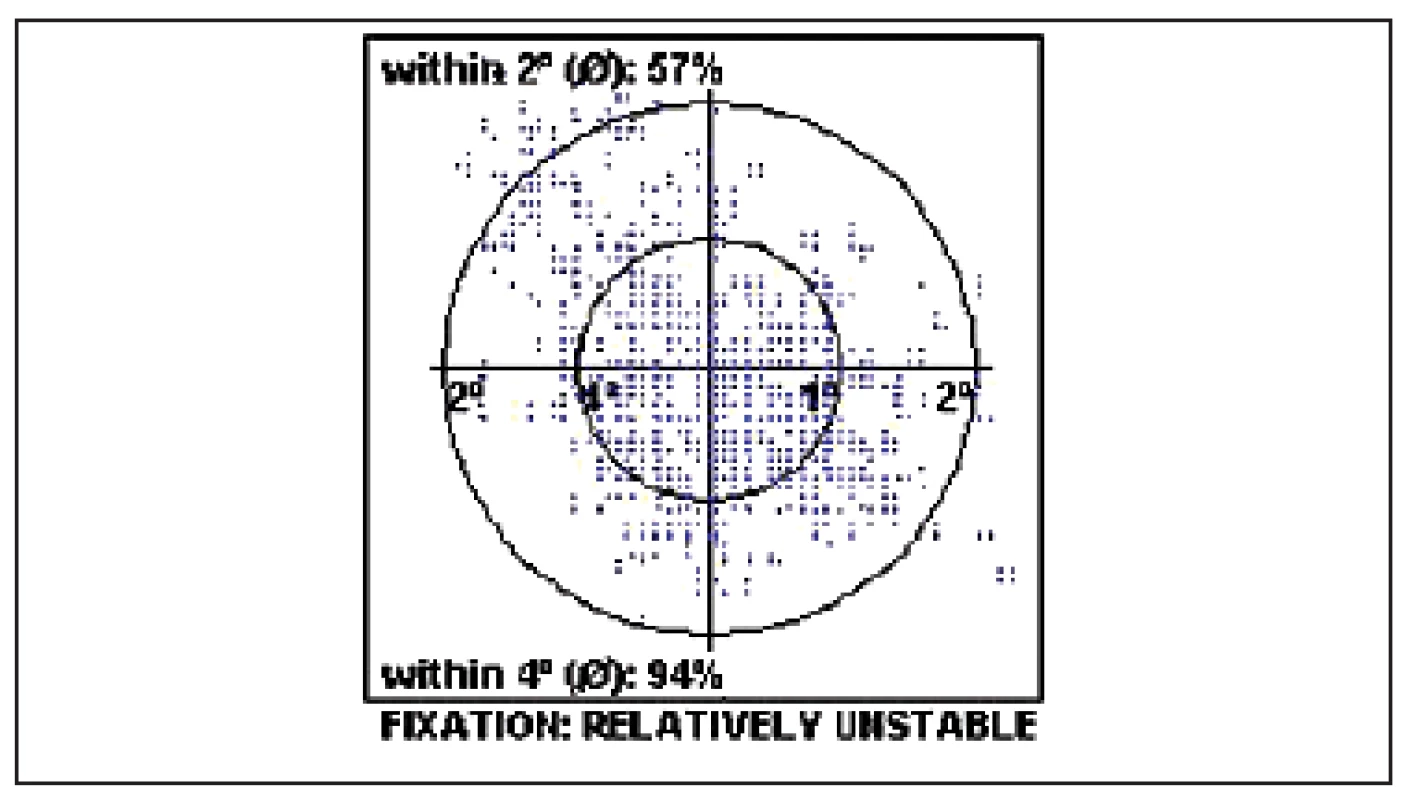
Image 3. Centrální stabilní fixace po úspěšné operaci IMD 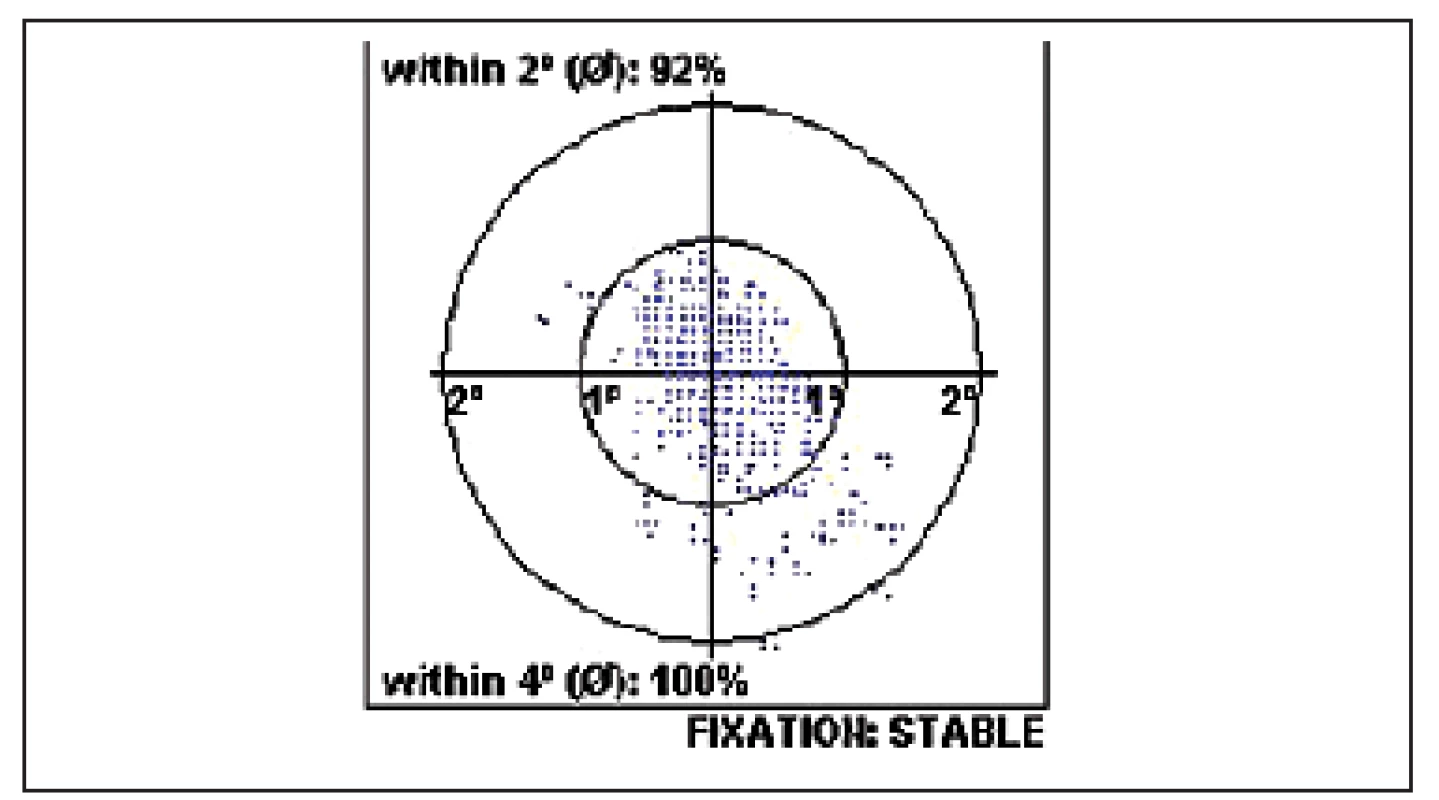
Image 4. Pokles citlivosti centrální krajiny před operací IMD 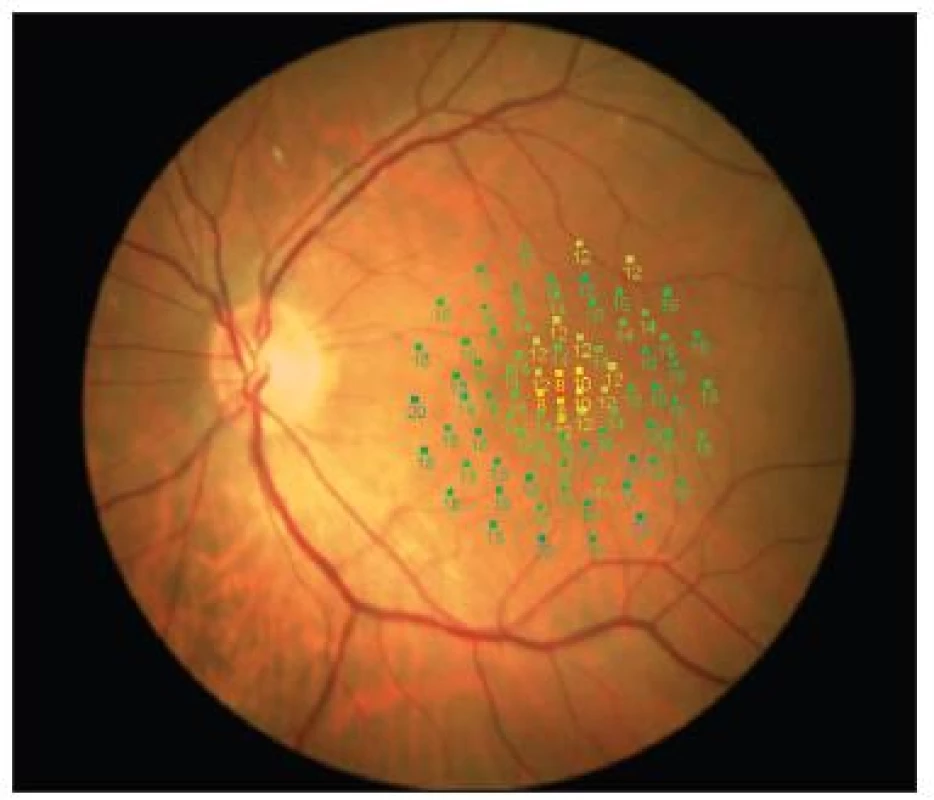
Image 5. Zhoršení funkce centrální krajiny po operaci IMD, kdy makulární díra zůstává otevřená s elevovanými okraji, v centru se rozvíjí absolutní skotom 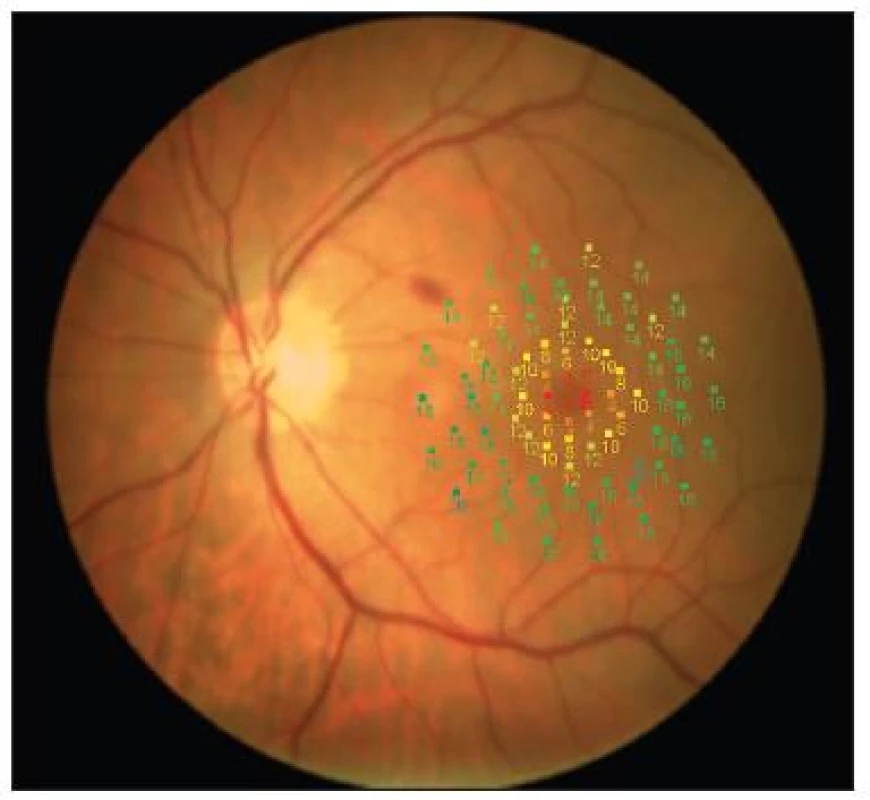
- D) Nezanedbatelný vliv na výsledky měření má velikost zornice a správná korekce (souvislost s eventuálním rozvojem katarakty) na vyšetřovanou vzdálenost [5].
Vzhledem k příznivým anatomickým a funkčním výsledkům považujeme operační řešení makulární díry cestou PPV s peelingem MLI za bezpečnou techniku, která výrazně zvyšuje pravděpodobnost uzávěru IMD (zejména ve vyšších stadiích). To, zda operatér zvolí provedení PPV s peelingem MLI či nikoliv, závisí ještě na mnoha dalších faktorech (doba trvání IMD, stadium choroby, velikost IMD, předpokládaná spolupráce při polohování, zkušenosti chirurga atd.).
Do redakce doručeno dne 9. 11. 2011
Do tisku přijato dne 1. 12. 2011
MUDr. Libor Hejsek
Oční klinika
Fakultní nemocnice Hradec Králové
Sokolská 581,
500 05 Hradec Králové
e-mail: hejselib@fnhk.cz
Sources
1. Apostolopoulos M.N., Koutsandrea C.N., Moschos M.N., et al.: Evaluation of successful macular hole surgery by optical coherence tomography and multifocal electroretinography, Am J Ophthalmol 134 : 667–674.
2. Brooks, H., L.: Macular hole surgery with and without internal limiting membrane peeling, Ophthalmol., 107; 2000 : 1939–1948.
3. Byron L. Lam: Electrophysiology of Vision: Clinical Testing and Applications, Tailor&Francis group, 2005, 6 p.
4. Fatih, C., G., Gungor, S., Mehmet, Z., B.: Intra-sessional and inter-sessional variability of multifocal elektroretinogram, Doc. Ophthalmol., 117, 2008; 3 : 175–183.
5. Gass, J., D., M.: Idiopathic senile macular hole: its early stages and pathogenesis, Arch Ophthalmol., 106; 1988 : 629–639.
6. Gonzalez, P., Parks, S., Dolan, F. et al.: The effects of pupil size on the multifocal electroretinogram, Doc Ophthalmol. 109; 2004 : 67–72.
7. Hejsek, L.: Mikroperimetrie a její klinický přínos při onemocnění sítnice, Čes. a Slov. Oftalmol., 62, 2006; 6 : 423–7.
8. Hood, D., C., Seiple, W., Holopigian, K. et al.: A comparison of the components of the multifocal and full-field ERGs, Vis. Neurosci., 1997; 14 : 533–544.
9. Hsuan, J., D., Brown, N., A., Bron, A., J. et al.: Posterior subcapsular and nuclear cataract after vitrectomy, J Cat Ref Surg. 27, 2001; 3 : 437–44.
10. Kelly, M., E., Wendel, R.,T.: Vitreous surgery for idiopathic macular holes, Arch Ophthalmol, 1991; 109 : 654–9.
11. Kumagai, K., Furukawa, M., Ogino, N. et al.: Vitreous surgery with and without internal limiting membrane peeling for macular hole repair, Retina, 2004; 24 : 721–7.
12. La Cour, M., Friis, J..: Macular holes: classification, epidemiology, natural history and treatment, Acta Ophthalmol. Scand., 80, 2002; 6 : 579–87.
13. Langrová, H., Hejsek, L.: Multifokální elektroretinografie a její význam v klinické praxi. In Rozsíval, P., Trendy soudobé oftalmologie, Praha, Galén, 2007 : 99–113.
14. Mester, V., Kuhn, F.: Internal limiting membrane removal in the management of full-thickness macular holes, Am J Ophthalmol. 2000; 129 : 769–77.
15. Moschos, M., Apostolopoulos, M., Ladas, J. et al.: Assessment of macular function by multifocal electroretinogram before and after epiretinal membrane surgery, Retina 21 : 590–595.
16. Niwa, T., Terasaki, H., Kondo, M. et al.: Function and morphology of macula before and after removal of idiopathic epiretinal membrane, Invest Ophthalmol Vis Sci 44 : 1652–1656.
17. Noyes, H., D.: Detachment of Retina with Laceration at Macula, Trans. Am Ophthalmol Soc. 1871; 8 : 128–9.
18. Ogata, K., Yamamoto, S., Mitamura, Y. et al.: Changes in multifocal oscillatory potentials after internal limiting membrane removal for macular hole: multifocal OPs after ILM removal, Doc Ophthalmol. 2007; 114(2):75–81.
19. Raymond, R., Margherio, M., D., Alan, R., M. et al.: Effect of Perifoveal Tissue Dissection in the Management of Acute Idiopathic Full-Thickness Macular Holes, Arch Ophthalmol. 000; 118 : 495–8.
20. Reese, A., B., Jones, I., S., Cooper, W., C.: Macular changes secondary to vitreous traction, Am. J. Ophthalmol., 1967; 95 : 544–9.
21. Shousha, M., A., Yoo, S., H.: Cataract surgery after pars plana vitrectomy. Curr Opin Ophthalmol. 21, 2010; 1 : 45–9.
22. Si, Y.J., Kishi, S., Aoyagi, K.: Assessment of macular function by multifocal electroretinogram before and after macular hole surgery, Br J Ophthalmol 83 : 420–424.
23. Smiddy, W., Feuer, W.: Incidence of Cataract Extraction After Diabetic Vitrectomy, Retina, 24, 2004; 4 : 574–81.
24. Šach, J., Karel, I., Kalvodová, B., Dotřelová, D.: Ultrastrukturální analýza tkáně odstraněné při operacích idiopatických makulárních děr. Čes a Slov Oftalmol. 2000; 56, (5): 286–292.
25. Tognetto, D., Grandin, R., Sanguinetti, G. et al.: Internal limiting membrane removal during macular hole surgery: Results of a multicenter retrospective study, Ophthalmol. 2006; 113 : 1401–10.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2011 Issue 5-6-
All articles in this issue
- Opacifikácia zadného puzdra pri dlhodobom sledovaní pacientov po implantácii hydrofilnej / hydrofóbnej šošovky Acri.Smart
- Metoda AquaLase – vliv na vznik sekundární katarakty a její bezpečnost
- Závislost nitroočního tlaku měřeného aplanační tonometrií, bezkontaktní tonometrií a TonoPenem na centrální tloušt’ce rohovky
- Příspěvek k vyšetřování funkce makulární krajiny při chirurgické léčbě idiopatické makulární díry
- Spontánne uzavretie idiopatickej diery makuly (prezentácia 4 prípadov)
- Minimální nález u pacienta s Bestovou chorobou podmíněnou mutací c.653G>A v genu BEST1
- Suprachoroidální hemoragie bez souvislosti s operačním výkonem
- Transkarunkulárna mediálna orbitotómia
- Porovnání keratometrických hodnot a excentricit rohovek u myopie, hypermetropie a emetropie
- Porovnanie vplyvu zmesi niektorých aminokyselín s antoglaukomatikami na VOT králikov (Prehľad výsledkov experimentálneho materiálu)
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Porovnání keratometrických hodnot a excentricit rohovek u myopie, hypermetropie a emetropie
- Minimální nález u pacienta s Bestovou chorobou podmíněnou mutací c.653G>A v genu BEST1
- Metoda AquaLase – vliv na vznik sekundární katarakty a její bezpečnost
- Suprachoroidální hemoragie bez souvislosti s operačním výkonem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



