-
Medical journals
- Career
Využití podtlakové terapie k řešení ranných komplikací po angiochirurgických výkonech
: M. Krejčí 1; T. Novotný 1; R. Staffa 1; P. Juřeníková 2
: II. chirurgická klinika, Centrum cévních onemocnění, LF MU a FN u sv. Anny v Brně 1; Katedra ošetřovatelství a porodní asistence, LF MU, Brno 2
: Cesk Slov Neurol N 2019; 82(Supplementum 1): 29-32
: Original Paper
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2019S29Cíl: Zhodnocení výsledků podtlakové terapie (negative pressure wound therapy; NPWT) při řešení infekčních ranných komplikací (II. a III. stupeň dle Szilagyiho klasifikace) u pacientů po elektivní tepenné revaskularizaci.
Soubor a metody: Retrospektivní analýza dat pacientů léčených v letech 2015–2018 pomocí NPWT pro infekční komplikace operačních ran po elektivních rekonstrukčních výkonech na tepnách dolních končetin.
Výsledky: V průběhu let 2015–2018 bylo pomocí NPWT léčeno celkem 13 pacientů po elektivní infrainguinální tepenné rekonstrukci. Jednalo se o 9 mužů a 4 ženy průměrného věku 72 let. U devíti pacientů (69,2 %) šlo o infekci stupně II dle Szilagyiho, u čtyř pacientů o infekci Szilagyi III (30,8 %). V 11 případech se jednalo o časnou infekci (84,6 %). Nejčastějším infekčním agens v ráně byl Staphylococcus aureus. Minimální délka sledování byla 12 měsíců. Průchodnost tepenných rekonstrukcí byla po dobu sledování 92,3 % a v 84,6 % bylo dosaženo úplného zhojení ran. Úspěšnost léčby ve skupině pacientů s arteficiálním štěpem byla 88,9 %.
Závěr: NPWT je účinnou metodou léčby infekčních ranných komplikací u pacientů po tepenné revaskularizaci na dolní končetině. Metoda vykazuje slibné výsledky i v řešení infekce cévních implantátů.
Klíčová slova:
podtlaková terapie – infekce – cévní chirurgie – angiochirurgický výkon
Úvod
Cévní chirurgie je specializovaným chirurgickým oborem obor se specifickými postupy v diagnostice a terapii, vč. operačních přístupů a řešení komplikací. Prognosticky významné je eventuální komplikované hojení operačních ran a s tím související riziko infekce cévní rekonstrukce.
Terapie ranné infekce se odvíjí od stavu pacienta, komorbidit a situace v operační ráně. V úvahu přichází lokální léčba se zachováním dosud průchodné rekonstrukce. U vybraných pacientů po tepenné revaskularizaci lze použít k topické léčbě lokalizované infekce operační rány stupně II a III dle Szilagyiho [1] podtlakovou terapii (negative pressure wound therapy; NPWT). Následně je v některých případech možná sutura rány, většinou jsou ale k dohojení zbytkového defektu využity materiály vlhkého hojení ran (moist wound healing; MWH) [2].
V případě nepříznivého lokálního nálezu je nezbytná explantace cévní náhrady a revaskularizace autologním štěpem, tepenným či žilním aloštěpem nebo cévní protézou [3–5].
Cílem práce bylo zhodnocení výsledků NPWT při řešení infekčních ranných komplikacích (surgical site infection; SSI) (II. a III. stupeň dle Szilagyiho klasifikace) u pacientů po elektivní tepenné revaskularizaci se zvláštním zaměřením na pacienty po implantaci cévní protézy.
Materiál a metodika
Do studie byli zařazeni všichni pacienti, kteří byli na našem pracovišti léčeni v letech 2015–2018 pomocí NPWT pro SSI po plánované tepenné rekonstrukci na dolní končetině. V souboru jsme hodnotili demografická data, bakteriální původce ranné infekce a úspěšnost léčby. Výsledky byly zpracovány metodikami deskriptivní statistiky. Indikačním kritériem pro zahájení NWPT bylo komplikované hojení operační rány po elektivní infrainguinální tepenné rekonstrukci. Kontraindikacemi byly známky těžké sepse a riziko krvácení z oblasti rekonstrukce.
K NPWT byl použit systém NPWT Vivano®Tec (Hartmann, Veverská Bítýška, ČR). Terapie byla zahájena po provedení débridementu rány. V případě infekce Szilagyi II jsme volili polyuretanovou pěnu a kontinuální podtlak 125 mm Hg. Pokud byl obnažen tepenný systém (Szilagyi III), použili jsme silikonový materiál Mepitel® One (Mölnlycke, Göteborg, Švédsko) na cévní strukturu a přes něj aplikovali bílou polyvinylalkoholovou pěnu s kontinuálním podtlakem 75 mm Hg až do překrytí rekonstrukce granulační tkání. Po přegranulování cévního svazku jsme již další léčbu vedli obdobně jako v případě infekce Szilagyi II, viz výše.
Po dosažení granulace a zmenšení rozsahu rány v rámci pravidelných výměn podtlakového systému byla provedena sutura rány nebo dohojení vhodnými preparáty MWH (nejčastěji obvaz s aktivním uhlím a stříbrem Actisorb® Plus [Systagenix, Praha, ČR], alginát Melgisorb® Plus [Mölnlycke, Göteborg, Švédsko] nebo hydrokoloidní krytí Aquacel® Ag [ConvaTec, Nové Město, ČR]). Pacienti byli do zhojení převazováni v režimu domácí péče (home care) 3× týdně s pravidelnými kontrolami v naší ambulanci 1× za 14 dnů. Po zhojení byli dále sledováni po dobu minimálně 12 měsíců.
Výsledky
V letech 2015–2018 bylo pomocí NPWT léčeno 13 pacientů po elektivní infrainguinální tepenné rekonstrukci na dolní končetině. Jednalo se o devět mužů a čtyři ženy, průměrného věku 72 (61–83) let. Komorbidity pacientů v souboru: hypertenze 77 %, ischemická choroba srdeční 46 %, cévní onemocnění mozku 15 %, diabetes mellitus 31 %, chronická renální insuficience 31 %, hyperlipidemie 54 %, obezita 77 %, kouření 85 %, chronická obstrukční plicní nemoc 15 %, defekt končetiny v době operace 15 %. V 11 případech byla cévní rekonstrukce indikována pro ischemickou chorobu dolních končetin a ve 2 případech pro aneuryzma podkolenní tepny. K cévní rekonstrukci byla použita v 8 případech pletená cévní protéza, ve 3 případech autologní vena saphena magna, v 1 případě byla provedena plastika tepen bovinním perikardem a v 1 případě pomocí autologní arteria femoralis superficialis. Pacienti s arteficiálními štěpy byli zařazeni do programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-33437A.
Ve sledovaném souboru jsme léčili SSI v 5 případech v oblasti třísla, v 6 případech v nadkolení a ve 2 případech na bérci. U 9 pacientů (69,2 %) šlo o infekci Szilagyi II a u 4 pacientů o infekci Szilagyi III (30,8 %). V 11 případech se jednalo o časnou pooperační infekci rány (84,6 %). Nejčastějším původcem infekce operační rány byl Staphylococcus aureus (30,8 %), dále Escherichia coli a Proteus mirabilis. Ve 23,1 % případů byla kultivace negativní.
U všech pacientů v souboru byla po provedení débridementu zahájena NPWT operační rány. Po dosažení redukce velikosti rány a kvalitních granulací byla NPWT ukončena a pacienti byli dále léčeni preparáty MWH do zhojení (obr. 1 a 2).
1. Sekundárně se hojící rána v pravém třísle u obézní pacientky po plastice femorální tepny (Szilagyi II, kultivačně Proteus a Staphylococcus aureus).
Fig. 1. Secondary healing of a wound in the right groin in obese patient after femoral artery patch angioplasty (Szilagyi II, wound culture: Staphylococcus aureus).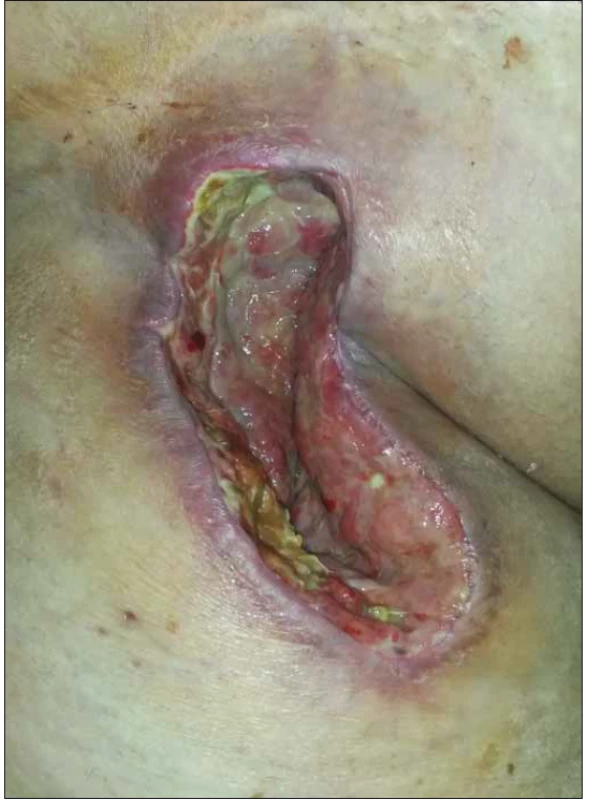
2. Stejná pacientka, zhojená rána po aplikaci podtlakové terapie a preparátů vlhkého hojení.
Fig. 2. Same patient, healed wound after negative pressure wound therapy and moist wound healing application.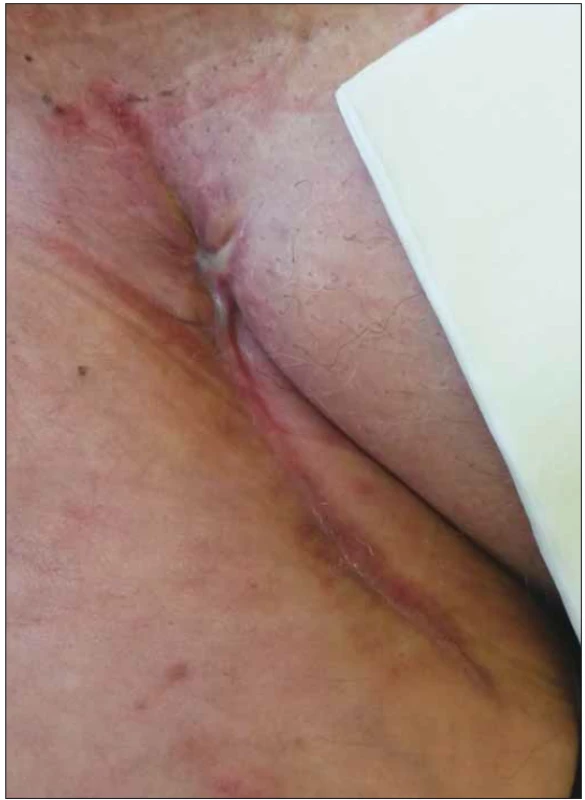
V průběhu sledování byla ve 12 případech zachována průchodnost tepenné rekonstrukce (92,3 %). V 11 případech došlo k úspěšnému kompletnímu zhojení operační rány při zachování končetiny (84,6 %).
Ve 2 případech NPWT úspěšná nebyla. V 1 případě se jednalo o pacienta s gangrénou levé nohy v době operačního výkonu s časnou infekcí rány Enterococcus faecalis. Tato infekce vedla k trombóze autologní rekonstrukce s nutností vysoké amputace končetiny. V druhém případě se jednalo o infekci rány Szilagyi III, kultivačně Escherichia coli a Staphylococcus aureus, s krvácivými komplikacemi z protetické plastiky v třísle, s nutností podvazu funkční rekonstrukce a exartikulace v kyčli.
Ve skupině pacientů s arteficiální náhradou bylo dosaženo zhojení rány, zachování průchodnosti rekonstrukce a záchrany končetiny v 88,9 %. Minimálně 12 měsíců po kompletním zhojení rány nebyly prokázány klinické ani UZ vyšetřením zjistitelné známky infekce štěpu.
Diskuze
Riziko SSI u infrainguinálních cévních rekonstrukcí dosahuje dle dostupných literárních údajů až 30 %, s maximem výskytu v oblasti třísla [6,7]. Nárůstu případů SSI lze čelit dodržováním opatření asepse, antisepse, antibiotické profylaxe, udržováním normotermie a homeostázy v perioperačním období a vhodnou operační technikou [8].
Výskyt infekce tepenné rekonstrukce je relativně nízký, postihuje dle literatury 0,2–5,0 % pacientů po tepenné revaskularizaci [9]. Mezi rizikovými faktory se uvádí diabetes mellitus, kouření, vyšší věk a obezita, imunosupresivní terapie, vyšší skóre American Society of Anesthesiologists, přítomnost infekčního fokusu v organizmu a kontaminace operačního pole [10]. Z infekčních fokusů je třeba zdůraznit význam v době operace přítomného ischemického vředu, gangrény nebo dekubitu, jejichž zhojení může být velmi obtížné i po úspěšné revaskularizaci [11].
Podtlaková terapie významně přispívá k rychlejšímu hojení ran, je komfortnější pro pacienta a představuje menší zátěž pro ošetřující personál. Jen u malé části pacientů je udávána vyšší bolestivost při pravidelné výměně systému v ráně a stres z anticipace bolesti při převazu [12]. Významnou roli v přístupu pacientů k léčbě hraje profesionalita a empatie ze strany ošetřujícího personálu [13].
Podtlaková terapie je provázena vyššími primárními náklady na materiál a přístrojové vybavení. Jak ale dokládají recentní studie zaměřené na ekonomickou stránku léčby, je tato metoda účinnější a díky urychlení procesu hojení ve výsledku levnější než konvenční terapie [14–16].
V našem případě bylo úspěšně zhojeno 11 ze 13 pacientů (84,6 %). Hodnocení výsledků je však limitováno různorodostí pacientů v souboru, rozdílnými lokalitami infekční komplikace a také velikostí souboru. Další limitací je i relativně krátká doba sledování, protože infekce cévních rekonstrukcí probíhají často mitigovaně a řadu let skrytě. Medicínské důkazy stran rizika recidivy infekce po NPWT v dlouhodobém sledování u těchto pacientů nejsou dostupné.
Nejasná a kontroverzní je také otázka léčby infekcí arteficiálních štěpů. Dle tradičního chirurgického přístupu není možné zhojení infekce bez explantace umělého materiálu. Následkem prosté explantace protézy může být ztráta končetiny a případně úmrtí pacienta. Možnosti okamžité náhrady odstraněného infikovaného implantátu v rámci jednoho operačního výkonu zůstávají nadále velmi limitované. Časté jsou i situace, kdy radikální řešení není možné. Také u těchto pacientů je pak často zkoušena NPWT. Několik recentně publikovaných prací udává velmi dobré výsledky léčby bez nutnosti explantace štěpu [9,17]. Naše vlastní zkušenosti z léčby SSI po cévní rekonstrukci, uvedené výše, jsou také velmi pozitivní. Na místě je určitá zdrženlivost vzhledem ke krátké době sledování pacientů (12 měsíců) a nedostupnosti dlouhodobých výsledků, ale přesto je možné recentní důkazy úspěšnosti léčby infekce cévních implantátů pomocí NPWT považovat za velmi slibné.
Závěr
Podtlaková terapie byla v námi sledovaném souboru pacientů ověřena jako účinná metoda léčby ranných komplikací u vybraných pacientů po tepenné revaskularizaci na dolní končetině. Metoda vykazuje slibné výsledky i v řešení lokalizované infekce cévní protézy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Tato práce byla podpořena z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-33437A „Vliv edukace na vybrané psychosomatické faktory u pacientů indikovaných k implantaci cévní protézy“. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Přijato k recenzi: 30. 6. 2019
Přijato do tisku: 7. 7. 2019
MUDr. Miroslav Krejčí, Ph.D.
II. chirurgická klinika
Centrum cévních onemocnění
FN u sv. Anny v Brně
Pekařská 664/53
656 91 Brno
e-mail: miroslav.krejci@fnusa.cz
Sources
1. Szilagyi ED, Smith RF, Elliott JP et al. Infection in arterial reconstruction with synthetic grafts. Ann Surg 1972; 176(3): 321–332. doi: 10.1097/ 00000658-197209000-00008.
2. Boateng J, Catanzano O. Advanced Therapeutic dressings for effective wound healing – a review. J Pharm Sci 2015; 104(11): 3653–3680. doi: 10.1002/ jps.24610.
3. Staffa R, Kříž Z, Vlachovský R et al. Autogenous superficial femoral vein for replacement of an infected aorto-ilio-femoral prosthetic graft. Rozhl Chir 2010; 89(1): 39–44.
4. Badretdinov IA, Pokrovsky AV. In situ aortofemoral reconstructions in surgical treatment of infected aortofemoral grafts. Angiol Sosud Khir 2015; 21(3): 173–180.
5. McGinigle KL, Pascarella L, Shortell CK et al. Spliced arm vein grafts are a durable conduit for lower extremity bypass. Ann Vasc Surg 2015; 29(4): 716–721. doi: 10.1016/ j.avsg.2014.11.013.
6. Diener H, Larena-Avellaneda A, Debus ES. Postoperative Komplikationen in der Gefässchirurgie. Chirurg 2009; 80(9): 814–826. doi: 10.1007/ s00104-009-1692-1.
7. Kuy S, Dua A, Desai S et al. Surgical site infections after lower extremity revascularization procedures involving groin incisions. Ann Vasc Surg 2014; 28(1): 53–58. doi: 10.1016/ j.avsg.2013.08.002.
8. Berríos-Torres SI, Umscheid CA, Bratzler DW et al. Centers for Disease Control and Prevention Guideline for the prevention of surgical site infection, 2017. JAMA Surg 2017; 152(8): 784–791. doi: 10.1001/ jamasurg.2017.0904.
9. Pirkl M, Daněk T, Černý M et al. Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky. Rozhl Chir 2013; 92(5): 237–243.
10. Suljagic V, Jevtic M, Djordjevic B et al. Surgical site infections in a tertiary health care center: prospective cohort study. Surg Today 2010; 40(8): 763–771. doi: 10.1007/ s00595-009-4124-4.
11. Antalová N, Pokorná A, Hokynková A et al. Factors influencing recurrence of the pressure ulcers after plastic surgery – retrospective analysis. Cesk Slov Neurol N 2018; 81/ 114 (Suppl 1): S23–S28.
12. Upton D, Stephens D. Andrews A. Patients‘ experiences of negative pressure wound therapy for the treatment of wounds: a review. J Wound Care 2013; 22(1): 34–39. doi: 10.12968/ jowc.2013.22.1.34.
13. Fagerdahl AM, Boström L, Ulfvarson J et al. Risk factors for unsuccessful treatment and complications with negative pressure wound therapy. Wounds 2012; 24(6): 168–177.
14. Apelqvist J, Willy C, Fagerdahl AM et al. Negative Pressure wound therapy – overview, challenges and perspectives. J Wound Care 2017; 26 (Suppl 3): S1–S154. doi: 10.12968/ jowc.2017.26.Sup3.S1.
15. Hiskett G. Clinical and economic consequences of discharge from hospital with on-going TNP therapy: a pilot study. J Tissue Viability 2010; 19(1): 16–21. doi: 10.1016/ j.jtv.2010.01.002.
16. Othman D. Negative pressure wound therapy literature review of efficacy, cost effectiveness, and impact on patients’ quality of life in chronic wound management and its implementation in the United Kingdom. Plast Surg Int 2012; 2012 : 374398. doi: 10.1155/ 2012/ 374398.
17. Berger P, de Bie D, Moll FL et al. Negative pressure wound therapy on exposed prosthetic vascular grafts in the groin. J Vasc Surg 2012; 56(3): 714–720. doi: 10.1016/ j.jvs.2012.02.007.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue Supplementum 1-
All articles in this issue
- The knowledge and practises of nurses in the prevention of medical devices related injuries in intensive care – questionnaire survey
- Effectiveness of comprehensive pain management in hard-to heal ulcers – a protocol of systematic review
- Negative wound pressure therapy in treatment of a pressure ulcer in paraplegics
- The use of negative pressure wound therapy for wound complication management after vascular procedures
- Mapping of pressure ulcers and non-healing wounds in medical curriculum
- Quality of life in patient with non-healing wounds
- Pain assessment of surgical wounds after angio-surgical interventions
- Effectiveness of hyperbaric oxygen therapy in non-healing ulcerations – meta-review
- Hyperbaric oxygen therapy in non-healing ulcerations – mechanisms of action, current european recommendations and case report
- Reconstruction of recurrent ischiadic pressure ulcer using turnover hamstring muscle flap
- Oxidative stress in wound healing – current knowledge
- Multidisciplinary approach in surgical pressure ulcer therapy after spinal cord injury
- Key factors for the development of pressure ulcers in surgical practice
- Pilot analysis of pressure ulcers – nationwide data from central adverse event reporting system
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Quality of life in patient with non-healing wounds
- The knowledge and practises of nurses in the prevention of medical devices related injuries in intensive care – questionnaire survey
- The use of negative pressure wound therapy for wound complication management after vascular procedures
- Negative wound pressure therapy in treatment of a pressure ulcer in paraplegics
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

