-
Medical journals
- Career
Využití ultrazvuku pro navigaci v neurochirurgii
Authors: M. Filip 1,2; P. Linzer 1; P. Jurek 1
Authors‘ workplace: Neurochirurgické oddělení, Krajská nemocnice T. Bati, a. s., Zlín 1; Ústav rehabilitace, LF OU a FN Ostrava 2
Published in: Cesk Slov Neurol N 2017; 80(6): 627-637
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2017627Overview
Intraoperativní sonografické zobrazení (IOS) v neurochirurgii představuje standardní nástroj pro aktuální a reálné zobrazení mozkové tkáně a zájmových struktur. Technologický rozvoj sonografické techniky vedl k miniaturizaci sond a umožnil jejich použití v omezeném prostoru kraniotomie. Kvalita zobrazení se zvýšila zavedením vysokofrekvenčních sond s vysokým prostorovým rozlišením. Prostředí mozkové tkáně je z hlediska insonačních podmínek příznivé a umožňuje přesnou lokalizaci a navigaci operačního přístupu u všech běžných druhů mozkových nádorů, jako jsou gliomy, metastázy, meningeomy a kavernomy. Základní zobrazení je B mód (2D zobrazení), které lze pro zlepšení orientace doplnit o rekonstruované 3D zobrazení. Tumorózní expanze se v IOS jeví proti mozkové tkáni jako hyperechogenní struktury. Další usnadnění orientace v IOS přináší integrace sonografického přístroje s optickou neuronavigací. Vedle navigační funkce je IOS výhodné při detekci a lokalizaci reziduí při resekcích gliálních nádorů a metastáz. Přispívá tak k dosažení co největší radikality resekce. Použití sonografické kontrastní látky při IOS zlepšuje dále kvalitu obrazu a snižuje vliv artefaktů na kvalitu zobrazení během resekce nádoru. Duplexní zobrazení v barevném dopplerovském nebo energetickém módu umožňuje lokalizovat cévní struktury, vyhodnotit jejich vztah k tumoru nebo lokalizovat cévní zásobení. Kromě lokalizace tumoru lze posoudit vnitřní strukturu tumoru a navigovat podle toho biopsie a přístup. Hlavními přednostmi IOS jsou přesné a aktuální zobrazení, dostupnost, libovolná opakovatelnost a vysoká kvalita zobrazení. Předpokladem vysoké výtěžnosti IOS je dlouhodobá zkušenost s tímto zobrazením. Nedostatkem je nemožnost navigovat kraniotomii a výskyt artefaktů při kontrole resekce.
Klíčová slova:
sonografické zobrazení – intraoperativní zobrazení – mozkový nádor – neuronavigace – hranice nádoruÚvod
Potřeba přesné, rychlé a jednoduché peroperační lokalizace mozkového nádoru spolu s možností kontroly průběhu vlastní operace je v neurochirurgii základním předpokladem optimálního pooperačního výsledku. Vedle běžně používaných neuronavigačních systémů založených na datech z předoperačního vyšetření magnetickou rezonancí (MR) se uplatňují intraoperativní zobrazovací technologie. Intraoperativní MR (iMR) poskytuje vysoce kvalitní a aktuální zobrazení, avšak její využití a zkušenosti jsou v současnosti omezeny jen na některá centra [1]. Technologie intraoperativní mobilní výpočetní tomografie (CT) nachází vedle spondylochirurgie uplatnění v neurotraumatologii a při stereotaktickém zavádění elektrod při hluboké mozkové stimulaci [2]. Vedle těchto zobrazovacích modalit se v praxi stále více uplatňuje intraoperativní sonografické zobrazení (IOS). Kvalitativní posun v úrovni sonografických přístrojů a miniaturizace vyšetřovacích sond přispěla k rozšíření tohoto intraoperativního zobrazení v neurochirurgii. Především možnost opakované, nezatěžující a dostatečně přesné lokalizace cílové struktury v mozkové tkáni dělá z IOS atraktivní navigační nástroj. V minulých dekádách demonstrovala řada studií vynikající lokalizační schopnost IOS pro prakticky všechny běžné mozkové expanze, ať už se jedná o gliomy různého stupně malignity, metastázy, meningeomy nebo kavernomy [3 – 10]. Schopnost kvalitního zobrazení se uplatňuje také u expanzí nenádorové povahy, jako jsou cévní léze nebo abscesy. Lokalizace cizích těles při operacích mozkových traumat je dalším příkladem využití v praxi. Vedle základního plošného zobrazení v tzv. B módu se uplatňuje 3D zobrazení, které poskytuje prostorové zobrazení a eliminuje možné nepřesnosti při čtení 2D obrazu. Pro další zpřesnění orientace v sonografickém obraze byly do klinické praxe zavedeny přístroje spojující ultrazvukové 2D/ 3D zobrazení s MR obrazem [11]. Informaci z 2D/ 3D obrazu lze doplnit o zobrazení cévních struktur vč. měření průtokových rychlostí. Slibné se zdá IOS s aplikací kontrastní látky, které dále zpřesňuje detekci nádorových reziduí a snižuje negativní vliv artefaktů [12]. V tomto přehledném sdělení jsou prezentovány typické sonografické nálezy a shrnuty naše zkušenosti vycházející z 20letých zkušeností s intraoperativním využitím sonografického zobrazení při operacích pro mozkové expanze. V současné době jsou v naší klinické praxi využívány sonografické přístroje BK Medical PRO Focus (BK Medical, Herlev, Dánsko) se semikonvexní sondou s pracovní frekvencí 8 MHz a dále systém SonoWand® (SONOWAND AS, Trondheim, Norsko) spojující sonografické zobrazení s neuronavigací založené na předoperačních MR datech.
Historie
Intraoperativní sonografické zobrazení mozku je běžnou součástí neurochirurgických operací od počátku 80. let minulého století. První popis intraoperativního použití ultrazvukového zobrazení se datuje rokem 1978 [13]. Později Rubin a Dorman poprvé publikovali svou práci o intraoperativní lokalizaci a navigaci při operacích mozkových expanzí [14]. V tomto období bylo využití ultrazvuku limitováno nedostatečnými technickými možnostmi přístrojů a současně také minimálními zkušenostmi s hodnocením ultrazvukového obrazu mozkové tkáně v průběhu operace. Rychlý technický vývoj na tomto poli rozšířil spektrum ultrazvukového vlnění o vysoké frekvenci, a zlepšil tak rozlišení vyšetřovaných struktur s minimalizací artefaktů. Miniaturizace ultrazvukových sond a zlepšení ergonomie umožnily jejich použití v omezeném prostoru operačního pole. IOS se stalo rovnocenným konkurentem dalších peroperačních zobrazovacích metod, jako jsou neuronavigační systémy, iMR a peroperační fluorescence. V posledních 10 – 15 letech přinesly další zlepšení kvality zobrazení přístroje kombinující peroperační ultrazvukový obraz s referenčním předoperačním MR obrazem.
Princip sonografického zobrazení
Podmínky pro šíření ultrazvukového vlnění v mozkové tkáni jsou po provedení kraniotomie velmi dobré a nejsou v ní překážky (jako kost nebo přítomnost vzduchu), které by bránily šíření ultrazvukových vln. Základním zobrazením je B mód (dvojrozměrný obraz, 2D obraz, B-obraz). Jedná se o dvojrozměrný záznam ech vznikajících na tkáňových rozhraních. Tato echa se zobrazují ve škále šedi, kdy je poloha bodu ve vertikálním směru dána tranzitním časem a v horizontální rovině směrem, ze kterého přichází. Intenzita bodu obrazu pak odpovídá intenzitě odrazu echa. Sonografický obraz je při IOS posuzován s ohledem na echogenicitu mozkové tkáně. Struktury a expanze, které mají vyšší echogenicitu, jsou označovány jako hyperechogenní (barva šedá až bílá). Z normálních nitrolebních struktur se jedná o tvrdou plenu mozkovou (např. falx cerebri), plexus chorioideus, arachnoideu a cévní struktury. Z hypoechogenních struktur (barva tmavě šedá až černá) lze rozlišit mozkové komory a arachnoidální cysty. Struktury neodrážející ultrazvuk se označují jako anechogenní. Patologické struktury, jako např. solidní nádory a krvácení, jsou typicky hyperechogenní. V případě expanzí obsahujících cystickou složku je její echogenicita závislá na obsahu a je obvykle hypoechogenní nebo anechogenní (obr. 1).
Image 1. Intraoperativní sonografický obraz v B módu. Fig. 1. Intraoperative ultrasound image in B-mode. 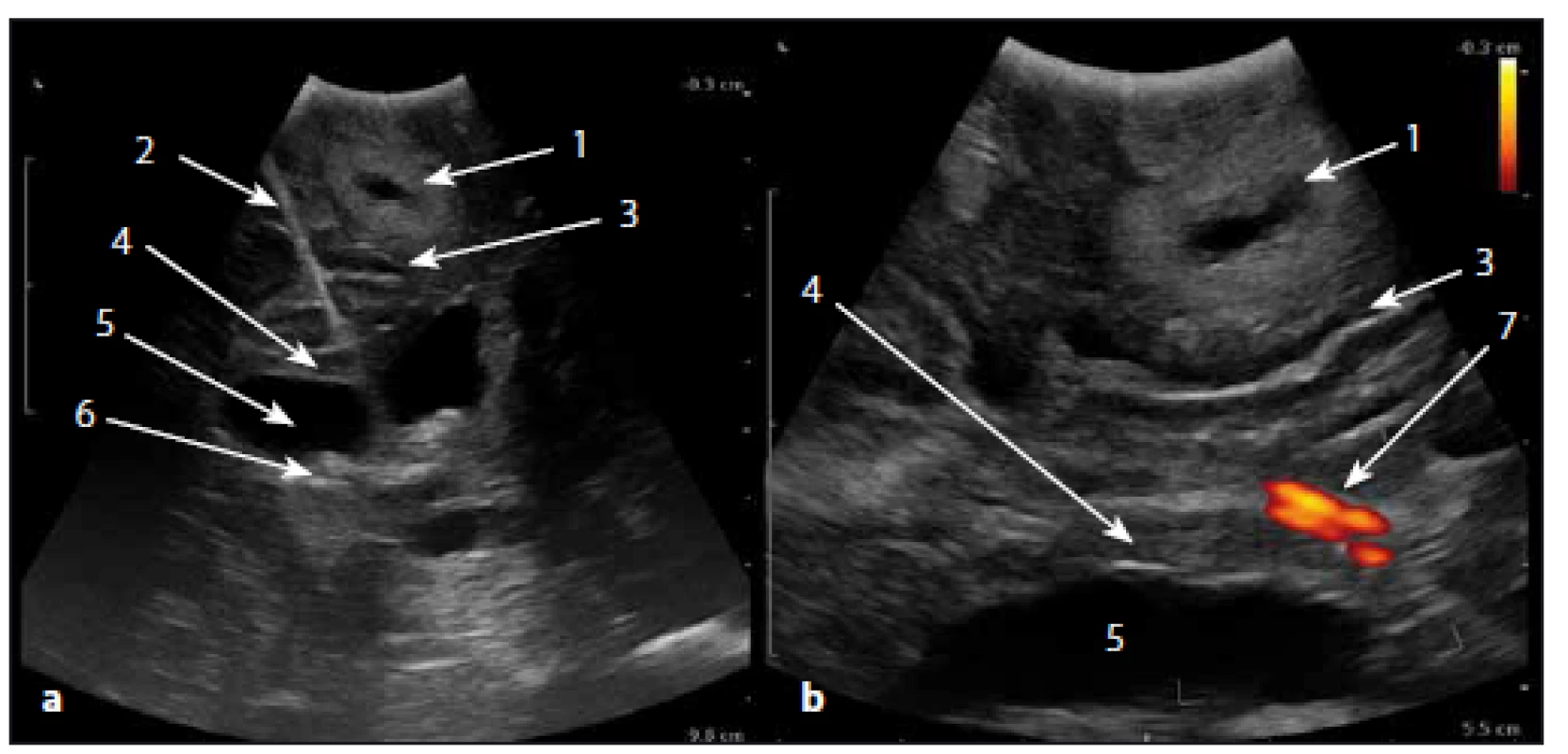
Obr. 1a) Koronární řez. Obr. 1b) Sagitální řez v (duplexní zobrazení s energetickým – PW módem). 1 – tumor, 2 – falx cerebri, 3 – mozkový sulkus, 4 – corpus callosum, 5 – postranní komora mozková, 6 – plexus chorioideus, 7 – aa. pericallosae. Fig. 1a) Coronal plane section. Fig. 1b) Sagittal plane section (duplex image with PW-mode). 1 – tumor, 2 – cerebral falx, 3 – brain sulcus, 4 – corpus callosum, 5 – lateral ventricle, 6 – choroid plexus, 7 – pericallosal arteries. Standardní 2D/ 3D IOS je možno doplnit o cévní zobrazení založené na Dopplerově principu při odrazu ultrazvukových vln od proudící krve. K dispozici je několik modalit zobrazení. Tzv. barevný Doppler (color flow Doppler; CF) barevně rozlišuje směr toku v insonované cévě (modrá od sondy, červená k sondě). Tzv. power Doppler (energetický mód, power mode) je zobrazení jednobarevné (oranžové) a intenzita roste se silou signálu. Neukazuje však směr a rychlost. Dopplerometrické zobrazení je peroperačně atraktivní především z hlediska lokalizace a ověření průchodnosti důležitých arteriálních struktur, event. zobrazení aneuryzmat a arteriovenózních malformací. A konečně spektrální dopplerometrické zobrazení dovoluje měření rychlosti ve zvoleném vzorkovém objemu. Tento typ zobrazení našel vedle cévního zobrazení využití také k detekci průtoku likvoru při dekompresních výkonech v zadní jámě lební u Chiari I malformací [15].
Technika intraoperativního ultrazvukového vyšetření
První sonografické zobrazení je obvykle prováděno po kraniotomii ještě před durotomií. Sonografická sonda je překryta sterilním obalem vyplněným sonografickým gelem a umístěna na povrch tvrdé pleny mozkové. K omezení artefaktů ze vzduchu při nedokonalém kontaktu sondy s povrchem je do kraniotomie aplikován fyziologický roztok. K intraoperativnímu zobrazení se využívají speciální lineární nebo semikonvexní multifrekvenční sondy o pracovním frekvenčním rozsahu 3 – 11 MHz (obr. 2). Pro povrchověji uložené léze jsou vhodnější vyšší frekvence sondy, která poskytuje větší rozlišení. Pro hluboko uložené léze jsou naopak výhodnější nižší frekvence s lepší penetrací. Nejběžnější zobrazovací frekvencí je 8 MHz. Neurochirurg následně provádí v B módu zobrazení v koronární, axiální a sagitální rovině. K orientaci v obraze napomáhá identifikace falx cerebri, mozkového kmene, mozkových komor a plexus chorioideus, mozkových závitů a mozkových tepen. Obraz při IOS je dynamický a lze pozorovat fyziologické pohyby, např. pulzace tepen. Sonografický obraz je možné zastavit a provádět měření vzdáleností či velikosti. Po lokalizaci cílové léze jsou optimalizovány umístění a rozsah durotomie. Další zobrazení je prováděno na povrchu mozku a neurochirurg volí optimální přístupovou cestu. U hluboko uložených lézí následují po kortikotomii další kontrolní zobrazení k ověření správného směru. Je výhodné vložit do operačního přístupu malý kousek neurochirurgické vaty, který je hyperechogenní a zlepšuje orientaci v IOS obraze (obr. 3). Se závěrem resekčního výkonu lokalizujeme eventuální nádorová rezidua s cílem maximálně dosažitelné resekce (obr. 4). IOS se tedy uplatňuje jak při lokalizaci a volbě přístupu, tak při kontrole resekce. V případech nejasného nálezu v mikroskopickém obraze a ztížené orientace v 2D zobrazení doplňujeme 3D rekonstrukci operované oblasti.
Image 2. Sonografický přístroj a sonda k intraoperativní sonografii. Fig. 2. Ultrasound device and ultrasound probe for the intraoperative use. 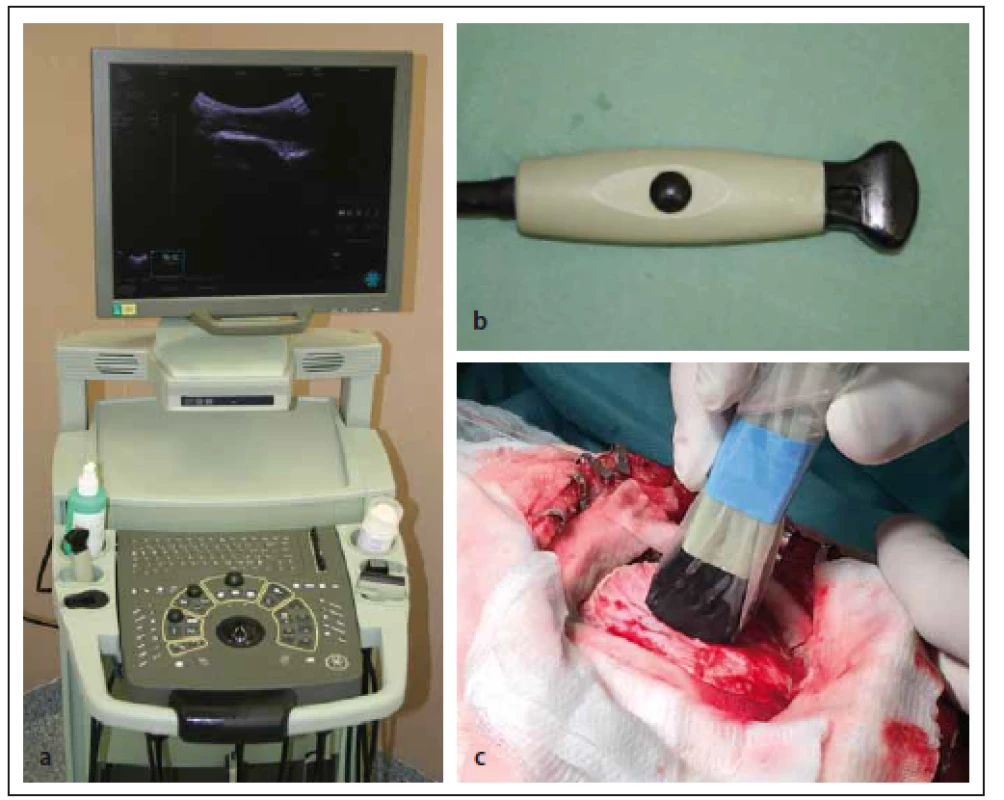
Obr. 2a) Sonograf BK Medical PRO Focus. Obr. 2b) Sonografická sonda 8 MHz. Obr. 2c) Sonda v kraniotomii. Fig. 2a) Ultrasound device BK Medical PRO Focus. Fig. 2b) Ultrasound probe 8 MHz. Fig. 2c) The probe in craniotomy. Image 3. Sonografický peroperační obraz přístupové cesty a korespondující pooperační MR koronární řez v T1W obraze. Fig. 3. The ultrasound image of the surgical approach and corresponding postoperative MRI T1W image in coronal section. 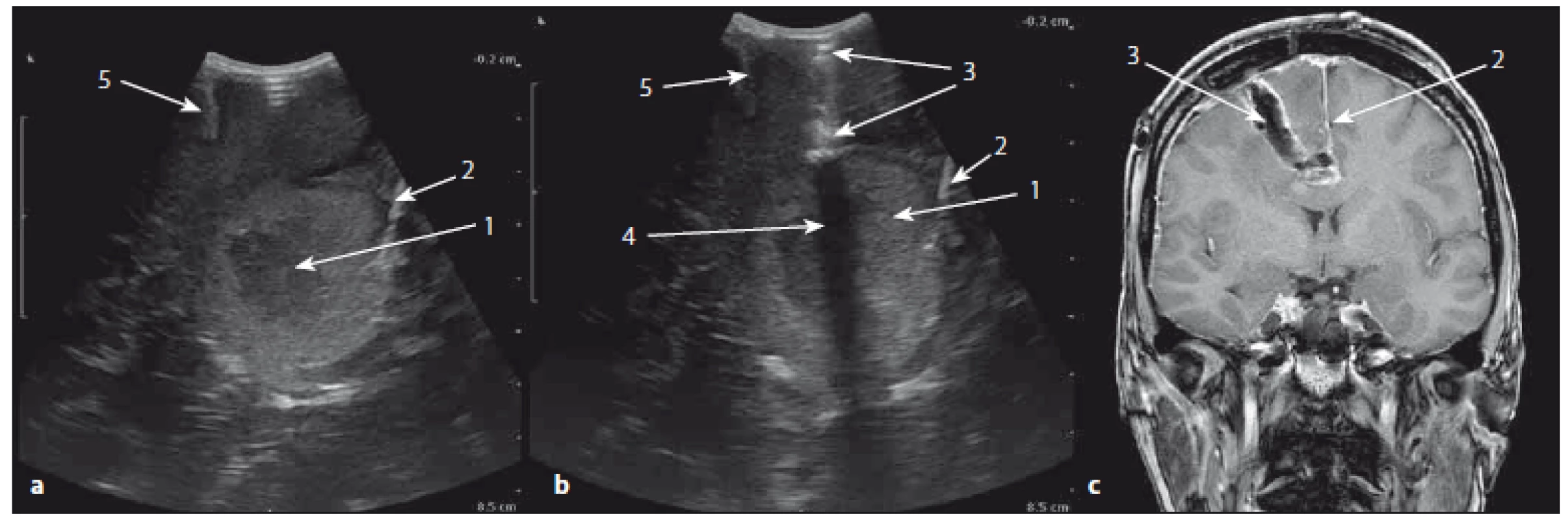
a) Sonografický obraz před kortikotomií, b) sonografický obraz přístupové cesty, c) MR T1W obraz po resekci nádoru. 1 – tumor, 2 – falx cerebri, 3 – přístupová cesta, 4 – artefakt, 5 – sulcus cerebri. a) Ultrasound image before corticotomy, b) ultrasound image of approach, c) MRI T1W postoperative image. 1 – tumor, 2 – cerebral falx, 3 – surgical approach, 4 – artefact, 5 – cerebral sulcus. Image 4. Sonografický obraz metastázy mozečku před a po resekci. Fig. 4. The ultrasound image of cerebellar metastasis before and after resection. 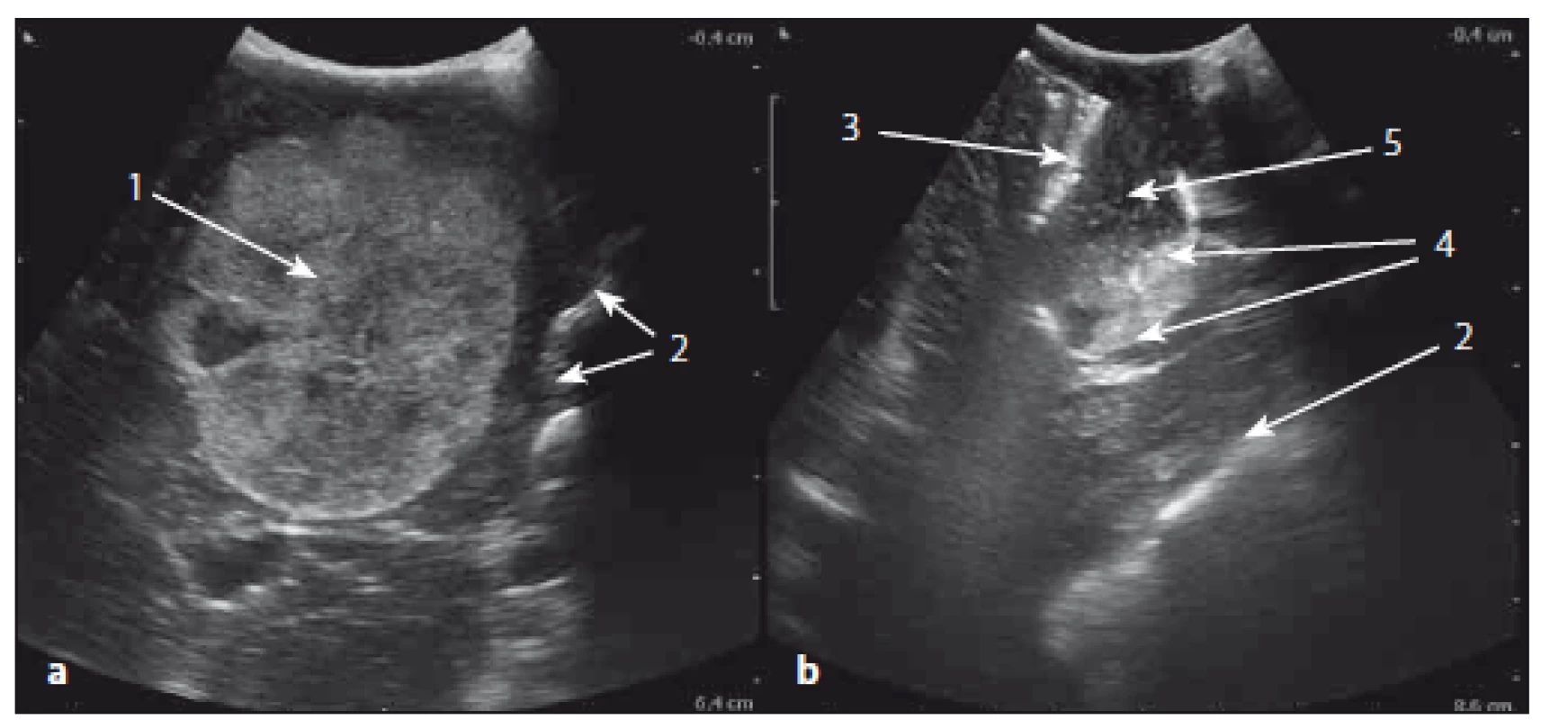
Obr. 4a) Metastáza mozečku. Obr. 4b) Sonografický nález rezidua tumoru. 1 – tumor, 2 – zadní stěna os petrosum, 3 – artefakt z hemostyptického materiálu na stěně, 4 – reziduum tumoru, 5 – resekční dutina. Fig. 4a) Cerebellar metastasis. Fig. 4b) Ultrasound image of tumor’s residue. 1 – tumor, 2 – posterior wall of petrous bone, 3 – artefact due to hemostyptic material on the wall, 4 – residue of tumor, 5 – resection cavity. 3D sonografické zobrazení
Sonografický obraz v B-módu představuje plošné zobrazení se ztrátou jednoho rozměru. To může přispět k chybnému vyhodnocení 2D obrazu a přehlédnutí např. rezidua tumoru. Moderní sonografické přístroje disponují možností 3D zobrazení. Principem 3D zobrazení je počítačová rekonstrukce z řady za sebou následujících dvojrozměrných zobrazení. Chirurg při výkonu provede posunem nebo nakláněním sondy sekvenci zobrazení a v horizontu desítek vteřin získává prostorové 3D zobrazení (obr. 5) [16,17].
Image 5. Sonografický 3D obraz kavernomu čelního laloku vpravo. Fig. 5. The ultrasound 3D image of right frontal lobe cavernoma. 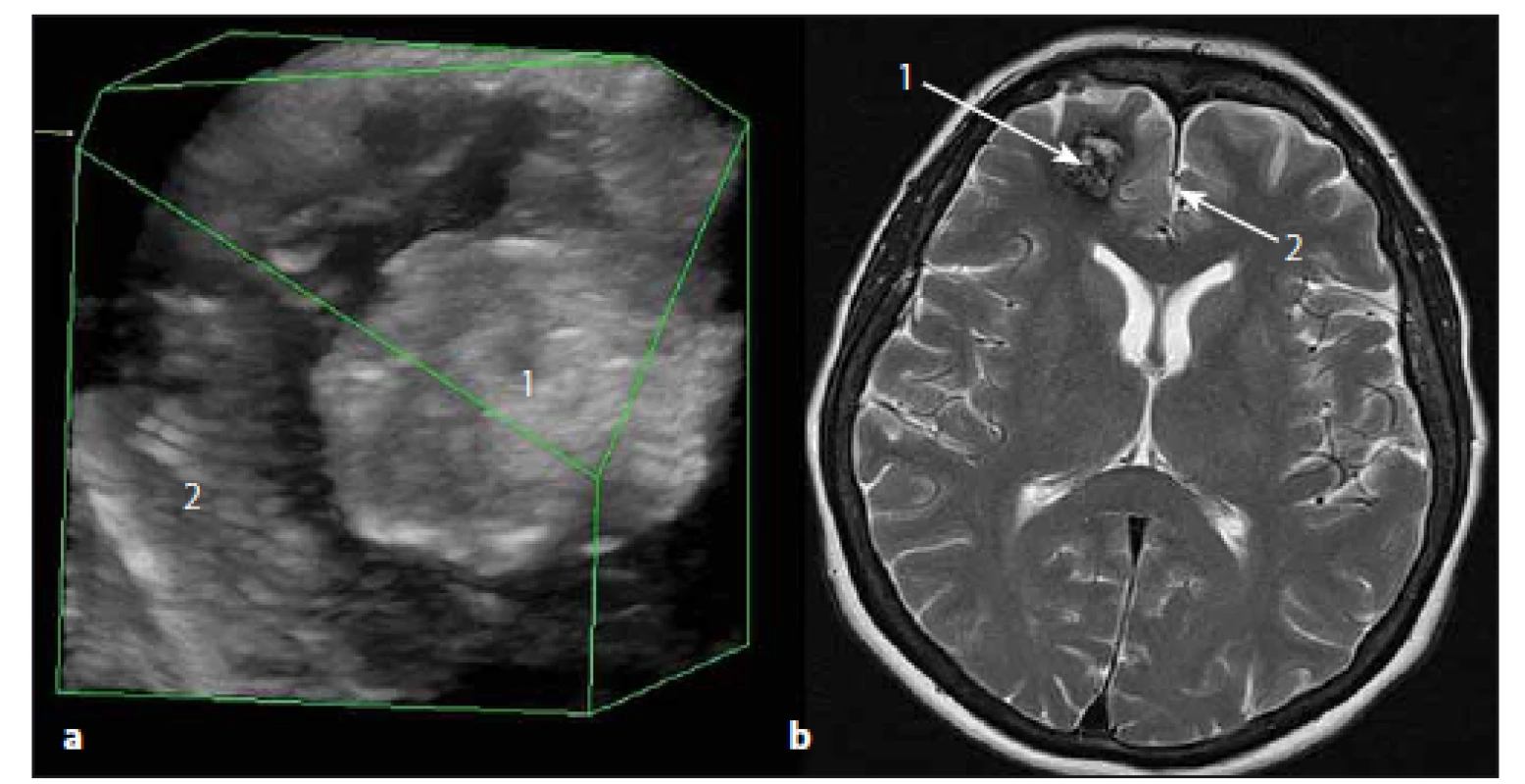
Obr. 5a) 3D sonografický obraz. Obr. 5b) MR T2W obraz. 1 – kavernom, 2 – falx cerebri. Fig. 5a) 3D ultrasound image. Fig. 5b) MRI T2W image. 1 – cavernoma, 2 – cerebral falx. IOS navigované biopsie
Současné moderní sonografické přístroje disponují funkcí zobrazení trajektorie pro zacílení biopsie. Na sonografickou sondu je pro tento účel upevněn bioptický adaptér. V duplexním zobrazení je možno nejen zaměřit cíl, ale také ověřit nepřítomnost cévních struktur v trajektorii biopsie (obr. 6).
Image 6. Sonografický obraz glioblastomu thalamu a korespondující MR obraz v T2W vážení. Fig. 6. The ultrasound image of thalamic glioblastoma and corresponding MRI T2W image. 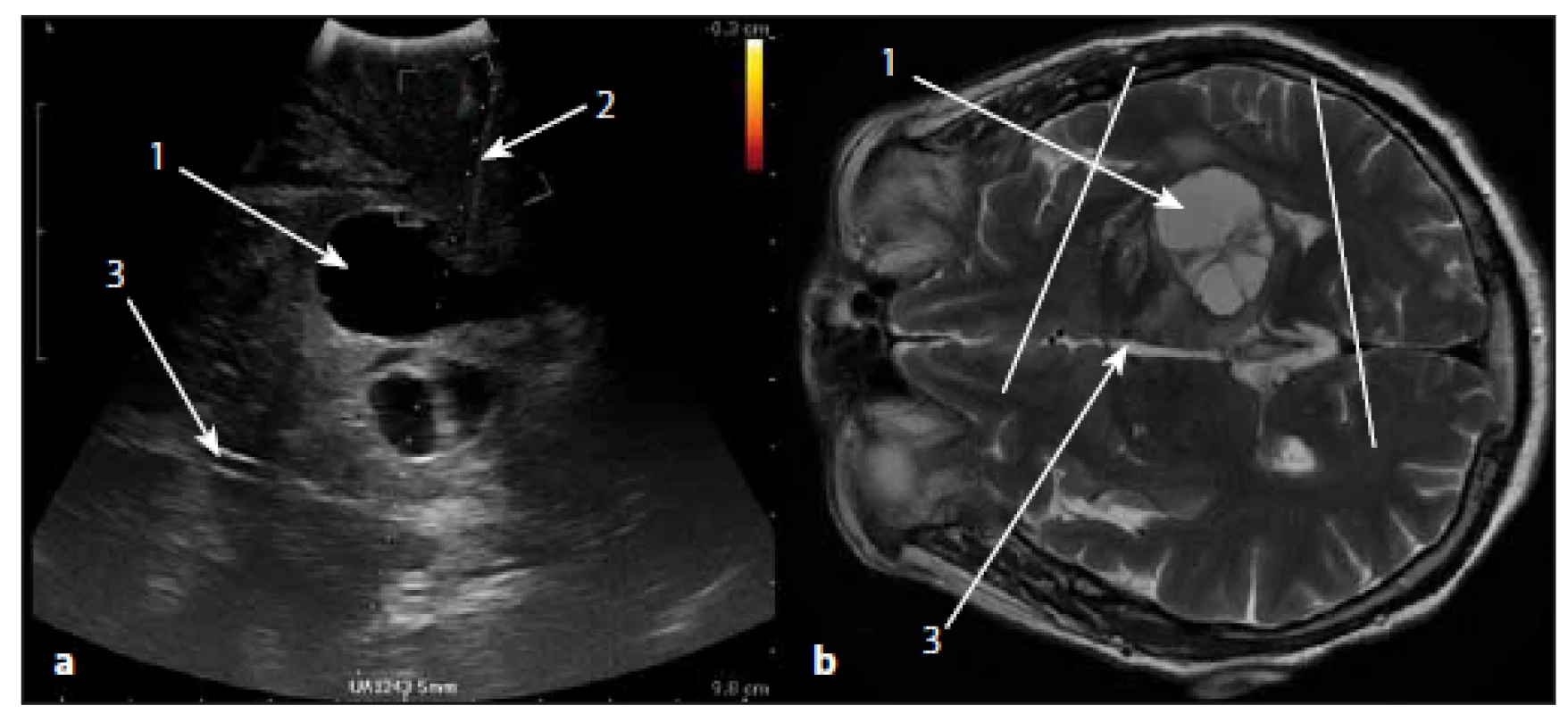
Obr. 6a) Sonografický obraz s trajektorií biopsie. Obr. 6b) Odpovídající MR T2W obraz. 1 – glioblastom, 2 – bioptická jehla, 3 – III. komora mozková. Fig. 6a) Ultrasound image with biopsy needle. Fig. 6b) Corresponding MRI T2W image. 1 – glioblastoma, 2 – biopsy needle, 3 – third ventricle. Fúze intraoperativního sonografického obrazu s předoperačním MR vyšetřením
Snaha spojit výhody IOS a optické neuronavigace vedly k vývoji systémů, které integrují do jednoho přístroje obě tyto zobrazovací metody nebo spolupracují oba systémy externě. Příkladem systému integrovaného do jednoho přístroje je SonoWand® (SONOWAND AS, Trondheim, Norsko). Takovéto spojení pak umožňuje srovnání, event. fúzi, sonografického obrazu s MR obrazem a usnadňuje operatérovi orientaci v sonografickém obraze (obr. 7). IOS pak koriguje možnou chybu přesnosti neuronavigace po kraniotomii. Jinou alternativou se v budoucnu zdají být sonografické přístroje schopné fúze MR vyšetření pacienta s transkraniálním duplexním sonografickým zobrazením (TCCS) – Esaote® (Esaote, Genova, Itálie), GE® (GE Healthcare, Waukesha, USA) nebo Toshiba Aplio® (Toshiba Medical Systems, Tochigiken, Japonsko). Zatím jsou tyto systémy konstruovány pro využití v neurologické diagnostice.
Image 7. Sonografické a MR zobrazení na přístroji SonoWand. Fig. 7. Ultrasound and MR images using SonoWand device. 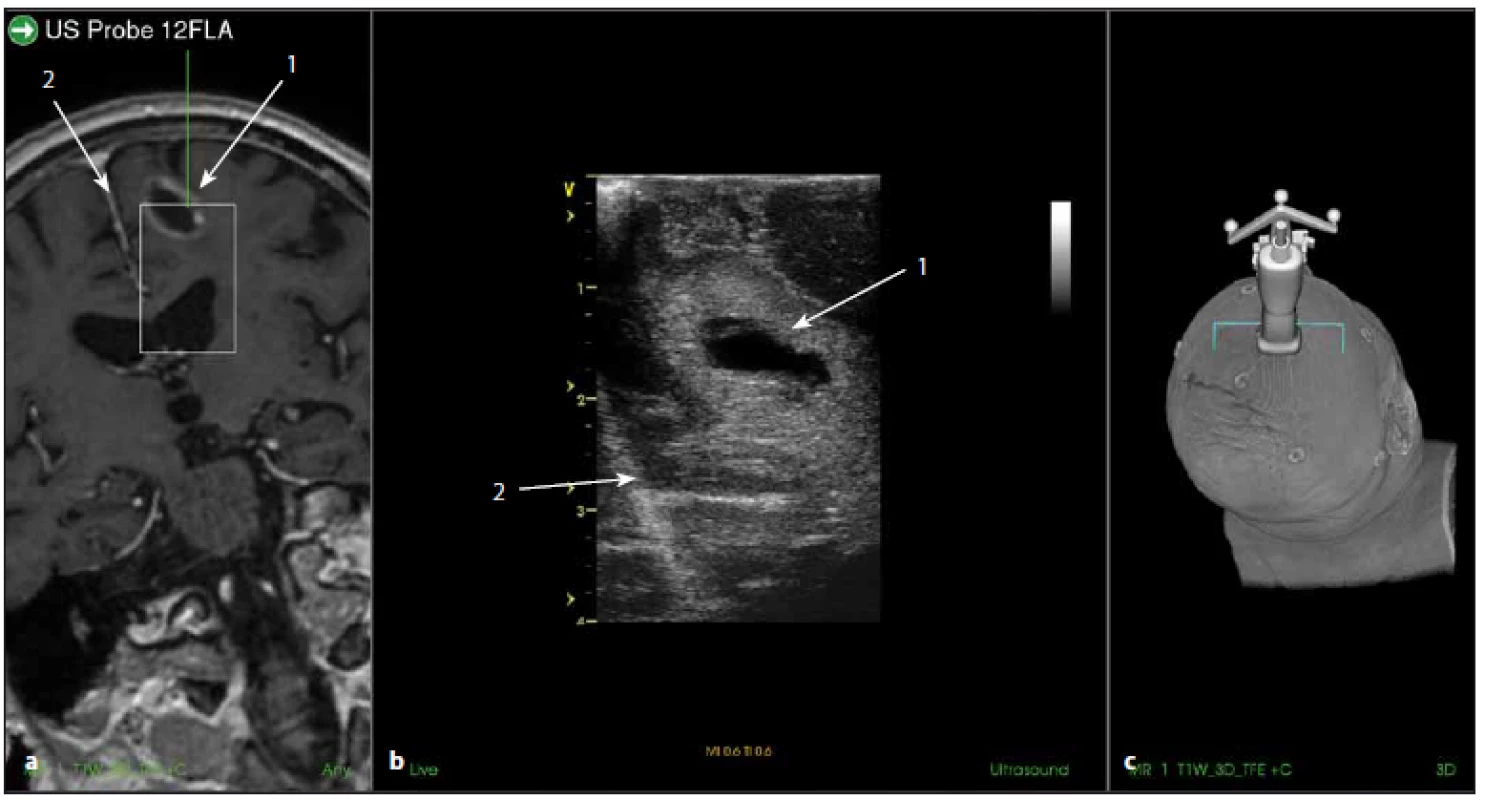
a) MR T1W obraz glioblastomu, b) odpovídající sonografický obraz, c) pozice sondy. 1 – tumor, 2 – falx cerebri. a) MRI T1W image of glioblastoma, b) corresponding ultrasound image, c) position of the probe. 1 – tumor, 2 – cerebral falx. Navigace pomocí IOS u operací mozkových expanzí
Vysokostupňové gliomy
Radikální resekce infiltrativních astrocytárních nádorů pozitivně ovlivňuje celkové přežití pacientů, délku období bez progrese nemoci i jeho kvalitu. Je klíčovým prognostickým faktorem [18]. IOS se při operacích gliomů uplatňuje jak při lokalizaci, tak i při kontrole radikality resekce [4,6,19,20]. V sonografickém obraze se u vysokostupňových tumorů obvykle jedná o heterogenní hyperechogenní strukturu (obr. 8). Sonografická detekce reziduí může přispět ke zvýšení radikality operace a prodloužení doby přežití pacientů [21]. Podle Campa et al je 3D IOS zobrazení schopno nejen detekovat přítomnost expanze, ale i rozlišit různé vlastnosti intrinzických nádorů s těsnou korelací mezi obrazovými charakteristikami a histologickými rysy [20]. Perifokální edém se zobrazuje jako lehce hyperechogenní změny v bílé hmotě. Nekrotické části a pseudocysty jsou obvykle hypoechogenní až anechogenní (obr. 9). IOS zobrazení je u recidivujících vysokostupňových gliomů (po radioterapii a chemoterapii) proti primárním operacím odlišné. Nadále umožňuje přesnou lokalizaci léze a navigaci přístupu, avšak nedokáže dostatečně rozlišit mezi tumorózní a změněnou netumorózní tkání [6,22].
Image 8. Sonografický obraz a odpovídající upravený MR T1W obraz glioblastomu levého temporálního laloku. Fig. 8. Ultrasound image and corresponding adjusted MRI T1W image of the temporal lobe glioblastoma. 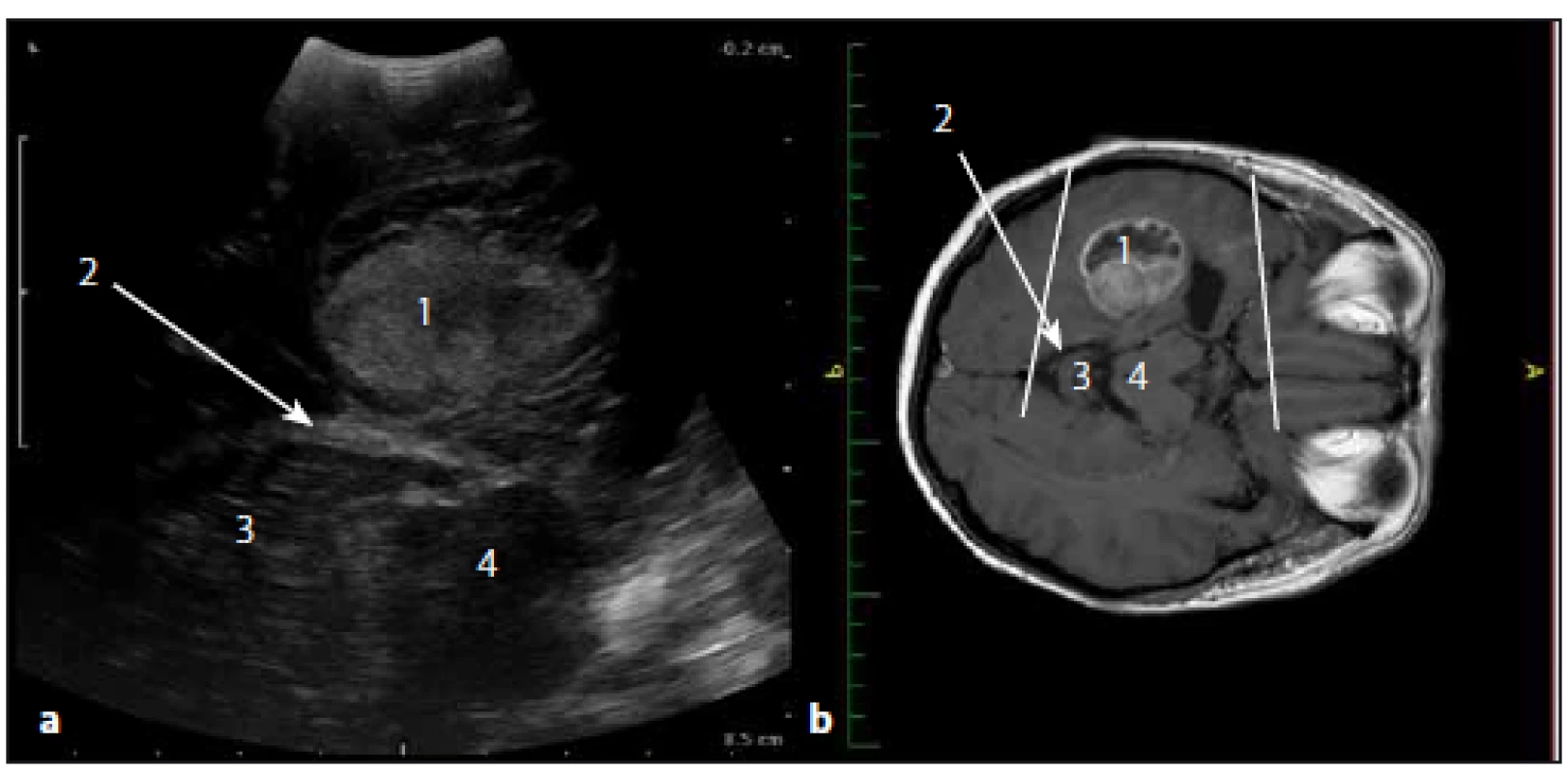
Obr. 8a) Sonografický obraz. Obr. 8b) MR T1W obraz. 1 – glioblastom, 2 – incisura tentoria, 3 – mozeček, 4 – mozkový kmen. Fig. 8a) Ultrasound image. Fig. 8b) MRI T1W image. 1 – glioblastoma, 2 – tentorial incisura, 3 – cerebellum, 4 – brain stem. Image 9. Glioblastom frontálně vlevo a v corpus callosum v sonografickém duplexním a MR T1W obraze. Fig. 9. Glioblastoma of the left frontal lobe and of corpus callosum in ultrasound duplex image and MRI T1W image. 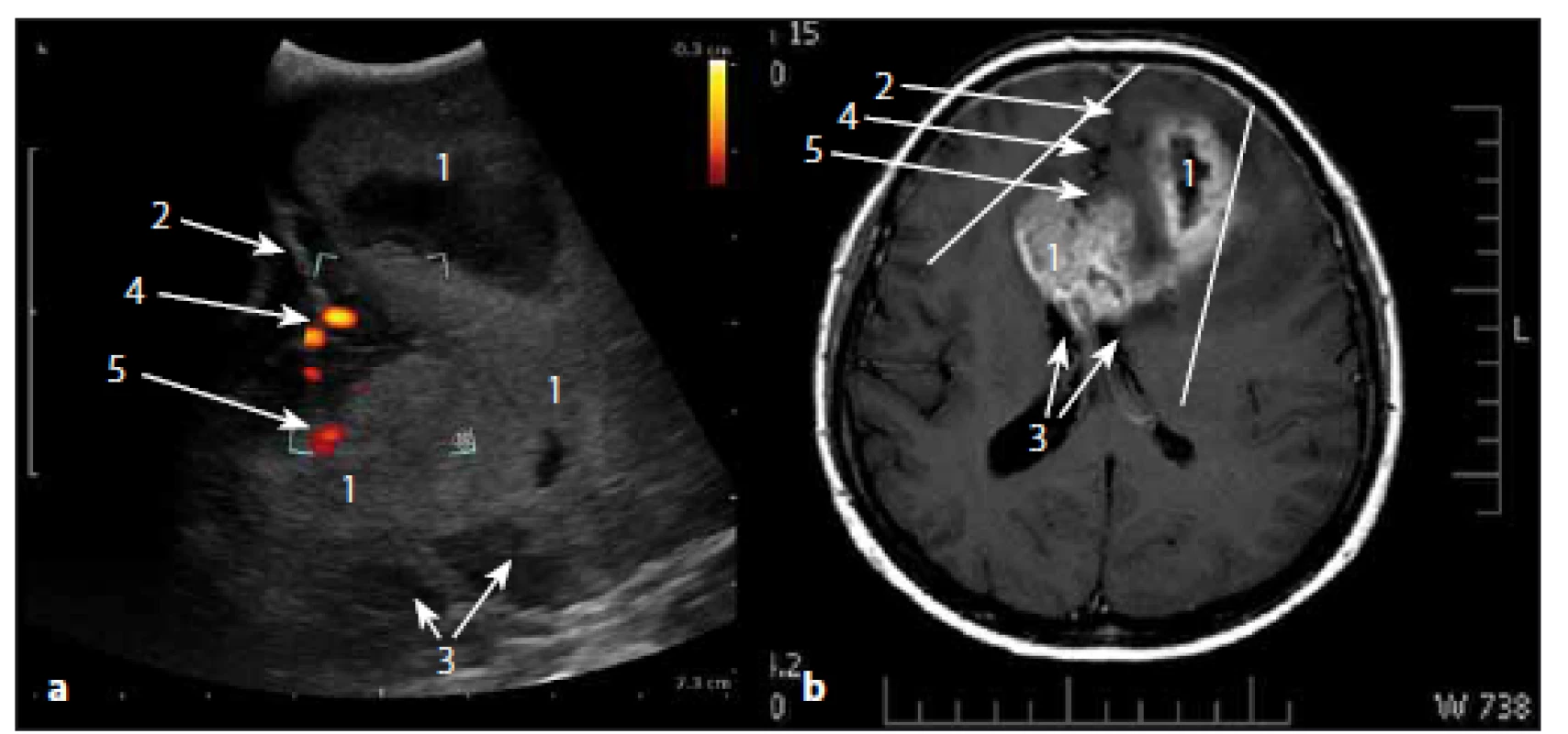
Obr. 9a) Sonografický duplexní obraz (energetický mód). Obr. 9b) MR T1W obraz. 1 – glioblastom, 2 – falx cerebri, 3 – postranní komora, 4 – a. callosomarginalis, 5 – a. pericallosa. Fig. 9a) Ultrasound duplex image (power mode). Fig. 9b) MRI T1W image. 1 – glioblastoma, 2 – cerebral falx, 3 – lateral ventricle, 4 – callosomarginal artery, 5 – pericallosal artery. Nízkostupňové gliomy
Podobně jako u maligních variant gliomů má operační léčba nízkostupňových gliomů za cíl maximální rozsah resekce při zachování neurologických funkcí. Resekce nádoru může být v tomto případě ztížena malým rozdílem ve vzhledu mezi normální a nádorovou tkání. Vedle intraoperativního MR zobrazení je IOS spolehlivým nástrojem lokalizace i malých tumorů (obr. 10) [5,23 – 25]. Sonografická navigace je úspěšná i v případech, kdy konvenční neuronavigační technika selže [23]. Názory na přínos IOS ke kontrole radikality resekce se různí a zdá se, že úspěšnost detekovat reziduum nádoru je u MR a iMR zobrazení vyšší [5,23]. Jiní autoři se domnívají, že artefakty stěžující lokalizací reziduí lze eliminovat [26]. Vedle IOS lokalizace a kontroly resekce nachází uplatnění cévní zobrazení v energetickém módu (power mode) při operacích v oblasti insuly, kdy je důležitá lokalizace lentikulostriátních arterií [27]. Peroperační podání sonografické kontrastní látky může rozlišit mezi nízkostupňovým a vysokostupňovým gliomem [28].
Image 10. Astrocytom grade II frontálně vpravo – sonografický a MR T1W obraz. Fig. 10. Low-grade astrocytoma (grade II) of the right frontal lobe – ultrasound and MRI T1W images. 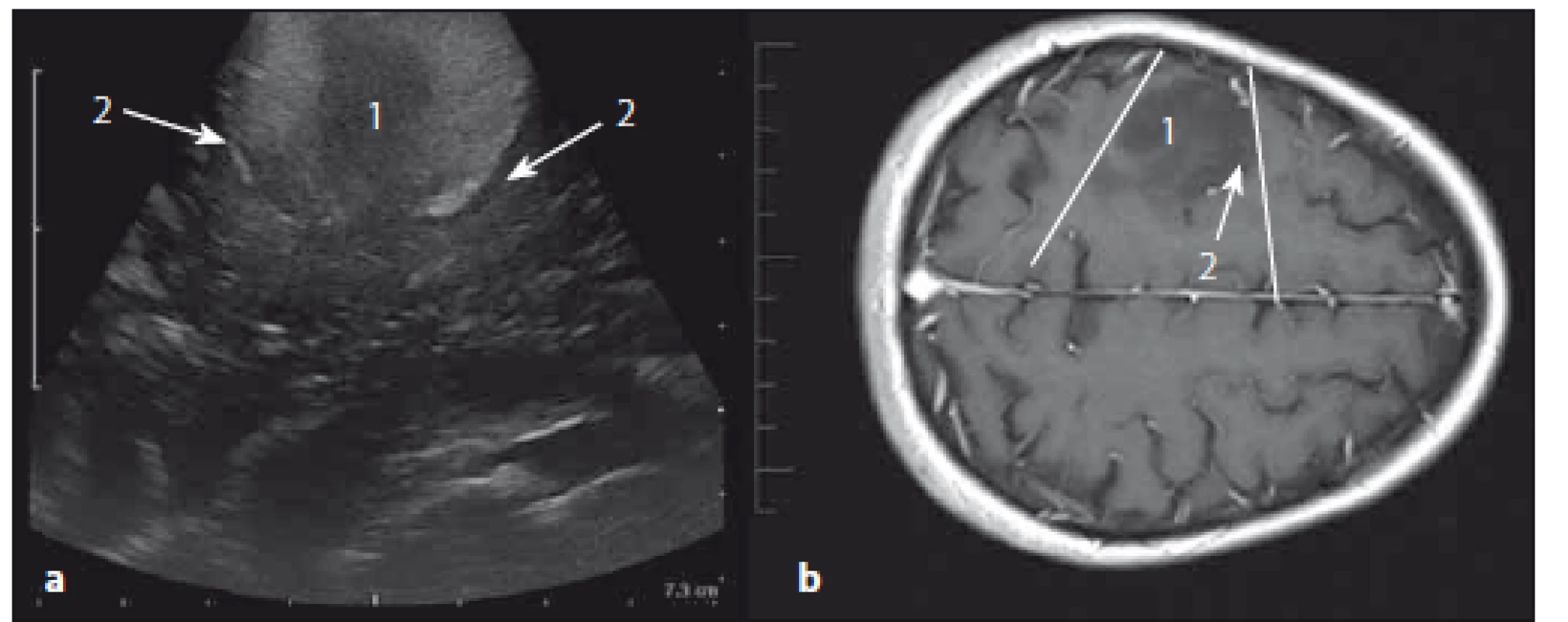
Obr. 10a) Sonografický obraz. Obr. 10b) MR T1W obraz. 1 – tumor, 2 – sulcus cerebri. Fig. 10a) Ultrasound image. Fig. 10b) MRI T1W image. 1 – tumor, 2 – cerebral sulcus. Metastázy
Cílem neurochirurgické léčby mozkových metastáz je dosáhnout lokální kontrolu nádorového onemocnění, udržet, event. i zlepšit kvalitu života nemocných. Mozkové metastázy jsou z hlediska intraoperativní sonografie velmi dobře zobrazitelnou lézí prakticky vždy (obr. 11). Sonograficky lze lokalizovat a navigovat i hluboko uložené léze [3,7]. Neurochirurgická resekce s kontrolou IOS zlepšuje dle de Lima Oliviera et al pooperační výsledky v Karnofského škále a snižuje objem reziduálního nádoru [29].
Image 11. Metastáza okcipitálního laloku vlevo v sonografickém a MR T1W obraze. Fig. 11. Metastasis of the left occipital lobe in ultrasound and MRI T1W images. 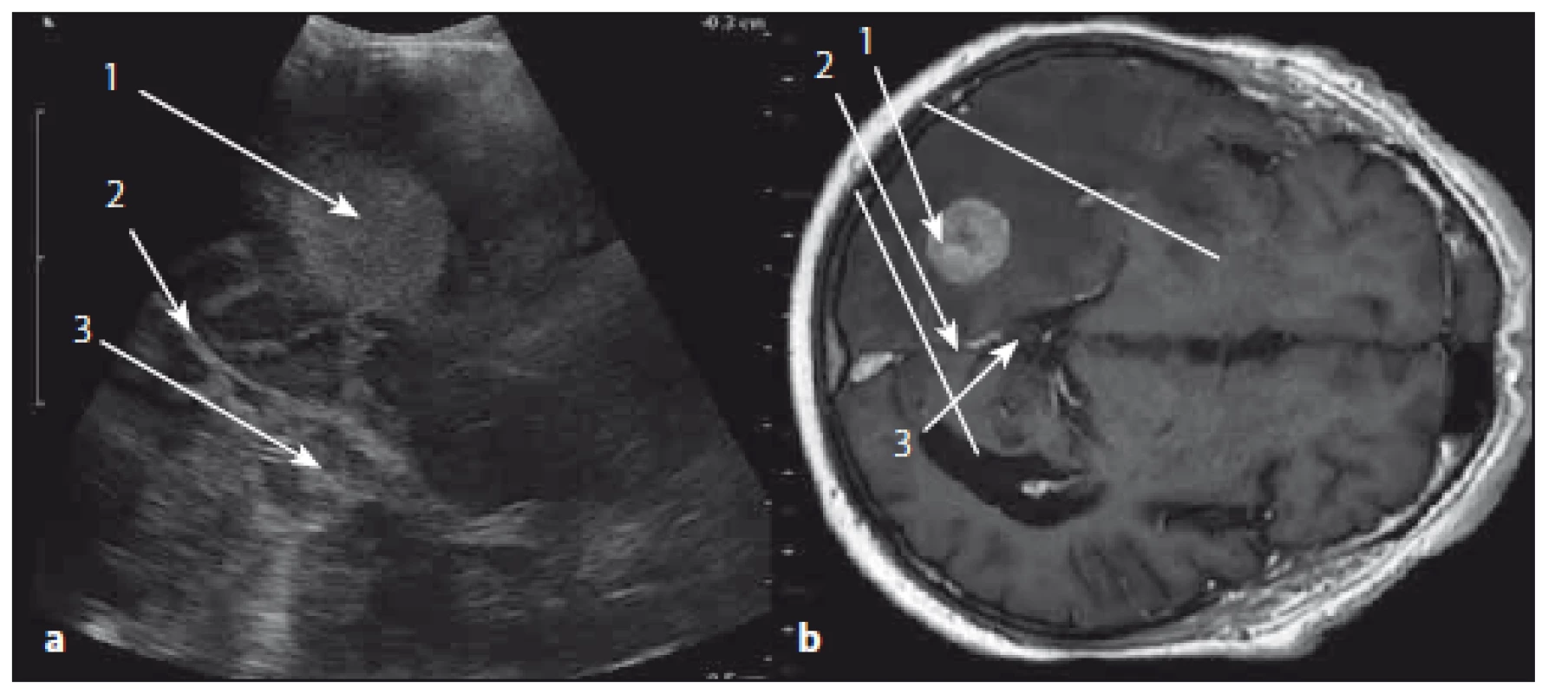
Obr. 11a) Sonografický obraz. Obr. 11b) MR T1W obraz. 1 – tumor, 2 – falx cerebri, 3 – incisura tentorii. Fig. 11a) Ultrasound image Fig. 11b) MRI T1W image. 1 – tumor, 2 – cerebral falx, 3 – tentorial incisura. Meningeomy
Meningeomy jsou v IOS hyperechogenního vzhledu s homogenní, někdy granulární strukturou obrazu. Pokud jsou přítomny kalcifikace, pak mohou být patrné akustické stíny. Okolní edematózní tkáň je v sonografickém obraze lehce hyperechogenní (obr. 12). Po provedení kraniotomie je meningeom vyšetřen transdurálně ve dvou rovinách, event. ve 3D zobrazení, a jsou identifikovány anatomické struktury v okolí expanze (falx cerebri, tentorium, poloha venózních splavů, komory s plexus chorioideus, arachnoidální prostory a průběh cévních struktur). Duplexní barevné zobrazení (obvykle v energetickém módu) dovoluje identifikovat arteriální zásobení a napomoci při devaskularizaci tumoru (obr. 13). V průběhu zmenšování meningeomu je sonograficky kontrolována tloušťka zbývající vrstvy meningeomu. IOS poskytuje užitečné a aktuální peroperační informace, které napomáhají při bezpečné resekci nádoru [30]. Po exstirpaci se dá ověřit v energetickém módu nebo barevném dopplerovském módu průchodnost důležitých cév [31].
Image 12. Meningeom čichové rýhy – srovnání axiálních sonografických a MR T1W obrazů. Fig. 12. Olfactory meningeoma – comparison of axial ultrasound and MRI T1W images. 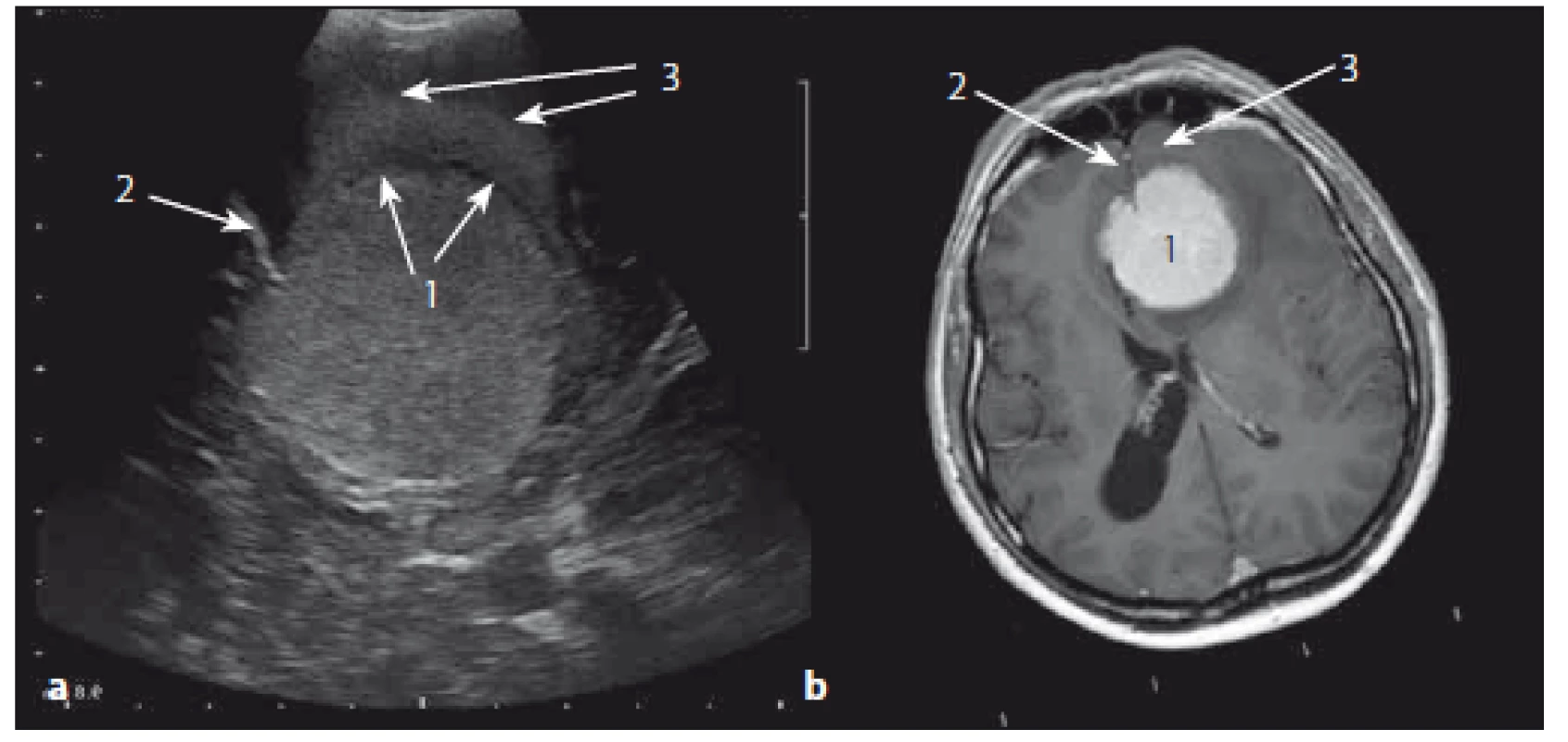
Obr. 12a) Sonografický obraz. Obr. 12b) MR T1W obraz. 1 – meningeom, 2 – falx cerebri, 3 – perifokální edém. Fig. 12a) Ultrasound image. Fig. 12b) MRI T1W image. 1 – meningeoma, 2 – cerebral falx, 3 – perifocal edema. Image 13. Sonografické duplexní zobrazení cévního zásobení meningeomu čichové rýhy. Fig. 13. The ultrasound duplex image of arterial supply of olfactory meningioma. 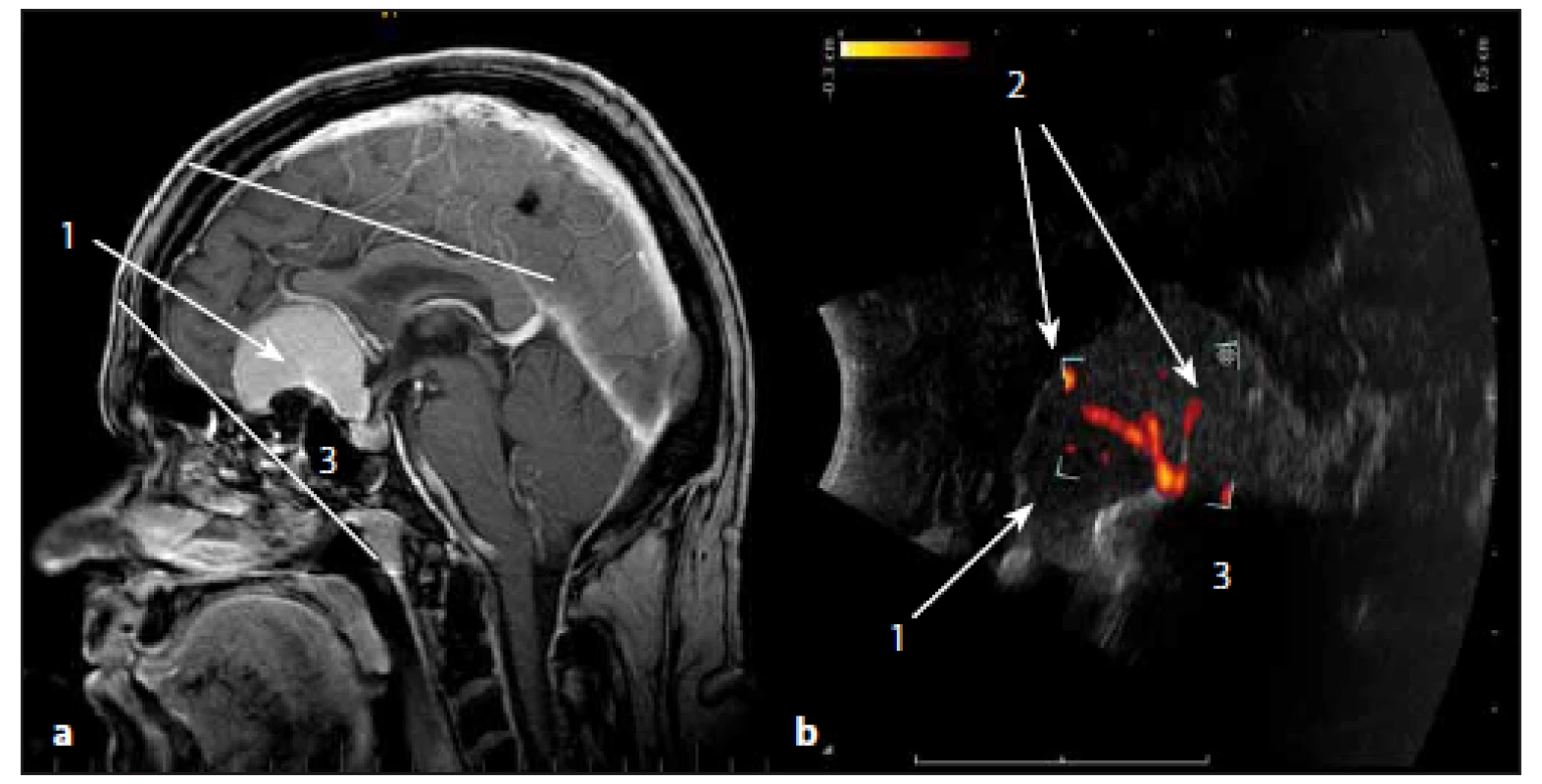
Obr. 13a) MR T1W obraz. Obr. 13b) Sonografický duplexní obraz (energetický mód). 1 – meningeom, 2 – cévní zásobení, 3 – baze přední jámy lební. Fig. 13a) MRI T1W image. Fig. 13b) Ultrasound duplex image (power mode). 1 – meningeoma 2 – arterial supply, 3 – anterior skull base. Kavernomy
V sonografickém obraze se kavernom jeví jako heterogenní hyperechogenní struktura (obr. 14) [32]. IOS je vhodný navigační nástroj a dosud nebyl popsán případ, kdy by toto zobrazení selhalo. Krvácení do okolí kavernomu modifikuje obraz v závislosti na stáří hemoragie. Krvácení do 2 – 8 týdnů bývá hyperechogenního vzhledu a může ztěžovat posouzení hranice kavernomu [33].
Image 14. Kavernom frontálního laloku vpravo – sonografický a MR T2W obraz. Fig. 14. Cavernoma of the right frontal lobe – ultrasound and MRI T2W images. 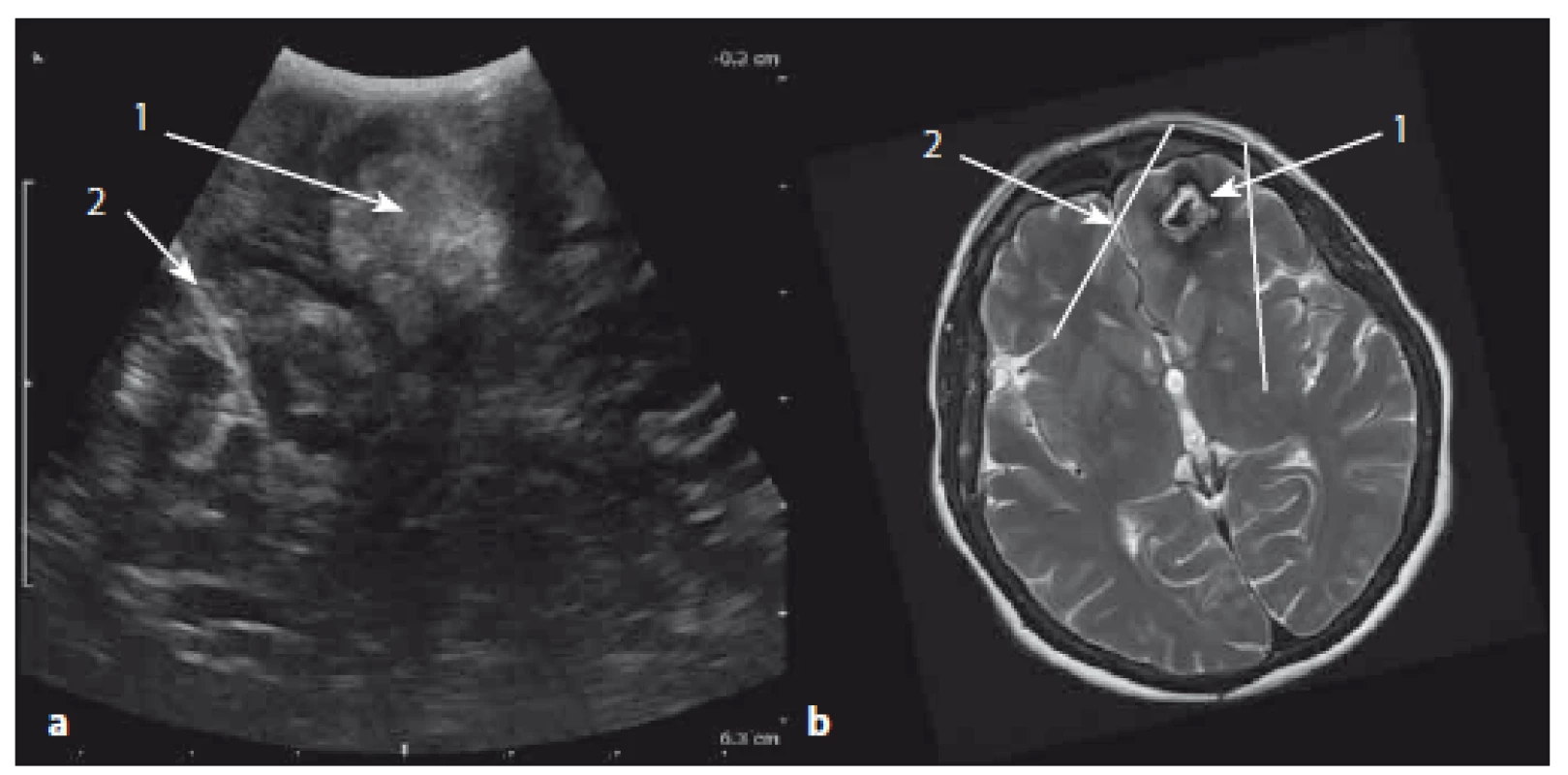
Obr. 14a) Sonografický obraz. Obr. 14b) MR T2W obraz. 1 – kavernom, 2 – falx cerebri. Fig. 14a) Ultrasound image. Fig. 14b) MRI T2W image. 1 – cavernoma, 2 – cerebral falx. Cévní léze
Zatímco je duplexní zobrazení při IOS zaměřeno nejčastěji na lokalizaci významných arterií v okolí cílové léze, objevují se také práce zabývající se hodnocením IOS při operacích mozkových aneuryzmat a arteriovenózních malformací (obr. 15) [34,35]. Zajímavá možnost je zobrazení a lokalizace lentikulostriátních arterií navigovaným 3D ultrazvukovým zobrazením v power módu, jež může pomoci při resekcích insulárních gliomů [27].
Image 15. Aneuryzma arteria cerebri media v CT obraze a duplexním sonografickém zobrazení – barevný Doppler (CF) a power Doppler (PW). Fig. 15. Aneurysm of the middle cerebral artery – CT and duplex ultrasound images – color Doppler (CF) and power Doppler (PW). 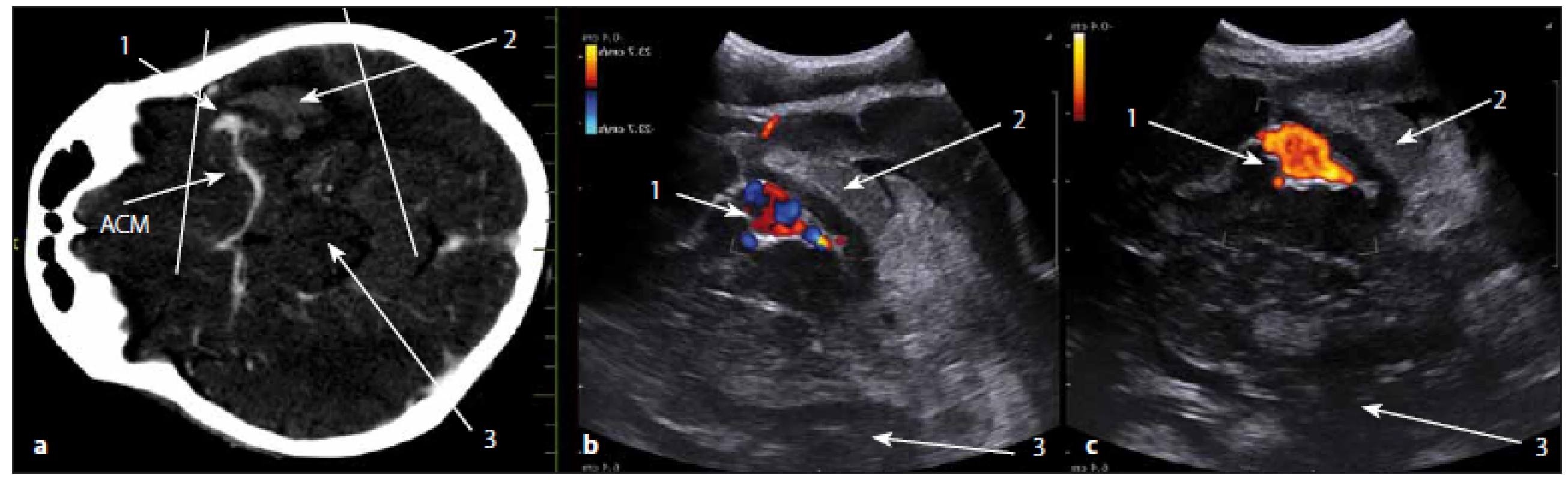
Obr. 15a) CT s kontrastní látkou, transverzální řez. Obr. 15b) Duplexní zobrazení Obr. 15c) Duplexní zobrazení. 1 – aneuryzma, 2 – intracerebrální hematom, 3 – mozkový kmen. Fig. 15a) CT contrast enhanced tranversal scan. Fig. 15b) Duplex ultrasound image (CF). Fig. 15c) Duplex ultrasound image (PW). 1 – aneurysm, 2 – intracerebral haematoma, 3 – brain stem. Abscesy
Podobně jako v případě solidních nádorů se absces zobrazuje jako hyperechogenní struktura s hypoechogenním až anechogenním středem (obr. 16). Lézi lze zacílit s využitím bioptického adaptéru a zavést např. drenáž.
Image 16. Absces temporálního laloku vpravo – sonografický a MR obraz. Fig. 16. Abscess of the right temporal lobe – ultrasound and MR images. 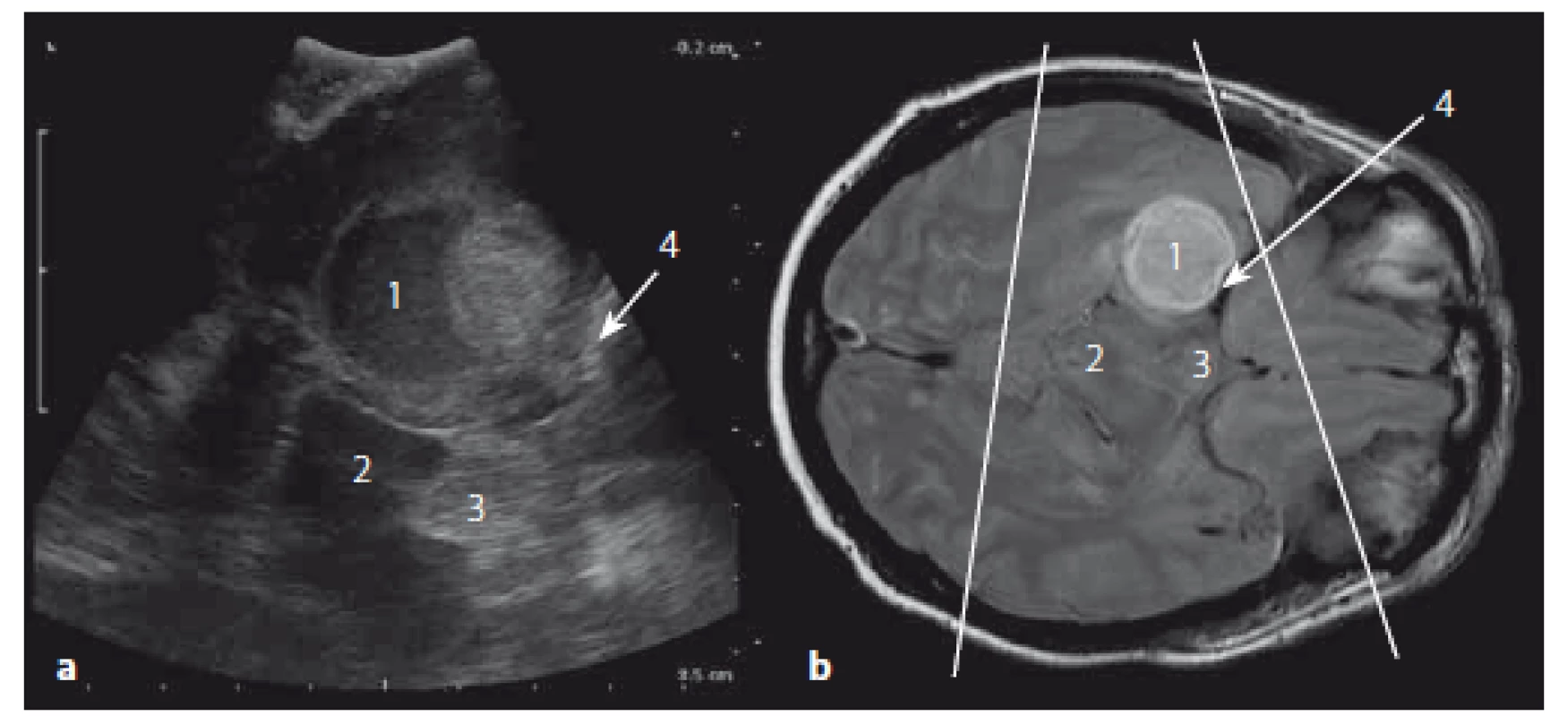
Obr. 16a) Sonografický obraz. Obr. 16b) MR obraz v axiální rovině. 1 – absces, 2 – mozkový kmen, 3 – perimezencefalické cisterny, 4 – Sylvijská rýha. Fig. 16a) Ultrasound image. Fig. 16b) MR image in axial section. 1 – abscess, 2 – brain stem, 3 – perimesencephalic cistern, 4 – Sylvian’s fissure. Artefakty při IOS
V průběhu resekce mozkových expanzí se v důsledku výskytu artefaktů v sonografickém obraze někdy snižuje kvalita obrazu. Může se jednat o vzduchové bubliny ve fyziologickém roztoku, které však nepředstavují zásadnější problém pro kvalitu zobrazení. Významnější jsou hyperechogenní artefakty na rozhraní povrchu resekční dutiny a fyziologického roztoku při sonografické kontrole radikality resekce. Příčinou je velký rozdíl v útlumu ultrazvukového vlnění mezi mozkem (event. tumorem) a fyziologickým roztokem, který má téměř nulový útlum [36]. Tyto artefakty se vyskytují především na dně resekční dutiny a mohou ztěžovat detekci eventuálního rezidua tumoru (obr. 17). Jednou z možností řešení takové situace je zobrazení s podáním sonografické kontrastní látky. Zvýší se tak kontrast v sonografickém obraze a možnosti detekce rezidua [37]. Další způsob řešení tohoto problému je fúze aktuálního 3D sonografického obrazu s předoperačním MR zobrazením. Porovnáním těchto obrazů lze nepřímo usoudit na přítomnost nádorového rezidua. Redukovat přítomnost artefaktů můžeme také zkrácením vzdálenosti mezi sondou a insonovanou oblastí a provést intrakavitární vyšetření miniaturní sondou [25]. Kromě uvedeného druhu artefaktu mohou vést k hyperechogenicitě povrchu resekční dutiny rovněž přítomnost koagul a hemostyptického materiálu.
Image 17. Artefakty při sonografické kontrole resekce nádoru. Fig. 17. Artefacts during ultrasound control of the tumor resection. 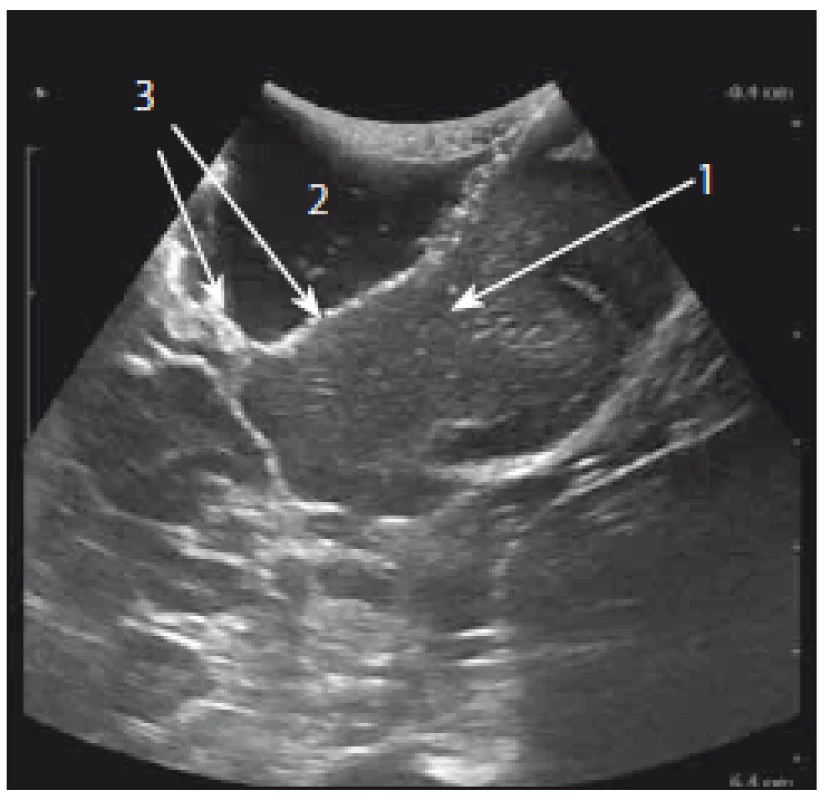
1 – reziduální tumor, 2 – resekční dutina, 3 – hyperechogenní artefakty na rozhraní tumor/fyziologický roztok. 1 – tumor’s residue, 2 – resection cavity, 3 – the hyperechoic artefact on the boundary of the fluid and tumor residue. Závěr
V současnosti je v neurochirurgické operační praxi využívána řada metod intraoperativního zobrazení s cílem správně lokalizovat cílovou lézi, optimalizovat přístup a kontrolovat radikalitu resekce. Běžně jsou využívány moderní neuronavigační systémy založené na předoperačních MR datech a jejich registraci. Tento přístup je zatížen možnou chybou v přesnosti, která vzniká v důsledku posunu a deformace mozkové tkáně po provedení kraniotomie, při odsátí mozkomíšního moku a resekci nádoru [38]. Reálnou nebo „téměř“ reálnou informaci poskytují pouze iMR, fluorescenční zobrazení a IOS s 2D nebo 3D zobrazením. Každá z těchto metod má své přednosti a nedostatky. Intraoperativní MR nabízí aktualizaci navigačních dat, detekci nádorových reziduí a umožňuje také zobrazení mozkových drah – traktografii. Vyžaduje však speciální vybavení operačního sálu a je nutný transport pacienta do gantry. Celá procedura trvá 15 – 20 min [1]. Větší rozšíření je omezeno značnými ekonomickými náklady s pořízením iMR přístroje. IOS, na rozdíl od iMR, nevyžaduje zvláštní prostory ani nástrojové vybavení a je vhodná pro integraci do stávajících operačních sálů. Rovněž časové nároky na provedení skenování jsou malé a lze jej prakticky libovolně opakovat bez podstatnějšího zdržení operace. I rekonstrukce 3D zobrazení není časově náročná [16]. IOS vybavení je výhodné i z ekonomického hlediska cena/ výkon, protože moderní sonografické přístroje jsou dnes běžným vybavením a je nutno jen pořídit speciální zobrazovací sondu. Ke zpřesnění sonografického obrazu a usnadnění orientace se dá využít technika spojení sonografického obrazu a předoperačního MR obrazu. Peroperační fluorescence pomocí kyseliny 5-aminolevulové poskytuje rovněž přesnou informaci o lokalizaci tumorózní tkáně, zobrazení je ovšem omezeno na povrch tkáně v přímém zorném poli operačního mikroskopu. Spojení IOS zobrazení a peroperační fluorescence má potenciál poskytovat výhody obou způsobů zobrazení.
Hlavní předností IOS techniky je aktuální reálné zobrazení („real-time“), a to při velmi dobrém prostorovém rozlišení. Kvalita IOS zobrazení se u moderních vysokofrekvenčních sond blíží kvalitě obrazu v T1 váženém zobrazení MR [9]. Vedle spolehlivé lokalizace všech běžných mozkových expanzí umožňuje IOS detailní zobrazení vnitřní struktury nádoru. Rozlišuje dobře solidní a cystické části tumorů, a je tak možno upravit operační strategii, provést biopsii nebo zavést katetr. Dle našich zkušeností a literárních údajů lze ve většině případů identifikovat dostatečně hranice nádorů a kontrolovat radikalitu resekce. Možnost 3D zobrazení zlepšuje prostorovou orientaci a detekci tumorózních reziduí. Recentní publikace zabývající se využitím sonografické kontrastní látky spolu s 3D zobrazením naznačují, jak je možno dále zlepšit jeho kvalitu [12,37]. To se týká spíše kontroly radikality resekce než vlastní lokalizace a navigace přístupu.
IOS zobrazení s sebou přináší také některé nedostatky. Poradiační změny při operacích recidiv vysokostupňových tumorů sice sonografickou lokalizaci umožňují spolehlivě, avšak kontrola radikality je nepřesná [22]. Zdá se též, že v některých případech povrchově uložených reziduí nízkostupňových gliomů je iMR zobrazení přesnější [5]. Pro IOS zobrazení jsou nepřístupné také nádory ve strukturách baze lební, jako jsou např. adenomy hypofýzy. Zde je suverénní metodou intraoperativní kontroly resekce iMR [39]. Sonograficky je možné pouze zobrazení supraselární části adenomu při transkraniálním přístupu. Další nevýhodou je nemožnost plánování kraniotomie. V tomto případě je možným řešením navigovat sonografické sondy, což dnes některé navigační systémy dovolují. Je nutné zdůraznit, že výtěžnost IOS je, zejména při kontrole resekce, ovlivněna zkušeností neurochirurga s odečítáním sonografického obrazu. Zatímco hodnocení standardních MR skenů je pro neurology a neurochirurgy rutinní záležitost, sonografické zobrazení vyžaduje delší praxi. Orientace v sonografickém obraze může být zpočátku obtížná, a je proto vhodná přítomnost neurologa nebo neurochirurga erudovaného v neurosonologii. Zajímavou možností, jak získat zkušenosti s IOS, je nácvik na zvířecích kadaverózních modelech [40].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petr Linzer, Ph.D.
Neurochirurgické oddělení
Krajská nemocnice T. Bati
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: petrlinzer@volny.cz
Přijato k recenzi: 5. 10. 2017
Přijato do tisku: 1. 11. 2017
doc. MUDr. Michal Filip, Ph.D.
Docent Michal Filip se narodil v Brně. Studia na LF UJEP v Brně (nyní MU) dokončil v roce 1984. Po studiích nastoupil do FN Ostrava na Chirurgickou kliniku a po úspěšném vykonání 1. atestace v roce 1987 přestoupil na Neurochirurgickou kliniku. Od roku 1988 zde působil postupně jako sekundární a odborný lékař. V roce 2004 byl jmenován do funkce asistenta pro vědu a výzkum. V roce 2006 se stal primářem Neurochirurgického oddělení, KNTB Zlín. V roce 2005 obhájil na LF MU v Brně titul Ph.D. na téma peroperační ultrazvukové zobrazování glioblastomů. V roce 2015 ukončil habilitační řízení na LF SZU v Bratislavě a byl jmenován docentem. V habilitační práci se věnoval vývoji bioaktivních implantátů ve spondylochirurgii. Peroperačnímu ultrazvukovému zobrazování a jeho rozvoji se aktivně věnuje 20 let. Publikuje v domácí i zahraniční odborné literatuře. V současné době také vyučuje na LF v Ostravě na Ústavu rehabilitace.
Sources
1. Beneš V, Netuka D, Kramář F, et al. Multifunctional surgical suite (MFSS) with 3.0 T iMRI: 17 months of experience. Acta Neurochir Suppl 2011;109 : 145-9. doi: 10.1007/ 978-3-211-99651-5_22.
2. Chen KT, Lee ST, Wu CT. The clinical value of intraoperative mobile computed tomography in managing high-risk surgical patients with traumatic brain injury – a single tertiary trauma Center Experience. World Neurosurg 2017;98 : 727–33.e3. doi: 10.1016/ j.wneu.2016.11.090.
3. Regelsberger J, Lohman F, Helmke K, et al. Ultrasound-guided surgery of deep seated brain leasions. Eur J Ultrasound 2000;12(2):115–21.
4. Hammoud MA, Ligon BL, ElSouki BL et al. Use of intraoperative ultrasound for localizing tumors and determining the extent of resection: a comparative study with magnetic resonance imaging. J Neurosurg 1996;84 : 737–41. doi: 10.3171/ jns.1996.84.5.0737.
5. Gerganov VM, Samii A, Giordano M, et al. Two-dimensional high-end ultrasound imaging compared to intraperative MRI during resection of low-grade gliomas. J Clin Neurosci 2011;18(5):669–73. doi: 10.1016/ j.jocn.2010.08.017.
6. Chacko AG, Kumar NK, Chacko G, et al. Intraoperative ultrasound in determining the extent of resection of parenchymal brain tumors – a comparative study with computed tomograhpy and histolopathology. Acta Neurochir 2003;145(9):743–8. doi: 10.1007/ s00701-0030009-2.
7. Wang YD, Wang Y, Mao Y, et al. Intraoperative ultrasound assistance in the resection of small, deep-seated, or ill-defined intracerebral lesions. Chin Med J (Engl) 2011;124(20):3302–8.
8. LeRoux PD, Winter TC, Berger MS, et al. A comparison between preoperative magnetic resonance and intraoperative ultrasound tumor volumes and margins. J Clin Ultrasound 1994;22(1):29–36.
9. Unsgaard G, Gronningsaeter A, Ommedal S, et al. Brain operations guided by real-time two-dimensional ultrasound: new possibilities as a result of improved image quality. Neurosurgery 2002;51(2):402–11.
10. Školoudík D, Majvald Č, Chudoba V. Možnost diagnostiky tkáňových lézí mozku pomocí ultrazvuku. Cesk Slov Neurol N 1999;3 : 135–40.
11. Gronningsaeter A, Kleven A, Ommedal A, et al. SonoWand, an ultrasound-based neuronavigation system. Neurosurgery 2000;47(6):1373–9.
12. Arlt F, Chalopin C, Müns A, et al. Intraoperative 3D contrast-enhanced ultrasound (CEUS): a prospective study of 50 patients with brain tumors. Acta Neurochir 2016;158(4):685–94. doi: 10.1007s00701-016-2738-z.
13. Reid MH. Ultrasonic vizualisation of a cervical cord cystic astrocytoma. Am J Roentgenol 1978;131 : 907–8. doi: 10.2214/ ajr.131.5.907.
14. Rubin J, Dorman G. Intraoperative neurosurgical ultrasound in the localisation and characterisation of intracranial masses. Radiology 1983;148 : 173–5. doi: 10.1148/ radiology.148.2.6867352.
15. Milhorat TH, Bolognese PA. Tailored operative technique for Chiari type I malformation using intraoperative color Doppler ultrasonography. Neurosurgery 2003;53(4):899–905.
16. Filip M, Linzer P, Šámal F. Peroperační 3D sonografie v neurochirurgii. Neurol pro praxi 2010;11(6):415–7.
17. Unsgaard G, Selbekk T, Brostrup Müller T, et al. Ability of navigated 3D ultrasound to delineate gliomas and metastases – comparison of image interpretations with histopathology. Acta Neurochir 2005;147(12):1259–69. doi: 10.1007/ s00701-005-0624-1.
18. Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001;95(2):190–8. doi: 10.3171/ jns.2001.95.2.0190.
19. Filip M, Paleček T, Starý M, et al. Ultrazvukový peroperační monitoring glioblastomů v 2D obraze a reálném čase. Cesk Slov Neurol N 2004;67/ 100 : 42–7.
20. Camp SJ, Apostolopoulos V, Raptopoulos V, et al. Objective image analysis of real-time three-dimensional intraoperative ultrasound for intrinsic brain tumour surgery. J Ther Ultrasound 2017;5 : 2. doi: 10.1186/ s40349-017-0084-0.
21. Sæther CA, Torsteinsen M, Torp SH, et al. Did survival improve after implementation of intraoperative neuronavigation and 3D ultrasound in glioblastoma surgery? A retrospective analysis of 192 primary operations. J Neurol Surg A Cent Eur Neurosurg 2012;73(2):73–8. doi: 10.1055/ s-0031-1297247.
22. Mursch K, Stolz M, Brück W, et al. The value of intraoperative ultrasonography during resection of the relapsed irradiated malignant gliomas in the brain. Ultrasonography 2017;36(1):60–5. doi: 10.14366/ usg.16015.
23. Petridis AK, Anokhin M, Vavruska J et al. The value of intraoperative sonography in low grade glioma surgery. Clin Neurol Neurosurg 2015;131 : 64–7. doi:10.1016/ j.clineuro.2015.02.004.
24. Mattei L, Prada F, Legnani FG, et al. Neurosurgical tools to extend resection in hemispheric low-grade gliomas: conventional and contrast enhanced ultrasonography. Child Nerv Syst 2016;32(10):1907–14. doi: 10.1007/ s00381-016-3186-z.
25. Šteňo A, Karlík M, Mendel P, et al. Navigated three-dimensional intraoperative ultrasound-guided awake resection of low-grade glioma partially infiltrating optic radiation. Acta Neurochir 2012;154(7):1255–62. doi: 10.1007/ s00701-012-1357-6.
26. Štěňo A, Matějčík V, Štěňo J. Intraoperative ultrasound in low-grade glioma surgery. Clin Neurol Neuro-surg 2015;135 : 96–9. doi: 10.1016/ j.clineuro.2015.05.012.
27. Štěňo A, Jezberová M, Hollý V, et al. Vizualization of lenticulostriate arteries during insular low-grade glioma surgeries by navigated 3D ultrasound power Doppler: technical note. J Neurosurg 2016;125(4):1016–23. doi: 10.3171/ 2015.10.jns151907.
28. Prada F, Mattei L, Del Bene M, et al. Intraoperative cerebral glioma characterization with contrast enhanced ultrasound. Biomed Res Int 2014;2014 : 484261. doi: 10.1155/ 2014/ 484261.
29. De Lima Oliveira M, Picarelli H, Menzes MR, et al. Ultrasonography during surgery to approach cerebral metastases: effect on Karnofsky index scores and tumor volume. World Neurosurg 2017;103 : 557–65. doi: 10.1016/ j.wneu.2017.03.087.
30. Tang H, Sun H, Xie L, et al. Intraoperatice ultrasound assistance in resection of intracranial meningiomas. Chin J Cancer Res 2013;25(3)339–45. doi: 10.3978/ j.issn.1000-9604.2013.06.13.
31. Prada F, Del Bene M, Moiraghi A, et al. From gray scale B-mode to elastography: Multimodal ultrasound imaging in meningeoma surgery – pictorial essay and literature review. Biomed Res Int 2015;2015 : 925729. doi: 10.1155/ 2015/ 925729.
32. Linzer P, Filip M, Šámal F, et al. Sonograficky navigované operace mozkových kavernomů Cesk Slov Neurol N 2013; 76/ 109(2): 203–6.
33. Woydt M, Krone A, Soerensen N, et al. Ultrasound-guided neuronavigation of deep-seated cavernous haemangiomas: clinical results and navigation techniques. Br J Neurosur 2001;15(6):485–95.
34. Heiroth HJ, Etminan N, Steiger HJ, et al. Intraoperative Doppler and Duplex sonography in cerebral aneurysm surgery. Br J Neurosurg 2011;25(5):586–90. doi: 10.3109/ 02688697.2010.534198.
35. Mathiesen T, Peredo I, Edner G, et al. Neuronavigation for arteriovenous malformation surgery by intraoperative three-dimensional ultrasound angiography. Neurosurgery 2007;60(4 Suppl 2):345–50. doi: 10.1227/ 01.NEU.0000255373.57346.EC.
36. Selbekk T, Jakola AS, Solheim O, et al. Ultrasound imaging in neurosurgery: approaches to minimize surgically induced image artefacts for improved resection control. Acta Neurochir 2013;155 : 973–80. doi: 10.1007/ s00701-013-1647-7.
37. Prada F, Bene MD, Fornaro R, et al. Identification of residual tumor with intraoperative contrast-enhanced ultrasound during glioblastoma resection. Neurosurg Focus 2016;40(3):E7. doi: 10.3171/ 2015.11.FOCUS15573.
38. Nimski C, Ganslandt O, Cerny S, et al. Quantification of, visualization of, and compensation for brain shift using intraoperative magnetic resonance imaging. Neurosurgery 2000;47(5):1079–80.
39. Netuka D, Masopust V, Belšán T, et al. One year experience with 3.0 T intraoperative MRI in pituitary surgery. Acta Neurochir Suppl 2011;109 : 157–9. doi: 10.1007/ 978-3-211-99651-5_24.
40. Vavruska J, Buhl R, Petridis AK, et al. Evaluation of an intraoperative ultrasound training model based on a cadaveric sheep brain. Surg Neurol Int 2014;5 : 46. doi: 10.4103/ 2152–7806.130314.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 6-
All articles in this issue
- Využití ultrazvuku pro navigaci v neurochirurgii
- H-reflex – jeho role v neurofyziologii a klinice
- Moderní techniky MR zobrazení u roztroušené sklerózy
- Případ časné neurosyfilis s neurokognitivní poruchou
- Periferní paréza lícního nervu vázaná na cestování letadlem
- AMETYST – výsledky observační studie fáze IV sledující účinky intramuskulárně podávaného interferonu beta-1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Hodnocení životní spokojenosti u pacientů s klinicky izolovaným syndromem
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Kdy operovat zlomeniny spánkové kosti?
- Cievne nehemoragické komplikácie hlbokej mozgovej stimulácie
- Účinky robotické rehabilitace chůze na psychosomatické indikátory u osob s různou etiologií lehké mentální retardace
- Prediktory pozitivního léčebného výsledku u pacientů s akutní cévní mozkovou příhodou podstupujících endovaskulární léčbu - výsledky z registru CERBERUS
- Kvantitativní analýza MRI textury pro rozlišení enhancujících a neenhancujících T1 hypointenzních lézí bez podání kontrastní látky u roztroušené sklerózy
- Syndrom reverzibilní mozkové vazokonstrikce
- Závažný serotoninový syndrom
- Předávkování baklofenem a klonazepamem u pacienta s chronickou bolestí krční páteře a ramen
- Nová mutace v genu GIGYF2 u pacienta s Parkinsonovou chorobou
- Stereotaktická biopsie mozku pomocí bezrámové navigace – výhody, omezení a technické tipy
- Dermatomyositis – úvodní projev pokročilého stadia primárního karcinomu ovaria z prstenčitých buněk
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Moderní techniky MR zobrazení u roztroušené sklerózy
- H-reflex – jeho role v neurofyziologii a klinice
- Kdy operovat zlomeniny spánkové kosti?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


