-
Medical journals
- Career
Úvod do neuromuskulární ultrasonografie
Authors: K. Mezian 1; P. Steyerová 2; J. Vacek 3; L. Navrátil 1
Authors‘ workplace: Katedra zdravotnických oborů a ochrany obyvatelstva, Fakulta biomedicínského inženýrství ČVUT v Praze 1; Radiodiagnostická klinika 1. LF UK a VFN v Praze 2; Klinika rehabilitačního lékařství 3. LF UK a FN Královské Vinohrady, Praha 3
Published in: Cesk Slov Neurol N 2016; 79/112(6): 656-661
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2016656Overview
Ultrasonografie, která využívá vysokofrekvenční sondy s vynikající rozlišovací schopností, zažívá prudký vývoj v neuromuskulární i muskuloskeletální medicíně. Vzhledem k absenci ionizujícího záření, absolutních kontraindikací, relativně nízké ceně, možnosti opakovaných vyšetření a dynamického zobrazení se stala zejména v posledních letech předmětem zájmu. Tento souhrnný přehled se zabývá přínosem ultrasonografie v hodnocení lokalizovaných svalových postižení a lézí periferních nervů. Ultrasonografii lze vzhledem ke schopnosti detekce svalových morfologických změn, svalových fascikulací a fibrilací využít i v diagnostice neuromuskulárních chorob a myopatií. Uplatňuje se také při intervenčních výkonech při aspiraci tekutiny, k navigaci aplikace botulotoxinu při spasticitě, léčebných obstřiků, nervových blokád apod.
Klíčová slova:
nervus medianus – periferní nerv – muskuloskeletální – ultrazvuk – ultrasonografie – úžinový syndrom – syndrom karpálního tunelu – intervenční metody – ultrazvuková navigace – amputační neuromÚvod
Ultrasonografií periferních nervů a pohybového aparátu se stále více kromě radiologů zabývají i klinici [1]. Neuromuskulární ultrasonografie (US) se stala předmětem zájmu zejména v posledních letech s modernizací přístrojové techniky, která využívá vysokofrekvenční sondy s vysokou rozlišovací schopností. US zobrazuje měkké tkáně (nervy, chrupavky, vazivové struktury, svaly) diferencovaně podle jejich echogenity. Umožňuje kvali - i kvantitativní posouzení vyšetřovaných tkání. Zobrazit je možno většinu měkkých tkání, nicméně vyšetření je limitováno, pokud zkoumaná oblast leží v akustickém stínu kostních struktur. Pohybový aparát je možné vyšetřit také již prenatálně a odhalit tak malformace axiálního skeletu a končetin. US v některých případech nahrazuje vyšetření metodou magnetické rezonance (MR), oproti které nabízí některé výhody. Moderní US přístroje nabízejí v hloubce do 1,5 cm od povrchu epidermis prostorové rozlišení 0,1 mm, tedy vyšší než MR o intenzitě magnetického pole 3 Tesla, s rozlišením 0,2 × 0,2 × 1 mm [2]. US dále umožňuje dynamické vyšetření a nabízí možnost stranového porovnání. Dopplerovské mapování poskytuje posouzení úrovně vaskularizace vyšetřované tkáně. US vyšetření prakticky nemá kontraindikace a dává možnost vyšetřit pacienty, u kterých nelze použít jiné metody. Při vyšetření je užitečné využití „sonopalpace“ ke korelaci nalezené patologie s místem maximální bolestivosti.
Přístrojové vybavení
V neuromuskulární US nachází využití zejména vysokofrekvenční sondy o frekvenci 18 – 22 MHz. Tyto sondy mají výborné prostorové rozlišení a jsou schopny zobrazit tkáně do hloubky cca 3 cm, což je pro většinu měkkých tkání a periferních nervů dostatečné. Pro zobrazení hlubších struktur lze použít sond s nižší frekvencí. S výhodou se dá využít i malá angulovaná sonda, tzv. hokejka, která poskytuje lepší možnosti pro manipulaci. Větší část vyšetření se odehrává v černobílém B-módu. Vyšetření je prováděno v reálném čase a poskytuje možnost hodnocení nejen statické, ale též dynamické – pohyblivost tkání vůči sobě, detekci jizvení, změny polohy tkání při pohybu končetiny, zobrazení svalových fascikulací a fibrilací apod. Dopplerovské mapování umožňuje detekci vaskularizace ve tkáni či přítomnost aberantních vaskulárních struktur (variet či např. pseudoaneuryzmat). Dalším významným milníkem ve vývoji techniky je sonoelastografie, která je schopna převést do barevného signálu informaci o tuhosti tkáně. Moderní US přístroje nabízejí rozšířené funkce pro zlepšení zobrazení. Užitečné může být zvýšení kontrastu zobrazené jehly (beam steering), které se uplatní při navigaci intervenčních metod. Panoramatická funkce rozšiřuje zobrazené pole. Relativně novou technologií je zpětná rekonstrukce trojdimenzionálních obrazů [3].
Intervenční neuromuskulární ultrasonografie
Intervenční metody jsou nedílnou součástí neuromuskulární US. Pod US navigací lze provádět punkce tekutinových kolekcí, aplikaci léčebného obstřiku u entrapment syndromů, regionální anestezii či odběr tkáně za účelem histologického vyšetření. V neurologii je US využívána také k navigaci aplikace botulotoxinu [4]. Základní techniky navigace jehly pomocí US jsou „indirect“ (obr. 1) a „direct“ (obr. 2).
Image 1. Krok 1 (A), „Indirect“ navigace s vyznačením orientačních bodů na kůži pomocí US; krok 2 (B), punkce je provedena bez přímé vizualizace jehly. Fig. 1. Step 1 (A), „Indirect“ navigation through target marking on the skin with US; step 2 (B), the needle is inserted without real-time visualisation. 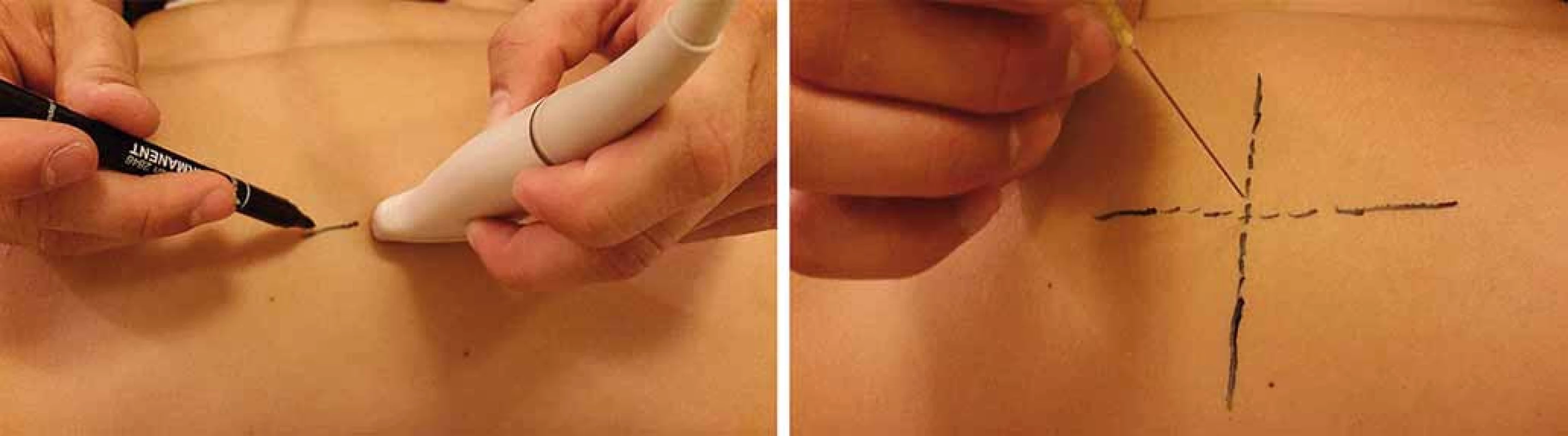
Image 2. „Direct in-plane“ technika (zobrazení celé délky jehly v reálném čase) na želatinovém fantomu s použitím funkce zvýraznění viditelnosti jehly (bílá šipka) (A,B); „direct out-of-plane“ metoda se zobrazením hrotu či těla jehly v podobě tečky (prázdná šipka) (C,D). Fig. 2. „Direct in-plane“ (real-time needle visualisation) technique on a gelatine phantom with the whole needle length visualisation (white arrow), us ing needle visualisation feature (A,B); „direct out-of-plane“ method with the hyperechoic spot as a visualisation of the needle tip or needle shaft (void arrow) (C,D). 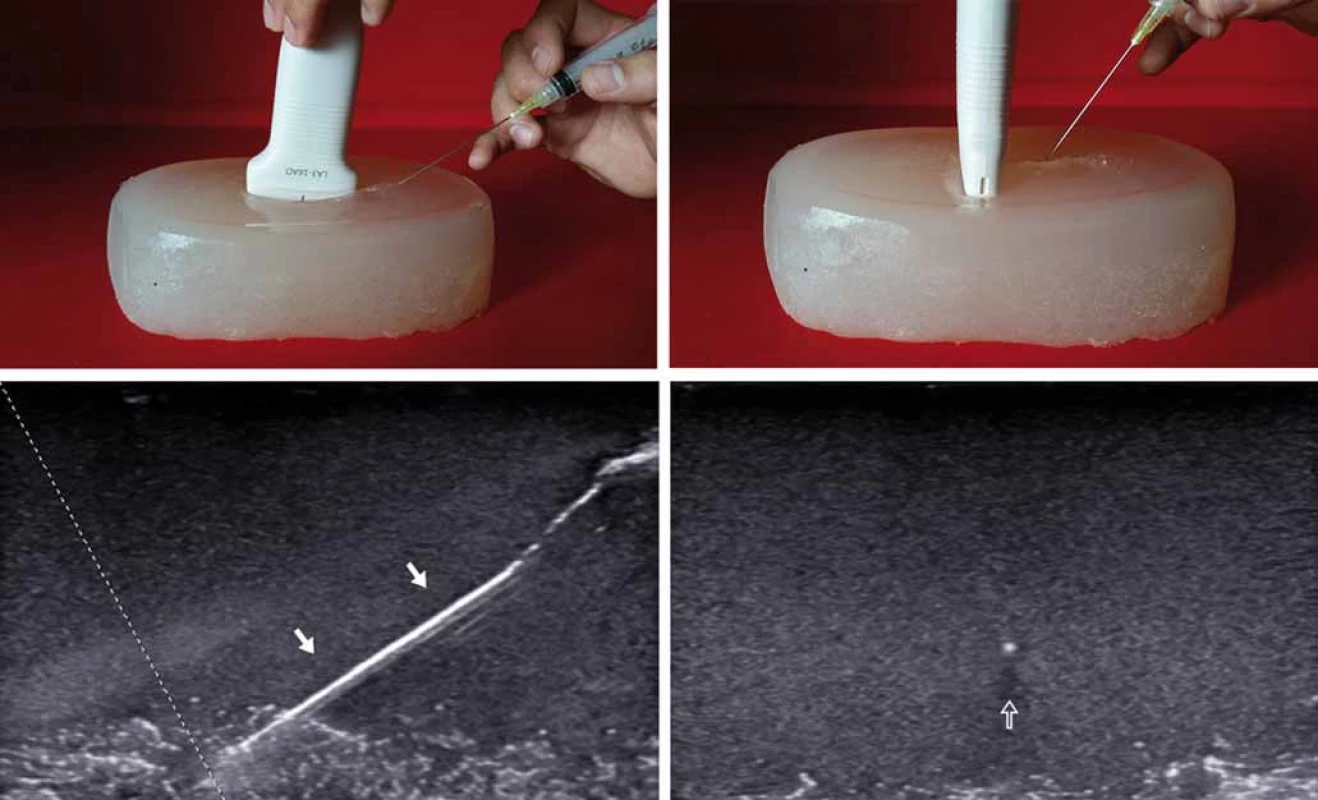
Techniku „direct“ lze použít při zobrazení „in-plane“ a „out-of-plane“. US poskytuje přesnou a maximálně šetrnou navigaci jehly, jejíž poloha je kontrolována v reálném čase. Polohu jehly lze též v každém okamžiku intervence změnit tak, aby bylo možno intervenci přesně zacílit a vyhnout se poranění anatomických struktur, zejména cév. Možnost kontroly pozice jehly zpřesňuje intervenci a vede k bezpečnějšímu, někdy i efektivnějšímu provedení zákroku [5]. K navigaci intervenčních výkonů na periferních nervech se používají lineární sondy s vysokou frekvencí. K intervencím na hluboko uložených strukturách se může s výhodou použít sonda konvexní s nižší frekvencí (2 – 5 MHz) (např. kořenové injekce na cervikální a lumbosakrální páteři, kaudální epidurální blok, facetová blokáda, léčebný obstřik sakroilického skloubení). Po základním US vyšetření a posouzení anatomických poměrů zvážíme indikaci aplikace léčebného obstřiku a nejvhodnější technický postup. Dopplerovské zobrazení napomůže identifikovat cévní struktury. Kožní povrch je v místě plánovaného vpichu označen nesmazatelným fixem. Následuje důsledná kožní dezinfekce. U injekce povrchových struktur (reálné riziko kontaminace jehly sondou) použijeme sterilní návlek na sondu. Ke kožní anestezii lze použít anestetický sprej či lidokainový krém. Během injekce se zvyšujícím se úhlem zavedené jehly se též zvyšuje riziko ztráty vizuální kontroly hrotu jehly na US obrazovce vzhledem ke snížení intenzity signálu odraženého od jehly. Ke ztrátě hrotu z obrazovky může dojít i u velmi zkušených intervenčních sonografistů [6]. K opětovné vizualizaci hrotu však lze využít některých speciálních manévrů (jemný třes jehlou, hydrolokace, Doppler apod.), speciálního softwaru („beam steering“) či echogenních jehel s nepravidelným povrchem. U jedinců, kteří nepociťují anxietu, se s výhodou uplatňuje pacientův přímý vizuální „feedback“ s procedurou na obrazovce přístroje [7].
Ultrasonografie svalu
Svalové struktury mají při US vyšetření typický vzhled s longitudinálně (v ose svalu) uspořádanou pravidelnou strukturou svalových vláken, která se jeví tmavší (hypoechogenní), a vazivovými septy a fasciemi, které jsou v US obraze světlejší (hyperechogenní). Při vyšetření svalu po traumatu lze odhalit porušení kontinuity svalových vláken s heterogenní strukturou svalu a s tvorbou hematomu. Během hojení můžeme pozorovat změny echogenity poraněné oblasti s tvorbou jizevnatých změn. US lze využít i v diagnostice myopatií. Mezi známky patologicky změněného svalu patří vyšší echogenita, atrofie (obr. 3), zvýšená homogenita a snížení sytosti kostního stínu [8].
Image 3. Denervace a tuková atrofie svalu (vlevo bílé šipky) u pacienta s lézí nervus ischiadicus po náhradě kyčelního kloubu. Fig. 3. Denervation and fatty atrophy of the thigh muscle (white arrows) in a patient with sciatic nerve palsy after hip joint replacement. 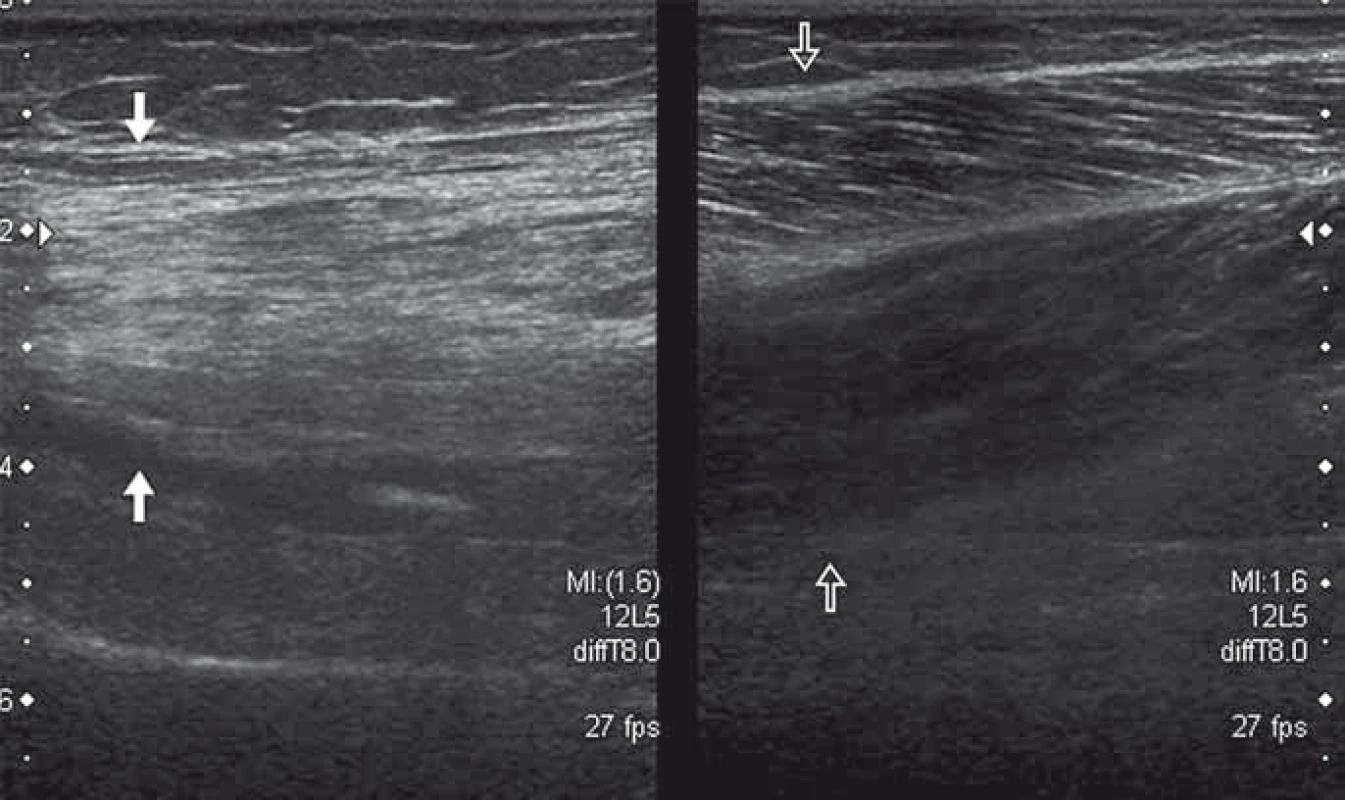
Vpravo normální nález (prázdné šipky). Normal muscle on the right (void arrows). Dochází k tukové a fibrózní přestavbě, což vede ke zvýšené akustické impedanci svalové tkáně. V některých případech, např. při Duchennově muskulární dystrofii, dochází ke svalové pseudohypertrofii. Při diagnostice myopatií byla zjištěna 67 – 81% senzitivita a 84 – 92% specificita [9]. Hodnocení echogenity svalu je však zatíženo subjektivní chybou. Při použití speciálního softwaru (počítačovým zpracováním stupnice šedi) se senzitivita zvyšuje na 87 – 92 % [10]. Metoda však zatím není rozšířena na rutinní praxi, neboť je nutné nejdříve překonat technická úskalí spojená s variabilním nastavením přístroje. Tím, že má US vysokou citlivost při detekci fascikulací, stává se vítaným pomocníkem při diagnostice neuromuskulárních chorob. Svalové fascikulace je možno pozorovat a dokumentovat v reálném čase [11]. Limitovaně lze detekovat i svalové fibrilace [12,13].
Šlachy mají výrazně vyšší echogenitu, což usnadňuje identifikaci zánětlivých či traumatických změn. Pomocí US je možno hodnotit kontinuitu šlachy a její porušení (např. traumatické) (obr. 4), změny při entezopatiích či zánětlivých procesech ať už akutních nebo chronických.
Image 4. Stav po řezném poranění v oblasti volární části palce, selhání sutury – v US obraze přerušení kontinuity s retrakcí konců šlachy (hvězdičky), mezi konci jizvení (bílá šipka) a pruhovité hyperecho šicího materiálu (prázdná šipka). Fig. 4. Tendon reconstruction failure after cutt ing wound in the thenar region – the US reveals tendon discontinuity with ends retraction (asterisks); scar tissue forming (white arrow) and hyperechoic line of the suture material is seen (void arrow). 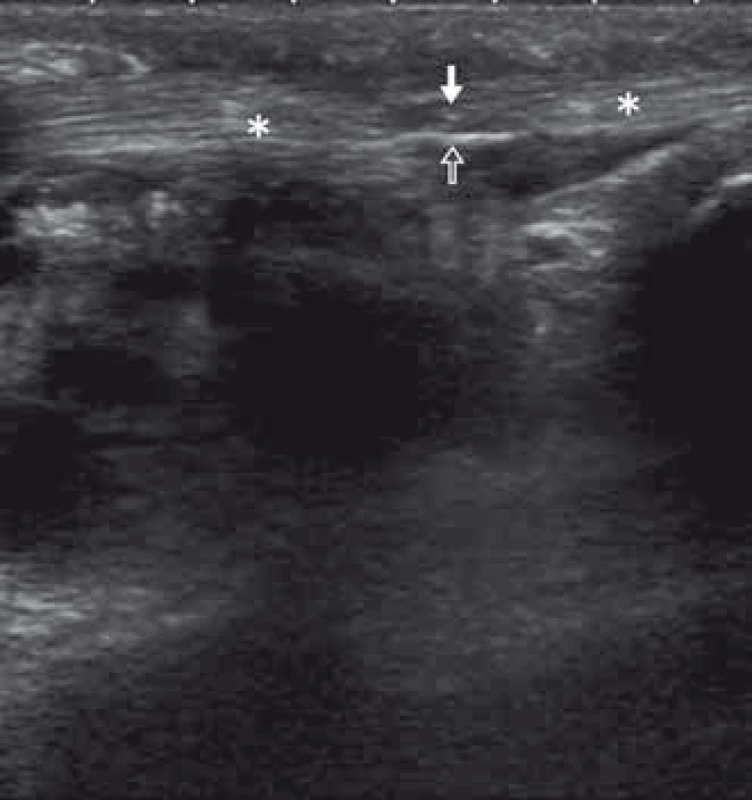
Ultrasonografie nervu
US umožňuje přímou vizualizaci periferních nervů. Na příčném průřezu mají periferní nervy ovoidní či oploštělý tvar. Ultrazvukem lze diferencovat struktury až k jednotlivým nervovým fasciklům. Nervy mají v US obraze vzhled medové plástve či snopce obilí se smíšenou echogenitou. Nervové fascikly jsou hypoechogenní, vazivové obaly fasciklů i celého nervu hyperechogenní. Existuje však několik výjimek, které mají ve specifických lokalitách fyziologicky hypoechogenní obraz (n. ulnaris v ulnárním sulku či n. radialis v sulcus nervi radialis) [14]. Periferní nervový systém lze zobrazit od výstupů z neuroforamin až do úrovně drobných senzitivních větví [15]. Brachiální plexus je vyšetření snadno přístupný, ovšem plexus lumbosacralis je pro své hluboké uložení nesnadné zobrazit [16]. Končetinové nervy jsou vyšetření většinou dobře přístupné v celém svém průběhu, stejně tak je možno zobrazit nervy v oblasti hrudní a břišní stěny a krku. Průsvit vyšetřitelných periferních nervů se za fyziologických podmínek pohybuje od cca 10 mm (n. ischiadicus) po méně než 1 mm (senzitivní větve v podkoží či digitální větve na končetinách).
Přínosem může být vyšetření jako doplňující informace k elektrofyziologickým vyšetřením, např. přesná lokalizace léze při entrapment syndromech. Při poruše konduktivity lze použitím US zhodnotit zachování či porušení strukturální kontinuity nervu, a tedy pomoci při indikaci k provedení nebo neprovedení rekonstrukčního výkonu. Někdy může sonografie příčinu potíží objasnit i tam, kde elektrofyziologické metody nepřináší uspokojivé vysvětlení (Mortonův neurom, meralgia paresthetica, syndrom tarzálního tunelu) [17]. Také může odlišit lézi nervu od patologie okolních tkání, pokud se klinicky projeví podobně (obr. 5), detekci anatomických variet apod. [18].
Image 5. Ruptura extenzoru zápěstí (bílá šipka) klinicky imitující parézu nervus radialis. Fig. 5. Wrist extensor tendon rupture (white arrow) clinically mimicking radial nerve palsy. 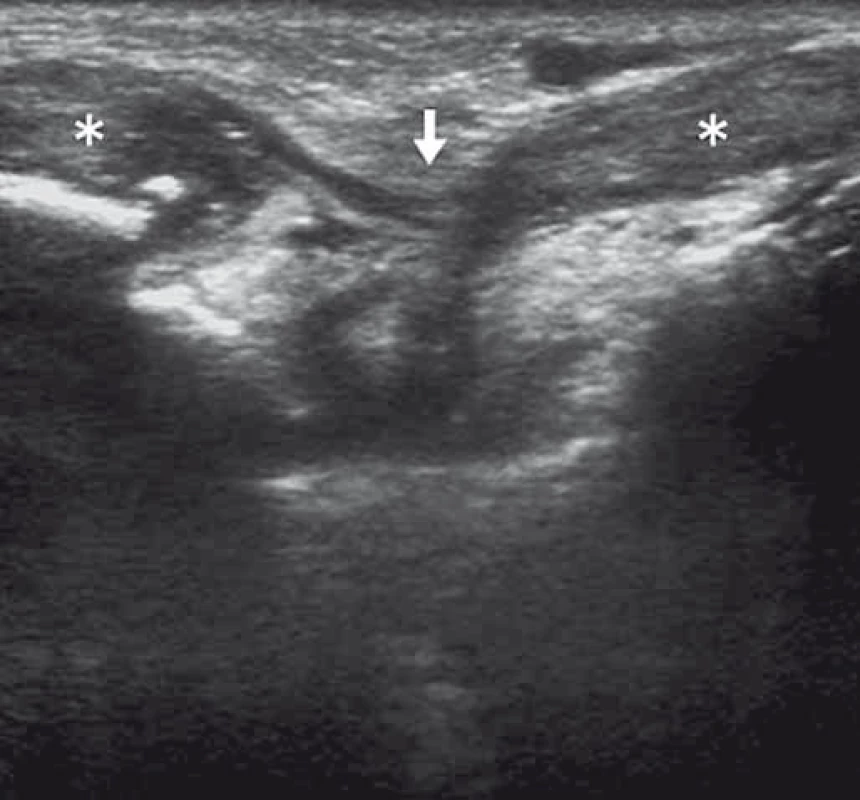
Retrahované konce extenzoru (hvězdičky). Retracted ends of extensor tendons (asterisks). U fantomových bolestí u pacientů po amputacích lze pomocí US identifikovat amputační neurom (obr. 6), a pomocí cílených blokád určit zdroj pacientových obtíží a poskytnout úlevu od bolesti.
Image 6. Amputační neurom. Fig. 6. Stump neuroma. 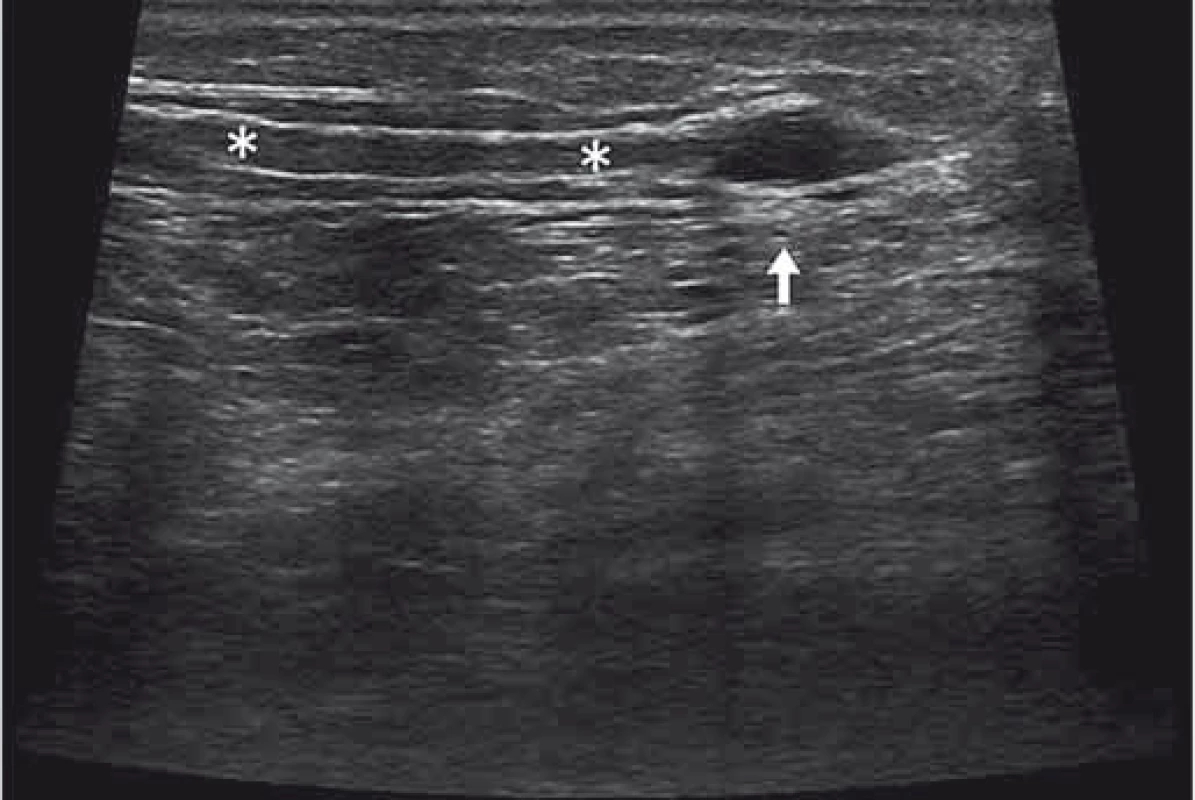
Kyjovité rozšíření pahýlu (bílá šipka) nervus ischiadius (hvezdičky) u pacienta po amputaci dolní končetiny. A thickened club-shaped end (white arrow) of the sciatic nerve (asterisks) in a patient after leg amputation. Zhodnocením struktury nervu a přilehlých měkkých tkání se dají odhalit též sekundární příčiny léze nervu. Například při peroneální mononeuropatii lze až v 18 % případů zjistit sekundární příčinu v existenci intraneurálního ganglionu v sousedství hlavičky fibuly [19]. Při vyšetření nervu hodnotíme jeho tvar, rozměry, echogenitu a vaskularitu. Při entrapment syndromech dochází k edému endo - epineuria a tvar nervu se zpravidla oplošťuje. V ultrazvukovém obraze dochází ke snížení echogenity nervu, rozšíření fasciklů či setření fascikulární struktury. Nejužívanější nástroje pro hodnocení rozměrů nervů v příčném zobrazení jsou plocha průřezu (Cross-Sectional Area; CSA) a swelling ratio (poměr CSA v místě nejvyšší hodnoty/ kontralaterální strana) (obr. 7). V případech suspekce na diagnózu syndrom karpálního tunelu lze vyšetření CSA n. medianus v úrovni vstupu do karpálního tunelu využít jako skríningový nástroj [20].
Image 7. Příčný sonogram levého zápěstí. Fig. 7. Axial sonogram of the left wrist. 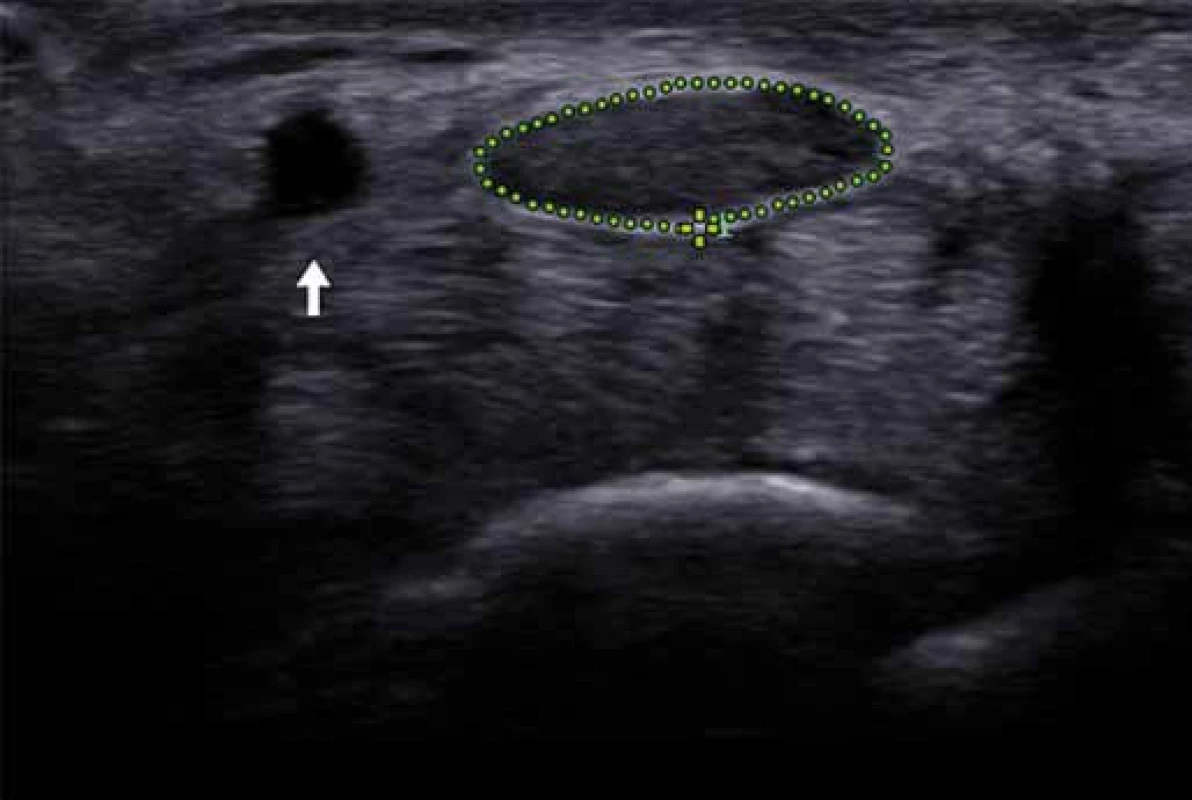
Příčný průřez nervus medianus (tečkované eliptické ohraničení) byl vyšší (31 mm2) než horní hranice normy (15,3 mm2). Nervus medianus se kromě rozšíření zobrazuje s patologickou hypoechogenitou a patrným setřením fascikulární struktury nervu. Arteria ulnaris (bílá šipka). Cross-sectional area of the median nerve (dotted ellipse) was larger (31 mm2) than normative data cut-off value (13.8 mm2). Median nerve appears swollen, hypoechoic and shows loss of the fascicular pattern. Ulnar artery (white arrow). Pro některé nervy a specifické lokality byly stanoveny referenční hodnoty [21]. Při chronické lézi nervu dochází často k jeho rozšíření, které je dobře patrné v US obraze. Selektivní edém nervových fasciklů se vyskytuje u některých onemocnění (chronická zánětlivá demyelinizační polyneuropatie (obr. 8) či některé druhy Charcot Marie Tooth polyneuropatie) [22].
Image 8. Obraz nervu při CIDP (chronická zánětlivá demyelinizační polyneuropatie). Fig. 8. Nerve affected by CIDP (chronic inflammatory demyelinating polyneuropathy). 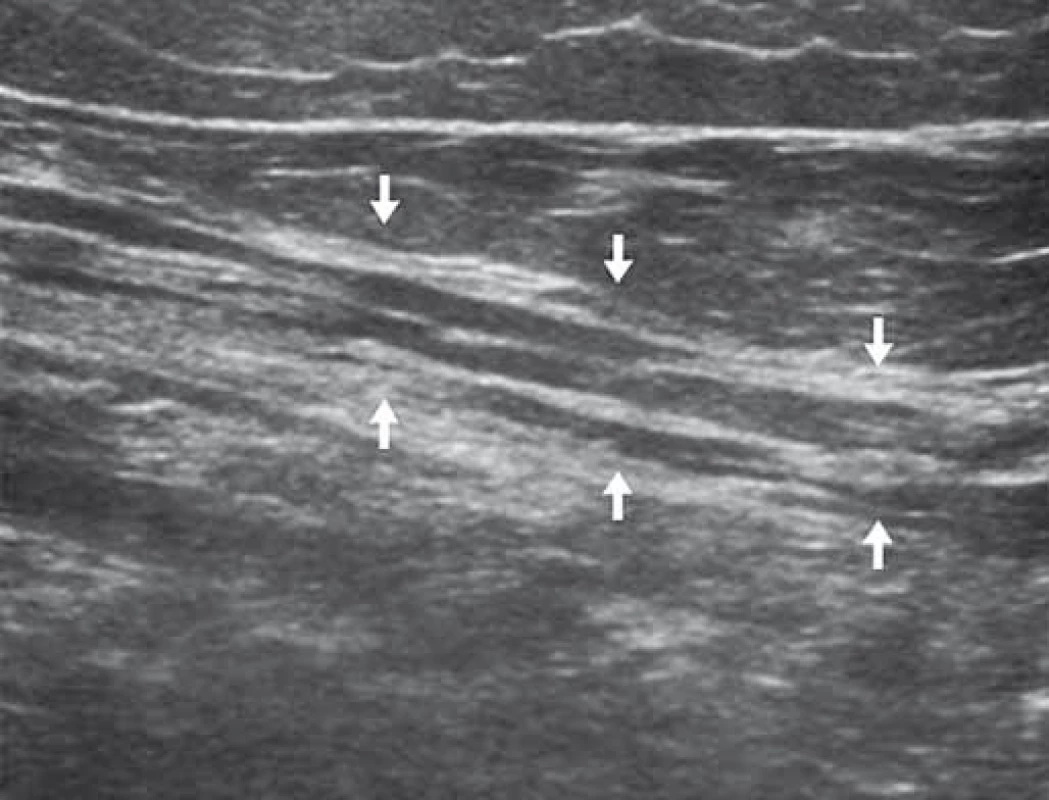
Je patrno nepravidelné zesílení jednotlivých fasciklů nervu (bílé šipky) (zde nervus ischiadicus). Irregular thickening of individual nerve fascicles is seen (white arrows) (sciatic nerve). Hypoechogenní strukturu nervu pozorujeme typicky při diabetické polyneuropatii [23]. Patologickou vaskularizaci prokazujeme při přítomnosti signálu barevného mapování uvnitř nervu [24]. V některých případech (syndrom karpálního tunelu) dochází ke snížení mobility nervu, jindy se mobilita zvyšuje (syndrom kubitálního tunelu) [25,26].
Závěr
US rozšiřuje diagnostické možnosti v oblasti měkkých tkání. Nabízí dostupný a bezpečný způsob zobrazení měkkých tkání ležících mimo akustické kostní okno. Je velmi přínosná v hodnocení lokalizovaných svalových postižení a lézí periferních nervů. US lze ale využít i v diagnostice neuromuskulárních chorob a myopatií. Kromě diagnostiky se rovněž uplatňuje při intervenčních výkonech z nejrůznějších indikací.
Poděkování za dlouhodobou podporu patří prof. MU Dr. Ivanu Dylevskému, DrSc.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Kamal Mezian
Katedra zdravotnických oborů a ochrany obyvatelstva
Fakulta biomedicínského inženýrství
ČVUT v Praze
Sportovců 2311
270 01 Kladno
e-mail: kamal.mezian@gmail.com
Přijato k recenzi: 4. 7. 2016
Přijato do tisku: 17. 8. 2016
Sources
1. Sharpe RE, Nazarian LN, Parker L, et al. Dramatically increased musculoskeletal ultrasound utilization from 2000 to 2009, especially by podiatrists in private offices. J Am Coll Radiol JACR 2012;9(2):141 – 6. doi: 10.1016/ j.jacr.2011.09.008.
2. Stoll G, Wilder-Smith E, Bendszus M. Imaging of the peripheral nervous system. Handb Clin Neurol 2013;115 : 137 – 53. doi: 10.1016/ B978-0-444-52902-2.00008-4.
3. Hrazdira L. Možnosti 3D ultrazvukového vyšetřování a prostorových rekonstrukcí pohybového aparátu. Brno: Paido 2004.
4. Ehler E. Použití botulotoxinu v neurologii. Cesk Slov Neurol N 2013;76/ 109(1):7 – 21.
5. Wilson DJ, Scully WF, Rawlings JM. Evolving role of ultrasound in therapeutic injections of the upper extremity. Orthopedics 2015;38(11):e1017 – 24. doi: 10.3928/ 01477447-20151020-11.
6. Sites BD, Spence BC, Gallagher JD, et al. Characterizing novice behavior associated with learning ultrasound-guided peripheral regional anesthesia. Reg Anesth Pain Med 2007;32(2):107 – 15.
7. Çağlayan G, Özçakar L, Kaymak SU, et al. Effects of Sono-feedback during aspiration of Baker’s cysts: a controlled clinical trial. J Rehabil Med 2016;48(4):386 – 9. doi: 10.2340/ 16501977-2049.
8. Zaidman C. Ultrasound of muscular dystrophies, myopathies, and muscle pathology. In: Walker FO, Cartwright MS (eds). Neuromuscular Ultrasound. 1st ed. Philadelphia: Elsevier 2011 : 131 – 49.
9. Pillen S, Arts IMP, Zwarts MJ. Muscle ultrasound in neuromuscular disorders. Muscle Nerve 2008;37(6):679 – 93. doi: 10.1002/ mus.21015.
10. Pillen S, Verrips A, van Alfen N, et al. Quantitative skeletal muscle ultrasound: diagnostic value in childhood neuromuscular disease. Neuromuscul Disord 2007;17(7):509 – 16.
11. Walker FO, Donofrio PD, Harpold GJ, et al. Sonographic imaging of muscle contraction and fasciculations: a correlation with electromyography. Muscle Nerve 1990;13(1):33 – 9.
12. Pillen S, Nienhuis M, van Dijk JP, et al. Muscles alive: ultrasound detects fibrillations. Clin Neurophysiol 2009;120(5):932 – 6. doi: 10.1016/ j.clinph.2009.01.016.
13. van Alfen N, Nienhuis M, Zwarts MJ, et al. Detection of fibrillations using muscle ultrasound: diagnostic accuracy and identification of pitfalls. Muscle Nerve 2011;43(2):178 – 82. doi: 10.1002/ mus.21863.
14. Won SJ, Kim BJ, Park KS, et al. Reference values for nerve ultrasonography in the upper extremity. Muscle Nerve 2013;47(6):864 – 71. doi: 10.1002/ mus.23691.
15. Simonetti S, Bianchi S, Martinoli C. Neurophysiological and ultrasound findings in sural nerve lesions following stripping of the small saphenous vein. Muscle Nerve 1999;22(12):1724 – 6.
16. Demondion X, Herbinet P, Boutry N, et al. Sonographic mapping of the normal brachial plexus. AJNR Am J Neuroradiol 2003;24(7):1303 – 9.
17. Özçakar L, Kara M, Yalçın B, et al. Bypassing the challenges of lower-limb electromyography by using ultrasonography: AnatoMUS-II. J Rehabil Med 2013;45(6):604 – 5. doi: 10.2340/ 16501977-1162.
18. Kurča E. Syndrom karpálného tunela. Cesk Slov Neurol N 2009;72/ 105(6):499 – 510.
19. Visser LH. High-resolution sonography of the common peroneal nerve: detection of intraneural ganglia. Neurology 2006;67(8):1473 – 5.
20. Kurča E, Nosal V, Grofik M, et al. Single parameter wrist ultrasonography as a first-line screening examination in suspected carpal tunnel syndrome patients. Bratisl Lek Listy 2008;109(4):177 – 9.
21. Qrimli M, Ebadi H, Breiner A, et al. Reference values for ultrasonograpy of peripheral nerves. Muscle Nerve 2016;53(4):538 – 44. doi: 10.1002/ mus.24888.
22. Sugimoto T, Ochi K, Hosomi N, et al. Ultrasonographic nerve enlargement of the median and ulnar nerves and the cervical nerve roots in patients with demyelinating Charcot-Marie-Tooth disease: distinction from patients with chronic inflammatory demyelinating polyneuropathy. J Neurol 2013;260(10):2580 – 7. doi: 10.1007/ s00415-013-7021-0.
23. Watanabe T, Ito H, Sekine A, et al. Sonographic evaluation of the peripheral nerve in diabetic patients: the relationship between nerve conduction studies, echo intensity, and cross-sectional area. J Ultrasound Med 2010;29(5):697 – 708.
24. Ghasemi-Esfe AR, Morteza A, Khalilzadeh O, et al. Color Doppler ultrasound for evaluation of vasomotor activity in patients with carpal tunnel syndrome. Skeletal Radiol 2012;41(3):281 – 6. doi: 10.1007/ s00256-011-1149-8.
25. Hough AD, Moore AP, Jones MP. Reduced longitudinal excursion of the median nerve in carpal tunnel syndrome. Arch Phys Med Rehabil 2007;88(5):569 – 76.
26. Filippou G, Mondelli M, Greco G, et al. Ulnar neuropathy at the elbow: how frequent is the idiopathic form? An ultrasonographic study in a cohort of patients. Clin Exp Rheumatol 2010;28(1):63 – 7.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 6-
All articles in this issue
- Deprese u vybraných neurologických onemocnění
- Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
- Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška
- Neuropsychologické abnormity v exekutivních funkcích u pacientů s blefarospazmem
- Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
- Případ závažného průběhu HIV-1 meningoencefalitidy a lues secundaria
- Autoimunitní encefalitidy – kazuistiky
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Strach související s bolestí u pacientů s chronickou bolestí dolní části zad
- Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
- Úvod do neuromuskulární ultrasonografie
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
- Předoperační výkony v oblasti vizuální paměti jako prediktivní faktor kognitivních změn po hluboké mozkové stimulaci subthalamického jádra u Parkinsonovy nemoci
- Orbitocelulitida jako komplikace akutní rhinosinusitidy – naše zkušenosti s léčbou u dospělých pacientů
- Spinálny gossypibóm 20 rokov po lumbálnej diskektómii – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

