-
Medical journals
- Career
Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
Authors: Z. Pavelek 1; P. Ryška 2; J. Žižka 2; S. Plíšek 3; M. Vališ 1
Authors‘ workplace: Neurologická klinika, LF UK a FN Hradec Králové 1; Radiologická klinika, LF UK a FN Hradec Králové 2; Klinika infekčních nemocí, LF UK a FN Hradec Králové 3
Published in: Cesk Slov Neurol N 2016; 79/112(5): 604-607
Category: Case Report
Overview
Idiopatická hypertrofická kraniální pachymeningitida (IHCP) je extrémně vzácné onemocnění neznámé příčiny. Jedná se o chronický, zánětlivý a fibrotizující proces postihující kraniální duru mater. Klinické projevy jsou značně heterogenní a zahrnují cefaleu, ataxii, epileptické záchvaty či obrnu kraniálních nervů, která je způsobena kompresí výstupní zóny nervových kořenů hypertrofickou pachymeningitidou. Cefalea je pak vysvětlována durálním zánětem. IHCP může dokonce imitovat tranzitorní ischemickou ataku. V laboratorních náběrech jsou obvykle přítomny zvýšené hodnoty C-reaktivního proteinu a sedimentace krve. Likvorový obraz v mnoha případech ukazuje na aseptický zánětlivý proces. Hlavní diagnostickou metodou je magnetická rezonance mozku, která zobrazí lokalizované či difuzní ztluštění dury mater s enhancementem po podání kontrastní látky gadolinia. Klinický průběh je chronicky-progresivní a zahrnuje četné rekurence. V léčbě je doporučena kombinace kortikosteroidů s další imunosupresivní medikací (azatioprin, cyklofosfamid či metotrexát), v rezistentních případech radioterapie či chirurgické odstranění postižené tkáně. V diferenciální diagnóze je nutné vyloučit jiné případy pachymeningitidy, a to infekční, systémová autoimunitní onemocnění, vaskulitidy, malignity a intrakraniální hypotenzi. V uvedené práci jsou prezentovány dvě kazuistiky, na kterých je demonstrován průběh, diagnostika a terapie tohoto závažného onemocnění.
Klíčová slova:
pachymeningitida – magnetická rezonance – ztluštění dury materÚvod
Idiopatická hypertrofická kraniální pachymeningitida (IHCP) je vzácné zánětlivé onemocnění postihující kraniální duru mater. Etiologie onemocnění je ve většině případů neznáma. Klinické projevy jsou heterogenní, zahrnují zejména bolesti hlavy s postižením kraniálních nervů. Základní diagnostickou metodou je magnetická rezonance (MR) [1]. Včasná diagnostika a správná léčba onemocnění může minimalizovat jeho klinické projevy. Vzhledem ke stále častějšímu používání MR stoupá v literatuře počet citovaných kazuistik. Tato práce prezentuje dva pacienty s typickými klinickými projevy IHCP, tedy entity, která doposud nebyla publikována v české literatuře.
Kazuistika 1
Pacient je 50letý muž narozen v roce 1965, v jehož anamnéze je pozoruhodný údaj o hospitalizaci v červnu roku 2012 pro komunitní pleuropneumonii s nenalezeným agens, která byla komplikována atakou centrální levostranné hemiparézy v trvání do 20 min. V rámci etiologického pátrání pro přechodnou ložiskovou lézi cerebrální bylo provedeno CT mozku, angiografické zobrazení extra - i intrakraniálního tepenného řečiště metodou CT a kardiologické vyšetření s negativním nálezem. Stav byl uzavřen jako tranzitorní ischemická ataka z pravého karotického povodí. V září roku 2012 byl pacient hospitalizován na Neurologické klinice v Hradci Králové pro cefaleu s diplopií při oboustranné paréze n. abducens. Provedená MR mozku byla až na několik nespecifických ložisek supratentoriálně negativní. Likvorologický nález nebyl přínosný (protein 1 g/l, lymfocyty 18/3, chloridy i hladina cukru v normě, infekční etiologie neprokázána). Mozková panangiografie a elektromyografie byla s normálním nálezem. I přes absenci bolestivé oftalmoplegie (susp. Tolosa-Hunt syndrom) byl přeléčen pulzem kortikoidů (3 × 1 000 mg Solu-Medrol) s následným postupným snižováním dávky perorálního kortikoidu, tzv. „taperem“ (à 3 dny v mg 32–16–0, 16–16–0, 16–0–0, 8–0–0 a ex). Po pulzní léčbě došlo k ústupu bolestí hlavy, diplopie přetrvávala. V prosinci 2012 se nemocný dostavil k vyšetření pro recidivu torpidních bolestí hlavy, v objektivním neurologickém nálezu byla konstatována nově navíc inkompletní zevní paréza n. oculomotorius vlevo a léze první a druhé větve n. trigeminus vlevo. MR mozku již s podáním kontrastní látky zobrazila ztluštění a opacifikaci mening paraselárně bilaterálně, v dif. dg. byla zvažována zánětlivá etiologie, sarkoidóza, tumorózní proces, idiopatická hypertrofická kraniální pachymeningitida či meningiom (obr. 1). Základní biochemické a hematologické vyšetření krve bylo v normě, patologickým nálezem byla zvýšená sedimentace (40/80). Při opakovaném vyšetření mozkomíšního moku došlo k nárůstu množství lymfocytů (58/3) a bílkoviny (1,4 g/l). Rozšířená mikrobiologická diagnostika mozkomíšního moku byla opět negativní. S negativním výsledkem dopadla diagnostika sarkoidózy, tuberkulózy a syfilis. Imunofenotypizace likvoru byla negativní a nádorové buňky nebyly zjištěny. Komplexní revmatologické vyšetření neprokázalo systémovou vaskulitidu či zánětlivé onemocnění pojiva. Při kontrolní MR mozku s odstupem 14 dnů byla zjištěna výrazná progrese nálezu ztluštění a postkontrastní opacifikace mening při bazi, zejména oboustranně paraselárně, která přecházela na tentorium a infratentoriálně do oblasti praepontinní a pontocerebellární cisterny oboustranně (obr. 2). Tento nález na MR mozku při negativitě předcházejících vyšetření podporoval diagnózu IHCP. Nemocný byl přeléčen 5 g metylprednizolonu intravenózně s taperem kortikoidy na cílovou dávku 16 mg denně (postupně à 3 dny v mg 32–16–0, 16–16–0, 16–0–0), do medikace byl rovněž přidán azatioprin v dávce 25 mg denně. Klinický efekt byl výrazný, odezněly bolesti hlavy, přetrvávala reziduální léze n. oculomotorius. V současné době nemocný podstupuje pravidelnou kvartální léčbu intravenózním metylprednizolonem v dávce 3 g, v chronické medikaci je ponechán metylprednizolon a azatioprin v dávce 16 mg, resp. 25 mg denně. Kontrolní MR ze srpna 2013 prokázala regresi ztluštění tvrdé pleny mozkové v oblasti klivu a tentoria, také regresi opacifikace mozkových plen v oblasti vnitřních zvukovodů (obr. 3). Recentní MR z ledna 2016 je se stacionárním nálezem.
Image 1. MR mozku, postkontrastní T1 vážené obrazy v axiální/koronární rovině; patologické pachymeningeální ztluštění tentoria – kazuistika 1. Fig. 1. Brain MRI, contrast-enhanced T1-weighted images in the axial/coronal plane; pachymeningeal pathological thickening of tentoria – a case report 1. 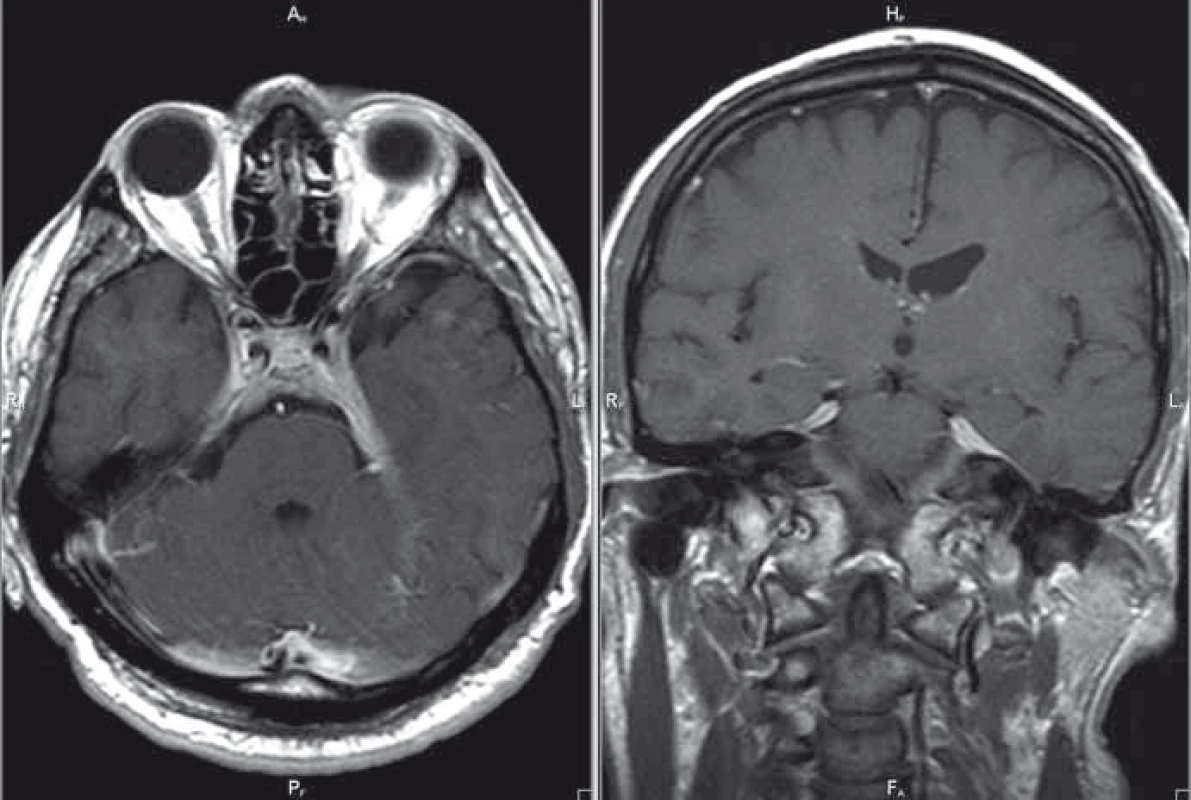
Image 2. MR mozku, postkontrastní T1 vážené obrazy v axiální/koronární rovině; progrese nálezu – kazuistika 1. Fig. 2. Brain MRI, contrast-enhanced T1-weighted images in the axial/coronal plane; disease progression – a case report 1. 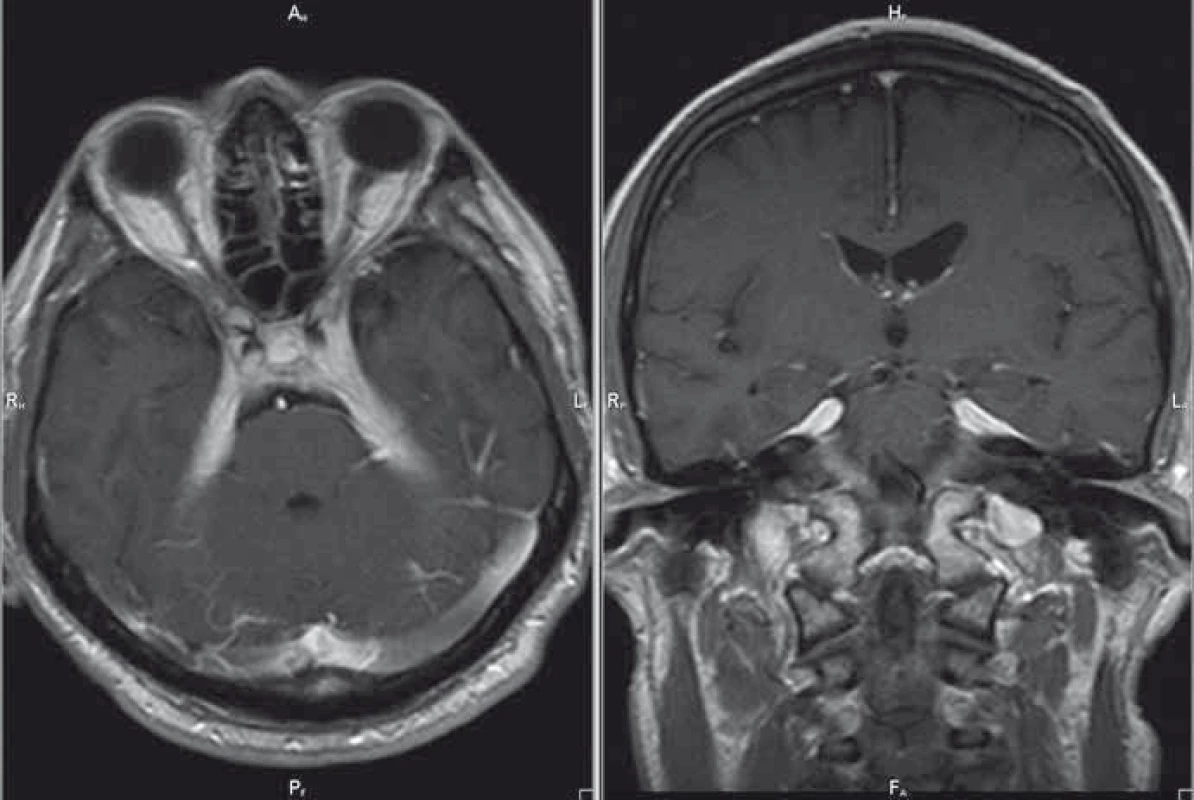
Image 3. MR mozku, postkontrastní T1 vážené obrazy v axiální/koronární rovině; regrese nálezu – kazuistika 1. Fig. 3. Brain MRI, contrast-enhanced T1-weighted images in the axial/coronal plane; disease regression – a case report 1. 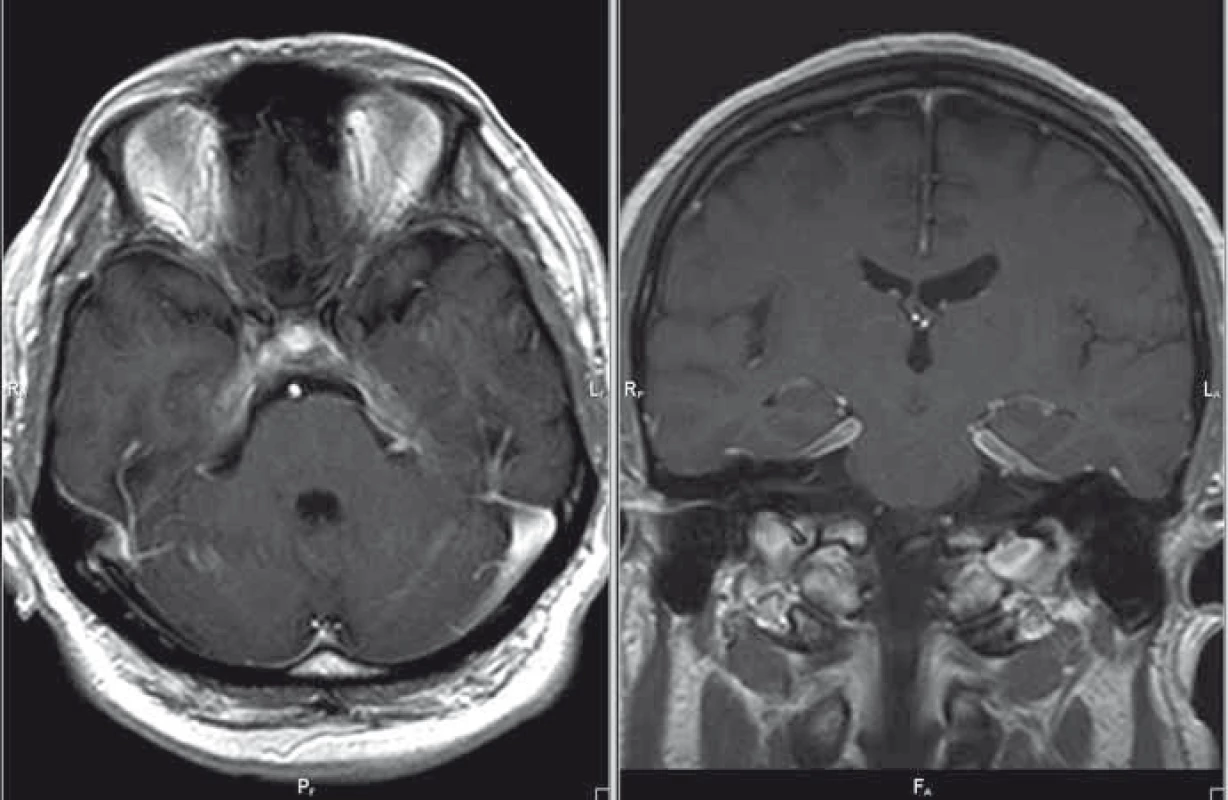
Kazuistika 2
Druhá kazuistika popisuje 57letého muže narozeného v roce 1958, který byl vyšetřován na spádovém pracovišti pro náhle vzniklou diplopii při lézi n. abducens vpravo se vznikem v lednu 2014. V rámci diagnostického pátrání bylo vstupně provedeno CT mozku, angiografické zobrazení extra - i intrakraniálního tepenného řečiště metodou CT s negativním nálezem. Doplněná MR mozku neprokázala kauzální patologii, stejně jako komplexní vyšetření mozkomíšní moku. Na našem pracovišti byl pacient poprvé vyšetřen v září 2014, kdy kromě přetrvávající parézy VI. hlavového nervu vpravo byl limitován torpidní faciální neuralgií z oblasti n. V/2 vpravo. V profylaktické léčbě neuralgie trigeminu byl zajištěn pregabalinem a amitriptylinem, pravidelně užíval oxycodon. Základní biochemické a hematologické vyšetření krve bylo v normě, vč. sedimentace. Provedená kontrolní MR mozku s kontrastní látkou s ohledem na nález rozsáhlé infiltrace mening podporovala diagnózu IHCP (při vyloučení revmatologického i infekčního onemocnění) a vysvětlila klinické obtíže (obr. 4). Nemocný byl přeléčen 5 g metylprednizolonu intravenózně s taperem kortikoidy (postupně à 3 dny v mg 32–16–0, 16–16–0, 16–0–0, 8–0–0 a ex). Při kontrolní MR mozku v dubnu 2015 byla konstatována výrazná regrese infiltrace mening, jak v oblasti cavum Meckeli, tak na bazi klivu a na tentoriu vpravo. V současné době je pacient léčen 5g metylprednizolonu intravenózně v intervalu à 4 měsíce, v neurologickém nálezu přetrvává lehká paréza n. abducens vpravo, faciální neuralgie je uspokojivě kompenzována profylaktickou medikací.
Image 4. MR mozku, postkontrastní T1 vážené obrazy v axiální/koronární rovině; patologické zesílení pravé poloviny tentoria s nápadnou opacifikací po podání kontrastní látky – kazuistika 2. Fig. 4. Brain MRI, contrast-enhanced T1-weighted images in the axial/coronal plane; pathological thickening of the right tentorium with significant post-contrast opacification – a case report 2. 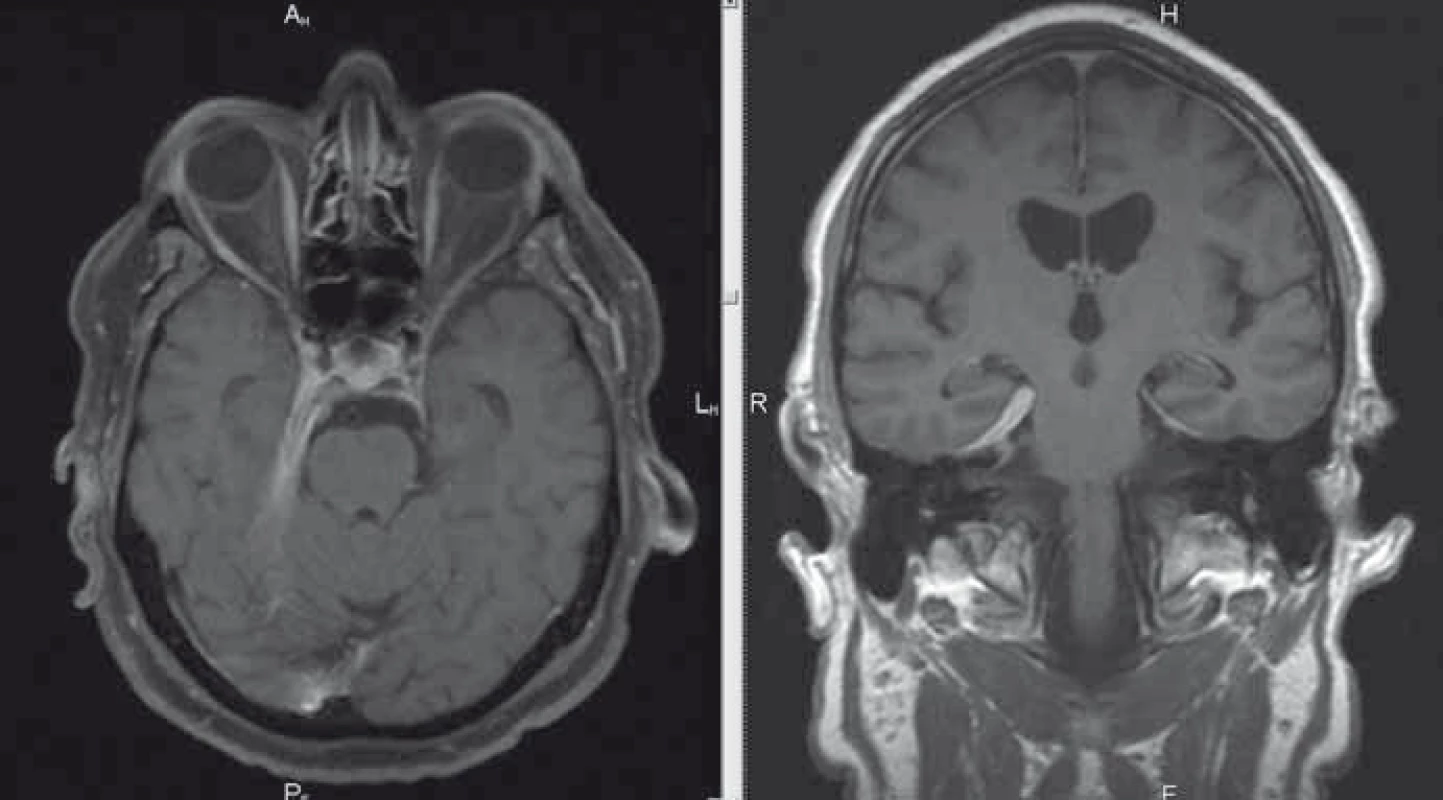
Diskuze
IHCP je vzácné zánětlivé onemocnění neznámé příčiny, které je obtížně diagnostikovatelné a může vést k mylnému výkladu klinického i radiologického nálezu [1]. První případy byly prezentovány v roce 1989 [2]. Projevuje se ztluštěním baze lební, tentoria a falxu [3]. Klinickým projevem je nejčastěji bolest hlavy a mnohočetné parézy hlavových nervů [4–7]. Bolest hlavy může být v některých případech izolovaný příznak, řadu let předchází rozvoji onemocnění. Nejčastěji postižený hlavový nerv bývá n. vestibulocochlearis, méně často n. trigeminus, facialis, vagus a hypoglossus, léze zbývajících kraniálních nervů je vzácnější [8]. Dalšími projevy může být ataxie nebo akutní ztráta zraku [9]. IHCP může imitovat i tranzientní ischemickou ataku [10]. Charakteristické klinické obtíže s dominující cefaleou a lézí hlavových nervů byly rovněž manifestací IHCP u dvou prezentovaných nemocných.
V laboratorní náběrech je zvýšená sedimentace, při vyšetření mozkomíšního moku je běžná lymfocytární pleocytóza a středně zvýšená hladina bílkoviny [11,12]. Základní metoda v diagnostice nemoci postihující duru mater, stejně jako k monitoraci aktivity nemoci a odpovědi na léčbu, je MR s podáním kontrastní látky gadolinia [2]. Centrální pachymeningeální vrstva se neopacifikuje na postkontrastních T1 vážených snímcích [13]. T2 vážené snímky ukazují lokalizované nebo difuzní ztluštění dury mater, rovněž dochází ke zřetelnému enhancementu po podání gadolinia [14]. Typický obraz na MR s enhancementem po podání kontrastní látky byl pozorován u obou popisovaných pacientů. MR může zobrazit také vhodné místo pro biopsii. Biopsie je důležitou metodou v diagnostickém procesu, ukazuje na chronickou zánětlivou odpověď, nicméně její hlavní rolí je vyloučení jiných příčin hypertrofické pachymeningitidy [15]. Diferenciální diagnostiku pachymeningitidy představili Karaksis et al (tab. 1) [1].
Table 1. Příčiny pachymeningitidy (abnormální ztluštění a enhancement dury mater po podání gadolinia) dle [1]. ![Příčiny pachymeningitidy (abnormální ztluštění a enhancement dury mater po podání gadolinia) dle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0d0aa838101837072247fb17331461f7.jpg)
Klinický průběh nemoci je obvykle progresivní, zahrnuje časté rekurence [14,16], data o spontánní remisi jsou ojedinělá [17]. V léčbě IHCP se používají kortikosteroidy obvykle s úvodním vysokodávkovým pulzem, nemoc může vyžadovat jejich dlouhodobé podávání. Bohužel neexistuje konsenzus o adekvátní dávce a trvání léčby kortikoidy [18]. Pacienti s nedostatečnou odpovědí na kortikosteroidy mohou být léčeni cyklofosfamidem, azatioprinem nebo metotrexátem [19]. Kombinovaná terapie (kortikosteroidy + imunomodulační léčba) dosahuje výrazně lepších výsledků [15]. Někteří nemocní s masivním ztluštěním baze lební vyžadují chirurgickou léčbu [20]. Oba pacienti byli léčeni primárně vysokodávkovým pulzem metylprednizolonu. První nemocný byl zajištěn chronickou perorální kortikoterapií a azatioprinem při znalosti výše uvedených literárních dat o benefitu kombinované terapie. S ohledem na chronický zánětlivý proces bylo přistoupeno vzhledem k dobré toleranci pulzní intravenózní kortikoterapie ke kvartálnímu podávání této léčby v dávce 3 × 1 000 mg. Přestože se nejedná o standardní léčbu, radiologické nálezy a klinická odpověď podporují správnou volbu této léčby. U druhého nemocného byla zahájena a ponechána monoterapie metylprednizolonem intravenózně s uspokojivou klinickou i radiologickou odpovědí. Posílení léčby o perorální imunosupresivum je plánováno pouze při selhání vysokodávkové pulzní léčby. Pulzní kortikoterapie tak může být alternativou chronické perorální kortikoterapie pro nižší četnost nežádoucích účinků.
Závěr
Ač je idiopatická hypertrofická kraniální pachymeningitida velmi vzácné onemocnění, musí být zahrnuta do úvahy v diferenciální diagnostice u pacientů s cefaleou a zejména parézou hlavových nervů. Klíčovou paraklinickou metodou je MR, která zobrazuje lokalizované či difúzní ztluštění dury mater s enhancementem po podání kontrastní látky gadolinia, nicméně komplexní diagnostický proces by měl zahrnovat biochemické a hematologické vyšetření krve, skiagram hrudníku, revmatologické vyšetření, vyšetření mozkomíšního moku, event. bioptické vyšetření dury mater.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zbyšek Pavelek
Neurologická klinika LF UK a FN v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: zbysekpavelek@email.cz
Přijato k recenzi: 29. 2. 2016
Přijato do tisku: 30. 3. 2016
Sources
1. Karakasis C, Deretzi G, Rudolf J, et al. Long-term lack of progression after initial treatment of idiopathic hypertrophic pachymeningitis. J Clin Neurosci 2012; 19 (2): 321–3. doi: 10.1016/j.jocn.2011.05.020.
2. Martin N, Masson C, Henin D, et al. Hypertrophic cranial pachymeningitis: assessment with CT and MR imaging. AJNR Am J Neuroradiol 1989; 10 : 477–84.
3. Rossi S, Giannini F, Cerase A, et al. Uncommon findings in idiopathic hypertrophic cranial pachymeningitis. J Neurol 2004; 251 (5): 548–55.
4. Smolders D, De Foer B, Pouillon M, et al. Idiopathic hypertrophic cranial pachymeningitis. JBR-BTR 2002; 85 (3): 154–5.
5. Sylaja PN, Cherian PJ, Das CK, et al. Idiopathic hypertrophic cranial pachymeningitis. Neurol India 2002; 50 (1): 53–9.
6. Yonekawa T, Murai H, Utsuki S, et al. A nationwide survey of hypertrophic pachymeningitis in Japan. J Neurol Neurosurg Psychiatry 2014; 85 (7): 732–9. doi: 10.1136/jnnp-2013-306410.
7. Kang SY, Choi JC, Kang JH. Idiopathic hypertrophic pachymeningitis presented with abducens nerve palsy. J Korean Neurol Assoc 2005; 23 (3): 431–3.
8. Mamelak AN, Kelly WM, Davis RL, et al. Idiopathic hypertrophic cranial pachymeningitis. Report of three cases. J Neurosurg 1993; 79 (2): 270–6.
9. Mathew RG, Hogarth KM, Coombes A. Idiopathic hypertrophic cranial pachymeningitis presenting as acute painless visual loss. International Ophthalmology 2012; 32 (2): 195–7. doi: 10.1007/s10792-012-9536-2.
10. Fan Y, Liao S, Yu J, et al. Idiopathic hypertrophic cranial pachymeningitis manifested by transient ischemic attack. Med Sci Monit 2009; 15 (12): CS178–81.
11. Phanthumchinda K, Sinsawaiwong S, Hemachudha T, et al. Idiopathic hypertrophic cranial pachymeningitis: an unusual cause of subacute and chronic headache. Headache 1997; 37 (4): 249–52.
12. Phanthumchinda K. Idiopathic hypertrophic cranial pachymeningitis: an emerging inflamatory meningeal syndrome. J Clin Neurosci 1997; 150 : 310.
13. Rumboldt Z. Brain Imaging with MRI and CT. Cambridge: UP 2012.
14. Lee YC, Chueng YC, Hsu SW, et al. Idiopathic hypertrophic cranial pachymeningitis: a case report with 7 years of imaging follow-up. AJNR Am J Neuroradiol 2003; 24 (1): 119–23.
15. Bosman T, Simonin C, Launay D, et al. Idiopathic hypertrophic cranial pachymeningitis treated by oral methotrexate: a case report and review of literature. Rheumatol Int 2008; 28 (7): 713–8.
16. Zhu R, He Z, Ren Y. Idiopathic hypertrophic craniocervical pachymeningitis. Eur Spine J 2015; 24: S633–5. doi: 10.1007/s00586-015-3956-4.
17. Nishio S, Morioka T, Togawa A, et al. Spontaneous resolution of hypertrophic cranial pachymeningitis. Neurosurg Rev 1995; 18 (3): 201–4.
18. Qin LX, Wang CY, Hu ZP, et al. Idiopathic hypertrophic spinal pachymeningitis: a case report and review of literature. Eur Spine J 2015; 24 (Suppl 4): S636–43. doi: 10.1007/s00586-015-3958-2.
19. Miyake K, Okada M, Hatakeyama T, et al. Usefulness of L-methyl-11c-methionine positron emission tomography in the treatment of idiopathic hypertrophic cranial pachymeningitis – a case report. Neurol Med Chir (Tokyo) 2012; 52 (10): 765–9.
20. Takuma H, Shimada H, Inoue Y, et al. Hypertrophic pachymeningitis with anti-neutrophil cytoplasmic antibody (p-ANCA), and diabetes insipidus. Acta Neurol Scand 2001; 104 (6): 397–401.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 5-
All articles in this issue
- Rasmussenova encefalitída
- Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
- Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

