-
Medical journals
- Career
Familiární amyloidová polyneuropatie – kazuistika
: T. Pika 1; P. Látalová 2; H. Hůlková 3,4; H. Vlášková 3; P. Otruba 5; V. Mejzlík 6; V. Ščudla 1,7
: Hemato-onkologická klinika LF UP a FN Olomouc 1; Ústav klinické a molekulární patologie, LF UP v Olomouci 2; Ústav dědičných metabolických poruch, 1. LF UK a VFN v Praze 3; Ústav patologie, 1. LF UK a VFN v Praze 4; Neurologická klinika LF UP a FN Olomouc 5; Centrum kardiovaskulární a transplantační chirurgie, Brno 6; III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc 7
: Cesk Slov Neurol N 2015; 78/111(6): 710-714
: Case Report
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2015710Předkládáme popis případu nemocného s familiární formou amyloidové polyneuropatie. Mladý nemocný s postupně progredujícími projevy léze periferních nervů byl zprvu diagnostikován a léčen pro chronickou zánětlivou demyelinizační polyneuropatii. Pro následné komplikace bylo provedeno endoskopické vyšetření zažívacího traktu s bioptickým průkazem amyloidových depozit. Následné komplexní vyšetření potvrdilo hereditární formu transtyretinové amyloidové polyneuropatie na podkladě raritní mutace v genu pro transtyretin na pozici Val50Ala.
Předkládáme popis případu nemocného s familiární formou amyloidové polyneuropatie. Mladý nemocný s postupně progredujícími projevy léze periferních nervů byl zprvu diagnostikován a léčen pro chronickou zánětlivou demyelinizační polyneuropatii. Pro následné komplikace bylo provedeno endoskopické vyšetření zažívacího traktu s bioptickým průkazem amyloidových depozit. Následné komplexní vyšetření potvrdilo hereditární formu transtyretinové amyloidové polyneuropatie na podkladě raritní mutace v genu pro transtyretin na pozici Val50Ala. Anamnesticky, matka nemocného byla léčena pro amyloidózu s neuropatickými projevy. Léčba pacienta preparátem tafamidis meglumine vedla k zabránění další progrese onemocnění a následně byla provedena ortotopní transplantace jater. V současnosti dochází ke klinickému zlepšování stavu nemocného s postupnou regresí motorických a senzitivních neuropatických projevů.
Klíčová slova:
familiární amyloidová polyneuropatie – transtyretin – tafamidis meglumineÚvod
Amyloidózy tvoří poměrně heterogenní skupinu onemocnění, jejichž společným rysem je ukládání amyloidu – insolubilního bílkovinného materiálu fibrilárního charakteru, který je extracelulárně deponován v tkáních. Doposud bylo identifikováno více než 30 různých amyloidogenních proteinů. V zásadě rozlišujeme amyloidózu dle rozsahu postižení na systémovou a lokalizovanou, dle charakteru přenosu pak na získané a hereditární formy [1]. V našich podmínkách se nejčastěji setkáváme s AL (light‑chain amyloidosis) typem amyloidózy, která náleží do skupiny monoklonálních gamapatií a jejíž příčinou je ukládání monoklonálních lehkých řetězců imunoglobulinu [2]. Hereditární amyloidózy představují přibližně 4 % celkového počtu případů a jsou často vázány na endemické oblasti. Nejčastějším dědičným typem je amyloidóza z depozice mutovaného transtyretinu (TTR, prealbumin). Doposud bylo identifikováno více než 130 mutací v transtyretinovém genu a dle typu příčinné mutace je charakterizován i klinický obraz onemocnění, přičemž nejčastější variantu představuje neuropatické postižení [3]. Náplní předloženého sdělení je prezentace raritního případu nemocného s dědičnou formou TTR amyloidózy.
Popis případu
Nemocný (25 let) byl v dubnu 2012 vyšetřen na spádovém neurologickém oddělení pro anamnézu dvou let trvajících a postupně progredujících dysestezií a parestezií dolních končetin spojených s atrofií svalů a omezením svalové síly akrálně pod obrazem peroneální parézy. V posledním roce byla rovněž přítomna intermitentní dyspepsie s úbytkem hmotnosti 10 kg (BMI 16,3; modifikované BMI (mBMI) 717,2). V osobní anamnéze byla zjištěna pouze endoskopicky neverifikovaná refluxní choroba jícnu léčená inhibitorem protonové pumpy. Matka nemocného zemřela ve 47 letech na amyloidózu. Bylo provedeno EMG vyšetření s nálezem těžké axonálně‑demyelinizační senzomotorické polyneuropatie s prevalencí na dolních končetinách. Dlouholatentní odpovědi na nervech dolních končetin (H ‑ reflex a F vlna) nebyly vybaveny, kondukční motorické studie prokazovaly snížení rychlosti motorického vedení na hodnoty mezi 35,3 – 42,9 m/ s. Amplitudy sumačních akčních potenciálů byly snížené s nápadnou chronodisperzí a při vyšetření n. ulnaris až do obrazu bloku vedení. Senzitivní neurogram na dolních končetinách nebyl vybaven, na nervech horních končetin prokazoval sníženou senzitivní rychlost vedení a redukci amplitudy senzitivního nervového akčního potenciálu. Doplněná jehlová EMG prokázala vyšší amplitudu motorických jednotek a výraznou redukci interferenčního vzorce. Tento nález byl interpretován jako změny při chronické zánětlivé demyelinizační polyneuropatii (CIDP) nebo probíhající polyradikuloneuritidě. Vyšetření likvoru ukázalo vyšší hladinu bílkoviny (1,37 g/ l, NR: 0,2 – 0,45 g/ l), jinak bylo zcela negativní, stejně tak další běžná vyšetření neprokázala možnou příčinu postižení (CD ‑ transferin, diabetologické testy, sérologie, paraneoplastické protilátky). Bylo rovněž provedeno elektroforetické vyšetření séra a stanovení sérových hladin volných lehkých řetězců imunoglobulinu s negativním nálezem, což bylo hodnoceno jako dostačující k vyloučení možné amyloidózy. Diagnostickým rozborem byla stanovena diagnóza CIDP, podpořená likvorologickým a EMG vyšetřením, nemocný byl zaléčen pulzy metylprednizonu (3 × 1 g i.v.) následně s udržovací terapií azatioprinem a prednizonem. Nemocný byl předán do domácí péče. Po 10 dnech od dimise byl hospitalizován na psychiatrické klinice pro organickou psychózu s bludy při steroidní terapii, zde během dvou dnů došlo k rozvoji horního dyspeptického syndromu a nemocný byl přeložen na gastroenterologické oddělení. Byla provedena horní endoskopie trávicí trubice s nálezem rozsáhlých nekróz sliznice žaludku, duodena a proximálního jejuna, histologické vyšetření bioptického vzorku prokázalo v žaludeční a duodenální sliznici depozici amyloidu. Nemocný byl přeložen k další péči do Centra pro diagnostiku a léčbu monoklonálních gamapatií, FN v Olomouci. Podrobněji byla doplněna rodinná anamnéza s tím, že matka nemocného zemřela na amyloidózu s neuropatickými projevy, která byla biopticky verifikována z n. suralis. Dědeček nemocného z matčiny strany zemřel v šestém deceninu na blíže nespecifikované neurologické onemocnění. Laboratorní vyšetření neprokázalo přítomnost monoklonálního gradientu v séru a moči, sérové hladiny volných lehkých řetězců byly v mezích normy, stejně tak i srdeční biomarkery (Troponin T, NT ‑ proBNP) byly v mezích normy. Nebyla zjištěna zvýšená proteinurie. Vyšetření kostní dřeně neprokázalo přítomnost monoklonální plazmocelulární populace či jinou atypii. Echokardiografické a MR vyšetření myokardu jednoznačně neprokázalo možné postižení při amyloidóze. AL amyloidóza se tedy zdála jako nepravděpodobná, pro což svědčila i negativní nepřímá imunohistochemie lehkých řetězců kappa a lambda v bioptických vzorcích. Imunohistochemická detekce sérového AA proteinu (SAA) byla v amyloidních depozitech rovněž negativní. Bioptické vzorky byly odeslány ke konzultačnímu vyšetření do laboratoře Ústavu dědičných metabolických poruch, VFN v Praze. Zde provedená imunohistochemická detekce primárních amyloidogenních proteinů prokázala masivní pozitivitu transtyretinu (TTR, prealbumin) v amyloidních depozitech v intersticiu lamina propria mucosae a muscularis mucosae žaludeční a duodenální sliznice. Identický výsledek byl následně potvrzen po zajištění potřebných protilátek i v laboratořích FN Olomouc (obr. 1, 2). Vzhledem k charakteru postižení a rodinné anamnéze byla zvažována hereditární forma amyloidózy, což bylo následně potvrzeno sekvenací TTR genu opět v laboratořích Ústavu dědičných metabolických poruch s průkazem mutace c.149T<C v heterozygotním stavu. Předpokládaným efektem této mutace na protein je záměna valinového za alaninový zbytek na 50. pozici (p.Val50Ala), v maturovaném proteinu se jedná o záměnu na 30. pozici (p.Val 30Ala). Byla tedy potvrzena diagnóza familiární polyneuropatie z depozice amyloidu na bázi transtyretinu s postižením periferního nervového systému a gastrointestinálního traktu. Vzhledem k etiologii onemocnění a dominantní syntéze patologického proteinu byl nemocný indikován k ortotopní transplantaci jater (OLT) jako kauzální terapii. Po doplnění potřebných vyšetření (sérologie, echokardiografie, CT břicha) byl zařazen na čekací listinu k OLT. Vzhledem k rychlé progresi neuropatických obtíží i přes konzervativní terapii (vazodilatancia, vitaminy, rehabilitace, nutriční podpora sippingem) a po prostudování dostupné literatury byla po schválení zdravotní pojišťovnou zahájena terapie preparátem Vyndaqel cps. (Tafamidis meglumine, Pfizer) v dávce 20 mg/ den. Terapie vedla k zastavení další progrese neuropatického postižení, zlepšení nutrice s ústupem dyspeptických obtíží, k nárůstu mBMI a celkovému zlepšení kondice nemocného. Léčba byla komplikována atakou hluboké žilní trombózy vena tibialis pravé dolní končetiny léčené nízkomolekulárním heparinem. V listopadu 2013, tedy 19 měsíců od stanovení diagnózy, byla provedena OLT s dobrým pooperačním průběhem, který byl komplikován časnou kortikosenzitivní rejekční epizodou a bronchopneumonií. V současné době nemocný intenzivně rehabilituje, dochází k postupné regresi motorických a senzitivních neuropatických projevů a zlepšení nutričního stavu nemocného (BMI 17,9; mBMI 841).
1. Biopsie žaludku, kongo červeň, zvětšení 100x. 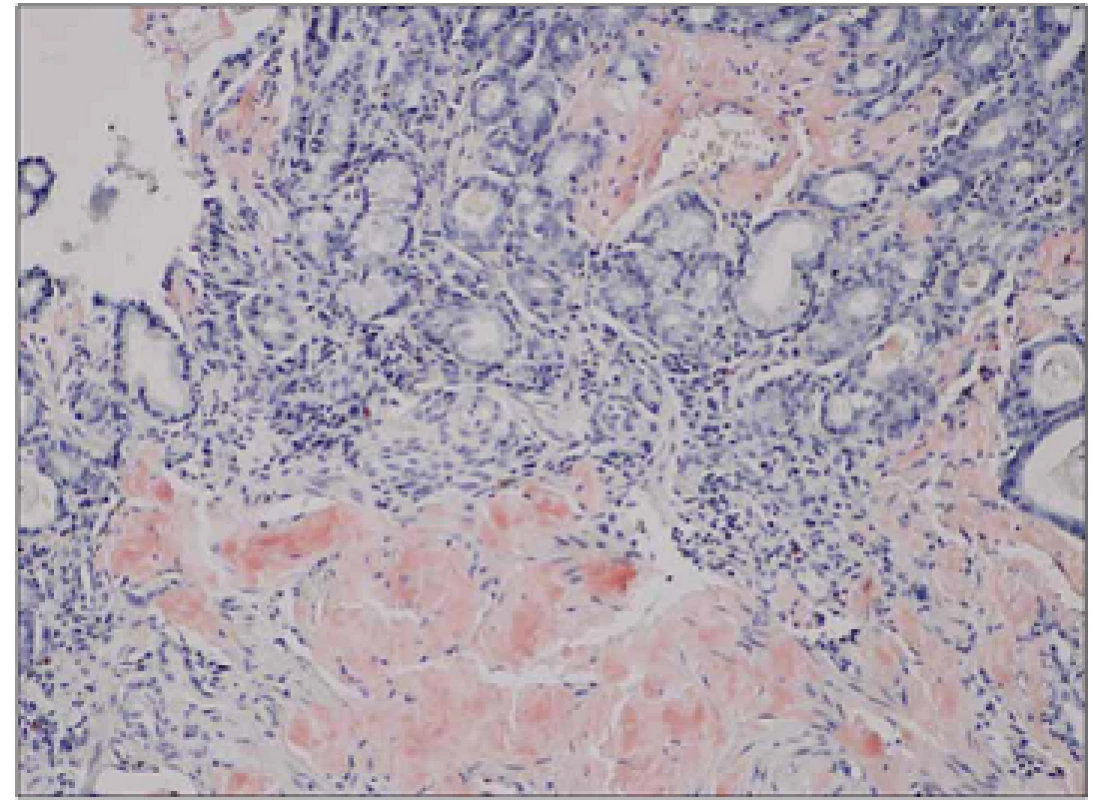
2. Biopsie žaludku, nepřímá imunohistochemie, protilátka proti transtyretinu, zvětšení 40x. 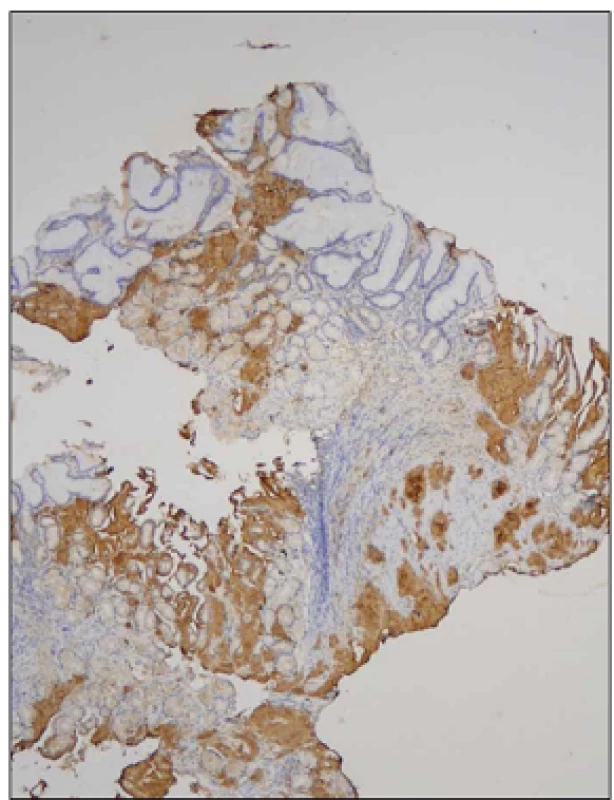
V imunohistochemickém vyšetření vykazují slizniční depozita amyloidu silnou pozitivitu v reakci s protilátkou proti transtyretinu. Diskuze
Transtyretin (prealbumin) je dominantně syntetizován v játrech, v menší míře pak v plexus choroideus v mozku a v retině, a plní funkci transportního proteinu pro řadu proteinů (tyroxin, retinol) [4 – 6]. Gen TTR kódující transtyretin se nachází 18. chromozomu. Mutace v genu vedou k destabilizaci tetramerů proteinu, který následně získává amyloidogenní potenciál [7]. V současnosti bylo identifikováno více než 130 mutací v genu TTR, s autozomálně dominantním typem dědičnosti. Nejčastější mutace je jednonukleotidová substituce na 30. pozici maturovaného proteinu způsobující záměnu valinu za metionin (p.Val30Met). Jednotlivé mutace se liší v penetraci a dále pak v klinických projevech, které jsou ovlivněny přítomností polymorfizmů či enviromentálními vlivy. Rovněž i prognóza nemocných je závislá na typu mutace a postižených orgánech [4,5,8].
Dominující klinický příznak TTR je pozvolna progredující axonálně‑demyelinizační typ senzomotorické periferní neuropatie, která je přítomna u ~ 90 % nemocných. Výše zmíněná nejčastější mutace p.Val30Met je podkladem pro familiární amyloidovou polyneuropatii I. typu (FAP). Výskyt FAP je vázán dominantně na endemické oblasti, nejčastěji Portugalska (jeden případ na 538 obyvatel), Švédska a Japonska [5]. Klinické příznaky se objevují po druhém deceniu života onemocnění, ale samotný věk klinické manifestace je variabilní. U nemocných v Portugalsku dochází ke klinické manifestaci choroby mezi 20. a 30. rokem s rychlou progresí, naopak u švédských nemocných jsou popisovány klinické projevy až mezi 60. a 70. rokem věku, ačkoliv obě populace nesou identickou mutaci. Tento fenotypový rozdíl je vysvětlován genetickými faktory a enviromentálními vlivy [4,8]. Pro onemocnění FAP je typická vzestupná progredující ztráta citlivosti nejprve dolních a posléze i horních končetin, syndrom karpálního tunelu, bolestivé dysestezie a svalová slabost s následnou atrofií. Postižení autonomního nervového systému je spojeno s ortostatickou hypotenzí, synkopami, impotencí či změnou motility gastrointestinálního traktu. Některá sdělení popisují i postižení centrálního nervového systému (CNS) ve formě leptomeningeální infiltrace vedoucí k ischemickým či krvácivým mozkovým příhodám nebo ataxii [3 – 5,9]. Srdeční postižení bývá pozorováno až u 60 % nemocných s rozvinutým onemocněním. Příznaky zahrnují městnavou srdeční slabost s dušností a otoky, časté jsou arytmie. Echokardiografie prokazuje koncentrickou hypertrofii s rozšířením mezikomorového septa, laboratorně bývá zachycena elevace hladin srdečních biomarkerů [10,11]. Onemocnění s mutacemi v genu TTR (p.Val122Ile, p.Gly47Val) vedoucí k dominantnímu srdečnímu postižení jsou označovány jako familiární amyloidové kardiomyopatie (FAC). Endemickou oblastí pro mutaci p.Val122Ile je oblast Střední Ameriky, vyskytuje se u 3,5 % Afroameričanů [4]. Postižení ledvin, tedy zvýšená proteinurie a/ nebo renální nedostatečnost jsou přítomny u ~ 1/ 3 nemocných a je rovněž závislé na typu příčinné mutace. Je popisována výraznější infiltrace amyloidními hmotami v renální dřeni. Afekce zažívacího traktu se vyskytuje přibližně u poloviny nemocných v době diagnózy onemocnění a závažnost příznaků se stupňuje s progresí choroby. Z klinických příznaků dominuje malabsorpce při infiltraci submukózy amyloidem či poruchách peristaltiky se střídáním průjmu a zácpy. Malnutrice je jedním s nepříznivých prognostických faktorů. Oční postižení zahrnuje zákaly sklivce a zvýšení nitroočního tlaku [5,6].
Mutace identifikovaná u našeho nemocného je velmi vzácná varianta mutace na pozici 30 vyskytující se u FAP. V literatuře byl nález této mutace popsán Jonesem et al v rodině německého původu, jejíž členové trpěli neuropatickými obtížemi a u kterých byla následně FAP nesoucí danou mutaci identifikována. Fenotypově se neliší od časté mutace Val30Met, otázkou však zůstává časnost nástupu projevů onemocnění, jež byla u našeho nemocného v poměrně brzkém věku. Vzhledem k ojedinělému nálezu této mutace je zatím světové písemnictví skoupé na detailnější klinický popis [12].
Samotná diagnostika onemocnění zahrnuje fyzikální vyšetření, detailní rodinnou anamnézu a komplexní neurologické vyšetření s EMG. U nemocných bez známé rodinné anamnézy TTR amyloidózy je potřebné provést histologickou verifikaci amyloidových mas s jejich důslednou typizací pomocí imunohistochemických či proteomických metod. Obvykle bývá prováděna biopsie surálního nervu (diferenciální diagnostika od CIDP) či biopsie z oblasti gastrointestinálního traktu. Doporučována je spolupráce s hematologem k vyloučení mnohem častější formy amyloidózy na podkladě depozice lehkých řetězců imunoglobulinu (AL amyloidóza), což je onemocnění patřící do skupiny plazmocelulárních dyskrazií [2,8]. Definitivní diagnóza je potvrzena sekvenací genu TTR s detekcí patogenní mutace (v České republice provádí Ústav dědičných metabolických poruch, VFN v Praze).
Transplantace jater představuje kauzální léčebnou modalitu, jelikož 95 % TTR je produkováno játry. Představuje standardní terapeutický postup u nemocných schopných OLT podstoupit. První transplantace byla provedena v roce 1990 ve Švédsku u nemocného nesoucího mutaci p.Val30Met. Doposud proběhlo více než 2 000 jaterních transplantací v 19 zemích. Pětileté přežití je uváděno u 82 % nemocných s p.Val30Met mutací, u non‑p.Val30Met je to 59 %. Kratší dlouhodobé přežití u non‑p.Val30Met je vysvětlováno ve vyšší míře pokračující depozicí amyloidu v myokardu po OLT [5,13]. OLT má jednoznačný efekt na neuropatické obtíže, u naprosté většiny nemocných dochází k zastavení progrese neuropatie, u řady pacientů spolu s řádnou podpůrnou a rehabilitační léčbou dochází i k postupné regresi obtíží. Uváděn je rovněž velmi příznivý efekt na nutriční stav nemocných. Naopak progrese depozice TTR v CNS a oku není OLT ovlivněna, jelikož syntéza TTR fyziologicky probíhá i v plexus choroideus a retině. OLT je zatížena celou řadou limitací. Mnoho nemocných není schopno vzhledem k věku, pokročilosti choroby a komorbiditám zákrok podstoupit. Otázkou je i dlouhodobá imunosuprese a možná srdeční progrese nemoci u non‑p.Val30Met variant. OLT by měla být provedena optimálně v časném stadiu onemocnění [5,8,13]. V případě familiární amyloidové kardiomyopatie lze uvažovat o duální transplantaci srdce a jater [13,14]. Vzhledem k tomu, že játra nemocného jsou krom produkce mutovaného TTR většinou plně funkční, je možné ve vybraných případech použít explantovaných jater pro tzv. domino transplantaci pro nemocné s terminálním jaterním postižením, avšak s rizikem pozdějšího rozvoje TTR amyloidózy u příjemce [8].
V současné době je pro léčbu časného stadia FAP registrován lék Vyndaqel (Tafamidis meglumine, 20 mg p.o. denně), jenž stabilizuje tetramery transtyretinu s narušením jeho disociace v monomery a další amyloidogenní složky. Výsledky studií potvrdily efekt na oddálení progrese neuropatických obtíží, zachování nutričního stavu a lepší kvalitu života oproti nemocným užívajícím placebo. Možné použití u jiných forem TTR amyloidózy je zatím předmětem klinických studií (FAC, wtTTR senilní, divoký typ amyloidózy) [5,8,14,15]. Léčba prokázala efekt i u našeho nemocného. Další preparát stabilizující tetramery transtyretinu je diflunisal, který je však stále ve fázi klinického testování. Mezi jiné testované léky patří léky narušující amyloidové fibrily (disruptory) [8,14,16]. Jako nejperspektivnější se jeví kombinace kyseliny tauroursodeoxycholové (TUDCA) s doxycyklinem, klinická studie fáze II nyní probíhá. Předběžné výsledky svědčí pro stabilizující efekt na neuropatické a kardiální postižení při dobré toleranci terapie [17]. Mezi další slibné látky náleží malé interferující RNA (siRNA (ALN ‑ TTR01, ALN ‑ TTR02)) či antisense oligonukleotidy (ISIS ‑ TTR), u kterých preklinické a klinické studie fáze I a II v současnosti probíhají [14,18,19]. Nedílnou součástí terapie je symptomatická léčba k ovlivnění symptomů, nutriční a rehabilitační péče. Multioborová medicínská spolupráce je nezbytná.
Závěr
FAP představuje v našich podmínkách neendemické oblasti raritní onemocnění. Vzhledem k podobnému klinickému obrazu může být zaměněna za jiné, častější klinické jednotky. V případě nejisté diagnózy a zejména rodinné anamnézy neuropatických obtíží je nutné myslet i na možnost FAP. Kauzální terapii představuje OLT, ve vybraných případech lze užít preparát tafamidis meglumine. Další léčebné modality jsou ve fázi klinického testování. Diagnostika a léčba onemocnění vyžaduje multidisciplinární přístup, jak dokresluje naše sdělení.
S podporou grantu NT 12451/ 5, NT 14400, MZ ČR – RVO VFN 64165.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 15. 9. 2015
Přijato do tisku: 15. 10. 2015
MUDr. Tomáš Pika, Ph.D.
Hemato-onkologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: tomas.pika@fnol.cz
Sources
1. Sipe JD, Benson MD, Buxbaum JN, Ikeda S, Merlini G, Saraiva MJ et al. Nomenclature 2014: amyloid fibril proteins and clinical classification of the amyloidosis. Amyloid 2014; 21(4): 221 – 224. doi: 10.3109/ 13506129.2014.964858.
2. Ščudla V, Adam Z, Hájek R, Krejčí M, Pika T, Maisnar Vet al. Diagnostika a léčba systémové AL amyloidózy: Doporučení vypracovaná Českou myelomovou skupinou (CMG) a myelomovou sekcí České hematologické společnosti ČLS JEP. Transfuze a hematologie dnes 2013; 19 (Suppl): 60.
3. Ryšavá R. Systémové amyloidózy a jejich léčba. Praha: Maxdorf 2013.
4. Zeldenrust SR. ATTR: diagnosis, prognosis and treatment. In: Gertz MA, Rajkumar SV (eds). Amyloidosis: diagnosis and treatment. New York: Humana Press 2010 : 191 – 204.
5. Sekijima Y. Recent progress in the understanding and treatment of transthyretin amyloidosis. J Clin Pharm Ther 2014; 39(3): 225 – 233. doi: 10.1111/ jcpt.12145.
6. Ueda M, Ando Y. Recent advances in transthyretin amyloidosis therapy. Transl Neurodegener 2014; 3 : 19. doi: 10.1186/ 2047 ‑ 9158 ‑ 3 ‑ 19.
7. Kufová Z, Ševčíková S, Hájek R. Detekce hereditárních amyloidóz. Klin Biochem Metab 2014; 22(2): 65 – 69.
8. Nuvolone M, Obici L, Merlini G. Transthyretin‑associated familial amyloid polyneuropathy – current and emerging therapies. Eur Neurol Rev 2012; 7(1): 14 – 21.
9. Laštovičková J. Hereditární amyloidóza s defektem transthyretinu a její neurologické projevy. Neurol Prax 2011; 12(2): 142 – 144.
10. Arbustini E, Merlini G. Early identification of transthyretin‑related hereditary cardiac amyloidosis. JACC Cardiovasc Imaging 2014; 7(5): 511 – 514. doi: 10.1016/ j.jcmg.2014.03.007.
11. Kristen AV, Scherer K, Buss S, Siepen F, Haufe S, Bauer R et al. Noninvasive risk stratification of patients with transthyretin amyloidosis. JACC Cardiovasc Imaging 2014; 7(5): 502 – 510. doi: 10.1016/ j.jcmg.2014.03.002.
12. Jones LA, Skara JC, Cohen AS, Harding JA, Milunsky A, Skinner M. Familial amyloidotic polyneuropathy: a new transthyretin position 30 mutation (alanine for valine) in family of German descent. Clinin Genet 1992; 41(2): 70 – 73.
13. Suhr OB, Herlenius G, Friman S, Ericzon BG. Liver transplantation for hereditary transthyretin amyloidosis. Liver Transpl 2000; 6(3): 263 – 267.
14. Barreiros AP, Otto G, Kahlen B, Teufel B, Galle PR. Familial amyloidosis: great progress for an orphan disease. J Hepatol 2015; 62 : 483 – 485. doi: 10.1016/ j.jhep.2014.09.008.
15. Coelho T, Maia LF, Martins da Silva A, Cruz MW, Plante ‑ Bordeneuve V, Lozeron P et al. Tafamidis for transthyretin familial amyloid polyneuropathy: a randomized, controlled trial. Neurology 2012; 79(8): 785 – 792. doi: 10.1212/ WNL.0b013e3182661eb1.
16. Berk JL, Suhr OB, Obici L, Sekijima Y, Zeldenrust SR, Yamashita T et al. Diflunisal trial consortium. Repurposing diflunisal for familial amyloid polyneuropathy: a randomized clinical trial. JAMA 2013; 310(24): 2658 – 2667. doi: 10.1001/ jama.2013.283815.
17. Obici L, Cortese A, Lozza A, Lucchetti J, Gobbi M, Palladini G et al. Doxycycline plus tauroursodeoxycholic acid for transthyretin amyloidosis: a phase II study. Amyloid 2012; 19 (Suppl 1): 34 – 36. doi: 10.3109/ 13506129.2012.678508.
18. Coelho T, Adams D, Silva A, Lozeron P, Hawkins PN, Mant T et al. Safety and efficacy of RNAi therapy for transthyretin amyloidosis. N Engl J Med 2013; 369(9): 819 – 829. doi: 10.1056/ NEJMoa1208760.
19. Adams D, Théaudin M, Cauquil C, Algalarrondo V, Slama M. FAP neuropathy and emerging treatments. Curr Neurol Neurosci Rep 2014; 14(3): 435. doi: 10.1007/ s11910 ‑ 013 ‑ 0435 ‑ 3.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 6-
All articles in this issue
- Orbital Tumors
- Overlapping of Neurodegenerative Dementias
- The Current View of Immunopathogenesis of Myasthenia Gravis
- Multiple Sclerosis, Infertility and its Treatment
- Delirium in Intensive Care Patients – a Prospective Study
- Heart Arrhythmias in Young Patients with Cryptogenic Ischemic Stroke
- European Society of Cardiology Congress
- Median Nerve Mobility before and after Carpal Tunnel Decompression
- Measuring Emotional Awareness – a Pilot Study of Psychometric Properties of the Czech Adaptation of the Levels of Emotional Awareness Scale
- Psychometric Properties of the Czech Version of Epworth Sleepiness Scale
- Our Experience with Surgical Treatment of Peripheral Nerve Tum
- Craniocervical Pneumatization Associated with Neurological Symptomatology – a Case Report
- Familiar Amyloid Polyneuropathy – a Case Report
- Early Rotation of Intrathecal Baclofen Pump – a Case Report
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Orbital Tumors
- European Society of Cardiology Congress
- Psychometric Properties of the Czech Version of Epworth Sleepiness Scale
- Familiar Amyloid Polyneuropathy – a Case Report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

