-
Medical journals
- Career
Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
Authors: R. Bartoš 1; P. Vachata 1; A. Hejčl 1; A. Zolal 1; A. Malucelli 1; T. Radovnický 1; M. Posltová 2; F. Cihlář 3; M. Derner 3; M. Sameš 1
Authors‘ workplace: Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Histopatologická laboratoř Biolab, Praha 2; Radiologické odd., Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 3
Published in: Cesk Slov Neurol N 2011; 74/107(3): 292-298
Category: Original Paper
Overview
Nízkostupňový hemisferální gliom WHO II je intrinsický nádor mladšího a středního věku s častou elokventní lokalizací a v některých případech i dlouhodobě příznivou prognózou. Současně je často velice obtížné mikrochirurgické odlišení tohoto typu nádoru od zdravé a eventuálně vysoce funkční mozkové tkáně. Během operace tedy vyvstává nutnost použití metod funkčního mapování. Tento článek hodnotí klinické výsledky 40 resekčních operací pro nízkostupňový gliom u 35 pacientů. Zabýváme se aspektem kompenzace epilepsie a návratu do předchozího zaměstnání. Radikalita resekce je zřejmě jedním z prognosticky příznivých faktorů, hodnotíme ji tedy pomocí počítačové semiautomatické volumetrie. V našem příspěvku k této tematice se také soustředíme na dosažitelnost smysluplné resekce ve vztahu k jednotlivým funkčním oblastem mozku.
Klíčová slova:
nízkostupňový gliom – epilepsie – radikalita resekce – volumetrie – funkční mapováníÚvod
V letech 2002–2009 jsme operovali 35 pacientů s diagnózou nízkostupňového gliomu WHO gradus (gr.) II. Tento soubor se liší od dříve námi publikovaného (1990–1999; 37 pacientů) zejména používáním metod funkčního mapování – elektrické kortikální a subkortikální stimulace, awake operace, použití kortikálního stimulačního gridu, funkční magnetické rezonance (fMR), traktografie (DTI) a elektrofyziologického monitoringu motorických evokovaných potenciálů (MEP). Vzhledem k trvajícím pochybnostem o smysluplnosti důrazu na včasnost a radikalitu operace chceme prezentovat naše výsledky se zaměřením na klinický stav pacientů po operaci, včetně frekvence epileptických záchvatů a návratu do zaměstnání. Tyto výsledky představujeme v kontextu s dosaženou radikalitou operací hodnocenou pomocí počítačové MR volumetrie. Domníváme se, že časný a aktivní postup je více než rovnocennou alternativou observace těchto pacientů. Je však důležité, že v poslední době se objevují zahraniční práce s poměrně konzistentními výsledky stran přežití a doby do progrese korelované k radikalitě výkonu, jež jsou založeny na velkých souborech pacientů a které aktivní postup jednoznačně podporují.
Materiál a metodika
V období osmi let jsme operovali 35 pacientů s diagnózou nízkostupňového gliomu WHO gr. II. U pěti z nich jsme v průběhu sledovaného období provedli pět reoperací pro recidivu bez jednoznačné malignizace nádoru. Celkem jsme tedy uskutečnili 40 operací pro nízkostupňový gliom u daného souboru pacientů. Mezi našimi pacienty bylo 12 žen a 23 mužů ve věku od 13 do 64 let, průměrný věk v době operace byl 35 let. Pravou hemisféru nádor postihoval v 18 případech, u 16 pacientů byl uložen vlevo a u jedné pacientky postihoval oba gyri cinguli. U pěti pacientů byl ve frontálním laloku, u devíti fronto-parietálně, u tří v centrální krajině, temporálně a meziotemporálně u dvou a parieto-okcipitálně u šesti. Insulu v kombinaci s frontálním či temporálním operkulem postihoval nádor u devíti pacientů, u jednoho se nacházel čistě insulárně a temporo-parieto-okcipitální oblast včetně gyrus angularis byla postižena u pěti pacientů. Vcelku jednotícím počátečním příznakem byl epileptický záchvat, s výjimkou dvou případů (6 %). U jedné pacientky byla iniciálním příznakem dlouhodobá bolest hlavy, u téže pacientky při recidivě nádoru došlo k subjektivnímu zhoršení psaní na počítači. U druhého pacienta byl nález gliomu incidentální při CT vyšetření mozku po středně těžkém kraniocerebrálním poranění. Epileptické záchvaty byly u čtyř pacientů pouze fokální, u šesti pacientů fokální, intermitentně se sekundární generalizací a u 22 pacientů pouze sekundárně generalizované. Osm z těchto pacientů bylo pro epilepsii dlouhodobě sledováno neurologem a opakovaně skenováno pomocí MR. Epileptologický výsledek jsme hodnotili podle Engelovy škály: Engel I – zcela bez záchvatů; Engel II – ojedinělé záchvaty; Engel III – signifikantní redukce záchvatů a Engel IV – bez zlepšení či naopak zhoršení [1].
Operace byla vedena snahou o maximální bezpečnou radikalitu. Vzhledem k časté lokalizaci tohoto typu nádoru v elokventních oblastech jsme u 32 operací – tedy v 80 % – mapovali a monitorovali motorické či řečové funkce. Pouze osm operací bylo prováděno bez elektrofyziologické kontroly. U sedmi operací byla fáze mapování a resekce provedena u spolupracujícího pacienta – „awake“. Během 17 operací jsme prováděli kortikální mapování motorických oblastí pomocí elektrické kortikální stimulace. Při sedmi operacích jsme mapovali řečové kortikální funkce, jedenkrát pomocí implantovaného kortikálního gridu, šestkrát pomocí Ojemannova stimulátoru, stejně tak jako ve všech případech mapování motorických oblastí. Metodiku techniky mapování pomocí Ojemannova kortikálního stimulátoru i operaci s využitím dočasné implantace 64svodového kortikálního gridu jsme popisovali v našich předchozích pracích. Během 10 operací jsme byli schopni pomocí kortikální stimulace lokalizovat motorickou kůru, v průběhu sedmi operací jsme motorickou odpověď pomocí kortikální stimulace nevyvolali. Obdobně během pěti operací jsme zaznamenali zástavu řeči, poruchu pojmenování či obtíže s tvorbou vět v návaznosti na kortikální stimulaci, v průběhu dvou operací jsme předpokládané řečové oblasti nelokalizovali. Kontinuální monitorování MEP jsme prováděli během osmi operací. Strategie operací byla vedena snahou o maximální bezpečnou radikalitu, neuronavigaci jsme k určení kortikálních hranic nádoru či hloubky resekce využívali při 33 operacích (83 %), prvních sedm operací nebylo navigováno. Dvě operace insulárních gliomů byly uskutečněny ve dvou dobách pro významné reziduum po první operaci.
Oligodendrogliální složka nádoru byla zastižena ve 29 vzorcích resekátů, o čistě fibrilární astrocytom se jednalo v 11 případech. V 10 případech histopatolog popsal potenciální přechod do gr. II–III, u 13 pacientů byl proliferační index Ki67 > 5 %. Po 10 operacích byla po konzultaci s onkologem a samozřejmě i pacientem indikována časná adjuvantní léčba (chemoterapie samotná či v kombinací s radioterapií), samozřejmě s rozpaky, které její indikace při primární diagnóze gliomu WHO gr. II přinášejí.
Po 31 operacích provedených po roce 2003 jsme objem resekované části nádoru retrospektivně objektivizovali pomocí semiautomatické počítačové volumetrie v T2 vážené MR. Jako radikální operaci hodnotíme resekci > 90 % T2 objemu nádoru, subtotální resekcí je nazýván výkon odstraňující 70–90 % nádoru a parciální resekcí odstranění < 70 % nádoru. Výsledek všech sedmi operací provedených v letech 2002–2003 a dvou operací po tomto období je bohužel hodnocen nevolumetricky, pouhým odhadem % velikosti rezidua na T2 vážené MR – v prvním období nebyly prováděny navigační sekvence MR s 3měsíčním odstupem po operaci, ve dvou případech po uvedeném období se jedná o technickou chybu sledování. Zajímavé je však srovnání výsledku hodnocení radikality operatérem pouhým odhadem procent resekované části nádoru dle T2 vážené MR s výsledkem počítačové volumetrie. Toto srovnání popisujeme po uvedených 31 operacích.
Výsledky
Klinický stav a komplikace
Chirurgické komplikace
Perioperační mortalita našeho souboru je nulová. Z chirurgických komplikací jsme jedenkrát zaznamenali nutnost časné revize pro intracerebrální hematom v postresekční dutině, jedenkrát jsme museli provést akutní operaci kvůli epidurálnímu krvácení. Jeden pacient po resekci nádoru v oblasti hippokampu měl inkompletní parézu nervus oculomotorius – ptózu víčka, která se do ambulantní kontroly po třech měsících po operaci zcela upravila. U dvou pacientů jsme museli později vyjmout kostní ploténku pro osteomyelitis a po zaléčení infekce provést akrylátovou kranioplastiku, u jednoho z nich dokonce bylo nutné při revizi odstranit subdurální empyém. Četnost chirurgických komplikací dosahuje tedy 12,5 %. Tyto, byť významné a nepříjemné komplikace nezpůsobily trvalou morbiditu.
Neurologická morbidita
Neurologickou morbiditu jsme hodnotili na základě pohovoru s pacientem a objektivního neurologického vyšetřením šesti měsíců po operaci. Devět pacientů udává zhoršení neurologického stavu oproti stavu před operací. Jedná se o lehkou expresivní fatickou poruchu u jednoho pacienta, u dvou o středně těžkou poruchu řeči, jeden pacient udává poruchu čití levé ruky s následkem poruchy jemné motoriky. Dva pacienti trpí dyskalkulií, která je v jednom případě kombinována s dyslexií. Další pacientka udává mírné zhoršení paměti a učení po reoperaci a radioterapii, byla však schopna dokončit postgraduální studium v ekonomickém oboru. Rodinní příslušníci dalších dvou pacientů udávají zhoršení krátkodobé paměti po operaci, u jednoho s občasným přeříkáváním. Pokud tedy zahrneme všech těchto devět pacientů do případů neurologické morbidity, bude činit 22,5 %. Je nutné poznamenat, že vzhledem k primární diagnóze mozkového nádoru všichni deficit akceptují a tolerují. Výraznější obtíže v běžném životě (Karnofsky Performance Scale skóre 80) udávají dva pacienti se středně těžkou fatickou poruchou (5 %).
Epilepsie
Po 35 operacích (ze 40, tedy v 88 %) pacienti hodnotili stav týkající se epileptických záchvatů jako uspokojivý (Engel I–II), šest z nich řadíme do skupiny Engel II, jelikož trpí fokálními záchvaty či ojedinělým (maximálně jednou ročně) záchvatem sekundárně generalizovaným. U jednoho z nich došlo po jednom roce opět k nárůstu četnosti sekundárně generalizovaných záchvatů (přesun do Engel III).
Po pěti operacích (13 %) nedošlo k signifikantní redukci záchvatů. Do této skupiny patří i starší pacient, původně dlouhodobě sledovaný pro epilepsii, která však byla po dva roky před operací dobře kompenzována. U něj došlo po parciální resekci ke zhoršení – během 21 měsíců prodělal čtyři sekundárně generalizované záchvaty, jedenkrát dokonce s přechodem do status epilepticus. U tohoto 64letého pacienta s oligodendrogliomem zpětně hodnotíme indikaci operace jako nesprávnou. Je zatížen i neurologickou morbiditou středně těžké poruchy řeči a museli jsme provést revizi pro osteomyelitis a subdurální empyém. Také tento pacient je však zcela soběstačný. Je velice zajímavé, že reakcí na intradurální zánětlivou komplikaci je úplná regrese rezidua nádoru, původně odstraněného pouze z 32 %.
Návrat do zaměstnání
Po 18 operacích (45 %) se pacienti navrátili k původnímu zaměstnání (např. ekonom, učitelka hudby, účetní, kuchař), dívka v době operace školou povinná nyní studuje střední odbornou školu. Můžeme tedy konstatovat, že po téměř polovině operací byli pacienti motivováni k návratu k původní pracovní činnosti. Dva již jsou starobními důchodci. Část pacientů zejména z rizikových provozů (např. automechanik) preferovala přijetí invalidního důchodu. Naopak nutno doznat, že v případě programátora s dyskalkulií a původní lokalizací nádoru v oblasti gyrus angularis tento deficit návratu do zaměstnání brání.
Hodnocení radikality
Hodnocení radikality odhadem neurochirurga posouzením snímků MR (40 operací)
Neurochirurg vždy hodnotil snímek MR v T2 vážení provedený se zhruba 3měsíčním odstupem od operace. Během 15 operací – včetně tří reoperací – bylo dle názoru operatéra dosaženo radikální resekce nádoru, jako subtotální resekci jsme hodnotili 12 operací – včetně jedné reoperace. Parciální resekci jsme dle našeho odhadu provedli 13krát, včetně jedné reoperace. Část infiltrovaného corpus callosum jsme resekovali během 10 operací. Úplné odstranění T2 abnormity na MR se nám podařilo u sedmi pacientů (20 %).
Hodnocení radikality pomocí semiautomatické počítačové MR volumetrie (31 operací)
Po 31 operacích jsme hodnotili výsledek přesněji volumetricky. Dosáhli jsme průměrné 79% radikality resekce, v rozmezí od 32 do 100 %. Odstranění více než 90 % nádoru se nám zdařilo u 10 pacientů (průměrná velikost rezidua 1,5 cm3), 70–90% radikality jsme dosáhli u 15 pacientů (průměrná velikost rezidua 13,3 cm3) a méně než 70 % nádoru jsme odstranili u šesti pacientů (průměrná velikost rezidua 49,8 cm3). Reziduum menší než 10 cm3 (pro lepší představu: krychle o straně 2,15 cm) mělo po operaci 13 pacientů, průměrný objem rezidua u takto radikální resekce byl 2,7 cm3. Úplného odstranění T2 abnormity na MR se nám podařilo dosáhnout u pěti pacientů (16 %).
Srovnání obou metod
Po těchto 31 operacích jsme měli možnost srovnat procentuální odhad resekce operatérem s přesnější volumetrickou metodou ve zmíněných třech skupinách radikality (> 90 %; 70–90 %; < 70 %). Ve 14 případech operatér adekvátně ohodnotil objem resekované tkáně, v 17 případech však byl jeho odhad chybný. V převážné většině ale docházelo k podcenění radikality výkonu, a to ve 12 případech. V pěti případech byla radikalita výkonu naopak přeceněna.
Histologická progrese a přežití
V pěti případech během období sledování od 5 do 99 měsíců (průměrná doba sledování 3 roky a 3 měsíce) došlo k malignizaci nádoru do gr. III či IV. Malignizaci jsme ve čtyřech případech verifikovali histologicky po reoperaci, v jednom případě dle MR progrese s výborným klinickým i grafickým efektem chemoterapie v režimu PCV (obr. 1). K histopatologické progresi došlo v průměru po 47 měsících (3 roky 11 měsíců) od první operace. Jedna pacientka byla mylně reoperována tři roky po první operaci pro radionekrózu, k malignizaci nádoru do anaplastického astrocytomu došlo v jejím případě po více než sedmi letech. Všichni pacienti, kromě jednoho, který v roce 2009 zemřel na bronchogenní karcinom, byli v dubnu 2010 naživu. Jeden pacient byl však již v období sledování v roce 2008 a 2010 operován pro multiformní glioblastom; jeho prognóza byla tedy velice špatná.
Image 1. 27letý pacient po subtotální resekci oligodendrogliomu gr. II gyrus frontalis superior, gyrus cinguli a corpus callosum vpravo v roce 2007, v roce 2009 grafická enhancující progrese v precentrálním gyru, léčen PCV s dobrou reakcí a grafickou i klinickou normalizací stavu. 
Diskuze
Obecně přijímanými prognostickými faktory doby přežití nízkostupňových gliomů jsou věk pacienta [2–5], vyšší Karnofsky Performance Scale skóre [6,7], epilepsie jako jediný příznak [5,8,9], histologická diagnóza oligodendrogliomu [2,10] či naopak přítomnost gemistocytární komponenty [11–13] a enhancement po podání kontrastní látky na MR [10]. Význam radikality operace zůstává nadále nejasný. Kritický přehled publikovaný skupinou Kelese et al v roce 2001 na podkladě do té doby dostupných retrospektivních studií konstatuje, že pozitivní názor pro radikalitu resekce jakožto určitého pozitivního faktoru pro dobu přežití spíše převažuje [2].
Rádi bychom však upozornili na články z posledních dvou let, jejichž závěry učiněné na velkých skupinách pacientů jsou poměrně kompaktní. První je práce z Heidelbergu [11], jež hodnotí efekt radikality resekce na dobu přežití u 130 pacientů (1985–2003). Radikalita resekce vzhledem k roku započetí studie není posuzována volumetricky. Jako totální je kvalifikována resekce ponechávající < 10 % hyperintenzity na T2 vážené MR. Výpočet byl hodnocen porovnáním maximálních průměrů nádoru před operací a po ní. Velice aktivní přístup dokazuje dosažení radikální resekce u 91 pacientů (70 % souboru). Devadesát šest pacientů bylo operováno pro recidivu. Tyto operace opět vykazují vysoké procento radikálních resekcí (53 %; 51 pacientů). U 33 % (43 pacientů) z celkového souboru došlo v průběhu sledování k malignizaci nádoru. Autoři bohužel neuvádějí klinický stav svých pacientů po operaci. Míru neurologického postižení lze pouze neurčitě odhadnout z konstatování hodnoty KPS < 80 % časně po operaci u 25 pacientů (19 %). Není však důvod předpokládat vyšší iatrogenní morbiditu u tohoto centra specializujícího se na mozkové nádory. Celková doba přežití byla příznivě ovlivněna > 90% resekcí nádoru, jak v univariantní, tak i v multivariantní analýze (p = 0,005). Naopak vliv radikality na dobu do progrese nedosáhl statisticky signifikantních hodnot. Studie však jako literárně první pozitivně hodnotí snahu o radikální reoperaci u nemalignizující recidivy – a to jak pro celkovou dobu přežití, tak i doby do další progrese. Dalším prognosticky příznivým faktorem multivarietní analýzy pro dobu přežití byla lokalizace nádoru ve frontálním laloku. Naopak nepříznivý vliv měla přítomnost > 50 % gemistocytů v gliomu. Další práce, na rozdíl od většiny studií zabývajících se především dobou přežití, hodnotí také aspekty recidivy a maligního zvratu a vychází ze souboru John Hopkins Hospital, Baltimore [10]. Čítá úctyhodných 191 pacientů operovaných v období 1996–2006, u kterých jsou kritéria pro radikální resekci nastavena velice přísně – jako radikální resekci klasifikují MR výsledek zcela bez FLAIR hyperintenzity. Mortalita velkého souboru je nulová, u devíti pacientů udávají autoři nový neurologický deficit, u tří z nich se jednalo o defekt perimetru, nový motorický či řečový deficit vznikl po operaci u šesti pacientů (3 %). Radikální resekce dosáhli u 69 pacientů, tedy v 36 %. Během doby sledování recidivoval nádor u 83 pacientů (43 %), u 44 (23 %) došlo k jeho malignizaci. Velikost nádoru > 3 cm byla nepříznivým faktorem, a to jak pro recidivu, tak i pro jeho přechod do vyššího grade. Histologická diagnóza oligodendrogliomu i fibrilárního astrocytomu vykazovala stejnou frekvenci recidiv, avšak druhý typ nádoru měl výrazně vyšší potenciál malignizovat. Radikální resekce snížila v univarietní analýze riziko malignizace 1,9krát; její efekt byl signifikantní i v multivariantní analýze. Navíc autoři zdůrazňují vyšší dosažitelnost radikální resekce u nádorů menších 3 cm, tedy logicky doporučují časnou indikaci operace. Stejně jako předchozí práce však radikální resekce neovlivnila dobu do recidivy nádoru. Poslední z recentních prací shrnuje zkušenosti s insulárními gliomy ze San Franciska (1997–2007) [14]. Zahrnuje gliomy gr. II–IV, pro účel tohoto sdělení jsme provedli analýzu podskupiny 70 nízkostupňových gliomů. Tato studie radikalitu resekce hodnotí již volumetricky, střední rozsah resekce byl 82 % (31–100 %). Práce zavádí klasifikační systém pro insulární gliomy dle autorů (Sanai et al). Insulární oblast rozdělují na zónu I–IV, zóna I (antero-superiorní) je nejpříhodnější pro radikalitu resekce, nejmenší úspěšnosti autoři dosahovali v zóně II (postero-superiorní). Morbiditu operací autoři nedělí mezi jednotlivé stupně malignity, tedy můžeme pouze konstatovat celkovou 6% trvalou neurologickou morbiditu u 104 pacientů v celém souboru. Po operaci došlo během střední doby sledování 4,2 roku k progresi u 20 (29 %) nízkostupňových gliomů, k malignizaci došlo u 18 pacientů, tedy na rozdíl od předchozích prací – u naprosté většiny. Jako důležitý se projevil vliv radikality resekce – po resekci ≥ 90 % objemu nádoru následovala 5letá doba bez recidivy u 88% pacientů, zatímco po parciální resekci (< 90%) nedošlo k recidivě v tomto období u 69 % pacientů. V případě, že se podařilo resekovat ≥ 90 % nádoru, žili po pěti letech všichni pacienti, v případě parciální resekce pouze 84 %.
Tyto nové publikace (byť zatížené podobnými potenciálními chybami jako práce předchozí), mají výhodu stejné metodiky přístupu k této diagnóze, vzniku v prakticky stejném období, zahrnutí vysokého počtu pacientů a již objektivnějšího hodnocení radikality.
Pokud srovnáme klinické výsledky nyní hodnoceného souboru s naší předchozí prací hodnotící skupinu 37 pacientů se stejnou diagnózou [8], je pravděpodobné, že funkční mapování snížilo následnou morbiditu a mortalitu. Soubor operovaný bez funkčního mapování v letech 1990–99 byl zatížen 11% těžkou neurologickou morbiditou (čtyři pacienti), dva z těchto pacientů v časném pooperačním období zemřeli (6 %). U současného souboru operovaného s pomocí navigace a funkčního monitoringu nedošlo ke komplikaci, která by způsobila úmrtí pacienta. Po operaci vznikla závažnější neurologická porucha u dvou pacientů (5 %). Jednalo se o fatickou poruchu u pacienta s nádorem perisylvijské oblasti dominantní hemisféry, která vznikla i přes dodržení hranice > 1 cm od míst s pozitivní odpovědí na kortikální stimulaci při testu pojmenování. Obecně komplexní mapování řečových funkcí považujeme za obtížnější než mapování funkcí motorických. Druhý pacient operovaný v celkové anestezii s negativní motorickou odpovědí během stimulace, který již před operací lehkou fatickou poruchou trpěl, měl nádor v oblasti horního frontálního gyru dominantní hemisféry. Domníváme se, že deficit vznikl na podkladě resekce suplementární motorické oblasti, k úplné úpravě ke stavu předoperačnímu však nedošlo. Naopak resekce infiltrované části corpus callosum, kterou jsme provedli během 10 operací (25 %) (obr. 2), ve shodě s literárními údaji nevedla k markantnímu funkčnímu deficitu [15]. Úplné odstranění nádoru se nám zdařilo u sedmi pacientů, ve volumetricky hodnoceném podsouboru udáváme pro zajímavost počet pacientů, u kterých bylo reziduum menší než 10 cm3. Tuto hranici používá Berger v jedné ze svých starších prací, v níž hodnotí soubor 54 pacientů – v případě 100% resekce (13 pacientů) nedošlo v průběhu 54měsíční střední doby sledování k recidivě nádoru u žádného z pacientů. V případě rezidua ≤ 10 cm3 (27 pacientů) nastala recidiva u 15 % pacientů, přičemž doba do progrese trvala průměrně 50 měsíců. V případě rezidua > 10 cm3 (13 pacientů) došlo k progresi u 46 % pacientů a doba do progrese byla signifikantně kratší – 30 měsíců [16]. Zajímavý je na našem souboru rozpor mezi volumetrickou analýzou a hodnocením MR snímků neurochirurgem s neschopností určit odhadem 30% a 10% rezidua nádoru. Z tohoto faktu opět vyvozujeme vhodnost objektivní semiautomatické volumetrie. Pokud srovnáme dosažitelnost radikality vzhledem k lokalizaci nádoru, vyšší radikality jsme dosahovali u nádorů uložených v neelokventně a v oblastech sousedících s motorickou kůrou (56 % radikálních, 38 % subtotálních resekcí a pouze 6 % parciálních resekcí) (obr. 3, 4), radikalita klesala v oblasti insuly a dominantní perisylvijské oblasti – operkulum a gyrus angularis (12 % radikálních, 53 % subtotálních a 35 % parciálních resekcí) (graf 1). Grafickou dokumentaci ke článku jsme však záměrně volili tak, aby vynikla rozdílnost průběhu onemocnění i u pacientů se stejným grade a lokalizací nádoru. I po snaze o maximální resekci dochází u některých pacientů s radiograficky difuzním procesem k časné progresi onemocnění.
Image 2. 46letá pacientka po parciální resekci oligodendrogliomu grade II v oblasti gyrus frontalis superior, gyrus cinguli a corpus callosum vpravo v roce 2006, v roce 2009 subtotální operace recidivy gr. II–III v oblasti gyrus cinguli, následovala onkologická léčba, v mezidobí pracovala i přes extenzivní resekci corpus callosum jako účetní. 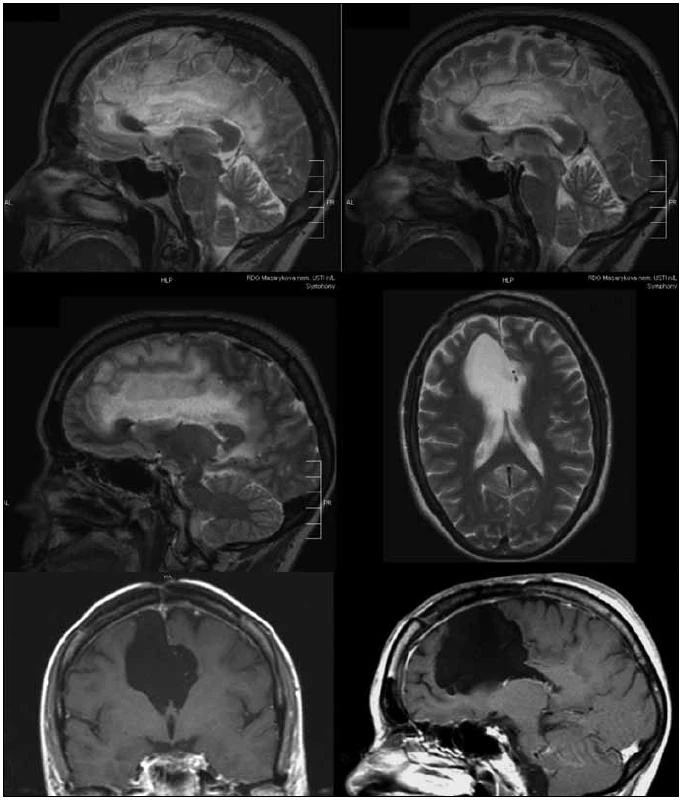
Image 3. 29letý pacient po radikální > 90% resekci oligodendrogliomu gr. II v oblasti gyrus postcentralis, lobulus parietalis superior a corpus callosum vpravo v roce 2006. 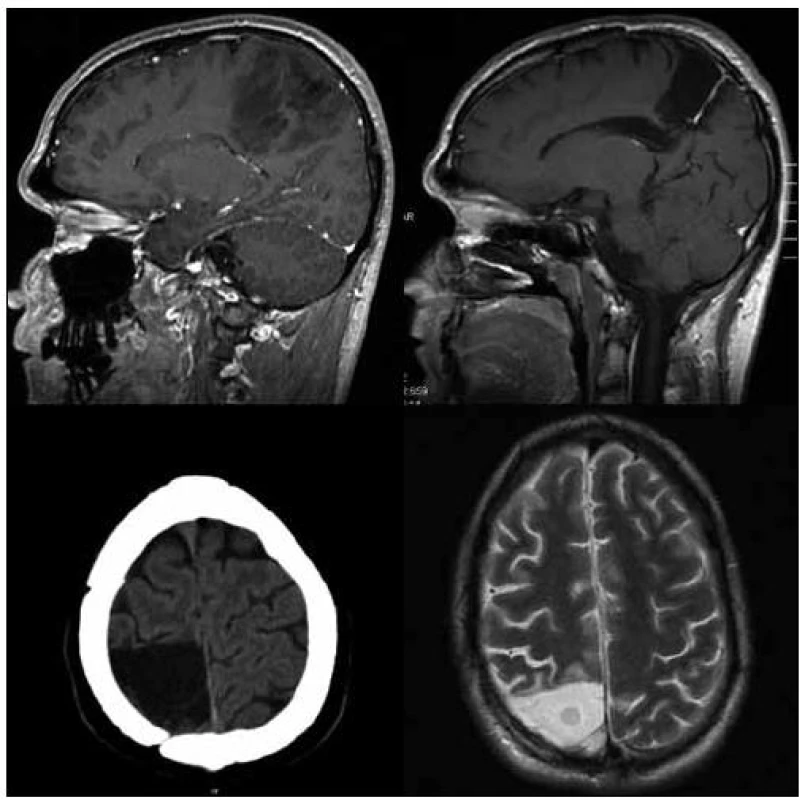
Image 4. 42letá pacientka po radikální > 90% resekci oligoastrocytomu gr. II v oblasti gyrus frontalis superior, gyrus cinguli a corpus callosum vlevo v roce 2007. 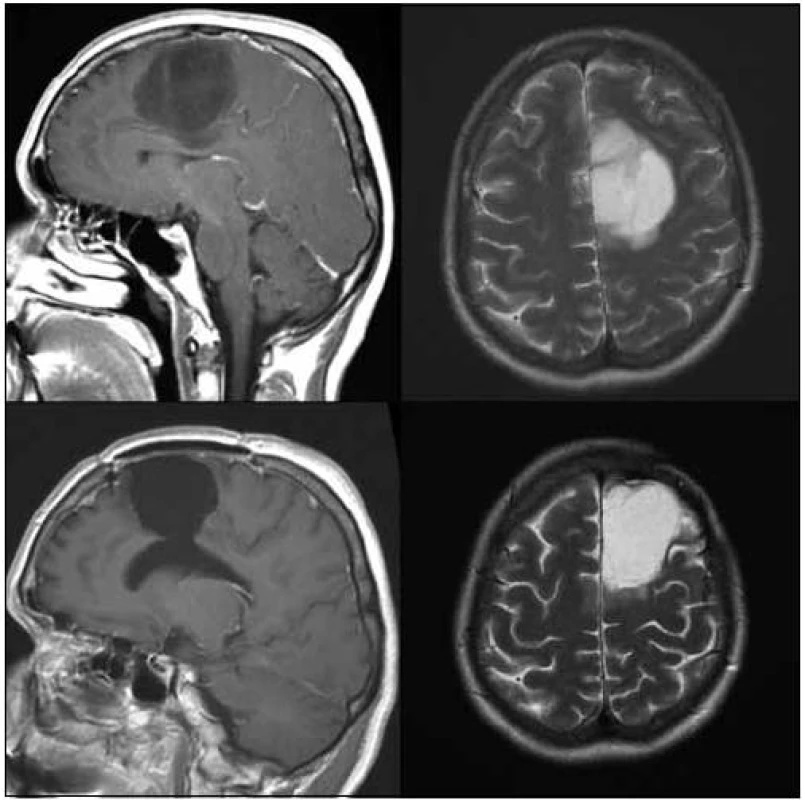
Graph 1. Vliv funkční lokalizace nádoru na dosažení radikality výkonu. RR: radikální resekce; STR: subtotální resekce; PR: parciální resekce 
Souvislost kompenzace epileptických záchvatů s dosaženou radikalitou výkonu není jistě zcela jednoznačná a je ovlivněna pokračující antiepileptickou léčbou u všech pacientů se záchvatem v anamnéze. Problémem hodnocení je také velice rozdílná doba od prvního záchvatu do operace. Ta se pohybuje mezi několika týdny a několika roky. Rozsáhlý soubor 332 pacientů [17] publikovala opět Bergerova skupina. Před operací trpělo záchvaty 81 % pacientů, 132 pacientů (49 %) mělo epilepsii nereagující na léčbu antiepileptiky. Kortikální léze oligodendrogliálního původu byly s epileptickými záchvaty spojeny častěji než astrocytomy. Autoři udávají výsledky po 12 měsících od operace, kdy 67 % pacientů bylo zcela bez záchvatu (Engel I), 17 % pacientů mělo zřídkavé záchvaty (Engel II), u 8 % pacientů došlo k signifikantnímu zlepšení (Engel III). Bez zmírnění záchvatů, či naopak jejich zhoršení nastalo u 9 % pacientů (Engel IV). Tedy po operaci bylo zcela bez záchvatu či došlo k zřetelnému zlepšení epilepsie u > 90 % pacientů, kratší doba anamnézy epilepsie a radikální resekce byly příznivými faktory dosažení kompenzace epilepsie. Zajímavý je však fakt, že 6 % pacientů, kteří před operací záchvaty netrpěli, po operaci nespadá do skupiny Engel I. Podobný případ jsme uvedli také v našem souboru. Ovšem celkově jsou i naše výsledky optimistické: do skupin Engel I–II spadá v našem souboru 88 % pacientů, u pěti pacientů hodnotíme výsledek z hlediska kompenzace epilepsie jako neuspokojivý (Engel IV). Zařazení do skupiny Engel III bylo v naší skupině obtížné a diskutabilní – do této skupiny jsme tedy nezařadili žádného pacienta. U 20 z našich pacientů, u nichž byla radikalita výkonu hodnocena volumetricky a současně mají epilepsii výborně kompenzovanou (Engel I), jednoznačně převažují radikální a subtotální resekce, pouze jedna resekce v této podskupině byla parciální. Minimální doba hodnocení je v našem případě šest měsíců. Osm našich pacientů (23 %) bylo před operací dlouhodobě sledováno a medikamentózně léčeno na specializovaném neurologickém pracovišti zabývajícím se léčbou epilepsie, šest z nich je nyní překvapivě zcela bez epileptických záchvatů, jeden pacient udává parestezie ruky opakující se zhruba týdně a jeden trpí přibližně 1krát měsíčně sekundárně generalizovaným záchvatem (Engel IV).
Závěr
Zavedení metod funkčního mapování, zejména elektrické kortikální a subkortikální stimulace (obr. 5) a monitoring motorických evokovaných potenciálů (MEP), jistě významně přispělo ke zvýšení bezpečnosti resekcí také nízkostupňových supratentoriálních gliomů WHO grade II. Resekce tohoto často elokventně lokalizovaného nádoru vyskytujícího se především u pacientů v mladším středním věku však s sebou dále ponese riziko vzniku pooperačního neurologického deficitu. I přes tento stresující faktor klademe důraz na radikalitu a v podskupině 31 volumetricky hodnocených resekcí jsme dosáhli průměrné 79% (32–100 %) cytoredukce na T2 vážené MR. U ostatních devíti nevolumetricky hodnocených resekcí jsou výsledky srovnatelné. Lze také konstatovat dosažitelnost > 90% radikality resekce u 40 % pacientů. Snáze lze radikální resekce dosáhnout u nádoru uloženého v pericentrální hemisferální oblasti, radikalita klesá v dominantní perisylvijské oblasti a v insule. U dvou z našich (5 %) pacientů vznikla po operaci středně těžká fatická porucha. Všichni pacienti po operaci zůstali soběstační, bez významného motorického deficitu. Téměř polovina pacientů se vrátila po operaci k původnímu zaměstnání, u 88 % pacientů došlo po operaci k významné redukci epileptických záchvatů.
Image 5. Traktografie pyramidové dráhy všech graficky dokumentovaných pacientů – pacienti popsaní v obr. 1 (vlevo nahoře), 2 (vpravo nahoře), 3 (vlevo dole) a 4 (vpravo dole). U všech byla peroperačně získána motorická odpověď při subkortikální stimulaci, po vystimulování dráhy jsme již daným směrem v resekci dále nepokračovali. U pacientky 2 je zdánlivá projekce dráhy do postresekční dutiny dána použitým 3D zobrazením. 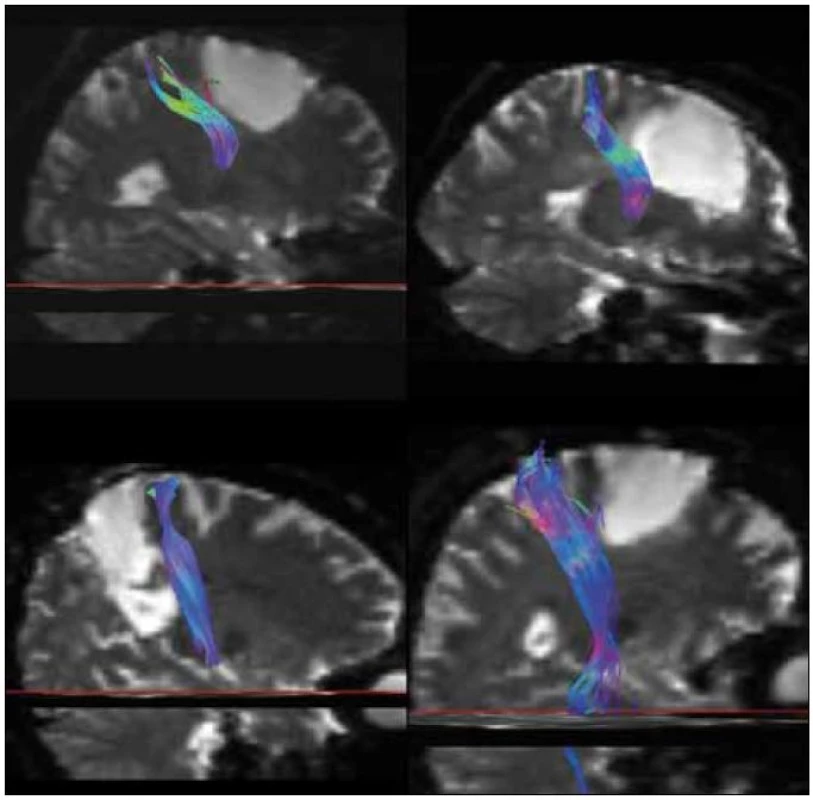
Po studiu nejnovějších zahraničních publikací týkajících se nízkostupňových gliomů se domníváme, že závěrem by neměla zaznít otázka – zda tyto nádory operovat, ale jak dosáhnout smysluplné, optimálně ≥ 90% radikality s přijatelnou neurologickou morbiditou.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika Univerzity J. E. Purkyně
Krajská zdravotní a.s., Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: robert.bartos@mnul.czPřijato k recenzi: 1. 10. 2010
Přijato do tisku: 15. 11. 2010
Sources
1. Engel J jr. Outcome with respect to epileptic seizures. In: Engel Engel J jr (ed). Surgical Treatment of the Epilepsies. New York: Raven Press 1987 : 553–571.
2. Keles GE, Lamborn KR, Berger MS. Low-grade hemisferic gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg 2001; 95(5): 735–745.
3. Scerrati M, Rosselli R, Iacoangeli M, Pompucci A, Rossi GF. Prognostic factors in low grade (WHO grade II) gliomas of the cerebral hemispheres: the role of surgery. J Neurol Neurosurg Psychiatry 1996; 61(3): 291–296.
4. Nicolato A, Gerosa MA, Fina P, Iuzzolino P, Giorgiutti F, Bricolo A. Prognostic factors in low-grade supratentorial astrocytomas: a uni-multivariate statistical analysis in 76 surgically treated adult patients. Surg Neurol 1995; 44(3): 208–223.
5. van Veelen MC, Avezaat CJ, Kros JM, van Putten W, Vecht C. Supratentorial low grade astrocytoma: prognostic factors, dediferentiation, and the issue of early versus late surgery. J Neurol Neurosurg Psychiatry 1998; 64(5): 581–587.
6. Laws ER, Taylor WF, Clifton MB, Okazaki H. Neurosurgical management of low-grade astrocytoma of the cerebral hemispheres. J Neurosurg 1984; 61(4): 665–673.
7. Piepmeier JM. Observations on the current treatment of low-grade astrocytic tumors of the cerebral hemispheres. J Neurosurg 1987; 67(2): 177–181.
8. Bartoš R, Sameš M, Julišová I, Derner M, Hladíková M. Supratentoriální gliom WHO grade II. Retrospektivní studie 37 pacientů. Cesk Slov Neurol N 2003; 66/99(5): 355–360.
9. Piepmeier J, Christopher S, Spencer D, Byrne T, Kim J, Knisel JP et al. Variations in the natural history and survival of patients with supratentorial low-grade astrocytomas. Neurosurgery 1996; 38(5): 872–879.
10. Chaichana KL, McGirt MJ, Laterra J, Olivi A, Quiñones-Hinojosa A. Recurrence and malignant degeneration after resection of adult hemispheric low-grade gliomas. J Neurosurg 2010; 112(1): 10–17.
11. Ahmadi R, Dictus C, Hartmann C, Zürn O, Edler L et al. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir 2009; 151 : 1359–1365.
12. Peraud A, Ansari H, Biste K, Reulen H. Clinical outcome of suprratentorial astrocytoma WHO grade II. Acta Neurochir (Wien) 1998; 140(12): 1213–1222.
13. Krouwer HG, Davis RL, Silver P, Prados M. Gemistocytic astrocytomas: A reappraisal. J Neurosurg 1991; 74(3): 339–406.
14. Sanai N, Polley MY, Berger M. Insular glioma resection: assessment of patient morbidity, survival, and tumor progression. J Neurosurg 2010; 112(1): 1–9.
15. Duffau H, Khalil I, Gatignol P, Denvil D, Capelle L. Surgical removal of corpus callosum infiltrated by low-grade glioma: functional outcome and oncological considerations. J Neurosurg 2004; 100(3): 431–437.
16. Berger MS, Deliganis AV, Dobbins J, Keles GE. The effect of extent of resection on recurrence in patients with low grade cerebral hemisphere gliomas. Cancer 1994; 74(6): 1784–1790.
17. Chang EF, Potts MB, Keles GE, Lamborn KR, Chang SM, Barbaro NM, Berger MS. Seizure charakteristics and control following resection in 332 patients with low-grade gliomas. J Neurosurg 2008; 108(2): 227–235.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2011 Issue 3-
All articles in this issue
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

