-
Medical journals
- Career
Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
Authors: D. Hořínek 1,4; B. Urbanová 2; D. Netuka 1; S. Ostrý 1; M. Vyhnálek 2; M. Mohapl 1; M. Bojar 2; F. Charvát 3; V. Beneš 1
Authors‘ workplace: Neurochirurgická klinika 1. LF UK a ÚVN Praha 1; Neurologická klinika dospělých 2. LF UK a FN v Motole, Praha 2; Radiodiagnostické oddělení ÚVN Praha 3; FN u sv. Anny, Mezinárodní centrum klinického výzkumu, Brno 4
Published in: Cesk Slov Neurol N 2011; 74/107(3): 254-259
Category: Review Article
Overview
Přehledný článek shrnuje literaturu zabývající se kognitivním postižením u stenózujícího onemocnění vnitřní krkavice (ACI), možnými příčinami tohoto postižení a vlivem intervenčních léčebných metod (karotická endarterektomie a endovaskulární stenting – CEA a CAS) na kognitivní funkce. Dosavadní studie jsou nesourodé jak ve výběru účastníků, ve výsledcích, tak i v metodice. Lze říci, že stenóza ACI představuje nezávislý rizikový faktor pro poškození kognitivních funkcí. Možné mechanizmy ovlivňující kognitivní funkce při stenózujícím onemocnění ACI jsou embolizace a hypoperfuze. V současnosti je testována hypotéza, že kognitivní dysfunkce je vázána spíše na porušenou hemodynamiku než na strukturální poškození embolizací. Výsledky multicentrické studie monitorující vliv intervencí na kognitivní funkce jsou rozporuplné. Současné poznatky nejsou dostatečné pro to, aby jakkoliv ovlivnily terapeutické indikace.
Klíčová slova:
onemocnění vnitřní krkavice – kognitivní porucha – stenting vnitřní karotidy – endarterektomie na krkavici – intrakraniální embolizace – hypoxie-ischemie mozkuÚvod
Od počáteční snahy diagnostikovat a léčit stenózující onemocnění vnitřní krkavice (ACI) se lékařská věda snaží stanovit vztah mezi stenózou ACI a postižením kognitivních funkcí. Kognitivní deficit není při klasickém neurologickém vyšetření tak zřejmý jako deficit ložiskový, kvalitu života však ovlivňuje stejnou nebo ještě větší měrou. Existují různé teorie původu vzniku kognitivního postižení u onemocnění ACI, názory na vliv léčebných výkonů na kognitivní dysfunkci jsou podobně protichůdné. Není známo, zda hodnocení kognitivních funkcí může sehrát roli při indikaci léčby onemocnění ACI.
Stenóza ACI se vyskytuje u 75 % mužů a u 62 % žen ve věku od 65 let, prevalence 50% a vyšší stenózy je v této populaci u 7 % mužů a 5 % žen [1]. Nemoci spojené s uzavíráním ACI jsou zodpovědné za 15 až 20 % všech ischemických centrálních mozkových příhod (CMP) [2]. Při běžném neurologickém vyšetření je většina stenóz ACI klasifikována jako asymptomatická, tzn. že pacientem nebo lékařem nebyly zaznamenány žádné ložiskové neurologické příznaky. Při klasifikaci, zda se jedná o asymptomatickou nebo symptomatickou stenózu, nejsou kognitivní funkce zohledněny.
CMP patří mezi uznávané příčiny demence [3,4], avšak samotná stenóza ACI jako rizikový faktor kognitivního postižení většinou vnímána není. Mechanizmy postižení kognitivních funkcí u pacientů s asymptomatickou stenózou ACI jsou málo známy.
V klasické neurologické terminologii je neurologickým deficitem míněna porucha motorických a senzorických funkcí. Postižení kognitivních funkcí však představuje neméně hodnotný korelát anatomického poškození CNS. Neurofyziologický pojem „vyšší nervová činnost“ může být z tohoto pohledu poněkud zavádějící. Termín „kognitivní deficit“ se vztahuje ke ztrátě jedné nebo více kognitivních funkcí, přičemž tyto funkce jsou spojeny stejně jako v případě motorického nebo senzorického deficitu s diferencovanými neuronálními sítěmi a funkčně anatomickými celky mozku. Díky moderní neuropsychologii jsou nám k dispozici sofistikované nástroje měření kognitivních funkcí. Neurologická diagnóza se tak zdokonaluje a umožňuje hlubší porozumění funkčnímu poškození, nemoci.
Kognitivní deficit u pacientů s onemocněním ACI může významně ovlivnit kvalitu života těchto nemocných, ať už vnímanou subjektivně nebo z hlediska rodiny či ošetřujícího personálu [5]. Pacienti s kognitivním deficitem jsou více postiženi funkčně a je u nich vyšší riziko závislosti na jiné osobě než u jedinců bez kognitivního postižení [6]. Bylo prokázáno, že u pacientů s kognitivním postižením je vyšší riziko následného rozvoje demence, institucionalizace a mortality [4,7].
Konvenční vaskulární rizikové faktory (hypertenze, diabetes, hyperlipidemie a kouření) jsou pro CMP, stenózu ACI a také pro demenci společné [1]. Jednou ze základních otázek je, zda onemocnění ACI představuje nezávislý rizikový faktor pro poškození kognitivních funkcí, nebo zda je stenóza ACI pouhým markerem intracerebrální nebo generalizované aterosklerózy. Potenciální mechanizmy pro vznik kognitivního deficitu u onemocnění krkavice představují embolizace a hypoperfuze.
Cíle práce
Cílem tohoto přehledného článku je seznámit čtenáře s poznatky, které současná literatura nabízí jako odpověď na následující otázky:
- Jaká je míra a možná etiologie kognitivního postižení u pacientů s asymptomatickým onemocněním ACI?
- Jaká je míra a možná etiologie kognitivního postižení u pacientů se symptomatickým onemocněním ACI?
- Jaký je vliv terapeutických intervencí při onemocnění ACI na vznik a povahu kognitivního postižení?
Kognitivní postižení u asymptomatické stenózy ACI
Existují dvě studie zabývající se kognitivním poškozením u asymptomatické stenózy ACI na velkých souborech. Johnston et al prováděli kognitivní měření v rámci Cardiovascular Health Study [8]. Ve studii bylo sledováno 4 006 praváků (mužů a žen ve věku ≥ 65 let), kteří neprodělali CMP (ani tranzitorní ischemickou ataku, TIA) a nepodstoupili karotickou endarterektomii (CEA). Stenóza ACI byla kvantifikována duplexní ultrasonografií, účastníkům byla též provedena magnetická rezonance (MR) mozku. Pro hodnocení kognice byla použita modifikovaná verze Mini-Mental State Examination. Soubor neuropsychologických testů byl v této studii primárně zaměřen na stanovení kognitivních funkcí v dominantní mozkové hemisféře. Bylo prokázáno, že vysoký stupeň (≥ 75%) stenózy levé ACI koreloval s poklesem kognitivních funkcí v průběhu dalšího sledování po dobu studie. Pro pravostrannou stenózu tato korelace vysledována nebyla. Hladina statistické významnosti výsledků byla zachována i po korekci na přítomnost pravostranné stenózy a vaskulárních rizikových faktorů. Studie ukázala, že kognitivní deficit tedy nemusí být v přímé souvislosti ani s cévními riziky, ani s generalizovanou aterosklerózou. Korelace stenózy levé ACI s kognitivním poškozením byla pozorována dokonce i u podskupiny, jež neměla známky mozkového infarktu na MR. Výsledky této velké studie silně podpořily hypotézu, že asymptomatická stenóza karotidy může být nezávislým rizikovým faktorem pro kognitivní poškození a další zhoršování kognitivních funkcí.
Mathiesen et al publikovali závěry ze studie Tromsø [9]. Hodnoceni byli opět pouze probandi bez prodělané CMP v anamnéze (189 subjektů, 201 členů kontrolní skupiny). Stenóza ACI byla měřena ultrasonograficky, účastníkům studie bylo provedeno MR mozku. U pacientů se stenózou ACI bylo prokázáno jedno - nebo oboustranné zúžení vyšší než 35 %. Střední věk ve studii byl průměrně 68 let. Kontrolní skupina byla spárována pohlavím a věkem a neměla známky postižení ACI patologickým procesem. Neuropsychologický výkon byl v obou souborech porovnán prostřednictvím podrobné baterie neuropsychologických testů. Skupina s onemocněním ACI dosáhla signifikantně nižších výkonů v několika kognitivních doménách. Vztah mezi kognitivními funkcemi a stenózou krkavice se opět ukázal být nezávislý na přítomnosti lézí na MR. V případě některých neuropsychologických testů byla prokázána přímá korelace mezi výsledkem testu a stupněm stenózy ACI.
Kognitivní postižení u symptomatické stenózy ACI
Z definice TIA vyplývá, že po ní nepřetrvávají žádné ložiskové neurologické příznaky. Ale i po měsících uplynulých od TIA byl u pacientů se stenózou nebo okluzí ACI prokázán lehký kognitivní deficit [10].
Kognitivními funkcemi po TIA u nemocných s onemocněním ACI se zabývalo na dvě desítky studií. Většina nalezla kognitivní deficit [11–13], některé práce však tento předpoklad nepotvrdily [14,15]. Jednotlivé studie se z hlediska výběrových kritérií, designu i neuropsychologických testů lišily. Srovnání studií, které prokázaly u nemocných zhoršení kognitivních funkcí, a studií, u nichž rozdíl oproti kontrolní skupině nalezen nebyl, neprokázalo žádné systematické rozdíly [11]. Většina z těchto prací však neuvádí relevantní faktory, jako přítomnost mozkového infarktu na CT nebo přítomnost hypoperfuze; je tudíž pravděpodobné, že rozdílné výsledky byly způsobeny nestejnorodostí vyšetřovaných souborů.
Bakker et al měřili kognitivní funkce u pacientů s okluzí ACI, kteří prodělali ipsilaterální TIA [16]. Do souboru byli zařazeni nemocní se symptomy vyskytnuvšími se v průběhu šesti měsíců před přijetím do studie. Střední doba mezi poslední ischemickou atakou, MR a neuropsychologickým vyšetřením byla průměrně 54 dnů. Okluze ACI a stupeň stenózy kontralaterální karotidy byly ověřeny na angiogramech. Pacienti byli do studie zařazeni bez ohledu na následnou indikaci CEA nebo extra-intrakraniálního (EC-IC) bypassu.
U 21 pacientů (54 %), ale jen čtyř členů kontrolní skupiny bylo (8 %) konstatováno postižení kognitivních funkcí. Kognitivní dysfunkce byla klasifikována jako mírná, pouze u pěti nemocných byl výkon v testech horší než tři standardní odchylky od průměru.
Studií zabývajících se kognitivními poruchami u pacientů se symptomatickým nebo asymptomatickým zúžením nebo okluzí ACI je málo. Chybí zejména práce, které by se zaměřily na detailní studium možné etiologie neuropsychologického deficitu.
Vliv endarterektomie a endovaskulárních výkonů na ACI na kognitivní funkce
Randomizované studie, které prokázaly nízkou morbiditu a mortalitu u pacientů podstupujících CEA, jsou všeobecně známy. Ve většině těchto studií bylo použito rutinní neurologické vyšetření k diagnostice ložiskového deficitu po CEA či endovaskulárním stentingu vnitřní krkavice (CAS). Podle některých údajů však může v důsledku CEA či CAS vzniknout kognitivní postižení až u čtvrtiny nemocných [17,18].
Vznik periprocedurálního kognitivního deficitu může být ovlivněn počtem embolů, které vstupují do mozkového oběhu během výkonu a také dominancí na straně intervence. Obdobně jako u stenózy ACI je třeba ve výsledném efektu na kognitivní funkce zohlednit celou řadu faktorů (načasování výkonu, věk, cévní rizika atd.).
Od roku 1990 bylo publikováno přes tři desítky prací týkajících se vlivu terapeutických intervencí na kognitivní funkce. Většina (25) se týká CEA, pouze čtyři CAS a jen tři srovnání CEA s CAS. Z celkového počtu se jich pouze 11 věnuje výhradně symptomatickým nebo asymptomatickým nemocným. Pouze tři z těchto studií uvádějí hodnocení kvality života po výkonu. Počet subjektů ve studiích se pohybuje mezi 22 a 189. Čtyři studie, které měřily kognitivní funkce po CAS, měly 10 až 100 účastníků (obr. 1, 2).
Image 1. První karotickou endarterektomii provedl Michael DeBakey v roce 1953 v Methodist Hospital v Houstonu (Texas). 
Image 2. První karotická endarterektomie provedená týmem autorů v roce 1982, angiografie před výkonem (a) a po něm (b). 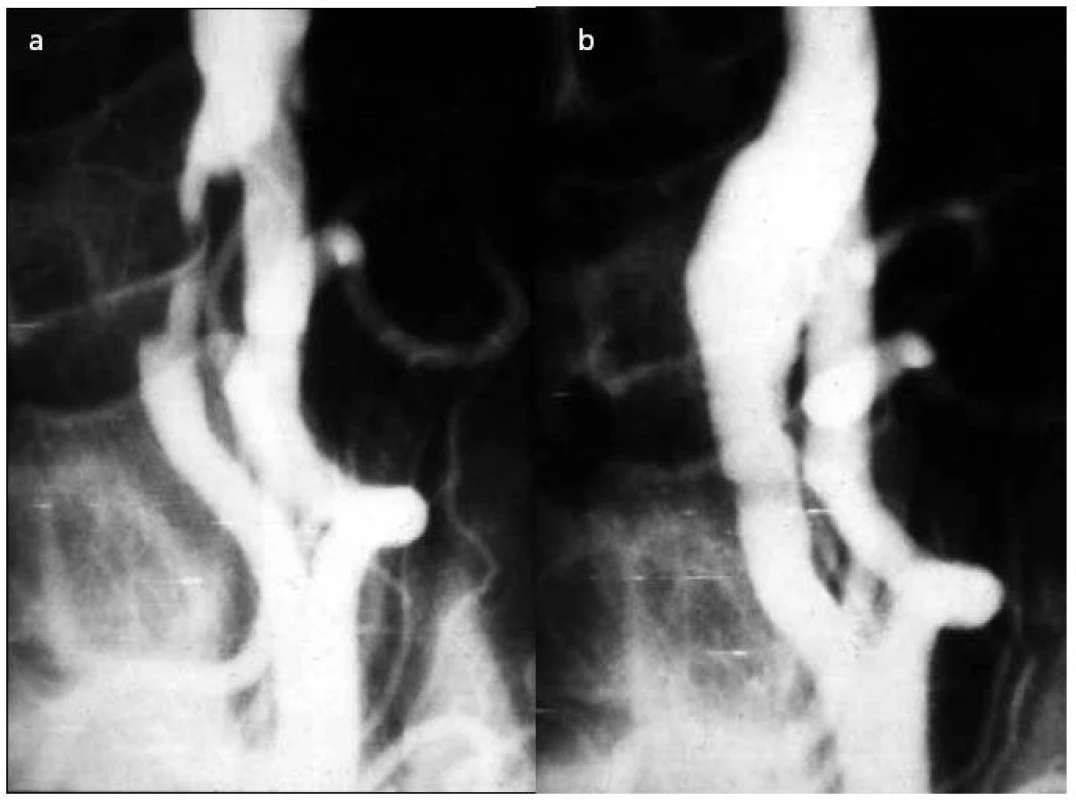
Po CEA nebyly nalezeny žádné významné změny v šesti studiích, v pěti bylo nalezeno zhoršení a ve čtyřech zlepšení kognitivních funkcí. Zbytek studií ukázal v jednotlivých kognitivních doménách nevyvážené výsledky [19].
Neuropsychologické testy byly prováděny též v rámci dvou multicentrických randomizovaných studií, srovnávajících CEA s endovaskulární léčbou: Carotid and Vertebral Transluminal Angioplasty Study (CAVATAS) [20,21] a Stent-Supported Percutaneous Angioplasty of the Carotid Artery versus Endarterectomy (SPACE) [22]. Ani v jedné studii nebyl používán protektivní filtr proti embolizaci (cerebral protection device, CPD). V žádném ze zmiňovaných srovnání nebyl prokázán signifikantní rozdíl v kognitivních funkcích mezi oběma sledovanými populacemi (CEA vs endovaskulární výkon) po proběhlé revaskularizaci. Nicméně vzhledem k tomu, že v rámci celé randomizované populace byl kognitivní deficit hodnocen u pouze malé podskupiny pacientů, mohly být soubory pro konečnou analýzu nevyvážené. U dvou skupin, které byly vyšetřeny v rámci CAVATAS, byla u všech zúčastněných použita angioplastika, zatímco ve studii SPACE byl systematicky prováděn stenting.
Ačkoliv byla zaznamenána vyšší embolizace při CAS, nebyl nalezen žádný vztah mezi embolizací (diagnostikovanou za pomoci transkraniálního ultrazvuku) a kognitivním postižením [20]. Nebyly též nalezeny rozdíly mezi hladinou proteinu S100β, markeru poškození glie, u nemocných podstupujících CAS v porovnání s těmi, kteří podstoupili CEA v rámci studie SPACE [22].
Celkem pět studií analyzovalo kognitivní dopad stentingu bez použití CPD [20,22–25]. Žádná z těchto prací s výjimkou jediné, která prokázala zlepšení, neodhalila jakékoliv změny v kognici po provedení CAS. U jiných dvou studií, kde CPD používán byl [26,27], konstatovali autoři zlepšení kognitivní funkce. Podle očekávání byl prokázán vliv mnohočetných faktorů (vzdělání, pohlaví, věk, symptomy, opakování kognitivních testů) na konečné výsledky [28].
Existuje pouze sedm studií, které se zabývaly účinkem CAS na kognitivní funkce, tři z nich ve srovnání s CEA [20,22–27]. Polovina autorů udávala zlepšení kognitivních funkcí, zejména v doméně paměti [26,27]; tyto závěry jsou v rozporu s výsledky některých starších studií, které referovaly o zhoršení kognitivních funkcí v důsledku embolizace [29,30], tato data se však týkala souborů nemocných po aortokoronárním bypassu.
Ovlivnění kognitivních funkcí revaskularizačním výkonem nelze na základě těchto malých studií s protichůdnými výsledky vyloučit, nelze však ani odhadnout povahu tohoto vlivu. Po léčebném výkonu na vnitřní krkavici je možné podle dosavadních pestrých výsledků očekávat obě možnosti: zlepšení i zhoršení kognitivních funkcí. Zlepšení kognitivních funkcí po CEA nebo CAS může být vysvětleno prevencí další embolizace do mozkového řečiště a také případným zlepšením hemodynamiky. Zhoršení může být dáno poklesem perfuzního tlaku během CEA nebo embolizací během CAS. Conolly et al nalezli korelaci mezi zhoršením kognitivních funkcí po CEA a vzestupem sérové hladiny proteinu S100β [31]. V jiné práci byla uvedena korelace mezi kognitivní dysfunkcí a dobou zasvorkování tepny během výkonu [32].
Rozporuplnost výsledků může být podmíněna i skutečností, že zlepšení kognitivních funkcí může být výraznější u nemocných trpících hypoperfuzí spíše než u pacientů s hemodynamicky nesignifikantními stenózami [33].
Skutečnost, že CAS s sebou nese zvýšené riziko mozkové embolie, je všeobecně akceptována. Pokles kognitivních funkcí byl prokázán u subklinické embolizace do mozku při jiných intervencích, jakými jsou katetrizace srdce a kardiochirurgické výkony [29,30]. U kardiochirurgického výkonu je však embolizační zátěž podstatně vyšší. Bylo prokázáno, že spontánní cerebrální emboly jsou signifikantně častější u pacientů s Alzheimerovou chorobou a vaskulární demencí než u kontrolní skupiny [34].
Hlavní argumenty proti embolizaci jako hlavnímu mechanizmu kognitivního poškození při stenóze ACI byly předloženy ve studiích Tromsø [9] a v Cardiovascular Health Study [8], které byly uvedeny ve stati o kognitivním postižení u asymptomatické stenózy ACI. V obou studiích se kognitivní poškození jevilo jako zcela nezávislé na přítomnosti vaskulárních lézí na MR.
Dosavadní literatura nepodává jasný důkaz o tom, že by byl CAS sdružen s větším kognitivním postižením než CEA. Neexistuje dosud přímé srovnání mezi CAS a CEA na velkých souborech. Ve třech studiích porovnávajících CAS a CEA [20,22,23] nebyly nalezeny rozdíly v kognitivním výkonu mezi oběma metodikami, přes vyšší počet embolizací u CAS [20].
Cerebrovaskulární reaktivita a vliv EC-IC bypassu
Cerebrovaskulární reaktivita (CVR) v reakci na inhalaci CO2 je citlivým měřítkem autoregulace a dostatečnosti kolaterálního oběhu. CVR bývá u pacientů se stenózou ACI narušena [35].
Efekt extra-intrakraniálního bypassu na kognitivní funkce je kontroverzní. Řada autorů udává po EC-IC bypassu zlepšení u pacientů se symptomatickým uzávěrem ACI [13,36], jiní tento efekt neprokázali [37,38]. Ve studii Sasoha et al 2003 byly kognitivní funkce po EC-IC bypassu zlepšeny, zlepšení korelovalo se zvýšeným regionálním mozkovým průtokem [39]. EC-IC bypass může vést ke znovuobnovení autoregulace mozkových cév, dostatečné množství přesvědčivých dat o pozitivním efektu EC-IC na kognitivní funkce však t.č. nemáme.
Silvestrini et al vyšetřili 102 praváků s levostrannou asymptomatickou (> 70%) stenózou ACI [40]. Pacienti se strukturálními lézemi na MR byli ze studie vyloučeni. V souboru byla vyšetřena také CVR. Nemocní s ipsilaterálním postižením CVR dosahovali horších výsledků v testech verbální paměti. Je možné, že u asymptomatické stenózy ACI je zapotřebí silného funkčního stimulu k detekci kognitivního deficitu, což v praxi znamená použití dostatečně náročných neuropsychologických testů. Jedná se o testy, které mají vysoce specifické nároky na neuronální síť, a tím i na regionální perfuzi. Důkaz zvýšeného regionálního průtoku při testování kognitivními testy nám v každodenní praxi podává funkční MR.
Skutečnost, že snížení kognitivního výkonu bylo zjištěno u osob se sníženou CVR, je v širším kontextu velmi významná. U naprosté většiny studií, které se zabývaly vztahem mezi onemocněním ACI a kognitivním deficitem, nebyla CVR zohledněna. CVR může být významným faktorem pro vysvětlení protichůdných závěrů studií, jež se zabývaly účinkem terapeutických intervencí na ACI na kognitivní funkce. Vzájemně si odporující údaje o neuropsychologickém zlepšení či zhoršení po CAS nebo CEA mohou pramenit z faktu, že hodnocené soubory byly heterogenní z hlediska hemodynamického účinku stenózy ACI. Články, které referovaly o kognitivním zlepšení u nemocných se symptomatickou stenózou ACI po CEA, ale jen u podskupiny se sníženou CVR, byly již publikovány [33,41].
Na datech Silvestriniho et al lze také ukázat, že neuropsychologický deficit a hemodynamické postižení lze vysledovat i u nemocných s asymptomatickou stenózou ACI, bez zjevného nálezu ischemie na MR a bez klinických příznaků cévního onemocnění [40]. I tento výsledek by svědčil spíše pro to, že kognitivní dysfunkce je svázána spíše s porušenou hemodynamikou než se strukturálním poškozením. Ve studii Bakkera et al byla provedena single voxel MR spektroskopie se stanovením koncentrace metabolitů v centrum semiovale [16]. V této studii byla prokázána zvýšená koncentrace laktátu v centrum semiovale u pacientů s okluzí karotidy po ipsilaterální TIA. Byl také prokázán signifikantní vztah mezi přítomností laktátu a sníženou CVR.
Studie zabývající se kognitivním deficitem u stenózy ACI, které do protokolu zahrnuly i vyšetření CVR, jsou sice nepočetné a na malém souboru pacientů, ale jejich design je podstatně komplexnější než u většiny zde citovaných prací. Mohlo by to být právě u nemocných s asymptomatickou stenózou ACI, kde by v budoucnu kognitivní vyšetření v kombinaci s vyšetřením CVR mohlo představovat potenciálně významný faktor při indikaci k terapeutickému výkonu.
Literatura nabízí o vztahu kognitivního postižení a mozkové hemodynamiky zatím jen velmi omezené množství informací. Podobné souvislosti však byly už popsány u příbuzných onemocnění. Například u nemocných s akutním iktem koreloval kognitivní deficit lépe s objemem tkáně s hypoperfuzí měřeným na perfuzní MR než s objemem infarktu měřeném v difuzně váženém obraze. Oproti tomu nebyl podán přesvědčivý důkaz o korelaci mezi kognitivním postižením a počtem lakunárních infarktů v bílé hmotě [42]. Z uvedeného se zdá, že důkazy, které dávají do souvislosti kognitivní deficit s poruchou regionální perfuze a postižením tkáňového metabolizmu, jsou přesvědčivější než ty, jež poruchy kognitivních funkcí vztahují ke strukturálním ischemickým lézím, způsobeným embolizací.
Závěr
Stenóza ACI je nezávislý rizikový faktor pro poškození kognitivních funkcí. Hlavní mechanizmy, které jsou považovány za nejpravděpodobnější příčinu vzniku kognitivního deficitu, jsou embolizace a hypoperfuze.
Z dosavadní literatury není jasné, zda léčebná intervence na krkavici dokáže kognitivní funkce zásadně změnit, ať už ve smyslu zlepšení nebo zhoršení. Podle výsledků dosavadních studií není významný rozdíl mezi CAS a CEA stran vlivu na kognitivní funkce po intervenci. Současná úroveň důkazu o kognitivním postižení u onemocnění vnitřní krkavice není dostatečná na to, aby měla vliv na indikace léčby.
MUDr. Daniel Hořínek, Ph.D.
Neurochirurgická klinika 1. LF UK a ÚVN
U Vojenské nemocnice 1200
160 00 Praha 6
e-mail: daniel.horinek@uvn.czPřijetí k recenzi: 13. 7. 2010
Přijetí do tisku: 22. 9. 2010Práce byla podpořena grantem MZ IGA NS/10331-3.
Sources
1. O’Leary DH, Polak JF, Kronmal RA, Kittner SJ, Bond MG, Wolfson SK jr et al. Distribution and correlates of sonographically detected carotid artery disease in the Cardiovascular Health Study. The CHS Collaborative Research Group. Stroke 1992; 23(12): 1752–1760.
2. Chaturvedi S, Bruno A, Feasby T, Holloway R, Benavente O, Cohen SN et al. Carotid endarterectomy – an evidence-based review: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2005; 65(6): 794–801.
3. Hachinski V, Munoz DG. Cerebrovascular pathology in Alzheimer’s disease: cause, effect or epiphenomenon? Ann NY Acad Sci 1997; 826 : 1–6.
4. Rockwood K, Wentzel C, Hachinski V, Hogan DB, MacKnight C, McDowell I. Prevalence and outcomes of vascular cognitive impairment. Vascular Cognitive Impairment Investigators of the Canadian Study of Health and Aging. Neurology 2000; 54(2): 447–451.
5. Sonková Z, Svátová K, Kemlink D, Kalina M, Sebesta P, Sonka K. Sleep apnea in carotid stenosis. Neuro Endocrinol Lett 2009; 30(1): 61–66.
6. Tatemichi TK, Desmond DW, Stern Y, Paik M, Sano M, Bagiella E. Cognitive impairment after stroke: frequency, patterns, and relationship to functional abilities. J Neurol Neurosurg Psychiatry 1994; 57(2): 202–207.
7. Desmond DW, Moroney JT, Sano M, Stern Y. Incidence of dementia after ischemic stroke. Stroke 2002; 33(9): 2254–2260.
8. Johnston SC, O‘Meara ES, Manolio TA, Lefkowitz D, O‘Leary DH, Goldstein S et al. Cognitive impairment and decline are associated with carotid artery disease in patients without clinically evident cerebrovascular disease. Ann Intern Med 2004; 140(4): 237–247.
9. Mathiesen EB, Waterloo K, Joakimsen O, Bakke SJ, Jacobsen EA, Banaa KH. Reduced neuropsychological test performance in asymptomatic carotid stenosis: The Tromsø Study. Neurology 2004; 62(5): 695–701.
10. Bakker FC, Klijn CJ, Jennekens-Schinkel A, van der Tweel I, Tulleken CA, Kappelle LJ. Cognitive impairment in patients with carotid artery occlusion and ipsilateral transient ischemic attacks. J Neurol 2003; 250(11): 1340–1347.
11. Bakker FC, Klijn CJ, Jennekens-Schinkel A, Kappelle LJ. Cognitive disorders in patients with occlusive disease of the carotid artery: a systematic review of the literature. J Neurol 2000; 247(9): 669–676.
12. Kelly MP, Kaszniak AW, Garron DC. Neurobehavioral impairment patterns in carotid disease and Alzheimer disease. Intern J Clin Neuropsychol 1986; 8(4): 163–169.
13. Younkin D, Hungerbuhler JP, O’Connor M, Goldberg H, Burke A, Kushner M et al. Superficial temporal middle cerebral artery anastomosis: effects on vascular, neurologic, and neuropsychological functions. Neurology 1985; 35(4): 462–469.
14. Iddon JL, Sahakian BJ, Kirkpatrick PJ. Uncomplicated carotid endarterectomy is not associated with neuropsychological impairment. Pharmacol Biochem Behav 1997; 56(4): 781–787.
15. van den Burg W, Saan RJ, Van Zomeren AH, Boontje AH, Haaxma R, Wichmann TE. Carotid endarterectomy: does it improve cognitive or motor functioning? Psychol Med 1985; 15(2): 341–346.
16. Bakker FC, Klijn CJ, Jennekens-Schinkel A, van der Tweel I, van der Grond J, van Huffelen AC et al. Cognitive impairment is related to cerebral lactate in patients with carotid artery occlusion and ipsilateral transient ischemic attacks. Stroke 2003; 34(6): 1419–1424.
17. Heyer EJ, Adams DC, Solomon RA, Todd GJ, Quest DO, McMahon DJ et al. Neuropsychometric changes in patients after carotid endarterectomy. Stroke 1998; 29(6): 1110–1115.
18. Heyer EJ, Sharma R, Rampersad A, Winfree CJ, Mack WJ, Solomon RA et al. A controlled prospective study of neuropsychological dysfunction following carotid endarterectomy. Arch Neurol 2002; 59)2): 217–222.
19. De Rango P, Caso V, Leys D, Paciaroni M, Lenti M, Cao P. The role of carotid artery stenting and carotid endarterectomy in cognitive performance: a systematic review. Stroke 2008; 39(11): 3116 – 3127.
20. Crawley F, Stygall J, Lunn S, Harrison M, Brown MM, Newman S. Comparison of microembolism detected by transcranial Doppler and neuropsychological sequelae of carotid surgery and percutaneous transluminal angioplasty. Stroke 2000; 31(6): 1329–1334.
21. Sivaguru A, Gaines PA, Beard J, Venables GS. Neuropsychological outcome after carotid angioplasty: a randomised control trial. J Neurol Neurosurg Psychiatry 1999; 66 (Suppl): 262.
22. Witt K, Borsch K, Daniels C, Walluscheck K, Alfke K, Jansen O et al. Neuropsychological consequences of endarterectomy and endovascular angioplasty with stent placement for treatment of symptomatic carotid stenosis. A prospective randomized study. J Neurol 2007; 254(11): 1524–1532.
23. Antonelli Incalzi R, Gemma A, Landi F, Pagano F, Capparella O, Snider F, Manni R, et al. Neuropsychologic effects of carotid endarterectomy. J Clin Exp Neuropsychol 1997; 19(6): 785–794.
24. Lehrner J, Willfort A, Milekush I, Guttmann G, Minar E, Ahmadi R et al. Neuropsychological outcome 6 months after unilateral carotid stenting. J Clin Exp Neuropsychol 2005; 27(7): 859–866.
25. Moftakhar R, Turk AS, Niemann DB, Hussain S, Rajpal S, Cook T et al. Effects of carotid or vertebrobasilar stent placement on cerebral perfusion and cognition. AJNR Am J Neuroradiol 2005; 26(7): 1772–1780.
26. Grunwald IQ, Supprian T, Politi M, Struffert T, Falkai P, Krick C et al. Cognitive changes after carotid artery stenting. Neuroradiology 2006; 48(5): 319–323.
27. Xu G, Liu X, Meyer JS, Yin Q, Zhang R. Cognitive performance after carotid angioplasty and stenting with brain protection devices. Neurol Res 2007; 29(3): 251–255.
28. Mocco J, Wilson DA, Komotar RJ, Zurica J, Mack WJ, Halazun HJ et al. Predictors of neurocognitive decline after carotid endarterectomy. Neurosurgery 2006; 58(5): 844–850.
29. Braekken SK, Reinvang I, Russell D, Brucher R, Svennevig JL. Association between intraoperative cerebral microembolic signals and postoperative neuropsychological deficit: comparison between patients with cardiac valve replacement and patients with coronary artery bypass grafting. J Neurol Neurosurg Psychiatry 1998; 65(4): 573–576.
30. Sylivris S, Levi C, Matalanis G, Rosalion A, Buxton BF, Mitchell A et al. Pattern and significance of cerebral microemboli during coronary artery bypass grafting. Ann Thorac Surg 1998; 66(5): 1674–1678.
31. Connolly ES jr, Winfree CJ, Rampersad A, Sharma R, Mack WJ, Mocco J et al. Serum S100B protein levels are correlated with subclinical neurocognitive declines after carotid endarterectomy. Neurosurgery 2001; 49(5): 1076–1082.
32. Heyer EJ, DeLaPaz R, Halazun HJ, Rampersad A, Sciacca R, Zurica J et al. Neuropsychological dysfunction in the absence of structural evidence for cerebral ischemia after uncomplicated carotid endarterectomy. Neurosurgery 2006; 58(3): 474–480.
33. Kishikawa K, Kamouchi M, Okada Y, Inoue T, Ibayashi S, Iida M. Effects of carotid endarterectomy on cerebral blood flow and neuropsychological test performance in patients with high-grade carotid stenosis. J Neurol Sci 2003; 213(1–2): 19–24.
34. Purandare N, Burns A, Daly KJ, Hardicre J, Morris J, Macfarlane G et al. Cerebral emboli as a potential cause of Alzheimer’s disease and vascular dementia: case–control study. BMJ 2006; 332(7550): 1119–1124.
35. Naylor AR, Merrick MV, Gillespie I, Sandercock PAG, Warlow CP, Cull RE et al. Prevalence of impaired cerebrovascular reserve in patients with symptomatic carotid artery disease. Br J Surg 1994; 81(1): 45–48.
36. Nielsen H, Hojer-Pedersen E, Gulliksen G, Haase J, Enevoldsen E. Reversible ischemic neurological deficit and minor strokes before and after EC/IC bypass surgery: a neuropsychological study. Acta Neurol Scand 1986; 73(6): 615–618.
37. Binder LM, Tanabe CT, Waller FT, Wooster NE. Behavioral effects of superficial temporal artery to middle cerebral artery bypass surgery: preliminary report. Neurology 1982; 32(4): 422–424.
38. Drinkwater JE, Thompson SK, Lumley JS. Cerebral function before and after extra-intracranial carotid bypass. J Neurol Neurosurg Psychiatry 1984; 47(9): 1041–1043.
39. Sasoh M, Ogasawara K, Kuroda K, Okuguchi T, Terasaki K, Yamadate K et al. Effects of EC-IC bypass surgery on cognitive impairment in patients with hemodynamic cerebral ischemia. Surg Neurol 2003; 59(6): 455–460.
40. Silvestrini M, Paolino I, Vernieri F, Pedone C, Baruffaldi R, Gobbi B et al. Cerebral hemodynamics and cognitive performance in patients with asymptomatic carotid stenosis. Neurology 2009; 72(12): 1062–1068.
41. Fearn SJ, Hutchinson S, Riding G, Hill-Wilson G, Wesnes K, McCollum CN. Carotid endarterectomy improves cognitive function in patients with exhausted cerebrovascular reserve. Eur J Vasc Endovasc Surg 2003; 26(5): 529–536.
42. Kwan LT, Reed BR, Eberling JL, Schuff N, Tanabe J, Norman D et al. Effects of subcortical cerebral infarction on cortical glucose metabolism and cognitive function. Arch Neurol 1999; 56(7): 809–814.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2011 Issue 3-
All articles in this issue
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

