-
Medical journals
- Career
Prevence cévních mozkových příhod léčbou hypolipidemiky
Authors: V. Soška
Authors‘ workplace: Oddělení klinické biochemie a II. interní klinika LF MU a FN u sv. Anny v Brně
Published in: Cesk Slov Neurol N 2010; 73/106(1): 20-25
Category: Review Article
Overview
Hypolipidemika, především statiny, jsou jedny ze základních léků pro primární i sekundární prevenci koronárních příhod. Tyto léky mají významnou úlohu i v prevenci ischemických cévních mozkových příhod (iCMP), i když snížení relativního rizika iCMP je při léčbě hypolipidemiky menší než při léčbě protidestičkovými léky nebo antihypertenzivy. Na základě výsledků intervenčních studií se v primární prevenci iCMP mohou uplatnit statiny, gemfibrozil a kyselina nikotinová. Tyto léky snižují riziko iCMP u nemocných s dyslipidemií a ischemickou chorobou srdeční, některé statiny (atorvastatin, rosuvastatin) také u osob bez kardiovaskulárních onemocnění s vysokým kardiovaskulárním rizikem, pokud mají vyšší než cílový LDL‑cholesterol. Jediným hypolipidemikem s prokázaným účinkem v sekundární prevenci iCMP je atorvastatin v dávce 80 mg. Při indikaci hypolipidemik v prevenci iCMP je třeba respektovat, jaký lék, v jaké dávce a v jaké populaci byl pro prevenci iCMP použit v klinických studiích.
Klíčová slova:
cholesterol – ischemická cévní mozková příhoda – statiny – fibráty – niacin – ezetimib – pryskyřiceÚvod
Hypercholesterolemie je jedním ze základních rizikových faktorů pro rozvoj kardiovaskulárních onemocnění (KVO). Vztah mezi hladinou cholesterolu (především cholesterolu neseného v lipoproteinech o nízké hustotě, LDL‑cholesterolu) a ischemickou chorobou srdeční (ICHS) prokázala řada epidemiologických studií [1] a z intervenčních studií s hypolipidemiky vyplývá, že snížení LDL‑cholesterolu (LDL‑C) o 1% sníží výskyt ICHS o 1–2% [2]. Méně jasná je závislost mezi cholesterolem a komplikacemi aterosklerózy v jiných lokalizacích, především ischemickou chorobou dolních končetin a ischemickými cévními mozkovými příhodami (iCMP). V případě cévních mozkových příhod (CMP) je často uváděn tzv. cholesterolový paradox: většina epidemiologických studií neprokázala závislost mezi hladinou cholesterolu a rizikem CMP [3–5], v intervenčních studiích však došlo k poklesu rizika iCMP při léčbě hypolipidemiky [2]. Vztah mezi cholesterolem a CMP neprokázala ani metaanalýza 45 prospektivních studií, ve kterých bylo sledováno po dobu 16 let přibližně 450 000 osob (to představuje asi 7,3 miliónu „pacient‑roků“) a u kterých došlo během doby sledování k přibližně 13 000 CMP [6]. Tato kohorta osob ale byla vytvořena především ke studiu rizika ICHS a navíc v ní nebyly rozlišovány ischemické a hemoragické CMP. Některé studie však vztah hypercholesterolemie a CMP prokázaly, tyto studie ale rozlišovaly mezi jednotlivými podtypy CMP. Např. Kodaňská prospektivní studie prokázala pozitivní korelaci mezi zvýšením celkového cholesterolu nad 8 mmol/l a rizikem iCMP [7]. Také studie MRFIT (The Multiple Risk Factor Intervention Trial) prokázala, že se zvyšující se hladinou cholesterolu se zvyšuje riziko úmrtí na iCMP [8]. Byla nalezena také souvislost mezi rozsahem aterosklerózy v cerebrálním řečišti a hladinou krevních lipidů [9]. Heterogenita CMP a nedostatky v jejich klasifikaci podle jejich příčin je proto pravděpodobně hlavní příčinou toho, že vztah hypercholesterolemie a CMP byl ve většině epidemiologických studií či jejich metaanalýzách jen obtížně prokazatelný.
Hypolipidemika a CMP
V současné době jsou registrovány následující skupiny hypolipidemik: statiny, fibráty, pryskyřice, kyselina nikotinová, ezetimib. Jejich účinek na krevní lipidy je uveden v tab. 1. Ke snížení LDL‑C jsou lékem první volby statiny, léky druhé volby pryskyřice a ezetimib; fibráty jsou indikovány především ke snížení hladiny triglyceridů a zvýšení HDL‑cholesterolu (HDL‑C) [10]. Kyselina nikotinová, která zatím na našem trhu stále chybí, má účinek jak na snížení LDL‑C, tak i na snížení triglyceridů a zvýšení HDL‑C. Prakticky všechny studie s hypolipidemiky byly koncipovány s cílem snížit riziko koronárních, nikoliv cerebrovaskulárních příhod. Většina z nich byla provedena u pacientů s manifestní ICHS a menší část u osob bez ICHS, pacienti po CMP do většiny z nich nebyli zařazeni. Část z těchto studií však byla úspěšná i z hlediska primární prevence iCMP (viz dále). Jediná intervenční studie s hypolipidemiky s cílem sekundární prevence CMP byla studie SPARCL [11].
Table 1. Účinek hypolipidemik na krevní lipidy. 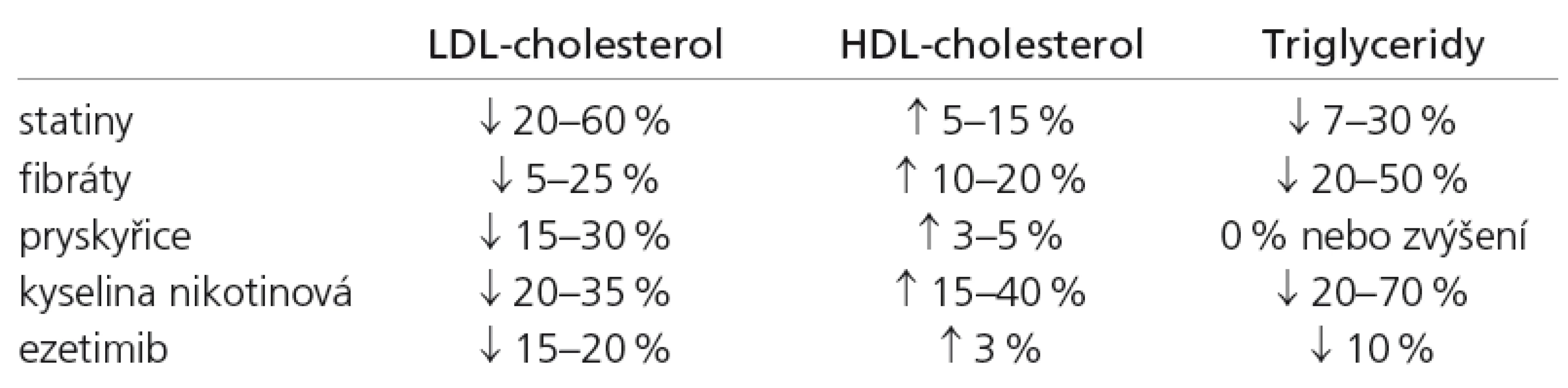
1. Fibráty a prevence CMP
Intervenčních studií s fibráty zaměřených na kardiovaskulární příhody jako hlavní klinické cíle je málo, žádná z nich nebyla primárně cílena na ovlivnění rizika CMP. Přehled těchto studií s fibráty je v tab. 2.
Table 2. Intervenční studie s fibráty cílené na redukci kardiovaskulárních příhod. 
Význam ovlivnění HDL‑C ve vztahu k riziku CMP prokázala studie VA-HIT (Veteran Affair – HDL Cholesterol Intervention Trial), ve které byli muži s ICHS s normální hladinou cholesterolu i triglyceridů, ale s nízkým HDL‑C, léčeni gemfibrozilem 1 200mg/den. Hladina LDL‑C se nezměnila, zvýšil se HDL‑C a výskyt CMP se snížil o 31% ve srovnání s placebem. Výskyt tranzitorních ischemických atak (TIA) se snížil dokonce o 59%, pokles rizika byl statisticky významný [12]. Význam HDL‑C v predikci rizika CMP prokázala i metaanalýza 61 prospektivních studií, publikovaná v roce 2007, a poměr celkový cholesterol/HDL‑C je zřejmě mnohem lepším ukazatelem rizika CMP než LDL‑C [6,13]. Vliv léčby fenofibrátem na riziko kardiovaskulárních příhod včetně CMP u diabetiků 2. typu s hraničními hodnotami krevních lipidů byl sledován ve studii FIELD (Fenofibrate Intervention and Event Lowering in Diabetes). V průběhu sledování nastalo 175 CMP (158 ischemických) v placebové větvi a 158 CMP (144 ischemických) ve větvi léčené fenofibrátem; rozdíl mezi oběma větvemi ale nenabyl statistické významnosti (p = 0,36 pro všechny CMP; p = 0,43 pro iCMP) [14]. Soubor diabetiků neměl na vstupu snížený HDL‑C a léčba fenofibrátem nevedla k vzestupu HDL‑C. Lze tedy spekulovat, že právě toto mohl být důvod, proč nedošlo k signifikantní redukci iCMP, jako tomu bylo ve studii VA-HIT s gemfibrozilem. V dalších fibrátových studiích – HHS (Helsinky Heart Study) a BIP (Bezafibrate Intervention Study) – nebyl výskyt CMP cílem těchto studií a CMP nebyly sledovány. S výjimkou gemfibrozinu, který ale již není na našem trhu, tedy chybí důkazy pro použití fibrátů k prevenci iCMP.
2. Kyselina nikotinová (niacin) a prevence CMP
Jde o velmi účinné, ale hůře tolerované hypolipidemikum. Důkaz o možnosti ovlivnění rizika CMP niacinem přinesly výsledky intervenční studie CDP (Coronary Drug Project), ve které byl niacinem v dávce 3g/den léčen soubor mužů s dyslipidemií a ICHS (po infarktu myokardu). Léčba vedla k poklesu výskytu ICHS, celkové mortality a riziko CMP se snížilo o 19% (rozdíl byl statisticky významný) [15]. Během léčby niacinem se významně zvýšila hladina HDL‑C a snížení rizika CMP je dáváno do souvislosti právě s touto skutečností, což znovu potvrzuje význam HDL‑C v ovlivnění rizika CMP. Kyselina nikotinová je tedy účinná v primární prevenci CMP u mužů s ICHS, podobně jako gemfibrozil. Stejně jako gemfibrozil však tento lék není na našem trhu k dispozici, i když v současné době již probíhá registrace kombinovaného preparátu niacinu s laropiprantem (laropiprant je látka omezující výskyt hlavních nežádoucích účinků niacinu, především „flush“).
3. Pryskyřice (inhibitory resorpce žlučových kyselin) a prevence CMP
Tyto léky jsou účinné a bezpečné pro snížení LDL‑C, kvůli jejich špatné toleranci (především dyspeptické obtíže) však jsou používány jen minimálně. Pro jejich využití v prevenci CMP chybí důkazy z klinických studií. V prakticky jediné velké intervenční studii s pryskyřicemi zaměřené na kardiovaskulární příhody – studii LRC‑CPPT (Lipid Research Clinics’ Coronary Primary Prevention Trial) – vedla léčba cholestyraminem k signifikantnímu poklesu výskytu ICHS a úmrtí na ICHS, výskyt CMP však v této studii nebyl sledován [16].
4. Statiny a prevence CMP
Statiny jsou v současné době základními hypolipidemiky, která blokují syntézu cholesterolu v hepatocytech. Snižují významně výskyt koronárních příhod, především u nemocných s ICHS. Intervenční studie prokázaly, že při léčbě statiny se může snižovat i riziko iCMP [17]. Vliv statinů na riziko CMP se lišil podle druhu statinu, podle použité dávky a podle toho, jaký soubor osob byl v konkrétní studii statiny léčen. Z hlediska jejich účinku v prevenci CMP je nutné rozlišovat zvláště mezi jejich použitím u osob bez manifestní ICHS a u nemocných s ICHS.
- a) Statiny a riziko CMP u osob bez kardiovaskulárních onemocnění
První statinové studie u pacientů s hypercholesterolemií bez KVO (WOSCOPS, AFCAPS/TEXCAPS, KLIS) neprokázaly vliv léčby na snížení rizika CMP [18–20]. Teprve studie CARDS (Collaborative Atorvastatin Diabetes Study) u nemocných s diabetes mellitus a nejnověji pak i studie JUPITER (The Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin) prokázaly, že statiny mohou snižovat riziko první CMP u osob bez manifestních KVO. Výsledky statinových studií u osob bez ICHS z hlediska jejich vlivu na riziko CMP jsou v tab. 3.
Table 3. Statinové studie u pacientů bez ICHS – vliv na incidenci ischemických CMP. 
Ve studii CARDS byli nemocní s diabetem mellitem nad 40 let věku a s hypercholesterolemií (bez ICHS) léčeni atorvastatinem 10mg (oproti placebu) po dobu čtyř let. Léčba vedla ke snížení relativního rizika CMP o 48% (riziko koronárních příhod se snížilo relativně o 36%) [21]. Ještě přesvědčivější jsou výsledky studie JUPITER, ve které byli muži nad 50 a ženy nad 60 let věku bez KVO, ale se zvýšeným kardiovaskulárním rizikem a s mírným zvýšením LDL‑C a CRP léčeni 20mg rosuvastatinu. Léčba vedla ke snížení relativního rizika CMP o 48%, přitom nedošlo k vzestupu rizika hemoragických CMP [22]. Z uvedených studií se statiny došlo k poklesu rizika iCMP pouze v těch, ve kterých byly použity nejúčinnější statiny (atorvastatin, rosuvastatin), které snižují LDL‑C o 30–50%. Navíc ve studii JUPITER měl zařazený soubor zvýšený CRP, který je rizikovým faktorem u aterotrombotických CMP a stenotického postižení karotid [23–25]. Ve studiích s méně účinnými statiny (lovastatin a pravastatin) léčba výskyt CMP neovlivnila [18–20]. U dalších statinů (simvastatin, fluvastatinu) nejsou k dispozici intervenční studie u osoby bez ICHS, které by měly za cíl redukci CMP.
- b) Statiny a riziko CMP u smíšené populace (osoby s KVO i bez KVO)
Patří sem čtyři statinové studie, do kterých byly zařazeny osoby v primární i v sekundární prevenci KVO uvedené v tab. 4. Ke snížení rizika CMP došlo pouze ve studii ASCOT (The Anglo‑Scandinavian Cardiac Outcomes Trial), ve které byla kritériem pro vstup hypertenze a nepřítomnost ICHS, zařazováni ale byli i nemocní s jinými manifestacemi aterosklerózy: 9,5% po CMP, 5% s ischemickou chorobou dolních končetin a 4% s jinou manifestací aterosklerózy. Šlo o vysoce rizikové osoby (kromě hypertenze byla podmínkou přítomnost nejméně třech další rizikových faktorů ICHS), byl zvýšený LDL‑C. Léčba atorvastatinem 10mg snížila riziko CMP o 27% (riziko ICHS kleslo o 36%, z léčby neprofitovaly ženy), podskupina nemocných zařazených po CMP však nebyla samostatně hodnocena [26]. Neúspěšná byla druhá studie s atorvastatinem – ASPEN (The Atorvastatin Study for Prevention of Coronary Heart Disease Endpoints in Non‑Insulin‑Dependent Diabetes Mellitus), ve které byli nemocní s diabetem a mírnou hypercholesterolemií léčeni 10mg atorvastatinu [27]. Léčba nevedla ke snížení rizika ICHS ani CMP. Ani ve dvou studiích se 40mg pravastatinu nevedla léčba ke snížení rizika CMP: studie ALLHAT u osob se zvýšeným LDL‑C bez ohledu na přítomnost či nepřítomnost ICHS a studie PROSPER u osob ve vyšším věku 70–82 let se zvýšeným LDL‑C [28,29].
Table 4. Statinové studie u smíšené populace (osoby bez KVO i s KVO) – vliv na incidenci ischemických CMP. 
- c) Statiny a riziko CMP u pacientů s ICHS
Vliv léčby statiny na redukci CMP u nemocných s ICHS je poměrně konzistentní, a to prakticky bez ohledu na druh použitého statinu. K dispozici jsou výsledky řady studií (přehled těch nejvíce citovaných s údajem o změně rizika CMP je v tab. 5), přičemž ve většině z nich došlo současně s poklesem koronárních příhod i ke snížení výskytu iCMP [30–35]. Ve většině z nich však nebyli zařazeni pacienti po prodělané CMP. Menší soubor pacientů po CMP byl ve studii HPS (Heart Protection Study), ve které léčba simvastatinem snížila v celém souboru signifikantně riziko iCMP, ke snížení rizika však nedošlo v podskupině těch, kteří již iCMP před zařazením prodělali [33]. Příčinou byla pravděpodobně dlouhá doba od prodělání CMP do zařazení do studie (průměr 4,3 roky), přičemž riziko recidivy CMP je nejvyšší v prvním roce. Ve studii MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering) vedla agresivní léčba 80mg atorvastatinu, zahájená u nemocných s akutní formou ICHS a s mírnou hypercholesterolemií ihned po přijetí, k relativnímu snížení rizika TIA o 50% (absolutně z 1,6 na 0,8%), riziko CMP se nezměnilo [34]. Lze však konstatovat, že u nemocných s ICHS jsou statiny účinné nejen v sekundární prevenci koronárních příhod, ale i v primární prevenci iCMP.
Table 5. Statinové studie u pacientů s ICHS srdeční – vliv na incidenci ischemických CMP. 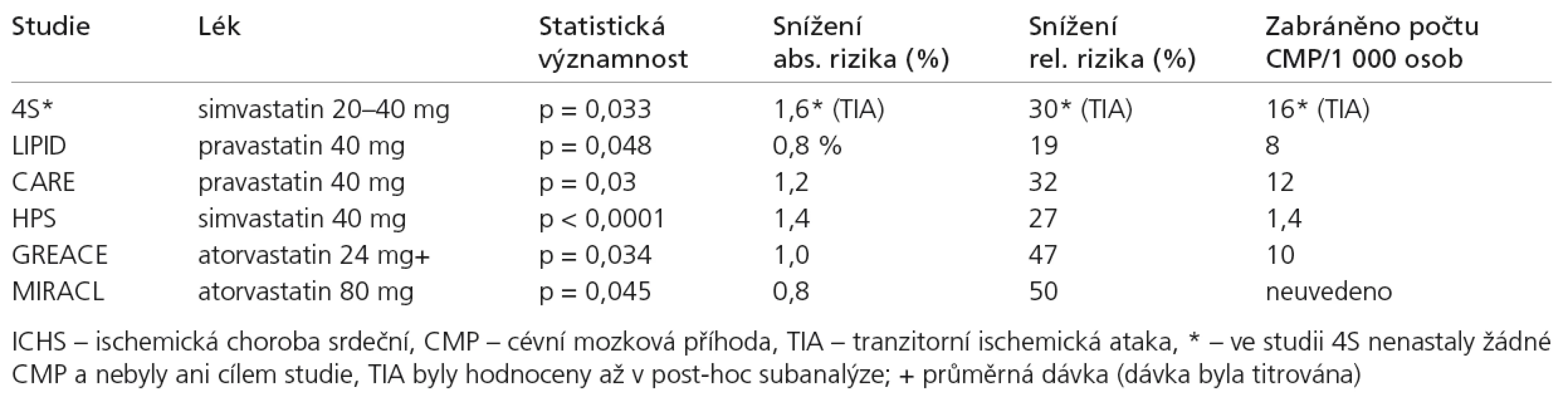
Ve statinových studiích srovnávajících u pacientů s ICHS „běžnou“ a intenzivní terapii statiny nebyl vliv léčby na riziko CMP jednoznačný (tab. 6). Studie PROVE-IT (Pravastatin or Atorvastatin Evaluation and Infection Therapy) srovnávající 40mg pravastatinu s 80mg atorvastatinu, studie A TO Z STUDY (Phase Z of the Aggrastat to Zocor Trial) srovnávající 20 a 80mg simvastatinu ani studie IDEAL (Incremental Decrease In End Points Through Aggressive Lipid Lowering) srovnávající 20mg simvastatinu s 80mg atorvastatinu) neprokázaly přínos intenzivní terapie na snížení rizika CMP [36–38]. Jen ve studii TNT (Treating to New Targets), srovnávající léčbu 10 a 80mg atorvastatinu, agresivní léčba atorvastatinem dále snížila riziko iCMP ve srovnání s léčbou „běžnou“ [39]. Je tedy otázka, zda i v prevenci iCMP platí: čím nižší LDL‑C, tím lépe [40].
Table 6. Statinové studie srovnávající „běžnou“ a „agresivní“ terapii – vliv na incidenci ischemických CMP u pacientů s ICHS. 
- d) Statiny v sekundární prevenci CMP
Průkaz o významu statinů v sekundární prevenci CMP přinesla studie SPARCL (Stroke Prevention by Aggressive Reduction of Cholesterol Levels) [11], ve které byli zařazeni nemocní se zvýšeným LDL‑C do půl roku od prodělané CMP nebo TIA (vyřazujícím kritériem byla přítomností ICHS). Léčba 80mg atorvastatinu snížila (ve srovnání s větví placebovou) relativní riziko recidivy CMP o 16%, riziko koronárních příhod se snížilo relativně o 29%. Pokles rizika CMP byl podobný jako v jiných statinových studiích u pacientů s ICHS. U nemocných zařazených po hemoragické CMP však došlo po léčbě ke vzestupu relativního rizika krvácivé CMP o 66% (tab. 7). Atorvastatin je tedy zatím jediný statin, u kterého je prokázáno snížení rizika recidivy ischemické CMP u nemocných v sekundární prevenci CMP. iCMP nebo TIA u pacienta se zvýšeným LDL‑C je proto indikací k časnému zahájení léčby atorvastatinem.
Table 7. Studie SPARCL – hlavní výsledky. 
- e) Metaanalýzy statinových studií a riziko CMP
Metaanalýza 26 studií (přes 90 000 pacientů) prokázala, že léčba statiny snižuje relativní riziko CMP průměrně o 21%, absolutní riziko o 0,9% [17]. Přitom pokles smrtelných CMP (údaje z 15 studií) nebyl statisticky významný, počet hemoragických CMP se ale nezvýšil (údaje z 12 studií). Desetiprocentní snížení LDL‑C bylo spojeno se snížením relativního rizika CMP o 15,6% a tloušťky intimy-medie karotid o 0,73%.
5. Ezetimib a prevence CMP
Tento relativně nový lék, který inhibuje resorpci cholesterolu ve střevě, je používán především v kombinaci se statiny a také zde zatím chybí důkazy pro jeho využití v prevenci CMP. V dosud jediné ukončené intervenční studii s klinickými cíli (studie SEAS, Simvastatin and Ezetimibe in Aortic Stenosis) byli kombinací simvastatinu 40mg a ezetimibu 10mg (oproti placebu) léčeni nemocní s aortální stenózou s primárním cílem ovlivnit progresi aortální stenózy. Sekundárním cílem byly kardiovaskulární příhody včetně iCMP, které však výše uvedenou léčbou nebyly ovlivněny [41]. Na výsledky velkých intervenčních studií s ezetimibem (studie IMPROVE-IT, SHARP) se ale teprve čeká a význam ezetimibu v prevenci CMP tedy zatím nelze definitivně posuzovat.
Závěr
Hypolipidemika mají své místo v primární i v sekundární prevenci iCMP [42]. Riziko iCMP snižují niacin, gemfibrozil a statiny. Výsledky každé intervenční studie však lze s jistotou vztahovat pouze na takovou populaci, která byla do studie zařazena. Bezpečně prokázana jsou proto pouze následující fakta:
A) Riziko první iCMP u osob bez ICHS snižuje:
- atorvastatin 10mg: a) u mužů nad 40 let věku s hypertenzí, hypercholesterolemií a nejméně třemi rizikovými faktory; b) u nemocných s diabetem mellitem 2. typu nad 40 let věku se zvýšeným LDL‑C a nejméně jedním dalším rizikovým faktorem pro ICHS.
- rosuvastatin 20mg u mužů nad 50 let a u žen nad 60 let věku ve vysokém riziku KVO s mírně zvýšeným LDL‑C a CRP.
B) Riziko první iCMP u nemocných s ICHS snižují: statiny (u mužů i žen s vyšším než cílovým LDL‑C), gemfibrozil (u mužů se sníženým HDL‑C) a niacin (u mužů po infarktu myokardu). Cílové hodnoty LDL‑C a optimální hodnoty HDL‑C jsou uvedeny v tab. 8 [10].
Table 8. Doporučené hodnoty krevních lipidů pro jednotlivé kategorie rizika [10]. ![Doporučené hodnoty krevních lipidů pro jednotlivé kategorie rizika [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2ea663dcc60cf41b8df3ed51a4caa143.png)
C) Riziko recidivy iCMP u pacientů bez ICHS snižuje časně zahájená léčba 80mg atorvastatinu.
Léčba hypolipidemiky je tedy velmi účinná prevence iCMP, i když snížení relativního rizika iCMP je při této léčbě menší než při léčbě protidestičkovými léky a antihypertenzivy (tab. 9) [43].
Table 9. Srovnání efektivity léků v prevenci ischemických CMP [43]. ![Srovnání efektivity léků v prevenci ischemických CMP [43].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bc4ff87ddc933e520f7a0eeee7ac6139.png)
Přijato k recenzi: 9. 7. 2009
Přijato do tisku: 19. 10. 2009
doc. MUDr. Vladimír Soška, CSc.
Oddělení klinické biochemie a II. interní klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: vladimir.soska@fnusa.cz
Sources
1. Neaton JD, Blackburn H, Jacobs D, Kuller L, Lee DJ, Sherwin R et al. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med 1992; 152(7): 1490–1500.
2. Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C et al; Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol lowering treatment: prospective meta‑anylysis of data from 90,056 participants in 14 randomized trials of statins. Lancet 2005; 366(9433): 1267–1278.
3. Law MR, Wald NJ, Thopmson SG. By how much and how quickly does reduction in serum cholesterol concentration lower risk of ischaemic heart disease? BMJ 1994; 308(6925): 367–372.
4. Amarenco P. Lipid lowering and recurrent stroke: another stroke paradox. Eur Heart J 2005; 26(18): 1818–1819.
5. Prospective Studies Collaboration. Cholesterol, diastolic blood pressure and stroke: 13,000 strokes in 450,000 people in 45 prospective cohorts. Lancet 1995; 346(8991–8992): 1647–1653.
6. Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J et al. Blood cholesterol and vascular mortality by age, sex, and blood pressure: meta‑analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet 2007; 370(9602): 1829–1839.
7. Lindenstrøm, Boysen G, Nyboe J. Influence of total cholesterol, high density lipoprotein cholesterol and triglycerides on risk of cerebrovascular disease: the Copenhagen city study. BMJ 1994; 309(6946): 11–15.
8. Iso H, Jacobs DR Jr, Wentworth D, Neaton JD, Cohen JD. Serum cholesterol levels and six‑year mortality from stroke in 350,977 men screened for the multiple risk factor intervention trial. N Engl J Med 1989; 320(14): 904–910.
9. Tell GS, Crouse JR, Furberg SD. Relationship between blood lipids, lipoproteins, and cerebrovascular atherosclerosis. A review. Stroke 1988; 19(4): 423–430.
10. Vaverková H, Soška V, Rosolová H, Češka R, Cífková R, Freiberger T et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007; 53(2): 181–197.
11. The stroke prevention by aggresive reduction in cholesterol levels (SPARCL) investigators. High‑dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006; 355 : 549–559.
12. Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, Elam MB et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high‑density lipoprotein cholesterol. N Engl J Med 1999; 341(6): 410–418.
13. Školoudík D, Bar M, Václavík D, Škoda O, Korsa J,Hradílek P et al. Riziko vzniku vaskulární příhody při léčbě fluvastatinem a fenofibrátem. Cesk Slov Neurol N 2007; 70/103(2): 163–167.
14. Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR et al. Effects of long‑term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005; 366(9500): 1849–1861.
15. Canner PL, Berge KG, Wenger NK, Stamler J, Friedman L, Prineas RJ, et al. Fifteen year mortality in coronary drug project patients: long term benefit with niacin. J Am Coll Cardiol 1986; 8(6): 1245–1255.
16. The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA 1984; 251(3): 351–364.
17. Amarenco P, Labreuche J, Lavallée P, Touboul PJ. Statins in stroke prevention and carotid atherosclerosis: systematic review and up-to-date meta‑analysis. Stroke 2004; 35(12): 2902–2909.
18. Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995; 333(20): 1301–1307.
19. Downs JR, Clearfild M, Weis S, Whitney E, Shapiro DR, Beere PA et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. JAMA 1998; 297(20): 1615–1622.
20. The Kyushu Lipid Intervention Study. Pravastatin use and risk of coronary events and cerebral infarction in Japanese men with moderate hypercholesterolemia. J Atheroscler Thromb 2000; 7(2): 110–121.
21. Colhoun HM, Thomason MJ, Mackness MI, Maton SM, Betteridge DJ, Durrington PN et al. Design of the Collaborative AtoRvastatin Diabetes Study (CARDS) in patients with type 2 diabetes. Diabet Med 2002; 19(3): 201–211.
22. Ridker P, Danielson E, Fonseca FAH, Genest J, Gotto AM, Kastelein JJ et al. Rosuvastatin to prevent vascular events in men and women with elevated C‑reactive protein. N Eng J Med 2008; 359(21): 2195–2207.
23. Di Napoli M, Schwaninger M, Cappelli R, Ceccarelli E, Gianfilippo GD, Donati C et al. Evaluation of C‑reactive protein measurment for assesing the risk and prognosis in ischemic stroke: a statement for health care professionals from the CRP pooling project members. Stroke 2005; 36(6): 1316–1329.
24. Vlachová I, Herzig R, Vaverková H, Novotký D, Krčová V, Bártková A et al. Prediktivní hodnota ultrasenzitivního C‑reaktivního proteinu u cévní mozkové příhody a jeho vztah k ateroskleróze karotid. Cesk Slov Neurol N 2007; 70/103(1): 49–55.
25. Václavík D, Školoudík D, Škoda O, Prax P, Axmanová K, Vlachová I. Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci. Cesk Slov Neurol N 2008; 71/104(3): 285–292.
26. Sever P, Dahlöf B, Poulter N, Wedel H, Beevers G, Caulfield M et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower‑than‑average cholesterol concentrations, in the Anglo‑Scandinavian Cardiac Outcomes Trial‑Lipid Lowering Arm (ASCOT‑LLA): a multicentre randomised controlled trial. Lancet. 2003; 361(9364): 1149–1158.
27. Knopp RH, d’Emden M, Smilde JG, Pocock SJ. Efficacy and safety of atorvastatin in the prevention of cardiovascular end points in subjects with type 2 diabetes: the Atorvastatin Study for Prevention of Coronary Heart Disease Endpoints in non‑insulin‑dependent diabetes mellitus (ASPEN). Diabetes Care 2006; 29(7): 1478–1485.
28. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. Major outcomes in high‑risk hypertensive patients randomized to angiotensin‑converting enzyme inhibitor or calcium channel blocker vs diuretic: the Antihypertensive and Lipid‑Lowering Treatment to Prevent Heart Attack Trial (ALLHAT‑LLT). JAMA 2002; 288(23): 2981–2997.
29. Shepherd J, Blauw GJ, Murphy MB, Bollen E, Buckley BM, Cobbe SM et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360(9364): 1623–1630.
30. Scandinavian Simvastatin Survival Study (4S). Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease. Lancet 1994; 334(8934): 1383–1389.
31. The Long‑term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339(19): 1349–1357.
32. Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators. N Engl J Med 1996; 335(14): 1001–1009.
33. Collins R, Armitage J, Parish S, Sleigh P, Peto R. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo‑controlled trial. Lancet 2003; 361(9374): 2005–2016.
34. Athyros VG, Papageorgiou AA, Mercouris BR, Athyrou VV, Symeonidis AN, Basayannis EO et al. Treatment with atorvastatin to the National Cholesterol Educational Program goal versus ‘usual’ care in secondary coronary heart disease prevention. Curr Med Res Opin 2002; 18(4): 220–228.
35. Waters DD, Schwartz GG, Olsson AG, Zeiher A, Oliver MF, Ganz P et al. Effects of atorvastatin on stroke in patients with unstable angina or non‑Q-wave myocardial infarction. Circulation 2002; 106(13): 1690–1695.
36. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004; 350(15): 1495–1504.
37. de Lemos JA, Blazing MA, Wiviott SD, Lewis EF, Fox KA, White HD et al. Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial. JAMA 2004; 292(11): 1307–1316.
38. Pedersen TR, Faergeman O, Kastelein JJ, Olsson AG, Tikkanen MJ, Holme I et al. High‑dose atorvastatin vs usual‑dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA 2005; 294(19): 2437–2445.
39. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352(14): 1425–1435.
40. Mazighi M, Lavallée PC, Labreuche J, Amarenco P.Statin therapy and stroke prevention: what was known, what is new and what is next? Curr Opin Lipidol 2007; 18(6): 622–625.
41. Rossebø AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med 2008; 359(13): 1343–1356.
42. Kalita Z, Keller O, Bar M, Mikulík R, Škoda O, Neumann J. Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě. Cesk Slov Neurol N 2008; 71/104 (3): 372–378.
43. Amarenco P, Lavallee P, Touboul PJ. Stroke prevention, blood cholesterol and statins. Lancet Neurol 2004; 3(5): 271–278.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 1-
All articles in this issue
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
- Prevence cévních mozkových příhod léčbou hypolipidemiky
- Magnetická rezonanční relaxometrie u roztroušené sklerózy – měření T2 relaxačního času v centrální šedé hmotě
- Vliv repetitivní transkraniální magnetické stimulace cerebella na motoriku horní končetiny u pacientů v iniciálním stadiu Parkinsonovy nemoci – pilotní studie
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Diabetická neuropatia u detí a adolescentov – prospektívna 5-ročná štúdia
- Jeden rok po hluboké mozkové stimulaci pacientů s Parkinsonovou nemocí – neuropsychologické výsledky
- Kongenitální myastenické syndromy – kazuistiky
- Myoklonická epilepsie a hluchota u sourozenců s mutací 7512T>C v genu pro mitochondriální tRNASer(UCN) – kazuistiky
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Sérový protein S100B jako molekulární marker závažnosti poranění mozku u dětí
- Hyperintenzivní léze reagující na steroidy u pacienta s Creutzfeldt‑Jakobovou nemocí
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Kongenitální myastenické syndromy – kazuistiky
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

