-
Medical journals
- Career
Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
Authors: A. Zolal 1; M. Sameš 1; P. Vachata 1; R. Bartoš 1; M. Nováková 2; M. Derner 2
Authors‘ workplace: Neurochirurgické oddělení Masarykovy nemocnice, Ústí nad Labem 1; Radiodiagnostické oddělení Masarykovy nemocnice, Ústí nad Labem 2
Published in: Cesk Slov Neurol N 2008; 71/104(3): 352-357
Category: Case Report
Overview
Cíl:
Cílem tohoto sdělení je popsat postup použitý při zobrazení nervových drah v bílé hmotě mozkové pomocí DTI (Diffusion Tensor Imaging – zobrazování difuzních tenzorů), použití těchto dat v navigaci a dokumentovat klinický význam této metody.Soubor a metodika:
Tato práce obsahuje popis 2 případů pacientů se supratentoriálně lokalizovaným nádorovým procesem, u kterých byly intraoperačně použity výsledky traktografie. K vlastnímu trasování a importu do navigace byla použita v literatuře popsaná metoda za použití programů Volume One a dTV. Výsledné obrazy drah byly voxelizovány a spojeny s difuzně neváženými datovými sadami (b = 0 s/mm2), ty pak byly importovány do navigace a registrovány s anatomickými snímky.Výsledky:
V obou případech byly obrazy klinicky relevantních drah pomocí popsaného postupu úspěšně rekonstruovány a jejich obrazy byly importovány do neuronavigačního systému. Pomocí tohoto systému pak bylo možno určit optimální operační přístup i rozsah resekce vzhledem k průběhu drah v blízkosti resekované léze.Závěr:
Výsledky DTI traktografie mohou být pomocí námi popsané metody spolehlivě integrovány do neuronavigačního systému. Použití traktografie představuje přínos pro určení operačního přístupu i rozsahu resekce.Klíčová slova:
DTI – traktografie – neuronavigace – nervové dráhy – mozkové tumoryÚvod
DTI (Diffusion Tensor Imaging – zobrazování pomocí difuzních tenzorů) představuje relativně novou metodu zobrazení anatomických vztahů uvnitř bílé hmoty mozkové. Tato zobrazovací metoda, poprvé popsaná Basserem v roce 1994 [1], využívá efektu anizotropie difuze v bílé hmotě – difuze je omezena membránami nervových vláken, je tedy silnější ve směru, kterým nervová vlákna probíhají. Při měření difuze pomocí MRI (magnetická rezonance) je její směrovost v jednotlivých voxelech matematicky popsána pomocí difuzních tenzorů, které určují hodnoty difuze v základních prostorových směrech. Lokalizaci nervových drah lze pomocí DTI určit již ze zobrazení využívajících např. barevné kódování směrů difuze v jednotlivých voxelech (obr. 1). Trasovací programy pak používají různé přístupy k rekonstrukci obrazů svazků nervových vláken, nejběžněji tzv. „line propagation“ algoritmus, kdy je v počátečním VOI/ROI (volume/region of interest) vytvořen určitý počet počátečních bodů („seed points“), ze kterých algoritmus po směru nejsilnější difuze propaguje rekonstruovaná vlákna. Různé modifikace tohoto základního přístupu pak berou v úvahu i předchozí směr propagovaných vláken („tensor deflection“ algoritmy) [2] nebo dynamicky mění délku kroku při trasování [3]. Jiný přístup pak představují algoritmy založené na teorii grafů, které lze použít k rekonstrukci dráhy mezi 2 předem určenými body. Ty po vytvoření grafu v oblasti hledání dráhy přiřadí hranám grafu váhy na základě změřených difuzních charakteristik a poté mezi danými body vyhledávají nejlepší spojení [4].
Image 1. Postup při trasování pyramidové dráhy u pacientky č. 1; barevné kódování směru: červená – laterolaterální, modrá – kraniokaudální, zelená – ventrodorzální; A – počáteční VOI vytvořeno v oblasti zadního raménka capsula interna (šipka), vzhledem ke křížení drah rekonstruoval trasovací algoritmus i části fasciculus arcuatus, corpus callosum a druhostranné pyramidové dráhy; B – určení cílových VOI/ROI (šipky) – zůstanou zobrazeny pouze ta vlákna, která těmito VOI/ROI procházejí; C – vylučující kulové VOI – vlákna, která procházejí takto označeným prostorem, nebudou zobrazena – zde objemné vylučující VOI umístěné v protilehlé hemisféře při rekonstrukci pravého kortikospinálního traktu; D – barevná FA mapa – barva určuje převažující směr difuze v daném voxelu, intenzita určuje hodnotu FA – poměr směrovosti difuze, zde je patrný vliv perifokálního edému na směrovost difuze v levé hemisféře (šipka); E – část vláken probíhajících v laterolaterálním směru při rekonstukci levostranného tractus corticospinalis – důsledek křížení drah. 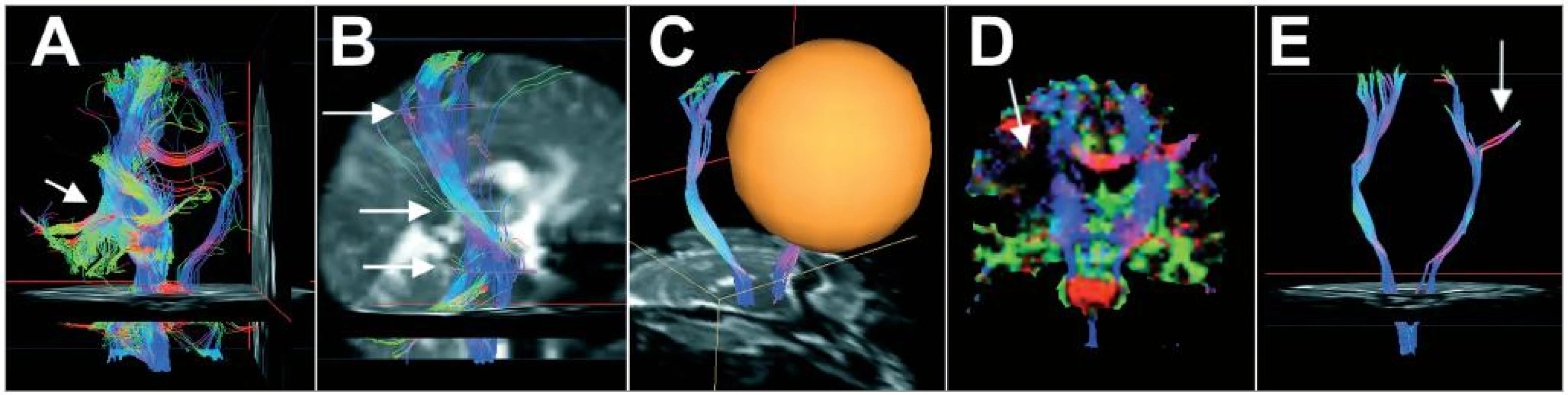
Z klinického hlediska je nejzajímavější použití DTI pro zobrazení a lokalizaci drah v bílé hmotě v blízkosti expanzivně se chovajících lézí [5], které může být využito jak při předoperačním plánování, tak v intraoperační neuronavigaci [6,7]. V literatuře byly opakovaně popsány výsledky implementace DTI traktografie kortikospinální dráhy [8,9], fasciculus arcuatus jako anatomického korelátu drah spojujících řečová kortikální centra [10], i zrakové dráhy [11,12]. Tyto studie potvrzují jak dobrou korelaci drah zobrazených pomocí DTI s výsledky získanými elektrofyziologicky, tak klinický přínos této metody.
Cílem této práce je popsat postup použitý při zobrazení nervových drah v bílé hmotě mozkové pomocí DTI, použití těchto dat v navigaci a dokumentovat klinický význam této metody pomocí popisu 2 případů s expanzemi v oblasti pyramidové dráhy a optické radiace.
Materiál a metodika
Představujeme 2 případy intraoperačního použití DTI traktografie v navigačním systému Treon (Medtronic, USA). Předoperačně bylo u obou pacientů provedeno MRI vyšetření v DTI sekvenci (single-shot, echo planární sekvence, matice 128 × 128, FOV 279 mm, TE: 96 ms TR: 10 100 ms, tloušťka řezu 2,2 mm, šířka pásma pixelu 1 500 Hz/Px, počet zprůměrování 5, b hodnoty 0 a 1 000 s/mm2, 6 prostorových směrů měření difuze, doba trvání skenu 6 min 4 s), s použitím 1,5T skeneru Magnetom Symphony (Siemens, Německo). Pro trasování drah a jejich převedení do navigačního systému Medtronic Treon byl použit v literatuře popsaný postup [10] za použití aplikací Volume One a dTV, využívající pro trasování drah line propagation algoritmus [13]. Pro spolehlivé trasování drah v co největším rozsahu odpovídajícím známé anatomii jsme použili multi-VOI metodiku popsanou Nimskym et al [14] (obr. 1). Při ní je na začátku trasování určeno první počáteční VOI v co největším anatomicky relevantním rozsahu. Výsledky trasování jsou pak vizuálně vyhodnoceny, je určena ta část vláken, která reprezentuje hledanou anatomickou strukturu a zbylá vlákna jsou metodou ponechání nebo vyloučení pomocí VOI odstraněna. Mez frakční anizotropie (FA) pro ukončení trasování byla vzhledem k přítomnosti perifokálního edému nastavena na 0,12, možnost ukončení trasování při překročení určitého úhlu nebyla použita. Výsledky trasování byly porovnány s barevnými FA mapami, aby bylo vyloučeno chybné trasování např. z důvodu chybného anatomického určení počátečních, konečných nebo vylučujících VOI. Rekonstrukce drah pak byly voxelizovány a importovány do navigačního systému, kde byly úspěšně registrovány s anatomickými navigačními obrazovými sadami. Během operace pak byla možná volba náhledu jak na anatomickou obrazovou sadu, tak na sadu s výsledky traktografie.
Výsledky
Pacientka č. 1, věk 46 let, se 2 metastázami bronchogenního karcinomu vlevo parietálně a vpravo frontálně. Klinicky se prezentovala pravostrannou hemiparézou, výraznější na horní končetině. Pomocí traktografie byly bilaterálně identifikovány kortikospinální dráhy v průběhu od kůry po kmen, levostranný kortikospinální trakt se nacházel na okraji perifokálního edému obklopujícího parietální metastázu, nicméně v bezpečné vzdálenosti od ní, proti pravostrannému byl dislokován mírně ventrálně (obr. 2). Výsledky traktografie byly importovány do navigačního systému a provedena radikální resekce metastáz. Postoperačně došlo ke zlepšení klinického stavu, pacientka byla při překladu 7. pooperační den již jen s frustní pravostrannou hemiparézou.
Image 2. Barevné kódování směru viz obr. 1: horní řada – pacientka č. 1: A – srovnání rekonstruovaných drah s barevnou FA mapou; B, C – pohled na rekonstruované tr. corticospinales, 3D pohled zpředu zleva, D – pohled na levý tr. corticospinalis, 3D pohled zezadu zleva, patrný prostup kortikospinálního traktu perifokálním edémem i mírná dislokace; dolní řada – pacient č. 2: E – barevná FA mapa, axiální řez, patrná laterální dislokace optické radiace vlevo; F – 3D zobrazení rekonstruované pyramidové a zrakové dráhy na straně léze; G, H – porovnání rekonstrukcí optické radiace na obou stranách, na straně tumoru zřetelné odtlačení kraniolaterálním směrem. 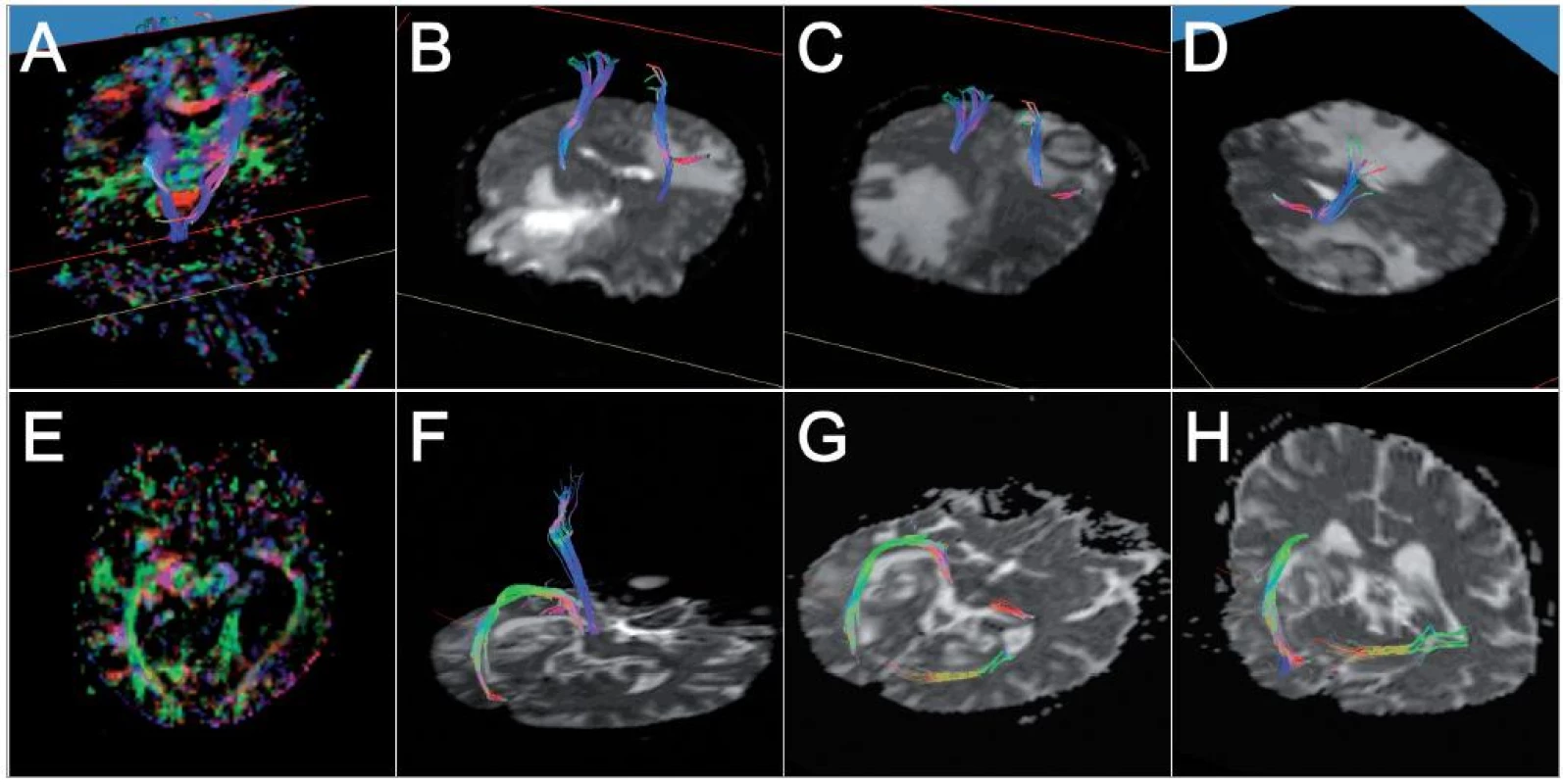
Pacient č. 2, věk 72 let, s WHO gr. IV glioblastomem vlevo temporookcipitálně s výrazným perifokálním edémem. Klinicky byla patrná mírná expresivní fatická porucha, na předoperačním perimetru jen ojedinělé skotomy v temporálním horním kvadrantu na pravém oku, odpovídající postižení Meyerovy kličky probíhající hluboko v levém temporálním laloku. Pomocí traktografie byly identifikovány zrakové dráhy od corpus geniculatum laterale k primární zrakové kůře bilaterálně, dále pak pyramidová dráha vlevo. Laterokraniální dislokace levé zrakové dráhy byla patrná jak na barevných FA mapách, tak na výsledcích trasování. Meyerova klička na levé straně se zdála odtlačená tumorem od zbytku dráhy, nicméně perifokální edém znemožnil její přesné zobrazení (obr. 2). Výsledky byly importovány do navigačního systému, předoperačně a intraoperačně byl určen přístup k tumoru tak, aby nedošlo k poškození velké části zrakové dráhy (obr. 3). V pooperačním průběhu byl pacient klinicky bez výpadu zorného pole, kontrolní vyšetření perimetrem týden po operaci odhalilo jen mírné zhoršení ve smyslu výskytu ojedinělých skotomů v horním temporálním kvadrantu na pravém oku a v horním nazálním kvadrantu na levém oku, odpovídající mírné lézi Meyerovy kličky vlevo (obr. 4).
Image 3. Snímek z neuronavigačního systému, pacient č. 2: černě DTI rekonstrukce optické radiace (bílé šipky), patrná je hranice traktografické datové sady, ta je správně registrovaná k anatomické T1 sadě (modrá šipka). 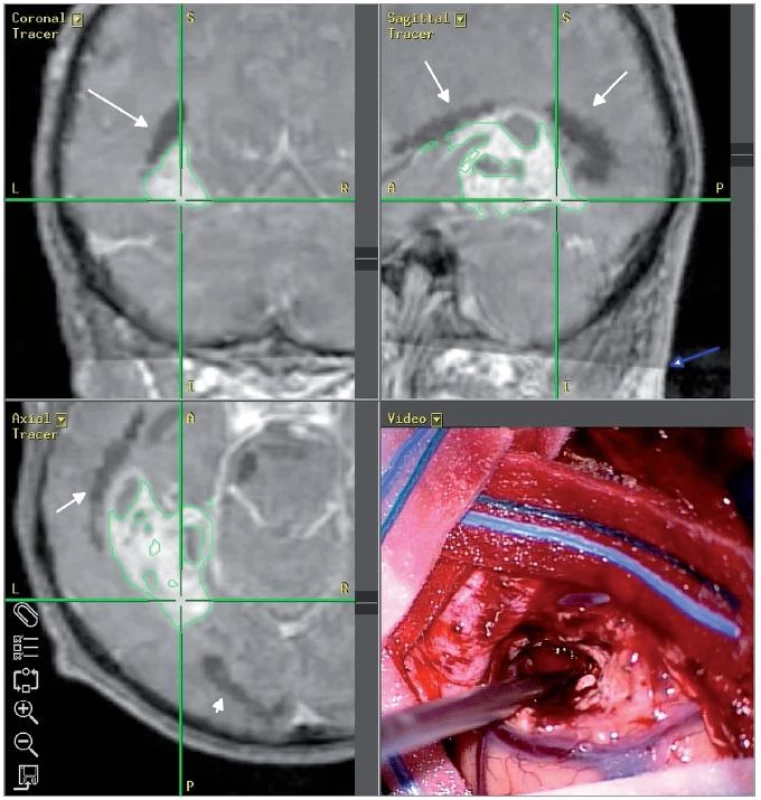
Image 4. Srovnání předoperačního a pooperačního vyšetření perimetrem u pacienta č. 2: černý obdélník – výpad; kroužek – normální nález; horní řada: předoperační stav (OL vlevo, OP vpravo), dolní řada: pooperační stav 9. den po operaci (OL vlevo, OP vpravo). 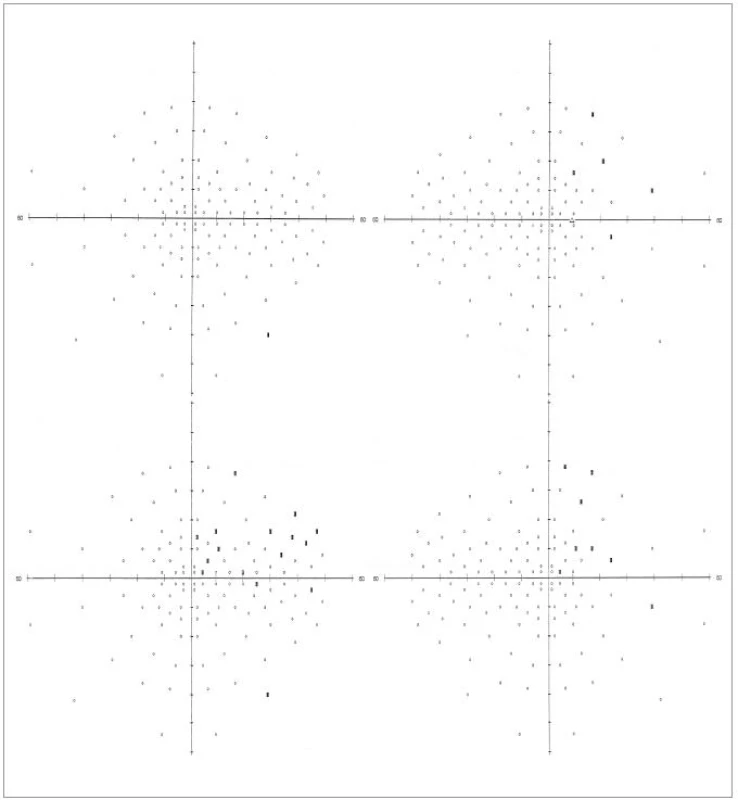
Diskuse
Oba zde zmíněné případy ilustrují možnosti klinického využití DTI traktografie. První námi prezentovaný případ je ilustrativní zejména z hlediska diagnostického – předoperační poměrně těžká klinická paréza mohla být na základě výsledků traktografie posuzována jako důsledek edému v motorické korové oblasti a kortikospinální dráhy, po operaci bylo tedy možné očekávat výrazné zlepšení, ke kterému také došlo. V případě, že by se jednalo o neuroepiteliální tumor v této lokalizaci, bylo by možné na podkladě DTI traktografie určit bezpečný rozsah resekce tak, aby byla v daném případě maximální možná, ale zároveň neohrozila elokventní dráhu a nesnížila tak výrazně pooperační kvalitu života pacienta. Druhý případ demonstruje výhodnost použití DTI traktografie u pacienta, u nějž lze předpokládat odtlačení dráhy směrem k povrchu mozku, tedy směrem možné cesty resekce – trajektorie byla v tomto případě určena právě na podkladě výsledků traktografie. V našem případě došlo jen k lehké lézi v oblasti Meyerovy kličky – tj. té části zrakové dráhy, která se na DTI rekonstrukcích ukazovala jako částečně roztlačená tumorem směrem k tentoriu. Tuto pouze lehkou pooperační lézi bylo tedy možno předpokládat a přistoupit k resekci beze strachu o možné funkční následky a snížení kvality života pacienta.
Je potřeba zdůraznit, že jde o metodu matematické rekonstrukce průběhu nervových vláken na základě dat o fyzikálních vlastnostech mozkové tkáně. Rekonstruované obrazy nervových drah tedy nejsou daty odrážejícími funkci nervových vláken, ale spíše odrazem anatomických poměrů v bílé hmotě mozkové. Výsledky traktografie je tedy nutné korelovat s anatomickými znalostmi o průběhu drah v bílé hmotě, a za rekonstruovanou dráhu považovat pouze tu část rekonstruovaných vláken, která jim odpovídá. Při interpretaci je rovněž nutno počítat s nepříznivými faktory ovlivňujícími možnosti traktografie – jak blízkost šedé hmoty, tak edém mozkové tkáně narušují anizotropii difuze v daném voxelu a znesnadňují trasování. Parametry trasovacího algoritmu mohou přesnost traktografie rovněž ovlivnit [15].
Dalšími faktory ovlivňujícími přesnost a spolehlivost traktografie je vlastní rozlišení zobrazovací metody, import vytvořených rekonstrukcí do navigačního systému a tzv. „brain shift“ efekt. DTI dosahuje v zahraničních studiích i v námi popisované metodice rozlišení zhruba 2 mm v každém prostorovém směru. V praxi to znamená, že rozdíly ve velikosti rekonstruovaných drah, které se pohybují do 2 mm, lze považovat jen za artefakty ovlivněné typem rekonstrukčního algoritmu a jeho nastavením. I tuto vlastnost metody je nutné mít v patrnosti při posuzování výsledků DTI traktografie. Při importu do navigačního systému při námi použitém postupu je nutné dbát na správnou registraci difuzně nevážených datových sad (b = 0 s/mm2, viz výše) obsahujících voxelizované obrazy rekonstrukcí k anatomickým datovým sadám použitým ve vlastní navigaci. Pokud nedojde k registraci správně, výsledné obrazy drah jsou proti anatomickým sadám i proti reálnému stavu posunuty. „Brain shift“ efekt je jevem vyskytujícím se při použití navigace v průběhu resekcí v neurologických strukturách – v průběhu operace dojde k posunu mozkové tkáně a v navigaci zobrazovaná data tím ztrácejí na platnosti. Pokud není k dispozici zařízení umožňující intraoperační zobrazení aktuálního stavu mozkové tkáně, novou registraci a update navigace, je nutné počítat s posunem zobrazených funkčních struktur proti reálnému stavu. Provedení vlastní rekonstrukce kvalifikovaným odborníkem a kritické posouzení výsledků je tedy při použití této metody nutností.
Přes nedostatky metody je zřetelný klinický přínos jak u výše zmiňovaných studií, tak u námi prezentovaných případů. Zejména u neuroepiteliálních tumorů v lokalizacích, u kterých není jasný směr odtlačení elokventní dráhy probíhající v jejich blízkosti, dokáže tato metoda určit lokalizaci nervové dráhy a umožní tak optimální naplánování operačního přístupu i rozsahu resekce.
Největší přínos DTI traktografie v kombinaci s výsledky funkčních zobrazovacích metod (fMRI, MEG, PET) je možné spatřovat v léčbě low grade gliomů (LGG). Indikace resekce těchto infiltrativních tumorů charakteristických pomalou progresí a vysokým rizikem anaplastické transformace je stále předmětem debat, zejména pokud se léze nachází v blízkosti elokventních oblastí. Případný trvalý neurologický deficit způsobený resekcí vede k výraznému snížení kvality života pacienta. Předoperační mapování a intraoperační zobrazení kortikálních a subkortikálních elokventních struktur umožní resekci tumoru s výrazným snížením rizika postoperačního neurologického deficitu a povede tak k rozšíření indikací k operační léčbě těchto lézí.
Perspektivně je u DTI traktografie možné očekávat ustanovení standardního postupu (nastavení parametrů trasovacího algoritmu, standardní anatomické lokalizace startovních a cílových VOI) pro zobrazení jednotlivých nervových drah, kdy bude na základě anatomických, histologických a elektrofyziologických studií ustanovena přesnost traktografie, její spolehlivost pro jednotlivé dráhy a za vlivu různých faktorů na vlastnosti tkáně (perifokální edém, postoperační změny) a rutinní užívání při operacích v blízkosti elokventních struktur bílé hmoty.
Práce byla podpořena grantem NR/8849-4.
MUDr. Amir Zolal
Neurochirurgické oddělení
Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: amir.zolal@mnul.cz
Přijato k recenzi: 18. 12. 2007
Přijato do tisku: 24. 1. 2008
Sources
1. Basser PJ, Mattiello J, LeBihan D. MR diffusion tensor spectroscopy and imaging. Biophys J 1994; 66(1): 259–267.
2. Lazar M, Weinstein DM, Tsuruda JS, Hasan KM, Arfanakis K, Meyerand ME et al. White matter tractography using diffusion tensor deflection. Hum Brain Mapp 2003; 18(4): 306–321.
3. Mori S, Crain BJ, Chacko VP, van Zijl PC. Three-dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann Neurol 1999; 45(2): 265–269.
4. Merhof D, Richter M, Enders F, Hastreiter P, Ganslandt O, Buchfelder M et al. Fast and accurate connectivity analysis between functional regions based on DT-MRI. Med Image Comput Comput Assist Interv Int Conf Med Image Comput Comput Assist Interv 2006; 9 (Pt 2): 225–233.
5. Inoue T, Shimizu H, Yoshimoto T. Imaging the pyramidal tract in patients with brain tumors. Clin Neurol Neurosurg 1999; 101(1): 4–10.
6. Coenen VA, Krings T, Mayfrank L, Polin RS, Reinges MH, Thron A et al. Three-dimensional visualization of the pyramidal tract in a neuronavigation system during brain tumor surgery: first experiences and technical note. Neurosurgery 2001; 49(1): 86–92.
7. Kamada K, Houkin K, Takeuchi F, Ishii N, Ikeda J, Sawamura Y et al. Visualization of the eloquent motor system by integration of MEG, functional, and anisotropic diffusion-weighted MRI in functional neuronavigation. Surg Neurol 2003; 59(5): 352–361.
8. Nimsky C, Ganslandt O, Merhof D, Sorensen AG, Fahlbusch R. Intraoperative visualization of the pyramidal tract by diffusion-tensor-imaging-based fiber tracking. Neuroimage 2006; 30(4): 1219–1229.
9. Berman JI, Berger MS, Chung SW, Nagarajan SS, Henry RG. Accuracy of diffusion tensor magnetic resonance imaging tractography assessed using intraoperative subcortical stimulation mapping and magnetic source imaging. J Neurosurg 2007; 107(3): 488–494.
10. Kamada K, Todo T, Masutani Y, Aoki S, Ino K, Morita A et al. Visualization of the frontotemporal language fibers by tractography combined with functional magnetic resonance imaging and magnetoencephalography. J Neurosurg 2007; 106(1): 90–98.
11. Kamada K, Todo T, Morita A, Masutani Y, Aoki S, Ino K et al. Functional monitoring for visual pathway using real-time visual evoked potentials and optic-radiation tractography. Neurosurgery 2005; 57(Suppl): 121–127.
12. Stefan H, Nimsky C, Scheler G, Rampp S, Hopfengartner R, Hammen T et al. Periventricular nodular heterotopia: A challenge for epilepsy surgery. Seizure 2007; 16(1): 81–86.
13. Masutani Y, Aoki S, Abe O, Hayashi N, Otomo K. MR diffusion tensor imaging: recent advance and new techniques for diffusion tensor visualization. Eur J Radiol 2003; 46(1): 53–66.
14. Nimsky C, Ganslandt O, Fahlbusch R. Implementation of fiber tract navigation. Neurosurgery 2006; 58(Suppl): 292–303.
15. Dauguet J, Peled S, Berezovskii V, Delzescaux T, Warfield SK, Born R et al. Comparison of fiber tracts derived from in-vivo DTI tractography with 3D histological neural tract tracer reconstruction on a macaque brain. Neuroimage 2007; 37(2): 530–538.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 3-
All articles in this issue
- Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
- Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
- Kvalita života u pacientů po subarchnoidálním krvácení – roční katamnéza
- Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervu
- Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Depersonalizace a derealizace – současné nálezy
- Sexuální dysfunkce u žen s epilepsií a jejich příčiny
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
- Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
- Funkce pravé komory srdeční a výskyt plicní hypertenze u pacientů se syndromem obstrukční spánkové apnoe
- Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
- Migréna v těhotenství
- Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?
- Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
- Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení European Stroke Organisation (ESO) 2008 – zestručněná česká verze
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

