-
Medical journals
- Career
Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
Authors: V. Špatenková 1; A. Kazda 2; P. Barsa 1; V. .beneš 1; P. Škrabálek 3; D. Králová 4; P. Suchomel 1
Authors‘ workplace: Neurocentrum, Krajská nemocnice Liberec, a. s. 1; Katedra klinické biochemie IPVZ, Praha 2; Oddělení klinické biochemie, Krajská nemocnice Liberec, a. s. 3; Institut biostatistiky a analýz, LF a PřF MU, Brno 4
Published in: Cesk Slov Neurol N 2008; 71/104(2): 156-162
Category: Original Paper
Overview
Úvod:
Hyponatremie s hypoosmolalitou je u akutního onemocnění mozku spojována se 2 syndromy: syndromem cerebrálně podmíněné ztráty soli (CSW) a syndromem nepřiměřené sekrece antidiuretického hormonu (SIADH). Jejich rozlišení je vzhledem k různé terapii podstatné a je možné pomocí renálních funkčních parametrů.
Cílem práce bylo zhodnocení hyponatremií po zavedení těchto parametrů do klinické praxe na naší neurologicko-neurochirurgické jednotce intenzivní péče.Metoda:
V retrospektivní studii jsme za období 5 let zhodnotili všechny hyponatremie (SNa+ < 135 mmol/l) u pacientů s akutním onemocněním mozku. Nejprve jsme je rozdělili podle měřené sérové osmolality a v další fázi jsme analyzovali hypoosmolální hyponatremie pomocí měřených a vypočtených funkčních renálních parametrů (p-hodnota vztažena k normě).Výsledky:
Za sledované období jsme hyponatremii zjistili u 251 pacienta v celkovém trvání 736 dní. Hyponatremie ve spojení s normoosmolalitou se vyskytla u 155 pacientů (297 dní), s hyperosmolalitou u 38 pacientů (41 den) a pouze u 50 pacientů (169 dní) s hypoosmolalitou. Zbylé hyponatremie neměly změřenou sérovou osmolalitu. Renální funkční parametry byly vyšetřeny u 31 (62 %) pacienta s hypoosmolální hyponatremií. CSW byl diagnostikován u 25 pacientů (dUNa+ 547 ± 384 mmol/den; p < 0,001; CEl 0,065 ± 0,036 ml/s; p < 0,001; CNa+ 0,061 ± 0,036 ml/s; p < 0,001; EWC -0,015 ± 0,032 ml/s; p = 0,030; FENa+ 0,029 ± 0,016; p < 0,001), 6 pacientů mělo jinou příčinu hyponatremie. SIADH jsme nezjistili u žádného pacienta.Závěr:
Renální funkční parametry představují snadnou a dostupnou metodu v diferenciální diagnostice hyponatremií u pacientů v neurointenzivní péči.Klíčová slova:
hyponatremie – hypoosmolalita – CSW – SIADH – renální funkční parametryÚvod
Hyponatremie patří mezi časté poruchy efektivní osmolality u akutního onemocnění mozku [1,2]. U subarachnoidálního krvácení (SAK) se vyskytuje až u 30–40 % pacientů [3–6]. Nachází se i u dalších mozkových lézí: u pacientů s tumorem, abscesem mozku, bakteriální meningitidou, hydrocefalem a po kraniocerebrálním traumatu (KCT) [5].
Hyponatremie znamená vážnou komplikaci v neurointenzivní péči, je spojena s vyšší morbiditou a mortalitou [3]. Její závažnost spočívá ve vzniku edému mozku. Akutní hyponatremie vede k signifikantnímu zvětšení objemu kontuze u traumatu na zvířecím modelu [7]. Unterberg et al [8] udávají hyponatremii jako příčinu refrakterní nitrolební hypertenze u pacientů s KCT. Wijdicks [9] sledoval vztah hyponatremie a vzniku ischemie u SAK. Signifikantně větší výskyt ischemií nalezl u pacientů s hyponatremií.
Edém mozku je výsledkem základní regulace osmolality v organizmu. Jedná se o udržování stejné osmolality v extracelulární (ECT) a intracelulární tekutině (ICT). Pokud nastává změna osmolality v určitém prostoru, vzniklý osmotický gradient je následně vyrovnáván přesunem vody. Na efektivní osmolalitě ECT se nejvíce podílí natrium. Při jeho poklesu dochází k hypotonicitě ECT a osmotický gradient mezi ECT a ICT vede k přesunu vody z ECT do buněk [10].
U akutního onemocnění mozku byla hyponatremie poprvé popsaná Petersem v roce 1950 [11]. Nyní je nejčastěji spojována se 2 syndromy vznikajícími na základě zcela odlišných příčin (tab. 1). Jedná se depleční hyponatremii způsobenou ztrátami natria močí (natriurézou) u syndromu cerebrálně podmíněné ztráty soli (cerebral salt wasting, CSW syndrome) a diluční hyponatremii, která vzniká při retenci čisté vody u syndromu nepřiměřené sekrece antidiuretického hormonu (syndrome of inappropriate secretion of antidiuretic hormone, SIADH). Prvním popsaným syndromem v literatuře byl CSW syndrom, publikovaný Petersem (1950) a Cortem (1954) [11,12]. Později v roce 1957 Schwartz uvedl syndrom SIADH [13]. Diferenciální diagnostika obou syndromů podle základních laboratorních parametrů (měřená sérová osmolalita, natremie, poměr močové osmolality k sérové) není možná, protože je pro oba syndromy shodná (hypoosmolalita, osmolalita moči vyšší než sérová) [14]. Jejich rozlišení však umožňují renální funkční parametry, které byly poprvé v této souvislosti vyhodnoceny v 90. letech [15,16]. Jedná se o dopočítané parametry renálních funkcí. V 1992 Lolin a Jackowski [15] použili první vypočítané ukazatele – osmolální clearance (COsm), clearance bezsolutové vody (CH2O), frakční exkrece natria (FENa+) a frakční exkrece vody (FEH2O). Mezi novější parametry patří clearance elektrolytová (electrolyte clearance, CEl), clearance bezelektrolytové vody (electrolyte-free water clearance, EWC) a clearance natria (CNa+). Tyto parametry tzv. „druhé řady“ jsou vhodnější pro sledování poruch natriového metabolizmu, zejména EWC, protože lépe charakterizují poruchy efektivní osmolality a poruchy osy antidiuretický hormon (ADH) – ledviny [17]. Diferenciální diagnostika obou výše uvedených syndromů je pomocí těchto parametrů poměrně jednoduchá, ale za hlavní přednost považujeme dostupnost v klinické praxi. Uplatnění spatřujeme také při sledování efektu léčby. U CSW, kdy je přítomna natriuréza, jsou zvýšené odpady natria v moči (dUNa+), zvýšená COsm, CEl, CNa+, FENa+ a FEH2O. Pro SIADH vzhledem k retenci čisté vody je charakteristická negativní EWC. Stanovení hormonů, které se podílejí na vzniku jednotlivých syndromů, ADH u SIADH a natriuretických peptidů (NP) u CWS, je v každodenní klinické praxi nedostupné. Význam jejich stanovení klesá s obligátním rozvojem kompenzačních mechanizmů [14]. Renální funkční parametry zaujímají primární místo v diagnostice hyponatremií. Diferenciální diagnóza hyponatremií je přitom esenciální, protože různý mechanizmus vzniku předpokládá zcela odlišnou terapii [4,18].
Table 1. Charakteristika syndromu CSW a SIADH. 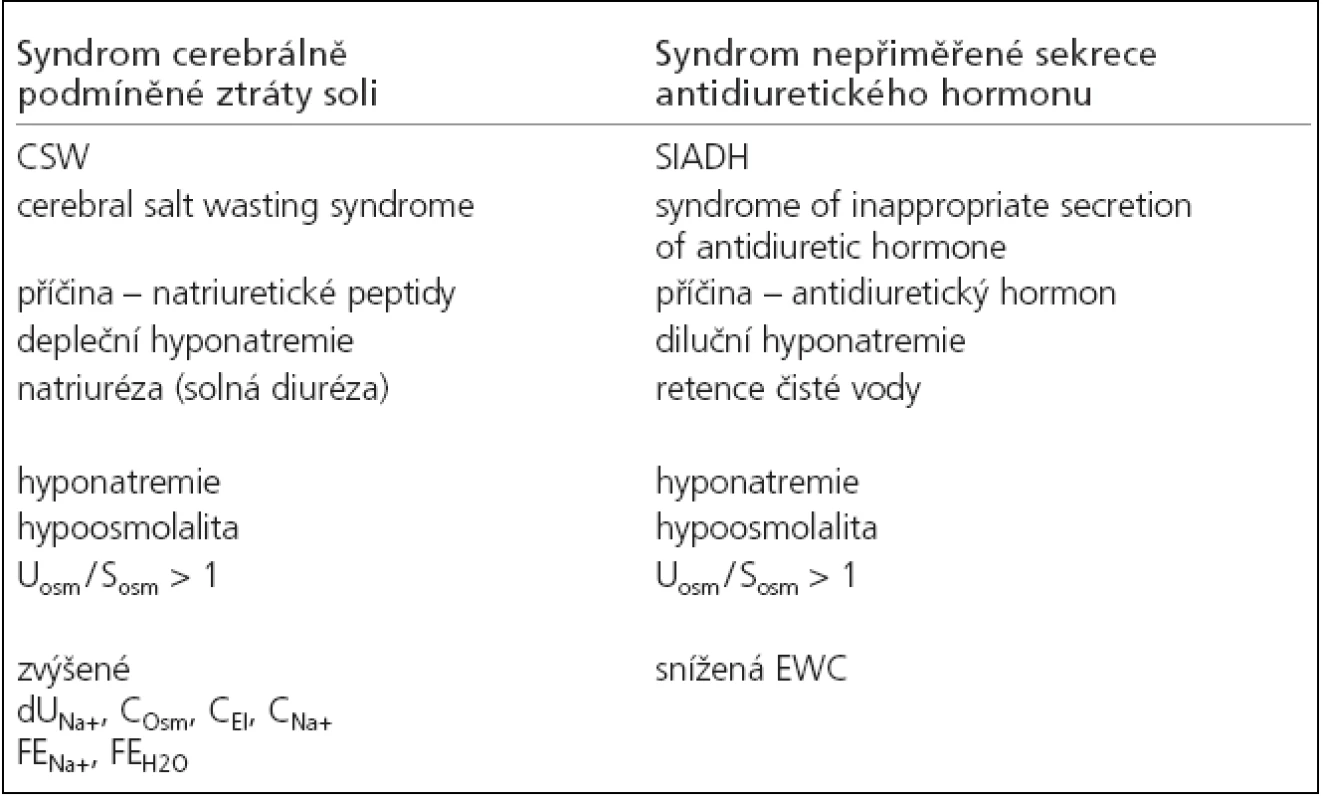
V následující práci jsme si stanovili cíl zhodnotit možnost diagnostiky hyponatremií prostřednictvím vyšetření renálních funkčních parametrů u pacientů s akutním onemocněním mozku na naší neurologicko-neurochirurgické jednotce intenzivní péče (NNJIP).
Soubor a metodika
Retrospektivní studie zahrnovala všechny pacienty s akutním onemocněním mozku hospitalizované na NNJIP za období 5 let, jejichž hodnoty sérového natria se pohybovaly pod 135 mmol/l.
V 1. fázi jsme hyponatremie rozdělili podle měřené sérové osmolality (SOsm, referenční meze 275–295 mmol/kg) do 3 skupin: 1. hyponatremie s hodnotou SOsm v referenčních mezích, 2. hyponatremie s hyperosmolalitou (SOsm > 295 mmol/kg) a 3. hyponatremie s hypoosmolalitou (SOsm < 275 mmol/kg). Byla provedena podrobná analýza jednotlivých skupin: diagnóza onemocnění mozku, typ operace a časový vztah k operaci, doba hospitalizace, doba trvání hyponatremie, Glasgow coma scale (GCS) při vzniku hyponatremie, mortalita na NNJIP (porovnána s mortalitou u normonatremických pacientů), vliv terapie (diuretika, manitol) a infuzních roztoků. Dále byl sledován příjem tekutin (ml/den), diuréza (ml/den), bilance tekutin (ml/den), z biochemických sérových parametrů: kalium, chloridy, glykemie, proteiny, albumin, urea, kreatinin.
V další fázi byla provedena diferenciální diagnostika hyponatremií s hypoosmolalitou pomocí měřených a vypočtených funkčních renálních pararametrů: denní odpady natria v moči (dUNa+, referenční meze 100–260 mmol/den), osmolální clearance (COsm, referenční meze 0,03–0,05 ml/s), elektrolytová clearance (CEl, meze 0,011–0,023 ml/s), clearance natria (CNa+, referenční meze 0,008–0,016 ml/s), clearance bezsolutové vody (CH2O, referenční meze -0,027 až 0,007 ml/s), bezelektrolytové vody (EWC, referenční meze -0,000 ± 0,006 ), frakční exkrece osmolální (FEOsm, referenční meze 0,01–0,035), frakční exkrece natria (FENa+, referenční meze 0,004–0,012 ml/s) a frakční exkrece vody (FEH2O, referenční meze 0,01–0,02). Dopočítané renální parametry byly přiřazeny k měřeným funkčním parametrům do biochemického přehledu na oddělení klinické biochemie.
Jako samostatný podsoubor byly vybrány hyponatremie s hodnotou sérového natria (SNa+) pod 130 mmol/l. Sledovali jsme vztah těchto závažných hyponatremií k ostatním, tj. s hodnotou SNa+ 130–134 mmol/l.
Biochemická stanovení byla prováděna na automatickém analyzátoru COBAS Integra 800 firmy Roche s výjimkou osmolality, která byla měřena na kryoskopickém osmometru Fiske 210 firmy Advanced. Pro výpočet hodnot clearance a frakčních exkrecí byly použity funkce z LIS Stapro s.r.o. Rovnice pro výpočet bezelektrolytové vody a rovněž očekávaná rozmezí k těmto renálním parametrům byly převzaty z práce Shoker AS [16].
Výsledky byly zpracovány programem Statistika 7.1, StatSoft, Inc. (2005) STATISTICA (data analysis software system), version 7.1. www.statsoft.com. U žádného parametru nebyla prokázána normalita, proto byl pro hodnocení rozdílu ve spojitém parametru použit neparametrický Kruskal-Wallis ANOVA test. Pro testování kategoriálních proměnných byl použit M-L Chi-square test. Pro porovnání hodnot měřených parametrů s normou byl použit jednovýběrový t-test.
Výsledky
Za sledované 5leté období jsme zjistili hyponatremii u 251 pacienta. Soubor zahrnoval 160 mužů a 91 ženu s průměrným věkem 53,9 ± 16,0 let (rozmezí 9–86 let). Průměrná doba hospitalizace činila 11,8 ± 10,1 dne (rozmezí 1–73 dny). Nejčastější diagnózou v našem souboru představovala cévní mozková příhoda (101 pacient; 40,2 %: subarachnoidální krvácení 40,6 %, intracerebrální hematom 35,6 %, ischemická cévní mozková příhoda 23,8 %). Dále byli zastoupeni pacienti s tumorem (80; 31,9 %), kraniocerebrálním traumatem (33; 13,1 %), infekcí (13; 5,2 %), epilepsií (12; 4,8 %), hydrocefalem (7; 2,8 %) a ostatní diagnózy (5; 2,0 %). Převážná část pacientů (188; 74,9 %) byla operována a hyponatremie nejčastěji vznikla až po operaci (161 pacient).
Celkem bylo zaznamenáno 736 dní hyponatremie s průměrnou dobou trvání 2,9 ± 3,8 dne (rozmezí 1–39 dnů). Průměrné GCS při vzniku hyponatremie činilo 13,6 ± 2,2 (rozmezí 3–15). U žádného pacienta nedošlo v souvislosti se změnami hladin natria k pontinní myelinolýze.
Hyponatremie byla nejčastěji spojena se sérovou normoosmolalitou (154 pacienti, 297 dní), část s hyperosmolalitou (38 pacientů, 41 den) a pouze 50 pacientů (169 dní) mělo hypoosmolalitu séra (graf 1). Ostatní hyponatremie byly bez měřené sérové osmolality. Podrobnou charakteristiku jednotlivých skupin uvádí tab. 2 a 3.
Graph 1. Počet pacientů s hyponatremií ve vztahu k měřené sérové osmolalitě. 
Table 2. Základní charakteristika pacientů s normoosmolální, hyperosmolální a hypoosmolální hyponatremií. 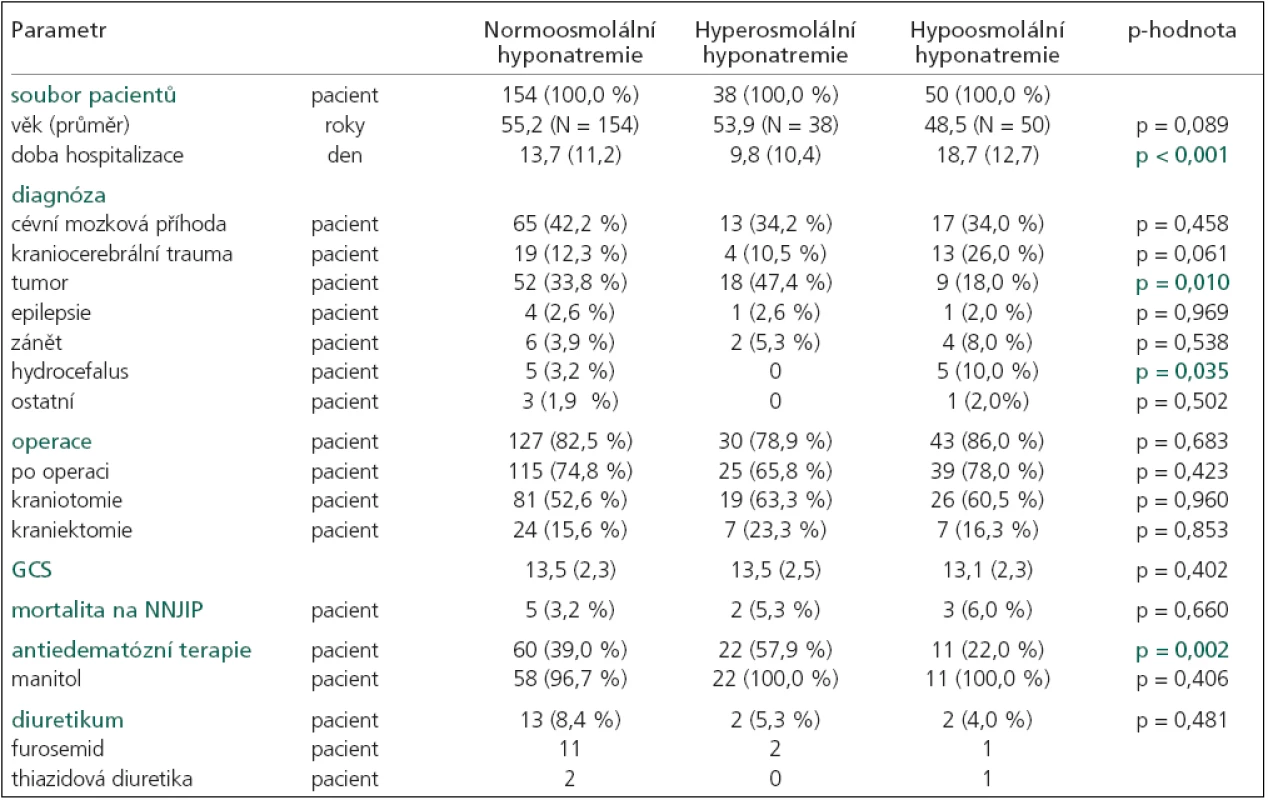
p-hodnota určuje hladinu významnosti, na které se jednotlivé typy hyponatremií mezi sebou navzájem liší (každá p-hodnota je výsledkem ANOVA testu pro více skupin a platí pro parametr na korespondujícím řádku tabulky), průměr (směrodatná odchylka), GCS při vzniku hyponatremie. Table 3. Charakteristika hyponatremií rozdělených podle měřené sérové osmolality do 3 skupin: 1. normoosmolální, 2. hyperosmolální a 3. hypoosmolální. 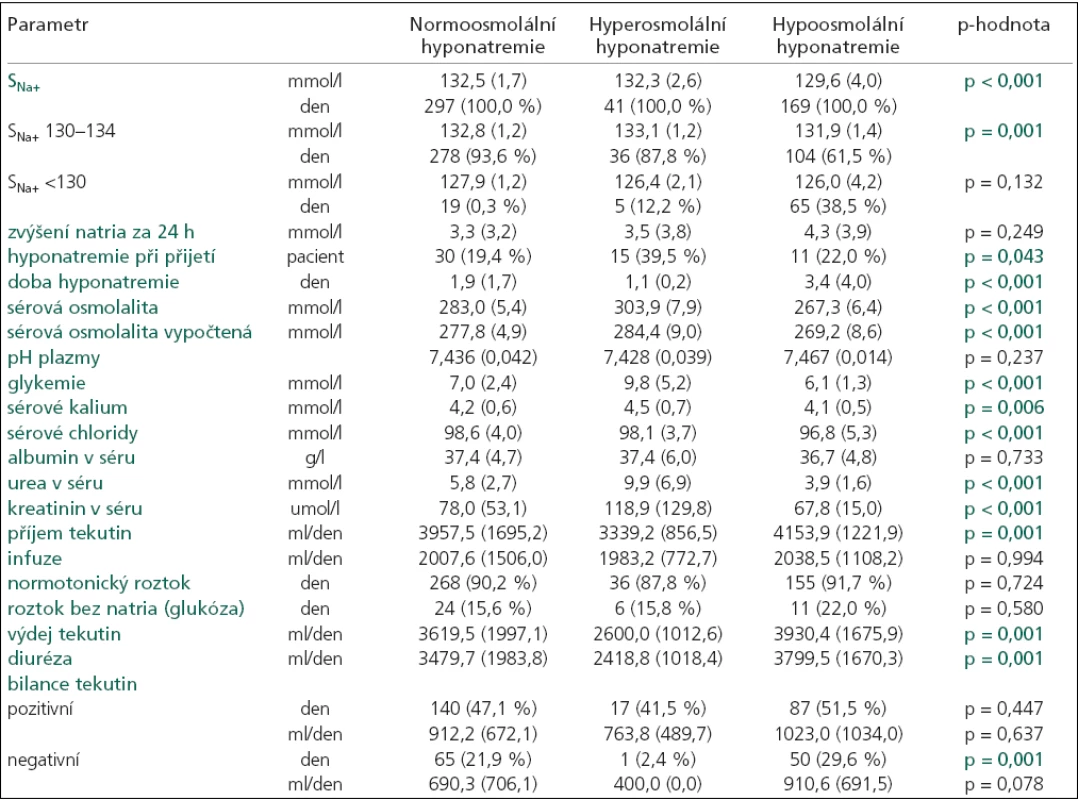
p-hodnota určuje hladinu významnosti, na které se jednotlivé typy hyponatremií mezi sebou navzájem liší (každá p-hodnota je výsledkem ANOVA testu pro více skupin a platí pro parametr na korespondujícím řádku tabulky), průměr (směrodatná odchylka), SNa+ – natremie, den = celkový počet dní. Průměrná hodnota sérového natria byla významně nižší u hypoosmolální hyponatremie (p = 0,001). V této skupině se nejvíce hodnot SNa+ nacházelo pod hranicí 130 a také doba hyponatremie byla významně delší (p = 0,001). Průměrná doba trvání hypoosmolální hyponatremie činila 3,4 ± 4 dny (rozmezí 1–22 dny). Nejkratší dobu trvaly hyperosmolální hyponatremie (průměrná doba 1,1 ± 0,2; rozmezí 1–2 dny). Normoosmolální hyponatremie se pohybovaly uprostřed, průměrná doba činila 1,9 ± 1,7 dne (rozmezí 1–13 dní).
Antiedematózní terapie manitolem byla nejčastěji podávána u pacientů s hyperosmolální hyponatremií (57,9 %). V této skupině hyponatremií jsme také zaznamenali statisticky významně vyšší hodnoty glykemie (p = 0,001) a urey v séru (p = 0,001). Hyperglykemii mělo 7 pacientů, zvýšenou ureu 6 a oba zvýšené biochemické parametry současně 6 pacientů. Všechny tyto vlivy se podílely i na příčině normoosmolální hyponatremie. Manitol mělo 58 (39 %) pacientů, hyperglykemie 2, zvýšenou ureu 4 a oba zvýšené parametry 4 pacienti. Další příčiny podílející se na vzniku normoosmolální hyponatremie ukazuje tab. 3.
Diferenciální diagnostiku hypoosmolálních hyponatremií bylo možné provést jen u 31 (62 %) pacienta, protože ostatní pacienti neměli renální funkční parametry. CSW byl diagnostikován u 25 pacientů (tab. 4), 6 pacientů mělo jinou příčinu hyponatremie. U 4 z nich byla hyponatremie následkem nesprávně podaného desmopresinu. SIADH nebylo diagnostikováno u žádného pacienta.
Table 4. Renální funkční parametry u CSW. 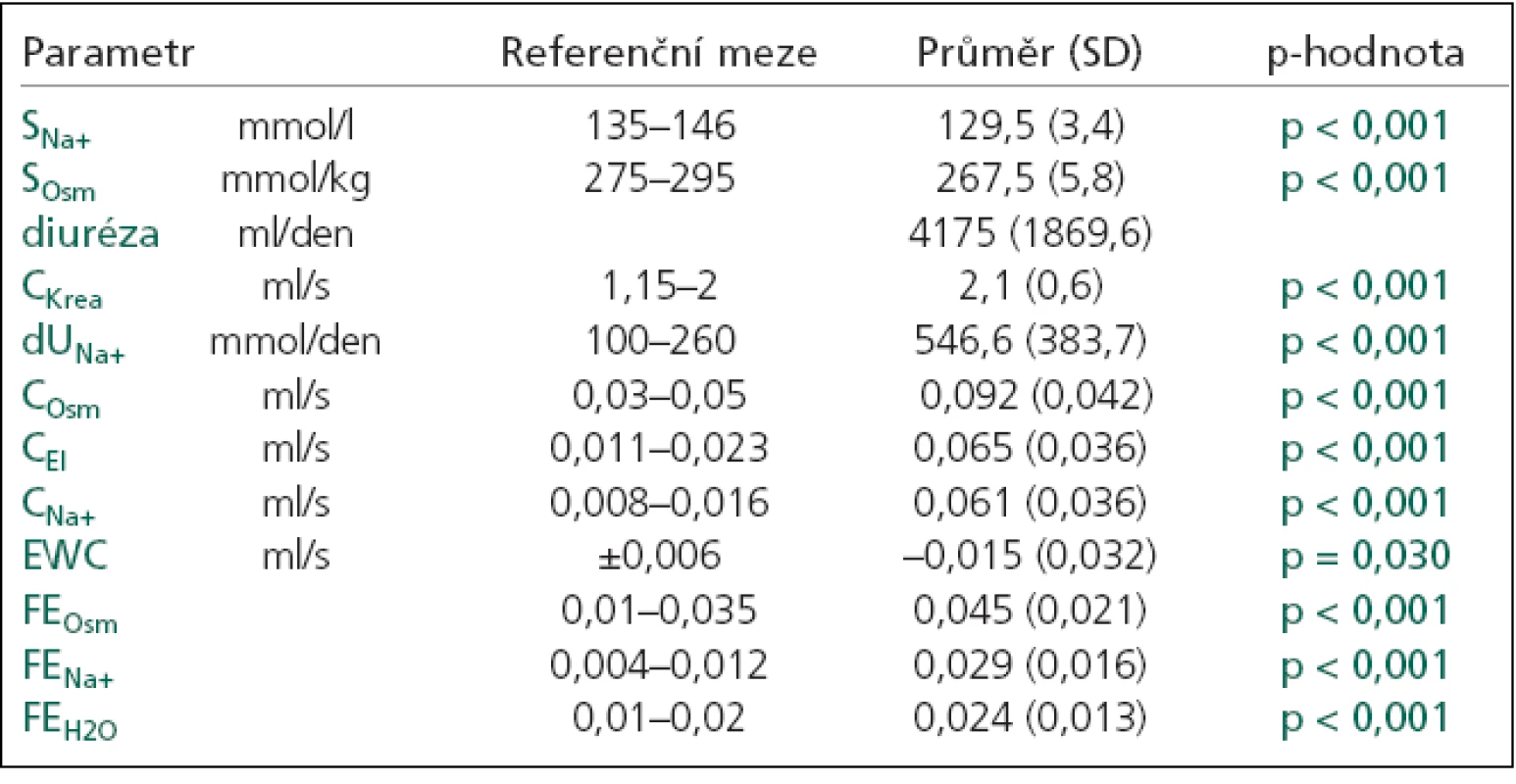
SNa+: natremie, SOsm: měřená sérová osmolalita, CKrea: clearance kreatininu, dUNa+: denní odpady natria v moči, COsm: osmolální clearance, CEl:elektrolytová clearance, CNa+: clearance natria, CH2O: clearance bezsolutové vody, EWC: clearance bezelektrolytové vody, FEOsm: frakční exkrece osmolální, FENa+: frakční exkrece natria, FEH2O: frakční exkrece vody, p-hodnota: statistická významnost vztažena k normě. Jednotlivé typy hyponatremií se významně nelišily v mortalitě na NNJIP (p = 0,660), ale mezi nejzávažnější patřila s 6% mortalitou hypoosmolální hyponatremie (3 pacienti: 1 KCT, 1 tumor, 1 hydrocefalus). Narozdíl od pacientů s normonatremií, kde mortalita na NNJIP činila 1,6 % (CMP 63,0 %, tumor 29,6 %, KCT 3,7 %, hydrocefalus 3,7 %).
Z 251 pacienta s hyponatremií se závažné hyponatremie s hodnotou sérového natria pod 130 mmol/l vyskytly u 51 pacienta (21 %). Celkem se jednalo o 106 dní, nejčastěji jsme zaznamenali hypoosmolální hyponatremie (65 dní, 61 %), méně normoosmolální (19 dní, 18 %) a nejméně byla zastoupena hyperosmolální hyponatremie (5 dní, 5 %). Zbylé hyponatremie neměly změřenou sérovou osmolalitu. U pacientů s touto závažnou hyponatremií byla sice významně delší doba hospitalizace (p < 0,001), doba trvání hyponatremie (p < 0,001), více cerebrálních komplikací (p < 0,001) a nižší GCS při vzniku hyponatremie (p = 0,018), nebyla však spojena s větší úmrtností na NNJIP (p = 0,103), tab. 5. Při srovnání natriurézy u hypoosmolální hyponatremie mezi skupinou s SNa+ pod 130 mmol/l a 130–134 mmol/l nebyl zjištěn významný rozdíl (p = 0,46).
Table 5. Srovnání skupiny hyponatremií s hodnotami sérového natria pod 130 mmol/l s ostatními hyponatremiemi. 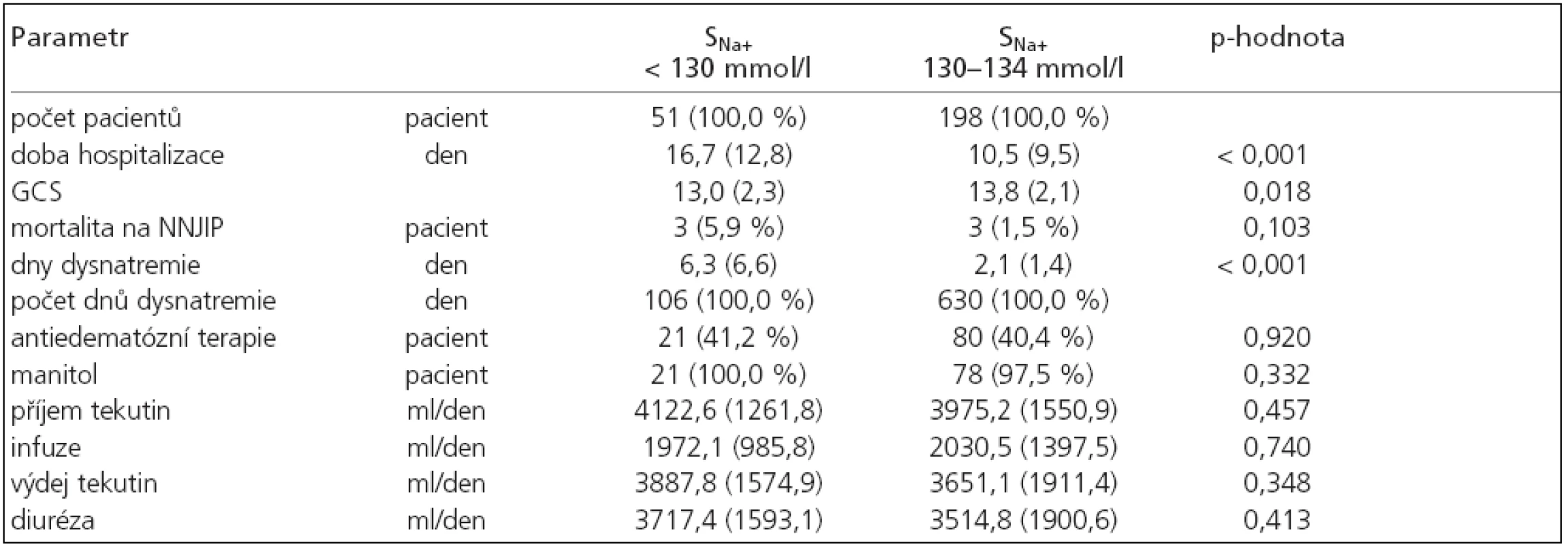
průměr (směrodatná odchylka), p-hodnota: statistické srovnání souboru hyponatremií s hodnotami sérového natria (SNa+) pod 130 mmol/l s 130–134 mmol/l, GCS: při vzniku hyponatremie. Diskuse
Hyponatremie patří mezi závažné komplikace v neurointenzivní péči, pokud je spojená s poklesem efektivní osmolality, to znamená vyskytuje-li se společně s hypoosmolalitou séra [3]. Mluvíme ale o měřené sérové osmolalitě, ne o vypočtené, která je pouze orientační a je dána součtem koncentrace natria, urey a glykemie. Význam vypočtené osmolality klesá zejména při osmoterapii manitolem, protože se s ním ve výpočtu nepočítá. Proto 1. krokem při nálezu hyponatremie je zjištění hodnoty měřené sérové osmolality.
Z našich výsledků vyplývá, že hypoosmolální hyponatremie nepatří mezi nejčastěji se vyskytující hyponatremie. Většina hyponatremií měla měřenou sérovou osmolalitu v referenčním rozmezí hodnot. Vysvětlení vidíme především v hyperglykemii, zvýšené hladině urey, osmoterapii manitolem nebo v negativní tekutinové bilanci. Vzácně můžeme při hyponatremii diagnostikovat dokonce hyperosmolalitu.
Hyponatremie je spojena s vyšší morbiditou a mortalitou u pacientů v neurointenzivní péči [3]. Vzhledem k závažnosti hyponatremie je důležitá včasná a správná diagnóza, kterou lze poměrně snadno zjistit pomocí měřených a vypočítaných renálních funkčních parametrů. Jejich velkou výhodou je dostupnost v běžné klinické praxi. Jabor [20] uvádí, že EWC by se měla stanovovat jako základní dopočtený renální funkční ukazatel. V neurointenzivní péči je hyponatremie spojována s 2 různými syndromy – častěji se vyskytujícím CSW a méně SIADH [19], což se ukázalo i v naší studii. V našem souboru jsme dokonce nenalezli žádný případ SIADH. Diagnostika však nebyla provedena u všech pacientů s hypoosmolální hyponatremií (62 %), protože u části pacientů renální funkční parametry chyběly. Při diagnostice je vždy důležité odlišit její příčinu od kompenzační reakce organizmu. V případě normonatremie s polyurií o nízké specifické váze moči, pozitivní EWC znamená kompenzační mechanizmus organizmu [20], a podáme-li desmopresin, může vzniknout hyponatremie následkem retence čisté vody. K takové situaci došlo u 4 pacientů v našem souboru.
Pokud nenacházíme typické syndromy doprovázející onemocnění mozku, CSW a SIADH, musíme se zaměřit na další příčiny hyponatremie [21]. Patří mezi ně hypokortikalizmus, hypoaldosteronizmus, polydypsie čistou vodou nebo hyponatremie u chronického etylizmu. V našem souboru jsme měli 1 pacienta s posledně jmenovanou příčinou.
Diferenciální diagnóza hyponatremií je esenciální vzhledem k různému mechanizmu vzniku a následné terapii [4,18]. U CSW [22] se jedná o substituci natria a tekutin, u SIADH [2] o restrikci tekutin a aplikaci diuretik a u hypokortikalizmu podání hydrokortizonu. Při terapii hyponatremie musíme vždy myslet na pravidla korekce natremie. Při rychlém vzestupu natremie hrozí riziko pontinní a extrapontinní myelinolýzy – poškození myelinu [23–25]. V 1. kroku při úpravě natremie je důležité si uvědomit, zda se jedná o akutní nebo chronickou hyponatremii [26]. V neurointenzivní péči se častěji setkáváme s hyponatremií akutně vzniklou. V našem souboru jsme zaznamenali jen 1 pacienta s chronickou hyponatremií. Jednalo se chronického etylika. V dalším kroku je potřeba si stanovit cílovou hodnotu natremie za 24 h. V tom případě nám častější kontroly natremie (minimálně po 6 h) usnadní předejít této závažné komplikaci. V našem 5letém sledování jsme myelinolýzu nediagnostikovali, i když jsme jednou překročili bezpečné pásmo posunu natremie. Došlo k vzestupu o 20 mmol/24 h.
Renální funkční parametry znamenají velký přínos v diagnostice hyponatremií [12,13], protože podle základních laboratorních parametrů (měřená sérová osmolalita, natremie, poměr močové osmolality k sérové) ji není možné provést. Pro oba syndromy – CSW i SIADH – vycházejí obdobné hodnoty. Po zavedení renálních funkčních parametrů došlo dokonce k přehodnocení původně diagnostikovaných SIADH na CSW [12,15].
Stanovení hormonů, které se podílejí na příčině těchto syndromů, není jednak přínosné, vzhledem ke kompenzačním změnám volumu tekutin, ale také v praxi nedostupné. U SIADH retence čisté vody vede k volumové expanzi a k následné stimulaci NP. U CSW je situace opačná, primární zvýšení NP vede k objemové depleci a k sekundárnímu zvýšení hladin ADH. Renální funkční parametry tak zaujímají primární místo v diferenciální diagnostice hyponatremií.
Závěr
Vzhledem k závažnosti hyponatremie u akutního onemocnění mozku je včasné a správné určení příčiny nutné. Zavedení renálních funkčních parametrů do klinické praxe znamená vyřešení tohoto závažného klinického problému a je vhodné pro kterékoliv pracoviště, jež se s hypoosmolálními hyponatremiemi setkává.
MUDr. Věra Špatenková
Neurocentrum
Husova 10
Krajská nemocnice
460 63 Liberec
vera.spatenkova@nemlib.cz
Přijato k recenzi: 26. 6. 2007
Přijato do tisku: 13. 11. 2007
Sources
1. Sivakumar V, Rajshekhar V, Chandy MJ. Management of neurosurgical patients with hyponatremia and natriuresis. Neurosurgery 1994; 34 : 269–274.
2. Betjes MG. Hyponatremia in acute brain disease: the cerebral salt wasting syndrome. Eur J Intern Med 2002; 13 : 9–14.
3. Fraser JF, Stieg PE. Hyponatremia in the neurosurgical patient: epidemiology, pathophysiology, diagnosis, and management. Neurosurgery 2006; 59 : 222–229.
4. Naval NS, Stevens RD, Mirski MA, Bhardwaj A. Controversies in the management of aneurysmal subarachnoid hemorrhage. Crit Care Med 2006; 34 : 511–524.
5. Harrigan MR. Cerebral salt wasting syndrome: a review. Neurosurgery 1996; 38 : 152–160.
6. Qureshi AI, Suri MF, Sung GY, Straw RN, Yahia AM, Saad M et al. Prognostic significance of hypernatremia and hyponatremia among patients with aneurysmal subarachnoid hemorrhage. Neurosurgery 2002; 50 : 749–755.
7. Ke C, Poon WS, Ng HK, Tang NL, Chan Y, Wang JY et al. The impact of acute hyponatraemia on severe traumatic brain injury in rats. Acta Neurochir Suppl 2000; 76 : 405–408.
8. Unterberg A, Kiening K, Schmiedek P, Lanksch W. Long-term observations of intracranial pressure after severe head injury. The phenomenon of secondary rise of intracranial pressure. Neurosurgery 1993; 32 : 17–23.
9. Wijdicks EF, Ropper AH, Hunnicutt EJ, Richardson GS, Nathanson JA. Atrial natriuretic factor and salt wasting after aneurysmal subarachnoid hemorrhage. Stroke 1991; 22 : 1519–1524.
10. Kazda A, Balík M. Osmolální dysbalance v intenzivní péči a jejich monitorování. Klin Biochem Metab 1996; 4 : 223–227.
11. Peters JP, Welt LG, Sims EA, Orloff J, Needham J. A salt-wasting syndrome associated with cerebral disease. Trans Assoc Am Physicians 1950; 63 : 57–64.
12. Cort JH. Cerebral salt wasting. Lancet 1954; 266 : 752–754.
13. Schwartz WB, Bennett W, Curelop S, Bartter FC. A syndrome of renal sodium loss and hyponatremia probably resulting from inappropriate secretion of antidiuretic hormone. Am J Med 1957; 23 : 529–542.
14. Kazda A, Špatenková V, Škrabálek P. Akutní onemocnění mozku – poruchy vodního a natriového hospodářství, natriuretické peptidy. Klin Biochem Metab 2003; 11 : 74–82.
15. Lolin Y, Jackowski A. Hyponatraemia in neurosurgical patients: diagnosis using derived parameters of sodium and water homeostasis. Br J Neurosurg 1992; 6 : 457–466.
16. Shoker AS. Application of the clearance concept to hyponatremic and hypernatremic disorders: a phenomenological analysis. Clin Chem 1994; 40 : 1220–1227.
17. Jabor A. Clearance bezelektrolytové vody u selhávajících ledvin, při hypernatremii a hyponatremii. Klin Biochem Metab 1997; 5 : 248–250.
18. Kröll M, Juhler M, Lindholm J. Hyponatraemia in acute brain disease. J Intern Med 1992; 232 : 291–297.
19. Berendes E, Walter M, Cullen P, Prien T, Van Aken H, Horsthemke J et al. Secretion of brain natriuretic peptide in patients with aneurysmal subarachnoid haemorrhage. Lancet 1997; 349 : 245–249.
20. Jabor A. Hodnocení poruch osmolality s využitím efektivní osmolální clearance, clearance sodíku, clearance bezelektrolytové vody a modelu extracelulárního a intracelulárního prostoru. Klin Biochem Metab 1997; 5 : 241–247.
21. Fall PJ. Hyponatremia and hypernatremia. A systematic approach to causes and their correction. Postgrad Med 2000; 107 : 75–82.
22. Singh S, Bohn D, Carlotti AP , Cusimano M, Rutka JT, Halperin ML. Cerebral salt wasting: truths, fallacies, theories, and challenges. Crit Care Med 2002; 30 : 2575–2579.
23. Adams RD, Victor M, Mancall EL. Central pontine myelinolysis: a hitherto undescribed disease occurring in alcoholic and malnourished patients. AMA Arch Neurol Psychiatry 1959; 81 : 154–172.
24. Tomlinson S, Hendy GN, O'Riordan JL. A in vivo experimental model for the study of resistance to the renal action of parathyroid hormone in man. Calcif Tissue Res 1976; 21(Suppl): 267–271.
25. Norenberg MD, Leslie KO, Robertson AS. Association between rise in serum sodium and central pontine myelinolysis. Ann Neurol 1982; 11 : 128–135.
26. Sterns RH, Cappuccio JD, Silver SM, Cohen EP. Neurologic sequelae after treatment of severe hyponatremia: a multicenter perspective. J Am Soc Nephrol 1994; 4 : 1522–1530.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 2-
All articles in this issue
- Roztroušená skleróza
- Zlyhanie farmakologickej antiepileptickej liečby
- Patofyziologie bloku vedení u neuromuskulárních chorob
- Žena a iktus
- Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
- Úskalí diagnostiky a léčby flekčně-distrakčních poranění hrudní a bederní páteře: prospektivní studie
- Efekt endoskopické a klasické operace pro syndrom karpálního tunelu
- Mírná řízená hypotermie jako neuroprotektivní metoda při pozdních ischemických komplikacích v resuscitační péči u pacientů s těžkým spontánním subarachnoidálním krvácením při ruptuře aneuryzmatu
- Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí
- Familiárna agregácia Parkinsonovej choroby: genealogická štúdia
- PCR diagnostika herpetických virů u pacientů s akutní „idiopatickou“ parézou lícního nervu
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Roztroušená skleróza
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

