-
Medical journals
- Career
Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
Authors: P. Bártová 1; D. Školoudík 1,2; T. Fadrná 1; P. Ressner 3; M. Bar 1; R. Herzig 2; P. Kaňovský 2
Authors‘ workplace: Neurologická klinika FNsP Ostrava 1; Neurologická klinika LF UP a FN Olomouc 2; Neurologické oddělení nemocnice Nový Jičín 3
Published in: Cesk Slov Neurol N 2007; 70/103(6): 653-657
Category: Original Paper
Předneseno formou přednášky na 16th Meeting of the European Neurological Society, Lausanne, Švýcarsko, 29. 5. 2006, 21. sjezdu Slovenských a českých mladých neurologů, Martin, Slovensko, 17. 2. 2006, 6. neurosonologických dnnech v Olomouci 5. 5. 2006 a formou posteru na 10th Congress of the European Federation of Neurological Societies, Glasgow, UK 4. 9. 2006 a 10th International Congress of Parkinsons disease and Movement Disorders, Kyoto, Japonsko 2. 11. 2006.
Overview
Hyperechogenní a rozšířená oblast substantia nigra je detekovatelná u více než 90 % pacientů s Parkinsonovou nemocí (PN). U zdravé populace se však tento nález vyskytuje maximálně v 10 %. Cílem naším práce bylo zjistit zastoupení nálezu hyperechogenní či rozšířené substantia nigra u pacientů s atypickým parkinsonským syndromem (APS).
Metodika:
Během 15 měsíců jsme vyšetřili pomocí transkraniální sonografie 209 pacientů s PN, multisystémovou atrofií (MSA), vaskulárním parkinsonským syndromem (VP) a esenciálním tremorem (ET). Jako kontrolní skupina byli vybráni pacienti s prokázanou PN a zdraví dobrovolníci.Výsledky:
Hyperechogenní SN byla nalezena u 42,9 % u pacientů s MSA, 10 % u ET, a 18,2 % u VP. Rozšířená oblast SN větší než 0,25 cm2 byla detekována u pacientů s MSA v 50 %, u VP ve 20 % a u ET ve 27,3 %. Hyperechogenní, rozšířená SN byla signifikantně častější u PN (84,7 %) a MSA (50 %) (p > 0,05) ve srovnání s VP (27,3 %), ET (20 %) a zdravými dobrovolníky (0 %).Závěr:
Nález hyperechogenní, rozšířená oblast SN je signifikantně častější u pacientů s PN a MSA. TCS detekce SN může být použita jako další metoda v diferenciální diagnostice PN a atypických parkinsonských syndromů.Klíčová slova:
transkraniální sonografie – substantia nigra – multisystémové atrofie – vaskulární parkinsonizmus – esenciální tremorÚvod
Rozlišení mezi idiopatickou Parkinsonovou chorobou (PN) a atypickými parkinsonskými syndromy (APS) podle klinických kritérii není vždy jednoznačné, zvláště v počátečních stadiích onemocnění. [1,2]. Zobrazovací metody, především počítačovou tomografii (CT) a magnetickou rezonanci (MRI), lze využít v diferenciální diagnostice parkinsonských syndromů k detekci strukturální léze centrální nervové soustavy a vyloučení jiné příčiny poškození centrální nervové soustavy [3]. MRI mozku však často neprokazuje žádnou patologii v počátečních stadiích onemocnění, a to nejen u PN, ale také atypických parkinsonských syndromů včetně multisystémové atrofie (MSA) [1-5].
Jednofotonovou emisní tomografii (SPECT) a pozitronovou emisní tomografii (PET) lze využít u pacientů s parkinsonským syndromem k detekci funkčního postižení jader mozkového kmene, bazálních ganglií a mozečku. Avšak pro jejich obtížnou dostupnost a finanční náročnost je lze využít jen u omezeného počtu pacientů. [6,7]. Indikací pro tato vyšetření je především odlišení esenciálního tremoru od Parkinsonovy choroby, ev dalších neurodegenerativních onemocnění [8]. Senzitivita a specificita těchto vyšetření je však stále relativně nízká [6-8].
Transkraniální sonografie (TCS) je neinvazivní metodou, která dokáže zobrazit strukturální postižení nigrostriatálního systému [9-11]. První práce s průkazem hyperechogenní, rozšířené substantia nigra (SN) u pacientů s PN pomocí TCS byla publikována již v roce 1995 [9]. Etiopatogeneticky se spekuluje o porušení metabolizmu železa a dalších kovů se zvýšeným ukládáním v oblasti SN a bazálních ganglií [12,13]. Několik prací z posledních let potvrdilo, že hyperechogenní, rozšířenou oblast SN lze při TCS vyšetření detekovat u více než 88 % pacientů s PN [10,11,14,15].
Cílem naší studie bylo zhodnotit echogenitu a velikost SN u pacientů s MSA, vaskulárním parkinsonským syndromem (VP) a esenciálním tremorem (ET) ve srovnání s pacienty s PN a zdravými dobrovolníky.
Soubor a metodika
V průběhu 15 měsíců bylo do studie zařazeno celkem 202 pacientů. U 8 pacientů byla stanovena diagnóza MSA dle diagnostických kritérií dle Quina [5], u 10 pacientů diagnóza ET dle kritérií Esential tremor consortium [16] a u 11 pacientů diagnóza VP dle skóre pro vaskulární parkinsonský syndrom [17,18].
Jako kontrolní skupina (KS) bylo vybráno 111 pacientů s parkinsonovu nemocí, u kterých bylo provedeno TCS vyšetření v letech 2005-2006. Druhou KS tvořilo celkem 60 dobrovolníků bez extrapyramidové symptomatiky. Základní charakteristiky pacientů v jednotlivých skupinách a dobrovolníků uvádí tab. 1.
Table 1. Charakteristika zdravých dobrovolníků a pacientů v jednotlivých skupinách. 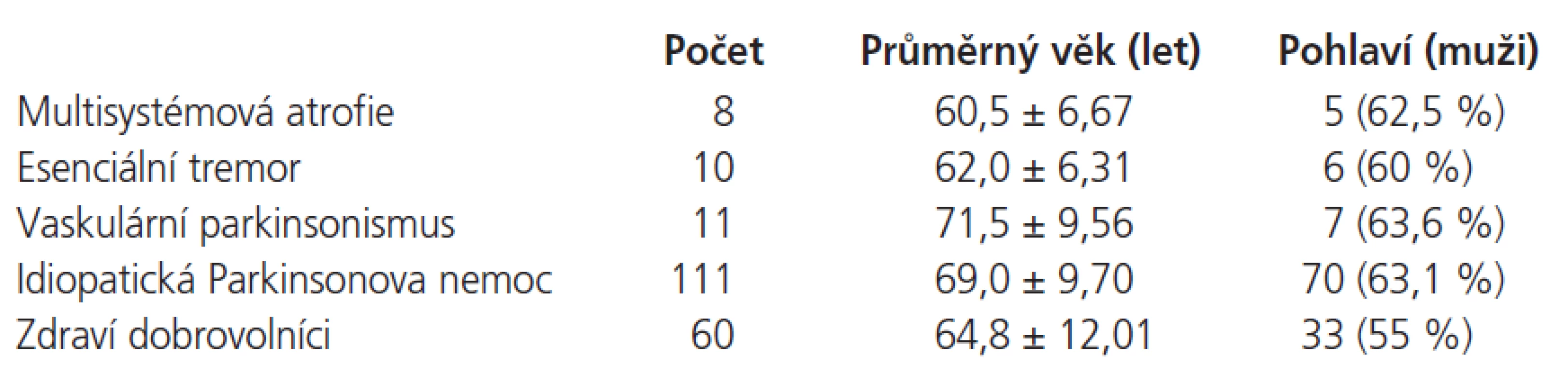
Všem pacientům bylo provedeno TCS vyšetření oblasti SN z transtemporálního přístupu (obr. 1). Vyšetření byla provedena zkušeným lékařem sonografistou, který neměl informaci o diagnóze pacientů. K ultrazvukovému vyšetření byl použit přistroj Philips HDI 5000 (Philips, Bothel , USA) se sondou 2-4 MHz (P 4-2) a penetrační hloubky 16 cm. Pro posouzení echogenity signálu sledované tkáně byla použita semikvantitativní škála – (tab. 2) [14]. Zároveň byl měřen obsah zobrazené oblasti SN pomocí programu Vista Matrix (SkillCrest LLC, Chicago, USA) (obr. 2).
Image 1. Transkraniální sonografické vyšetření oblasti substantia nigra z transtemporálního přístupu. 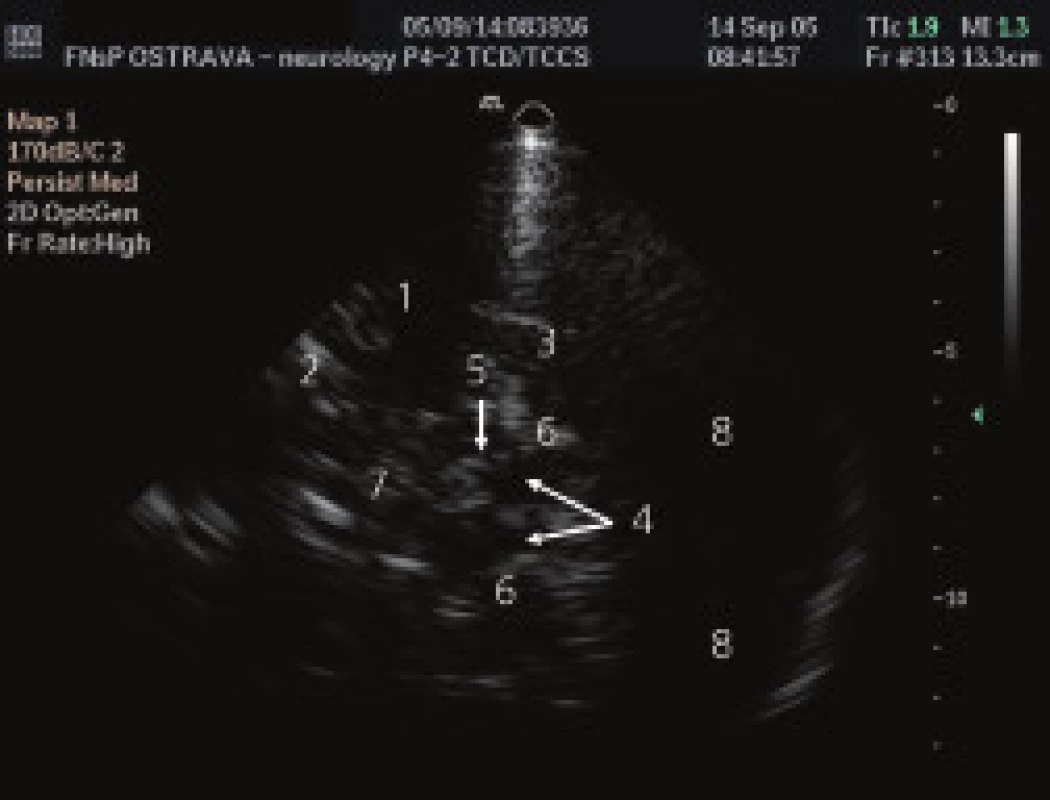
1 – a. cerebri media, 2 – malé křídlo sfenoidální kosti, 3 – horní hrana pyramidy, 4 – mesencephalon, 5 – substantia nigra, 6 – perimezencefalické cistrny, 7 – třetí komora, 8 – mozeček Table 2. Škála echogenity substantia nigra. 
Image 2. Transkraniální sonografické vyšetření – měření obsahu substantia nigra, echogenita stupeň III, obsah 0,59 cm<sup>2</sup>. 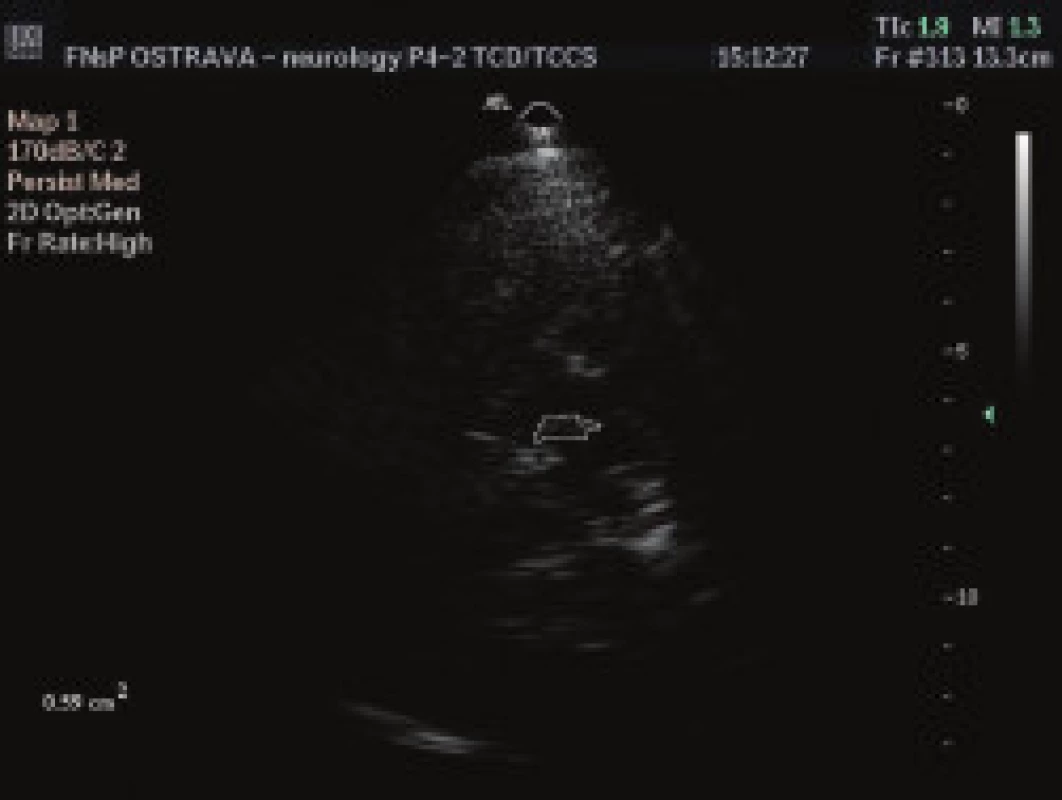
Celá studie byla provedena v souladu s Helsinskou deklarací z r. 1975 (revidovanou v r. 1983) a byla schválena etickou lékařskou komisí FN.
Statistické hodnocení
Pro statistické hodnocení byly vybrány jako hraniční hodnoty echogenity stupně 2 a 3 a velikost substantia nigra 0,25 cm2. Pro statistické zpracování byly použity Mannův-Whitneyův test a Studentův t-test.
Výsledky
Do studie bylo vybráno celkem 31 pacientů s atypickým parkinsonským syndromem, z nichž 2 pacienti (6 %) byli vyřazeni pro neprostupné transtemporální okno při TCS vyšetření. Všichni pacienti byli starší 60 let. Bližší charakteristika pacientů je uvedena v tab. 1.
U všech 8 pacientů s MSA bylo klinické stadium onemocnění podle škály Hoehnové a Yahra (HY) stanoveno stupněm 3 nebo 4 a MRI mozku prokazovala atrofii kmene a striata. Rozložení klinických syndromů a odpovídavosti na L-dopu zobrazuje tab. 3.
Table 3. Klinické příznaky u pacientů s multisystémovou atrofií. 
Ve druhé skupině 11 pacientů s VP bylo klinické stadium onemocnění dle HY škála v rozmezí 2. až 4. stupně. Podle skóre pro vaskulární parkinsonský syndrom [17,18] dosáhlo 36,3 % pacientů 2 body, 54,6 % pacientů 3 body a 9,1 % pacientů 4 body. U všech pacientů s VP zobrazovací metody prokázaly difuzní vaskulární postižení centrální nervové soustavy nebo lakunární infarkty ve více oblastech (CT mozku u 36,3 % pacientů , MR mozku u 36,3 % pacientů a neurosonologické vyšetření u 27,2 % pacientů). Ischemické změny v bazálních gangliích byly detekovány u 27,3 % pacientů. Klinicky bylo postižení dolní části těla, tzv. lower body parkinsonismus, patrno u 72,6 % pacientů. U 45 % pacientů byla diagnostikovaná demence a u 81,8 % další příznaky spojené s multiinfarktovým postižením CNS jako anxieta, posturální tremor, cerebelární syndrom, pyramidové jevy či hemiatetóza. U 18,2 % byl parkinsonský syndrom podobný Parkinsonově chorobě s částečnou odpovídavostí na L-dopu.
Třetí skupinou pacientů byl o 12 pacientů s esenciálním tremorem. Všichni pacienti měli progresivní průběh onemocnění, oboustranný posturální tremor horních končetin, u 30 % i tremor hlavy. Rodinný výskyt esenciálního tremoru byl u 30 % pacientů a u 50 % byl přítomný pozitivní alkoholový test se zmírněním tremoru. Byly vyloučeny jiné příčiny tremoru při ložiskových změnách mozku (dle CT a MRI vyšetření), endokrinní či psychické příčiny.
Porovnání echogenity a velikosti SN v jednotlivých skupinách ukazuje tab. 4. Zastoupení echogenity vyšší než 2 a zároveň rozšíření obsahu SN nad 0,25 cm2 v jednotlivých skupinách ve srovnání s pacienty s PN a zdravými dobrovolníky ukazuje tab. 5.
Table 4. Rozložení echogenity a obsahu SN. 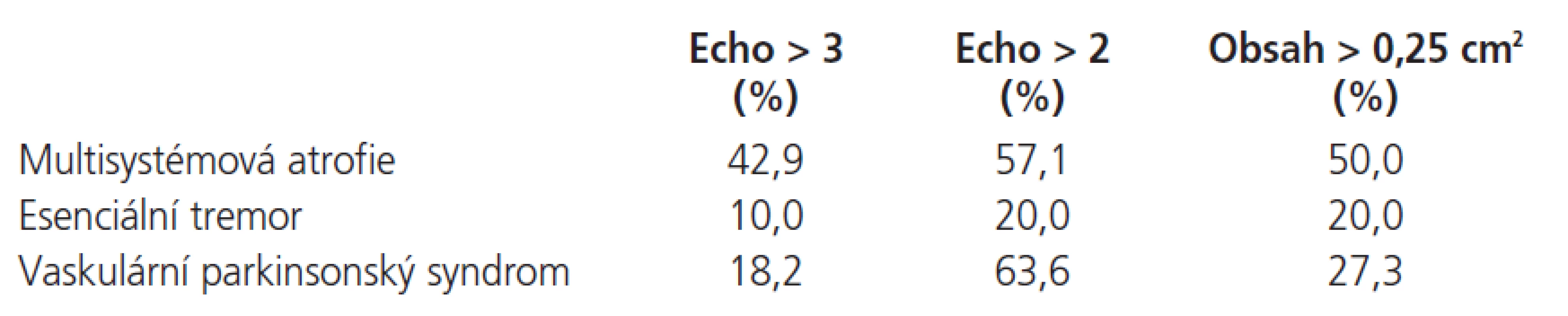
Table 5. Srovnání nálezu rozšířené a hyperechogenní SN u pacientů s multisystémovou atrofií, esenciálním tremorem, vaskulárním parkinsonským syndromem, idiopatickou Parkinsonovou chorobou a dobrovolníků bez extrapyramidové symptomatiky. 
Diskuse
U pacientů s PN a atypickým parkinsonským syndromem lze detekovat pomocí TCS rozšířenou, hyperechogenní SN [10,11,14]. U pacientů s PN lze pomocí TCS detekovat hyperechogenní, rozšířenou SN ve více než 88 % případů [10,11,14]. U parkinsonských syndromů je hyperechogenní, rozšířená SN detekovatelná u podstatně menšího procenta pacientů [1,2] .V našem souboru u MSA pacientů byla detekovaná hyperechogenní (>3) v 42,9 % a středně echogenní (3) u 14,2 % pacientů. Rozšířená oblast SN nad 0,25 cm2 byla detekován u 50 % pacientů. Behnke et al nalezli také hyperechogenní SN u 25 % pacientů s MSA, středně echogenní SN pak u dalších 37,5 %. U většiny těchto pacientů byl detekován také hyperechogenní nucleus lentiformis [1,2].
Výsledek nálezu hyperechogenní, rozšíření SN u pacientů s ET v naší studii byl pouze u 20 %, což nebylo významně odlišné od nálezů ve zdravé populaci, kde je udáván výskyt hyperechogenní, rozšíření SN v 8–10 % [12,13]. Signifikantní rozdíl v echogenitě SN u pacientů s ET nenalezli ani Niehaus et al [15].
V našem souboru pacientů s VP byla hyperechogenní SN (>3} detekována v 18,2 % případů a středně echogenní SN (3) u 45,4 % pacientů. V dostupných literárních zdrojích jsme zatím nenalezli jinou práci studující TCS nálezy u pacientů s VP.
Přesná příčina hyperechogenity a rozšíření SN u PN a parkinsonských syndromů zatím není známa. Výsledky výzkumů post mortem na zvířecích modelech uvádějí souvislost s metabolizmem železa a jeho ukládáním v SN. Je možné, že i u parkinsonských atypických syndromů, jako je MSA a VP, je hyperechogenní rozšířená SN způsobena tímto mechanizmem. Důvody, proč u těchto atypických parkinsonských syndromů vznikají různé poruchy metabolizmu železa, budou předmětem dalších výzkumů. Zvažuje se také možnost příčin neurální degenerace v oblasti SN a souvislost této degenerace s působením toxických expozic, jako jsou pesticidy, těžké kovy, nebo poraněním bazálních ganglií, ev vliv oxidativního stresu [12,13]. Autoři spekulují také možný vliv pouhé atrofie jádra SN.
U pacientů s PN je prokázána určitá závislost velikosti hyperechogenní SN na délce trvání choroby, tíži onemocnění a věku pacientů. Vzhledem k omezenému počtu pacientů s APS jsme v našem souboru tyto faktory zatím nehodnotili.
Je třeba zmínit také omezení naší studie. Sonografické vyšetření uvedených struktur je závislé na erudici vyšetřujícího a kvalitě transkraniálního kostního okna. Pomocí TCS lze detekovat také další mozkové struktury a jejich změny u pacientů s APS, např. echogenitu nucleus lentiformis, nucleus caudatus, talamu a velikost 3. komory, které pak slouží k rozlišení dalších neurodegenerativních a heredodegenerativních onemocnění, jako je multisystémová atrofie, progresivní supranukleární paralýza, kortikobazální degenerace, Huntingtonova choroba a další [5]. Hodnocení jiných struktur než SN jsme zatím vzhledem k omezenému počtu pacientů neprováděli. Omezený počet pacientů v naší pilotní studii je významný z hlediska potenciální chyby sledovaných výsledků. V budoucnu je nutné ověřit tyto výsledky ve větším souboru pacientů.
Závěr
Pomocí TCS lze detekovat hyperechogennní, rozšířenou SN u pacientů s APS. U pacientů s MSA a VP se tento patologický nález na rozdíl od pacientů s ET vyskytuje častěji než v běžné populaci. Hyperechogenní SN se v současné době jeví jako marker indikující strukturální postižení SN. Sonografické vyšetření může v budoucnu přispět k diferenciální diagnostice atypických parkinsonských syndromů a Parkinsonovy choroby.
Přijato k recenzi: 12. 4. 07
Přijato do tisku: 23. 5. 07
MUDr. Petra Bártová
Neurologická klinika FN Ostrava
tř. 17. listopadu 1790
708 52 Ostrava
email: petrabartova@seznam.cz
Sources
1. Behnke S, Berg D, Naumann M, Becker G. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry 2005; 76 : 423–425.
2. Walter U, Niehaus L, Probst T, Benecke R, Meyer BU, Dressler D. Brain parenchyma sonography discriminates Parkinson’s disease and atypical parkinsonian syndromes. Neurology 2003; 60 : 74–77.
3. Schrag A, Good CD, Miszkiel K, Morris HR, Mathias CJ, Lees AJ et al. Differentiation of Atypical Parkinsonian Syndromes with Routine MRI. Neurology 2000; 54 : 697–702.
4. Růžička E, Roth J, Kaňovský P, Sekyrová M, Urgošík D, Vladyka V. Parkinsonova nemoc a parkinsonské syndromy. Praha: Galén 2000 : 118–165.
5. Gilman S, Low P, Quinn N, Albanese A, Ben-Shlomo Y, Fowler C et al. Consensus statement on the diagnosis of multiple system atrophy. American Autonomic Society and American Academy of Neurology. Clinical Auton Res 1998; 8 : 359–362.
6. Brucke T, Asenbaum S, Pirker W, Djamshidian S, Wenger S, Wober C et al. Measurement of the Dopaminergic Degeneration in Parkinson’s Disease with [123I]-CIT and SPECT: Correlation with Clinical Findings and Comparison with Multiple System Atrophy and Progressive Supranuclear Palsy. J Neural Transmit 1997; 50(Suppl.): 9–24.
7. Booij J, Speelman JD, Horstink MW, Wolters EC. The Clinical Benefit of Imaging Striatal Dopamine Transporters with [123I]FP-CIT SPECT in Differentiating Patients with Presynaptic Parkinsonism from those with Other Forms of Parkinsonism. Eur J Nuclear Med 2001 Mar; 28 : 266–272.
8. Asenbaum S, Pirker W, Angelberger P, Bencsits G, Pruckmayer M, Brucke T. [123I] beta-CIT and SPECT in Essential Tremor and Parkinson’s Disease. J Neural Transm 1998; 105 : 1213–1228.
9. Becker G, Berg D. Neuroimaging in basal ganglia disorders: perspectives for transcranial ultrasound. Mov Disord 2001; 16 : 23–32.
10. Berg D, Becker G, Zieler B, Tucha O, Hofman E, Preier M et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 1999; 53 : 1026–1031.
11. Becker G, Seufert J, Bogdahn U, Reichmann H, Reiners K. Degeneration of substantia nigra in chronic Parkinson´s disease visualized by transcranial color-coded real-time sonography. Neurology 1995; 45 : 182–184.
12. Berg D, Grote C, Rausch WD, Maurer M, Wesemann W, Riederer P et al. Iron accumulation of the substantia nigra in rats visualized by ultrasound. Ultrasound Med Biol 1999; 25 : 901–904.
13. Berg D, Roggendorf W, Schroder U, Klein R, Tatschner T, Benz P et al. Echogenicity of substantia nigra association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 2002; 59 : 999–1005.
14. Ressner P, Školoudík D, Kaňovský P. Echogenita substantia nigra u Parkinsonovy nemoci - pilotní studie. Ces Slov Neurol N 2006; 102 : 376–379.
15. Niehaus L, Savyer N, Weber U, Hertel R, Trottenberg T, Kupsch A. Brain parenchyma sonography in patients with essential tremor and Parkinson´s disease. Cerebrovasc Dis 2004; 17(Suppl 4): 3 [abstract].
16. Jankovic J. Essencial Tremor: clinical characteristics. Neurology 2000; 54 (Suppl 4): S21-S5.
17. Thanvi B, Lo N, Robinson T. Vascular parkinsonism - an important cause of parkinsonism in older people. Age and Ageing 2005; 34 : 114–119.
18. Demirkiran M, Bozdemir H, Sarica Y. Vascular Parkinsonism: a distinct, heterogenous clinical entity. Acta Neurol Scand 2001; 104 : 63–67.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 6-
All articles in this issue
- Obrna lícního nervu
- Elektrofyziologické vyšetření lícního nervu
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- 5 let činnosti Národní referenční laboratoře lidských prionových onemocnění při Oddělení patologie a molekulární medicíny FTNsP: naše zkušenosti a přehled literatury
- Klinický pohled na výpočetní tomografii u akutní ischemie mozku
- Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
- Porovnání výsledků vyšetření zrakových evokovaných potenciálů u pacientů s roztroušenou sklerózou a neuroboreliózou
- Kognitívne evokované potenciály – vlna P300 u pacientov so sclerosis multiplex: vzťah k forme ochorenia, somatickému postihnutiu a kvalite života
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Centrální neurocytom: kazuistika a přehled literatury
- Gelastické záchvaty u hypotalamického hamartomu: kazuistika
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
- Poúrazová porucha čichu: kazuistiky
- Mozková žilní trombóza u uživatelek hormonální antikoncepce
- Úspěšné použití jediné otázky pro screening syndromu neklidných nohou v České republice
- Závisí vývoj dysfunkce mikce u roztroušené sklerózy na typu neurologické léčby?
- Relabující-remitující roztroušená skleróza a oligoklonální pruhy v průběhu léčby modifikující průběh choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

