-
Medical journals
- Career
Svalová biopsie u myotonické dystrofie v éře molekulární genetiky
Authors: Z. Lukáš 1; I. Kroupová 1; J. Bednařík 2; M. Falk 3; L. Fajkusová 4; J. Sedláčková 4; I. Valášková 5; S. Voháňka 2
Authors‘ workplace: Ústav patologie LF MU a FN Brno 1; Neurologická klinika LF MU a FN Brno 2; Biofyzikální ústav AV ČR, Brno 3; Centrum molekulární biologie a genové terapie hematoonkologické kliniky LF MU a FN Brno 4; Oddělení klinické genetiky FN Brno 5
Published in: Cesk Slov Neurol N 2007; 70/103(4): 395-401
Category: Short Communication
Podpořeno grantem IGA MZ ČR NR 8052-3
Overview
Histopatologické rysy obou v současnosti definovaných forem myotonické dystrofie (MD1 i MD2) jsou velmi podobné, vykazují charakteristický komplex změn. Vyšetření svalových biopsií in situ může kromě toho přinést i zjištění přítomnosti expanzí repetic CUG resp. CCUG v transkriptu mutované DNA, která tvoří genetický základ onemocnění. Expandované úseky lze znázornit ve tkáňových řezech metodou fluorescenční in situ hybridizace (FISH) jako fokální intranukleární inkluze. Pro posouzení významu svalové biopsie v době, kdy je diagnostika MD1 a MD2 založena na DNA analýze lymfocytů z periferní krve, jsme analyzovali výsledky histopatologického vyšetření souboru 34 nemocných, u kterých byla biopsie provedena na základě klinického podezření na myotonickou dystrofii. Diagnóza MD byla potvrzena analýzou DNA pro oba typy onemocnění. FISH byla provedena u 27 z nich. Mutační analýzou DNA byla potvrzena MD1 v 13 případech, MD2 v 10 případech, u 11 pacientů nebyla diagnóza MD1 či MD2 potvrzena. Ve většině případů byl bioptický histopatologický nález u prokázané MD hodnocen buď jako typický pro MD1 či MD2, anebo nález kompatibilní s touto diagnózou. Bioptické nálezy u některých pacientů s MD byly atypické: ve 2 případech byla přítomna zánětlivá infiltrace, v jednom případě obraz připomínající kongenitální myopatii. Naproti tomu histopatologické rysy MD byly zjištěny v některých biopsiích, u nichž diagnóza MD1 ani MD2 nebyla potvrzena. Fokální intranukleární inkluze prokazované FISH byly prokázány u 23 pacientů – ve shodě s výsledky analýzy DNA – u 13 s MD1 a u 10 s MD2. Metodou volby při podezření na myotonickou dystrofii je mutační analýza DNA z periferní krve. V případě provedené svalové biopsie z důvodu atypického klinického obrazu, který nevedl k podezření na MD, však může zhodnocení biopsie vést k dodatečnému molekulárně-genetickému vyšetření pacienta. Metoda FISH v biopsii je zajímavá z teoretického pohledu, neboť umožňuje zkoumat retinovanou RNA v jádrech jednotlivých buněk a tkání postižených pacientů, a tak může napovědět o jejich možné účasti v patogenezi onemocnění.
Klíčová slova:
myotonická dystrofie – biopsie – molekulární genetika – diagnózaÚvod
Myotonická dystrofie (MD) je autosomálně dominantní neuromuskulární onemocnění s incidencí asi 1/8000. Je to nejčastější forma svalové dystrofie postihující dospělou populaci [1].
Příčinou „klasické“ myotonické dystrofie (DM1) je na molekulárně-genetické úrovni nestabilní trinukleotidová repetitivní sekvence (CTG)n v genu kódujícím protein-kinázu (DMPK - dystrophia myotonica protein-kinase) na chromozomu 19q13.3 [2,3]. Expanze trinukleotidové sekvence má za následek retenci transkriptu genu DMPK v jádře [ 4], která generuje fenotyp MD [5]. Molekulárně genetická diagnostika CTG expanzí na úrovni DNA je možná Southern blot analýzou [2,6] nebo pomocí PCR [7,8]. Retinovanou RNA v jádrech lze prokázat i ve tkáňových řezech hybridizací in situ, fluorescenční (FISH) či chromogenní [5,9,10]. FISH se zakládá na afinitě fluorochromem označené próby ke komplementárním sekvencím DNA či RNA ve tkáních (buňkách, kulturách).
V 90. letech byla studována a postupně rozpoznávána varianta myotonické dystrofie postihující zejména proximální svalové skupiny (MD druhého typu, MD2, PROMM), u níž nebyla prokázána expanze na 19q13.3 [11,12], avšak byla zjištěna repetice (CCTG)n nukleotidů v genu ZNF9 na chromozomu 3q21 [13]. Také tuto repetitivní sekvenci lze prokázat DNA analýzou, a stejně jako u prvního typu byla vypracována i varianta detekce retinované RNA intranukleárně in situ [14,15].
Bylo prokázáno, že je to RNA obsahující zmíněné tri - či tetranukleotidové expanze, která odpovídá za klinické rysy obou forem onemocnění. Expanze jsou inkorporované do ribonukleárních inkluzí, přitom dojde k dysregulaci RNA-vazebných proteinů: ke snížené regulaci rodiny muscleblind proteinů (MBNL) a ke zvýšené regulaci CUG-vazebných proteinů (CUG-BP). Obě tyto dysregulované skupiny proteinů pozměňují či poškozují sestřih transkriptů, které se uplatní v patogenezi MD, zejména transkript chloridového kanálu, receptoru pro inzulin a další [16].
Klinický obraz MD je dobře vymezen, vyznačuje se však mimořádnou variabilitou. I když je MD pokládána za onemocnění kosterního svalstva zahrnující distální myotonii, progresivní slabost a dystrofii, postihuje i další systémy. Postižení často trpí alterací srdečního a hladkého svalstva, dále bývají přítomny katarakta, hypersomnie, abnormální odezva na aplikaci glukózy a u mužů navíc předčasná plešatost a testikulární atrofie. Poruchy srdeční vodivosti mohou mít za následek fatální arytmii, a tak ovlivnit prognózu onemocnění. Nápadným rysem je variabilita fenotypu jak mezi, tak uvnitř postižených rodin [16]. Mnozí pacienti s MD mají příznaky onemocnění již od dětství, zatímco v jiných případech mohou být časné symptomy zjištěny dříve u pacientových dětí než u pacienta samotného. Velmi charakteristická forma onemocnění počínající in utero je pozoruhodná a málo obvyklá [17]. Zatím však byla popsána jen u prvního typu – MD1.
Elektromyografický nález (EMG) není pro diagnostiku rozhodující, jsou-li přítomny jasné klinické symptomy případně rodinná anamnéza. EMG vyšetření je však nezbytné pokud myotonie není zřetelná nebo chybí. V klinicky vyvinutých případech jsou nejčastější několik sekund trvající serie výbojů se snižující se frekvencí a amplitud, provokované inzercí či pohybem jehlové elektrody – myotonické výboje. Volní EMG vykazuje myopatický vzorec [17].
Charakteristické histopatologické rysy onemocnění u MD1 i MD2 jsou velmi podobné. Zahrnují směs neurogenních i myogenních změn. Neexistuje však jediný znak, který by byl typický a charakteristický pro MD, avšak jen seskupení určitých znaků může přinést podporu klinickému podezření na toto onemocnění. Mezi tyto znaky patří zejména zvýšená frekvence a zřetězení vniřních i sarkolematických jader. Častá je i přítomnost atrofických angulárních vláken nebo jaderných shluků s minimem sarkoplazmy, dále prstenčitá vlákna (ring fibres, Ringbinden), přítomnost sarkoplazmatických mas a velikostně-typová dysproporce s nižšími hodnotami průměrů vláken 1 a endo-perimyziální fibróza. V některých případech byla popsána přítomnost degenerativních strukturálních změn až nekróz a známek regenerace [18]. Tyto znaky jsou patrně společné pro MD1 i MD2, i když některé sestavy v recentních sděleních ukazují na rozdíly v typu atrofických vláken (viz níže).
Na naších pracovištích jsme v 90. letech a dříve neměli k dispozici molekulárně genetické diagnostické metody rozlišující oba typy MD a diagnostka spočívala na elektrofyziologických a klinických nálezech většinou doplněných svalovou biopsií. Později byly u nás vypracovány metody mutační analýzy DNA pacientů postižených MD1 i MD2 [19,20] a v minulých letech jsme postupně zaváděli do diagnostické praxe fluorescenční in situ hybridizaci. Vyšetření svalových biopsií in situ (vyšetření in situ znamená vyšetření přítomnosti určitých tkání a orgánů v topografické návaznosti na struktury okolní (situs viscerum), na úrovni tkáně nebo i buňky je to přítomnost a poloha jádra, organel, či sloučenin (glykogen, železo, enzym, protein), a to v kontextu přítomných struktur, na rozdíl od vyšetření extra situm, třeba v homogenátech nebo v extraktech. Patří sem tedy jak histopatologické vyšetření, tak i molekulárně genetické vyšetření: může kromě histopatologické analýzy přinést i zjištění přítomnosti expanzí repetic CUG resp. CCUG v transkriptu mutované DNA, která tvoří genetický základ onemocnění. Expandované úseky RNA lze znázornit ve tkáňových řezech metodou fluorescenční in situ hybridizace (FISH) jako fokální intranukleární inkluze.
V tomto sdělení uvedeme výsledky diagnostiky obou forem MD ze svalových excizí pacientů na základě klinické indikace. Výsledky histopatologické analýzy biopsie a výsledky RNA hybridizace in situ jsou srovnány s výsledky vyšetření DNA metodou PCR.
Materiál a metodika
Analyzovali jsme soubor 34 pacientů (17 mužů od 15 do 64 let a 17 žen od 16 měsíců do 75 let), u kterých byla provedena svalová biopsie na základě klinického podezření z diagnózy myotonické dystrofie. Diagnóza MD1 nebo MD2 byla potvrzena či vyloučena pomocí DNA analýzy u 34 pacientů (tab. 1). V tabulce není zařazeno 13 předchozích bioptických vyšetření z doby, kdy vyšetření MD pomocí molekulárně genetických metod ještě nebylo zavedeno.
Table 1. a. Klinická indikace biopsie, bioptický nález, DNA analýza a FISH. 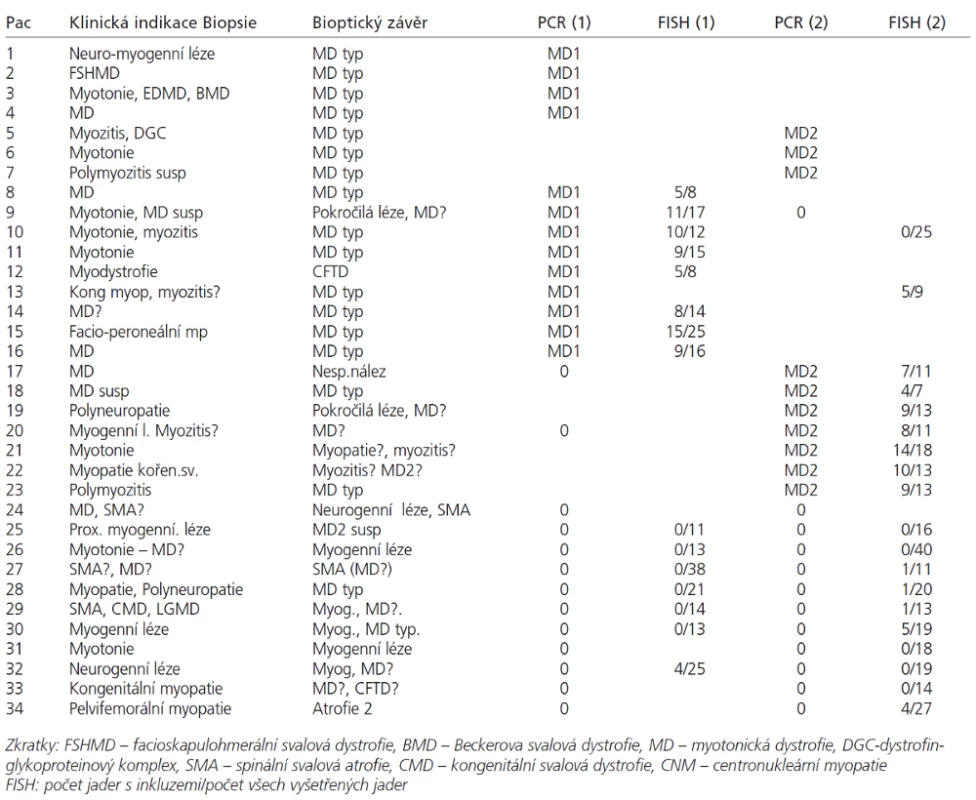
Tab. 1b. frekvence histopatologických parametrů. 
Svalové biopsie byly hluboce zmrazeny a kryostatové řezy zpracovány konvenčními histologickými a histochemickými metodami [21,22] doplněnými u 27 nemocných o RNA FISH. V každém vzorku byly hodnoceny tyto parametry: přítomnost vnitřních jader (normálně do 3 %, u myogenních lézí více než 5 %, u MD a centronukleární myopatie dosahuje frekvence až 65–100 %). Dále je to přítomnost atrofických vláken (v normě jen ojedinělá, jako dolní konec Gaussovy křivky), přítomnost prstenčitých vláken a sarkoplazmatických mas (v normě nepřítomna), velikostně-typová dysproporce s nižšími hodnotami průměrů vláken 1, a endo-perimyziální fibróza (v normě se též nevyskytují). Na základě těchto parametrů byla míra pravděpodobnosti dg. MD odstupňována takto: typický nález (v tabulce MD typ) obsahuje nad 65 % vnitřních jader, atrofie, případně ještě další znaky; nález kompatibilní s dg. MD (v tabulce MD?) znamená nález mírně zvýšeného počtu (nad 5 %) vnitřních jader a přítomnost atrofií.
In situ hybridizace vycházela z citovaných prací [8,9], upravená podle Thorntona (osobní sdělení). Řezy (6mm) byly napjaty na skla (SuperFrost Plus slides Menzel-Glaser), vysušeny při pokojové teplotě 30 minut, fixovány v modifikované Carnoyově tekutině (73% etanol; 25% kyselina octová; 2% formalin) 30 minut při 4 °C a promyty v PBS. Následovala inkubace v prehybridizačním pufru (30% formamid a 2x SSC) a hybridizace s probou (1 ng/ml) 2 hodiny při 37 °C v hybridizačním pufru (30% formamid, 2x SSC, 0,02% BSA, 66 mg/ml yeast tRNA, 2 mM vanadyl komplex). Sekvence próby pro MD1: (5’-CAG CAG CAG CAG CAG CAG CAG-3’2’ –O-Me-RNA5’Fl), sekvence próby pro MD2 (5’-CAG GCA GGC AGG CAG GCA GG-3’2’ –O-Me-RNA5’Fl, ). Po hybridizaci byly řezy oprány ve 30% formamidu a 2x SSC po 30 minut při 45 °C, a 40 min při pokojové teplotě. Nakonec zamontovány ve směsi s DAPI (Vectashield Mountaing Medium with DAPI, Vector Laboratories, USA) a hodnoceny ve fluorescenčním mikroskopu Leica DMRXA2.
Hodnocení výsledků RNA-FISH: jediným parametrem je přítomnost tečkovitých signálů retinované RNA v subsarkolematických i vnitřních jádrech svalových vláken. V pozitivních jádrech jsou většinou přítomny 1-4 jednotlivé signály. Z technických důvodů (tloušťka řezu) nemusejí být v každém nákroji jádra přítomné RNA signály zastiženy, proto hodnotíme biopsie jako MD-pozitivní, je-li přítomno aslepoň 30 % pozitivních jader. Dalším problémem je možná nespecifická pozitivita, vysvětlitelná interferencí autofluoreskujícího lipopigmentu, který emituje široké spektrum vlnových délek [9]. Tato autofluorescence je někdy obtížně odlišitelná od specifické fluorescence užitého fluorochromu.
Pro hodnocení validity klinických i histopatologických nálezů a FISH byly výsledky molekulárně genetického vyšetření pacientů brány jako kritérium správné diagnózy.
Výsledky
Histopatologické parametry
Jednotlivé parametry a výsledky histopatologického nálezu, RNA-FISH, DNA analýzy na základě klinické indikace biopsie jsou shrnuty v tab. 1. Z tabelárních údajů vyplývá, že vysoká či zvýšená frekvence vnitřních jader (obr. 1) byla v naší sestavě zjištěna s jedinou výjimkou ve všech pozitivních biopsiích obou skupin pacientů. Přítomnost atrofií (obr. 1) byla zjištěna ve všech biopsiích obou skupin. Atrofie vláken 1 převažovala v biopsiích pacientů s MD1, zatímco u MD2 nebyla zjištěna ani v jediném případě. U MD2 byla přítomna jen atrofie typu 2 nebo obou typů vláken. Velikostně typová dysproporce základních typů s vyššími hodnotami vláken 1 (obr. 2) byla nalezena u 30-60 % případů MD1, MD2 i MD nerozlišené. Prstenčitá vlákna a sarkoplazmatické masy (obr. 3 a 4) byly v našich pozitivních biopsiích zjištěny celkem v 18 % všech pacientů obou skupin, ve 20 % u pacientů s MD1 a 30 % u pacientů s MD2. Fibróza byla zjištěna asi v polovině vyšetřených případů, 2krát dokonce i zánětlivá infitrace (jednou s pozitivní reakcí MAC v cévní stěně a HLA1 v sarkolemě).
Image 1. MD1. Vnitřní jádra a silně atrofické vlákno – jaderné shluky (šipka). Přehledné barvení Hem Eos. Úsečka – 50 μm. 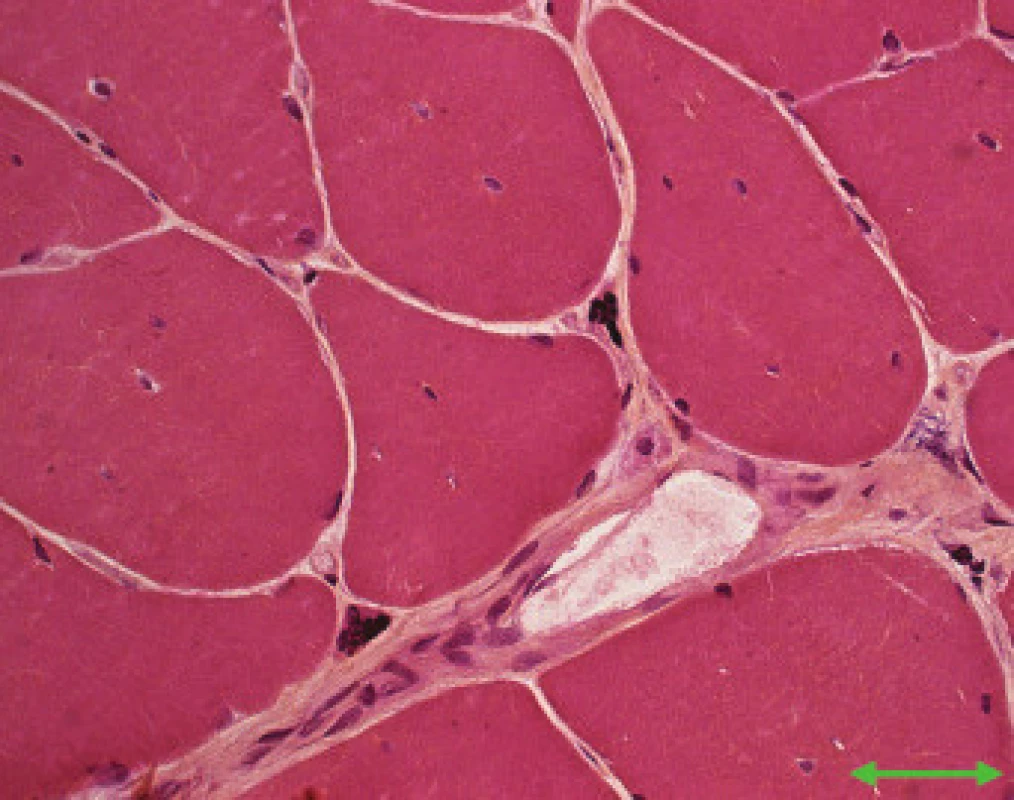
Image 2. MD 1. Vyšší průměry vláken 2 (tmavší vlákna), Ca-ATPáza, pH 9,4. Úsečka – 50 μm. 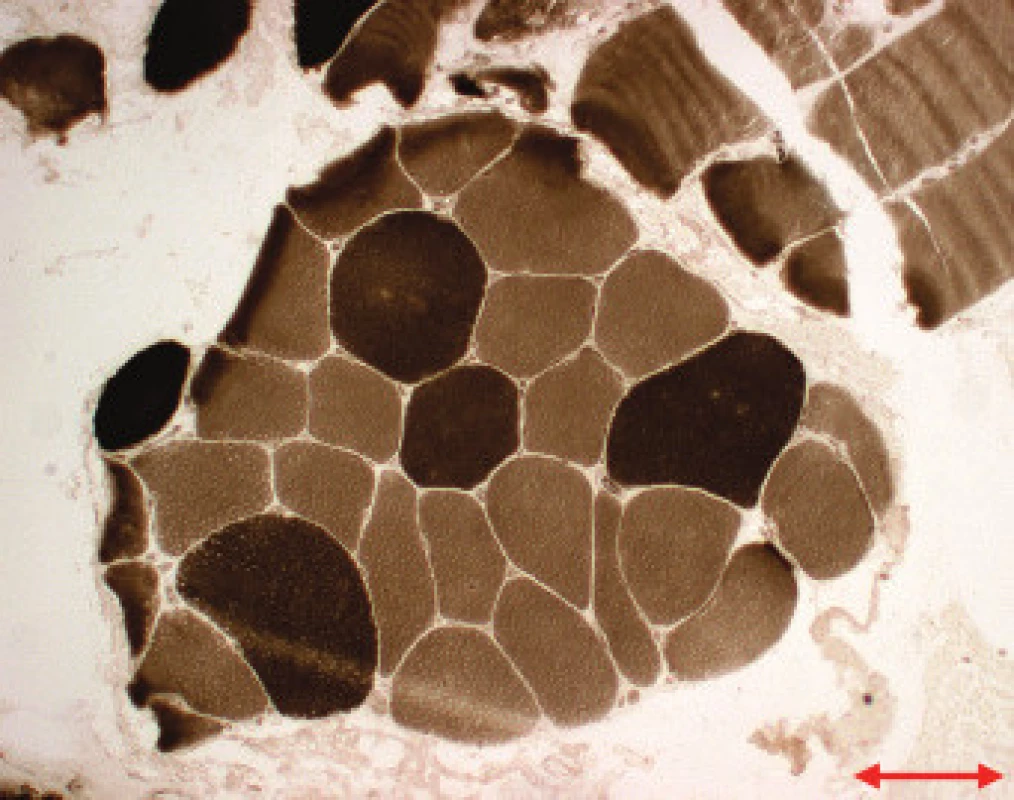
Image 3. MD1. Prstenčité vlákno, na periferii cirkulárně orientované myofibrily (šipka). NADH-tetrazolium reduktáza. Úsečka – 50 μm. 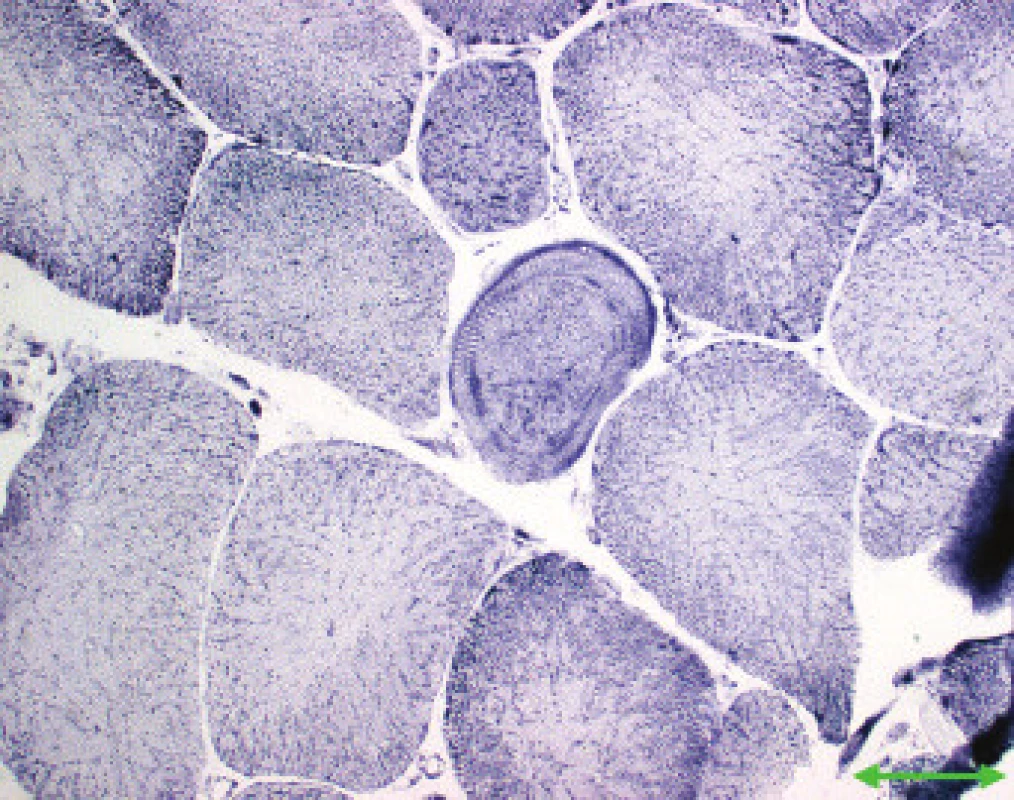
Image 4. MD1. Sarkoplazmatické masy s intenzivní reakcí na mitochondriální dehydrogenázy na periferii vlákna. NADH tetrazolium reduktáza. Úsečka – 20 μm. 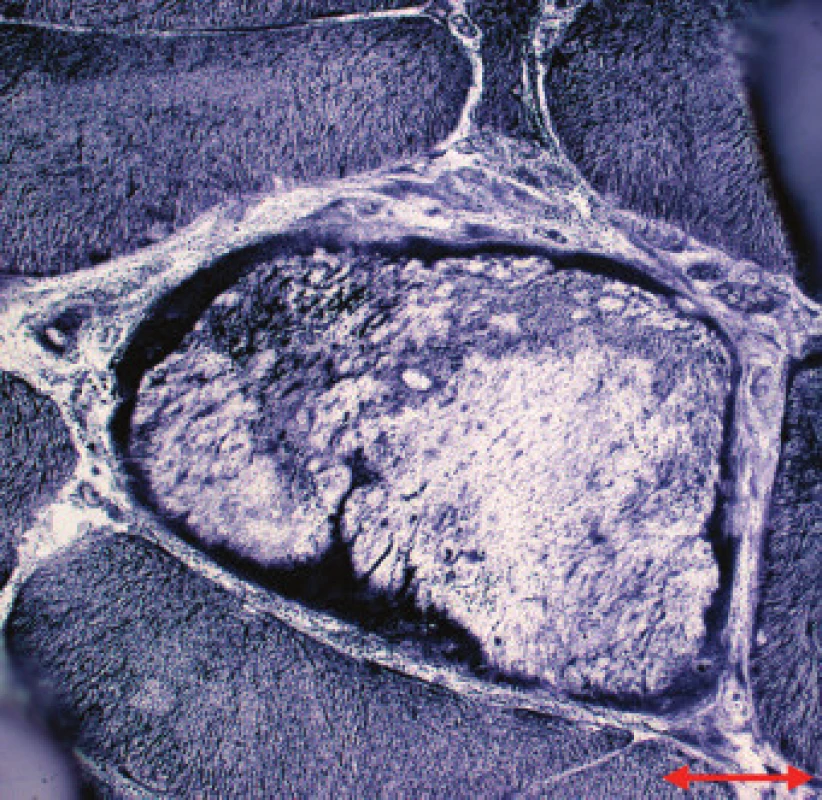
V několika případech byly histopatologické nálezy netypické. U pacienta 12 byla DNA analýzou prokázána MD 1 a bioptická diagnóza zněla kongenitální typová disproporce svalových vláken (CFTD). U pacienta 19 byla zjištěna tak pokročilá léze, že histopatologická diagnóza nebyla možná, zatím co DNA analýza prokázala repetici CTG svědčící pro MD 1. Pacient 24 s prokázanou SMA měl v biopsii obraz neodlišitelný od MD. U pacientů 21 a 22 byla přítomna již zmíněná zánětlivá infiltrace, u MD velmi vzácná.
RNA fluorescenční in situ hybridizace
V pozitivních jádrech byly většinou přítomny 1-4 jednotlivé signály (obr. 5 a 6 pro DM1 a DM2). Pozitivní signály byly zjištěny i v některých jádrech intramuskulárních cév. V těchto jádrech však byly většinou jen 1-2 signály. Kromě toho, několik pozitivních signálů bylo nalezeno i v jádrech cévních endotelií (nedemonstrováno). Biopsie, v nichž bylo nalezeno více než 30 % pozitivních jader svalových vláken, byly hodnoceny jako pozitivní pro zkoumaný typ MD. Ve většině případů, kdy byla provedena FISH (34 ze 36), odpovídaly její výsledky nálezům DNA analýzy z periferní krve. V jádrech u pacientů 13 a 30, kde diagnóza MD2 nebyla mutační analýzou DNA potvrzena, byly pozitivní signály přítomny. Nespecifické pozitivní signály snad mohou být způsobeny interferencí autofluoreskujícího lipopigmentu, která při hodnocení výsledků FISH často působí komplikace [9]. Lipofuscin excituje a emituje široké spektrum vlnových délek, takže generuje signál prakticky v každém z užívaných kanálů, zatímco specifický signál fluoresceinu – FITC (495/520) resp Texaské červeně (596/620) je vidět pouze s filtrem odpovídajících vlnových délek. Při nejasnostech v topografii vysílaného signálu pomůže vyšetření laserovým konfokálním mikroskopem.
Image 5. Tečkovité signály retinované RNA v subsarkolematických jádrech svalových vláken u MD2, FISH. Úsečka – 10 μm. 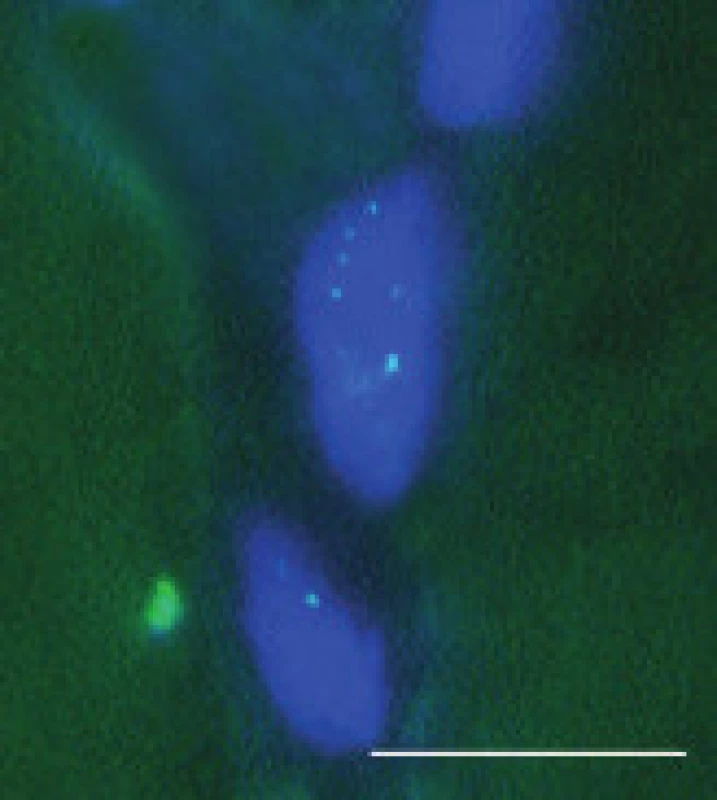
Diskuse a závěry
Klinická indikace biopsie zahrnuje samozřejmě jen část případů MD diagnostikovaných v našem regionu, protože u většiny pacientů byla a je diagnostikována na základě klinického a elektrofyziologického nálezu doplněného DNA analýzou [20].
Porovnáme-li jednotlivé parametry histopatologického vyšetření vedoucího k diagnóze MD (tab. 1), zjišťujeme, že nejčastějším a patrně nejspecifičtějším histopatologickým parametrem je zvýšená frekvence vnitřních jader [18,21,22]. Přítomnost atrofií, ať ve formě jaderných shluků (nuclear clumps) s minimem sarkoplazmy nebo jako malá angulární vlákna, je dalším znakem přítomným prakticky ve všech našich pozitivních biopsiích. U MD1 je udávána atrofie vláken 1 [17,18], avšak u MD2 nacházejí Schoser et al [23] a Vihola et al [24] převážně atrofii typu 2. Naproti tomu autoři Day et al [25] popisují u MD2 atrofii vláken bez udání typů. Tento parametr však má cenu jen ve spojení s dalšími, protože atrofie vláken typu 2 je znakem inaktivity, vyskytujícím se u celého spektra neuro - i myopatií včetně myozitid a dalších onemocnění pohybového aparátu. Atrofie svalových vláken je však i základním znakem neurogenních (i některých dalších myogenních) lézí, takže její specificita je tím pro histopatologickou diagnostiku MD limitovaná. Nicméně, naše výsledky podporují údaje citovaných autorů o převaze atrofie vláken typu 1 u MD1 a atrofie vláken typu 2 u MD2.
Velikostně-typová dysproporce základních typů vláken [26] je však odlišným znakem, který nemusí nutně znamenat atrofii některého typu, pouze vyšší průměrné hodnoty velikosti (průměrů) vláken typu 2 než má typ 1. Prstenčitá vlákna [27] jsou dosti specifickým nálezem u MD, ale jejich frekvence v našich pozitivních biopsiích je nevysoká, stejně jako v publikovaných větších sestavách [17]. Oba jmenované parametry jsou přítomny jen v části biopsií s průkazem obou typů MD.
Naše nálezy ukazují, že histopatologický obraz u MD1 i 2 je poměrně charakteristický a před érou molekulárně-genetické diagnostiky podpořil diagnózu myotonické dystrofie.V několika případech histopatologické vyšetření nevedlo ke správnému diagnostickému závěru: u 2 pacientů s DNA analýzou potvrzenou diagnózou DM skýtal bioptický nález obraz myozitidy, u dalšího pacienta bioptická diagnóza zněla kongenitální typová disproporce svalových vláken (CFTD). Nález zánětlivé infiltrace je u DM vskutku ojedinělý, její přítomnost u svalových dystrofií jako DMD, či FSHMD, nebo i u neurogenních atrofií však byla popsána opakovaně [21]. Velikostní typová dysproporce je ovšem znak nespecifický a bývá přítomen nejen u CFTD, ale i u myotonické dystrofie, u dalších kongenitálních myopatií (nemaline myopathy), ale i u spinální svalové atrofie. V naší sestavě byl tento případ ojedinělým bioptickým nálezem MD bez přítomnosti vnitřních jader.
V éře molekulárně-genetické diagnostiky MD1 a MD2 však diagnostika myotonické dystrofie pomocí histopatologických změn pozbývá významu a metodou volby při typickém klinickém a elektrofyziologickém nálezu (který se u obou geneticky definovaných chorob poněkud liší [20] je jednoznačně DNA diagnostika z periferní krve. Pozitivita FISH nálezů však těsně koreluje s nálezy DNA analýzy. Znalost histopatologického obrazu charakteristického pro MD však může být přínosná v případě, že svalová biopsie byla provedena z výše uvedených důvodů: histologický nález známek typických pro MD může vést k dodatečnému vyšetření DNA z lymfocytů periferní krve, nebo i ze zbytku bioptického materiálu. DNA analýza z lymfocytů je samozřejmě jednodušší, protože obsahuje daleko víc jaderné DNA na hmotnostní či objemovou jednotku než sval. A konečně, na zbytku biopsie lze pomocí FISH odhalit i přítomnost intranukeárních fokusů s expandovanou RNA (viz výše).
Metoda FISH v biopsii je zajímavá z teoretického pohledu, neboť umožňuje zkoumat retinovanou RNA v jádrech jednotlivých buněk a tkání u postižených pacientů, a tím i mechanizmus rozvoje klinické manifestace. Je nutné dořešit i metodické aspekty jako prezervace či fixace tkání, upřesnit vyhodnocení pozitivních nálezů a vztah k výsledkům DNA analýzy. Nejsou dosud známy rozdíly v expanzi DNA v jednotlivých tkáních a orgánech postižených pacientů; zřejmě však takové variace existují [28]. Také zmapování RNA inkluzí v tkáních pacientů s MD a jejich případný vztah k velikosti expanze nejsou v současné době dostatečně prozkoumány.
Přijetí k recenzi: 25. 1. 2007
Přijetí do tisku: 8. 2. 2007
prof. MUDr. Zdeněk Lukáš, CSc.
Ústav patologie FN Brno,
Jihlavská 20, 625 00 Brno
e-mail: zlukas @fnbrno.cz
Sources
1. Harper PS. Myotonic dystrophy. London: WB Saunders 2001.
2. Brook JD, McCurah ME, Harley HG, Buckler AJ, Church D, Aburatani H et al. Molecular basis of myotonic dystrophy: expansion of a trinucleotide (CTG) repeat at the 3´ end of a transcript encoding a protein kinasae family member. Cell 1992; 68 : 799-808.
3. Fu YH, Pizzuti A, Fenwick Jr RG, King J, Rajnarayan S, Dunne PW et al. An unstable triplet repeat in a gene related to myotonic dystrophy. Science 1992; 255 : 1256-1258.
4. Davis BM, McCurach ME, Taneja K, Singer RH, Housman DE. Expansion of a CUG trinucleotide repeat in the 3´ untranslated region of myotonic dystrophy protein kinase transcripts results in nuclear retention of transcripts. Proc Natl Acad Sci 1997; 94 : 7388-7393.
5. Mankodi A, Logigian E, Callahan L, McClain C, White R, Henderson D et al. Myotonic dystrophy in transgenic mice expressing an expanded CUG repeat. Science 2000; 289 : 1769-1772.
6. Buxton J, Shelbourne P, Davies J, Jones C, Van Tongeren T, Aslanidis C et al. Detection of an unstable fragment of DNA specific to individuals with myotonic dystrophy. Nature 1992; 355 : 547-548.
7. Cheng S, Barcelo JM, Korneluk RG. Characterization of large CTG repeat expansions in myotonic dystrophy alleles using PCR. Hum Mut 1996; 7 : 304-310.
8. Schalling M, Hudson TJ, Buetow KH, Housman DE. Direct detection of novel trinucleotide repeats in the human genome. Nature genetics 1993; 4 : 135-139.
9. Taneja KL. Localization of trinucleotide repeat sequences in myotonic dystrophy cells using a single fluorochrome –labeled PNA probe. Biotechniques 1998; 24 : 472-476.
10. Jiang H, Mankodi A, Swanson MS, Moxley RT, Thornton CA. Myotonic dystrophy type 1 is associated with nuclear foci of mutant RNA, sequestration of muscleblind proteins and deregulated alternative splicing in neurons. Human molecular genetics 2004; 13 : 3079-3088.
11. Thornton CA, Griggs RC, Moxley RT. Myotonic dystrophy with no trinucleotide repeat expansion. Ann Neurol 1994; 35 : 269-272.
12. Ricker K, Koch MC, Lehmann-Horn F, Pongraz D, Otto M, Heine R et al. Proximal myotonic myopathy: a new dominant disorder with myotonia, muscle weakness and cataracts. Neurology 1994; 44 : 1448-1452.
13. Liquori CL, Ricker K, Moseley ML, Jacobsen JF, Kress W, Naylor SL et al. Myotoni dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9. Science 2001; 293 : 864-867.
14. Sallinen R, Vihola A, Bachinski LL, Huoponen K, Haapasalo H, Hackman P et al. New methods of molecular diagnosis and demonstration of the (CCTG)n mutation in myotonic dystrophy type 2 (MD2). Neuromusc Disord 2004; 14 : 274-283.
15. Cardani R, Mancinelli E, Sansone V, Rotondo G, Meola G. Biomolecular identification of (CCTG)n mutation in myotonic dystrophy type 2 (DM2) by FISH on muscle biopsy. Eur H Histochem 2004; 48 : 437-442.
16. Day JW, Ranum LPW. RNA pathogenesis of the myotonic dystrophies. Neuromusc Disord 2005; 15 : 5-16.
17. Ranum LPW, Day JW. Myotonic dystrophy: RNA pathogenesis comes into focus. Am J Hum Genet 2004; 74 : 793-804.
18. Pongratz D, Schultz D, Koppenwallner C, Hubner G. Wertigkeit der Muskelbiopsie in der diagnostik der dystrophia myotonica (Curschmann-Steinert). Klin Wschr 1979; 57 : 215-224.
19. Falk M, Vojtěšková M, Lukáš Z, Kroupová I, Froster U. Simple procedure for automatic detection of unstable alleles in myotonic dystrophy and Huntington´s disease loci. Genetic testing 2006; 10 : 83-94.
20. Voháňka S, Bednařík J, Fajkusová L, Sedláčková J. Myotonická dystrofie typ 2: vzácné nebo časté onemocnění v České rerpublice? Česk Slov Neurol N 2005; 68/101 : 390-393.
21. Dubowitz V. Muscle biopsy. A practical approach. Bailliére Tindall 1985.
22. Carpenter S, Karpati G. Pathology of skeletal muscle. Oxford University Press 2001.
23. Schoser BG, Schneider-Gold C, Kress W, Goebel HH, Reilich P, Koch MC et al. Muscle pathology in 57 patients with myotonic dystrophy type 2. Muscle Nerve 2004; 29 : 275-281.
24. Vihola A, Bassez G, Meola G, Zhang S, Haapasalo H, Paetau A et al. Histopathological differences of myotonic dystrophy type 1 (DM1) and PROMM/DM2. Neurology 2003; 60 : 1854-1857.
25. Day JW, Ricker K, Jacobsen JF, Rasmussen LJ, Dick KA, Kress W et al. Myotonic dystrophy type 2: molecular diagnosis and clinical spectrum. Neurology 2003; 60 : 657-664.
26. Bundschu HD, Hauger W, Lang HD. Myotonische dystrophie Curschmann-Steinert. Dtsch Med Wschr 1975; 100 : 1337-1341.
27. Hübner G. Ringbinden der quergestreiften Muskulatur. Acta neuropath 1977; 38 : 27-32.
28. Kinoshita M, Takahashi R, Hasegawa T, Komori T, Nagasawa R, Hirose K et al. (CTG)n expansions in various tissues from a myotonic dystrophy patient. Muscle Nerve 1996; 19 : 240-242.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 4-
All articles in this issue
- Svalová biopsie u myotonické dystrofie v éře molekulární genetiky
- Chirurgická léčba hormonálně aktivních adenomů hypofýzy
- Ovlivnění exprese mRNA genu SMN2 inhibitory histonových deacetyláz a jejich vliv na fenotyp spinální svalové atrofie I. a II. typu
- Poliomyelitis-like syndrom na podkladě klíšťové meningoencefalitidy
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Léčba spánkové apnoe malých dětí dvojúrovňovým přetlakem v dýchacích cestách
- Polykací obtíže u difuzní idiopatické kostní hyperostózy
- Cervikální dystonie
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Změny kognitivních funkcí u pacientů s akutní cévní mozkovou příhodou testovaných pomocí Mini-Mental State Examination a Clock Drawing Test
- Dekompresní kraniektomie jako léčba pro krysí model „maligního“ infarktu střední mozkové tepny
- Korelace mezi indexem IgG a oligoklonálními pásy při CSF vyšetření u pacientů s roztroušenou sklerózou
- Analýza 1 775 pacientů léčených pro trigeminální neuralgii perkutánní radiofrekvenční rizotomií
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cervikální dystonie
- Hladina D-dimerů u pacientů s akutní ischemickou cévní mozkovu příhodou
- Trombóza esovitého splavu – současný pohled na diagnostiku a léčbu
- Repetitivní transkraniální magnetická stimulace a chronický subjektivní nonvibrační tinnitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

